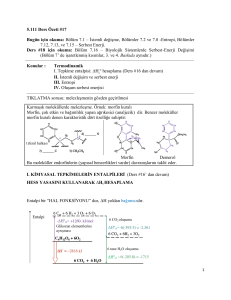
Denge; kapalı bir sistemde ve sabit sıcaklıkta gözlenebilir
özelliklerin sabit kaldığı, gözlenemeyen olayların devam ettiği
dinamik bir olaydır.
DENGE
KİMYASAL REAKSİYONLARDA DENGE
Kimyasal tepkimelerin %100 ürüne dönüşmeleri pratikte mümkün
değildir. Ancak reaktanlardan en az birinin derişimlerinin ölçülemeyecek
kadar az kaldığı tepkimeler teorikte tek yönlü tepkimeler denir ve → ile
gösterilir.
Bazı kimyasal tepkimelerde reaktifler ürünlere dönüşmez. Ürünlerin
derişimi belli bir değere ulaşınca geri tepkime başlar ve zamanla ileri ve
geri tepkimelerin hızları eşit olur.Bunun sebebi reaksiyonların zamanla
denge konumuna ulaşmasıdır.
Yani reaksiyon hem ileri hem de geri yönde ilerler Sadece bir yönde
gerçekleşen tepkimelere tersinmez tepkimeler, hem ileri hem de geri
yönde gerçekleşen tepkimelere tersinir tepkimeler denir.
Sadece tersinir tepkimeler dengeye ulaşabilir. Denge tepkimeleri
denklemlerle ifade edilirken çift yönlü ok (↔) kullanılır. Denge, sistemde
gerçekleşen olayın türüne bağlı olarak fiziksel veya kimyasal olabilir.
Tersinir hal değişimi, bir yönde gerçekleştikten sonra, çevre üzerinde
hiçbir iz bırakmadan ters yönde de gerçekleşebilen hal değişimi diye
tanımlanır. Ürünlerin kendi aralarında etkileşip girenleri oluşturduğu
tepkimelerdir. Çift yönlü olarak gösterilirler.
CaCO3 (k) ısı CaO(k) CO2(g)
Tersinir olmayan (tersinmez) hal değişimi; girenlerin tamamen
ürüne dönüştüğü tepkimelerdir. Organik maddelerin yanması,
çökelme, kuvvetli asit ve bazların nötrleşmesi böyle
tepkimelerdir.Tek yönlü olarak gösterilirler.
C 2 H 5 OH (s) 3O 2(g) 2CO2(g) 3H2O(s)
FİZİKSEL DENGE
Maximum düzensizliğe gidiş
H2O(s)
Minumum Enerjiye Eğilim
H2O(g)
Bir cam kabın içine 20°C‘ ta su koyar ve ağzını
kapatırsak bir kısım su molekülleri sıvı fazdan gaz
fazına geçerler. Su molekülleri gaz fazına geçtikçe
suyun kısmi basıncı yükselir. Öte yandan belli bir süre
sonra bazı su buharı molekülleri enerji kaybederek
sıvı faza geçer. Sonunda basınç yükselmesi durur ve
suyun buhar basıncı sabit olur. Bu durumda sistem
dengeye ulaşmış olur.
Böylelikle su ile buharı arasında denge kurulmuş olur.
Denge kurulduğunda buharlaşma ve yoğunlaşma
devam ettığinden buna sıvı - buhar dinamik dengesi
denir. Olay fiziksel olduğundan sıvı-buhar dengesi
fiziksel dengedir.
KİMYASAL DENGE
Kimyasal tepkimeler belli bir hızla devam ederken zamanla geri tepkime de
başlar, öyle bir zaman gelir ki Vi=Vg olur. Bu duruma denge anı, bu şekilde
gerçekleşen tepkimelere denge tepkimeleri denir.
Kısaca, tersinir bir tepkime kapalı bir kapta ve sabit sıcaklıkta dengeye ulaşır. Bu
olaya kimyasal denge denir.
Kimyasal dengeye ulaşmış tepkimede derişim, sıcaklık, renk, basınç, çökelme ve
gaz çıkışı gibi gözlenebilir değişiklikler durmuş gibidir.
A +B↔C+D gibi bir denge tepkimesinde
ÖRNEK:
Sabit şartlarda bir kaba, H2
I2
eklendiğinde başlangıçta her iki
maddenin derişimi maximum olduğundan önce hızlı bir tepkime gözlenir.
Daha sonra giren maddelerin derişimleri azalacağından tepkimenin hızı
azalmaya devam eder. Bu arada geri tepkime de başlamıştır. Belli bir
süre sonra girenlerle ürünlerin derişimi değişmez.
H2 + I2 ↔ 2HI dengesi oluşur.
H2 + I2 ↔ 2HI
Görüldüğü gibi, girenlerin
derişimi zamanla azalırken
ürünlerin derişimi de zamanla
artar.
Dolayısıyla, ileri tepkimenin
hızı azalırken, geri
tepkimenin hızı da zamanla
artar.
Vi = Vg anına denge anı denir.
Kısaca, Kimyasal Denge Anında;
1.Sistem kapalıdır (gaz).
2.Sıcaklık sabittir.
3.Gözle görüle bilen olaylar (makroskobik)
durmuş ancak görünemeyen olaylar devam
etmektedir.
4.İleri ve geri tepkimeler aynı hızla devam
etmektedir.
5.Minimum enerjiye ve maksimum düzensizliğe
ulaşma isteği eşittir.
6.Tersinir tepkimeler ister tek kademede ister çok
kademeden oluşsun sonuçta dengeye ulaşır.
Homojen Denge
Kimyasal tepkimelerde girenlerin ve ürünlerin hepsinin aynı fazda
olduğu tepkimelere denir.
CO(g) + Cl2 (g) ↔ COCl2(g)
Fe+2 (suda) + SCN- (suda) ↔ FeSCN+2(suda)
Heterojen Denge
Kimyasal tepkimelerde girenlerin ve ürünlerin hepsinin aynı fazda
olmadığı tepkimelere denir.
CaCO3(k) ↔ CaO(k) + CO2(g)
Zn(k) + Cu+2 (suda) ↔ Zn+2(suda) + Cu (k)
DERİŞİME GÖRE DENGE BAĞINTISI YAZMA
H2(g) + I2(g) ↔ 2HI (g)
Bu tepkime için:
Vi= ki [H2] [I2] ve Vg= kg [Hl]2 olur.
Denge anında Vi = Vg
ki [H2] [I2] = kg [Hl]2
K=
ki
kg
=
[Hl]2
[H2] [I2]
NOT: Denge bağıntısında da saf katı ve sıvılar alınmazlar.
NOT: Denge bağıntısı, Norveçli Kimyacılar Cato GOLDBERG Peter WAGGE
tarafından 1964 yılında önerilmiştir.
Denge Bağıntılarının Yazılması
K=
CO(g) + Cl2(g) ↔ COCl2(g)
Fe+2
(suda)
+
SCN-
(suda)
↔
FeSCN+2
K=
(suda)
N2(g) + 3H2(g) ↔ 2NH3 (g) (suda)
CaCO3(k) ↔ CaO(k) + CO2(g)
Zn(k) + Cu+2 (suda) ↔ Zn+2(suda) + Cu (k)
K=
K’=
K’=
[COCl2]
[CO] [Cl2]
[FeSCN+2]
[Fe+2] [SCN-]
[NH3] 2
[N2] [H2]3
[CaO] [CO2]
[CaCO3]
[Zn+2] [Cu]
[ Zn ]
[Cu+2]
K= [CO2]
K=
[Zn+2]
[Cu+2]
Kp ile Kd Arasındaki Bağıntı:
İki denge bağıntısı arasında;
Kp = Kd (RT)Δn ilişkisi vardır.
Burada
Kp = Kısmi basınca göre denge bağıntısı,
Kd = Derişime göre denge bağıntısı dır.
R= Gaz sabiti
T= Mutlak sıcaklık (Kelvin)
Δn = Ürünlerin katsayısı toplamı- Girenlerin katsayısı toplam (Gaz)
ÖRNEK:
N2O4(g) ↔ 2NO2(g) ise Δn=2-1=1
Kp = Kd RT
N2(g) + 3H2(g) ↔ 2NH3 (g) Δn=2-4=-2
Kp = Kd
H2(g) + I2(g) ↔ 2HI (g) ise Δn=2-2=0
Kp = Kd
(RT)-2 =
1
(RT)2
N2O4(g) ↔ 2NO2(g)
Denge Problemleri
ÖRNEK:
2SO3(g) ↔ 2SO2(g) + O2 (g)
Belli bir sıcaklıkta 5 L lik bir kapta bulunan 4 mol SO3(g) gazı,
yukarıdaki tepkime gereği % 50 oranda ayrışarak dengeye ulaşıyor.
Tepkimenin derişimler türünden denge sabitini hesaplayınız?
Çözüm:
K d=
[SO3] 2
2SO3(g) ↔ 2SO2(g) + O2 (g)
Başlangıç: 4 mol
Değişim:
Sonuc:
Derişim:
-2 mol
2 mol
2/5=0,4M
+2 mol
2 mol
+1 mol
[SO2] 2 [O2]
K d=
[0,4] 2 [0,2]
[0,4] 2
1 mol
2/5=0,4M 1/5=0,2M
K d=0,2
Örnek:
CO2(g) + C(k) ↔ 2CO(g)
Belli bir sıcaklıkta 2 L lik bir kapta bulunan 3 mol CO2(g) ve 4 mol C(k)
konuluyor. Dengeye ulaşıldığında kapta 2mol CO2 gazı ölçüldüğüne
göre,
A-Denge anındaki Kd sabitinin değeri nedir?
B- Tepkime denge ulaştığında C’un % kaçı kalmıştır?
Çözüm:
CO2(g) + C(k) ↔ 2CO(g)
Başlangıç:
K d=
[CO]2
[CO2]
3 mol
4 mol
Değişim:
-1 mol
-1 mol
2 mol
Sonuc:
2 mol
3 mol
2 mol
Derişim:
2/2=1M
Sabit
2/2=1M
%75 i kalmıştır.
K d=
[1]2
[1]
K d=1
Örnek:
PCl5(g) ↔ PCl3g) + Cl2g
640 K sıcaklıkta kapalı bir kapta bulunan PCl5 gazı dengeye ulaştığında
% 80 inin ayrıştığı görülüyor. Denge anındaki toplam basınç 3,6 atm
olarak ölçüldüğüne göre,
A- Kp si kaçtır?
[pPCl3] [pCl2]
B- Aynı sıcaklıktaki Kd si kaçtır?
K d=
[pPCl5]
Çözüm:
[1,6] [1,6]
=6,4
K d=
PCl5(g) ↔ PCl3g) + Cl2g
[0,4]
Başlangıç: 1 mol
0 mol 0 mol
Değişim:
Sonuc:
Derişim:
-0,8 mol
0,2 mol
0,4 atm
0,8mol 0,8 mol
0,8 mol 0,8 mol nT=1,8 mol
1,6 atm
1,6 atm
Kp = Kd (RT) ise 6,4=Kd .0,082.300.640 ise Kd=0,122 olarak bulunur.
Denge Kesri yada Dengenin Kontrolü (Q)
Herhangi bir tepkimenin, her hangi bir zamanda dengede olup
olmadığının kontrolüne denge kontrolü denir, bu durumdaki denge
sabitine de denge kesri diyoruz.
İstenilen zamandaki maddelerin derişimleri dikkate alınarak bir Q
denge sabiti (denge kesri) bulunur. Bulunan bu değer denge sabitiyle
karşılaştırılır.
Q= K ise sistem dengededir.
Q< K ise sistem dengede değildir. Dengeye ulaşması için
tepkimenin ileri yönde devam etmesi gerekmektedir.
Q> K ise sistem dengede değildir. Dengeye ulaşması için
tepkimenin girenler lehine kayması gerekmektedir.
Örnek:
H2(g) + l2(g) ↔ 2Hl(g)
Sabit sıcaklıkta 1 L lik kapalı bir kapta bulunan 1 mol H2 ,1 mol I2 , 2 mol Hl yukarıdaki denklem gereği
tepkimeye giriyor. Tepkimenin denge sabiti 64 olduğuna göre;
A- Sistem dengede midir.
B-Siztem dengeye ulaştığında her maddenin derişimi ne olur?
Çözüm:
H2(g) +
l2(g)
↔ 2Hl(g)
Başlangıç:
1 mol
1 mol
2 mol
Derişim:
1M
1M
2M
l2(g)
↔ 2Hl(g)
H2(g) +
Başlangıç:
Derğişim:
Sonuç:
1 mol
-x
1 mol
-x
(1-x)
(1-X)
2 mol
+2x
(2+2x)
[2+2x] 2
Kd=64=
[1-x][1-x]
İse x=06
[Hl] =3,2M
[H2] = [I2] = 0,4M