HAYVAN FİZYOLOJİSİ
Version 0.3
DR UTKU GÜNER
Ders
Notları
Güncel sürüm için kare kodun
adresine gidin.
TRAKYA UNİVERSİTESİ
Fen Fakültesi Biyoloji Bölümü
Kod adı: AŞURE 3+3
Vertex site
Trakya Üniversitesi
Fen fakültesi
Biyoloji Bölümü
Mayıs 2014
DERLEME
İçindekiler
Temel Fizyolojik Yasalar................................................................ 1
Termodinamik yasalar .....................................................................1
Avogadro hipotezi............................................................................2
Boyle yasası ....................................................................................4
Herry yasası ....................................................................................5
Laplace yasası ................................................................................6
Fick Yasası......................................................................................6
Frank-Starling hipotezi.....................................................................7
Hücre Fizyolojisi............................................................................... 8
Hücre...............................................................................................8
Hücrenin inorganik bileşikleri.........................................................10
Hücrede su ....................................................................................11
Suyun fonksiyonu ..........................................................................12
Hücrenin organik molekülleri ........................................................13
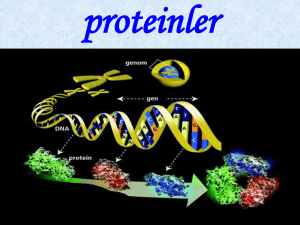
Proteinler .......................................................................................13
Proteinlerde Üç Boyutlu Yapısı......................................................17
Lipidler...........................................................................................25
Hormonlar......................................................................................27
Enzimler ........................................................................................27
Vitaminler ......................................................................................30
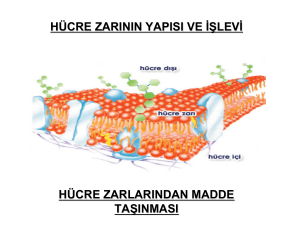
Hücre Zarı.......................................................................................31
Fosfolipid yapısı ............................................................................32
Hücre membranın görevleri ...........................................................35
Membran Proteinleri ......................................................................36
Membran proteinlerinin görevleri: ..................................................39
Membran Karbohidratları...............................................................39
Kolesterol ......................................................................................40
Kolesterol İşlevi .............................................................................42
Membran bağlantıları.....................................................................43
Bazal lamina..................................................................................45
1
Adhezyon Molekülleri: ...................................................................46
Hücre dışı matriks .........................................................................48
Fosfolipidlerin geçirgenliği .............................................................49
Basit Difüzyon ...............................................................................51
Filtrasyon.......................................................................................52
Taşıma proteinleri ile Kolaylaştırılmış diffüzyon.............................53
Kolaylaştırılmış difüzyon GLUT glikoz transporterları ....................54
Kolaylaştırılmış difüzyon Aquaporin su kanal proteinleri ...............55
Aktif- pasif Taşıma.........................................................................56
Simport-Antiport aktif taşıma yolları...............................................59
Primer aktif taşıma Na-K ATPaz....................................................60
Primer aktif taşıma Ca ATPaz .......................................................61
Sekonder Aktif Taşıma Na -Glikoz ve Amino asit coportu .............61
Membran reseptörü ikincil haberci.................................................62
Ekzositoz .......................................................................................63
Endositoz.......................................................................................64
Sitoplazma ......................................................................................66
Sıvı kısım sitozol ...........................................................................66
Endo plazmik Retikulum ................................................................67
Düz E.R. işlevi ...............................................................................67
Granüllü ER İşlevi..........................................................................68
Ribozom ........................................................................................68
Golgi Aygıtı....................................................................................70
Lizozom .........................................................................................72
Vitamin A zehirlenmesine bağlı lizozom membran hasarı .............73
Kanser ve lizozom .........................................................................74
Lizozomlar ve Gut hastalığı ...........................................................74
Lizozomlar ve Yangı ......................................................................74
Mitokondri ve Enerji Üretimi.........................................................75
Kemoosmotik Atp sentezi .............................................................76
Hücre iskeleti Görevi .....................................................................77
İntermedial Filamentler ..................................................................78
Mikrofilamentler .............................................................................78
Mikrotübüller..................................................................................79
Sentrozom .....................................................................................80
Kamçı ve Siler ...............................................................................81
Hücre iskeleti ve hareket ...............................................................81
Çekirdek (Nükleous) .......................................................................81
Sinir sistemi ....................................................................................85
Nöron.............................................................................................86
3
Gibbs Donan Dengesi ...................................................................88
Refleks Olayı .................................................................................90
Sinir iletisi ......................................................................................91
Membran Dinlenme potansiyeli .....................................................92
İyon Kanalları ................................................................................93
Kimyasal kapı yada Ligant kapısı ..................................................93
Voltaja bağlı Na kapısı...................................................................94
Aksiyon Potansiyeli .......................................................................94
Depolarizasyon-Hiperpolarizasyon ................................................96
İmpulsun sinir boyunca yayılması..................................................98
Mutlak refrakter periyod:................................................................99
Relatif (Nisbi) refrakter periyod: .....................................................99
Reobaz (Eşik değer)................................................................... 101
Ekdize Edici Post Sinaptik Potansiyel (EPSP) İnhibe edici post sinaptik
potansiyel (IPSP):........................................................................ 104
Sumasyon: ..................................................................................108
Nörotransmiter maddeler............................................................. 109
Asetilkolin .................................................................................... 112
Histamin ...................................................................................... 112
Dopamin: ..................................................................................... 112
Glutamik asit ve aspartik asit....................................................... 113
MAO (Mono amino oksitaz) ......................................................... 114
COMT (Katekol-O-Metil Transferaz):...........................................114
Serotonin ..................................................................................... 115
Kalsiyum kanalları ....................................................................... 116
Sinir sistemi ..................................................................................116
Sinir sistemin evrimsel gelişimi .................................................... 116
Sinir Organizasyonu .................................................................... 120
Omurilik sinirleri...........................................................................123
Beyinden çıkan sinirler ................................................................124
Beyin Kısımları ............................................................................125
Retiküler Aktive edici sistem (Retiküler Formasyon) ...................127
Bazal Ganglion ............................................................................128
Limbik sistem...............................................................................128
Hipotalamus ................................................................................129
Talamus....................................................................................... 130
Sinir sistemi organizasyon........................................................... 131
Sempatik Sinir Sistemi................................................................. 132
Parasempatik Sistem................................................................... 134
Kolinerjik Ve Adrenerjik Etkiler .................................................... 135
4
Cerebellum (Küçük Beyin) Fonksiyonlari..................................... 136
Büyük Beyin (Beyin korteksi) (Cortex cerebri) ............................. 137
Tek Hücrelilerde hareket ............................................................. 138
Çok hücrelilerde hareket..............................................................139
Kas ...............................................................................................141
Kas tipileri.................................................................................... 141
Kas Yapısını Oluşturan Proteinler ...............................................144
Aktin ............................................................................................ 144
Tropomiyozin: ..............................................................................145
Troponin : .................................................................................... 145
Miyozin : ...................................................................................... 145
Sarkomer Yapısı.......................................................................... 146
Motor Ünite..................................................................................147
Nöromüsküler bağlantı (kavşak, uç plak)..................................... 148
Kas Kasılmasi..............................................................................150
İskelet Kasında Gevşeme............................................................ 151
Tetani .......................................................................................... 152
Merdiven Treppe Olayı ................................................................153
İskelet kası tipleri......................................................................... 153
İskelet Kasında Enerji.................................................................. 154
Alaktik Anaerobik Sistem (Fosfatojen = ATP- Keratin fosfat): ..... 156
Glikoliz......................................................................................... 158
Kasılma Tipleri.............................................................................158
Rigor Mortis .................................................................................159
Kalp kası...................................................................................... 160
Düz Kas....................................................................................... 163
Mandal Mekanizması................................................................... 163
Kalsiyumu Bağlıyan Protein -Kalmodulin..................................... 167
Düz Kas Tipleri ............................................................................168
Viseral Düz Kas (Tek Birimli Düz Kas) ........................................ 168
Multiunit Düz Kas ........................................................................ 168
Reseptörler ...................................................................................170
Duyu Organları ve Reseptörler.................................................... 172
Duyu Organı Sınıflaması ............................................................. 173
Duysal Sistemin Genel Özellikleri................................................174
Deride sıcaklık algılanması.......................................................... 177
İki-Nokta Ayırımı .......................................................................... 178
Reseptörlerdeki Elektriksel ve İyonik Olaylar...............................178
Jeneratör Potansiyeller................................................................178
Fotoreseptörler ............................................................................178
5
Omurgalı Göz Yapısı ................................................................... 179
Görme Olayı ................................................................................179
Görmenin Kimyası ....................................................................... 181
Çubuk Hücreleri...........................................................................183
Retina .......................................................................................... 183
Koni Hücreleri..............................................................................184
Bipolar Hücreler...........................................................................184
Ganglion Hücreleri....................................................................... 184
Fotoreseptörler uyarı oluşumu ve bunun işlenmesi ..................... 185
Görme sinirleri .............................................................................186
Gece Körlüğü ..............................................................................186
Koku ............................................................................................ 187
Tad duygusu................................................................................189
İşitme Duyusu ve Denge ............................................................. 190
Tüy Hücreleri ...............................................................................193
Ses özelikleri ...............................................................................194
Kulak Zarı ve Kemiklerin İşlevleri ................................................195
İşitme Sinir Liflerindeki Aksiyon Potansiyelleri............................. 196
Odiyometre..................................................................................198
Vestibüler Fonksiyon .................................................................. 199
Vestibular Apparat Krista Ampullaris ve Dinamik Denge .............199
Nistagmus ...................................................................................199
Utrikular Reseptör Hücreleri Üzerine Yerçekiminin Etkisi ............200
Kalp ve damarlar...........................................................................201
Böcekte dolaşım sistemi..............................................................202
İnsanda Kalp ...............................................................................203
Kalp Sesleri .................................................................................206
Kalp ileti sistemi...........................................................................207
Elektrokardiyogram (EKG)........................................................... 213
Kalp atımı etkileyen faktörler ....................................................... 215
Stannius bağları .......................................................................... 218
Dolaşım sistemi ...........................................................................218
Kan basınçı .................................................................................219
Sistemik Dolaşım......................................................................... 221
Pulmonar dolaşım: ...................................................................... 222
Kan damarları ..............................................................................222
Kapiller kan damarları.................................................................. 223
Kapillerin Fonksiyonları: ..............................................................224
Kan akımı kontrolü ...................................................................... 226
Akut kontrol .................................................................................226
6
Kan Akımının Uzun Süreli Kontrolü .............................................228
İyonlar ve Diğer Kimyasal Faktörlerle Vasküler Kontrol...............232
Bazı Özgül Dokularda Kan Akımının Özel Kontrolü ve Endotel... 232
Kapillerde madde taşıma yolları ..................................................235
Kapiller membrandan sıvı geçişi: Starling güçleri; ....................... 235
Lenf sistemi .................................................................................236
Kan Fizyolojisi...............................................................................238
Plazma Proteinleri ....................................................................... 238
Plazma Lipidleri ...........................................................................242
Plazma Karbonhidratları ..............................................................242
Plazmada Bulunan İnorganik Maddeler....................................... 243
Kan hücreleri ...............................................................................243
Eritrositler(akyuvarlar) ................................................................. 243
Eritrosit membran proteinleri ....................................................... 245
Hemoglobin Yapımı ..................................................................... 246
Demir Metabolizması................................................................... 248
Alyuvarların Yıkımı ...................................................................... 249
Anemi .......................................................................................... 251
Eritroblastozis Fetalis .................................................................. 251
Polisitemi ..................................................................................... 251
Kan Grupları ................................................................................252
Trombositler ................................................................................254
Kanın Pıhtılşaması(hemoztaz) .................................................... 255
Ekstrensek Yol ............................................................................260
İntrensek Yol ...............................................................................260
Pıhtılaşma Faktörleri.................................................................... 261
Pıhtılaşmanın Sınırlandırılması ...................................................261
Kan Pıhtısının Erimesi ................................................................. 262
Vitamin K eksikliği ....................................................................... 263
Hemofili ....................................................................................... 263
Tromboembolik Olaylar ...............................................................263
Lökositler-Akyuvarlar Beyaz Kan Hücreleri ................................. 264
Nötrofil ......................................................................................... 264
Eozinofil....................................................................................... 265
Bazofil.......................................................................................... 266
Lökositoz-lökopeni....................................................................... 268
Lösemi......................................................................................... 268
Vücudun Enfeksiyonlara Direnci..................................................269
Doğuştan gelen bağışıklık ........................................................... 269
Kazanılan bağışıklık .................................................................... 270
7
Aktif ve pasif bağışıklık ................................................................270
Antijen ve antikorlar ..................................................................... 271
Komplement sistem ..................................................................... 273
Toll-benzeri reseptörler (Toll-like receptors-TLR) ........................ 275
Hapten......................................................................................... 275
Aşırı duyarlılık reaksiyonları ........................................................ 276
Tip I Hipersensitivite .................................................................... 276
Tip II Aşiri Duyarlilik..................................................................... 278
Tip III Aşiri Duyarlilik .................................................................... 278
Tip IV Aşiri Duyarlilik.................................................................... 279
Püy(irin oluşumu) ........................................................................ 281
Sindirim Fizyolojisi ........................................................................282
Farklı besinlere göre sindrim sistemi ...........................................283
Geviş getiren ve getirmeyen Otcularda sindirim sistemi ..............284
Sindirim kanalının yapısı ............................................................. 285
Müküs salgısı ..............................................................................287
Tükrük Salgısı .............................................................................287
Özofagus Salgısı ......................................................................... 288
Mide............................................................................................. 288
Mide salgı hücreleri ..................................................................... 290
Pankreas ..................................................................................... 292
Enterohepatik dolaşım................................................................. 294
İnce Barsak Salgısının Yapısı ..................................................... 295
Kalın Barsak ................................................................................295
Sindirim kanalındaki başlıca Sfinkterler ....................................... 296
Besinlerin Kimyasal sindirimi.........................................................297
Protein sindirimi...........................................................................297
Karbonhidrat sindirimi.................................................................. 301
Yağların sindirimi......................................................................... 304
Safra tuzlarının ............................................................................305
Karaciğer ..................................................................................... 306
Homestazi.....................................................................................313
Geribildirim ..................................................................................315
Refleks ve yerel homeostatik yanıtlar .......................................... 316
Isı dengesi ...................................................................................317
Canlıların çevreye osmotik durumuna uyumu ............................. 324
Azotlu atık maddeler.................................................................... 325
Üre sentezi ..................................................................................325
Ürik asit ....................................................................................... 328
Boşaltım organları ....................................................................... 328
8
Balıklarda Osmoregülasyon ....................................................... 329
Kuşlarda ozmoregülasyon: .......................................................... 331
Sıvı-Elektrolit Dengesi ................................................................. 331
İntrasellüler sıvı ...........................................................................332
Extrasellüler sıvı .......................................................................... 333
Sıvı değişiminde etkili faktörler .................................................... 334
Osmotik Basınç ...........................................................................335
Sodyum ve Potasyum.................................................................. 335
Asit-Baz dengesi ......................................................................... 336
İnsanda Azotlu atıklar(Üre, Ürik asit, Kreatin)..............................336
Amonyağın Atılımı ....................................................................... 338
Ekstrasellür ve İntrasellüer Tamponlar ........................................ 338
Boşaltım sistemi Böbrekler............................................................340
Böbrek Yapısı..............................................................................341
Böbreğin Kanlanması .................................................................. 341
Nefron tipleri ................................................................................342
Nefron yapısı ...............................................................................343
Filtrasyon yarıkları ve Podositlerin uzantıları ...............................345
Bowman kapsülünde basınç bağlı filtrasyon................................346
Glomerül filtrasyon Oranı............................................................. 347
Mezangiyal hücreler .................................................................... 348
Vesa recta ...................................................................................351
Jukstaglomerüler Apparat ve Hormonal kontrol........................... 352
Renin ........................................................................................... 353
ANP ............................................................................................. 356
İdrar oluşumu ..............................................................................356
Boşaltım sistemi diğer kısımları İdrar Torbası ve İdrar Yolları ..... 357
Hemodiyaliz.................................................................................357
Solunum Fizyolojisi .......................................................................360
Direkt ve indirekt solunum ........................................................... 361
Trake solunumu...........................................................................362
Dış ve İç solunum ........................................................................ 363
Canlılarda Gaz Alış Verişi............................................................ 363
Deri solunumu .............................................................................364
Solungaç solunumu ..................................................................... 365
Akçiğer solunumu ........................................................................ 366
Ters Akım Sistemi: ...................................................................... 367
Kuşlarda solunum........................................................................ 368
İnsanda Solunum Sisteminin Kısımları ........................................ 369
Soluk alıp verme.......................................................................... 370
9
Solunum pigmentleri.................................................................... 371
Akciğer ve Dokularda Gaz Değişimi ............................................373
Metabolizma ................................................................................378
Respiratuvar değişim oranı (RER, R) .......................................... 378
Solunum hızı kontrolü.................................................................. 379
Akçiğer alveollerindeki yüzey gerilimi ......................................... 381
Akciğer Hacim ve kapasiteleri: .................................................... 381
Su Altı (Dalma) Fizyolojisi............................................................ 384
Şnorkel ile Solunum..................................................................... 385
Hücre haberleşme yolları ..............................................................386
G-Proteinine Bağlı Reseptörler.................................................... 389
Tirozin Kinaz Reseptörleri ........................................................... 391
İyon Kanalı Reseptörleri ..............................................................393
İkincil haberciler...........................................................................394
Protein Fosforilasyonu................................................................. 400
Hücre İçi Reseptörler................................................................... 401
Hormon........................................................................................ 404
Hormon reseptörleri..................................................................... 409
Hormon Etki Mekanizmaları ........................................................ 409
Endokrin Bezler ...........................................................................413
Hipotamus ...................................................................................413
Hipofiz Hipotalamus İlişkisi .......................................................... 414
Hipotalamus hormonları ..............................................................414
Hipofiz hormonları(trofik hormonlar) ............................................415
Ön hipofiz hormonları .................................................................. 417
Opiyomelanokortin ailesi hormonlar ............................................417
Glikoprotein ailesi hormonlar ....................................................... 418
Somatomammotropin ailesi hormonları ....................................... 419
Opiyomelanokortin ailesi ön hipofiz hormonları (POMC) .............420
Pineal bez (Epifiz) hormonu (melatonin)...................................... 421
Böbrek hormonları (Eritropoietin, 1,25 kalsiferol, Renin) .............422
Timus bezi hormonları ................................................................. 422
Kalpten salgılanan ANP hormunu ...............................................422
Plasenta hormonları Koryonik gonadotropin (hCG) ..................... 423
Tiroid Bezi hormonları ................................................................. 423
Kalsitonin..................................................................................... 425
Paratiroid Bezi hormonları ........................................................... 426
Böbrek Üstü Bezleri (Adrenal Bezler) hormonları........................ 427
Glukokortikoidler.......................................................................... 428
Mineralokortikoid ......................................................................... 428
10
Gonadokortikoidler ...................................................................... 428
Pankreas hormonları ................................................................... 428
Glukagon ..................................................................................... 429
İnsülin .......................................................................................... 430
Diabetes Mellitus ......................................................................... 433
Gonadlar: Cinsiyet bezleri ........................................................... 433
Diğer Dokulardan salgılanan Hormonlar...................................... 437
Kaynaklar......................................................................................439
Indeks ...........................................................................................441
11
H A Y V A N
F İ Z Y O L O J İ S İ
Bölüm
1
Temel Fizyoloji Yasaları ve
Hücre Fizyolojisi
Temel Fizik ve kimya yasalarının bir kısmı fizyolojik önemi bakınundan
incelenmiştir. Hücre fizyolojisinde özellikle hücre membrane yapı ve işlevi ile
organeller hedeflenmiştir.
Temel Fizyolojik Yasalar
Termodinamik yasalar
1. yasa: evrendeki enerjiler yok olmaz sadece birbirine veya işe dönüşür. Evrendeki
toplam enerji sabittir (istisnai olarak nükleer reaksiyonlarda kütle enerjiye dönüşür, ama
evrendeki toplam kütleyi de enerji cinsinden kabul edersek, toplam enerji yine de
sabit olur).
Kalori (cal) sıcaklığı artırmak için gerekli enerjidir olarak
tanımlanır. 1 gram suyu 14.5°C dereceden 15.5°C. yükseltmek
için gereken enerjisidir. Kalorinin 1000 katı kilokalori(kcal)
olarak tanımlanır. Diğer bir enerji birimi ise joule (J) dür. 1000
joule 1 kilo joule eşittir. 1 Kcal 4.184 kJ eşittir.
ŞEKİL 1.1 Termodimaniğin birinci yasası enerji ve entropi
Canlı sistemler enerjilerini temel olarak ya diğer canlılardan, güneşten yada kimyasal
bağ enerjisinden elde eder. Enerji yok olmaması yalnızca farklı formlara dönüşmesi
1
H A Y V A N
F İ Z Y O L O J İ S İ
ekositemde canlı metabolizmasında önemlidir. Tüm enerji döngüleri sırasında bir miktar
enerji kaybolur yani entropi(düzensizlik) artar.
2. yasa: Hiçbir cihaz veya sistem aldığı ısıyı tamamen işe dönüştürecek şekilde
çalışamaz(%100 verim olmaz). Ayrıca sadece ısıyı bir sıcaklıktan daha yüksek bir
sıcaklığa transfer eden bir süreç mümkün değildir. Canlı sistemlerde enerji dönüşümü
mekanik sistemlerden daha yüksek verimde olmasına rahmen hiçbir zaman yüzde yüze
seviyesine gelemez. "Hiçbir enerji akışı, düzensizlikten düzene doğru olamaz." veya
"Bütün sistemler, evrenin yapısı gereği düzensizliğe doğru gitmeye mahkûmdur."
veya "Yapılar, her zaman düzenli bir halden, düzensiz bir hale doğru
ilerlerler."Biyolojik yapılarda enerji dönüşümleri insan yapımı sistemlere daha
yüksektir. En yüksek verimli enerji dönüşümü biyolümünasta gözlenir. Ateşböceği
lüsiferin adlı maddenin ATP ile fosforilasyonu sonucu bir parıltı meydana getirir.
Kimyasal enerji böylece ışık enerjisine dönüşür ve böcekler arasında iletişimi sağlayan ışık
parlamaları meydana gelir. Az bir enerjide ısı olarak kaybolur(verim %98).
3. yasa: mükemmel kristallenmiş bütün maddelerin mutlak sıcaklıktaki (0 kelvin)
entropileri sıfırdır. Entropi hesabının temelini oluşturan yasadır. Sıfır Kelvin üzerindeki
tüm moleküllerin belirli bir kinetik enerjileri vardır. Bu enerji canlı sistemlerindeki kendi
kendine olan enerji kullanılmayan tüm olay için gereklidir.
0. yasa (evet sıfırıncı): Eğer iki cisim üçüncü bir cisim ile ısısal denge halinde ise
birbirleriyle de ısısal dengededir ve bu nedenle aynı sıcaklıktadır.
ŞEKİL 1.2 Termodimaniğin sıfıncı yasası ısısal denge
Sıcaklık ölçümünün temeli bu yasadır. Sıfırıncı olmasının sebebi ise diğer yasalardan sonra
çıkmış olması ama diğer yasaların anlaşılabilmesi için gerekli olmasıdır. Canlı sistemdeki
ısı dengesinde 0. yasa kullanılır. Canlılar ısı koruması için yada ısının diğer ortamlara
transferinde bu yasa önemlidir.
Avogadro hipotezi
Bütün maddeler; demir, kalsiyum ya da oksijen gibi saf kimyasal maddeler, kimyasal
elementlerden oluşur. Bir element kimyasal olarak daha küçük parçalara ayrılamayan
maddedir.
2
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.3 Avargadro hipotezi
Maddeler normal şartlarda gaz, katı yada sıvı halde olabilir. Vücudun yaklaşık % 98'i
oksijen, karbon, hidrojen, nitrojen, kalsiyum ve fosfor olmak üzere sadece altı
elementten meydana gelmiştir. Madde moleküler farklı atom ağırlığa sahip olmalarına
rahmen molar olarak eşitlerse aynı sayıda atom içeririrler. Aynı sıcaklık, basınç ve hacim
altında gazlar, aynı sayıda molekül içerirler. Buna göre, belirli bir hacimdeki gazın
bulundurduğu molekül sayısı, gazın kütle ya da boyutundan bağımsızdır. Örnek olarak,
aynı hacimdeki hidrojen ve nitrojen verilebilir. Buna göre, hidrojen de nitrojen de, aynı
hacim, aynı basınç ve aynı sıcaklıkta aynı molekül sayısına sahiptir. Bu durum solunda
alınan havaın birleşenlerin dağılımında önemlidir. Soluk havasında bulunan gazların
dağılımında basınç ve sıcaklık önemli rol oynar buna karşın molekül ağırlıları gaz karşımda
gazların dağılımı değiştirmez. Bu noktada gazların sıvılar içinde erimelerinde diğer
faktörlerinde rolü olduğu unutmamalıdır.
Avagadro kanunu matematiksel olarak şöyle gösterilebilir:
V \ n= a.
V kübik metre olarak hacim, n gazın mol sayısı, a da bir sabittir. Bu denklem, sadece
homojen maddeler(tek bileşenli) için geçerlidir. Buna homojen sıvılar ve katılar da dahildir.
Avogadro yasasının en önemli sonucu, yasanın ideal gaz sabitinin tüm gazlar için aynı
olduğunu bulmasıdır.
P paskal olarak basınç, T de Kelvin olarak sıcaklıktır. Denkleme göre, tüm gazlar için bu
sabit eşittir. Yani gazın boyutunun ya da kütlesinin bu sabitin değerini değiştirmez.
Standart durumda, bir mol ideal gaz, 22.4 litre (dm3) yer kaplar. Bu değer, genellikle molar
hacim olarak kullanılır. Bir moldeki molekül sayısı olan Avogadro sayısı, yaklaşık olarak mol
başına 6.02×1023 parçadır. Avogadro yasası, toplam gaz yasasını oluşturan Boyle yasası,
Charles yasası ve Gay-Lussac yasasıyla birlikte ideal gaz yasasını oluşturur. Farklı gazların
karışımı olan havadaki her bir molekül farklı atom ağırlığına sahip olmasına karşın
aynı hacim ve basınçta eşit sayıda molekülden oluşmuştur. Sıcaklığın ve basınçın
değişmesi hava karışımdaki moleküllerin sayısını etkiler. Bu durum dalış fizyolojisi için
önemlidir.
Molekül ağırlığı, bir maddenin molekülünün yapısına katılan tüm atomların ağırlıklarının
toplamıdır. Örneğin suyun (H2O) molekül ağırlığı; 2 x 1,008 + 16,00 = 18,016’dir.Molekül
ağırlığının gram cinsinden ifadesi mol olarak tanımlanır.
1/1000 mol=1 mmol veya 1 mol=1000 mmol.
Örneğin 1 mol (1000 mmol) su, 18,016 gram su demektir veya 18,016 gram su 1 mol’dür
Gerçekte 1 mol (1000 mmol) suda Avogadro sayısı (6,023 x 1023) kadar su molekülü
bulunur
Ekivalan ağırlık (eşdeğer ağırlık), bir element veya bileşiğin 1 mol hidrojen ile
birleşen veya onun yerine geçebilen miktarını ifade eder; moleküler ağırlığın valansa
(değerlik) bölümüne eşittir. Ekivalan ağırlığın gram cinsinden ifadesi, ekivalan sayısı (Eq)
olarak tanımlanır. 1/1000 Eq=1 mEq veya 1 Eq=1000 mEq
Örneğin 1 ekivalan HCl, 36,46 gram HCl demektir veya 36,46 gram HCl, 1 ekivalan HCl’dir.
3
H A Y V A N
F İ Z Y O L O J İ S İ
Aynı şekilde 1 Eq (1000 mEq) kalsiyum(Ca), 40,08/2=20,04 gram kalsiyum demektir veya
20,04 gram kalsiyum 1 Eq (1000 mEq) kalsiyumdur.
Valans (değerlik); bir asit için moleküldeki yer değiştirebilen H atomları sayısı, bir
baz için moleküldeki yer değiştirebilen OH- iyonu sayısı ve bir tuz için moleküldeki
(+) yüklü iyonların yerine geçebilecek H+ iyonu sayısı oksidan bir madde için
reaksiyon sırasında alınıp verilen elektron sayısını gösterir.
Boyle yasası
Boyle yasasına göre, sıcaklıklar sabit tutulduğu sürece, belirli ölçüde alınan bir ideal
gazın hacmiyle basıncının çarpımı sabittir. Matematiksel bir anlatımla:
PxV=k
P paskal olarak basınç,
V kübik metre olarak hacim,
k gaz sabiti (8.3145 J/(mol K).
Sabit sıcaklıkta tutulan belirli bir miktar gazın, hacmi ile basıncının çarpımı
sabittir.
Boyle yasası, genellikle, sadece hacim ya da basınç anlamında yapılan bir değişikliğin
sonuçlarını önceden tahmin etmek için kullanılır. Belirli ölçüdeki herhangi bir gazın,
sıcaklığın sabit tutulma şartıyla (bunun için soğutma ve ısıtma kullanılmalıdır), "önce" ve
"sonraki" hacim-basınç ilişkisi aşağıdaki gibidir:
P2P=1 xPV
/VP22 x V2
1V1 1=
Bu denklem, genellikle herhangi bir (basınç ya da hacim) "sonra" öğesinin bulunması için
kullanılır. Örnek: Gazlar, sıkışabilirler. Gazlar Basınç farkı yönünde akarlar. Direnç artarsa
akış azalır. “Hava”, bağımsız olarak difüze olan gazların bir karışımıdır. Her bir gazın
karışım içinde miktarına bağlı bir “kısmî basıncı” (Pgaz) vardır. Boyle yasası akciğerlerin
çalışmasında önemlidir. Akciğerlerde soluk verilmesi sırasında hacim artışı olur ve
akciğer basıncı azalır bu durumda dıştaki hava akciğerlere dolar. Tersine soluk
vermede akciğer hacim azalı ve artan basınçla akciğerlerdeki hava dışa atılır.
ŞEKİL 1.4 Hacim basınç arasındaki ilişki
Boyle kanuna göre sabit sıcaklık altında gazların hacimleri basınçlarıyla ters
orantılıdır. Basıncın artışı ile dolaşımdaki ve dokulardaki gazların hacimleri ve oluşmuş gaz
4
H A Y V A N
F İ Z Y O L O J İ S İ
kabarcıklarının çapları küçülür. Bu etkiden gaz embolisi ve kabarcık oluşumuyla ilintili
olan dekompresyon (vurgun) hastalığında faydalanılır. Su dalmak için yüzeyde hava alıp
dalan bir dalgıç akciğer hacmi 6 lt kabul edilirse 10 metrede bu hacim 3 litreye düşer
(her on metrede 1 atm basınç artışı olur). Dönüp hiç nefes vermeden su yüzeyine
çıktığında akciğerindeki hava miktarı aynı olduğundan, akciğerin hacmi de ilk haline eşit
olacaktır. Dalgıç su yüzüne çıkarken sıkıştırılmış olarak solunan bu fazla havanın boşalması
için yeterli zaman tanımazsa akciğerlerde genişleyen gaz dokularda yırtılmalara yol açar.
Fakat tüple dalış yapan (scuba- self contained underwater breathing apparatus) bir
dalgıç için durum farklıdır. Bu sefer dalgıç, 10 metrede hacmi yarısına inmiş olan ciğerini
tüpteki havayla doldurur. Şimdi akciğerlerde yüzeydekinin iki katı kadar hava vardır. Yine
hiç nefes vermeden su yüzeyine geri döndüğünde, akciğerin içindeki hava ilk hacminin iki
katına ulaşmak isteyecektir. Bu da akciğerin kapasitesini zorlayacağından, zarar
görmesine sebep olabilir. Eğer dalgıç derinde soluduğu havayı su yüzeyine çıkarken geri
vermezse genişleyen hava akciğer dokusunu zedeleyebilir. Yırtılan damarlardan dolaşıma
katılan hava tıkanmaya (emboliye) yol açabilir. Dokularda ve merkezi sinir sisteminde
çözünen azot derinde karar verme gibi fonksiyonları bozup dalgıçın yaşamını tehlikeye
sokabilir.
Herry yasası
Bir maddenin belli bir çözücünün belli bir miktarında, belli basınç ve sıcaklıkta
çözünebilen en fazla miktarına o maddenin çözünürlüğü denir. Çözülmeyi bazı
faktörler etkiler: Belirli şartlar altında bir gazın
• Çözünen maddenin türü, sıvıdaki çözünürlüğü o gazın çözülme
katsayısı ve basınçı ile doğru orantılıdır. Gazın
• Çözücünün türü,
“kısmi basıncı” ile çözülür doğru orantılı iken
• Sıcaklık, Basınç,
sıcaklık ile ters orantıdır. Çeşitli çözücülerdeki
• Ortak iyon etkisi,
gaz çözünürlüğü değişir Örneğin Suda O2: 0.15
• Ortamın pH sı,
mmol/L (zayıf) iken
CO2: 3.0 mmol/L
• Yabancı iyonlar,
(kuvvetli [x20]). Gazın erime katsayısı artıkça
• Kompleks oluşumu.
yada gazın basınçı artıkça daha fazla gaz sıvıde
erimiş hale geçer. Başka bir ifade ile bir sıvının içinde çözünebilecek gaz miktarı o gazın
kısmi basıncıyla doğru orantılıdır.
Gazın basıncı arttıkça sıvıda eriyen gaz miktarıda artar. Buna örnek olarak kola şişesinde
erimiş halde bulunan CO2 verilebilir. Kolada çözünen gaz CO2tir ve yüksek basınçlarda
daha çok çözünür. İçecek kapağı açıldığında gaz çıkışı fark edilir. Basınç kalktığı için
çözünmüş CO2 uzaklaşır ki bu da köpürme şeklinde görülür. Herry yasasının fizyolojik
önemi solunum sisteminde ve vurgunda gözlenir. Dalgıçların zaman zaman
yaşadıkları“vurgun” olayı da gazların çözünürlüğü ile ilgilidir. Dalgıçlar su altında basınçlı
hava solurlar ve bu nedenle kanda daha fazla miktarda azot gazı çözülür. Dalgıç yüzeye
çıktığında fazla çözünmüş azot kabarcıklar oluşturur. Bu kabarcıklar eklem ve
damarlarda şiddetli ağrılara, felç ve hatta ölümlere neden olur. Herry yasasının canlılardaki
diğer önemli etkisi sıcaklığa bağlı olarak çözülmenin(Oksijen sıvıdaki örneğin plazma içinde)
çözülmesinin artmasıdır.
5
H A Y V A N
F İ Z Y O L O J İ S İ
Laplace yasası
Kan damarı duvarı, kan basıncı ve kabın dışındaki çevre basıncı arasındaki farkın bir sonucu
olarak gerilir. La Place yasası transmural basınç farkı ile gerginlik, yarıçapı ve damar
duvarının kalınlığı arasındaki ilişkiyi açıklar. Tabii ki, daha yüksek bir basınç farkı, fazla
gerilime neden olacaktır. Damar çapı daha büyük olan daha fazla bir gerilime sahiptir. Bu üç kural
bir denklemin içine sonuçlanır:
T = (P x R ) / M
T duvarlarında gerilim olduğunda, P duvar boyunca olan direnç, R silindirin yarıçapıdır
ve M duvarın kalınlığı basınç farkıdır. Kalp kan getiren venlerle kalp basınçı artar. Bu
durumda kalp ölçüde gerilmiş olur ve yarıçapı (R) ventrikül artar. Bu nedenle çok daha büyük
bir duvar tention (T)kalp kası tarafından geliştirilebilir olan kan ejeksiyon sırasında aynı basıncı (
P) oluşturmak için kullanılır. Böylece genişlemiş kalp, normal büyüklükte kalp kıyasla kan
aynı miktarda pompalamak için daha fazla enerji gerektirir. Bir balon üflemediğinizi
düşünün. Daha sert balonda, içindeki hava basıncı ile dış arasında daha yüksek bir
basınç farkı vardır. Basınç farkı yükselir, bu balon lastik duvarlarında gerilim de artar ve
bu da balon gerginliğe neden olur. Şimdi çok kalın kauçuktan yapılmış bir balon üfleme hayal
edin. Daha fazla basınç farkı balon duvarlarında gerginliği aşmak için gereklidir.
La place yasası
Basınç altında kalan damar ve
alveolerde basınça maruz kalan
membranın şekline bağlı olarak
farklı gerilim formülleri kullanılır.
ŞEKİL 1.5 Bir kabın cidarına yapılan basınç
Bir organın duvarındaki gerilim, organ içi basınç ve lümen çapı ile doğrudan ilişkilidir. (gerilim =
basınç x çap). Kalbin duvar gerilimi arttığı takdirde beslenmesi bozulur, iskemi sonucunda
yetmezlik görülebilir
Fick Yasası
Bir gazın diffüzyonu gazın solübilitesi ve membranın yüzey ölçümü ile doğru,
membranın kalınlığı ile ters orantılıdır. Diffüzyon için membranın iki tarafında basınç farkı
olmalıdır.
6
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.6 Gaz difüzyonun etkileyen faktörler.
Moleküler kütle taşınımı, difüzyon, konsantrasyon farklarının bulunduğu bir ortam
içinde, yüksek konsantrasyon bölgelerinden düşük konsantrasyon bölgelerine yönelmiş
moleküler kütle taşınımı ile karşılaşılır. Difüzyon adı verilen bu olayda, bir noktada birim
yüzeyden birim zamanda geçen mol sayısına difüzyon akı yoğunluğu (Mdif ) denir. Fick yasasına
göre, difüzyon akı yoğunluğu konsantrasyon gradyenti ile orantılıdır. Ortamın ve taşınan
moleküllerin özelliklerine bağlı olan D parametresine difüzyon katsayısı adı verilir
V gaz = A x D x (P1 – P2) / T
Frank-Starling hipotezi
Frank-Starling mekanizması temel olarak, kalp kası doluş sırasında ne kadar çok gerilirse,
kasılmanın kuvvetinin ve aortaya pompalanan kanın miktarının da o kadar büyük
olacağı anlamına gelir. Fizyolojik sınırlar içerisinde diyastol esnasında kalp ne kadar
kanla dolarsa(kalbe ne kadar gelirse), sistolde de o oranda fazla miktarda kan
pompalanır. Yani kısaca kalbe ne kadar kan gelirse kalp o kadar kan pompalar. FrankStarling yasasının altında yatan temel mekanizma kalp kası liflerinin gerildiklerinde kasılma
güçlerini artırmaları yatmaktadır(örneğin lastiğin gerildikten sonra bırakılması gibi). Kalbe
venöz dönüsteki herhangi bir artış diyastol sonu hacmi artırır, bu artış ventrikülleri genişletir, kalp
kası liflerini gerer, atım hacmini sonuçta da Kalp output (kalp çıktısı) artırır. Atardamarın
kapiller damar girişinde kan basıncı 40 mm Hg Osmotik basınç ise 25 mmHg iken ven ucunda
kan basıncı 15 mm Hg Osmotik basınç 25 mmHg seviyesindedir. Arter damar ucundan
başlayarak kapiller damarlar botunca su, iyonlar kısmende albümin kan proteinleri doku
sıvısına(ekstrasellüler sıvıya) geçmeye başlar bu neden kapiller boyunca kanın osmotik basınçi 25
mm Hg 15 mmHg seviyesine iner buna nedenle kapiller damarların arteriol ucunda kan dan doku
sıvına net geçiş varken kapillerin ven ucunda osmatik basınçın azalmasından dolayı sıvı geçişi
doku sıvıdan kana doğru olur.
7
H A Y V A N
F İ Z Y O L O J İ S İ
Hücre Fizyolojisi
Canlılar, hücre adı verilen en küçük yapısal birimlerin, çok karmaşık fonksiyonları
yerine getirebilecek şekilde bir araya gelmesiyle oluşmuşlardır. Hücre, gözle
görülemeyecek kadar küçüktür ve çevresi yarı geçirgen bir zarla kuşatılmış durumdadır.
Hücreye şeklini veren sitoplâsma gerekli yaşamsal öğeleri içeren, yarı sıvı bir maddedir.
Aynı görevdeki hücrelerin kümelenmesi ile dokular; farklı dokuların belirli bir işlevi görmek
üzere birleşmesiyle de organlar oluşur. Yapısal özellikleri farklı olan organların bir
araya gelmesi sonucunda da belirli bir işlevsel bütünlük gösteren sistemler
şekillenir. Canlıdaki tüm metabolik faaliyetler hücre içinde geçer. Hücrenin iki temel
bölümü nükleus ve sitoplâzmadır. Nukleus, sitoplazmadan bir nükleus
membranından ayrılmıştır; sitoplazma, kendini çevreleyen sıvıdan hücre
membranıyla ayrılır.
Hücre
Canlının, tüm canlılık işlevlerini yürütebilen temel birimine hücre denir. Hücreyi meydana
getiren başlıca beş esas madde; su, elektrolitler, proteinler, lipidler ve karbonhidradlardır.
Hücreyi meydana getiren bu maddelerin bütününe protoplazma denir. Bir hücrenin işlevleri
organel adı verilen alt sistemler (hücre çekirdeği, mitokondri, endoplazmik retikulum, golgi
cisimciği, ribozomlar vb.)tarafından bir iş bölümü halinde yürütülür. Organeller hücre içi
sıvıdan zarlarla ayrılırlar. Hücre de dış ortamdan hücre zarı ile ayrılır. Protoplazmayı dıştan
çevreleyen bu zar, canlı, esnek, seçici geçirgen özelliğine sahiptir. Hücrenin Fonksiyonel
Özellikleri: Hücreler ortamdan ham materyali alırlar. Enerji üretirler: Bu enerji iç ortam
dengesini sağlamak ve sentez reaksiyonlarını yürütmek için gereklidir. Kendi
moleküllerini sentez ederler. Organize bir şekilde büyürler. Çevreden gelen uyarılara
cevap verirler. Çoğalırlar (bazı istisnalar haricinde). Hücrenin Yapısal Özellikleri Kalıtsal
bilgiler DNA içinde saklanır. Hücredeki genetik kod temelde aynı yapıdadır. Bilgi DNA dan
proteinlere RNA aracılığı ile geçer. Proteinler ribozomlar tarafından yapılır. Proteinler
hücrenin fonksiyon ve yapısını düzenlerler. Bütün hücreler seçici geçirgen bir zar olan
plazma membranı ile çevrilmiştir.
Çekirdek Hücre çekirdeği çekirdek zarı , sitoplazması
çekirdekçik ve kromatin iplikten meydana gelir. Hücre
bölüneceği zaman çekirdek zarı ve çekirdekçik eriyerek
kaybolur. Hücre bölündükten sonra tekrar meydana
gelir. Çekirdekçik rRNA’nın sentezlendiği yerdir ve
Ribozomun oluşturulmasını sağlar. Çekirdek zarı
Endoplazmik retikulumla bağlantılıdır. Porlar yardımıyla
çekirdekten çıkan maddeler hücre sitoplazmasına geçer.
Çekirdek 3 temel yönlendirme yapar.
1) Hücrenin en basit şekilde iki yeni hücre vermek üzere
bölünmesini kapsayan hücresel çoğalması,
2) Hücrenin metabolik aktivitelerinin oluşumu sırasında
hücrenin farklılaşmasını kontrol etmesi,
3) Hücrenin metabolik aktivitelerini düzenlemesidir
ŞEKİL 1.7 Hücre ve organeleri
8
H A Y V A N
F İ Z Y O L O J İ S İ
1. Hücre, canlının tüm yaşam belirtilerini barındıran ve uygun ortamda
gelişen, bölünüp çoğalabilen en küçük yaşam birimidir.
2. Sitoplâzma inorganik maddeler ve karbon içeren organik moleküllerden
oluşmaktadır.
•
•
İnorganik maddeler: Su, mineral iyonlar (anyon, katyon)
Organik maddeler: protein, karbonhidrat, lipid, nükleik asitlerdir.
Hücre boyutu fonksiyon ve işlevine uygun biçimde büyük farklılıklar içeririr. Örneğin
İnsan ovumu 200 mikron, Balık yumurtası 5 mm ve Tavuk yumurtası 30 mm
boyutlarındadır. Buna karşın beyin hücrelerinin en küçüğü 4-5 mikron çapındadır. Hücre ve
hücre içindeki organeller boyutları 20 um başlar, buna karşın makro moleküllerin boyutları
20 nanometre kadardır. İnsan vücudunda yer alan hücrelerin boyutları oldukça farklıdır.
Örneğin en küçük hücrelerin boyutu 4-5 mikron kadar olduğu halde yumurta hücresi
(ovum) 200 mikron çapındadır ve çıplak gözle bile görülebilir. Hücre boyutları açısından
sözü edilmeye değer en ilginç örnek ise sinir hücreleridir. Uzantıları ile birlikte boyu 1.5
metreyi bulan tipleri vardır. İnsan vücudundaki hücreler kübik ve silindirik biçimden
örümceksiye kadar değişen biçimler gösterirler. İnsanda Kan hücreleri hariç toplam
hücre sayısı 1013–1014 kadardır. Merkezi sinir sistemi, retina, lens kristali hücre sayısı
sabittir ve sonradan çoğalamaz. Hücreler çoğunlukla renksizdir, buna karşın deri ve
gözdeki pigmentli hücreler vardır. Sıvı ortamda bulunan hücreler (akyuvarlar) küremsi
biçimlidirler. Hücrenin şeklide fonksiyona uygun biçimde odukça farklıdır. Sinir
hücreleri dalanma bir birine temas ederken, Epitel hücreleri yan yana gelerek
fonksiyonlarına uygun yüzey alanları oluştururlar.
ŞEKİL 1.8 Hücre boyutu
9
H A Y V A N
F İ Z Y O L O J İ S İ
Atomlar molekülleri, moleküller makromolekülleri, makromoleküller makromoleküler
kompleksleri oluşturmasıyla, dokuların en küçük yapı taşları olan ve yaşamın tüm
özelliklerini sergileyen hücreler oluşmaktadır. Genel olarak tüm hücreler temelde aynı yapıya
sahiptirler. Fakat kökene aldıkları dokuya ve dolayısıyla fonksiyonlara bağlı olarak bazı
özelleşmeler gösterirler. İnorganik moleküllere, hücrede yaygın olarak bulunan ve önemli görevler
üstlenen sodyum (Na+), potasyum (K+), kalsiyum (Ca2+), klor (Cl-), hidrojen (H+),
oksijen (O2), tuz (NaCl) ve su (H2O) oluşur. Organik moleküller ise, karbohidratlara; basit
şekerler, glikojen, lipidlere; yağ asidleri, trigliseridler, fosfolipid, steroidler, proteinlere,
keratin, antikor, aktin, miyozin ve enzimler nükleik asidlere ise; deoksiribonükleik asid
(DNA) ve ribonükleik asid (RNA). Protoplazma temel olarak beş maddeden oluşur: su,
elektrolitler, proteinler, lipitler, karbonhidratlar oluşur.
Birleşik yada madde
Hücredeki oranı(ağırlık)
Su(H2O)
İnorganik iyonlar(Na, K, Mg, Ca, CI)
Küçük metabolitler
Proteinler
RNA
DNA
Fosfolipit ve diğer lipitler
Polisakkaritler
70
1
3
18
1.1
0.25
5
2
Hücrenin inorganik bileşikleri
Hücrenin temel sıvı ortamı sudur, birçok hücrenin %70-80’i sudan oluşmuştur (yağ
hücreleri hariç). Hücre içindeki birçok kimyasal madde suda çözünmüş durumdadır,
diğer maddeler parçacıklar halinde süspanse olmuştur. Kimyasal reaksiyonlar, erimiş
kimyasallar arasında ya da süspanse haldeki zarsı yapı ve partiküllerin yüzeyiyle su
arasındaki sınırda gerçekleşir.
ŞEKİL 1.9 Moleküllerin üç boyutlu ve iki boyutlu gösterimi.
Suyun önemi, H atomlarının kısmi (+)yük, O2’in de kısmi (-)yük taşımasından ileri
gelmektedir. Bu su molekülüne dipol iki kuvvetli özelliği kazandırmaktadır. Hem
birbirlerine hem de artı ve eksi yüklü diğer moleküllere bağlanabilmektedirler.
10
H A Y V A N
F İ Z Y O L O J İ S İ
Hücrede su
Hücredeki toplam suyun % 5’i hücredeki diğer yüklü moleküllere bağlanır. Bu suya bağlı
su denir. Serbest su ise hücredeki suyun %95’ini oluşturur. Serbest su hücrede diğer
maddeler için iyi bir eritici ve sitoplazmanın kolloidal yapısı için iyi bir dağıtıcı ortam
sağlar.
•
•
•
•
Tüm Biyokimyasal Reaksiyonlar Sulu Ortamda Gerçekleşir.
İyi bir çözücüdür.
Hidrolazlar gibi enzimler için substrat.
Isı düzenleyicidir.
.
Hücrenin su içeriği, hücrenin yaşı ve hücrenin metabolik etkinliği ile ilgilidir. Su miktarı
embriyonik hücrelerde en fazla iken ergin ve yaşlı organizmalarda bu oran azdır.
Ayrıca kemik minesi ve kemik dokuda su miktarı yok denecek kadar azdır.
Su, yüksek erime ısısına sahiptir. 1 gram buzu eritmek için 0 °C'de 80 kalori gerekir.
Erime ısısının yüksek olması suyun donmasını geciktirir; böylece biyolojik sistemler düşük
sıcaklıklara dayanıklı olabilen özelliklerini kazanırlar.
Suyun Isınma (özgül) ısısı yüksektir. 1 g suyun sıcaklığını 1 °C arttırmak için 1 kalori'lik
enerji gereklidir. Bu özgül ısı, amonyak dışındaki tüm maddelerinkinden yüksektir. Böylece su
sıcaklıklarda fazla artış olmadan daha fazla enerji depolayabilir ve böylece canlı sistemde
sıcaklık ve metabolik olaylar daha kararlı olabilmektedir.
Suyun gizli buharlaşma ısısı yüksektir. 100 °C'de 1 g suyu 1 g su buharı haline
dönüştürmek için 539 kaloriye ihtiyaç vardır. Gizli buharlaşma ısısının yüksekliği canlı
sisteminin izotermal olmasında en önemli katkıya sahiptir. Suyun gizli buharlaşma ısısı,
Hidrojen bağlarından dolayı yüksektir. Hidrojen bağlarının kırılması için yüksek enerjiye
gerek vardır.
11
H A Y V A N
F İ Z Y O L O J İ S İ
Suyun fonksiyonu
1.
Hücrelerin ihtiyacı olan maddeleri hücreye taşımak: su temel molekül olarak tüm
suda erimiş maddeleri taşır.
2. Hücrelerin fonksiyonlarını yerine getirebilmesi için gerekli olan katı maddelerin
çözünmesini sağlamar tüm maddeler(hirofobikler hariç) suda erir.
3. Hücrelerde metabolik faaliyetler sonucu oluşan atık maddeleri boşaltım
organlarına (böbrek, akciğer, deri, sindirim kanalı) taşıyarak vücut dışına atılımını
sağlar.
4. Su vücut ısısını dengede de tutar.
5. Vucud içindeki tüm sıvılar temel olarak kan üzerinden ayarlanır su kanın
hacmini dengeler bu yolla tüm sıvıların miktarını ve yoğunluğunu ayarlar.
6. Besinlerin sindirimine yardımcı olur hidroliz suyla gerçekleşir.
7. Beyin, omurilik gibi bazı organları dış etkenlerden korumak, suyun görevleridir.
8. Suyun ısı kapasitesinin yüksek oluşu vücut ısısının ayarlanmasını sağlar.
Buharlaşma enerjisi yüksek oluşu nedeniyle vücuttaki fazla ısı terleme ve buharlaşma
ile dışarı atılır. Vücut ısısı dengelenir. Buharlaşma ısısı yüksek olduğu için su kaybı
az olur. Vücuttaki suyun %20 sinin kaybı hayati tehlikeye neden olur.
9. Suyun sıvı halinin yoğunluğu katı halinin yoğunluğundan fazladır. Bu sayede su
üstten donmaya başlar. Bu da suda yaşayan canlılar için hayati önem sağlar. Bu
maddede açıklamam gereken bi konu var; su üstten donduğu için su dışındaki düşük
ısıdan su daha çok etkilenmez. Yani su yüzeyindeki buz tabakası, suyu yorgan
gibi örttüğünden dışarıda su -15 derecelerdeyken bile su o kadar soğumaz.
10. Su donarken dışarı ısı vererek izolasyon görevi yapar.
11. Su, vücuttaki boşluklara pasif difüzyonla geçer ve basınçla dengeyi sağlar.
12. Vücuda alınan besinlerin bir kısmının çözülmesini sağlayarak sindirimi
kolaylaştırır. Ayrıca suda bazı vitaminler çözünür, bunlar da metabolizmanın
düzenlenmesinde yardımcıdır.
13. Vücutta iyonize olarak asit-baz dengesinin korunmasında rol oynar. Besin
maddelerinin ve oksijenin hücrelere taşınmasını ve biyokimyasal reaksiyon
ürünlerinin dışarı atılması için taşıyıcı olarak görev yapar
12
H A Y V A N
F İ Z Y O L O J İ S İ
Hücrenin organik molekülleri
Hücrede lipit, protein ve karbohidrat olmak üzere temelde 3 organik molekül vardır. Yapısal
olarak vücutta en fazla bulunan organik molekül kollejendir. Hücrede su dışında bulunan
anyon (negatif yüklü iyonlar) ve katyon (pozitif yüklü iyonlar) hücre kitlesinin %1’ini
oluşturur. Bunlar hücre metabolizmasında görev alır ve hücre işlevinde kritik roller oynarlar.
Asit-baz dengesini korur ve osmotik basıncın ayarlanmasında önemlidir. Canlı vücudunda
Enerji verici moleküller
= karbonhidratlar, lipitler, proteinler.
Yapıcı-onarıcı moleküller
= proteinler, lipitler, karbonhidratlar.
Düzenleyici moleküller
= proteinler, vitaminler, lipitler.
Yönetici moleküller
= nükleik asitler.
biyosentez reaksiyonları sonuncu oluşturulan maddelerdir.
Organik moleküllerin vücutta çeşitli görevleri vardır. Bunlar;
Protein
Yağ (Lipid)
Vitamin
Element
Karbonhidrat
C, H, O
C, H, O, N (S, P)
C, H, O
-----
Monomer
Glikoz
Amino asit (a.a.)
3 yağ asidi + gliserol
------
—Yapım ve onarım
(Hc memb. Yapısına
katılır)
—Depo maddesi
—Isı izolasyonu
—Enerji vermek
—Basınç ve
darbelerden koruma
Fosfolipidler,
Steroidler
1gr 9.3 Kcal
Görevleri
—Enerji vermek
(Yapım ve onarım)
—Hücre yapısına
katılmak (Hc.
Membranında)
—Depo maddesi
(Karaciğer)
—Yapım ve onarım
—Yapı ham maddesi
(Membranlar)
—Düzenleyici rol
(Hormonlar)
—Enerji kaynağı
(Açlık halinde)
Örnek
Nişasta, Glikojen
Albumin, Glikoprotein
Enerji
Miktarı
Bağlar
1gr 4.1 Kcal
1gr 4.3 Kcal
Glikozit
Peptid
Ester
Nükleik asit
C, H, O, N, P
Nükleotid
—Düzenleyici
Koenzimlerin
yapısına katılırlar.
—Kalıtımdan
sorumlu
—Yönetici
moleküller
Protein sentezi
A, D, E, K
vitaminleri
----
DNA, RNA
----
----Fosfodiester
Proteinler
Karbon (C), hidrojen (H), oksijen (O), azot (N) bilişimindedir. Ayrıca yapılarında
kükürt (S) ve fosfor (P)da bulunabilir. Proteinler amino asit adı verilen yapı taşlarından
meydana gelir. Amino asitler amfoter bileşikleridir. 20 çeşit amino asit bulunur, amino
asitlerin her birinin radikal grubu farklıdır. İnsan vücudunda sekiz çeşit amino asit
sentezlenemez(valin, lösin, isolösin, treonin, metionin, lisin, fenilalanin, triptofan).
Bunlara temel (esansiyel) amino asit denir, besinlerle dışarıda alınır.
Proteinler hücre kütlesinin %10-20’sini oluşturur. Hücre proteinleri yapısal proteinler ve
genellikle enzim olarak işlev gören globular proteinler olarak ikiye ayrılır. Hücredeki bu tip
yapısal proteinler, genellikle uzun, ince filamentler halinde bulunur, bunlar birçok protein
molekülünün polimeridir.
13
H A Y V A N
•
•
•
•
•
F İ Z Y O L O J İ S İ
Hücre zarı yapısında yer alır ve dokuların yapısal bileşenlerini
oluştururlar. Ör: keratin
Küçük moleküllerin taşınmasında ve depolanmasında görev alır.
Ör:hemoglobin tarafından O2 taşınması
Hücreler arası sinyal iletim işine katılırlar. Ör:hormonlar
Enfeksiyonlara karşı koruma görevi üstlenirler. Ör:antikorlar
Enzim yapısını oluştururlar. Ör: Renin
Bu tür intraselüler filamentlerin en bilinen kullanımı, tüm kasların kontraktil
mekanizmasıdır. Filamentler ayrıca mikrotübüller halinde silia, sinir aksonu, mitotik
iğcikler gibi “hücre iskeleti" organellerini de oluştururlar. Fibriler proteinler ekstrasellüler
olarak özellikle kollejen ve bağ dokusunun elastin liflerinde, kan damarları, tendon,
ligament vb. içinde bulunur. Globüler proteinler tamamen farklı tiptedir, genellikle tek
protein moleküllerinden oluşmuştur ya da daha büyük oranda, fibriler yapıdan çok
globüler yapıda bir araya gelmiş bir kaç protein molekülünden oluşurlar.
ŞEKİL 1.9 Polipeptid bağı ile meydana gelen di, poli ve peptid veprimer sekonder ve tersiyer yapı
Bu proteinler genellikle hücrede enzim işlevi görür ve fibriler proteinlerin tersine hücre içi
sıvıda erimiş durumdadır. Önemli bir bölümü de hücre içindeki membrana yapışık
durumdadır. Bu enzimler hücredeki diğer maddelerle doğrudan ilişki içindedir ve
kimyasal reaksiyonları katalizlerler.
14
H A Y V A N
F İ Z Y O L O J İ S İ
Proteinler farklı şekiller sınıflandırılır. Protein yapı ve fonksiyon olarak çok farklı
şekillerde olabilir.
1 - Katalizör Proteinler : Biyolojik sistemlerde hemen hemen tüm kimyasal reaksiyonlar enzim
denen spesifik makromoleküllerle katalizlenirler. Bu reaksiyonların bazıları CO2’in
hidrasyonundaki gibi oldukça basittir, diğer bazıları ise, kromozom replikasyonundaki gibi
oldukça karmaşıktır. Enzimler çok büyük bir katalitik güç oluştururlar ve reaksiyonların hızını en
az bir milyon kez arttırırlar. Yaklaşık 1000 kadar enzim karakterize edilmiş ve bunlardan
bazıları kristalize edilmiştir. Pepsin, tripsin, kimotripsin, lipaz, amilaz ve ribonükleaz midebağırsak kanalının sindirim enzimleri olarak sırasıyla proteinleri, yağları, şekerleri ve nükleik asitleri
parçalama yeteneğindedirler. Bilinen enzimlerin tümü proteindir. Böylece proteinler biyolojik
sistemlerde kimyasal dönüşümlerin gerçekleşmesinde yekpare rol oynarlar. Hücre proteinlerinin
en büyük kısmını enzimler oluşturur. Bunlar hücrede kısmen eriyebilir şekilde kısmen de
yapıya bağlı halde bulunurlar. Memeli hayvan karaciğerinde bilinen enzimlerin sayısı o
kadar fazladır ki hücre proteininin hemen hemen tümünü temsil ederler. Tek hücreli
E.coli’de 2500 kadar enzim bulunduğu sanılmaktadır.
2 - Taşıyıcı ve Depolayıcı Proteinler : Bazı küçük moleküller ve iyonlar spesifik proteinlerle
taşınırlar. Örneğin, hemoglobin eritrositlerde 02 i kaslara taşır. Demir kan
plazmasında transferrin ile taşınır ve karaciğerde farklı bir protein olan ferritin ile kompleks
oluşturarak depolanır. Yumurtada ovalbumin, sütte kazein, mısırda zein ve bağday
tohumunda gliadin amino asit deposu fonksiyonu gören besinsel proteinlerdir.
3 - Koordineli Hareketten Sorumlu Proteinler : Kasın en büyük kurucusu proteindir. Kas
kasılması aktin ve miyozin denen iki cins protein flamentinin birbiri üzerinde kaymasıyla
birliktedir. Mikroskopik bakıda, kromozomların mitoz safhasındaki hareketleri ve spermlerin
kamçıları ile hareketleri de proteinlerin kasılma hareketiyle meydana gelirler. Kirpiklerin ve
flagella’ların hareketi dyneinadlı protein ile mümkündür.
4 - Mekanik Destek Sağlayıcı Proteinler : Deri ve kemiğin yüksek taşıma gücü yapısında
bulunan fibröz bir protein olan kollagen ile ilgilidir. Deri bu sayede gergin durur ve kemikler bu
sayede uyumlu bir bağlantı sağlarlar. Fibronektin ve integrinler hücre dışı matriks proteinleri
olarak hücrelerin matrikse bağlanmalarına aracılık ederler. Kolajen birbiri üzerine sarılmış 3
zincirden meydana gelir. Her bir zincir 1400 amino asit uzunluğundadır . 3 amino asidin
tekrarlanması ile dengeli bir yapı oluşur. 3.amino asit gliserindir ve içerde kalır. Dışarıda ise
proline ve hidroksiproline bulunur.
15
H A Y V A N
F İ Z Y O L O J İ S İ
Vücudumuzdaki tüm proteinlerin ¼’ü kolajen’dir. Kolajen, moleküler telleri şekillendirerek,
tendonları ve boşlukları güçlendiren, cildin ve iç organların esnekliğini sağlayan ana yapısal
proteindir. Kemikler ve dişler de kolajen’e eklenen mineral kristalleri ile oluşmuştur.
5 - İmmun Koruma Sağlayıcı Proteinler : Antibadiler bakteri, virus veya diğer organizma
hücreleri
gibi
yabancı
maddelerle
birleşebilen
yüksek
derecede
spesifik
proteinlerdir. Fibrinojen ve thrombin de bu özelliklerde proteinlerdir. Organizmaya yabancı bir
protein veya makromolekül (antijen) girdiğinde antikorlar ortaya çıkar ve antijeni bağlayarak
antikor-antijen kompleksi oluştururlar. Bu reaksiyona “immun yanıt” denir. Bu durum sadece
omurgalılar için söz konusudur.
6 - Sinir İmpluslarının Oluşumundan ve İletiminden Sorumlu Proteinler : Spesifik bir
uyarıma sinir hücresinin cevabı reseptör proteinler ile sağlanır. Rodopsin, retinanın rod
hücrelerinde bir reseptör proteindir. Reseptör proteinler asetilkolin gibi küçük spesifik
moleküllerle tetik çekebilirler. Sinir impulslarının sinir hücreleriyle birleşme yerlerine
ulaştırılmasında bunlar gereklidir.
7 - Büyüme ve Farklılaşmanın Kontrolünden SoRumlu Proteinler (Regülatör Proteinler):
Genetik bilginin bir sıra dahilinde kontrol edilmesi hücrelerin düzenli büyümesi ve farklılaşması
için zorunludur. Yüksek organizmalarda büyüme ve farklılaşma büyüme faktörü proteinler
tarafından kontrol edilir. Örneğin sinir büyüme faktörü sinir ağının oluşumunu yönetir. Çok
hücreli organizmalarda değişik hücrelerin fonksiyonları hormonlarla düzenlenir. Bu
hormonlardan bazıları proteindirler (insulin, ACTH, GH, TSH vb). Gerçekten de proteinler
hücrelerde enerji ve madde akışını kontrol eden alıcılar olarak hizmet ederler. Bir çok hormonal
uyarıya hücrelerin cevabı G-proteinler olarak adlandırılan ve GTP bağlayan bir protein sınıfı
üzerinden gerçekleşir.
8 - Ekzotik Proteinler: Sınıflamaya girmeyen bazı proteinler de vardır ki bunlara ekzotik
proteinler denir. Örneğin Antarktika sularında yaşayan balıklarda antifriz proteinler soğuk
ortamda yaşamak durumundaki canlıyı donmaya karşı korur. Bir Afrika bitkisinin kuvvetli şeker
tadında bir proteini olan monellin insanların tüketimine sunulan, toksik olmayan ve yağlanmayı
önleyen bir gıda tadlandırıcısıdır. Bazı canlılarda mevcut yapışma özelliğine sahip tutkal
proteinler bu gruba örnek oluştururlar.
Protein tipi
Örnekler
Yapısal proteinler
Regülatör proteinler
Kontraktil proteinler
Taşıyıcı proteinler
Depo proteinleri
Omurgalı kanındaki koruyucu proteinler
Membran proteinleri
Toksinler
Enzimler
Kolajen ipek, virüs kılıfı, mikrotübüller
İnsülin, Adrenokortikotropin, büyüme hormonları
Aktin, miyozin, dyenin, knesin
Hemoglobin, miyoglobin, transferin
Yumurta akı, albümin
Antikorlar
Membran transport proteinleri, antijenler
Besin zehirleri, Difteri toksini
Sukraz, pepsin, tripsin
Proteinler sekonder ve tersiyer yapıları ile fonksiyonel hale gelir. Primer yapıdaki bazı
amino asitler sekonder yapının değişimine yol açan bağlar ve etkileşimler yapar.
Sekonder ve tersiyer yapıda en fazla rastlanan bağ ve etkileşimler iyonik etkileşimler,
hidrojen bağları disülfit kovalent bağları vander waals etkileşimleridir. Kovalent
bağlar iki atom arasında ortaklaşa kullanılan elektron çiftinden oluşan bağlardır.
16
H A Y V A N
F İ Z Y O L O J İ S İ
Negatif yüklü elektronun bağa katılan iki atom tarafından eşit kuvvette çekildiği
kovalent bağa nonpolar kovalent bağ denir. Negatif yüklü elektronun bağa katılan
iki atomdan birine daha yakın bulunduğu kovalent bağa polar kovalent bağ denir.
Proteinlerde Üç Boyutlu Yapısı
Proteinler; belirli bir kimyasal yapıya ve molekül ağırlığa, genlerle belirlenen bir tek amino asit
dizisine: iyi belirlenmiş üç boyutlu bir yapıya (konformasyon) sahiptir. Konformasyon,
basit bağlar etrafında mümkün olan dönmeler sonucunda bağlarda kopma olmaksızın çok
çeşitli pozisyonlarda bulunabilen grupların uzaysal düzenini ifade eder. Konformasyon;
proteinlerde daha çok ikincil, üçüncül ve dördüncül yapıların beraberliğini ve bütünlüğünü
izah eder. Proteinin görevi ile (taşıma, katalizleme vb.) sıkı ilişkilidir.
Proteinlerin yüksek yoğunluğundan (1,4 g/cm3) da anlaşılacağı gibi amino asitler molekülde
oldukça sık durumdadırlar. İç kısımda hidrofob, az hidratize olan bir bölge oluşur. Yüklü
gruplar hemen hemen yalnız yüzeyde bulunurlar ve sulu çözeltide bir hidrat zarfı ile
çevrildiğinden molekül olduğundan biraz daha büyük görünür. Bu durum ultrasantrifüjde,
sedimentasyonda ve jel kromatografisinde önemlidir. Bu tür proteinler su ve tuz çözeltilerinde
çözünerek alınabilirler. Ancak biyolojik membranların sentezine katılan proteinler dış
kısımlarında hidrofob gruplar taşırlar ve böylelikle membran lipidleriyle hidrofobik
etkileşmeye girerler ve membranda sabitleşirler. Membran içinde yer almış olmaları birçok
protein için (özellikle solunum zinciri enzimleri) fonksiyonel bakımdan önemlidir. Hidrofob
yüzey nedeniyle böyle proteinler suda veya tuz çözeltilerinde çözünmezler, ancak
deterjanlarla çözelti halinde alınabilirler.
Her protein biyolojik aktivitesiyle ilişkili olarak yüzeyinde bir veya birkaç spesifik bölge veya
alan ihtiva eder. Bu bölge toplam yüzeye oranla çok küçük bir bölümü oluşturur. Böylece her
enzim katalize ettiği reaksiyonunun substratıyla doğrudan ilişkiye girebilecek bir aktif bölgeye
sahiptir. Taşıyıcı proteinler ilgili oldukları molekülleri dönüşümlü olarak bağlayacak bir
bağlama bölgesi taşırlar. Örneğin, Hemoglobin 4 hem grubu taşır ve herbiri reverzibl
olarak O2 ile birleşebilir. Hücre reseptörleri olarak hizmet eden proteinler spesifik substratları
için bağlama bölgelerine sahiptirler. Bundan başka, protein hormonlar bir hücre yüzeyinde
hormon reseptörleriyle doğrudan ilişki kurabilecek spesifik yüzeysel yapılar içerirler.
Proteinler hidrojen bağlarından zengindir. Proteinlerin üç boyutlu yapısını belirleyen güçler,
protein omurgasındaki peptid atomlarının ve yan zincir (R) grupları arasında şekillenen
etkileşmeler sonucu meydana gelir. Proteinlerin aktif üç boyutlu yapılarını kazanmalarında çözücü
sistemin (su ve içinde çözünmüş bulunan bileşiklerin) de önemli bir rolü vardır.
Biyolojik sistemlerde tüm bu geri-dönüşümlü moleküler etkileşimler başlıca 3 güçle sağlanır:
1. Hidrojen bağları
2. Elektrostatik bağlar (tuz bağı yada iyonik bağ)
3. van der Waals çekmeleri
Hidrojen bağları ana zincirinin =NH ve –C=O grupları arasında alfa-sarmal ve beta yaprak
tabaka yapıları oluşturur. Ayrıca, 20 temel amino asitten 11’inin yan zinciri de hidrojen bağı
oluşumuna
katılabilir.
Hidrojen
bağı
oluşturma
yeteneği
olan
gruplar;
17
H A Y V A N
F İ Z Y O L O J İ S İ
1. Triptofan (indol) ve argininin (guanidin) yan zincirleri (sadece hidrojen bağı
vericisidirler).
Bu2.gruplar
değişimine
bağlı
olarak bazen
alıcı veserin
bazen
verici olarak
hizmet ederler.
Peptid pH
grubuna
ek olarak
glutamin,
asparajin,
ve de
threonin
yan zincirleri
(hidrojen
bağı vericisi ve alıcısı olarak hizmet edebilirler).
3. Lizin e-amino grubu, aspartik asit ve glutamik asit b- ve g-karboksil grubu, tirozin
fenol grubu ve histidin imidazol grubu.
Amfoterik, Amfiprotik, Amfipatik
Amfoterikterimi hem asit hem de baz olarak davranabilen
türler(atom, molekül veya iyon) için kullanılır. Amfiprotik
ise proton, H+alabilen veya verebilen tür anlamına gelir . Suyu
veya HCO3- gibi bir iyonu ele alırsak bunların hem amfoterik
hem de amfiprotik olduğunu görürüz. Ama öte yandan tek
başına metaller veya bazı metal/yarı metal oksitler (Al, Zn,
Al2O3,PbO,SnO gibi..) amfoter özellik gösterdiği halde
amfiprotik değillerdir. Amfipatik'e gelince hem hidrofobik
hem de hidrofilik bölgelere sahip moleküller için kullanılır.
Verilebilecek en basit örnek fosfolipidlerdir: fosfolipidlerde yağ
asitlerinin bulunduğu kısım hidrofobiktir ve hücre zarının içi
kısmında yer alırlar; fosfat grubunun bulunduğu kısım ise
hidrofiliktir ve zarın dış kısmına bakar.
Proteinlerin üç boyutlu yapılanmasına katılan
bu güçler kovalan olmayan zayıf
bağlardandır. Fakat hepsinin bir arada
çalışmasıyla kooperatif bağlanma adı verilen
ve birbirinin etkisini güçlendiren bir yapı
ortaya çıkar. Bu şekilde proteinler ortam
koşullarındaki aşırı değişmelerde bile
konformasyonlarını muhafaza edebilirler.
Hatta, birçok protein biyolojik aktivitesini kaybetmeden kristalleştirilebilir. Bir molekülün özel üç
boyutlu yapısı çeşitli fiziksel metotlarla (x ışını kristalografisi gibi) tayin edilebilir. Canlı
hücrelerdeki konformasyon (ya da buradan izole edilmiş en yüksek biyolojik aktivitedeki bir
proteinin konformasyonu) natif durum diye adlandırılır. Bir protein natif halde görevlerini en
üst derecede sergiler. Yapısal olanlara kollagen, katalitik olanlara enzimler ve taşıyıcı olanlara
ise hemoglobin örnek verilebilir. Protein moleküllerinin çoğu biyolojik aktivitelerini veya
fonksiyonel kapasitelerini çok sınırlı bir ısı ve pH’da muhafaza ederler. Yüksek ısı veya pH’da
protein molekülleri denatürasyon denen bir yapısal değişikliğe uğrarlar. Birincil yapı dışındaki
diğer yapılar bozulur, kovalan bağlar dışındaki bağ yada çekmeler kopar. Proteinlerin çoğu
50-60oC’nin üzerinde denatüre olur. Bazıları 10-15 C’nin altında da denatüre olurlar.
Denatürasyon proteinlerin biyolojik aktivitelerinde kayba neden olur (enzimlerin ısı ile
inaktivasyonu, proteinlerin ısı ile koagülasyonu). Denatürasyon çok sayıda etken tarafından
oluşturulabilir. Bunlar ısı ve ilaçlar (6 mol/L üre vb), deterjanlar (SDS vb) ve sülfidrilli
ayıraçlardır (merkaptoetanol vb). Denatürasyona uğramış protein bazan sebep olucu etkenin
ortadan kalkmasıyla yeniden natif hale dönebilir (renatürasyon). Denatüre edilen protein bir
enzim ise renatürasyon ile katalitik aktivitesini yeniden kazanabilir. Renatürasyon biyolojik bir
aktiviteyi restore edebilir, fakat asla natif proteinde mevcut olmayan bir aktiviteyi meydana
getirmez.
18
H A Y V A N
F İ Z Y O L O J İ S İ
Kovalent bağ, iki atom arasında, bir veya daha fazla
elektronun paylaşılmasıyla karakterize edilen kimyasal bağın
bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir
arada tutan ortak çekim gücü olarak tanımlanabilir.
Paylaşılan elektron ya da elektronlar, her iki çekirdek
etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha
uzun süre bulundukları için bu bölgede (-) yüklü bir alan
yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti
uygulayarak bir bağ yaratır. Kovalent bağ, söz konusu
atomların dış yörüngelerinin dolması ile meydana gelir. Bu
tür bağlar, moleküller arası hidrojen bağından daima daha
güçlü, iyonik bağ ile ise ya aynı güçte ya da daha güçlüdür.
Bazı inorganik maddelerin hidrojen(H), amonyak (NH3),
klor (Cl), su(H2O) ve azot(N) molekülleri ile tüm organik
maddelerin molekülleri kovalent bağ ile bir arada
tutulmaktadır.
ŞEKİL 1.10 Polar ve nonpolar kovalent bağlar.
İyonik (elektrovalent) bağlar ise atomlar, elektron kazanarak ya da kaybederek iyon adı
verilen yüklü parçacıkları oluştururlar. Zıt yüklü iyonlar arasındaki çekim kuvveti sonucu
olarak da iyonik bağlar oluşur Vander waals bağları elektriksel çekim kuvvetlerinin etkisi ile
birbirlerine yaklaşan iki atom arasında, atomlar birbirlerine göre en kararlı oldukları uzaklıkta
oluşur. Hidrojen bağları, aynı cins (hidrojen ile azot ve oksijen) arasında oluşur
moleküller arasında, farklı cins moleküller arasında, bir molekül içinde oluşabilir.
ŞEKİL 1.11 Hidrojen bağları.
Bir hidrojen (H) atomunun oksijen (O) ve azot (N) gibi bir elektronegatif atoma
kovalent bağlanması halinde, elektronların oksijen ve azot atomuna hidrojenden daha
yakın bulunmaları nedeniyle elektropozitif hale gelen hidrojenin başka bir elektronegatif
atom tarafından çekilmesi sonucu meydana gelir. Hidrojen bağlarında, hidrojen bağı
donörleri (vericileri) diye bilinen −OH, ⟩ NH, −SH gruplarının hidrojen atomları, O, N, S
gibi akseptör ( alıcı) atomların serbest elektronları ile etkileşirler.
19
H A Y V A N
F İ Z Y O L O J İ S İ
Proteinler her organizmada bulunan önemli
bir makromolekül sınıfıdır. Proteinler, 20 farklı
tip L-α-amino asitten meydana gelen
polimerlerdir. Biyolojik fonksiyonlarını yerine
getirebilmek için proteinler uzay içinde belli bir
biçim alacak şekilde katlanırlar. Bu katlanmayı
yönlendiren güçler, protein atomları arasındaki
hidrojen bağı, iyonik etkileşimler, Van Der
Waals güçleri ve hidrofobik istiflenme gibi,
kovalent olmayan etkleşimlerdir. Proteinlerin
işlevlerini moleküler düzeyde anlayabilmek için
genelde onları üç boyutlu yapısının çözülmesi
gerekir.
ŞEKİL 1.12 Sekonder ve tersiyer yapıdaki bağ ve etkileşimler.
Hücrede sentezlenen protein her canlıda kendine özgüdür. Proteini oluşturan amino
asitlerin çeşidi, sayısı ve dizilişleri hücre DNA’sı tarafından her canlıda farklı bir
şekilde belirlenir. Proteinlerde amino asitlerin dizilişi genlerle kontrol edilir. Proteinler,
yüksek sıcaklık, basınç veya kuvvetli asitlerle etkileştirilirse yapısı bozulur,
aktifliklerini kaybeder. Bu olaya denatürasyon denir.
ŞEKİL 1.13 Amino asi tipleri
20
H A Y V A N
F İ Z Y O L O J İ S İ
Proteinler başka birleiklerle oluşturdukları bileşiklere iki gruba ayrılır
1-Basit proteinler: Hidrolize uğradıklarında yapı taşları olan amino asitlere ayrılırlar. Basit
proteinlere örnek; albumin ve globulinler verilebilir.
2-Bileşik proteinler: Amino asitlere ek olarak protein özelliğinde olmayan başka grupları
da içerirler. Bileşik proteinlerin hidrolizleri sonunda amino asitlerin yanı sıra başka bir
organik bileşik de meydana gelir. Örneğin;
• Nukleoprotein = protein + nukleik asit (Histon + DNA)
• Glikoprotein = protein + polisakkarit
• Lipoprotein
protein
yağ asitleri birine uyar:
Canlı hücredeki reaksiyonların
çoğu,=beş
genel+kategoriden
• Kromoprotein = protein + boya maddeleri (hemoglobin)
•
Fonksiyonel grup transferi
•
Oksidasyon-redüksiyon
•
Bir veya daha fazla karbon atomu çevresindeki bağ yapısının yeniden
düzenlenmesi
•
C
C bağlarını oluşturan veya yıkan reaksiyonlar
•
Bir molekül su çıkışıyla iki molekülün kondensasyonu reaksiyonları
21
H A Y V A N
F İ Z Y O L O J İ S İ
Karbohidratlar
Karbohidrat terimi, orjinal olarak karbon, oksijen ve hidrojenden oluşmuş bir
grup bileşiği belirtmektedir. Karbohidratlar, kimyasal yapı bakımından, polihidroksi
aldehit, polihidroksi keton ya da hidrolizi sonucu bu tip bileşiklere ayrılan bileşiklerdir.
Karbohidratlar yapısal olarak başlıca dört gruba ayrılabilirler. Bunlar sırasıyla,
monosakkaritler, disakkaritler, polisakkaritler ve karbohidrat türevleridir.
Karbonhidratlar glikoprotein moleküllerinin bir parçası olmak dışında yapısal
açıdan fazla işlevsel önem taşımazlar ama hücre beslenmesinde büyük rol oynarlar. İnsan
hücrelerinin çoğunda karbonhidrat depoları fazla büyük değildir, genellikle toplam
hücre kitlesinin %1’ini oluşturur, bu oran kas hücrelerinde %3, karaciğer
hücrelerinde %6’dır. Çözünmüş glikoz şeklinde karbonhidrat ekstrasellüler sıvıda her
zaman kullanılabilir durumdadır. Az miktarda karbon hidrat, hücrede, suda
çözünmeyen glikoz polimeri olan glikojen halinde depolanmıştır, glikojen, gerekli
olduğu durumlarda hızla hücrenin enerji gereksinimini karşılar.
ŞEKİL 1.14 Sükroz molekülü meydana getiren fruktoz ve glikoz
Aldozlar ve Ketozlar: Karbonil bileşikleri ve önemi Karbonil grubu (C=O), sp2
melezleşmesi yapmış ve oksijenle çift bağ oluşturmuş bir karbon atomu taşır. Bu grubun
geometrisini sp2 melezleşmesi yapmış olan karbon atomu belirler. Karbonil grubu sp2
karbonu dolayında düzlemseldir. Karbonla oksijen arasında bir sigma bağı, bir pi bağı vardır.
Ayrıca oksijende iki ortaklanmamış elektron çifti bulunur. Karbonil grubu alkol ve eterdeki CO bağından daha polardır. Bu durum, pi elektronlarının elektronegatif oksijen atomu
tarafından, C-O bağındaki sigma elektronlarına göre daha kolay çekilmesine yorulabilir.
Fonksiyonel grup olarak bir aldehid içeren monosakkaridlere aldozlar, keton grubu içerenlere de
ketozlar denir. ör: gliseraldehid ve glukoz bir aldoz, dihidroksiaseton ve fruktoz ise
ketozdur.
D-Glikoz bir aldohekzozdur. Dekstrorotatör olduğundan dekstroz adını da alır. Birçok önemli
disakkarit ve polisakkaridin yapısına katılır. Üzümde bol miktada bulunduğundan üzüm şekeri de
denir. Tatlı ve lezzetlidir.
22
H A Y V A N
F İ Z Y O L O J İ S İ
D-Galaktoz doğada nadiren serbest halde bulunur. Laktozun yapı taşıdır. Ayrıca
serebrositlerin, gangliositlerin ve glikoproteinlerin yapısında yer alır. L-Galaktoz
yosunlardan elde edilen bir polisakkarit olan agar içerisinde bulunur. Tadı glikozdan daha
azdır. Fermentasyon yönünden de glikoza kıyasla mayalar tarafından daha yavaş fermente edilir.
D-Fruktoz bir ketoheksoz olup levorotatör özelliğinden dolayı levuloz adını alır. Sakkarazun
ve inulinin yapı taşıdır. Bitkilerde yaygındır. Balda da bulunur. Fötüs kanında, plasentada ve
sperma sıvısında serbest halde fruktoz vardır. Bir trisakkarid olan rafinozun yapısına katılır.
D-Mannoz kısmen serbest ve kısmen de bağlı şekilde bitkilerde bulunur. Hayvansal
organizmada gilkopepditlerin, kan grubu maddelerinin yapı taşı olarak sıkça rastlanır.
Tabiatta bulunan pentozlardan L-arabinoz, D-riboz ve D-ksiloz gibi aldozlar ve ketopentoz
olan L-ksiluloz mevcuttur. Alfa-D-ksiluloz pyranoz halkası teşkil eder ve bu halka şekli glikozun
5 numaralı karbonuna bağlı hidroksimetil grubu hariç diğer bakımdan glikoza çok benzer.
D-Riboz ribonükleik asitlerin ve koenzim görevi yapan nükleotidlerin yapısında bulunur.
D-Ksiloz Ağaç zamklarında, proteoglikanlarda bulunur. Bu şekerin keto şeker karşıtı Dksilüloz’dur. D-ksilüloz üronik asit yolunda önemli bir ara maddedir.
Nöyraminik asitler D-şekerlerdir. Piruvik asitle mannozaminin birleşmesi sonucu oluşur.
Hayvansal hücre çeperlerinin önemli yapı taşıdır. Lipidlerin polisakkaridlerin,
glikoproteinlerin ve mukoproteinlerin yapısında olarak bakterilerde ve hayvan dokularında
yaygın bir şekilde bulunur.
Nöyraminik asitin N-açil türevleri sialik asitler olarak bilinir. Sialik asitler tükrük bezi salgısı
ve diğer mukoza salgılarındaki glikoprotein yapısında bulunurlar. Ayrıca kan grubu
maddelerin yapı taşıdır. Mümarik asit bakteri hücre duvarlarının önemli yapı taşıdır. Burada da
amino grupları asetillenerek N-asitil mümarik asit oluştururlar.
Glikozidler: Monosakkaridler, glikozid bağlarıyla bağlanarak daha büyük yapılar
oluştururlar. İki monosakkarid içeren yapıya disakkarid denir. ör: laktoz (galaktoz +
glukoz), maltoz ( glukoz + glukoz), sukroz (glukoz + fruktoz). 3-12 monosakkarid ünitesi
içerenlere oligosakkarid, ör: glikoproteinlerde bulunur, 12'den fazla monosakkarid içerenlere de
polisakkarid denir, ör:glikojen (homopolisakkarid) ve glikozaminoglikanlar
(heteropolisakkarid).
Monosakkaritteki aldehit grubu veya keton grubu ile molekül içerisindeki bir alkolik hidroksil
grubu arasında oluşan hemiasetal ve hemiketal bağ aynı zamanda gilkozidik bağdır. Eğer
glikozidik bağ monosakkaritlerin D-glikoz ve D-fruktoz içinde meydana gelecek olursa her iki
şekerin a-D ve b-D şekilleri meydana gelmektedir. Bu glikozidik bağ monosakkaridin kendi
içerisinde meydana gelebildiği gibi iki monosakkarit arasında da meydana gelebilir. Bu
takdirde disakkaritler oluşmaktadır. Eğer glikozidik bağ pek çok monosakkarit arasında
oluşuyorsa bu durumda da polisakkaritler meydana gelmektedir. Metil alkol ile glikoz
reaksiyona girerse bu iki yapı arasında glikozidik bir bağ oluşur ve metil glikozid meydana gelir.
Bu şekilde oluşan esterlere de glikozidler denir. Bunların da a- ve b- şekilleri vardır. Tabiatta,
hidrolize olduğunda şeker ve alkol veren, karbonhidrat olmayan artıklar ihtiva eden bir çok
glikozid vardır. Bu glikozidlerin karbonhidrat olan bölümüne glycone, karbonhidrat olmayan
23
H A Y V A N
F İ Z Y O L O J İ S İ
bölümüne de aglycone denir. Glycone’un hidrofilik karakterinden dolayı glikozid, suda
aglycone’dan daha fazla erir. Aglycone’lar, çiçek renkli maddelerindeki çeşitli flavonlar ve
anthocyanin’ler dahil, ekseriye bitkilerde bulunan fenolik bileşiklerdir. Bir çok meyve ağaçlarının
köklerindeki zehirli bir glikozid olan phlorizin’deki polyphenol ve kendisinden indigo
boyasının elde edildiği glikozidde bulunan indoxyl aglycone’dırlar. Tıpta kullanılan
glikozidlerden en önemlisi kalp glikozidi olarak bilinen dijitaldir.
Glikojen Hayvanlarda glikozun depo şeklidir. Dallıdır ve alfa glikozit bağı ile bağlanmıştır. Suda
çözünür. İyot ile kahverengiye boyanır. En fazla karaciğer ve kaslarda bulunur, depo edilir.
Hidroliz olunca glikoz ünitelerini verir. Amiloz’dan çok amilopektin’e benzer. Hem a-1,4 hem
de a-1,6 glikozidik bağ taşır. Glikojende her bir indirgeyici olmayan son gruba karşılık 8-12 glikoz
artığı bulunur. Molekül ağırlığı 270.000 ile 100 milyon arasında değişir.
Glikojen hayvan hücresinde nişasta granüllerinden çok daha küçük parçacıklar halinde
bulunur. Glikojen su ile kolay karışır ve opalescent eriyikler meydana getirir.
Dekstrinler nişastanın enzim veya asitle hidrolizi sonucu oluşur. Glikoz ünitelerinden kuruludur.
Suda erir. Çocukların beslenmesinde kullanılır.
• Karbohidratlar C, H, O den oluşmuş organik moleküllerdir.
• Monosakkarit ve disakkarit yıkımı ile hücresel enerji sağlanır ve bunlar
diğer hücresel bileşenlerin sentezi için başlangıç materyali sağlar.
Ör:Asetil ko enzim A
• Polisakkaritler hücrenin depo formunu (nişasta glikojen) ve hücrelerin
yapısal bileşenini (selüloz, kitin) oluştururlar.
• Polisakkaritlerin daha kısa polimerleri hücrelerin komşularına adezyonu
ve proteinlerin uygun intraselüler hedeflere taşınmaları görevini
üstlenirler.
Karbonhidratlar, yağ asitlerine dönüşebilir ve asetil CoA ara metabolizmasının kavşak
noktasındadır. Karbonhidratlar, bazı aminoasitlere çevrilebilirler. Karbonhidratların α
keto aside dönüşmesinin ardından aminlenmesi gelir.
Piruvat
→ alanin
Bazı aminoasitler
glukozun
karbon atomlarından köken alabilirler. Aminoasitleirn
asit → aspartik
asit
metabolizmasınınOkzaloasetik
krebs siklusunun
bir ara yapısına
dönüştüğü durumlarda, bu özellik söz
α
ketoglutarik
asit
→
glutamik
asit
konusudur. Çünkü oksaloasetat, fosfoenol piruvatı
verebilir. Bazı aminoasitler, lipidlere
3-fosfogliserik
asitasetil
→ serin
ve diğerleri
çevrilebilir. Lipidlere
çevrilmeler
CoA
nın ve gliseraldehit 3-fosfattan itibaren
gerçekleşir. Şöyleki aminoasitlerin karbon iskeletinin daha ileri yıkılımında son ürün olarak
sitrik asit siklusu ara maddeleri olan piruvat ve asetil CoA meydana gelmektedir. Oluşan
asetil CoA, sitrik asit siklusuna katılmakta veya asetoasetat üzerinden yağlara dönüşmektedir.
Krebs siklusu aracılığıyla yağ sentezlerinden itibaren, karbonhidratların net bir sentez
olasılığı yoktur. Çünkü iki karbon atomu bir molekül asetil CoA tarafından taşınıyorsa,
iki karbon atomu da CO2 biçiminde elimine edilir. Yağ asitleri yine bazı aminoasitlerin,
aynı proseslerle prekürsörleri olabilmektedirler. 1- Gerek krebs siklusunun prosesi ki, bu
proses α ketoglutarik asitten türeyen aminoasitler için çok daha geçerlidir. 224
H A Y V A N
F İ Z Y O L O J İ S İ
Gerekse glioksilik asit siklusunun prosesi 3- Nükleotidlerin biyosentezi: Glukozdan
riboz 5-fosfat, çeşitli aminoasitler (aspartik asit, glisin, glutamin) yine bazı aminoasitlerin
metabolizmasından kaynaklanan tek karbonlu üniteler burada yer alırlar. Karbon
iskeletlerinin metabolizması sırasında aminoasitlerden ortak son ürünler elde edilmektedir.
Lipidler
glisin,
serin,
treonin,
hidroksiprolin
ve triptofan
→ piruvat
SudaAlanin,
erimezler
ancak
yağ sistein,
çözücülerde
(alkol,
eter, kloroform
gibi organik
eriticiler)
Aspartik
asit
ve
asparajin
→
okzalaoasetat
erirler. Hücrelerin çoğundaki en önemli lipidler fosfolipidler ve kolesteroldür. Bu tip yağ
Tirozin,
ve aspartat
→ fumarik
asit
toplam
hücre fenilalanin
kitlesinin %2’sini
oluşturur.
Fosfolipid
ve kolesterolün suda erimemesi,
ve metiyonin
→ süksinil
CoA birbirinden ayıran membran bariyerlerin
hücreİzolösin
membranının
ve hücre
içi bölümleri
Glutamat,
glutamin, histidin, prolin ve arjinin → α ketoglutarat
oluşumunu
sağlar.
İzolosin, losin ve triptofan → asetil CoA oluşturmaktadır.
ŞEKİL 1.14 Amphipatik molekülün su içinde konumlanması.
Fosfosfingolipidlerde gliserol yerine sfingosin ve sfingosine bağlı bir yağ asidi yine fosforik
asit ve X değişkeni bulunur. Sfingosin bir amino alkoldür. Sadece hayvansal hücrelerde
bulunur.
Fosfosfingolipidlere
örnek
olarak
sfingomiyelin
verilebilir.
Fosfosfingolipidlerde bir yağ asidi bulunur.
Glikolipidler gliserol ve sfingosin içermesine göre sınıflandırılırlar. Gliserol içerenlerde iki
yağ asidi ve bir gliserol ile glukoz bulunur. Sfingosin içerenlerde ise bir yağ asidi ve
sfingosin ile glukoz bulunur. Gliserol içeren glikolipidler bitkisel hücrelerde bulunduğu
halde sfingosin içeren glikolipidler hayvansal hücrelerde bulunurlar. Sfingosin içeren
glikolipidlere örnek olarak serebrosid ve gangliosid verilebilir. Serebrosidde tek glukoz
molekülü bulunduğu halde gangliosidde çok sayıda glukoz molekülü bulunur. Zar yapısına
giren bütün lipidler amfipatik moleküllerdir. Sulu bir ortama bırakıldıkları zaman hidrofilik
kısımlar suya yönelirken hidrofobik kısımları birbirine bakar. Tek tabakalı, çift tabakalı
sıralar halinde dizildikleri gibi dairesel şekilde de dizilebilirler. Bu özellikleri dolayısıyla
hücre organellerinin zarlarını ve hücre zarını oluşturabilirler.
25
H A Y V A N
F İ Z Y O L O J İ S İ
Fosfolipidlerde yağ asitlerinin bulunduğu kısım hidrofobiktir ve hücre zarının içi
kısmında yer alırlar; fosfat grubunun bulunduğu kısım ise hidrofiliktir ve zarın dış kısmına
bakar.
ŞEKİL 1.15 Lipit yapısı doymuş ve doymamış trigiliserol.
Fosfolipidler ve kolestrol dışında hücrelerde çok miktarda nötral yağlar da denen
trigliseritler de bulunur. Yağ hücrelerinde hücre kitlesinin %95’i trigliseritlerden oluşmuştur.
Bu hücrelerdeki yağ, vücudun gereksinim duyduğu her durumda çözünerek enerji sağlayan
besinlere dönüşen ana depolardır. Yağ moleküllerindeki karbon atomları arasında bulunan
bağlara göre yağ asitleri iki gruba ayrılır.
1. Doymuş yağ asitleri: Karbon atomları arasında tek bulunduğu için bunlar H’e tamamen
doymuşlardır. Örneğin, bütirik asit ve palmitik asit. Bu yağ asitlerini bulunduran yağlar
genellikle oda sıcaklığında katıdır. Örneğin tereyağı doymamış yağ asidi taşır.
Doymamış Yağ Asitleri
Çift bağlı karbon atomları içerirler. Neredeyse
tamamı sıvı haldedir. Sık karşılaşılan örnekleri
linoleik asit, linolenik asit ve oleik asittir. Çift
bağlarının konumuna göre cis veya trans
şeklinde bulunabilirler. Böyle yağ asitlerine
doymamış yağ asitleri denir.
Doymuş Yağ Asitleri
Yağ asitlerinin yapısında bulunan karbon atomları
mümkün olan en fazla hidrojen ile bağ
yapmışlarsa doymuş yağ asidi olarak adlandırılır.
Doymuş yağ asitleri oda sıcaklığında katı halde
bulunurlar ve hayvansal kaynaklıdırlar.
ŞEKİL 1.16 Doymuş ve doymamış yağ asitleri .
2. Doymamış yağ asitleri: Karbon atomları arasında, bazılarında çift bağ bulunabilir. Böyle
durumlarda karbon atomları hidrojen ile tam doymamıştır. Örneğin, oleik asit ve linoleik
26
H A Y V A N
F İ Z Y O L O J İ S İ
asit doymamış yağ asitleridir. Bunları içeren yağlar da genellikle oda sıcaklığında sıvıdır.
Örneğin, ayçiçeği, mısırözü ve zeytin yağ gibi.
•
•
•
•
Yağlar(lipidler) alkol ve yağ asitlerinden oluşan esterlerdir.
Enerji depo formudur. Lipidler gliserol ve yağ asitlerine ayrıldıktan
sonra yağ asitleri oksitlenerek sitrik asit döngüsünde (6C) parçalanır ve
yağ asitlerinin R yan zincirindeki karbon sayısına bağlı olarak glikozdan
çok daha fazla ATP üretimine neden olur.
Hücresel zarların temel yapısını oluştururlar.
Lipidler hem steroid hormonlar (östrojen, testesteron) hem de haberci
moleküller olarak hücre içi sinyal iletimini sağlar.
Hormonlar
Hormonlar, amin, peptid, steroid, lipid yapısında olabilir. Amin yapısındaki hormonlar:
adrenalin, dopamin Peptid yapısındaki hormonlar: Sinyal iletim molekülleridir. Ör:
insulin, prolaktin, endorfin steroid yapısındaki hormonlar: küçük molekül ağırlıklıdır. Ör:
Testesteron, östrojen, progesteron. Lipid yapısındaki hormonlar: Kısa süreli lokal
etkiye sahip lipid türevi biyomoleküllerdir. Ör:Prostoglandin
Enzimler
Enzimler biyolojik katalizörlerdir, yani biyokimyasal reaksiyonları hızlandıran biyolojik
kökenli maddelerdir. Enzimlerin en önemli özellikleri: katalitik etkinlik, spesifiklik ve
regülasyondur. Enzimler reaksiyonları yaklaşık 1 milyon kat hızlandırırlar. Bilinen en hızlı
enzim karbonik anhidraz saniyede 105 CO2 molekülü bağlayabilir (dokulardan kana CO2
taşır). Reaksiyonu 107 kat hızlandırır.
Enzimler biyolojik yapıdaki çoğunlukla protein
yapısında (RNA hariç) katalizör görevi yapan
kimyasallardır. Enzimler reaksiyonu binlercemilyonlarca kez hızlı olmasını sağlar. Tepkimeye
giren maddelerin aktivasyonu düşürür.
Enzimler, proteinlerden yapılmışlardır ve doğal
olarak yalnız canlılar tarafından sentezlenirler.
*Enzimler; etki ettiği maddeye SUBSTRAT ve
bu maddeni sonuna "ase=az" eki getirilerek ya da
katalizlediği tepkimenin çeşidine göre
adlandırılırlar.
ŞEKİL 1.17 Emzim etkisi
Enzimler, spesifik kimyasal reaksiyonları hızlandırırlar; substratları için yüksek
derecede spesifiteye sahiptirler; sulu çözeltilerde çok ılımlı sıcaklık ve pH durumları
altında fonksiyon gösterirler. Enzimlerle katalize edilen tepkimeye katılan kimyasal
moleküllere substrat adı verilir. Aktif merkez için, enzim-substrat bağlanmasını açıklayan iki
model ileri sürülmüştür. Fisher’in anahtar-kilit modelinde, substrat ve enzimin aktif
yerinin birbirine uyacak şekilde önceden belirlenmiş olduğu varsayılır. Koshland’ın uyum
27
H A Y V A N
F İ Z Y O L O J İ S İ
oluşturma modeline göre aktif merkez esnek yapıdadır; substrat varlığında, proteinin
tersiyer yapısında oluşan bir değişiklikle, enzim substratını katalize uygun en doğru biçimde
bağlayacak biçimsel bir değişikliğe uğrar.
ŞEKİL 1.18 ATP bağlı olarak konformasyon değiştiren hücre membran pompa proteinleri(Enzim).
Biyolojik reaksiyonlar besinlerin parçalanması, sinir uyarılarının gönderilmesi, kas kasılması
gibi olaylarda gereklidir. Aksi durumda bu reaksiyonlar çok yavaş ilerler. Biyolojik
ortamlarda reaksiyonlar çok hızlıdır ve enzim, substrat ve ürün için uygun koşulları sağlar.
Enzimin substratı ile reaksiyon verdiği bölge aktif bölge (aktif merkez) ve aktif
bölgeye bağlanan molekül de substrat olarak adlandırılır. Aktif merkezdeki amino asitler
ve bunların grupları substrat ile bağlanır ve kimyasal dönüşümü gerçekleştirir.
ŞEKİL 1.19 Enzim aktif merkezi
Bazı enzimler aktivite için, protein yapıyı oluşturan amino asit kalıntılarından başka
kimyasal bileşen gerektirmezler. Bazı enzimler ise kofaktör diye adlandırılan bir ek
kimyasal bileşen gerektirirler. Kofaktörü ile birlikte tam, katalitik olarak aktif bir enzim,
holoenzim olarak adlandırılır. Holoenzimin bir protein kısmı bir de kofaktör kısmı
vardır. Holoenzimin protein kısmı apoenzim veya apoprotein olarak adlandırılır.
Holoenzimin kofaktör kısmı, bazı enzimler için Fe2+, Mg2+, Mn2+, Zn2+ gibi bir veya daha
fazla inorganik iyon; bazı enzimler için ise koenzim denen bir organik veya metalloorganik
28
H A Y V A N
F İ Z Y O L O J İ S İ
kompleks bir moleküldür. Koenzimler, bazı enzimlerin aktiviteleri için gerekli olan ve
kofaktör diye adlandırılan ek kimyasal bileşenlerin organik veya metalloorganik
molekül yapısında olanlarıdır. Koenzim enzime çok sıkı bağlanmış olabildiği gibi, koenzim
enzime çok gevşek olarak bağlanmış olabilir. Koenzimlerin enzim proteinine çok sıkı bir
şekilde kovalent olarak bağlı olup enzim proteininden ayrılmayanları prostetik grup
olarak adlandırılırlar
ŞEKİL 1.20 Enzim çalışması
Koenzimlerin enzim proteinine çok gevşek bir şekilde nonkovalent olarak bağlı olup
enzim proteininden ayrılabilenleri kosubstrat olarak adlandırılırlar. Uluslararası Biyokimya
ve Moleküler Biyoloji Birliği (IUBMB) tarafından önerilen ve benimsenen sistematik
adlandırmada enzimler, altı sınıfa ayrılırlar, her sınıfın da katalizlenen reaksiyon tipine
dayanan alt sınıfları vardır:
Enzim sınıfları
Enzimler
kimyasal reaksiyonları
bazıveya
faktörlerin
etkisi altında kalırlar.
1- Oksidoredüktazlar:
elektrongerçekleştirdiklerinde
transferi (hidrid iyonları
H atomları)
Bunlar;
2- Transferazlar: Grup transfer reaksiyonları
Isı: Her enzim reaksyonunun optimal bir ısı seviyesi vardır. İnsanda bu ısı 36,5 derecedir. Sıfır
derecede
enzimler Hidroliz
canlılıktareaksiyonları
kaybedilmeyebilir.
Genel olarak
enzimler
60 C derece de
3- Hidrolazlar:
(suya fonsiyonel
grupların
suya transferi)
bozulurlar.
4- Liyazlar: Çift bağlara grupların ilavesi veya grupların uzaklaştırılmasıyla çift bağların
pH: (asitlik-bazlık
oranı): Her reaksiyonun gerçekleşebilmesi ortamın pH'ını belirleyen belli
oluşturulması.
+
oranda [H ] ve [OH-] iyonları konsantrasyonu olmasına bağlıdır.
5- İzomerazlar: Molekül içine grupların transferi ile izomerik formların oluşturulması.
Substrat konsantrasyonu: Ortamda reaksiyon hızını artırıcı yapılardan biride enzim ve substrat
miktarıdır.
Her ikisinin
miktarı belirli
oranlarda
artırılırsa
reaksiyon
hızı sürekli
artar.
6- Ligazlar
: ATP hidrolizi
ile C-C,
C-S, C-O,
ve C-N
bağlarının
oluşumu
.
Su: Enzim reaksiyonunun gerçekleşebilmesi için ortamda belirli oranda su olması gerekir.
Çünkü moleküllerin birbirine çarparak reaksiyonu gerçekleştirebilmesi için hareketi sağlayacak sıvı
bir ortamın olması gerekir. Tohumlarda su miktarı az olduğundan reaksiyonlarda minimal
seviyede gerçekleşmektedir
29
H A Y V A N
F İ Z Y O L O J İ S İ
Vitaminler
Canlı yaşamın sürdürülmesi için gerekli olan ve besin içerisinde doğal olarak bulunan basit
yapılı bileşiklerdir. Vücut fonksiyonlarının düzenlenmesinde önemlidir. Vitaminler vücutta
parçalanmazlar, yani vitaminler doğrudan enerji elde etmek için kullanılmazlar. Vücut, her
vitaminden gerekli olan miktarın kan dolaşımında sürekli mevcut olmasını sağlar. Yağda
eriyenler (A, D, E, K) yağ dokuda depolanır, suda eriyenler (B1, B2, B3, B5, B6, B12, C)
fazlası vücuttan atılır her gün alınmalıdır.
Suda Çözünür Vitaminler
Yağda Çözünür Vitaminler
Thiamin (B1), Riboflavin (B2), Niacin (B3), Vitamin A, Vitamin D ,Vitamin E ,Vitamin K
Pantothenic
Acid
(B5),
Pyridoxal,
Pyridoxamine, Pyridoxine (B6), Biotin,
Cobalamin (B12), Folic Acid, Ascorbic Acid
Gözdeki pigment tabakası büyük miktarlarda A vitamini bulundurur. A vitamininin ışığa duyarlı
pigmentlerin önemli bir ön maddesidir. Gece körlüğü, ciddi A vitamini eksikliğinde meydana
gelir. Bunun basit nedeni uygun miktarda retinale dönüşecek yeterli A vitamini olmamasıdır. Bu
yüzden, yapılabilecek rodopsin miktarı ciddi şekilde azalır.
ŞEKİL 1.21 Vitaminlerin yapısı
Trioyit bezi üzerinde bulunun paratriot bezlerinden salgılanan paratiroid hormonu böbreklerde D
vitaminini aktive eder, aktive olmuş D vitamini de kalsiyum absorpsiyonunu artırır. C
vitamini Askorbik asit, kollajenin yapısal bir bileşiği olan hidroksipirolinin oluşumundaki
hidroksilasyon aşamasını hızlandıran prolil hidroksilazın aktivasyonu için gereklidir.
Askorbik asit olmadan vücudun hemen hemen bütün dokularında yapılan kollajen lifleri
kusurlu ve zayıftır. Bu nedenle, C vitamini, derialtı dokusu, kıkırdak, kemik ve
dişlerde liflerin büyümesi ve dayanıklılığı için gereklidir. E vitaminin doymamış yağların
oksidasyonunu engeller. B1 Tiyamin karbonhidratların ve birçok amino asit
metabolizmaları için gereklidir. Riboflavin (B2 Vitamini), dokularda normal olarak
fosforik asitle birleşerek iki koenzim olan, flavin mononükleotid (FMN) ve flavin adenin
dinükleoid (FAD)’i oluşturur. Bunlar da mitokondrilerdeki önemli oksidatif sistemlerde
hidrojen taşıyıcısı olarak görev yaparlar. Folik asit en önemli görevi, DNA sentezinde
30
H A Y V A N
F İ Z Y O L O J İ S İ
gerekli olan pürinlerin ve timinin sentezidir. Bu nedenle folik asit, B12 vitamini gibi
hücresel genlerin replikasyonu için gereklidir. İnce barsağın ileum kısmında B12
vitaminin emilimi icin gerekli olan intrensek faktör, hidroklorik asit ile birlikle paryetal
hücrelerden salgılanır. B12 vitaminin alınması için intrensek faktör ile bağlanması şartır.
İntersek faktör B12 vitaminin düşük pH değerlerinde bozulmadan kalmasını sağlar barsağın
ileum kısımda reseptöre bağlı pinositoz ile alınmasını gereklidir. İntersek faktör olmadan
B12 alınması 1/50 oranında azalır ve kemik iliğinde eritrositler yeterince olgunlaşamaz ve
pernisiyoz anemiye oluşur. B6 vitamini protein sentezi için gereklidir. B6 vitaminin en
önemli rolü, amino asitlerin sentezindeki transaminasyon olayındaki koenzim
görevidir. B6 vitamini Transminasyon amino transferazlar adı verilen enzimlerle çalışır.
Bu vitaminin yokluğunda amino asitlerin sentezi çok azalır ve bu nedenle protein yapımı da
normal devam edemez. K vitamini intestinal kanalda bakteriler tarafından surekli olarak
sentezlenir. K vitamini protrombin, faktör VII, faktör IX, faktör X ve protein C gibi
beş önemli pıhtılaşma faktörünün yapımı için gereklidir. Eksikliğinde pıhtılaşma süresi
artar. Kumarin olan walfarin K vitamini ile yarışarak ve böylece K vitamininin
etkinliğini önleyerek gösterir. Karaciğerde büyük miktarlarda D vitamini ve B12 vitamini
de depo edilir. Ayrıca A vitamini eksikliğini on ay gibi uzun bir süre önlemeye yetecek
kadar A vitamini karaciğerde depo edilebilir. D vitamini eksikliğini üç-dört ay önleyecek
kadar, B1 2 vitamini ise en az bir yıl ya da daha uzun süre eksikliği onleyecek kadar
depo edilebilir.
Hücre Zarı
Hücre zarının bileşimi, yaklaşık olarak %55 protein, %25 fosfolipid, %13 kolesterol, %4 diğer
lipidler ve %3 karbonhidratlardan oluşur. Bu maddeler birbirleriyle bağlı ya da bağımsız halde
zarın yapısında bulunur. Zarın yapısı fonksiyonuna göre farklılık gösterebilir.
•
•
•
•
•
Hücre zarı, sitoplazmayı çevreleyerek hücreye şekil verir ve
dağılmasını engeller.
Madde alış verişini düzenler.
Ozmatik dengenin düzenlenmesinde görev alır.
Salgı görevi vardır.
Enzimleri taşıyıcı görevi vardır.
Hücre zarına “plazma zarı" da denir. Hücreyi dış ortamdan ayıran, seçici geçirgen canlı
yapıdır. Hücreyi çevreleyen birim zar ortalama olarak 75 Angström (75x10-7 mm)
kalınlığındadır. Elektron mikroskobu çalışmaları, zarların lipoproteinlerden yapılmış
mozaik şeklindeki fonksiyonel birimler olarak incelenmesinin daha uygun olacağını
göstermektedir. Hücre zarı hücreye şekil vermekle kalmaz, besin maddelerinin ve artık
maddelerin hücreye giriş çıkışını da ayarlar. Zar aynı zamanda hücrenin
koruyucusudur.
İlk bilimsel model 1935 yılında Danielli ve Dawson tarafından ortaya atılmıştır. Bu model
uzunca bir süre benimsendi ancak bu model hücre zarının işleyişini açıklayamadı. 1972
yılında Singer ve Nicolson'ın akıcı-mozaik zar modeli önermiştir. Bu modele göre zarın
yapısında %65 protein, %33 lipit, %2 karbonhidrat bulunmaktaydı. Hücre zarı,
gözenekli ve yarı geçirgen yapıya sahiptir. Esas yapı taşları lipid ve proteinlerdir. Her
31
H A Y V A N
F İ Z Y O L O J İ S İ
hücrenin protein, yağ ve karbonhidrat oranları birbirlerinden farklı olduğu için her hücre
zarı, o hücreye özgüdür. Hücreye gelen bütün kimyasal maddeler ve elektriksel iletiler
hücre zarı ile alınır. Hücre zarının yapısında protein, yağ ve karbonhidrat bulunur.
Hücre zarının görevleri;
Yapı
Lipidler
Proteinler
Karbon
hidrat
Sınıf
Fosfolipid
Alsınıf
GliserolFosfolipitler
Fonkisyonu
İki yağ a. oluşan kuyruk ve gliserolü
baş
Kolesterol
Zarın sertliğine katkı sağlar
Periferal proteinler
Enzim ve sinyal algılama
İntegral
Kanal proteini Selektif iyon taşıma
protein
Taşyıcı protein Selektif madde taşıyıcısı
Hücre dışı glikokaliks
Hücre zarının temel olarak 2 fonksiyonu vardır.
1. Uyarı iletimi yapar.
2. Hücrelerin birbirlerini tanımalarını sağlar.
ŞEKİL 1.22 Hücre zarındaki lipit ve protein dağılımı
32
H A Y V A N
F İ Z Y O L O J İ S İ
Fosfolipid yapısı
Fosfolipitlerin fosfat grubunu içeren polar başları hidrofilik (suyu seven), apolar
kuyrukları ise hidrofobik (suyu sevmeyen) özellik gösterir. Bu yüzden sulu ortamda
fosfolipitler hidrofobik kuyruklarını yanyana ve uçuca yerleştirerek, sadece hidrofilik başların
suyla temas ettigi bir çifte tabaka oluştururlar. Oluşan bu çifte tabaka esnek, bir sıvı kristal
gibi akışkan, ve kısmen geçirgendir.
ŞEKİL 1.23
Fosfolipit molekül ve şematik görünümü
Bu şekilde oluşan zar yapısının içinde yer alan fosfolipit ve diger moleküller, zarın düzlemi
içinde yatay olarak serbestçe hareket edebilirler. Sıvı Mozaik Modeline göre hücre zarındaki
lipitler adeta bir mozaik yapı oluştururlar ve bunun içinde yer alan protein ve diğer maddeler için
bir çözücü olarak işlev görürler. Zarın oluşturduğu düzlemde bu moleküllerin difüzyon yoluyla
yatay hareketi sayesine, hücre zarında çeşitli biyokimyasal reaksiyonlar gerçekleşir. Laboratuar
ortamında fosfolipit kullanarak lipozom veya vesikül adı verilen, küresel şekilli, içleri boş, lipit
çift tabakalı bir zarla çevrili kesecikler yapılabilir. Bu keseciklerin içine bir madde (örneğin DNA)
doldurup bunların hücre içine alınmasını sağlamak mümkündür.
Hücre zarı üzerinde iyon ve molekül pompaları bulunur. Bu pompalar hücrenin dışındaki bir
çok maddeyi hücre içine transfer etmekle görevlidir. Bazı özelleşmiş proteinler ise zara
homojen bir şekilde dağılarak çeşitli fonksiyonlar üstlenmiştir. Hücre zarının seçici
geçirgen özelliği vardır.
Hücre zarının yapısı için akıcı mozaik zar modeli geçerlidir. Bu modele göre zar proteinleri
dağınık haldedir ve tek tek proteinler çift katlı fosfolipit tabakaya gömülüdür.
33
H A Y V A N
F İ Z Y O L O J İ S İ
Fosfolipaz C hücre içi ikincil haberci (görevi
hücre membranındaki fosfatidil inositolü yıkarak
iki parçaya ayırmaktır. Bunlar inositol trifosfat ve
diaçil gliserol sisteminde rol alan enzimdir.
Clostridiyumun alfa toksininde bulunur.
Fosfolipaz A2 pankreatik sıvıda bulunan ve
gıdalarla alınan fosfolipitleri yıkan enzimdir. ayrıca
hücre içinde de var olup, araşidonik asiti
serbestlestirir. en önemli sentez blokerı
steroidlerdir. bu bloğu lipokortin sentezini
arttırarak yaparlar. Yılan ve arı zehirinde bol
miktarda bulunur, membrandaki fosfolipitleri
yıktıgı icin hücre yapısını bozup ödem geliştirir
ŞEKİL 1.24
Fosfolipit yapısı
Lipit ve fosfolipid molekülleri bir iskelet üzerine yerleşmiş polar ve bu nedenle
hidrofilik bir baş ile polar olmayan ve bu nedenle hidrofobik iki karbon
kuyruğundan oluşur. Lipid ve fosfolipidler sulu bir ortam içinde bulunduklarında,
hidrofobik kısımları su molekülleri tarafından dışlanır. Bu nedenle lipid molekülleri ya
misel adı verilen küresel biçimde yada çift tabaka (bilayer) biçimde kümelenirler.
Fosfolipitler dört bileşenden oluşurlar; bir veya iki yağ asit grubu, negatif yüklü bir
fosfat grubu, bir alkol grubu ve de bunları birbirine baglayan bir omurga. Gliserol
omurgalı fosfolipitlere gliserofosfolipit veya fosfogliserit denir. Sfingozin omurgalı
tek bir fosfolipit vardır: sfingomiyelin. Hücre zarlarının (membranlarının) ana bileşenleri
fosfolipitler, kolesterol ve glikolipitlerdir. Fosfolipit, sentezi mitokondri ve
sitoplazmada ER yapılır. Fosfogliserit sentezinin ilk aşamasında fosfatidatın kimyasal
olarak aktive edilmesi, yani reaksiyona girmeye eğilimli hale gelmesi gerekir. Fosfolipitlerin
sentezinde ya aktive edilmiş bir diasilgliserol ya da aktive edilmiş bir alkol gerekir.
Fosfatidil serin ve fosfatidil inositol oluşumunda, bir alkol (serin veya inositol)
hidroksili ile sitidin difosfodiasilgliserol (CDP-diacylglycerol) arasında bir fosfo ester
bağlantısı oluşur. Fosfatidil etanolamin sentezinde, alkol önce ATP ile fosforlanır, sonra
sitidin difosfat (CDP) ile reaksiyona girip aktive olur. Bu alkol ardından diasilgliserol ile
reaksiyona girip son ürünü verir. Memelilerde fosfatidil kolin iki yoldan sentezlenebilir: ya
fosfatidil etanolamin sentezine benzer bir seri reaksiyonla ya da fosfatidil etanolamin
metil transferaz enziminin katalizlediği fosfatidil etanolaminin metilasyonu ile.
Sfingomiyelinin sentezinde, sfingozinin amino ucu, uzun zimcirli Asetil-CoA ile birleşerek
seramit oluşturur. Bunun ucundaki hidroksil grubuna fosfatidilkolin (diğer adıyla lesitin)
eklenmesiyle sfingomiyelin meydana gelir
34
H A Y V A N
F İ Z Y O L O J İ S İ
Hücre membranın görevleri
1. Hücre içindeki sitoplâzmayı hücre dışındaki dış ortamdan ayırır.
2. Hücreleri diğerlerinden ayırır.
3. Kimyasal reaksiyonların oluşabileceği belirgin bir yüzey oluşturur.
4. Hücreye materyal giriş-çıkışını düzenler.
5. Yapısında bulunan proteinler hücreye yapısal destek sağlarlar.
6. Bazı proteinler kimyasal reaksiyonları hızlandıracak enzim görevi yaparlar.
7. Reseptör görevi yaparlar.
8. Hücreye antijenik özellik kazandırırlar (hücrelerin birbirlerini tanımasını sağlarlar).
9. Hücre zarının en önemli özelliklerinden birisi seçici geçirgenlik özelliğine sahip
olmasıdır. Bu; homeostazis için ve hücrelerin uyarılması için gereklidir.
Lipid tabaka sadece yağda eriyen maddelere geçirgendir; Sterol yapısındaki hormonlar (Kortizol,
Testestron ) ya da yüksüz küçük moleküller (O2, CO2, N2). Lipid tabaka içindeki proteinler
yüzey boyunca hareket edebilir.
İntegral proteinler- yapısal proteinler başlıca işlevleri:
- pompa (Na-K ATPaz, SERCA, Na-Glikoz pompası SGLT)
-taşıyıcı protein (GLUT glikoz transportorları)
-iyon kanalı ( Na kanalları, K kanalları, Ca Kanalları)
-reseptör (Protein reseptörleri EPO)
-enzim ve antikor (ACE, Eritrosit antijen oligosakkaritleri)
Secici geçirgen olan Na iyon kanalları çapı 5 A olup Na daha küçük olan Li geçirirken
Na daha büyük olan moleküllerin geçmesine izin vermez.
Taşıma yapan kanaların yanlzıca çapları değil aynı zamanda yükleri madde geçişi üzerinde
etkidir. Bu yolla kanal proteinlerin belirli maddelere karşı geçirgen belirli maddelere karşı ise
geçirgen olmaması sağlanır.
35
H A Y V A N
ŞEKİL 1.25
F İ Z Y O L O J İ S İ
Na iyon kanalı geçirgenliğini belirleyen aralık
Temel olarak hücre Membranların ortak özellikleri :
1-Membranlar birkaç molekül kalanlığında ince tabaka yapısındadır. Birçok membranın
kalınlığı, 60-100 A arasındadır. Membran kalınlığı fonksiyona göre değişir.
Membran Proteinleri
2. Esaszarı
yapılarını
lipidler
oluşturur.
Membranlarda
ayrıca
proteinsaran
ve liptlere
bağlı
Hücre
ya da protein
plazma ve
zarı
hücrenin
organellerini
ve sıvı
içeriğini
ve hücreye
karbonhidratlar
da
bulunur.
yapısal bütünlük sağlayan ayrıca çok önemli işlevleri yürüten seçici geçirgen bir yapıdır.
Her ne kadar biyolojik zarların temel yapısı lipidler tarafından oluşturuluyorsa da,
3. Membran lipitleri, hem hidrofilik hem de hedrofobik kısımları bulunan nispetin küçük
hücrenin yaşamasıyla ilgili birçok özel fonksiyon proteinler tarafından gerçekleştirilir.
moleküllerdir. Bu lipitler sulu bir ortamda kendiliklerinden kapalı iki tabakalı yapılar
Proteinler iki tiptir: integral proteinler zarıboydan boya kat ederler, periferik proteinler
oluştururlar. Bu lipit tabakaları yüklü moleküllerin geçişi için bariyer görevi görürler.
ise memranın yalnızca bir yüzeyine tutunmuşlardır. Zarda yer alan proteinlerin tipleri ve
miktarları
Örneğin;
Sinir aksonlarını
kuşatan
myelin
zarlarda,
zarın
4. Özgül oldukça
proteinlerfarklıdır.
membranın
belirli fonksiyonlarına
aracılık
ederler.
Membran
proteinleri,
toplam
kütlesinin
%
25
inden
daha
azı
proteinken,
mitokondri,
kloroplast
gibi
enerji
pompa, geçit, reseptör, enerji transdüseri ve enzim olarak fonksiyon görürler. Bu
üreten
yapılarda
bu miktar
% 75
Olağan
ise bu
miktar
yaklaşık %
proteinler
lipit tabakaları
arasında
yerkadardır.
alırlar ki, bu
liptlerzarlarda
proteinlerin
görev
yapabilmeleri
için50
dolaylarındadır.
Lipid
molekülleri,
protein
molekülleriyle
kıyaslandığında,
hacım
olarak
daha
uygun ortamı sağlarlar.
küçük olduğundan bu % 50 lik oranda bile çok fazla sayıda lipid molekülü vardır. Genel
olarak
zarlarda 1 protein
molekülüne
karşılık
yaklaşık yapısını
50 lipidoluşturan
molekülüprotein
yer alır.ve lipit
5. Membranlar
nonkovalent
yapılardır.
Membranların
molekülleri birçok nonkovalent bağlantılar kurmuşlardır.
6. Membranlar asimetriktir. Membranların iç ve dış yüzeyleri birbirlerinden farklıdır.
Apostatik hücreler hücre içi proteinler Aneksin V dış tarafa döner.
7. Membranlar sıvı yapıdadır. Lipit yapılar membranın yüzeyine difüze olmuşlardır. Özgül
birtakım bağlantılar yapmadıkları zaman proteinler de bu şekilde yerleşmişlerdir. Membranlar
“proteinlerin ve liptlerin iki, boyutlu çözeltileri” olarak tanımlanabilir.
ŞEKİL 1.26 Hücre membrane yapısı
Hücre membranı temel görevleri:
36
H A Y V A N
F İ Z Y O L O J İ S İ
•
Hücre içi ortamın özgün bileşimini hücre dışı ortamdan ayırmak, Hücre içi ile
hücre dışı ortamlar arasında seçici bir şekilde madde alışverişini sağlayarak hücrenin
atıklarını hücre dışı ortama vermek, hücre dışından hücreye gerekli maddeleri
almak ve hücre içi ortamın özgün yapısını korumaya yardımcı olmak,
•
Komşu hücrelerle iletişimi ve madde alışverişini sağlamak,
•
Hücreyi dış ortamdan ayırır. Hücreye şekil verir.
•
Madde giriş-çıkşını düzenler. Aktif taşıma olayını düzenler.
•
Hücrenin beslenmesine yardımcı olur.
•
Komşu ve yabancı hücreyi bulur.
•
Hücreyi alınacak hormonları tanır.
•
Hücrenin yıpranan kısmını onarır.
•
Metabolizma atıklarının dışarı atılmasını sağlayarak iç ortamı düzenler.
•
Prokaryot hücreye sahip canlılarda zardaki solunum enzimleri sayesinde enerji
üretimi sağlanır.
Birçok zar proteini, lipid tabakada bir taraftan diğer tarafa kadar uzanır. Transmembran
proteinler olarak adlandırılan bu proteinler amfipatik özelliktedir, yani hem hidrofilik hem de
hidrofobik bölgelere sahiptirler. Hidrofobik kısımları lipid tabakanın hidrofobik iç
kısmıyla, hidrofilik kısımları ise lipid tabakanın her iki yanında yer alan su
tabakasıyla ilişkidedir. Bu proteinlerin bazılarının hidrofobikliği kendilerine kovalent
olarak bağlanmış olan ve lipid tabakanın sitoplazmik yarısı içine gömülü bulunan yağ
asiti zincirleri nedeniyle artabilir. Zarların sitoplazmik yarısına bağlanan bazı proteinler
sadece yağ asiti zincirleri aracılığıyla lipid tabakaya tutunur. Bazı hücre yüzey proteinleri ise
küçük bir fosfolipid olan fosfatidil inositole kovalent olarak bağlanarak lipid tabakanın dış
yüzünde yer alırlar. Yağ asitlerine kovalent olarak tutunan proteinler zarda bulunan lipidlere
kovalent olarak bağlanır. Bu proteinler üç tip lipid grubuyla bağlanırlar.
İntegral proteinler:
37
H A Y V A N
F İ Z Y O L O J İ S İ
• Hücre zar proteinleri lipid tabakaya gömülü olan proteinlerdir.
• Bunlar fosfolipidlerle hidrofobik etkileşimler sayesinde bir arada bulunurlar.
• İntegral proteinlerin membranı kateden ve lipidlerle etkileşen yüzeyinde
apolar (veya hidrofobik) amino asitler bulunur.
• Birçok integral protein suda eriyen maddelerin hücre dışı ile içi arasında
girip çıktığı bir kanal sağlamaktadır (transmembran proteinleri, Na-K ATPaz).
• Aquaporinler denen özel bir transmembran ailesi bazı özelleşmiş
hücrelerde (proksimal tubul, toplayıcı kanallar) suyun hızlı hareketini sağlar.
Proteinleri zara bağlanması Üç yolla olur.
•
Birinci tip bağlanmada (açilasyon); bir yağ asiti zinciri (myristic veya palmitic
acid) bir amid bağı aracılığıyla, sitozolik yüzde, proteinin amino ucundaki
glisine kovalent olarak bağlanır.
İkinci tip bağlanmada (prenilasyon); bir prenyl grubu (farnesyl veya daha uzun olan
geranyigeranyl grubu) bir thioeter bağı ile, sitozolik yüzde, proteinin karboksil ucundaki 4.
sırada yer alan sistein'e bağlanır. Bu prenilasyonu takiben uçtaki 3 amino asit ayrılır ve yeni
oluşan karboksil uç metillenir, böylece protein zara yerleşmiş olur.
ŞEKİL 1.27 Hücre membran bileşenleri yeri ve dağılımı
•
Üçüncü tip bağlanmada; proteinler, zarın dış yüzünde yer alan
glikozilfosfatidilinositol (glycosylphosphatidylinositol)(GPI)'a bağlanır. GPl'ın
yapısı hücreler arasında farklılık gösterebilir. Bu yapı genel olarak fosfatidilinositol ve
fosfatidiletanoamin ihtiva eder. Fosfatidilinositolün iki yağ asidi zarda uzanırken
fosfatidiletanoamin bu lipid yapıyı proteine bağlar. Fosfatidilinositol ve
fosfatidiletanoamin arasında ise sayısı hücre tipine göre değişen şeker rezüdüler yer
alır.
38
H A Y V A N
F İ Z Y O L O J İ S İ
Membran proteinlerinin görevleri:
• Enzimatik görevleri vardır.
• Reseptör olarak görev yaparlar. Hormon, ilaç, bakteri ve virüsler için
reseptör oluştururlar.
• Taşımada veya taşımaya yardımcı kanallar oluşturmada görev
almaktadırlar.
• Plazma membranında yer alan transmembran proteinler bir yandan hücre
iskelet elemanları ile diğer yandan hücre dışında bulunan bazı ipliksi
proteinlerin bağlantı noktalarını oluştururlar.
• Hücre-hücre etkileşimini sağlarlar.
Membran Karbohidratları
Plazma zarının hücre dışı yüzeyi, zar lipit ve proteinlerinin bazılarına kovalent olarak
bağlanmış az miktarlarda karbonhidrat içermektedirler. Glikoproteinler ya da glikolipitler
şeklinde adlandırılırlar. İntegral proteinlerin çoğu glikoproteinlerdir ve zarın lipit moleküllerinin
yaklaşık onda biri glikolipitlerdir. Bu moleküllerin “gliko” bölümleri hemen daima hücre
yüzeyinden dışa doğru değişmez şekilde çıkıntı yapar. Proteoglikan olarak adlandırılan
karbonhidrat bileşiklerinin bir çoğu, küçük protein çekirdeklerle birbirlerine tutunmuş ve
hücrenin dış yüzeyine gevşek biçimde bağlanmış karbonhidrat maddeleridir. Bu nedenle hücrenin
dış yüzeyi çoğu kez bütünüyle glikokaliks adı verilen gevşek bir karbonhidrat örtüyle kaplıdır.
Hücrenin dış yüzeyine tutunan karbonhidrat uçlarının (glikokaliks) birkaç önemli işlevi
vardır:
Membran
karbonhidratları
hemen daima
(1) Glikokalilks
hücrenin kimliğinin
teşhis proteinler
edilmesinde,ya da lipidlerle kombine olarak
glikoproteinler ve glikolipidler halinde bulunur. Integral proteinler çoğu glikoproteindir.
Bu(2)moleküllerin
“gliko”
bölümleri
hemen
daima
hücre yüzeyinden
dışadış
doğru
asılarak
çıkıntı
Çoğu elektriksel
olarak
negatif
yüklü
oldukları
için hücrenin
yüzeyinin
negatif
yapar,
bileşiklerinin
proteoglikan
adımaddeleri
verilen birçoğu,
yüklükarbonhidrat
olmasına neden
olur ve diğer
negatif yüklü
iterler. küçük bir protein çekirdekle
biri birine tutunmuş ve hücrenin dış yüzeyine gevşek biçimde bağlamış karbonhidrat maddelerdir.
Bu(3)nedenle
hücrelerin
dış yüzeyi
glikokaliks
verilen gevşek
bir karbonhidrat
örtüyle
Bazı hücrelerin
glikokaliksi
diğer
hücrelerinadı
glikokaliksine
bağlanır,
böylece hücreler
kaplıdır.
Hücrenin
dış olurlar.
yüzeyine tutunan karbonhidrat uçlarının birkaç önemli işlevi vardır:
birbirlerine
tutunmuş
Glikolipid ve glikoproteinlerin gliko kısmının hücre yüzeyinde yaptığı karbonhidrat örtüye
(4) Karbonhidratların
çoğu insülin
hormonların
bağlanması
reseptör
görevi
glikokaliks
denir. Karbonhidrat
uçlar gibi
negatif
yüklüdür (hücre
yüzeyi için
negatif
yüklü olur).
yapar, bağlanmadan sonra bu kombinasyon bağlı olan internal proteinlerin aktive
olmasını sağlar, bu da bir dizi intraseiüler enzimin aktivasyonuna neden olur.
(5) Bazıları da bağışıklık reaksiyonlarına girer
39
H A Y V A N
F İ Z Y O L O J İ S İ
Glikokaliks
•Hücre örtüsüdür
•Negatif elektrik yüküne sahiptir.
•Antijen antikor birleşmesi için uygundur
•Bir hücrenin başka bir canlıda antijen özelliğini
göstermesine yol açar.
•Kan grupları glikokaliksin antijenik özelliklerine
göre belirlenir
ŞEKİL 1.28 Hücre zar.
Glikokaliksin işlevi;
—Eritrositlerdeki glikokaliks kan grubunun oluşumunda etkilidir.
—Difüzyon için seçici bir engeldir.
—Hücrelerin birbirini tanımasını sağlar
—Kontakt İnhibisyona neden olur
—Hücreye antijenik özellik kazandırır
—Reseptör görevi yapar
Kolesterol
Kolesterol, hayvanların vücut dokularındaki hücre zarlarında bulunan ve kan plazmasında
taşınan bir sterol, yani bir steroid ve alkol birleşimidir. Daha düşük miktarlarda
bitkilerde de bulunur. İlk defa 1754'te safra taşlarında kolesterol bulunduğu için bu
maddenin ismi Yunanca chole- (safra) ve steros (katı) sözcükleri ile kimyadaki -ol
ekinden türetilmiştir.
40
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.29 Zar proteinleri.
Kolesterol, özellikle hayvansal gıdalarda bulunur ama vücuttaki kolesterolun ancak ufak bir
kısmı gıda kaynaklıdır; çoğu vücut tarafından sentezlenir. Vücudun her hücresinde
bulunmakla beraber, onun sentezlendiği veya hücre zarlarının daha çok olduğu organ ve
dokularda, örneğin karaciğer, omurilik ve beyinde kolesterolun yoğunluğu daha
yüksektir. Kolesterol kanda normalden fazla bulunması halinde damarlarda birikerek damar
sertleşmesine (ateroskleroz) yol açar. Bazen de safra pigmentleri ile birleşerek safra
taşlarının oluşumunda rol oynar.
Düşük yoğunluklu lipoprotein
(İngilizce karşılığı olan Low Density
Lipoprotein'den LDL olarak
kısaltılır) kanda kolesterol taşıyan ve
yoğunluğu 1,019-1,063 g/mL
arasında olan lipoprotein sınıfına
karşılık gelir. Karaciğerde üretilen
çok düşük yoğunluklu lipoprotein
(İngilizce Very Low Density
Lipoprotein, VLDL) metabolizması
sonucu oluşur. LDL tanecikleri 18-25
nm çapındadır, taşıdığı lipitlerin yanı
sıra apolipoprotein B-100 (apoB100) ve apoE proteinlerini içerir.
ŞEKİL 1.30 LDL alınması ve hücre içi sindirimi
Kolesterol pek çok biyokimyasal reaksiyonda yer almasına rağmen özellikle
lipoproteinlerin kolesterolü taşıma biçimleri ve kandaki kolesterol düzeyleriyle kalp
hastalıkları arasındaki bağlantıdan dolayı bilinir. Vücut, kolesterolü kullanarak hormonlar
41
H A Y V A N
F İ Z Y O L O J İ S İ
(kortizol, üreme hormonları), D vitamini ve yağları sindiren safra asitlerini üretir. Bu
işlemler için kanda çok az miktarda kolesterol bulunması yeterlidir.
ŞEKİL 1.31 Kolestrol yapısal formülü
Eğer kanda fazla miktarda kolesterol varsa kan damarlarında birikir ve sertleşmeye ve
daralmaya (ateroskleroz veya arteriyoskleroz) yol açar. Aterosklerozda damar duvarında
biriken tek madde kolesterol değildir; akyuvarlar, kan pıhtısı, kalsiyum gibi maddeler de
birikir. Yüksek kan kolesterolünün zararlarından bahsedilirken söz konusu olan "kötü
kolesterol", yani düşük yoğunluklu lipoprotein (İngilizce low density lipoproteins LDL)
tarafından taşınan kolesterol düzeyidir. Yüksek yoğunluklu lipoprotein (İngilizce high
density lipoproteins HDL) tarafından taşınan kolesterola "iyi kolesterol" denir.
Kolesterol, D vitamini ve çeşitli steroid hormonlarının öncülüdür. Ayrıca safra asitleri de
Kolesterol İşlevi
• sentezlenir.
Sıcaklık Kolesterol
ile doğru hücre
orantılıdır.
kolesterolden
zarlarının (membranlarının) inşası ve bakımı için
gereklidir. • Yağ asidi zincir uzunluğu ile ters orantılıdır.
•
Yağ asidi doymamışlık derecesi ile doğru orantılıdır.
Hücre zarının
akışkanlığı:miktarı
Kolesterol
içeren
membranlar daha geniş sıcaklık aralığında
• Kolesterol
ile ters
orantılıdır.
akışkanlıklarını korurlar. Kolesterol, yağların sindirimine yarayan safranın sentezlenmesinde
kullanılır. Ayrıca aralarında yağda çözünen vitaminlerin (A, D, E ve K vitaminleri gibi)
metabolizmasında rolü önemlidir. Aldosteron, testosteron, östrojen ve projesteron gibi
steroid hormonlarının ve kortizolun sentezlerinde yer alır. Başka araştırmalar
kolesterolün sinir hücreleri arasındaki sinapslarda ve bağışıklık sistemi hücrelerinin
işlevlerinde rol oynadığını gösterir. Hücre membranının yapısına etkisi sonucunda hücre
sinyal iletimine ve membranlardaki iyon ve proton geçirgenliğine de etki eder.
42
H A Y V A N
F İ Z Y O L O J İ S İ
Membran bağlantıları
ŞEKİL 1.32
Bağlantı komplekleri
Tight juction – sıkı bağlantı: Sıkı Bağlantı ya da Zonula Occludens, vücudu dış etkilerden
koruyan hücrelerde bulunan, hücrenin yan yüzeyinde yaptığı hücreler arası bağlantılardandır.
Epitel hücrelerindeki kuvvetli bağlantılar bu tiptedir. Bu tip bağlantı da hücreler arası
boşluk yok denecek azdır. Genellikle de yalıtma özellikleri fazladır. Beyin kan bariyeri,
ince barsakta epitelyum hücrelerinde sıkı bağlantı vardır.
ŞEKİL 1.33 Hücreler arası bağlantı yapıları
43
H A Y V A N
F İ Z Y O L O J İ S İ
En yüzeydeki hücreler arası bağlantı noktası. Okludin ve klaudin proteinlerini içerir. Bariyer
yapılarında yer alır (kan-beyin, kan-timus, kan-testis, kan-gaz, kan-göz gibi). Mesane ve
gastrointestinal sistemde de bulunur
•
Gap junction – geçit bölgesi: Epitel hücrelerinin lateral yüzeyindeki morfolojik
değişikliklerdir. Bu bölgeler epitel hücrelerinde olduğu gibi düz kas ve kalp kası
hücrelerinde de bulunan bir sıkı bağlantı bölgesi olarak iki hücrenin elektriksel
bağlanma bölgeleridir. Nexus da delikler bulunduğu için delikli geçit bölgeleri
olarakta bilinmektedir. Bu deliklerden iki hücre arasında molekül ağırlığı 1000
daltondan daha küçük moleküller geçer. Örneğin cAMP (Cylic Adenozin
mono fosfat) molekülleri bir hücreden diğer hücreye geçerek hücre de bazı
faaliyetleri başlatırlar.
Gap junction connexin adlı protein subunitlerinden oluşur. Sinsityum halinde
çalışan dokulardaki hucreleri bir kanal yapısında birbirine bağlayan oluşumlardır.
Normalde hücre mebranları hücre içini dişindan izole eder, gap junction'lar komşu
hücre mebranlarını kat eden kanallar vasitasiyla bu hücreler arasi elektriksel uyari
ve madde gecişine izin verir, böylece mesela uyarilan bir hücre komşu hücrelere bu
uyariyi elektriksel olarak veya kimyasal ligandlar yoluyla iletebilir ve tüm doku uyarilmiş
olur.
ŞEKİL 1.34
•
Gap junction connexin proteinlerin bir araya gelemsiyle oluşur.
Gap junctionlar kalp kası, uterus, osteosit, korneada bulunur.
Desmosoz
aynı hücreye
işlevi yürüten
hücrelerin
ortak
hareketbağlantı
etmelerini
ve birbirine yapışmalarını
• Hücreden
elektriksel
iletimi
sağlayan
yapılarıdır.
sağlayan sitoplazmik uzantılardır. Çoğunluk simetriktirler. Bu uzantılar küçük bölgeler halinde
olabilir
ya da hücrenin
etrafını
çepeçevre
sarar
(kemer
desmozom).
• Bir(düğme
hücrededesmozom)
6 adet konneksin
bir araya
gelerek
bir yarı
kanal
(konnekson)
oluşturur.
• İki hücredeki konneksonlar yan yana gelince tam bir kanal oluşur (neksus)
44
• Böylece iki hücre arasında iyon ve hormonların geçişini sağlayan bir kanal oluşmuş
olur
H A Y V A N
F İ Z Y O L O J İ S İ
Mekanik etki altında kalan hücrelerde düğme desmozom daha fazladır. Esasında
hücre bağlantıları, hücrelerin serbest yüzünden derinlere doğru farklı bölgeler gösterir.
belt- kemer desmosom
spot- düğme desmosom
ŞEKİL 1.35 Hücre zarının farklı bağlanma yapıları.
Bazal lamina
Bazal zar ya da bazal membran; epitel hücrelerinin bazal kısımlarını döşeyerek epiteli
altındaki bağ dokudan ayıran, düz kas, iskelet kası, kalp kası, sinir hücreleri ve yağ
hücrelerinin etrafını kaplayan, çeşitli fibrillerden ve aramaddeden oluşan ince tabakaya
denir. Esnek, ince, ekstar sellüler matriksin özelleşmiş şeklidir.
Bazal lamina: Fibroblast, epitel,
düz kas ve swann hücreleri
tarafindan sentezlenen, epitel
hücreleri, kas hücreleri, adipöz
(yag doku) ve schwan hücreleri
etrafinda bulunan tabakadir.
Molekül olarak laminin, entactin
(nidojen), fibronektin, tenasin,
kollagen tip iv proteinleri
(glikoprotein) ve heparan sülfat
bulunur. laminin ve nidojen temel
komponentleridir.
ŞEKİL 1.36 İntersellüler matriks elemanları
Bazal lamima epitel hücrenin altında, ya da düz kas, iskelet kası hücrelerin etrafını kuşatır
veya glomerulus, akciğer alveolleri gibi bölgelerde iki hücre tabakası arasında yer alır.
Bazal lamina ve retiküler lamina olmak üzere iki katmanı vardır. Bazal zar ait olduğu
hücreler tarafından sentezlenir. Epitel hücrelerinin bağ dokusuna bakan yüzeylerindeki
hücre zarlarının altında uzanır. Kalınlığı 400–700 Ao arasında değişir. Glikoprotein
45
H A Y V A N
F İ Z Y O L O J İ S İ
yapısındadır. Alttaki retiküler lifler ile süreklilik gösterir. Burada retiküler lifler
yoğunlaşıp retiküler laminayı oluşturur. Bazal lamina ile alttaki retikulum telcikleri ağının
oluşturduğu tabakaya bazal membran denilir. İki katmandan oluştuğu gözlemlenmiştir:
Daha az yoğunlukta ve hücre zarına yakın olan katmana, lamina rara, (lamina lucida);
fazla yoğun ve bağ dokusu tarafında yer alan katmana ise, lamina densa denilmektedir.
Bazı dokularda bağ dokusu tarafında bulunan üçüncü katmana lamina reticularis denilir.
Çok katlı epitelin altında iyi gelişmiş olarak bulunur.
Kadherinler: Kadherinler aynı tip hücreleri bağlarlar (homofilik).Selektinler :Selektinler
farklı tip hücreleri bağlarlar (heterofilik).Selektinler endotel hücresinde, lökosit,
Bazal
lamina birbirine
belliLökositlerin
düzende tutunmuş
4 bileşenden
oluşur.
trombositlerde
bulunur
kapille olan
damar
endotel bağlanmasında
görev alır..
Hücre göçünde, hücre tipinin belirlenmesinde kadherinler görev yapar.
1-Laminin
Kadherinler:Glikoprotein
kalsiyuma bağlı reseptör proteinlerdir.
2-Tip IV kollagen
3-Entaktin : Glikoprotein
4-Perlekan : Heparan sülfattan zengin bir proteoglikan
İntegrinler: Epitel hücrelerini, altlarındaki bazal membrana bağlayan adezyon
molekülüdür. Bazal membrandaki laminin ve fibronektine tutunurlar.
ŞEKİL 1.37 Hücre membran proteinlerinin görevleri
Bazal lamina filtrasyonda, hücre polaritesinin oluşturulmasında, hücre metabolizması,
farklılaşması ve gelişmesinde görev alır. Hasar gören hücrelerin yenilenmesinde ve hücre
göçünde de bazal lamina görevi vardır. Pek çok kanser türünde bazal lamina tamamen
kaybolur. Yaşlanma, diyabet, Hipertansiyonda bazal lamina kalınlığı artar ve dokular
yeterince beslenemez.
Adhezyon Molekülleri:
Adheren (tutturucu, yapıştırıcı) bağlantılar epitel hücrelerinde, fibroblastlarda, kalp kası
hücrelerindeki interkalar disklerde ve düz kas hücrelerinin arasında bulunur. Adezyon
molekülleri, hücrelerin özgül olarak dokulara yönlenmelerinde, birbirlerini
tanımalarında, embriyogenez, hücre büyümesi, hücre farklılaşması ve inflamasyon
gibi olguların düzenlenmesinde görev alırlar. Adezyon kuvvet molekülleri bugün dört sınıfta
incelenmektedirler: integrinler, selektinler, immünglobulin süper-ailesine dahil
adezyon kuvvet molekülleri ve kaderinler. Bir de fonksiyonel olarak adezyon kuvvet görevi
gören ama yukarıdaki gruplar içerisinde sınıflandırılamayan adezyon kuvvet molekülleri
vardır.
46
H A Y V A N
F İ Z Y O L O J İ S İ
İntegrinler
İntegrinler, heterodimer transmembran proteinlerdir. Aktif ya da inaktif halde
bulunabilen integrinlerin, biribirine kovalent olmayan bağlarla bağlı alfa ve beta (ß)
alt üniteleri vardır. Molekülün fonksiyonel aktivitesi için her iki alt ünite de gereklidir, ancak
ba lanma özgüllüğünün alfa alt ünitesi ile ilişkili olduğu düğünülmektedir. İntegrinler,
yapılarında bulundurdukları ß alt ünitelerine göre ß1, ß2, ß3 ve ß7 integrinler olarak
adlandırılırlar. ß1 yapısında olan integrinlere “Very Late Activation (VLA)” adı verilir. Bu
ismi aktive olmu T lenfositlerin yüzeyinde 2-4 hafta gibi uzun bir süre sonunda
eksprese olmaları nedeniyle alırlar. ß1 integrinler özellikle lökositlerin endotel hücrelerine ve
hücre-dışı matrikse bağlanmasında görev alırlar. ß2 grubu integrinler üç homolog
heterodimerden oluşur; kompleman reseptör tip 3 (CR3;CD11b/18), CR4 (CD11c/18) ve
lökosit fonksiyonlarıile ilişkili molekül-1 “Leukocyte FunctionAssociated Antigens-1
(LFA-1; CD11a/18)” İntegrinlerin yapıları ve fonksiyonları iki-değerli katyonlara bağımlıdır
(Ca2+, Mg2+). İntegrinler arginin-glisin-asparagin (RGD) aminoasit dizilerine sahip
moleküllere bağlanma özelliği gösterir. Bu diziler hüce-dışı matriks glikoproteinlerinde, bazı
hücrelerin yüzeyinde ve bazı kompleman proteinlerinde bulunur. Sitoplazmik kısımları ile
vinkulin, talin, aktin, alfaaktinin, tropomiyozin gibi hücre içi iskelet yapıları ile
etkileşirler. Dolaşımdaki lökositlerin damar endoteline tutunup yapıştıktan sonra,
inflamatuvar reaksiyonun bulunduğu alana göç etmelerinde rol alırlar. Hücre dışı sinyaller
aracılığı ile haberleşmeyi sağlarlar. İntegrin adı, bu moleküllerin hücredışı matriks ve hücre
iskeleti ile ilgili aktivitelere aracılık etmesinden (integre etmesi) kaynaklanır.
Embriyolojik geliğim, hemostazis, trombosis, yara iyileşmesi, immün ve immünolmayan savunma mekanizmaları gibi birçok fizyolojik olayda hücre-hücre ve hücrematriks adezyonuna katılırlar. Kardiyovasküler sistemde hücre-hücre ilişkisi dinamik bir
olgudur ve ince ayarlı bir düzenleme gerektirir. Fibrinojen (2 mg/ml) varlığına rağmen
trombositler agrege olmaz, kan akımına rahmen lökositler inflamasyon alanına gidebilir.
Bütün bu olaylarda integrin grubu hücre yüzey molekülleri rol oynar. İntegrinler, insan
vücudunda bulunan hemen tüm hücrelerde eksprese olurlar. Aktif hale geçen bir
hücre sitoplâzmasından sinyal iletildi İnde, integrinlerin hücre-dışında kalan kısmı şekilde
işlevini göstererek kendi ligandına olan afinitesini arttırır. Bu işleme içeriden-dışa(insideout) sinyal iletimi denir. Bu işlem adezyon molekülleri arasında bir tek integrinlerde görülür.
İntegrinlerin ligandına başlanması ile bu kez dışardan-içeriye (outside-in) sinyal
mekanizması çalışır; bu da hücre içerisinde apoptozisten proliferasyona kadar birçok
işlevde etkili olur. İntegrinler, liganlarının aviditesi yönünden düşük ve yüksek afiniteli
durumda olabilirler. İntegrinler farklı yollardan aktive edilebilirler. TCR kompleksi veya
protein kinazı C (PKC) aktive eden forbol esterler aracılığıyla içeriden dışarıya doğru sinyal
iletimi sa lanabilir. CD2, CD44 veya CD43’e karşı monoklonal antikorlar da
C11/CD18 aktivasyonuna neden olurlar. Mg2+ ve Mn2+ ve bazı integrin başlayan
antikorlar da (MEM83, KIM127, KIM18) hücre içi sinyali olmaksızın integrin aktivasyonu
yapabilirler.
Fibro nektinler
Bu proteinin esas görevi hücreleri matrikse bağlamaktır. Fibronektinler iki polipeptid
zincirinden meydana gelmiştir. C-terminal uçlarından birbirleriyle disülfit bağları ile
bağlanmıştırlar. Uzunluğu 60–70 nm, kalınlığı ise 2–3 nm kadardır. Üzerinde çok sıkı
katlanmış globüler bölgeler vardır. Bu bölgelerle matrikste özellikle kollagen tip I, II, III
ve V ' e, heparan sülfata, fibrin, denature kollagen ve hücre zarlarındaki integrinlere
bağlanırlar. Vücudun çeşitli bölgelerinde 20 çeşit fibronektin izole edilmiştir. Bütün bu
47
H A Y V A N
F İ Z Y O L O J İ S İ
fibronektinler tek bir fibronektin geninin çeşitli (splicing) diziliş gösteren kalıplardan
oluşturulan RNA'lardan sentezlenmiştir. Fibronektinler hücre göçünün yapılmasında da
etkin moleküllerdir. Bu moleküller 6 kolu bulunan tenasin proteini ile özellikle gelişmekte
olan organlarda epitel hücrelerinin altında yer alan mezenşim hücrelerinin bol olduğu
ortamda birleşirler.
Hücre dışı matriks
Hücre dışı matriks pek çok işlevsel protein ve polisakkaritten oluşur (Glikoprotein,
Proteoglikan). İçinde bulunduğu veya temas halinde olduğu hücreler tarafından salgılanır.
Örneğin konnektif dokuda bu matriks makromoleküllerini (ESM) salgılayan büyük hücreler
fibroblastlardır. Kemik ve kartilaj dokularında ise bu hücreler kondroblast, osteoblastlardır.
Kendilerini üreten hücrelerin yüzeyi ile yakın ilişki içindedirler. Hücrelerin ve dokuların bir arada
tutulmasına yardım eder. Hücreler arası boşlukları doldurur. Destek (Kemik ve kıkırdak)
görevi vardır. Hücre yapısı ve hareketi ile hücre gelişim ve farklılaşmasında önemlidir. Besin ve
madde alışverişi ve hücre yaşamının devamlılığında gereklidir. Ayrıca hücrelerin
migrasyonunu ve birbirleri ile olan ilişkilerini organize eder.
Hücrelerde, N-bağlı şekerler proteinlere bağlanarak protein çeşitliliğine neden olurlar. Bu
glikoproteinler, hücre zarının yüzeyine yerleşerek hücrelere yeni kimliklerini kazandırır.
Bununla beraber N-glikosilasyonlu proteinlerin şeker profilinin uç kısmında bulunan
şekerler, örneğin; sialik asitler hücrelerin birbirleriyle ve çevreleriyle iletişiminde önemli
rol oynar. Negatif yüklü sialik asitler universal bir molekül olarak hücre yüzeylerinin
özelliklerinin şekillenmesine katkıda bulunurlar ve hücrelerin çevreleriyle arasında birçok ilişkinin
kurulmasında çok önemli rol oynarlar. Çok çeşitli hücresel tanıma olayları, hücre
farklılaşması, pozitif yüklü iyonların taşınması, reseptörleri maskeleyerek asıl reseptörün
tanınmasının engellenmesi ve onları bozulmaya karşı koruması bunlardan bazılarıdır.
Hücre içinde veya yüzey elemanlarına bağlı sialik asitler, hücresel tanıma, tutunma,
farklılaşma, yaşlanma gibi fizyolojik olaylarda yüzey değişikliklerinden ve hücrelerde
bilgi iletimi gibi işlevlerle, hücrede birçok moleküler ilişkinin şekillenmesine katkıda
bulunurlar.
Hücre dışı matriks farklı moleküllerden meydana gelir.
Glikozaminoglikanlar (GAG); Hidrate, jelimsi
Hyalüronik asit, Kondroitin sülfat, Dermatan sülfat, Heparin ve
heparin sülfat, Keratan sülfat
Fibröz proteinler
Yapısal olanlar:
Kollajen, (Gerilme gücü)
Elastin (Matrikse esneklik)
Adezif olanlar:
Hücrelerin matrikse uygun yerlere tutunmaları
48
H A Y V A N
F İ Z Y O L O J İ S İ
Fibronektin, laminin, tenasin, entaktin, vitronektin, İntegrin,
Selectin, VCAM, ICAM, v.b
Diğer ECM proteinleri:
Fibrillin, fibulin, nudelin, netrin, galaktin, glutaktin, vs.
En fazla bulunan hücre dışı protein %25 ile kollejendir. Kollajen (bazen kolajen veya
kollojen olarak da anılır) hareket sisteminin yapı taşlarını, özellikle kemik, kıkırdak, lif ve
eklemleri oluşturan proteindir. Bu madde Fibroblast, Osteoblast, Kondroblast, Retiküler
hücre, Epitel hücre, Endotel hücresi, Düz kas hücresi, Schwann hücresi tarafından
sentezlenir. Bu protein birbiri üzerine sarılmış üç alfa zincirinden meydana gelir. 19 tane değişik
tipi tanımlanmış olup, tip I, tip II şeklinde isimlendirilir. Bu çeşitlilik moleküler yapıdan
kaynaklanmaktadır. Kollajenin ana molekülü tropokollajendir. Tropokollajenler de hücrenin
içinde üretilen prokollajenlerden oluşur.
Fosfolipidlerin geçirgenliği
Hücre zarı, seçici geçirgen bir yapıya sahiptir. Molekülün büyüklüğüne, yağda veya suda
çözünmesine, polaritesine, ortamdaki yoğunluğuna veya türüne göre zar üzerinden
madde taşınmasını dört farklı şekilde gerçekleştirir. Basit pasif difüzyon da gazlar gibi
solutler ve su kendi elektrokimyasal gradiyentleri doğrultusunda membranlar dan
kolaylıkla geçerler. Lipit çift tabaka iyonlar için geçirgen değildir, iyonlar sadece özel
kanallar sayesinde hücre membranından geçebilir. Fosfolipidler, fosfogliseridler ve
sfingomyelin olmak üzere ikiye ayrılır.
49
H A Y V A N
F İ Z Y O L O J İ S İ
Fosfolipid
Sfingolipid
ŞEKİL 1.38 Fosfolipit molekülden geçen maddeler ve diffüzyon
Hücre zarınında pasif difüzyonun diğer bir tipi ise kanallar aracılığı ile olur ve genellikle
iyonlar bu yolu kullanırlar. Elektrolitlerin lipid çözünürlüğü kötü olduğu, suyla hidrojen bağı
kuramadığı için membranın çift katlı fosfolipid tabakasından difüzyonu yoktur. Bu sebeple
iyonların membrandan geçiş katsayıları düşüktür ve membrandan geçebilmek için bir
kanala (protein yapısındaki iyon kanalları) ihtiyaç duyarlar. Sinir hücrelerinde bulunan ligand
kapılı ve voltaj kapılı kanallar bu şekildedir
Transport Tipi
Konsantrasyon farkına göre yön
Enerji ihtiyacı
Basit difüzyon
Aynı yönde
Hayır
Kanal ve porlar
Aynı yönde
Hayır
Pasif transport
Aynı yönde
Hayır
Aktif transport
Karşı yönde
Evet
Membrane Transportu kullanılan farklı yollar temel olarak ATP kullanması yada
kullanılmasına göre sınıflandırır. Diffüzyon, kolaylaştırılmış diffüzyon fitrasyon, osmoz ATP
kullanılmadan membranda madde taşıma yolarıdır. Primer ve sekonder aktif taşıma,
Ekzositoz, Endositoz ise ATP kullanarak yapılan madde taşır.
50
H A Y V A N
F İ Z Y O L O J İ S İ
Basit Difüzyon
Molekül ve elementlerin sahip olsukları kinetik enerji yani Brown hareketleri sonucu
yüksek konsantrasyonlu bir bölgeden düsük konsantrasyonlu bölgeye moleküllerin
(veya iyonların) membranı geçerek transportudur. Net hareket düsük konsantrasyon
yönündedir. Yüksek konsantrasyonlu bölgedeki moleküllerin düsük konsantrasyonlu bölgeye
doğru hareket etme ihtimali, düsük konsantrasyonlu bölgedeki moleküllerin yüksek
konsantrasyonlu bölgeye hareket etme ihtimalinden daha büyüktür. Bu nedenle zaman
içersinde konsantrasyon farkı yönünde moleküllerin hareketi olacaktır. Bu hareket her iki
bölgedeki moleküllerin sayıları esit oluncaya kadar devam eder ve sonuçta her iki
bölgedeki madde konsantrasyonu esit olur. Bu hareketin hızı tamamen konsantrasyon
farkıyla orantılıdır. Hidrofobik maddeler lipid membranları hidrofilik maddelere göre
daha kolay geçerler. Hidrofobik ortamda yüksek erime özelliğine sahip olan bu moleküller
(örn. gliserol) plazma membranını suda eriyen maddelere göre daha kolay geçerler. Bu
kuralın istisnası su dur. Su son derece polar olduğundan gliserol için söylenenden daha düsük
bir diffüzyon hızına sahip olmalıdır. Aslında suyun diffüzyon hızı lipid yapay membranda
gliserolun 7 katı kadardır. Tabii hücre membranında ise suyun diffüzyon hızı gliserolun
100 katıdır (aquaporinler etkisi). Membran taşıma proteinden ve enerjiden(ATP)
bağımsızdır. Sadece gradiente bağlı olarak geçiş olmaktadır. Taşınacak madde konsantrasyon
gradienti ne kadar fazla ve ne kadar hidrofobik ise geçiş o kadar hızlı olmaktadır. Taşınacak
molekül büyüklüğü, ne kadar küçükse, membran kalınlığı, ne kadar ince ise ve geçiş
yüzeyinin büyüklügü ne kadar fazla ise difüzyon hızı o kadar artar.
Farklı
maddelerin
difüzyon
katsayıları
farklıdır.
En hızlı difüzyon gazlarda meyadana gelir, sıvılarda daha yavaş olur. Difüzyon katılarda da
meydana gelebilir; bu, atomlara birbirlerinin etrafında hareket edip yer değiştirme olanağını
sağlayan kristal kafesi kusurlarında oluşur. Bununla birlikte bunun oranı o denli küçüktür ki sıkı
temas halinde iki katı cisimde yıllar sonra bile görünür bir karışmaya tanık olunmaz.
Difüzyon oranı, konsantrasyon gradieninin fonksiyonudur, İki alan arasında konsantrasyon
farkı ne kadar büyük olursa, yüksek konsantrasyonlu alandan düşük konsantrasyonlusuna
moleküller o kadar hızla yayılır (difüze olur).
51
H A Y V A N
F İ Z Y O L O J İ S İ
Difüzyon, Geçişme veya Yayılma olarak da
bilinir, maddelerin çok yoğun ortamdan az
yoğun ortama göçü. Fiziksel kimyada ise
moleküllerin kinetik enerjilerine bağlı olarak
rastgele hareketlerine denir. Difüzyon,
maddenin bütün hallerinde farklı hızda ve
özellikte görülür.
ŞEKİL 1.39 Diffüzyon bağlı olarak konsantrasyon değişimleri .
Yağı seven Lipofilik (hidrofobik yada başka bir ifade ile sudan kaçan) maddeler
membranda daha kolay çözüldükleri için daha hızlı geçiş gösterirler. Bu nedenle
gliserol, üre, yağ asitleri membranları daha kolaygeçer. Ancak membranda en hızlı difüzyona
uğrayan molekül su molekülüdür (Ozmoz). Bir maddenin çift katlı lipid tabakadaki hareket
hızını belirleyen en önemli faktörlerden birisi o maddenin lipiddeki eriyebilirliğidir. Örneğin
oksijen, karbon dioksid, azot ve alkolün lipidde çözünürlüğü yüksektir. Böylece bütün
bu maddeler çift katlı lipid tabakada doğrudan çözülürler ve sudaki eriyiklerinde olduğu gibi
difüzyonu uğrarlar, bu maddelerin membrandan difüzyon hızlan, onların lipidde
eriyebilirliği ile doğru orantılıdır.
Filtrasyon
Bir zarn iki kesimindeki hidrostatik basnç fark nedeniyle sıvının membranda bulunan
porlardan (deliklerden) zarın bir bölümünden diğer bölümüne geçişlidir. Özellikle kılcal
damarlarda meydana gelen bu olayda süzülen maddenin miktarı ile ortamda bulunan basınç
farkı ve hücre zarının geçirgenliği etkilidir. Böbrek glomerullerinde ve kılcal damarlarında
plazmanın süzülmesi de buna güzel bir örnektir.
Bir membranın iki yüzü arasındaki hidrostatik basınç farkı nedeniyle, basıncın yüksek olduğu
taraftan az olduğu tarafa doğru sıvı ve beraberinde erimiş küçük moleküllerin geçişine filtrasyon
(süzülme) denir.
ŞEKİL 1.40 Filtrasyon
52
H A Y V A N
F İ Z Y O L O J İ S İ
Vücutta filtrasyona örnek kapillerlerdeki ve böbreklerdeki taşıma olayları gösterilebilir.
Kapillerlerdeki olay basınç farkı nedeniyle su ve suda erimiş partiküllerin damar dışına
çıkışıdır (dokular arası sıvıya geçişidir). Filtrasyonda proteinler gibi büyük moleküller
damar dışına geçemez. Fitrasyonda hücreler arası geçiş parasellüler geçiş önemlidir.
Taşıma proteinleri ile Kolaylaştırılmış diffüzyon
Bir molekülün yüksek konsantrasyonda bulunan bölgeden düsük konsantrasyon tarafına,
plazma membranında bulunan protein tasıyıcı ile tasınması olayına verilen isimdir. Bu olay
pasif bir olaydır. Ve konsantrasyon gradyanı yönünde yapılmıstır. Üç özelliğe sahiptir:
1) Taşıma proteinleri bir partiküler molekül için spesifiktir.
2) Kolaylaştırılmış difüzyon basit diffüzyondan daha hızlıdır.
3) Kolaylaştırılmış difüzyona taşınan madde kendine has olan tüm taşıma
proteinlerini doldurmuş olabilir. Satüre olabilir(doyma kinetiği Tm değeri
vardır).
Glikoz, laktoz, amino asid, nükleotidler ve gliserol v.s. gibi benzer moleküllerin herbiri için
spesifik, özel tasıyıcılar vardır. Glikoz tasıyıcısı D-glikozu tasıyacaktır, fakat L-glikozu
tasımaz. Tasınacak molekül bağlandığı zaman tasıyıcı molekül yapısal bir değisiklik geçirmek
üzere etkilenir. Böylece küçük molekülü membranın öbür tarafına geçirir. Plazma membranını
geçerken hareket hızı, basit diffüzyondan daha hızlıdır. Belki de bu hücre içinde
kullanılan, normal olarak membrandan çok düsük hızda diffüze olan hidrofilik
moleküllerin transportu için gelismis bir mekanizmadır. Herhangi bir hücrede bir molekül
veya iyon için sınırlı sayıda tasıyıcı vardır. Bütün tasıyıcılar bağlandığı zaman, transport hızı
maksimum olur. Bu yüzden olay satüre olabilir özelliğe sahiptir. Transport kinetiği bir basit
enzim için tanımlanan proseslere benzer. Bir tarafta konsantrasyon büyük olduğu zaman daha
çok tasıyıcı bağlanacak ve diğer tarafa net hareket meydana gelecek. Konsantrasyon farkı sıfır
olduğunda ise tasıyıcılar hala faaliyet gösteriyor olsalar da sonuçta içeriye ve dısarıya aynı hızda
madde tasıyan moleküllerdir. Bu yüzden net diffüzyon gözlenmez. İnsülin ve epidermik
büyüme faktörü gibi hormonlar normal olarak gözlenen diffüzyon hızından daha fazlasının
olmasını sağlarlar. Örneğin glikozun hücre içersine girişini insülin hormonu hızlandırır.
Kolaylaştırılmış diffüzyonda eloktrokimyasal gradient söz konudur. Yani taşımacak
molekül çok olduğu yerden az olduğu yere doğru taşınır. Ancak membrandaki transport
proteinler aracılığı ile olur. Bu nedenle taşıma işleminde doyma kinetiğine sahiptir.
Kolaylaştırılmış difüzyon enerjiye(ATP) ihtiyaç duymaz. Glikozun hücre membranından
geçişi kolaylaştırılmış transport ile olmaktadır(GLUT). Suyun difüzyonunda da aquaporin
adındaki suya özel taşıma kanalları görev yapar. Organizmadaki diğer örnekleri demirin
incebarsaktan absorbsiyonu ve plesentadan glikozun geçişidir.
53
H A Y V A N
F İ Z Y O L O J İ S İ
Kolaylaştırılmış difüzyon bir taşıyıcı
aracılığı ile gerçekleşir: (1) Taşınacak
madde taşıyıcı proteine bağlanınca,
taşıyıcı proteinde şekil değişikliği olur ve
içte kapalı olan hücre kanalının ucu açılır.
(2) Molekül buradan içeri girmeye başlar.
(3) Proteine zayıf bağlandığı için hücre
içine yakın bir yere geldiğinde, ısıdan
kaynaklanan hareketle protein,
molekülden ayrılır ve molekül hücre
içine girer.
ŞEKİL 1.41 Membran madde taşıma yolları .
Taşınacak madde molekülleri hücre membranlarını bir özel taşıyıcı denilen özel trasportor ile
kompleks yaparak hücre membranını geçerler. Taşıma işlemi taşınacak moleküle özel
olduğundan bir tip taşıma molekülü yalnız bir molekülün kolaylaştırılmış difüzyona izin verir.
Öğreniğin benzer yapıda olmasına rahmen glikoz taşıma proteinleri(GLUT5) bir tipi yalnız
fruktoz taşıması yapar.
ŞEKİL 1.42 Kolaylaştırılmış difüzyonda da gözlenen transfermaksium Michael-mental kinetiği
Çoğu protein kanalı bir veya daha fazla sayıdaki iyon veya molekülün transportu için yüksek
düzeyde seçicidir. Bu, kanalın çapı, şekli ve iç yüzeyindeki elektriksel yük gibi niteliklerin
sonucudur. Hücre membranından çok büyük miktarda difüze olan madde sudur.
Örneğin, su alyuvar membranından her iki yönde düzenli olarak difüze olur. Saniyede alyuvar
membranından her iki yönde difüze olan su miktarı yaklaşık olarak hücre hacminin 100 katma
eşittir. Normal ol arak her iki yönde difüze olan suyun miktarı öyle hassas ayarlanmıştır ki suyun
net hareketi görülmez. Bundan dolayı, hücrenin hacmi sabit kalır. Buna karşın belirli bazı
koşullarda üpkı öteki maddeler için geliştiği gibi, membramn iki tarafı arasında su için de bir
konsantrasyon farkı gelişir. Bu koşullarda, membranda suyun net hareketinin yönüne bağlı olarak
hücre şişer ya da büzülür. Suyun konsantrasyon farkından doğan bu net hareketine osmoz denir.
Kolaylaştırılmış difüzyon GLUT glikoz transporterları
Glukoz taşıyıcılar GLUT hücrelerin yüzeyinde bulunan ve kolaylaştırılmış difüzyon ile
glukoz taşıyan protein ailesidir. Farklı tipleri olan bu proteinler hemem hemem tüm
hücrelerde vardır.
54
H A Y V A N
F İ Z Y O L O J İ S İ
•
GLUT-1: Merkezi sinir sistemi(beyin ve omurilikte) ve eritrositler
•
GLUT-3: Visseral organlar
•
GLUT-4: Daha çok periferik dokularda (kalp ve iskelet kası)
•
GLUT-5: Sindirim sistemin’de gösterilmiştir.
ŞEKİL 1.43 Glikoz kolaylaştırılmış diffüzyon proteinleri GLUT taşıma sıstemi
Farklı tip GLUT olması sayesinde bazı hücrelerin örneğin beyin omurlilik ve sinir hücrelerinin
insülin gibi glikoz hücre içine alınmasında düzenleme yapan hormonlardan bağımsız olarak
alınmasına izin veririr
Kolaylaştırılmış difüzyon Aquaporin su kanal proteinleri
Hücre içinde ve dışında su molekülleri canlı için hayati öneme sahiptir. Su basit difüzyonla
hücre zarından geçer ayrıca su kanalları olarak da bilinen, aquaporinler gözenekli yapıya
sahip su için özelleşmiş taşıma proteinlerdir. Bazıları, aquaglyceroporins olarakta bilinir.
Bu taşıma proteinleri aynı zamanda por büyüklüğüne bağlı olarak, örneğin, zar boyunca
gliserol, CO2, amonyak(NH3) ve üre gibi diğer küçük yüksüz eriyikleri taşıayabilir.
Örneğin, aquaporin 3 kanal 8–10 A por genişliğine sahiptir ve 150-200 Da molekül ağırlığına
sahiğ hidrofilik moleküllerin geçişini sağlar. Aquaporinler porları protonlar gibi hücre
membranı elektrokimyasal potansiyelinin korunmasında kritik önemi olan moleküllerin
karşı geçirgen değildir.
ŞEKİL 1.45 Aquaporin membran taşıma proteinleri 7 heliks yapısı
Memelilerde aquaporins on üç bilinen türleri vardır ve bunlardan altısı böbrekte bulunur.
En çok çalışılan aquaporinler AQP1, AQP2, AQP3 ve AQP4 dir. Su fosfolipid çift-katlı
55
H A Y V A N
F İ Z Y O L O J İ S İ
aracılığıyla veya aquaporinler adı verilen özel su kanalları boyunca geçirilerek difüzyon ile ya
da hücre zarı geçer. Şimdiye kadar ondan fazlası memelilerde aquaporinler tespit edilmiş, fakat
daha birçok varlığı kanıtlanmamıştır. Aquaporinler iyonları ve diğer küçük moleküllerin geçişine
izin vermez buna karşın özel su kanalları olarak görev yapar. Bazı aquaporinler aquaglyceroporins olarak bilinen - su artı gliserol ve birkaç diğer küçük molekülleri
taşıma görevi yapabilir.
•
Aquaporin 1: AQP1 böbrekte bulunan, yaygın olarak ifade edilen su kanalı
proteinleridir. Böbrekte proksimal tübüllerde, Henle kulpunda vasa rektatda inen
bölümü içinde bazolateral ve apikal plazma zarlarında bulunur. Buna ek olarak,
kırmızı kan hücreleri, vasküler endotelyum, gastrointestinal sistemde, ter bezleri
ve akciğer bulunmaktadır. Aquaporin 1
(ADH) vazopressin tarafından
denetlenir.
•
Aquaporin 2: AQP2 böbreğin toplama kanalı ana hücrelerinin apikal hücre
zarlarında ve hücre içinde bulunan hücre içi veziküller içinde bulunur. Bu
aquaporin tipi peptit hormonu olan vazopresinle iki yolla düzenlenir: bir artış
yoluyla da apikal plazma membranı apikal bölgeye kayması, AQP2 veziküllerin hareketi
sayesinde kısa süreli düzenleme (dakika), ve uzun vadeli düzenleme (gün) AQP2 gen
ekspresyonu. Bu kanalda mutasyonlar otozomal dominant ya da resesif olabilir. Şekersiz
diyabet ile ilişkilidir. Genellikle bipolar bozukluğu tedavi etmek için kullanılan
lityum, AQP2 genin ekspresyonunu azaltarak diabetes insipidus neden olabilir.
AQP2 geninin ekspresyonu, gebelik ve konjestif kalp yetmezliği gibi su retansiyonu ile
ilişkilidir koşullarında artar.
•
Aquaporin 3 ve 4: Aquaporinler ana toplama kanalı hücrelerin bazolateral hücre
zarında bulunan ve bu hücrelerinden su çıkışı için bir yol sağlamar. AQP4 yapısal
olarak ifade edilir, buna karşın böbrekte, AQP3 gen ifadesi, (ADH) vazopresin ile
düzenlenir. AQP4 astrositler olarak ifade edilir ve merkezi sinir sistemine doğrudan
uyarılması regüle edilir.
Band 3 proteini : Eritrositlerin başlıca görevi akciğerlerden dokulara oksijen, dokulardan akciğere
karbondioksit taşımaktır. Karbondioksitin oksijen ile değişimi bir anyon değiştirici transport
proteini sayesinde olur. İşte eritrositlerdeki bu anyon transport proteinleri Band 3 proteinlerdir.
Band 3 proteini de bir (multipass)transmembran proteindir. Kolaylaştırılmış difüzyonla iyon
değişimi yapar(klor shift)
Aktif- pasif Taşıma
Lipid zar yapısı hidrofilik ve iyon yada büyük maddelerin geçisi izin vermez. Buna karşın
hücrenin metabolizması için gerekli olan maddelerin uygun şekilde alınması gereklidir. Bu
noktada hücre aktif taşıma yapar.
Şekerler ve amino asitler poler (kutuplu) moleküllerdir. Bunların çapları 8 A°'dan büyük
olduğu için normal yollardan hücre zarını geçemezler. Halbuki, bu iki maddenin de hücre
zarını bolca geçmeleri gerekir. Çünkü hücrenin enerji üretimi ve protein sentezi yapabilmesi için
bu iki maddeye İhtiyacı vardır. Öyleyse, başka bir mekanizmayla hücre zarını geçmeleri
gerekmektedir. Yapılan deneyler, bu maddelerin zar yüzeyinde özel yerlere bağlandığım ve zarın
dış yüzünden iç yüzüne (hücre içine) taşındığını göstermiştir. Bu tür taşınma şekline taşıyıcılar
56
H A Y V A N
F İ Z Y O L O J İ S İ
aracılığıyla taşınma denir. Çünkü hücre zarında bulunan taşıyıcı moleküller, taşımaya aracılık
ederler. Bu yolla zarı geçen maddeler kimyasal özgüllükleri, rekabet ve doymuşluk yaratma
özellikleriyle basit difüzyonla geçen maddelerden ayrılırlar.
•Sodyum-potasyum pompası, özellikle sinir hücrelerinde yaygındır. Sinir hücrelerinde, Na-K
yoğunluklarındaki değişliklikler elektriksel yük meydana getirirler. Hücre zarı boyunca Na ve
K’un sürekli diffüzyonu ve sızması, Na - K pompası ile gerçekleşir.
• Kalsiyum pompası, kas kasılmasında kalsiyum iyonlarının taşınması için gereklidir.
• Sodyum bağı kotransportta, şeker ve aminoasitler aktif olarak taşınırken Na iyonları da pasif
olarak efllik eder.
• Hidrojen bağlı kotransportta ise hidrojen iyonları bağlanırken, şekerler aktif olarak
taşınır.
ŞEKİL 1.45 Aktif taşıma sistemleri
1-Özgüllük: Taşıyıcılarla taşınmada, taşıyıcıların bazı kimyasal gruplara özgü olması özelliğidir.
Örneğin şeker taşıyan sistem, amino asitleri taşımaz. Bazı sistemler o kadar özgüldür ki aynı
atom sayısı ve kimyasal grupları taşıyan iki molekülden birisinin molekül biçiminde
küçük bir değişiklik olsa, bunu ayırt edebilmekte ve o molekülü taşımamaktadır.
2-Doymuşluk(micheal mental enzim kinetiği) Basit difüzyonda, hücre dışında bulunan ve
difüzyonla hücre içine girecek olan maddenin dıştaki yoğunluğu ne kadar artarsa, hücreye
giren madde miktarı da o kadar artar. Taşıyıcılarla olan taşınmadaysa maddenin hücreye girişi,
dıştaki yoğunluğun artmasıyla bir yere kadar artar, bir noktadan sonra durur. Buna göre, taşıma
57
H A Y V A N
F İ Z Y O L O J İ S İ
sisteminin bir kapasitesi olduğu söylenebilir. Dıştaki yoğunluk, bu taşıma kapasitesinin
üzerindeyse fazlası taşınmaz. Başka bir deyişle taşıma sistemi doymuştur. Sistemin doyması,
hücre yüzeyindeki Özgül bağlanma yerlerinin tümüyle işgal edilmesi ve sistemin maksimum
kapasiteyle çalışması anlamına gelmektedir.
3-Rekabet: Birbirine benzer iki madde, aynı taşıyıcı sistemle taşınıyorsa birbiriyle
rekabet eder. Örneğin amino asitlerden alanin ve glisin aynı taşıyıcıyı kullanırlar, yani
aralarında rekabet vardır. Benzer olarak nötür amino asitler arasında aynı taşıma proteinine
bağlanmak için rekabet oluşur.
Zarda bulunan taşıyıcı moleküllerle konsantrasyon farkına bağlı olarak birim zamanda yalnızca bir
molekül ya da iyonun sitosolden içeri ya da dışarı doğru taşınması üniport taşıma olarak
tanımlanır. Memeli hücrelerinde glikozun taşınması buna bir örneltir(SGLT).
Aktif taşıma için taşınacak madde konsantrasyon farkı zorunluluğu yoktur. (madde
konsantrasyon yönününe zıt olarak taşınabilir). Aktif taşıma da görev yapacak proteinler taşınacak
molekülü membran içine özel proteinler(taşıma proteinleri) kullanarak taşır.
1) ATP-az’lar: Na+/K+ transport sistemi dısında en önemli transport sistemi kas liflerinin
sarkoplazmik retikulumundaki Ca+2 - transport sistemidir. Bu sistem kasın relaksasyon
zamanında etkili olur ve Ca2+’u hücre içindeki küçük vesiküler bosluklara kaldırır. Bunu hücre
stoplazmasıyla vesikül içi arasındaki büyük kalsiyum konsantrasyonu farkına rağmen yapabilir
(Ca2+ plazma = 10-7 mol/L ,Ca+2 vezikül= 10-3 – 10-2 mol/L) .Transport ATP’nin
parçalanmasından açığa çıkan metabolik enerji ile gerçeklesir. Bir ATP molekülünün hidrolizi
ile 2 mol Ca2+ vesiküle alınır. Bu olayda da gene Mg2+’un varlığına ihtiyaç vardır. Enzim
fonksiyonları Ca2+ ve Mg2+ tarafından stimüle edilir. Ca2+ / Mg2+ ATP-az , Na+/K+ ATP-az
gibi sadece lipidlerin varlığında fonksiyon görür. Hücre membranlarından özellikle eritrositlerden
izole edilmistir. Ca2+ / Mg2+ ATP-az ’a ek olarak mide, böbrek ve glandların hücre
membranlarında ATP -az’lar da vardır. Bu ATP- az’lar HCO-3 veya K+ tarafından aktive olurlar.
3) Aktif H+ transportu (Redox sistem): Mitokondriler hücre solunumunun gerçeklestiği
yerlerdir. Redoks reaksiyonları mitokondirinin içinden dısına aktif H+ transportunu sağlar.
Bu transport mitokondri membranının iki tarafı arasında bir elektrokimyasal potansiyel
farkının olusmasıyla sonuçlanır. Bu potansiyel proton geri akısı olarak ATP sentezini
yönetir. Oksijenli solunum sonunda ATP sentezin en fazla yapıldığı basamak
mitokondri zar arasında elektrokimyasal gradiye bağlı proton taşıması
sırasındadır(Kemosmotik ATP sentezi).
a) Mitokondri içindeki H+ iyonlarının dısa transportuyla dıs fazın baslangıçtaki asitlik özelliği
değisir. Membranın lipid fazı Triton 100 gibi deterjanlarla parçalanırsa asitlikte değisiklik olmaz.
b) H+ iyonlarının transport hızı direkt olarak oksijen kullanımıyla orantılıdır. Bir oksijen
atomu için 6H+ iyonu transfer edilir. ATP - az inhibitörler bunu etkilemezler. Fakat solunum
zincirini etkileyen zehirler değistirebilir.
c) H+ iyonlarının dısa tasınması bir membran potansiyeli meydana getirir(dıs pozitif, iç
negatif). Membran potansiyelini ölçmek için mitokondiriler çok küçüktür.
58
H A Y V A N
F İ Z Y O L O J İ S İ
Simport-Antiport aktif taşıma yolları
Simporta iki madde aynı yönde taşınırken antiport bir birine zıt yönde iki madde
taşınması yapılır. Simport–antiport taşıma yollu mekanizması pasif taşınmanın tersinedir.
Taşınacak molekülün düşük konsantrasyondan yüksek konsantrasyona doğru, bir taşıyıcı
molekül aracılığıyla taşınmasıdır. Yokuş yukarı taşınma diye tabir edilen bu sistemde,
enerjiye ihtiyaç duyulur. Enerji ihtiyacı, ATP molekülünden sağlanır. Bu sistemde
moleküller genellikle tek yönde taşınır. Bazı sistemlerde, taşıyıcı molekül taşınacak maddeyi, her
iki yönde de taşıyabilir. Ancak, taşıyıcının taşınacak moleküle karşı affinitesi (birleşme isteği,
meyli) bir tarafta yüksek, öteki taraftaysa düşüktür. Taşınmanın bir yöne doğru olması ve
yoğunluğun bir tarafta yüksek tutulabilmesi için bu şarttır.
ŞEKİL 1.46 Uniport ve kotransport yolu.
Aktif taşıma tipi olan Simport ve Antiporta iki yada daha fazla molekülün birbirine bağımlı
transportudur. Eğer taşınım membranın iki tarafına göre aynı yönde ise simport, farklı
yönlerde ise antiport adını alır.
Böbreklerde ve sindirim kanalında glikoz aktif rezorpsiyonu sekonder aktif transporta
örnektir. Hücrenin diğer yüzeyinde(bazal membran tarfında) aktif Na+/K+ pompası vardır.
Bu mekanizma Na+ iyonlarını hücrenin iç kısmından dış kısmına(kapiller damara) taşır. Bu
yüzeyde ise glikoz için pasif bir transport mekanizması(GLUT) vardır. Sodyum-glikoz Cotransport mekanizması lümene ait hücre membranlarında(Epitel hücrelerin lümen yüzeyinde)
bulunmustur. Protein yapısındaki taşıma proteinleri inhibitör maddelerle durdurulabilir. Örneğin
Oubain Na+/K+ ATP az pompasını inhibe edebilir. Bazal lamina kısmında bulunan
(Kontraluminal tarafında) hücre membranınında eritrositlerde tanımlanana benzer
sekilde glikoz transport mekanizması, floretin tarafından inhibe edilebilir. Luminal hücre
membranlarının Na+-glikoz Co-transport mekanizması florizin tarafından inhibe edilir.
Sodyum iyonları, yeterli glikoz molekülleri varsa elektrokimyasal potansiyel gradyanı
boyunca böbrek veya sindirim sistemi lümeninden hücreye girer. Sodyum, hücre dışında
içerideki miktarından 10 kat fazladır. Potasyumsa, hücre içinde dışa göre 30-35 kat daha
fazladır. Bu iyonların hücre içinde ve dışındaki yoğunluk farkı, aktif taşınmayla muhafaza edilir.
Na-K pompası, bu sistemle çalışır. Taşıyıcı molekül, hücre içinden 3 mol sodyumu hücre
dışına taşır. Arkasından da hücre dışından 2 mol potasyumu hücre içine taşır. Tüm bu
olaylar için 1 mol ATP kullanılır.
Na bağlı glikoz taşıma proteini bir glikoz molekülü bir veya iki sodyum iyonuna
bağlanır. Böylece intrasellüler glikoz konsantrasyonu, kan tarafındaki diğer ortamdakinden daha
59
H A Y V A N
F İ Z Y O L O J İ S İ
fazla oluncaya kadar artar. Glikozun kolaylaştırılmış difüzyonla taşınması mümkündür. Bu
durumda glikoz molekülleri pasif mekanizma ile kana geçebilir(GLUT). Glikozun
lümenden kan tarafına tasınması devamlıdır. Hücrenin her iki tarafındaki sıvı hacimleri içersinde
mutlak olarak aynı bilesim olsa bile bu işlem sürer. Sodyum transportu azalırsa, mesela
oubain ile o zaman glikoz transportu da azalırr. Glikoz konsantrasyonu azalırsa, sodyumun aktif
transportu da azalır. Sekonder aktif transport esas olarak tüm epitelyal dokularda bulunur.
Böbrekte sekonder aktif transport mekanizması bikarbonat, protonların sekresyonu ile beraber
glikoz, amino asit, monokarboksil ve dikarboksil asitler, safra asiti, fosfat, sülfat ve
kalsiyum iyonlarının rezorpsiyonundan sorumludur. Glikozun sodyuma transpotunda SGLT
denen transtport proteinleri bu taşımada görev alır. İntraselüler ortama giren sodyum daha
sonra sodyum-potasyum ATPaz pompası ile hücre dışına atılmaktadır. Oral rehidratasyon(su
kazandırma) sıvılarında sodyum ve glukoz beraber verilmektedir. Çünkü sodyum ve glikoz
birbirlerinin emilimini incebarsak düzeyinde kolaylaştırırlar. Sodyum ve glikoz böbrek
tübüllerinde de geri beraber emilir. Diabetik hastalarda filtratta glikoz fazla olması nedeniyle daha
fazla olan glikozun geri emilimi için daha çok sodyum ve bunla beraber su emilir.
Primer aktif taşıma Na-K ATPaz
Sodyum-potasyum pompası (Na+- K+) sodyum iyonlarını hücre dışına taşırken, aynı anda
potasyum iyonlarını da hücre dışından içine taşır. Bu pompa vücuttaki bütün hücrelerde
vardır. Pompa, hücre içinde negatif bir elektiriksel potansiyelim oluşmasının yanı sıra,
sodyum ve potasyum konsantrasyon farklarının korunmasından da sorumludur.
o
Sodyum-potasyum pompasında hücrenin içine doğru çıkıntı oluşturan tarafında
sodyum iyonlarının bağlanması için üç reseptör bölgeye sahiptir.
o
Dış tarafında potasyum iyonları için iki reseptör bölgeye sahiptir.
o
Proteinin iç tarafında sodyumun bağlanma yerlerine yakın ya da ona komşu bir
bölge ATP-az aktivitesi gösterir.
ŞEKİL 1.47 Na-K ATPaz.
•
•
•
Proximal tübülde Na+’un geri emilimi,
Distal tübülde Na’un geri emilimi ve
Kas sarkoplazmasında Ca2+’un geri emilimi aktif taşıma ile yapılır
Na-K ATPaz membran dinlenme potansiyelinin oluşturur. Hücreden ne iyon
çıkışı(katyon çıkışı) sağlar. Na-K ATPaz çalışmaması sonunda hücre içi iyonların
bağlı olarak su girişi ile hücre patlar.
60
H A Y V A N
F İ Z Y O L O J İ S İ
Primer aktif taşıma Ca ATPaz
Kalsiyum (Ca 2+ ) hücre içinde sekonder haberci olması gibi birçok önemli rolleri
vardır. Serbest kalsiyum bezlerden salgılama için, çizgili kas hücrelerinde kasılma yada
döllenmiş yumurta tetiklenmesinde görev yapabilir. Serbest kalsiyum hücre içinde düşük
konsantrasyonları muhafaza edilmesi için kalsiyum pompaları çalışır. İskelet kas
sarkoplazmik retikulumun zarında bulunan ATPase ve sitozol içinde, hücre membranda
bulunan kalsiyum pompaları kalsiyum hücre içinde Sarkoplazmik retikülüm yada ekstra
sellüler sıvı içine pompalar. Bu pompalama işi primer aktif transport mekanizmasına
örnektir. Kalsiyum iyonları normal olarak vücuttaki tüm hücrelerde intraselüler sıvıda gerçekten
çok düşük konsantrasyonda, ekstrasellüler sıvının 1/10.000 oranında bulunur. Bu amaçla iki
kalsiyum pompası çalışır. Bunlardan biri hücre membranındadır ve kalsiyumu hücreden dışarıya
pompalar. Diğeri, kalsiyum iyonlarını, kas hücresinin sarkoplazmik retiküluma veya tüm
diğer hücrelerde mitokondriler gibi bir veya birden fazla vesiküler organelin içine
pompalar. SERCA, yada sarko/endoplasmik retikulum Ca2+-ATPaz, SR Ca2+-ATPaz,
ATP varlığında sitoplazmadan endoplasmik retikulum kalsiyum iyonu pompalayan primer aktif
taşıma yapan bir taşıma sistemdir.
ŞEKİL 1.48 Ca taşınmasın kullanılan yollar..
Sekonder Aktif Taşıma Na -Glikoz ve Amino asit coportu
Metabolik falliyetlerin düzenlenmesinde anahtar rol üstenen iki önemli molekül olan Glikoz ve
aminoasitlerin çoğu hücrelerin içine büyük konsantrasyon gradyanlarına karşı taşınır.
Yani hücre içinde yüksek konsantrasyonda olmalarına karşın ekstrasellüler sıvıdan ATP
kullanılarak hücre içine pompalanırlar. Bu taşıma maddelerin taşıma mekanizması sekonder
aktif taşımadır.
61
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.49 Sekonder aktif taşıma ile glikozun barsak epitelinde emilimi
Taşıyıcı proteinlerin, dış tarafta, biri sodyum, diğeri glikoz için olmak üzere iki bağlanma
yerine sahiptir. Aynı zamanda sodyum iyonlarının konsantrasyonu dışarı da çok yüksek,
içerde çok düşüktür. Bu taşınma için gerekli olan enerjiyi sağlar. Taşıyıcı proteinin spesifik bir
özelliği glikoz molekülü bağlanıncaya kadar sodyum iyonlarının içeriye hareketine izin
veren konumsal değişikliğinin ortaya çıkmamasıdır. SGLT taşıma proteinleri glikoz
sodyum simportu ile lümenden glikoz alır. SLGT2, Sodyuma bağımlı glikoz
cotransporters (ya da sodyum-glukoz bağlanmış taşıyıcı , SGLT ) ailesidir glükoz taşıyıcıdır.
Bağırsak mukoza ( ince barsak bölgesinin) ve nefronlarda proksimal tübül içinde bulunur.
böbrek glikoz geri emiliminin katkıda bulunur . Böbreklerde glikozun % 100 kısmını geri
emilir. Glomeruluslarda glikoz % 98 nefron boyunca SGLT2 ile yeniden absorbe edilir.
Çok yüksek plazma glukoz konsantrasyonu ( hiperglisemidurumunda ), glikoz idrarla atılır.
(glikozüri) SGLT2 sodyum ile glikoz arasında 4900 kadar çalışırken SGLT1 bu oran 70
dir.Barsak hücresinden kana glikoz verilmesi, başka bir taşıma proteini GLUT5 tarafından
yapılır.
ŞEKİL 1.51
Barsakta kullanılan kotransport yolu.
Membran reseptörü ikincil haberci
Pankreastan beta hücrelerinden salgılanan insülin, ve IGF-1 (insülin benzeri büyüme
faktörü), farklı hücrelerden sentezlenen büyüme faktörleri (EGF, FGF, PDGF gibi
growth faktörler) tirozin kinaza bağlı reseptörleri kullanırlar. İnsülin tirozin kinazın
62
H A Y V A N
F İ Z Y O L O J İ S İ
beta kuyruğunu aktive eder. Hipofizden salgılana büyüme faktörü ise JAK-STAT’ı
sekonder haberci sistemeni kullanır.
İnsülin hücre dışında yer
alan zar proteinlere
bağlanır. İnsülin
bağlanması Triozin
kinaz bir araya
gelmesine yol açar ve bu
durumda oluşan dimer
aktif hale gelir. Aktif
forma gelen triozin kinaz
fosforilazyon şelalesi
meydana getirirek İkincil
habercilerde etkisini
gösteririr.
ŞEKİL 1.52 Membranda buluna hormon reseptörleri
Hormon bağlanmış triozin kinaz bir seri protein üzerinde fosforilasyon şelalesi oluşturarak tek
bir moleküle karşın 106 kadar değişime uğramış aktif madde sentezine yol açabilir. Bu yola
çok küçük miktardaki haberleşme molekülleriyle(sinyal moelkülleri yada hormonlar)
büyük miktarda etki yapmak mümkündür. Fosforilasyon şelalesi sinyal molekülü varken
hızlı ve artılmış bir yanıt oluşumu imkânı verir. Benzer şekilde sinyal molekülünün( yada
hormonun) ortamdan uzaklaşması, yıkılması durumunda hücresel yanıtın hızla
durmasına olanak tanır.
Bir hormona veya nörotransmitter'e duyarlı reseptörlerin sayısını artırarak veya azaltarak
hücreler bu moleküle olan duyarlılıklarını ayarlayabilirler. Bu bir geri besleme
mekanizmasıdır. Bir uyarıya uzun süreli veya tekrarlı maruz kalmak çoğu zaman bir reseptörün o
uyarana düşük tepki vermesine yol açar, buna reseptör duyarsızlaşması denir. Reseptör
duyarsızlaşması (desensitizasyonu) liganda olan afinitenin azalmasına yol açar. Ligand-bağlı
reseptörlerin duyarsızlaşması (desensitizasyonu) ilk kez nikotinik asetilkolin reseptörlerinde
gösterildi. Duyarsızlaşma aşağıdaki şekillerde olabilir: Reseptör fosforilasyonu. Reseptör
effektör moleküllerinin ayrışması.
Ekzositoz
Proteinlerin ve buyuk molekullu maddelerin transportu icin ozel transport mekanizmaları vardır.
Tasınacak olan madde membranın bir parcası ile paketlenir. Hücre icersine alınırsa endositoz
veya önceden oluşmuş ve hücre duvarına temas ile icindekileri hücre dısına bosaltırsa ekzositoz
adı verilir. Bu sekilde proteinler veya daha büyük partiküller, hücre parcaları veya bakteriler
sindirim icin hücre icersine alınır. Bunun yanında hücrede üretilen hormon ve enzimler de dıstaki
ortama serbest bırakılırlar. Endositozun ilk adımında makromolekullerin membran
yuzeyindeki spesifik bağlanma yerlerine bağlandığı gözlenir. Bağlanma olayı canlı
membran materyelinde lokal formasyonunu tetikler. Kesin olarak istirahat durumundaki lipid
komposizyonu ve protein dağılımı farklılasır. Yeni oluşan hücre membranının iki lipid
tabakasında yuzey gerilimin değismesinden dolayı membranın invaginasyonu görülür. Bu
vesikuller hücre duvarından ayrıldıktan sonra lizozomlar tarafından sindirilir. Hücre içinde
63
H A Y V A N
F İ Z Y O L O J İ S İ
sentezlenen çeşitli maddelerin hücre dışına çıkartılması olayına sekresyon denir. Ökaryotik
hücrelerin birçoğu sekresyon yapabilirler ve sekresyon hemen her zaman ekzositoz yolu ile
yapılır. Hücre dışına çıkartılan maddelerin üç yoldan birini izler. Bunlar ya ekzositoz
oldukları hücrenin yüzeyine tutunurlar, ya ekstraselüler matrikste kalırlar ya da kan
dolaşımına katılırlar.
ŞEKİL 1.53 Ekzositoz.
Endositoz
Birçok hücrede endositoz sürekli olarak meydana gelir ve bu tip endositozda ekstraselüler
matriks ve bunun içinde çözünmüş maddeler, veziküller içinde hücreye girerler. Buna sıvıfaz endositozu (pinositoz) denir. Başka bir tip endositoz ise ancak hücre endositoz için uyarıldığı
zaman görülür. Buna reseptör aracılı endositoz denir. Pinositoz, çok büyük moleküllerin hücre
içine girebilmesinin tek yoludur, örneğin proteinlerin çoğu bu yolla hücre içine alınır. Bu tür
moleküllerin hücre zarıyla temaslarının artması pinositik vezikül oluşumunu artırır.
Pinositotik veziküllerin oluşma hızı bu tür moleküller membranın dış yüzüne değince
artar. Bu moleküler genellikle absorbe edilecek proteine- reseptöre bağlanır, reseptörler hücre
membranının dış yüzeyinde kaplı (örtülü) çöküntü (ceplerde) yoğunlaşmış olarak bulunurlar.
Bu ceplerin hücre içine bakan bölümünde Klathrin adı verilen bir fibriler protein aktin ve
miyozin gibi kontraktil bir ağ oluşturur.
64
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.54 Klatrin kaplı çukurlarla endositoz
Klatrin, hücre dışı veziküllerin belirli bir şekle kavuşması için rol oynayan temel
proteinlerdir ve sitoplazmada küçük vezilküller oluşmasını kolaylaştırır. Protein
molekülleri reseptörlerine bağlandığı zaman membıamn yüzey özellikleri, tüm cebin hücre içine
doğru çökmesine neden olacak biçimde değişir. İçe çöken cebin çevresindeki proteinler, az
miktarda ekstıaselüler sıvıyla birlikte reseptöre tutunan proteinlerin etrafının sarılmasını sağlar.
ŞEKİL 1.55 Ekzositoz ve endositoz.
Reseptörle sağlanan endositoz; LDL’lerin hücre içine alınmasında, epidermal büyüme
faktörünün hücreye alınmasıda, sinir büyüme faktörünün hücreye alınmasında, difteri
toksininin hücreye alınmasında, virüslerin hücreye alınmasında görev(HIV virüsünün T
lenfoistlerin CD4 reseptörlerine bağlanması) alır.
65
H A Y V A N
F İ Z Y O L O J İ S İ
Sitoplazma
Hücrenin esasının protoplazma adı verilen pelte kıvamında kütle oluşturur. Hayat bu kütle
içerisinde meydana gelen fizikokimyasal reaksiyonlar sonucu devam eder. Hücrenin yapısına
Proteinler, karbonhidratlar, yağlar en fazla miktarda ise su katılmaktadır. Ayrıca Na, Ca, K,
P gibi mineraller, enzimler, vitaminler, hormonlar da katılır.
Hücrenin metaboliz faaliyetlerinin gerçekleştiği yerdir. Sitoplazma, farklı büyüklükte ve
dağınık durumda partiktül ve organelle doludur. Partiküllerin içinde dağıldığı
sitoplazmanın berrak sıvı kısmına denir. Bu sıvıda çözünmüş proteinler, glikoz ve
elektrolitler (Ca, K, Mg) bulunur. Hücrenin önemli metabolik faaliyetleri (hücre hareketi
kasılması, glikolitik evre, hücrenin bölünmesi ve enerji dönüşümleri gibi) sitoplazmik
matrikste yer alır.
Sıvı kısım sitozol
Sitozolun büyük kısmını (%90) su oluşturur. Bu oran bazı canlılarda %98’e kadar
yükselebileceği gibi, sporlarda ve tohumlarda %5-15’e kadar düşebilir. Sitozolda organik ve
inorganik (kuru madde) maddelerin oranı %10–40 arasında değişir. Kuru maddelerin %90’ını
organik,%10’unu da inorganik maddeler oluşturur. Sitozolda en çok bulunan kuru madde
protein molekülleridir. Ayrıca sitozolda; yağ, vitamin, hormon, organik ve inorganik
asitler bulunur. Sitozolda bulunan önemli inorganik maddeler Na, Ca, K, P, Mg, Fe’dir. Bu
elementlerin hücredeki fonksiyonlarını şöyle özetleyebiliriz: Bazı biyo-moleküllerin yapısına
girerler. Örneğin Fe hemoglobinin yapısına katılır. Osmotik basıncın oluşmasını yani
hücrede belli bir yoğunluk oluşturarak, suyun hücreye girmesini sağlar. Düzenleyici
olarak görev yaparlar. Yarı akışkan, yoğun bir maddedir. Hücre sudan yoğun olup suyun içine
atıldığında dibe çöker.
•
Sitoplazma protein, karbonhidrat, yağ, vitamin, mineral, enzim ve su gibi organik ve
inorganik maddelerden oluşmuştur. Yarı akışkan bir sıvıdır. Sitoplazmanın sıvı kısmına
sitozol denir. Sitoplazmanın % 90’ını su oluşturur.
•
Görevi: Biyokimyasal reaksiyonlar için zemin oluşturmak
•
Organellere yataklık etmek
•
Organellerin hareketini sağlamak
Sitoplazma yer alan proteinler globuler ve ipliksel yapıdadırlar. Bu proteinler hücrenin
gereksinimine göre iplikçikler (mikroflaman) yada borucuklar oluştururlar.
Mikroflamanlar: ipliksel ve globuler proteinlerden oluşur.
Mikrotubuluslar: globuler protein içerir.
Globuler proteinler lipidlerle işbirliği yaparak membranları oluştururlar. Bu tür lipopratein
yapıdaki membranlara unit membran- elementer membran adı verilir.
66
H A Y V A N
F İ Z Y O L O J İ S İ
Endo plazmik Retikulum
Endoplazmik retikülüm agranüler ve granüler olmak üzere hücre sitoplazmasının her tarafında
yaygındır ve kanalcıklar, veziküller ve keseler gibi yapılardan oluşmuştur. Intrasellüler
kalsiyumun en yüksek olduğu organeller endplazmik retinakulum ve mitokondridir.
Endoplazmik retikulum membranında sitokrom redüktaz ve glukoz fosfataz gibi enzimler
bulunur. Granüllü endoplazmik retikulumun görevleri; kollajen, pıhtılaşma proteinleri,
serum albunini ve immünglobulinler gibi hücre dışına gönderilecek maddelerin
sentezidir. Granülsüz endoplazmik retikulumun steroid hormon sentezi, ilaç
defoksikasyonu, kas hücrelerinde
Kalsiyum regülasyonu gilokojen ve lipid
metabolizmasında fonksiyonu vardır. Özellikle steroid sentezi yapan adrenal kortex
hücrelerinde çok gelişmiştir. Endoplazmik retikulum lipid, protein (ribozomlar aracılığı ile)
ve kompleks karbonhidratların yapım yeridir. Endoplazmik retikulum hücredeki toplam
membranların yarısından fazlasını oluşturur. Endoplazmik retikulum iki membrandan oluşur,
iki membran arasında kalan boşluğa endoplazmik retikulum lümeni denir. İki tip
endoplazmik retikulum vardır.
•
Granüllü Endoplazmik Retikulum: Üzerinde ribozomlar vardır. Sisterna denilen
yassılaşmış keseler şeklindedir. Salgı ve zar proteinleri yapılır.
•
Düz Endoplazmik Retikulum: Ribozomları yoktur, tüplerden oluşan bir ağ
şeklindedir. Endokrin bezler ve yağ sentezinde görevlidir.
Ribozom ve diğer organellerde sentezlenen bazı maddeler ER’daki enzimlerle işlenir ve
Golgiye aktarılır.
Düz E.R. işlevi
Farklı hücre tiplerinde düz ER değişik metabolik süreçlerde görev alır. Bunlar arasında lipid
sentezi, karbonhidrat metabolizması ve ilaç ya da zehirlerin detoksifikasyonu bulunur.
Düz ER de bulunan enzimler yağ, fosfolipid ve steroid gibi farklı lipidlerin sentezinde
görev alırlar. Düz ER de üretilen steroidler ör: eşey hormonları. Karaciğer hücreleri düz ER
nin karbonhidrat metabolizmasındaki önemlidir. Karaciğer hücreleri karbonhidratı bir
polisakkarit olan glikojen şeklinde depolar. Glikojenin hidrolizi karaciğer hücrelerinden
glukoz salınmasına yol açar. Bu olay kan şekerini düzenler. Ancak glukojen hidrolizinin ilk
ürünü glukoz fosfattır. İyonik formdaki bu şeker hücreyi terk ederek kana karışamaz. Karaciğer
hücrelerinin düz ER zarı içinde bulunan bir enzim, glukozdaki fosfatı uzaklaştırır ve
serbest glukoz hücreyi terk eder.
Mikrocisimcikler : ER dan köken alırlar. Karaciğer epitellerinde ve böbrek kanallarında çok
bulunurlar. Hidrojen peroksidin yapım(ürikaz) ve yıkımını sağlayan(katalaz) peroksidaz
grubu enzimleri içerirler. Mikrocisimciklere aynı zamanda peroksizomlarda denir.
67
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.56 Golgi aygıtın hücredeki fonksiyonu
Düz endoplazmik retikülüm, karaciğer, adrenal korteks, kas, over, testis, plasenta, böbrek
ve deride bulunur. Başlıca görevleri steroid sentezi, ilaç detoksifikasyonu, glikojen ve lipid
metabolizması olan bu organel kas hücrelerinde triad ve diad yapısına katılarak kalsiyumun
depolanması ve sitoplazmaya salınması olaylarında da rol oynar.
Düz ER deki enzimler özellikle karaciğer hücrelerinin ilaç ve zehirleri detoksifiye
etmelerini sağlar.
Detoksifikasyon
genellikle
ilaçlara
hidroksilyüzeyinde
gruplarının
eklenmesi ile
• Granülsüz
endoplazmik
retikülüm
sitoplazmik
ribozomlar
gerçekleştirilir. Hidroksil
grupları
ilaçları
çözünür
hale
getirir
dolayısıyla
vücuttan
atılmalarını
içermezler.
kolaylaştırır. Kas taki ER sarkoplazmik retikulm zarı kalsiyum iyonlarını sitosolden
sisternal alana
pompalar(SERCA).
Kasdüzhücresi
bir sinir
hücresi süreçlerde
tarafından görev
uyarıldığında,
• Farklı
hücre tiplerindeki
ER değişik
metabolik
sisternedeki Kalsiyum
ER
zarını
geçerek
tekrar
sitosole
çıkar
kas
hücresinin
kasılmasını
alırlar. Bunlar arsında
tetikler.
•
Granüllü ER İşlevi
lipid sentezi (fosfolipid, steroid)
Salgı proteinlerinin yapılmasını sağlar. Granüllü ER kendi zar fosfolipidlerini yapar; ER
• Karbonhidrat
metabolizması
zarında yerleşmiş
olan enzimler
sitosolden gelen fosfolipid öncülerini biraraya getirirler. ER
zarı genişler ve transport vezikülleri şeklinde iç-zar sisteminin diğer bileşenlerine aktarırlar.
• İlaç ya da zehirlerin detoksifikasyonu bulunur.
Ribozom
Ribozom, ribozomal RNA (rRNA) ve proteinlerden oluşmuştur ve hücrenin protein sentez
yerlerine verilen addır. Virüsler hariç tüm hücrelerde bulunur. Sitoplazmada serbest veya
endoplazmik retikulum'a bağlı olarak bulunan 120-200 Å (angstrom) çapında yapılardır.
Ribozomun yaklaşık %65 kadarı rRNA, geri kalan %35'lik bir kısmı ise ribozomal
proteinlerden oluşur Ribozomlar protein sentezlerinin yapıldığı merkezlerdir. Protein
68
H A Y V A N
F İ Z Y O L O J İ S İ
sentezleneceği zaman DNA'nın yarım dizisi karşısında sentezlenen mRNA zinciri ribozomun
40S'lik küçük alt birimine bağlanır.
ŞEKİL 1.57 Ripozomda protein sentezi
ŞEKİL 1.58 tRNA
69
H A Y V A N
F İ Z Y O L O J İ S İ
Ribozomlar tek tek yahut gruplar halinde bulunurlar. Tek bulunanlara monomer ribozom,
gruplar halinde bulunanlara ise polizom veya poliribozom denir. Bunlar ayrıca hücrenin
tipi, gelişmesi ve fonksiyonuna göre ya endoplazmik retikulum'a bağlı veya sitoplazmada
serbest olarak bulunurlar. Endoplazmik retikulum'a bağlı olanlar hücre dışına verilecek
proteinleri (pankreas, sindirim enzimleri v.b) serbest ribozomlar ise hücrenin ihtiyaç duyduğu
yapısal proteinleri sentezler.
ŞEKİL 1.59 DNA üzerindeki bilgilinin protein haline gelinceye kadar değişmesiGolgi Aygıtı
Golgi kompleksi hem yapı hem de fonksiyon yönünden endoplazmik retikulum ile
yakından ilişkilidir. Bu organel birbirine paralel bir dizi membranöz kanaldan oluşur ve salgı
yapan hücrelerde iyi gelişmiştir. Golgi kompleksinin fonksiyonu endoplazmik retikulumda
sentezlenen maddelere son şeklini vermek ve bu maddeleri bir membranla
çevrelemektir. Ayrıca hücre zarının yenilenmesi ve yüzeyinin genişletilmesi görevini de
üstlenir. Uzun zaman, pek önemli bir organel olmadığı gerekçesiyle, dikkate alınmayan Golgi
aygıtı son zamanlarda hücre zarının özgüllüğünü saptamada önemli görev almaşı nedeniyle,
dikkatleri üzerine çekti. Çünkü hücre zannın özgüllüğü karbonhidratlarla saptanmaktadır
ve karbonhidratlar da Golgi aygıtı'nda sentezlenmektedir. Bazı karbonhidratların, proteinler
gibi kalıtsal denetim altında sentezlendiğine ilişkin kanıtlar vardır. Kan grupları ve
immunokimyasal incelemeler bunu göstermektedir. Protein glikosilasyonu Endoplazmik
reikülümü da başlar Golgide devam eder. Zarların protein ve fosfolipidleri de
değiştirilebilirler. Örneğin çeşitli golgi enzimleri glikoproteinlerin oligosakkarit kısımlarını
değişikliğe uğratırlar.
70
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.60 Golgi aygıtı.
Oligosakkaritlerin proteinlere eklenmesi, granüllü Endoplazmik retikülüm üzerinde protein
sentezlenirken gerçekleşir. Ortaya çıkan glikoprotein, Endoplazmik retikülünün geri kalan
kısmı ve Golgi içinden geçtiği sırada değişikliğe uğratılır.
71
H A Y V A N
•
F İ Z Y O L O J İ S İ
Hücreler tarafından salgılanan birçok polisakkarit Golginin ürünüdür.
Lizozom
Hidrolitik enzimler içeren zar ile çevrili organeldir. Asit fosfataz, esteraz, sülfataz, katepsin ve
beta-glukuronidaz gibi enzimler içerir. Lizozomlar lipoprotein yapısında bir membranla
çevrilidir. Olgunlaşmasını tamamlamış lizozomlar yani henüz bir madde ile karşılaşmamış
lizozomlara primer lizozom denir. Hücre dışından alınmış yabancı maddeyi içeren vezikülle
(fagozom) birleşmiş olan lizozomlar ise sekonder lizozom olarak bilinir. Hücre içinde
yaşlanmış ve işlevini yitirmiş organellerin unit zarla çevrilip bir primer lizozomla
birleşmesiyle otofajik vakuoller oluşur. Uzun yıllar hücrede kalan otofajik vakuoller lipofuksin
pigmenti içerirler. Primer lizozomlardan oluşan sekonder lizozomlara otofagozom denir.
Lizozomlar özellikle fagositik aktivite gösteren makrofajlarda bol miktardadır. Lizozom
membranı lizozomun hücreyi tümüyle sindirmesini önler. Hidrolitik enzimler ve lizozom zarı,
granüllü ER tarafından yapılır. Daha ileri değişiklikler için Golgi aygıtına gönderilir.
enzimlerinin 4 çeşit etki tarzı vardır;
•
Lizozom sia
1) Akyuvar ve makrofajler doku harabiyeti olan yere hücum ederler. Burada lizozomlar
hücre içine alınan partikülleri sindirirler.
•
galaktoz,
2) Otofaji; yaşlanmış organellerin yıkımı ve açlık hali
•
hyalüronik a
3) Otoliz; hücrede tamir işlevi durunca ve ölüm hali. Putrifikasyon birdenbire oksijensiz kalan
hücrede lizozom membranı yırtılır. Bazı hücre zehirleri aynı durumu yaratır. Hücrenin
kendisi ve civar dokular parçalanır.
•
kondroitin s
4) Tiroid bezi hücrelerinden hormon salınma mekanizması.
ŞEKİL 1.61 Troid hormonun sentezi ve kemik yıkımda lizozom
Lizozom enzimleri daha çok hafif asidik ortamlarda etkendir. Hücrede birçok işlevinin yanısıra,
bozukluklannda bazı hastalıkların ortaya çıkmasına neden olurlar. Örneğin, soluduğumuz
havadan alınan karbon parçacıkları, akciğerimizdeki fagositlerde yıllarca kalmasına karşın,
silisyum dioksit, fagositlerin lizozomuna girer ve oranda bulunan enzimlerin etkisiyle,
kristallerinin üzerinde silisik asit oluşur. Silisik asidin hidroksil grupları, hücre zarının
yapısında bulunan fosfolipit ve proteinlerin bazı gruplarıyla çok sıkı hidrojen bağları kurar.
72
H A Y V A N
F İ Z Y O L O J İ S İ
Böylece hücre ve lizozom zarları zedelenir. Ayrıca silisyum dioksit taşıyan fagositler hücre
dışına bir madde salgılarlar. Bu madde, özellikle akciğerdeki bağ dokunun bir çeşit fibröz dokuya
dönüşerek esnekliğin yitirmesine neden olur. Bnezer olarak aspest kristalleri benzer durumu
oluşturur, özellikle mezotelyum (vücut boşluğunu astarlayan zar) kanserlerini meydana
getirir.
Vitamin A zehirlenmesine bağlı lizozom membran hasarı
Yüksek seviyede alınan A vitamini lizozom membranı etkiler ve membranı bozar. Deney
hayvanlarında kemik ve kıkırdak dokuda lizozom enzimleri serbest kalmakta, bu nedenle
kemikler kolayca kırılmaktadır.
ŞEKİL 1.62 ROS hücre membranı üzerindeki etkisi
A vitamini lizozom membranını zayıflatır, ancak kortizon ise daha stabil hale getirir. Kortizonun
yangı olayını azaltması veya durdurması, lizozom membranı üzerinde olan etkisi ile izah
edilebilir. Lizozomlar kendi hücresi içerisindeki bazı maddeleri ya da organelleri (çoğunluk
işlevlerim bitirmiş ya da bozulmuş) de sindirir. Sindirim kofullarının içinde ribozom ve
mitokondrilere rastlanır. Fazla A vitamininin kemiklerdeki ve kıkırdaktaki lizozom
enzimlerim serbest bıraktığı ve dolayısıyla kemikleri kırılır bir duruma geçirdiği; fakat yeterli
miktarlarda da yaşlı hücreleri yok etmeyi sağladığı için genç kalmada yardımcı olduğu
saptanmıştır.
73
H A Y V A N
ŞEKİL 1.63
F İ Z Y O L O J İ S İ
A vitaminin yapısı .
Kanser ve lizozom
Silika ve asbest tozlarının uzun süre solunum havası ile alınmaları sonucu silikozis ve asbestos
hastalıkları meydana gelmektedir. Asbest partiküllerine maruz kalmada bazı tür kanserlerin
görülmesi, lizozomlar ile bu tür kanserler arasında bir ilişki olabileceğini
düşündürmektedir. Fagositlerin ölümü, kollajen fibrillerini sentezleyen ve salan
fibroblastlarda başka bir reaksiyona sebep olarak fibröz doku yapımını kamçılamaktadır.
Lizozomlar ve Gut hastalığı
Gut, Metabolik bir bozukluk nedeniyle mono-sodyum ürat kristallerinin oynak yerlerinde
toplanması sonucu ortaya çıkan bir hastalıktır. Sodyum ürat kristalleri fagositler tarafından alınır.
Bu hastalıkta lizozom enzimleri serbest kalmakta GUT hastalığında görülen ağrı ve
yangı olayları lizozomlardan ileri gelmektedir. Kanda ürik asit miktarı artar, eklem yerlerinde
ürik asit kristalleri toplanır. Bu kristaller plazma kininlerini aktive eder. Plazma kininleri ağrı
meydana getiren kimyasal maddelerdir.
Lizozomlar ve Yangı
Kızarıklık, Sıcaklık, Şişlik, Ağrı ile kendisini gösteriri, Yangılı doku ve hücrelerden kapiler
permeabilitesini arttıran histamin, seratonin ve bradikinin gibi maddeler açığa çıkar.
Bradikinin serum proteinlerinin enzim etkisi ile parçalanması sonucu meydana gelen bir
peptiddir. Yangıdaki doku tahribi bradikinin şekillenmesi lizozom proteazları tarafından
yapılmaktadır.
Lizozomların işlevi;- dokuların gerilemesi
Aktivitesi azalan dokuda lizozomal aktivite artar; -gebelikten sonra uterusun gerilemesinde,
sütten
meme bezinin
• kesince
—hücrelerin
otoliziküçülmesinde ve çalışmayan kasların atrofisinde lizozom
görev alır.
•
—hücresel sindirim işlevi
Peroksizomlar Çeşitli substratlardan O2’e H+ aktararak, yan ürün olarak H2O2 oluşturan
enzimler içerirler. Hücre için zehirli olabilecek maddeleri oksitleyerek zehirsiz hale getirirler. (örn.
•
—yumurtanın döllenmesi
alkol) H2O2’ in fazlası hücre için toksiktir. ve bunu katalaz enzimi parçalar. H2O2- Katalaz
enzim sistemi; hücredeki zararlı molekülleri oksitleyip etkisiz kılar.
•
—corpus luteum dejenerasyonu
74
H A Y V A N
F İ Z Y O L O J İ S İ
Mitokondri ve Enerji Üretimi
Hücrenin ihtiyaç duyduğu ATP’nin sentezlendiği yerdir. Mitokondri hücrede kendini
bölünerek yenileyebilen tek organeldir. Mitokondri iç zarı kristalar oluşturmak üzere katlantılar
yapmıştır. İç membran yarı geçirgen yapıdadır. Iç zarda fosforilasyon enzimleri, elektron
transport sistemi bulunur. Matrikste kalsiyum içeren yoğun matriks granülleri bulunur.
Mitokondriumda A, C ve E vitaminleri bulunur. Mitokondride TCA enzimleri bulunur. (amorf
matrikste) Membran vezikül ve vakuol gibi üç farklı komponentten oluşmuştur. Intraselüler su
miktarının ayarlanmasında görev alırlar. Belirli hücre ürünlerinin sindiriminde görevlidir. Hücre
solunumun yapıldığı merkezlerdir. Hücrenin ATP üretim yeridir. Yani enerji santralidir. Bu
organelde birim zar ile çevrilidir. İçteki zar kıvrımlıdır. Bu kıvrımlara “krista” denir.
Mitokondrinin kendine ait DNA, RNA, ETS (elektron taşıma sistemi) ve ribozomu vardır.
ETS’ si olduğundan kendi enerjisini üretir.
Lenfosit ve epitelyal hücrelerde az sayıda mitokondri bulunurken, midenin parietel hücreleri,
böbrek tübül hücreleri, karaciğer hücreleri ve adrenal korteks hücreleri gibi yüksek
metabolik aktiviteye sahip hücrelerde bol miktarda bulunur. Örneğin bir karaciğer
hücresinde (hepatosit) 2000–3000 adet mitokondri bulunabilir.
ŞEKİL 1.64 Mitokondri ve ATP sentezi.
Mitokondri DNA’ sı olduğundan kendini eşleyebilir. Ayrıca mitokondri oksijenli solunumun
yapıldığı yerdir. Oksijenli solunum sayesinde ATP üretilir. Hücre için gerekli enerjinin
(ATP) elde edildiği organeldir. Kendi DNA, RNA, ribozom ve proteinleri olan
mitokondri, kendisi bölünerek yenilenebilen tek organeldir. Mitokondride iç ve dış olmak
üzere çift ünit zar vardır. Fosforilasyon enzimleri, elektron transport işlemi iç zar (kristalar.
yağ asitleri karnitin aracılığıyla buraya geçer) üzerinde yerleşmiştir. Bu nedenle yapısında
en çok protein olan membran mitokondri iç zarıdır (Lipit/protein oranı en yüksek yapı
miyelin kılıftır). Matrikste ise kalsiyum içeren yoğun matriks granülleri izlenir. TCA
siklusu enzimlerinden sadece süksinat dehidrogenaz iç zarda yerleşmiştir. Mitokondrinin
biyokimyasal markerı glutamat dehidrogenazdır (matriks enzimi). P53 geninin bax protein
ürünü mitokondri iç zarında kanal oluşturur. Matrikste bulunan sitokrom C bu kanaldan
sitoplazmaya çıkar. Sitokrom C apopitozisi başlatan enzim olan caspase’ı aktive eder.
Caspase (C-cysteinn, asp-aspartat, ase) enzimi proteinleri sistein ve aspartat
rezidülerinden parçalar. Apopitozis gerçekleşmiş olur.
75
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.66 Enerji üretimi
Kemoosmotik Atp sentezi
Kemiosmoz; iyonların, elektrokimyasal gradyanı azaltmak için seçici geçirgen bir zardan
geçme hareketidir. Hücresel solunumdaki ATP sentezinin gerçekleşmesini sağlayan
enerjinin büyük bir kısmı hidrojenlerin yaptığı bu hareketten karşılanır. İyonlar şekildeki
gibi bir kanaldan geçirildiğinde, sahip oldukları potansiyel enerji, kimyasal reaksiyonları
gerçekleştirmek için kullanılabilir. Hidrojen iyonları (protonlar) proton konsantrasyonun
yüksek olduğu yerden düşük olduğu yere doğru difüzyon hareketi yaparlar.
ŞEKİL 1.67
ATP.
ATP-sentaz kemiosmoz aracılığıyla ATP sentezleyen enzimdir. ATP-sentaz protonların
zardan geçmelerine imkan vererek; protonların sahip oldukları kinetik enerjiyi, ATP
fosforilasyonu yapmak için kullanır. Bu mekanizmayla ATP üretimi kloroplast ve
mitokondrinin yanı sıra bazı bakteri türlerinde de görülür.
76
H A Y V A N
ŞEKİL 1.68
F İ Z Y O L O J İ S İ
Farklı organellerde ATP sentetazi yapılması.
Hücre iskeleti Görevi
Hücre iskelteinin görevi hücreye desteklik ve şekil vermektir. Hücre iskeletinin temel işlevi çeşitli
şekillerdeki hücre hareketini meydana getirmektir. Bunun dışında hücre içinde motor
proteinlerin organelleri taşıması için bir yol oluşturmak hücre iskeletinin diğer görevidir.
ŞEKİL 1.69
Hücre iskeleti elemanları.
Mikrotübüller ve mikrofilamentler küresel proteinlerden oluştukları halde ara filamentler
fibrilsi proteinlerden oluşur. Mikrotübüller 240 A° çapında, mikrofilamentler 70 A°,
77
H A Y V A N
F İ Z Y O L O J İ S İ
ara filamentler ise 100 A° çapındadırlar. Mikrotübül ve mikrofilamentlerin tek alt
birimi olduğu halde ara filamentlerin 5 farklı alt birimi vardır. Mikrotübüller ve
mikrofilamentler polimerizasyon için enerjiye ihtiyaç duydukları halde ara
filamentler enerji ihtiyacı duymazlar.
İntermedial Filamentler
Vimentin, proteinlerin ara filaman (intermedial filament) ailesinin bir üyesidir. Ara filamanlar,
ökaryotik hücrelerde mikrotübüller ve aktin mikrofilamanlarıyla beraber, hücre iskeletine
oluşturur. Çoğu ara filamanın yapısı kararlı olsa da, vimentin değişken bir yapıya sahiptir.
Vimentin organellerin yerini sabitlemeye yarar, hücreye esneklik sağlar ve hücre içinde
kolesterol taşınmasında rol oynar. Vimentin ve mikrotübüller arasında sıkı ilişkiler vardır.
İntermedial filamentler kontraktil olmayan, bulunduğu hücreye desteklik eden filamentler. Ara
filamentler çapları 10-12 nm arasında değişen heterojen bir gruptur. Dayanıklı, devamlı
fibriller olup elektron mikroskopta düz veya hafifçe bükülmüş şekilde görülürler.
Ara filamentlerin 5 ana grubu vardır:
1.Sitokeratinler (cytokeratin veya prekeratin)
Mikrofilamentler
2.Vimentin 7 nm çapında sert çubuklar halinde bulunur. Aktin moleküllerinden meydana
Mikrofilamentler
3.Desmin
(Skeletin),
gelmişlerdir. Bir
mikrofilament aktin alt birimlerinden oluşmuş ve birbiri üzerine sarılmış iki
4.Glial
fibriler
protein
(GFAP,
Glial fibriller)
ve İki önemli görevleri vardır, birincisi
zincirden meydanaasidik
gelir. Tüm
ökaryotik
hücrede
bulunurlar.
5.Nörofilamentler.
hücre
hareketini gerçekleştirmek ikincisi ise hücre şeklini korumak.
Mikro filamentler değişik uzunlukta olabilen kontraktil protein iplikciklerdir. Hemen bütün
hücrelerde bulunurlarsa da özellikle kas hücrelerinde çok miktarda bulunurlar (myofilament).
Kas hücrelerindeki kasılma fonksiyonu aktin (actin) ve miyozin (myosin) arasındaki
ilişkiye bağlıdır. Aslında “mikrofilament” terimi özellikle 6-8 nm kalınlığında aktin için
uygun bir terimdir. Miyozin 15 nm kalınlığındadır ve kasın kalın miyofilamenti diye
isimlendirilir. Kalın bir miyozin filamentinde 500 kadar miyozin başı vardır ve bunlar saniyede 510 defa aktin bağlayıp bırakabilir. Kas hücreleri dışındaki bazı hücrelerde aktin total
proteinin %10’unu teşkil edebilir. Kas hücrelerindeki aktinin yapısı stabil iken diğer hücrelerde
aktin parçalanıp yeniden yapılabilir. Mikrovillus içindeki filamentler aktin yapısındadır.
Bunlar apikal sitoplazmadaki terminal ağlara tutunur ve kontraksiyonla mikrovillusda
kısalma veya bükülmeye yol açarlar. Birçok hücrede plazmalemma altında ince bir tabaka
oluşturan mikrofilamentler hücre membranının lokal hareketinde (örneğin fagositozisde) rol
oynarlar. Mikrofilamentlerin sitoplazmik komponentlerin hareket ve hücre içi yer
değiştirmelerinde (sitoplazmik akıntı) rolü olduğuna da inanılır. Mitozda hücrenin ikiye
bölünmesine de katkıda bulunurlar
78
H A Y V A N
F İ Z Y O L O J İ S İ
Mikrotübüller
Tüm ökaryotik hücrelerde bulunurlar. İçleri boş olan tübül duvarı, tübilin adı verilen globüler
proteinlerden meydana gelmişlerdir. Hücre iskeletini oluşturmakla birlikte hücre içeride
organellerin taşınması, kamçı ve sil yapısının meydana getirilmesi, sentrozomları
oluşturmaları gibi birçok görevleri vardır.
ŞEKİL 1.69
Kamçı hareketi .
• Dynein aksonal iletide retrograt iletimden sorumludur (içi boş vezikülü taşır).
• Kinezin aksonal iletide anterograt iletimden sorumludur (içi dolu vezikülü taşır).
Hücre iskeleti deformasyona karşı hücre şeklini korunması sağlar ve mekanik direnç kazandırır;
Hücre iskeleti HDM ile hücre arasında iletişim sağla böylece hücre ve hücrenin çevresini deforme
ve hücreler göçü düzenlener. Hücre iskeleti hücre sinyal yollarında görev alabilir. Bu yolla hücre
dışında madde alınması (endositoz ;)yada hücre bölünmesinde kromozomlarını hareketinde ve
sitokinez - ana hücrenin iki kardeş hücreye bölünmesinde görev alabilir. Ayrıca, hücre zarından
yapılan flajeller, kirpikler, lamellipodia ve podosomes oluşturulmasında görev yapar.Hücre iskeleti
tarafından gerçekleştirilen diğer önemli bir işlev kas kasılmasıdır.
Dynein silya yapısı içerisinde hareketi sağlar. Kinezin ise aktif hareket yapan silyanın
kollarının eski hâline gelmesini sağlar. Dynein genetik olarak eksikse Kartagener sendromu
oluşur. Dynein hareket ettirir. Kinezin eksi konumuna getirir. Dynein ve Kinezin Her ikisinin
de ATPaz aktivitesi var. Dynein retrograt iletimden sorumlu – kutba doğru Kinesin antegrat
iletimden sorumlu + kutba doğru Dynein silya yapısı içerisinde hareketi sağlar. Kinezin ise
ise aktif hareket yapan silyanın kollarının eski haline gelmesini sağlar.
79
H A Y V A N
F İ Z Y O L O J İ S İ
Mikrotüpüllerin başlıca görevleri
1.Mitoz bölünmede: Sayıca artan mikrotubuluslar, hücrenin iki kutbu arasında yerleşerek iğ
iplikçiklerini oluştururlar. Kromozomların kutuplara çekilmesinde katkıları vardır. Bölünmeden
sonra mikrotubullerin çoğu kaybolur.
2. Yeni sil ve flagellum yapımı: Sentriol yeni silin gelişeceği yüzeye göç ederek sillerin başlangıç
yeri olan bazal cisimleri oluşturur.
3. İletim: Sinir hücrelerinde akson boyunca ilerleyen nörotubuluslar hücre içi madde iletiminde
görev alırlar.
4. Hücre iskeletini oluşturur. Hücre iç yapısına desteklik ederek, belli bir biçim ve dirilikte
kalmasını sağlar.
5. Hareket: Silya ve flagellumun yapısına girerek hareketlerine katkıda bulunur.
6. Salgı atılması ve intrasellüler organel taşınması: Sentezlenen salgı maddelerinin hücre
yüzeyine doğru hareket ettirilmesinde rolleri vardır. Kromozomların iğ iplikçiklerine hareketi,
melanositlerde melanin pigmentinin sitoplazmik uzantılara göçü ve ER’dan Golgi
aparatına taşıyıcı veziküllerin ilerlemesi mikrotubul ağının fonksiyonuyla bağlantılıdır.
İntermedial filament
Bunlar mikrofilmentlerden daha kalın, mikrotübüllerden ise daha incedir. Görevleri arasında,
Hücre biçimlerini güçlendirme, organellerin hücre içerisindeki yerlerini sabitleme gibi
görevleri vardır. Mikrofilamentler iskelet kasında: kas kasılmasında, Hücre korteksinde:
membran hareketinde, hücrenin yer değiştirmesi, endositoz, ekzositoz Hücre yüzey
farklılaşmasında: Mikrovillusların yapısında (villin, fimbrin) mitozda görev alır.
Sentrozom
Sentrozomlar sentriyol çiftlerinden meydana gelmişlerdir. Her bir sentriyol dokuz adet üçerli
mikrotübülHücre bölünmesi öncesinde eşlenerek iki çift olurlar ve mitoz bölünme sırasında
karşı kutuplara giderek kromozomların tutunup çekileceği iğ ipliklerini meydana getirirler
(9+3).
ŞEKİL 1.70 Sentrozomların yapısı
80
H A Y V A N
F İ Z Y O L O J İ S İ
Kamçı ve Siler
Siller ve kamçılar hücrelerin hareketini sağlarlar. Siller daha kısa ama çok sayıda hücre
yüzeyinde bulunurlar. Memelilerin solunum organlarındaki hücrelerin silleri tozların
tutulmasını sağlar. Kamçı ise hücrelerde bir yada iki tane olur ve sillerden daha uzundur. Sil
ve kamçıların yapısında mikrotübüller vardır (9+2).
Hücre iskeleti ve hareket
Hücrede 2 hareket sistemi vardır (Motor Sistemleri ):
•
Aktin-tabanlı motilite: miyosinler
•
Tübülin tabanlı motilite: kinesinler ve dyneinler
Dynein: ATP enerjisini mekanik enerjiye harekete dönüştüren (aynı zamanda motor molekül
olarak da adlandırılır), bir motor proteindir. Dynein genellikle hücre merkezine yönelen
mikrotübülün arasında eksi sonuna doğru sitoskeletal mikrotübüllere boyunca "yürüme" ile
çeşitli hücresel kargoları taşır. "eksi uç yönelen motorlar" olarak bilinir. Bu tür taşıma
retrograd nakil olarak bilinir. Bunun aksine yönünde ise, mikrotübüle 'artı ucuna doğru
hareket sağlayan motor proteinler kinesinlerdir, Kinesinler uça yönelik motorlar proteinler
olarak adlandırılır.Dyenin farklı memeli hücre tiplerinde vardır, solunum yolu epitel
hücrelerinde ve sperm hücrelerindeki hareketli kirpikler ya da flagella'yı bulunur.
Kinesinler, siliyer / kamçılı ucuna doğru axonemal mikrotübül boyunca parçacıkların
taşınmasını yapar Sitozolik dyneins geri sitozolüne doğru axonemal taşıma yapar.
Memlilerde en azından 40 farklı kinesin geni belirlenmiştir.
Çekirdek (Nükleous)
Çekirdek nükleus membranı, kromatin, çekirdekçik, nükleoplazma içerir. Nükleus
membranı iki paralel ünit zar ve bunların arasında yer alan perinükleer sisternadan
oluşmuştur. İnsanda en büyük nükleus spinal ganglion ve oosit de bulunur. Karaciğer,
kıkırdak, epitel hücreleri, vesica urineria ve leydig hücrelerinde iki tane nukleus olabilir.
81
H A Y V A N
F İ Z Y O L O J İ S İ
İç ve dış membranlarının birleşme yerlerindeki porlar 500 Ao çapındadır. Porlar nükleus ve
sitoplazma arasında madde alışverişini sağlar. Bazı bölgelerde nükleus dış membranı ER ile
devam eder. Membrana nuklearis externa'da ribozomlarda bulunabilir. Çekirdek nükleer DNA
taşır. DNA molekülü aşırı derecede kıvrılarak ve proteinlerle birleşerek kromatin adı
verilen yapıyı oluşturur. Bu yapı hücre bölünmesine girerken daha da kısalır ve kendini eşleyerek
kromatid adı verilen yapıya dönüşür. Bir metafaz kromozomu böylece kendini eşlemiş bir
çift kromatid den meydana gelir. Bunlara kardeş kromatidlerde denir. Genetik açıdan
birbirlerinin aynısıdırlar ve aynı DNA nükleotid sırasına sahiptirler.
ŞEKİL 1.71
DNA yapısı ve paketlenemsi .
DNA molekülü kromatin haline gelebilmesi için histon adındaki proteinlerce
paketlenmesi gerekir. Histonlar, çoğunlukla ökaryotik hücrelerde bulunan, küçük molekül
ağırlıklı, bazik proteinlerdir. Lizin ve arginin içeriklerine göre, H1 (H5 de denir), H2A,
H2B, H3, H4 ve arkeal histonlar olmak üzere 6 tiptir. Kromatin yapısında DNA,
DNA'nın iki katı kadar protein bulnur. Hücre çekirdeğindeki bu proteinler, asidik özellikte
"histon olmayan" ve bazik özelikte "histon" tipi proteinlerdir. Bir farenin karaciğer
hücresinde yapılan araştırmaya göre hücre çekirdeğindeki proteinlerin %11'i histon %19'u
histon olmayan proteinlerden oluşmaktadır. Spermde histonlar "protamin" adını alır.
Histonlar molekül ağırlığı küçük moleküllerdir. Ökaryotların tüm soma ve eşey
hücrelerinde bulunan histonlar, genelde türler arasında benzer tiptedir. Histon protein tipleri
elektroforez yöntemleriyle kolayca ayrılabilir. Çekirdekçik(nükleous) Ribozom
sentezlemekle görevlidir. Protein sentezi çok olan hücrelerde, çekirdekçik sayısı da
artmaktadır. Hücre bölünmesi sırasında eriyerek kaybolur, bölünme tamamlandıktan sonra
tekrar oluşur. Nukleolus bir yapı değildir sadece görünür kısımdır.
Çekirdek zarında, zarların birbirine temas ettiği bölgelerde 400–1000 Angstrom çapında
annulus adı verilen porlar meydana gelmiştir. Böylece nukleus membranı aracılığı ile
nukleoplazma ve sitoplazma sürekli ilişki halinde olup bu porlardan RNA molekülleri,
polipeptidler, tuzlar, enzimler, koenzimler, ATP ve şekerler rahatlıkla geçebilirler.
Sitoplazmada bulunan birçok organel ve çekirdek zarı mikrotübülüsler aracılığı ile
sürekli bağlantı halindedir. Nükleus membranı, mitoz bölünmenin profaz evresi
sonunda kaybolur, bölünmenin tamamlanmasından sonra yeniden oluşur.
82
H A Y V A N
F İ Z Y O L O J İ S İ
NÜKLEOTİD
Azotlu organik baz
PÜRİN
-Adenin (A)
-Guanin (G)
PİRİMİDİN
-Sitozin (S=G)
-Timin (T)
-Urasil (U)
5 C’lu Şeker
-Riboz
-Deoksiriboz
Fosforik asidin
fosfor grubu
H3PO4
Nükleik asitler, tüm hücrelerin nukleus ve sitoplazmalarmda (mitokondri ve bitkilerde
kloroplast) bulunurlar ve;- DNA (Deoksiribonükleik asit) - RNA (Ribonükleik asit)
olmak üzere iki tiptedirler. Her iki nükleik asit de nükleotidlerin polimerize olması ile
meydana gelir ve yapılarında;
• Şeker
• Fosfat
• Baz ünitelerini bulundururlar.
ŞEKİL 1.71 Pürin ve primdin bazları
DNA da 5 karbonlu şekerlerden (pentoz) deoksiriboz bulunur. Deoksiribozun 1.
Karbonuna glikozid bağ ile tutunmuş bazlar pürin ve pirimidin olmak üzere iki tiptir.
Pürin bazları adenin (A) ve guanin (G), Pirimidin bazları ise sitozin (C ) ve timin
(T) dir. DNA da bulunan bazlar kantitatif olarak Edwin Chargaff tarafından
incelenmiş olup adenin miktarının timine, guanin miktarının ise sitozine eşit olduğu
görülmüştür. Chargaff kuralı olarak bilinen bu kural; kısaca A=T ve G=C olarak
özetlenebilir. Adenin ile timin arasında iki, guanin ile sitozin arasında üç adet hidrojen (H)
bağı bulunur. Deoksiribonükleik asidin çift iplikli yapısına Watson-Crick sarmalı (doubleheliks) adı verilmektedir. 20 Angstrom çapındaki sarmalda bazlar 3.4 Angstrom aralıklarla
sıralanmıştır ve sarmal her 10 bazda bir dönüş yapar. Sarmaldaki iplikler antiparalel olup
bir iplik 5’—>3', diğer iplik ise 3'—>5' yönündedir. Şeker ve fosfat omurgasından
oluşan iplikler birbirlerine hidrojen bağları ile zayıf olarak bağlanmışlardır. Omurga
oluşturulurken şekerin 5 numaralı karbonuna bağlı fosfat grubunun hidroksili ile diğer
nükleotiddeki şekerin 3' karbon atomuna bağlı hidroksil grubu arasında bir fosfodiester
bağı oluşur.
83
H A Y V A N
F İ Z Y O L O J İ S İ
ŞEKİL 1.72 Kodon ve antikodon eşleşmesi ve DNA yapısı
84
H A Y V A N
F İ Z Y O L O J İ S İ
Bölüm
2
Uyarılabilir Dokular Sinir ve
Kas sistemi
Uyarılabilen, uyarı taşıyan, uyarıya karşı tepki veren dokular Uyarılabilir
dokulardır. Reseptörler oluşturulan aksiyon potansiyeli Merkezi sinir
sistemine ileten sinir sistemi ile MSS gelen bilgiler ile hareket eden kas
sistemi bu bölümde yer almaktadır.
Sinir sistemi
Tüm canlılar herhangi bir uyaran karşı cevap verme yeteneğine sahiptirler. Bu uyaranlar ya dış
ortamdan gelir yada canlının kendi iç ortamında meydana gelebilir. Hayvanları bitkilerden
ayıran en önemli özellik uyaranlara çok hızlı cevap vermesidir. Bu da sinir sistemi ile
gerçekleşir. Sinir sistemi çevrenin, mekanik, termal, kimyasal ve elektriksel özelliklerini
algılar ve bunlara karşı cevaplar oluşturur. Bu ilişkide sözü edilen çevre sinir sisteminin kendisi
dışındaki her şeydir. Tek hücrelilerde bütün bu olaylar tek bir hücre içinde meydana gelirken,
çok hücrelilerde bu fonksiyonların her birini yapmak için özelleşmiş hücre ve hücre grupları
bulunmaktadır. Çok hücreli gelişmiş canlılarda bu 4 komponentten herbiri için özelleşmiş bir
hücre ya da organ vardır.
1-Uyarılabilme: Yeteneğine sahip Yani uyarı alabilen reseptörler bulunur. Ör: göz retinası
reseptörleri
Bu organ kas, bez ve hatta sinir sisteminin diğer kısımlarıdır. Effektör organ gelen sinyale
göre
aktive ya da meydana
inhibe edilir.
gözün retinasında
ışıksinirleri
dalgalarından
etkilenen
2- Reseptörde
gelenÖrneğin,
sinyali merkezlere
ileten duyu
conductivite
işinireseptör
yapan
hücreler
vardır.
Reseptörlerde
meydana
gelen
sinyali
ileten
duyu
sinirleri
iletim
işini
özel hücrelerdir.
yapan özel hücrelerdir. Uyarılabilir doku ve hücreler:
3-Sinir merkezleri, buraya getirilen sinyali değerlendirip canlının ne yapması gerektiğini
saptar (correlation).
• Sinir hücreleri
4-Cevabın gerçekleştirilmesi için merkezden gerekli sinyaller motor sinirler yoluyla iş görecek
• (effektör
Kas hücreleri
(kalp,götürülür.
iskelet veÖzelleşmiş
düz kas) effektör hücreler reaksiyon (reaction)
organa
organa)
gösterirler.
• Bazı endokrin (hipofiz, pankreas beta adacık hücreleri, adrenal bez medulla
hücreleri) bez hücreleri
•
Bağışıklık sistemine ait bazı hücreler (makrofaj ve nötrofiller)
•
Üreme sistemine ait bazı hücreler (fertilize yumurta)
85
H A Y V A N
F İ Z Y O L O J İ S İ
Nöron
Sinir hücresine nöron adı verilir. Evrimi biraz daha ilerlemiş sinir sisteminde uyarma ile
meydana gelen sinyalin iletiminde iki ayrı iletici (conductor) hücre vardır. Birinci nöron
reseptörden sinyali alır, belirli bir yere kadar götürür; ikinci nöron ile ağlantı kurar ve bu ikinci
nöron sinyali effektör organa iletir. Burada birinci kondüktor nörona sensorik nöron (duyu
nöronu) denir ki duyuları ileten nörondur; ikinci nörona motor nöron denir ki bir effektörü
harekete geçiren nörondur. Bir omurgalı spinal motor nöronu fonksiyonel olarak özelleşmiş
bölgeler içerir. Bilgi akımı dendritlerden akson ucuna doğrudur. Bazı nöronlar bilgiyi hücre
gövdeleriyle alırlar. Alınan bilgi nörotransmiterlerle akson terminallerine taşınır ve böylece
sinyal iletilmiş olur. Bir Nöron hücresinde nörofilamanlar, nörotubuluslar bulunur. Bu
yapılan dyenin ve knesin aracılığı akson ucunda salgılanan nörotrasmiteri taşır.
ŞEKİL 2.1
Nöronda nörotransmitter madde taşınması
Bir nöronda temel olarak 3 kısım vardır :
Hücre gövdesi
Dendrit
Akson
Gelişmiş canlılarda sinir sisteminde duyu ve motor nöronlar arasında association
nöron(internöron=ara nöron) lar yer almıştır. Ara nöronlar sayesinde bir tek reseptörden
alınarak duyu nöron ile iletilen sinyal, çeşitli motor nöronlara ve çeşitli effektör organlara
doğru yönetilir. Burada ara nöronlar ve motor nöronlar beraberce nöronlar topluluğunu
(ganglion) meydana getirmişlerdir ki bu sinir merkezlerinin ilk taslağıdır.
Nöronlar MSS’ndeki hücrelerin yaklaşık %10’unu oluştururken, geriye kalanını nöroglia da
denen (glia=tutkal) glial hücreler oluşturur. Bunula birlikte, nöronlar, glial hücrelerden çok
daha fazla dallanma yaptıkları için, nöronlar beyin ve omurilik hacminin %50’sinden
fazlasını işgal ederler. Glial hücreler nöronun soma, akson ve dentritlerinin etrafını
çevreler ve nöronları fiziksel ve metabolik olarak desteklerler. Oligodendrositler,
astrositler, mikroglialar ve epandimal hücreler olmak üzere 4 çeşit glial hücre vardır.
• Oligodendrositler: MSS’nde aksonları kaplayan miyelini yapar (PSS’nde bu işi yine
bir nöroglia hücresi olan Schwann hücresi yapıyor).
• Astrositler: (1) sinaps etrafındaki sinirsel iletim maddelerini ve potasyum iyonlarını
uzaklaştırarak, MSS’ndeki hücre dışı ortam sıvısının içeriğinin
düzenlenmesine yardım eder. (2) kapiller duvarını oluşturan hücreler arasındaki sıkı
bağlantıların oluşumunu yani kan beyin bariyerinin oluşumunu uyarmaktır.
86
H A Y V A N
•
•
F İ Z Y O L O J İ S İ
(3) glikoz sağlayıp amonyağı uzaklaştırarak, nöronlara metabolik destek
sağlar. (4) embriyonel gelişim sırasında nöronların son olarak yerleşecekleri yere göç
etmesine rehberlik eder ve büyüme faktörleri salgılayarak nöronal gelişmeyi
uyarırlar. (5) pek çok nöron benzeri özelliğe de sahip olup, iyon kanallarına belirli
sinirsel iletim maddelerinin reseptörlerine ve bunları işlemek için enzimlere,
zayıf bir elektriksel yanıt oluşturma yeteneğine sahiptirler.
Mikroglialar: MSS’nde immün işlevleri gerçekleştiren makrofaj benzeri
özelleşmiş bir hücredir.
Epandimal hücreler: beyin ve omurilik içinde sıvı bulunan boşluklarda
bulunurlar ve BOS oluşumunu ve akışını düzenlerler.
ŞEKİL 2.2
Nöronlara yardım(fizyolojik ve metabolik destek yapan) eden diğer hücreler.
Aksonlar iki tipe ayrılır:
Miyelinli
aksonlarda aksolemma üzerini miyelin denilen lipoid
1-Miyelinli akson
tabiatında
kalınca bir örtü çevreler. Miyelin örtüsü akson boyunca
2-Miyelinsiz akson
belirli aralıklarla kesintiye uğrayarak boğumlar meydana getirir. Bu
boğum yerlerine ranvier boğum denir. Aksonun miyelin kılıfı, periferik
sinir sisteminde düzenli aralığa sahip, dar ve halka şeklinde boğumlanmalar Bu boğumlar,
“Ranvier Düğümü” İki düğüm arasında kalan bölge, “internodal bölge” Bu bölgede, sadece
bir tek Schwann hücresi bulunur. Düğümler arası bölgelerin uzunluğu, fetüste ve bebekte
azdır, yaşla birlikte artar Ranvier düğümlerinin bulunduğu bölgede, miyelin kılıfı kesintiye uğrar.
Dolayısıyla, buralardan madde alış-verişi gerçekleşir (Miyelin, madde alış-verişini
engelleyici bir kılıftır). Miyelinli sinir tellerinde uyarının hızlı iletilmesinin iki sebebi vardır:
Miyelin kılıfın izole edici özelliği ve uyarının, Ranvier düğümleri boyunca atlayarak
aksonda saltatorik şekilde iletilmesi. Miyelin kılıfının, sinir tellerinin yenilenmesinde de
önemli rolü vardır. Bir sinir teli kesilince, kesilme yerinden çevreye doğru önce miyelin kılıfı
meydana gelir. Yenilenen akson, bu kılıfı takip eder. Miyelin kılıfı, akson için klavuzluk yapar.
Yenilenmenin gerçekleşebilmesi için, nöronun hücre gövdesinin sağlam olması şarttır. Hücre
gövdesi zedelenmiş ve ölmüş olan bir nöronun aksonunda, yenilenme olayı da
gerçekleşmez. Miyelin kılıfının uyarı iletiminde önemli rolüne karşılık, besin fizyolojisi
87
H A Y V A N
F İ Z Y O L O J İ S İ
bakımından bunun tersi sayılabilecek bir etkisi vardır. Miyelin kılıfında lipit bulunduğu için,
besin maddelerinin aksona geçişi zor olur. Bu durum özellikle kalın miyelin kılıflar için daha
da önemlidir. Gerek Ranvier düğümleri ve gerekse Schmidt – Lantermann yarıkları, miyelin
kılıfının kesintiye uğradığı veya azaldığı bölgelerdeki madde alış-verişinin sağlandığı kısımlardır. Bu
açıklıklar, aksonla çevresi arasındaki bağlantı bölgeleridir. Gaz, metabolitler ve besin
maddeleri, aksoplazmaya bu yerler aracılığıyla girip çıkar.
ŞEKİL 2.2 Myelinli nöron
Elektrofizyolojik çalışmalarda, uyarının kalın miyelinli aksonlarda bir Ranvier düğümünden
diğerine atlar. Bu tür uyarı “Saltatorik Akım” denir. Mitokondriyonların Ranvier düğümlerinde
bol olarak bulunmasının sebebi taşınma olayları için ihtiyaç duyulan enerjinin bu organellerce
karşılanmasıdır. Miyelin tabakasının üzerini nörolemma denen membran çevreler. Bu membranı
schwan hücreleri meydana getirir. Schwan hücresi önce bir tabaka halinde aksonu sarar.
Daha sonra daireler halinde birçok tabaka teşkil ederek miyelin tabakasını oluşturur.
Nörolemmanın üzerinde İnce ve retiküler fibrillerden yapılmış bir zar bulunur buna
endonerium denir
Gibbs Donan Dengesi
İyonlar membranın bir tarafından diğer tarafına aktarılabilir ve elektrik yüklerinin ayrılması ile
membranın iki tarafı arasında elektriksel potansiyel farkı yaratabilirler. Bu iş için iyonların
devamlı aktif transportu gereklidir(Na-K ATPaz). Ayrıca membranın bir tarafında membranı
geçebilen ve geçemeyen iyonlar var ise, bir potansiyel farkı meydana gelir ve korunur. Eğer
membranı geçebilen partiküller sadece pasif olarak hareket edebiliyorlarsa, meydana
gelecek iyon konsantrasyonu dağılışına Gibbs-Donnan dengesi denir.
Membran içinde (-) yüklü proteinler ve dışarıya göre 30 kat fazla K+ iyonu bulunur.
Membran dışında ekstraselüler sıvıda 10 kat fazla Na+ iyonu ve 14 kat fazla Cl- iyonu vardır.
Difüzyon ile Na+ içeri K+ dışarı çıkma eğilimindedir. Bu durum Na-K pompası ile
dengelenmeye çalışılır. Eksi (-) yüklü proteinler membrandan dışarı çıkamazlar. Çünkü
büyüktürler. Cl iyonları geçebilir, fakat sinirde mevcut potansiyel fark, Cl iyonlarının
çoğunu dışarıda tutmaya yeterlidir. O halde dışarı çıkamayan protein anyonlar ile gerek
olmadıkça içeri giremeyen Cl iyonları bulunmaktadır. Na-K iyonları sinir impulsu oluşumu
açısından önemlidir. Membranın Na+ a karşı geçirgenliği azdır; ama yine de bir miktar Na+
konsanatrasyon gradiyentine göre içeri sızar. Fakat içeri sızan sodyum (Na+ ) pompa sistemi
tarafından dışarı atılır. Böylece dışarda yüksek Na+ konsantrasyonu muhafaza edilir. K+ iyonları
membranı kolayca geçebilir. İçerde K+ çok olduğundan süratle dışarı sızar. İçerisi potasyum
(K+ ) kaybettiği için de içerde bulunan (-) yüklü proteinlerden dolayı membran içi dışarıya oranla 70 milivolt kadar bir potansiyel farkı gösterir. Fakat potasyum(K+’un) dışarı çıkışının da bir sınırı
88
H A Y V A N
F İ Z Y O L O J İ S İ
vardır. İçerdeki (-) yüklü organik anyonların, (+) yüklü K iyonlarını çekmesi, dışarıdaki
(+) yüklü Na iyonların gene (+) yüklü olan K iyonlarını itmesi gibi nedenlerle
dışardakinin
30
kat
K+
içerde
muhafaza
edilir.
• En basit refleks yayı (hem duysal bilgiyi alan hem de efektör hücreyi
kontrol eden aynı nörondur).
• Monosinaptik refleks yayı (duysal bilgiyi alan nöron merkezi sinir
sistemindeki bir motor nöron ile sinaps yapar).
• Polisinaptik refleks yayı (nöronal devirde birden fazla sinaps vardır).
ŞEKİL 2.4 Nöron ve sinaps
Akson
Dendirit
Nöron gövdesinden bilgi alırlar.
Yüzeyleri düzdür.
Bir nöronda bir akson bulunur.
Hiç ribozom yoktur.
Miyelinli olabilirler
Nöron gövdesinden uzakta dallanırlar
Nöron gövdesine bilgi getirirler
Yüzeyi düz değildir.
Bir nöronda çok sayıda dendrid vardır.
Ribozomları vardır.
Miyelinleri yoktur.
Nöron gövdesinin yakınında dallanırlar.
89