T.C.
MİLLİ EĞİTİM BAKANLIĞI
MEGEP
(MESLEKİ EĞİTİM VE ÖĞRETİM SİSTEMİNİN GÜÇLENDİRİLMESİ
PROJESİ)
KİMYA TEKNOLOJİSİ
METALLER 2
ANKARA 2008
Milli Eğitim Bakanlığı tarafından geliştirilen modüller;
Talim ve Terbiye Kurulu Başkanlığının 02.06.2006 tarih ve 269 sayılı
Kararı ile onaylanan, Mesleki ve Teknik Eğitim Okul ve Kurumlarında
kademeli olarak yaygınlaştırılan 42 alan ve 192 dala ait çerçeve öğretim
programlarında amaçlanan mesleki yeterlikleri kazandırmaya yönelik
geliştirilmiş öğretim materyalleridir (Ders Notlarıdır).
Modüller, bireylere mesleki yeterlik kazandırmak ve bireysel öğrenmeye
rehberlik etmek amacıyla öğrenme materyali olarak hazırlanmış,
denenmek ve geliştirilmek üzere Mesleki ve Teknik Eğitim Okul ve
Kurumlarında uygulanmaya başlanmıştır.
Modüller teknolojik gelişmelere paralel olarak, amaçlanan yeterliği
kazandırmak koşulu ile eğitim öğretim sırasında geliştirilebilir ve
yapılması önerilen değişiklikler Bakanlıkta ilgili birime bildirilir.
Örgün ve yaygın eğitim kurumları, işletmeler ve kendi kendine mesleki
yeterlik kazanmak isteyen bireyler modüllere internet üzerinden
ulaşılabilirler.
Basılmış modüller, eğitim kurumlarında öğrencilere ücretsiz olarak dağıtılır.
Modüller hiçbir şekilde ticari amaçla kullanılamaz ve ücret karşılığında
satılamaz.
İÇİNDEKİLER
AÇIKLAMALAR ................................................................................................................... V
GİRİŞ ....................................................................................................................................... 1
ÖĞRENME FAALİYETİ-1 ..................................................................................................... 3
1. BAKIR ................................................................................................................................. 3
1.1. B Grubu Elementleri ..................................................................................................... 3
1.2. Alaşım ........................................................................................................................... 3
1.2.1. Alaşımların Yapısı ................................................................................................. 4
1.2.2. Alaşımların Özellikleri .......................................................................................... 4
1.3. Grup I B Elementleri..................................................................................................... 4
1.4. Genel Özellikleri ........................................................................................................... 6
1.4.1. Fiziksel Özellikleri................................................................................................. 6
1.4.2. Kimyasal Özellikleri.............................................................................................. 7
1.5. Bakırın Doğada Bulunuşu............................................................................................. 7
1.6. Bakırın Elde Edilmesi ................................................................................................... 8
1.7. Bakırın Özellikleri....................................................................................................... 10
1.8. Bakırın Kullanıldığı Yerler ......................................................................................... 11
1.9. Laboratuvarda Bakır (II) Nitratın Elde Edilmesi ........................................................ 11
UYGULAMA FAALİYETİ .............................................................................................. 12
ÖLÇME VE DEĞERLENDİRME .................................................................................... 13
ÖĞRENME FAALİYETİ-2 ................................................................................................... 15
2. BAKIRIN ÖNEMLİ BİLEŞİKLERİ.................................................................................. 15
2.1. Oksijenli Bileşikleri .................................................................................................... 15
2.1.1. Küproz Oksit [Cu2O ] .......................................................................................... 15
2.1.2. Küprik Oksit [CuO ] ............................................................................................ 16
2.2. Halojenürleri ............................................................................................................... 17
2.2.1. Bakır (I) Halojenürleri ......................................................................................... 17
2.2.2. Bakır (II) Halojenürleri [ CuX2 ] ......................................................................... 17
2.3. Sülfürleri ..................................................................................................................... 18
2.3.1. Bakır (I) Sülfür [ Cu2S ]....................................................................................... 18
2.3.2. Bakır (II) Sülfür [ CuS ]....................................................................................... 18
2.4. Bakır (II) Sülfat [ CuSO4 ] .......................................................................................... 19
2.5. Bakırın Alaşımları....................................................................................................... 19
2.6. Laboratuvarda Bakır (II) Sülfatın Elde Edilmesi ........................................................ 20
UYGULAMA FAALİYETİ .............................................................................................. 21
ÖLÇME VE DEĞERLENDİRME .................................................................................... 23
ÖĞRENME FAALİYETİ-3 ................................................................................................... 25
3. GÜMÜŞ ............................................................................................................................. 25
3.1. Doğada Bulunuşu........................................................................................................ 25
3.2. Elde Edilmesi .............................................................................................................. 25
3.2.1. Yan Ürün Olarak Elde Edilmesi .......................................................................... 25
3.2.2. Minerallerinden Gümüş Elde Edilmesi ............................................................... 26
3.3. Elektrolitik Saflaştırma ............................................................................................... 27
3.4. Gümüşün Özellikleri ................................................................................................... 27
3.5. Kullanıldığı Yerler ...................................................................................................... 28
3.6. Önemli Bileşikleri ....................................................................................................... 29
i
3.6.1. Gümüş Oksit [Ag2O ] ......................................................................................... 29
3.6.2. Halojenürleri........................................................................................................ 30
3.6.3. Gümüş Sülfür [ Ag2S ]......................................................................................... 31
3.6.4. Gümüş nitrat [ AgNO3 ]....................................................................................... 31
3.7. Alaşımları.................................................................................................................... 32
3.8. Laboratuvarda Gümüş Aynası Elde Edilmesi ............................................................. 32
UYGULAMA FAALİYETİ .............................................................................................. 33
ÖLÇME VE DEĞERLENDİRME .................................................................................... 35
ÖĞRENME FAALİYETİ-4 ................................................................................................... 37
4. ÇİNKO ............................................................................................................................... 37
4.1. Grup II B Elementleri ................................................................................................. 37
4.2. Grup II B Elementlerinin Özellikleri .......................................................................... 38
4.2.1. Fiziksel Özellikleri............................................................................................... 38
4.2.2. Kimyasal Özellikleri............................................................................................ 38
4.3. Çinkonun Doğada Bulunuşu ....................................................................................... 39
4.4. Çinkonun Elde Edilmesi ............................................................................................. 39
4.5. Çinkonun Özellikleri................................................................................................... 40
4.6. Çinkonun Kullanıldığı Yerler ..................................................................................... 41
4.7. Önemli Bileşikleri ....................................................................................................... 42
4.7.1. Çinko Oksit [ ZnO ]ve Çinko Hidroksit [ Zn(OH)2]............................................ 42
4.7.2. Çinko Halojenürleri ............................................................................................. 43
4.7.3. Çinko Sülfür [ ZnS ] ............................................................................................ 44
4.7.4. Çinko Sülfat [ ZnSO4 ] ....................................................................................... 44
4.8. Alaşımları.................................................................................................................... 45
4.9. Çinko Hidroksidin Amfoter Özelliğinin İncelenmesi ................................................. 45
UYGULAMA FAALİYETİ .............................................................................................. 46
ÖLÇME VE DEĞERLENDİRME .................................................................................... 48
ÖĞRENME FAALİYETİ-5 ................................................................................................... 50
5. KROM................................................................................................................................ 50
5.1. Grup VI B Elementleri ................................................................................................ 50
5.2. Grup VI B Elementlerinin Özellikleri......................................................................... 50
5.3. Kromun Doğada Bulunuşu.......................................................................................... 52
5.4. Kromun Elde Edilmesi................................................................................................ 52
5.5. Kromun Özellikleri ..................................................................................................... 53
5.6. Kullanıldığı Yerler ve Alaşımları................................................................................ 54
5.7. Önemli Bileşikleri ....................................................................................................... 55
5.7.1. Oksijenli Bileşikleri ............................................................................................. 55
5.7.2. Kromatlar [ CrO4-2]ve Bikromatlar [ Cr2O7-2]...................................................... 56
5.7.3. Halojenürleri........................................................................................................ 57
5.7.4. Diğer Bileşikleri .................................................................................................. 58
5.8. Laboratuvarda Sodyum Kromat Elde Edilmesi .......................................................... 58
UYGULAMA FAALİYETİ .............................................................................................. 60
ÖLÇME VE DEĞERLENDİRME .................................................................................... 62
ÖĞRENME FAALİYETİ-6 ................................................................................................... 64
6. MANGAN.......................................................................................................................... 64
6.1. Grup (VII) B Elementleri ............................................................................................ 64
6.2. Genel Özelikleri .......................................................................................................... 65
ii
6.3. Manganın Doğada Bulunuşu....................................................................................... 66
6.4. Manganın Elde Edilmesi............................................................................................. 66
6.5. Manganın Özellikleri .................................................................................................. 66
6.6. Manganın Kullanıldığı Yerler ..................................................................................... 67
6.7. Manganın Önemli Bileşikleri...................................................................................... 67
6.7.1. İki Değerlikli Mangan Bileşikleri........................................................................ 67
6.7.2. Üç Değerlikli Mangan Bileşikleri........................................................................ 69
6.7.3. Dört Değerlikli Mangan Bileşikleri ..................................................................... 69
6.7.4. Altı Değerlikli Mangan Bileşikleri ...................................................................... 70
6.7.5. Yedi Değerlikli Mangan Bileşikleri..................................................................... 71
6.8. Asidik ve Bazik Ortamda Potasyum Permanganatı .................................................... 72
Özelliklerinin İncelenmesi ................................................................................................. 72
UYGULAMA FAALİYETİ .............................................................................................. 73
ÖLÇME VE DEĞERLENDİRME .................................................................................... 76
ÖĞRENME FAALİYETİ-7 ................................................................................................... 78
7. DEMİR ............................................................................................................................... 78
7.1. Grup VIII B Elementleri ............................................................................................. 78
7.2. Demir Grubu Metallerinin Genel Özellikleri .............................................................. 79
7.3. Demirin Doğada Bulunuşu.......................................................................................... 80
7.4. Demirin Elde Edilmesi................................................................................................ 80
7.4.1. Yüksek Fırında Ham Demirin Elde Edilmesi ...................................................... 81
7.4.2. Ham Demirden Çelik Elde Edilmesi ................................................................... 83
7.5. Demirin Özellikleri ..................................................................................................... 87
7.6. Kullanıldığı Yerler ...................................................................................................... 88
7.7. Laboratuvarda Demir (II) ve Demir (III) Klorür Elde Edilmesi ................................. 88
UYGULAMA FAALİYETİ .............................................................................................. 89
ÖLÇME VE DEĞERLENDİRME .................................................................................... 91
ÖĞRENME FAALİYETİ-8 ................................................................................................... 93
8. DEMİRİN ÖNEMLİ BİLEŞİKLERİ ................................................................................. 93
8.1. Oksijenli Bileşikleri .................................................................................................... 94
8.1.1. Demir (II) Oksit (Ferro Oksit) [FeO ]................................................................. 94
8.1.2. Demir (III) Oksit (Ferri Oksit) [Fe2O3 ].............................................................. 94
8.1.3. Demir (II, III) Oksit (Manyetik Demir Oksit) [ Fe3O4 ] ...................................... 94
8.1.4. Demir (II) Hidroksit (Ferro Hidroksit) [Fe(OH)2] .............................................. 95
8.1.5. Demir (III) Hidroksit (Ferri Hidroksit) [Fe(OH)3]............................................... 95
8.2. Halojenürleri ............................................................................................................... 96
8.2.1. Demir (II) ve Demir (III) Florür (Ferro ve Ferri Florür) [ FeF2, FeF3 ]............... 96
8.2.2. Demir (II) ve Demir (III) Klorür ( Ferro ve Ferri) [ FeCl2 ve FeCl3 ] ................. 96
8.3. Sülfürleri ..................................................................................................................... 97
8.3.1. Demir (II) Sülfür [ FeS ]...................................................................................... 97
8.3.2. Demir (III) Sülfür [ Fe2S3 ] ................................................................................. 97
8.3.3. Pirit [ FeS2 ] ........................................................................................................ 98
8.4. Kompleks Bileşikleri................................................................................................... 98
8.4.1. Potasyum Ferrosiyanür [ K4[Fe(CN)6] ] ............................................................ 98
8.4.2. Potasyum Ferrisiyanür [ K3[Fe(CN)6] ] .............................................................. 99
8.5. Diğer Bileşikleri........................................................................................................ 100
8.5.1. Demir (II) Sülfat [ FeSO4 ] ................................................................................ 100
iii
8.5.2. Demir (II) Karbonat [ FeCO3 ] ......................................................................... 101
8.5.3. Demir (II) Nitrat [ Fe(NO3)2 ] ve Demir (III) Nitrat [ Fe(NO3)3 ] .................... 101
8.6. Demirin Önemli Alaşımları....................................................................................... 102
8.7. Laboratuvarda Demir III Sülfat Elde Edilmesi ......................................................... 102
UYGULAMA FAALİYETİ ............................................................................................ 103
ÖLÇME VE DEĞERLENDİRME .................................................................................. 105
ÖĞRENME FAALİYETİ-9 ................................................................................................. 107
9. KOBALT.......................................................................................................................... 107
9.1. Doğada Bulunuşu...................................................................................................... 107
9.2. Elde Edilmesi ............................................................................................................ 107
9.3. Özellikleri.................................................................................................................. 108
9.4. Kullanıldığı Yerler .................................................................................................... 108
9.5. Laboratuvarda Kobalt Klorür ile Nem Belirlemek ................................................... 108
UYGULAMA FAALİYETİ ............................................................................................ 109
ÖLÇME VE DEĞERLENDİRME .................................................................................. 111
ÖĞRENME FAALİYETİ-10 ............................................................................................... 113
10. KOBALTIN ÖNEMLİ BİLEŞİKLERİ.......................................................................... 113
10.1. Oksijenli Bileşikleri ................................................................................................ 113
10.1.1. Kobalt (II) Hidroksit [ Co(OH)2 ] .................................................................... 113
10.1.2. Kobalt (II) Oksit [ CoO ] ................................................................................. 114
10.1.3. Kobalt (II, III) Oksit [ Co3O4 ] ......................................................................... 114
10.2. Halojenürleri ........................................................................................................... 114
10.3. Kompleks Bileşikleri............................................................................................... 115
10.4. Kobalt (II) Nitrat [Co(NO3)2].................................................................................. 116
10.5. Kobalt (II) Sülfat [CoSO4] ...................................................................................... 116
10.6. Kobalt (III) Sülfat [Co2(SO4)3]................................................................................ 116
10.7. Kobaltın Alaşımları................................................................................................. 116
10.8. Kobalt Klorür Çözeltisine Isının Etkisinin İncelenmesi ......................................... 117
UYGULAMA FAALİYETİ ............................................................................................ 118
ÖLÇME VE DEĞERLENDİRME .................................................................................. 119
ÖĞRENME FAALİYETİ-11 ............................................................................................... 121
11. NİKEL............................................................................................................................ 121
11.1. Doğada Bulunuşu.................................................................................................... 121
11.2. Elde Edilmesi .......................................................................................................... 121
11.3. Özellikleri................................................................................................................ 122
11.4. Kullanıldığı Yerler ve Önemli Alaşımları............................................................... 122
11.5. Önemli Bileşikleri ................................................................................................... 122
11.6. Laboratuvarda Nikel Oksit Elde Edilmesi .............................................................. 124
UYGULAMA FAALİYETİ ............................................................................................ 125
ÖLÇME VE DEĞERLENDİRME .................................................................................. 127
MODÜL DEĞERLENDİRME ............................................................................................ 129
CEVAP ANAHTARLARI ................................................................................................... 131
KAYNAKÇA ....................................................................................................................... 133
iv
AÇIKLAMALAR
AÇIKLAMALAR
KOD
ALAN
DAL
MODÜLÜN ADI
MODÜLÜN TANIMI
SÜRE
ÖN KOŞUL
YETERLİK
MODÜLÜN AMACI
EĞİTİM ÖĞRETİM
ORTAMLARI VE
DONANIMLARI
ÖLÇME VE
DEĞERLENDİRME
524KI0147
Kimya Teknolojisi
Kimya
Metaller 2
Bakır, gümüş, çinko, krom, mangan, demir, kobalt ve nikel
elementlerinin bulunuşu, özellikleri, kullanıldığı yerler,
önemli alaşım ve bileşiklerle ilgili bilgilerin verildiği öğrenme
materyalidir.
40/24
Metaller 1 modülünü başarmış olmak
Metal bileşiklerini elde etmek ve özelliklerini incelemek
Genel Amaç
Bu modül ile gerekli ortam sağlandığında metalleri elde
edebilecek ve inceleyebileceksiniz.
Amaçlar
Gerekli ortam sağlandığında kuralına uygun olarak;
1. Bakır II nitrat elde edebileceksiniz.
2. Bakır II sülfat elde edebileceksiniz.
3. Gümüş aynası elde edebileceksiniz.
4. Çinko hidroksidin amfoter özelliğini inceleyebileceksiniz.
5. Sodyum kromat elde edebileceksiniz.
6. Asitli ve bazik ortamda potasyum permanganatı
inceleyebileceksiniz.
7. Demir II klorür ve demir III klorür elde edebileceksiniz
8. Demir III sülfat elde edebileceksiniz
9. Kobalt klorür ile havadaki nemi belirleyebileceksiniz
10.
Kobalt
klorür
çözeltisine
ısının
etkisini
inceleyebileceksiniz.
11.
Nikel oksit elde edebileceksiniz.
Donanım
Projeksiyon, bilgisayar, DVD çalar, televizyon, beher, baget,
deney tüpü, spatül, damlalık, bek, destek, mezür, piset.
Isıtıcı, kristalizuvar, üçayak, z borusu, lastik tıpa, gaz toplama
borusu, adi süzgeç kâğıdı, kibrit çöpü, maşa.
Modülün içinde yer alan herhangi bir öğrenme
faaliyetinden sonra, verilen ölçme araçları ile kendi
kendinizi değerlendireceksiniz.
Modül sonunda öğretmeniniz tarafından ölçme teknikleri
uygulanarak modül uygulamaları ile kazandığınız bilgi ve
becerileriniz değerlendirilecektir.
v
vi
GİRİŞ
GİRİŞ
Sevgili Öğrenci,
Bu modülde günlük yaşamda sürekli olarak kullandığımız, bakır, gümüş, çinko, krom,
mangan, demir, kobalt ve nikel metallerinin bulunuşu, elde edilmesi, özellikleri ve
kullanılışıyla ilgili bilgiler verilmektedir.
Sürekli olarak kullandığımız tencere, çatal, bıçak vb. eşyaların çoğu alaşımlardan
yapılmaktadır. Bu modülde bu alaşımların nasıl yapıldığını, yine bazı kimyasal maddelerin
laboratuvarda kolaylıkla elde edilebileceğini ve ülkemizde bulunan çok sayıdaki
minerallerden elementlerin nasıl elde edildiğini öğreneceksiniz.
Uygulama faaliyetlerini dikkatlice yapınız. Gözlemlerinizi yazınız. Uygulama
faaliyetlerindeki her bir ayrıntıyı dikkatlice gözlemleyiniz. Kimya teknolojisinde nitelikli ve
bilgili gençlere olan ihtiyaç, her geçen zaman içinde artmaktadır. Bu iş alanında çalışmak
için gereken bilgi ve becerileri kazanmaya gayret ediniz.
Başarılar dileriz.
1
2
ÖĞRENME FAALİYETİ-1
ÖĞRENME FAALİYETİ-1
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak bakır (II) nitrat elde edebilecek
bilgi, beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Kıbrıs’ın adının bakırla ilişkisi var mı? Araştırınız.
Bakırın suda çözünmeyen önemli bileşiklerinin Kç’lerini (çözünürlük çarpımı)
araştırınız.
Bakır metalinin teknik önemini araştırınız.
1. BAKIR
1.1. B Grubu Elementleri
B grubu elementleri (d) orbitallerine elektron almaya başlayan ve dolmamış (d)
orbitaline sahip olan elementlerdir. 1B - VIII B grupları ile lantanit – aktinit serileri bu
grupta yer alır. Lantanit ve aktinit serisi elementleri iç geçiş, 1B - VIII B grupları geçiş
elementleri olarak adlandırılır. Tamamı metaldir. Dolmamış (d) orbitalleri nedeniyle değişik
değerliklerde bileşikler yaparlar. Her grup B elementleri ve özellikleri ileride öğrenme
faaliyetlerinde anlatılacaktır.
1.2. Alaşım
Metallerin çoğu istenilen sağlamlıkta, esneklikte veya havaya ve diğer kimyasal
etkenlere karşı dayanıklı olmadıklarından sanayide doğrudan doğruya kullanılmaz. Fakat bir
metal içerisine belirli oranlarda başka elementler katılarak özellikleri değiştirilebilir. Bu
şekilde tekniğin istediği özellikte metal karışımları hazırlanır ki bunlara alaşım denir.
Alaşım; iki veya daha fazla metalin eritilip karıştırılması ile elde edilen, metalik
görünüşlü, kristal yapıya sahip maddelerdir. Sadece cıvanın meydana getirdiği alaşımlara
özel olarak amalgam denir. Ekseriya, metaller içerisine çok az miktarda karbon, silisyum,
fosfor gibi ametaller katılırsa metal, istenilen özelliği kazanır. Örneğin, çokça kullandığımız
pirinç alaşımı bakır ve çinko metalleri karıştırılarak elde edilir. Yine bilinen çelik, demir
içerisine az miktarda karbon katılarak elde edilir. Bugün çeşitli özellik gösteren binlerce
alaşım, sanayide türlü amaçlarla kullanılmaktadır.
3
1.2.1. Alaşımların Yapısı
Erimiş metallerin birbirleriyle karıştırılması sonucu meydana gelen alaşımların yapısı
üç ayrı şekilde olabilir:
Alaşım kristali, her iki metali karıştırıldıkları oranda kristal yapısında
bulundurur. Örneğin, altın - gümüş alaşımı bu özelliktedir.
Alaşımda her iki metal, ayrı ayrı saf metal kristalleri hâlinde bulunur. Kalay –
kurşun alaşımı bu grup arasına girer.
Alaşım kristali, her iki metali belirli atom sayıları oranında kristal yapısında
bulundurur. Örneğin, sodyum amalgam kristalinde sodyum ve cıva, NaHg4 ve
NaHg2 gibi belirli oranlarda bulunur.
1.2.2. Alaşımların Özellikleri
Her alaşımın kendine has özellikleri var ise de alaşımların genel özellikleri de vardır.
Bu özellikler aşağıda sıralanmıştır:
Bir alaşımın erime noktası, kendisini meydana getiren metallerin erime
noktalarından daha düşüktür. Örneğin lehim, kalay – kurşun alaşımıdır. Kalay
231,9 °C de, kurşun 327,4 °C’de erirken lehim 182 °C’de erir.
Alaşımlar, kendilerini meydana getiren metallere göre ısı ve elektriği daha az
iletir.
Alaşımlar, daha güç tel ve levha hâline gelir. Yani, serttir. Fakat, döküme daha
elverişlidir.
Metalik parlaklık gösterirler, yüzeyleri parlaktır.
1.3. Grup I B Elementleri
Bakır (Cu), gümüş (Ag) ve altın (Au) elementlerinin oluşturduğu bakır grubu
elementlerine Grup I B elementleri denir. Bu grup elementler 8 bin yıl öncesinden beri
bilinmektedir. Bu grup metallerin yer kabuğunda serbest olarak bulunmaları veya kolaylıkla
elde edilebilmeleri bunların çok eski çağlardan beri bilinen metaller olmasını sağlamıştır.
4
H
Li
He
Be
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
8B
Na
Mg
3B 4B
5B 6B
7B
1B
2B
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
29Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
47Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
79Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lw
Tablo 1.1: Periyodik tablo
Doğada az bulunmaları ve korozyona dayanıklı olmaları nedeniyle bu metaller, daha
çok para yapımında kullanılırdı. Önceleri yalnız altın ve gümüş bu amaçla kullanılırken
sonraları bakırın da bu metallere katılmasıyla daha dayanıklı alaşımların yapılması, paranın
hem daha ucuza mal edilmesi hem de daha uzun süre aşınmadan kalmasını sağlamış ve her
üç metale para metalleri adı verilmiştir.
Bu grup elementlerinde tam dolu d yörüngelerinden sonra gelen en dış s
yörüngelerinde bir elektron vardır. Benzer bir yapının alkali metaller grubunda da olması, bu
grup elementlerin grup I A elementleriyle benzer özellikler göstermesi ve o nedenle de aynı
grupta incelenmesi gerektiğini düşündürebilir. Ancak iki grubun benzerliği yüksek elektrik
iletkenliği ve + 1 değerlikli olmaktan ileri geçmez. Bu iki grup arasındaki farklar şu şekilde
özetlenebilir:
Grup I A elementleri çok aktif metaller oldukları hâlde bu grup elementleri çok
zor yükseltgenir ve bu nedenle de soy metaller adını alırlar.
Grup I A elementleri yalnız + 1 değerlikli olurken grup I B elementleri + 1
değerliğin yanı sıra + 2 ve + 3 değerlikli de olabilirler.
Grup I B elementleri çok sayıda kompleks bileşikler oluşturduğu hâlde grup I A
elementlerinde bu özellik hiç görülmez.
Grup I B elementlerinin birçok bileşikleri renkli iken grup I A elementleri,
potasyum permanganatta olduğu gibi, anyona bağlı olarak bazı renkli bileşikler
verir.
Grup I B elementlerinin oksit ve hidroksitleri zayıf bazken grup I A
elementlerinin oksit ve hidroksitleri kuvvetli bazlardır. Grup I A elementlerinin
bileşiklerinin çoğu suda kolay çözünürken grup I B elementlerinin bileşiklerinin
çoğu suda zor çözünür.
5
Özellikler
Sembolü
Atom numarası
Atom kütlesi
Bakır
Cu
29
63,54
Gümüş
Ag
47
107,87
Elektron dizilişi
[Ar] 3d10 4s1
[Kr] 4d10 5s1
1083
2595
8,96
+2, +1
1,17
1,28
961
2210
10,5
+1
1,34
1,44
Altın
Au
79
196,97
[Xe] 4f14 5d10
6s1
1063
2970
19,3
+3,+1
1,34
1,46
178
175
213
469
497
474
1,9
1,76
1,9
1,46
2,4
0,56
72,8
60,7
81,8
0,092
0,056
0,031
0,593
0,616
0,420
0,94
0,93
0,71
(M+/M ) = 0,52
(M+2/M) = 0,34
7,1
(M+/M ) = 0,80
(M+2/M) = 0,34
10,3
(M+/M ) = 1,69
(M+3/M) = 1,42
10,2
Erime noktası(°C)
Kaynama noktası(°C)
Öz kütlesi (g/cm3)
Değerliği
İyon yarıçapı(A°)
Atom yarıçapı(A°)
Birinci iyonlaşma
enerjisi (kcal/mol)
İkinci iyonlaşma enerjisi
(kcal/mol)
Elektronegatifliği
Erime ısısı(kcal/mol)
Buharlaşma
ısısı(kcal/mol)
Özgül ısısı(cal/g/°C)
Elektrik
iletkenliği(mikroohm–1)
Isı iletkenliği
(cal/cm2/cm/°C/sn)
Standart indirgenme
potansiyeli (volt)
Atom hacmi(w/d)
Tablo1.2: I B Grubu elementlerinin bazı özellikleri
1.4. Genel Özellikleri
1.4.1. Fiziksel Özellikleri
Grup I B elementleri metal özellikleri gösterir. Bu elementler tel ve levha hâline
getirilebilir, elektrik ve ısıyı çok iyi iletir, kesitleri metalik parlaklık gösterir, kristal örgüleri
yüzey merkezli küp şeklindedir. Bu grupta bakırdan altına doğru metallerin aktifliği,
esnekliği, germe direnci ve özgül ısıları azalırken yoğunlukları ve iyonlaşma enerjileri artar.
Bazı fiziksel özellikleri Tablo 1.1’de verilmiştir.
6
1.4.2. Kimyasal Özellikleri
Grup I B elementleri çoğunlukla zor yükseltgenirler, asit ve bazlarla çok zor tepkime
verirler. Elektron dizilişinden beklenildiği gibi (Tablo1.1) en dış s yörüngelerindeki bir
elektronu vererek + 1 değerlikli olurlar. s yörüngeciyle tam dolu d yörüngelerinin enerjileri
birbirine çok yakın olduğundan az bir enerji eklenmesiyle d yörüngelerinden de elektron
vererek + 2 ve + 3 değerlikli de olabilirler. Ancak bakır ve gümüş + 1 ve + 2, altın ise + 1 ve
+ 3 değerlikli bileşikler oluştururlar. Gümüşün + 1, bakırın + 2, altının ise + 3 değerlikli
bileşikleri daha kararlıdır.
Madde
X2
Genel Denklem
Açıklama
Cu ile n=2 F2,Br2,Cl2 için n=1 I2 için
2M + n X2 → 2MXn
Ag ile n=1 F2,Br2,Cl2, I2 için
Au ile n=3 Br2 ve Cl2 için n=1 I2 için
Bakırla 1000°C nin üstünde
4 M + O2 → 2M2O
O2
Gümüşle basınç altında
2 M + O2 → 2 MO
S
P
Asit
NH3
HNO3
H2SO4
Altın
suyu
2M + S →M2S
3 M + P → M 3P
2 M + 4H+ +O2 → 2M+2 + 2 H2O
2 M + 8 NH3 + O2+ 2 H2O → 2 [M(NH3)4] +2 +
4 OH3 M + 4 H+ +NO3- → 3 M+ + NO + 2 H2O
2 M + 4 H+ +SO4-2 → 2 M+ +SO2 + 2 H2O
M + 5H++ 4Cl -+ NO3- → HMCl4 + NO + 2H2O
Bakırla 1000°C nin altında
Bakır ve gümüşle
Bakırla
Bakırla oksijenli ortamda
Bakırla amonyak çözeltisinde
Gümüşle(Bakır, Cu+2 verir)
Gümüşle(Bakır, Cu+2 verir)
Altınla (Bakır, Cu+2 gümüş AgCl
verir )
Tablo1.3: Grup I B elementlerinin bazı tepkimeleri
1.5. Bakırın Doğada Bulunuşu
Bakır, yer kabuğunun yaklaşık % 1.10–4 ünü oluşturur. Doğada serbest hâlde veya
bileşikleri hâlinde bulunur. Önemli mineralleri; kalkosit [Cu2S], kalkopirit (bakır piriti)
[CuFeS2], kovelit [CuS], kuprit [Cu2O], malahit [CuCO3.Cu(OH)2], azurit
[2CuCO3.Cu(OH)2] ve tenorit [CuO] tir. Bu minerallerden malahit güzel yeşil renktedir ve
mücevher olarak doğrudan kullanılır.
Türkiye’de bakır cevheri Artvin, Trabzon, Kastamonu, Rize, Elazığ, Giresun ve
Siirt’te bulunmaktadır.
7
1.6. Bakırın Elde Edilmesi
Serbest hâldeki bakır çok fazla değildir. Bu durumdaki bakır cevheri toz hâline
getirildikten sonra yıkanarak temizlenir. Daha sonra ergitilerek safsızlıklardan ayrılır. Bakır
oksit veya karbonat mineralleri seyreltik sülfürik asitle küprik çözeltilerine dönüştürülür ve
buradan bakır elektroliz yöntemiyle elde edilir.
Kullanılmakta olan bakırın % 80 kadarı kükürtlü minerallerden elde edilmektedir. Bu
mineral cevherlerindeki bakır, çoğunlukla % 0,3 – 5 oranında bulunmaktadır. Bu durumda
cevher flotasyon (yüzdürme) yöntemiyle bakır oranı % 20 – 25 olacak şekilde
zenginleştirilir. Daha sonra bakır elde edilmesi, pirometalurjik (kavurma) ve midrometalurjik
(sıyırma) yöntemlerinden biri veya her ikisiyle yapılır. Pirometalurjik yöntemde cevher
(örneğin kalkopirit) havada kavrulur.
2 CuFeS2 + 4 O2 → Cu2S + 2 FeO + 3 SO2
Kavrulan mineral alev fırınında silisyumdioksitle birlikte ısıtılır. Demir ve diğer
safsızlıklar silikatları hâlinde cürufa geçer; bakır (I) sülfür ve demir (II) sülfürden oluşan
kütle (mat) elde edilir.
Ergimiş mat, fırının altından alınır ve Bessemer tipi bir fırında silisyumdioksit
eklenmesiyle hava üflenerek yakılır. Geride kalan demir sülfür, oksijenle demir (II) okside,
2 FeS + 3 O2
→ FeO + 2 SO2
FeO + SiO2 → FeSiO3
Bu da silisyumdioksitle demir silikatı vererek cüruf hâlinde ayrılır. Kükürt, kükürt
dioksite dönüştürülerek yan ürün olarak ortamdan uzaklaşır. Bakır (I) sülfür önce bakır (I)
okside dönüşür, daha sonra bakır (I) sülfürle bakıra indirgenir.
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
2 Cu2O + Cu2S → 6 Cu + SO2
Bu şekilde elde edilen bakır % 97 – 99 saflıkta olup kalıplar hâlinde alınır. Ergimiş
bakırın soğuması sırasında, çözünmüş gazların kabarcıklar hâlinde çıkması nedeniyle bu
bakıra blister bakır denir.
Bakırın oksit ve karbonatlı minerallerinden elde edilmesinde diğer bir yöntem ise
mineraller kavrulur ve karbonla indirgenir.
CuCO3 → CuO + CO2
2 CuO + C → 2 Cu + CO2
8
Blister bakırdan saf bakır elde etmek için elektroliz yönteminden yararlanılır.
Elektroliz için Şekil 1.1’deki gibi bir düzenek kullanılır. Burada elektrolit olarak bakır sülfat,
katot olarak saf bakır, anot olarak saf olmayan (blister) bakır kullanılır.
Şekil 1.1: Bakırın elektrolizle saflaştırılması
Devreden geçen akımın amperi veya gerilimin voltajı kontrol edilerek saf bakır elde
edilir. İçinde safsızlık olarak en çok demir, çinko, altın ve gümüş bulunan bir bakır çubuğun
saflaştırılması incelenirse çinko ve demir, bakıra göre daha kolay; gümüş ve altın ise bakıra
göre daha zor yükseltgenir. Bu durum, yükseltgenme potansiyellerinden anlaşılabilir.
Zn → Zn +2 + 2 e-
E° = 0,76 volt
Fe → Fe+2 + 2 e-
E° = 0,44volt
Cu → Cu +2 + 2 e-
E° = - 0,34 volt
Ag → Ag + + e-
E° = - 0,80 volt
Au → Au +3 + 3 e-
E° = - 1,49 volt
Devredeki voltaj uygun bir değerde tutulursa çinko, demir ve bakır yükseltgenerek
çözeltiye geçer, gümüş ve altın ise değişmeden çöker. Çözeltideki bakır (II) iyonları daha
kolay indirgeneceğinden katotta saf bakır olarak toplanır, çinko ve demir (II) ise çözeltide
kalır. Yükseltgenmeyen altın, gümüş ve platin metalleri anot çamurunu oluşturur. Anot
çamurundan elde edilen bu kıymetli metaller elektroliz işleminin bütün masraflarını
karşılayabilir. Çoğu cevherde bir ton bakır eldesinde 100–150 g gümüş ve 10 – 20 g altın yan
ürün olarak elde edilir.
9
Hidrometalurjik yöntem uygulaması son yıllarda önemli bir artış göstermektedir. Bu
yöntemin temeli, düşük tenorlu (yüzdeli) cevherlerden bakırın sıyrılarak alınmasıdır.
Cevherin asidik veya bazik (eğer fazla kireç taşı içeriyorsa) çözeltilerinden hava
geçirilmesiyle Cu+2 çözeltiye alınır.
Cu2S + 5/2O2 + 2 H+ → 2 Cu+2 + SO4–2 + H2O
Cu2S + 5/2O2 + 8 NH3 + H2O → 2 Cu(NH3)4+2 + SO4–2 + 2 OHÇözeltiye atık demir parçaları eklenirse bakır indirgenerek ayrılır.
Cu+2
+ Fe → Cu
+ Fe+2
Buradan elde edilen bakır, elektroliz yöntemiyle saf hâle getirilir.
1.7. Bakırın Özellikleri
Kolaylıkla işlenebilen yumuşak bir metaldir. Isı ve elektriği çok iyi iletir. Diğer
fiziksel özelikleri için Tablo 1.1’e bakınız.
Bakır çok zor tepkime verir. Asit ve bazlar bakıra zor etki eder. Bakır, normal
koşullarda kuru havadan etkilenmez. Fakat bakır ısıtıldığı zaman havanın nemi ve
karbondioksidin katalitik etkisiyle hava oksijeni tarafından önce oksitlenir. Daha sonra
yüzeyi yeşil renkli, çok zehirli bazik bakır karbonat ( Cu2(OH)2CO3 ) tabakasıyla örtülür. Bu
tabaka bakırı dış etkenlere karşı korur.
2 Cu + CO2 + O2 + H2O → Cu2(OH)2CO3
Nemli hava ve SO2 gazı da benzer şekilde bazik bakır sülfat [CuSO4. 3Cu(OH)2]
tabakasını oluşturur.
4 Cu + SO2 + 5/2 O2 + 3 H2O → CuSO4. 3Cu(OH)2
Sıcakta derişik sülfürik asit, bakıra etki ederek bakırı yükseltger ve kükürtdioksit gazı
açığa çıkarır.
Cu + 2 H2SO4 → CuSO4 + 2 H2O + SO2
Nitrik asit yükseltgen bir ortamda (hava, potasyum klorat gibi) etki eder, fakat
hidrojen açığa çıkarmaz.
2 Cu + 4 HNO3 + O2 → 2 Cu(NO3)2 + 2 H2O
Derişik nitrik asit sıcakta bakıra etki ederek azotdioksit gazı oluşturur.
Cu + 4 HNO3
→ Cu(NO3)2 + 2 H2O + 2 NO2
10
Seyreltik nitrik asit bakıra sıcakta etki ederek azotmonoksit verir.
3 Cu + 8 HNO3
→ 3 Cu(NO3)2 + 4 H2O + 2 NO
Kral suyu da bakıra etki eder ve azotmonoksit gazı çıkışı olur.
3 Cu + 6 HCl + 2 HNO3 → 3 CuCl2 + 2 NO + 4 H2O
Halojenler, fosfor, kükürtle ve NH3 ile verdiği tepkimeler için Tablo 1.2’yi
inceleyiniz.
Kuvvetli bazlar bakıra etki etmez.
1.8. Bakırın Kullanıldığı Yerler
Bakır, en çok elektrikli araçlarda ve elektrik kablolarında (% 53)
Buhar boruları ve kazanlar gibi yapı inşaatında (% 16)
Endüstriyel makinelerde (% 12)
Ulaşımda (% 8)
Bakır bileşiklerinin sentezinde
Alaşım yapımında kullanılır
Bakır insan sağlığı için önemlidir. Su ve yiyeceklerle yeterli miktarda bakır alınır.
Bünyedeki bakır azlığı veya fazlalığı birçok sorunu doğurur. Bakır azlığı kan hücrelerinin
zayıflamasına, saçların renk kaybına, hemoglobin ve fosfolipidlerin sentezlerinin azalmasına
ve hücrelerdeki enerji veren tepkimelerin durmasına neden olur. Bakırın az olduğu
bünyelerin radyasyon etkilerine karşı daha dayanıksız olduğu söylenmektedir. Kanda bakır
oranı artarsa başka dokulara geçer, özellikle akciğer ve beyinde fazla miktarda toplanır. Bu
durum ölüme neden olabilir.
1.9. Laboratuvarda Bakır (II) Nitratın Elde Edilmesi
Bakır üzerine derişik nitrik asit eklenirse azot dioksit gazı çıkışı ile birlikte bakır (II)
nitrat meydana gelir. Çıkan azot dioksit gazı çok zehirli olup bu deneyin çeker ocakta
yapılması gerekir
Cu + 4 HNO3 Cu(NO3)2 + 2 H2O + 2 NO2
Araç ve gereçler: Bakır, derişik nitrik asit ve deney tüpü
11
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Deney tüpüne yarım spatül bakır tozu alınız.
Öneriler
Laboratuvar önlüğünüzü giyiniz.
Çalışma ortamınızı hazırlayınız.
Laboratuvar güvenlik kurallarına
uygun çalışınız.
Kullandığınız araç ve gereçlerin
temizliğine dikkat ediniz.
Derişik nitrik asit ekleyiniz.
Çeker ocakta dikkatli ve titiz
çalışınız.
Azot oksitlerinin çok zehirli
olduklarını unutmayınız.
HNO3 asit yakıcıdır, giysinize ve
cildinize temas etmesini
önleyiniz, temas etmiş ise
giysinizi ve cildinizi bol su ile
yıkayınız.
Oluşan karakteristik rengi gözlemleyiniz.
Tepkimede hangi azot oksidin
oluştuğunu belirleyiniz.
Tepkimenin denklemini
yazmaya çalışınız.
12
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Aşağıdakilerden hangisi bakır minerali değildir?
A) Galen
2.
B) 0,64
C) 3,2
D) 6,4
B) 4,12
C) 10,5
D) 25,6
Cu + HNO3 → Cu(NO3)2 + H2O + NO tepkime denkleştirilirse HNO3 asidin kat
sayısı kaç olur?
A) 3
5.
D) Azurit
CuSO4.5 H2O (göz taşı) bileşiğindeki bakır %’si aşağıdakilerden hangisidir?
( Cu: 64, S: 32, O: 16, H: 1 )
A) 2,56
4.
C) Kuprit
Elektroliz yöntemiyle saf bakır elde edilirken elektroliz devresinden 9650 Coulomb
yük geçmektedir. Katotta kaç g saf bakır toplanır? ( Cu: 64 ) (1 mol 96485 Coulomb’a
eşittir. Bu nedenle 0.1 mol bakır toplanır. Cevap 6.4 olmalıdır.)
A) 0,32
3.
B) Kalkosit
B) 8
C) 4
D) 2
0,1 M 200 mℓ Cu+2 çözeltisindeki bakır iyonlarının tamamını metalik bakıra
indirgemek için kaç g demir metali gerekir? ( Cu: 64, Fe: 56 )
A) 1,12
B) 5,6
C) 11,2
D) 56
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
13
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Deney tüpüne yarım spatül bakır tozu aldınız mı?
Aldığınız bakır tozu üzerine derişik nitrik asit eklediniz mi?
Oluşan karakteristik rengi gözlemlediniz mi?
Hesaplamaları yaptınız mı?
Deney araç ve gereçlerini temizleyerek raporunuzu hazırlayıp
öğretmeninize teslim ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
14
ÖĞRENME FAALİYETİ-2
ÖĞRENME FAALİYETİ-2
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak bakır (II) sülfat elde edebilme
bilgi, beceri ve deneyimine sahip olabileceksiniz.
ARAŞTIRMA
Bir çözeltide bakır iyonlarının varlığı nasıl anlaşılır? Araştırınız.
Çevrenizde bakır metalini işleyerek değerlendiren işletme veya işletmeler var
mı? Araştırınız.
Bakır metali ile bakır iyonu arasındaki farkları araştırınız. Araştırma neticelerini
maddeler hâlinde yazınız. Araştırma sonucunu sınıfta arkadaşlarınızla tartışınız.
2. BAKIRIN ÖNEMLİ BİLEŞİKLERİ
Bakır, iki tür bileşik yapar. Bakırın + 1 değerlikli bileşiklerine bakır (I) (küproz)
bileşikleri, bakırın + 2 değerlikli bileşiklerine ise bakır (II) (küprik) bileşikleri denir. Bakır
(I) bileşikleri yüksek sıcaklıkta, bakır (II) bileşikleri daha düşük sıcaklıkta kararlıdır.
2.1. Oksijenli Bileşikleri
Bakırın en önemli oksijenli bileşikleri bakır (I) ve bakır (II) oksitleridir.
2.1.1. Küproz Oksit [Cu2O ]
Tabiatta küprit minerali hâlinde bulunur. Laboratuvarda Bakır (I) klorürün sodyum
hidroksitle kaynatılmasıyla kırmızı kahve renkli bakır (I) oksit elde edilir.
2 CuCl + 2 OH- → Cu2O + 2 Cl- + H2O
Bakır (II) çözeltileri indirgen maddelerle ısıtılıp tepkimeye sokulduğunda kırmızı
bakır (I) oksit oluşur.
2 Cu +2 + 2 OH - + 2 e- (indirgenden) → Cu2O + H2O
15
Bu tepkime kanda şeker aranmasında kullanılır. Bu amaç için bakır (II) sülfat ile
sodyum hidroksit ve sodyum potasyum tartarak çözeltilerinden Fehling çözeltisi oluşturulur.
Bu çözelti ile hastanın kanının karıştırılıp ısıtılması ile kırmızı kahve renkli bakır (I) oksit
çöker.
Bakır (II) oksidin 1000 °C dolayında ısıtılmasıyla kırmızı bakır (I) oksit oluşur.
4 CuO → 2 Cu2O + O2
Bakır (I) oksit, seyreltik nitrik asit ve sülfürik asitle bakır (II) tuzlarını ve elementel
bakırı verir.
Cu2O + H2SO4 → CuSO4 + H2O + Cu
Cu2O + 2 HNO3 → Cu(NO3)2 + H2O + Cu
Bakır (I) oksit suda çözünmez, amonyakta çözünerek diamın bakır (I) kompleks
iyonunu verir.
4 NH3 + H2O + Cu2O → 2 [Cu(NH3)2]+1 + 2 OH-
2.1.2. Küprik Oksit [CuO ]
Doğada tenorit minerali hâlinde bulunur. Siyah renkte, suda çözünmeyen bir oksittir.
Bakır (II) hidroksit, bakır (II) nitrat veya bazik bakır (II) karbonatın ısıtılması ile elde edilir.
Cu(OH)2 → CuO + H2O
Cu(NO3)2 → CuO + N2O5
CuCO3.Cu(OH)2 → 2 CuO +CO2 + H2O
Asitlerde çözünerek bakır (II) tuzlarını verir.
CuO + 2 HCl → CuCl2 + H2O
Kuvvetle ısıtıldığında oksijen vererek küproz okside dönüşür.
4 CuO → 2 Cu2O + O2
Hidrojen ve karbonmonoksitle metalik bakıra indirgenir.
CuO + H2 → Cu + H2O
2CuO + C → 2 Cu + CO2
16
2.2. Halojenürleri
Bakır bütün halojenlerle birleşerek küproz ve küprik halojenürleri verir.
2.2.1. Bakır (I) Halojenürleri
Bakır (I) florür bilinmemektedir. Bakır (I) klorür ve bromür, bakır (II) tuzlarının asidik
çözeltilerde aşırı orandaki bakırla kaynatılmasıyla önce kompleks iyonu hâlinde elde edilir,
su eklenirse beyaz renkte bakır (I) klorür,
Cu + Cu +2 + 4 Cl - → 2 [CuCl2]-1
[CuCl2]-1 → CuCl + Cl –
ve açık sarı renkte bakır (I) bromür çöker.
Cu + Cu +2 + 4 Br - → 2 [CuBr2]-1
[CuBr2]-1 → CuBr + Br –
Bakır (II) tuzlarına iyodür eklenmesiyle önce bakır (II) iyodür çöker, ancak bu hemen
bakır (I) iyodür ve iyoda ayrışır.
2 CuI2 → 2 CuI + I2
Bakır (I) halojenürlerinin üçü de düzgün dört yüzlü yapısındadır. Halojen iyonları
düzgün dört yüzlünün köşelerinde, bakır (I) iyonları da merkezinde yer alır.
Bakır (I) halojenürleri suda çok az çözünür.
CuCl
Cu + + Cl-
Kç = 3,2.10–7
CuBr
Cu + + Br-
Kç = 5,9.10–9
CuI Cu + + I-
Kç = 1,1.10–12
2.2.2. Bakır (II) Halojenürleri [ CuX2 ]
Bakır (II) florür: Bakır ve florun doğrudan tepkimesiyle elde edilir. Renksiz, iyonik
bir bileşiktir.
Cu + F2 → CuF2
Bakır (II) klorür: Bakır ve klor elementlerinin doğrudan birleşmesiyle sarı renkte
kristaller hâlinde elde edilir.
Cu + Cl2 → CuCl2
17
Kristal suyu içeren bakır (II) klorür, bakır (II) hidroksit veya bakır (II) karbonatın HCl
asit ile tepkimesi ve çözeltinin buharlaştırılmasıyla elde edilir.
Cu(OH)2 + 2 HCl Cu (H2O)2.Cl2
Derişik bakır (II) klorür çözeltileri yeşil renktedir, çünkü hem mavi renkte hidrata
bakır (II) iyonlarını [Cu(H2O)4]+2 hem de sarı renkte kompleks küprik klorür iyonlarını
[CuCl4]-2 içerir. Çözelti seyreltilirse klorür iyonlarının yerini su molekülleri alır ve çözelti
mavileşir.
Bakır(II) bromür: Doğrudan elementlerinden veya HBr asidin bakır (II) oksit veya
bakır (II) karbonatla tepkimesiyle elde edilen siyah renkte bir katıdır.
Cu + Br2 CuBr2
CuO + 2 HBr CuBr2 + H2O
CuCO3 + 2 HBr CuBr2 + H2CO3
2.3. Sülfürleri
Bakır kükürtle birleşerek bakır (I) ve bakır (II) sülfürlerini verir.
2.3.1. Bakır (I) Sülfür [ Cu2S ]
Doğada kalkosit minerali hâlinde bulunur. Bakırın kükürtle havasız bir ortamda
ısıtılmasıyla,
2 Cu
+ S Cu2S
veya bakır (II) sülfürün havasız bir ortamda ısıtılmasıyla elde edilir.
2CuS Cu2S + S
Bakır (I) sülfür yüksek sıcaklıkta kararlı bir bileşiktir.
2.3.2. Bakır (II) Sülfür [ CuS ]
Doğada en az çözünen bakır (II) bileşiği CuS dür. Bakır (II) tuzu çözeltilerinden
asidik, bazik veya nötr ortamda hidrojen sülfür gazı geçirilmesiyle siyah renkte çöker.
Cu +2 + H2S CuS + 2 H+
K= 8.10–37
Ancak nitrik asitle ısıtılırsa çözünür.
3 CuS + 2 NO3- + 8 H+ 3 Cu+2 + 3 S + NO + 4 H2O
18
2.4. Bakır (II) Sülfat [ CuSO4 ]
Bakır (II) sülfat en çok bilinen bakır (II) bileşiğidir. Çoğunlukla beş mol kristal suyu
içerir. 5 mol kristal su içeren ( CuSO4.5 H2O ) mavi renkli bu bileşiğe halk arasında göztaşı
denir. Bakır (II) sülfat 300 C’de kristal suyunun tamamını vererek susuz bakır (II) sülfatı
oluşturur. Susuz olanı renksizdir. Daha yüksek sıcaklıkta ısıtılırsa bakır (II) okside dönüşür.
CuSO4
CuO + SO3
Bakır (II) sülfat, endüstride bakır(II) sülfürün havada kavrulduktan sonra sülfürik
asitle tepkimesiyle elde edilir.
2 CuS + 3 O2 2 CuO + 2 SO2
CuO + H2SO4 CuSO4 + H2O
Laboratuvarda ise bakır metali üzerine seyreltik sülfürik asit eklenmesi ve hava
üflenmesiyle elde edilir.
2 Cu + 2 H2SO4 + O2 2 CuSO4 + 2 H2O
Bu tepkimede derişik sülfürik asit kullanılırsa kükürt dioksit gazı açığa çıkar.
Cu + 2 H2SO4
CuSO4 + 2 H2O + SO2
Bakır (II) sülfat, elektrolizlerde elektrolit olarak kullanılır. Mikrop ve bakterileri
öldürücü ilaçların yapımında, suların temizlenmesinde ve benzeri alanlarda da kullanılır.
2.5. Bakırın Alaşımları
En önemli alaşımları bronz ve pirinçtir. Bronzun ana bileşimi % 90 bakır ve % 10
kalaydır. Ancak bazen çok az miktarda başka bazı metallerin katılmasıyla ek bazı özellikler
kazandırabilir. Pirinç, bir bakır – çinko alaşımıdır. Çinko oranı % 18 ile % 30 arasında
değişir, korozyona karşı saf bakırdan daha dayanıklıdır.
Bakırın önemli alaşımlarından biri de devarda alaşımıdır. Bu alaşım % 5 Zn, % 45 Al
ve % 50 Cu içerir. Çok kırılgandır. Kolaylıkla toz hâline getirilebilir. Bu toz laboratuvarlarda
alkali hidroksitlerden hidrojen açığa çıkararak kuvvetli bir indirgen ortam oluşturmakta
kullanılır.
Alaşımın Adı
Monel metal
Para (gümüş),
Amerikan gümüşü
Para (bakır)
Alman gümüşü
İngiliz gümüşü
Bileşimi
% 60 Ni, % 33 Cu, % 7 Fe
% 90 Ag, % 10 Cu
% 75 Cu, % 25 Ni
% 50–60 Cu, % 20 Zn, % 20–25 Ni
% 92,5 Ag, % 7,5 Cu
Tablo1.3: Bakırın diğer önemli alaşımları
19
2.6. Laboratuvarda Bakır (II) Sülfatın Elde Edilmesi
Bakır üzerine derişik sülfürik asit eklenip ısıtılırsa kükürtdioksit gazı çıkışı ile birlikte
bakır (II) sülfat oluşur. Kükürt dioksit gazı çok zehirli olduğundan bu deney mutlaka çeker
ocakta yapılmalıdır.
Cu + 2 H2SO4 CuSO4 + SO2 + H2O
Mavi renkte bakır (II) sülfat çözeltisi kaynatmadan bir süre ısıtılıp soğutulursa
CuSO4.5 H2O (göztaşı) kristalleri meydana gelir.
Araç ve gereçler: Isıtıcı, beher, baget, bakır tozu ve derişik sülfürik asit
Şekil 2.1: Bakır sülfat kristalleri
20
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Behere yarım spatül bakır tozu koyunuz.
Öneriler
Laboratuvar önlüğünüzü giyiniz.
Çalışma ortamınızı hazırlayınız.
Laboratuvar güvenlik kurallarına
uygun çalışınız.
Kullandığınız araç ve gereçlerin
temizliğine dikkat ediniz.
Üzerini örtecek kadar derişik sülfürik asit
ekleyiniz.
Deneyi çeker ocakta yapınız.
H2SO4 asit yakıcıdır, giysinize
ve cildinize temas etmesini
önleyiniz, temas etmiş ise giysi
veya cildinizi bol su ile
yıkayınız.
Bakır tozları çözününceye kadar ısıtınız
SO2 gazı zehirlidir, ısıtma
işlemini mutlaka çeker ocakta
yapınız.
21
Mavi rengi gözlemleyiniz.
Çözeltinin rengini tam
gözlemleyebilmek için karışımı
adi süzgeç kâğıdından sıcak
olarak süzmeyi unutmayınız.
Beherdeki suyu buharlaştırınız.
Karışımı kaynatmadan ısıtınız.
Çözeltiyi kuruluğa kadar
buharlaştırmayınız, aksi hâlde
beyaz bir tortu oluşur.
Kristalleri gözlemleyiniz.
Kristalin renginden maddenin
formülünü belirlemeye çalışınız.
22
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
0,1 mol CuO (bakır (II) oksit) bileşiği yeteri kadar H2 gazı ile indirgendiğinde kaç
gram bakır metali elde edilir? Bulunuz. ( Cu : 64, O : 16, H : 1 )
A) 3,2
2.
+ OH- tepkimesi denkleştirildiğinde
C) 2
D) 1
B) 3,2
C) 12,5
D) 125
10 gram bakır para ( % 75 Cu, % 25 Ni) yapmak için kaç gram nikel metali gerekir?
Bulunuz.
A) 2,5
5.
B) 3
D) 64
3.2 g bakır metali üzerine yeterince derişik H2SO4 asit etki ettiriliyor. En çok kaç gram
göz taşı (CuSO4.5 H2O) elde edilir? Bulunuz. (Cu : 64, S : 32, O :1 6, H : 1 )
A) 1.25
4.
C) 32
NH3 + H2O + Cu2O → [Cu(NH3)2]+1
amonyağın kat sayısı kaç olur? Bulunuz.
A) 4
3.
B) 6,4
B) 5
C) 7,5
D) 9
Elektrolizle saf bakır elde edilirken anot çamurunda aşağıdaki metallerden hangisi
bulunmaz?
A) Au
B) Ag
C) Pt
D) Ni
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
23
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetin de kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Behere yarım spatül bakır tozu koydunuz mu?
Üzerini örtecek kadar derişik sülfürik asit eklediniz mi?
Bakır tozları çözününceye kadar ısıttınız mı?
Mavi rengi gözlemlediniz mi?
Beherdeki suyu buharlaştırdınız mı?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
24
ÖĞRENME FAALİYETİ-3
ÖĞRENME FAALİYETİ-3
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak gümüş aynası elde etme bilgi,
beceri ve deneyimine sahip olabileceksiniz.
ARAŞTIRMA
Gümüşhane iline niçin bu ad verilmiştir ? Araştırınız.
Ülkemizde yılda kaç kg veya ton gümüş elde edilmektedir? Araştırınız.
Çevrenizde gümüş metalini işleyen işletmeler var mı? Araştırınız.
3. GÜMÜŞ
3.1. Doğada Bulunuşu
Gümüş doğada az bulunan bir elementtir. Yer kabuğunun yaklaşık % 10 – 18’ini
oluşturur. Serbest olarak galen [PbS] mineraliyle birlikte simli kurşun olarak bulunur. Ayrıca
bileşikleri hâlinde argentit [Ag2S], horn gümüşü [AgCl], kırmızı gümüş [3Ag2S.Sb2S3]
mineralleri hâlinde bulunur.
3.2. Elde Edilmesi
3.2.1. Yan Ürün Olarak Elde Edilmesi
Gümüş daha çok bakır ve kurşun minerallerinde safsızlık olarak bulunur ve bunların
elde edilmesinde yan ürün olarak görülür.
3.2.1.1. Bakır Üretiminde Yan Ürün Olarak Elde Edilmesi
Bakır üretiminde, bakırın elektrolitik saflaştırılmasında, altın ve gümüş anot
çamurunda toplanır. Buradan gümüşün kazanılması için çamur seyreltik sülfürik asitle
karıştırılırsa gümüşten daha aktif olan safsızlıklar çözünür. Çözeltinin süzülerek
alınmasından sonra geride kalan artık bu kez derişik sülfürik asitle etki ettirilirse gümüş,
gümüş sülfat çözeltisi hâlinde altından ayrılır. Bu çözelti içine bakır parçaları atılmasıyla
gümüş açığa çıkar.
2 Ag + 2 H2SO4 Ag2SO4 + 2 H2O + SO2
Ag2SO4 + Cu CuSO4 + 2 Ag
25
3.2.1.2. Kurşun üretiminde Yan Ürün Olarak Elde Edilmesi
Kurşun minerallerinde safsızlık olarak bulunan gümüş değişik yöntemlerle
kazanılabilir. Bunlar, birbirini tamamlayan Pattinson, Parkes ve Kupellet yöntemleridir.
Pattinson yöntemi: Bu yöntem, kurşun minerallerinden gümüş elde
edilmesinde kullanılan bir yöntemdir. Bunun için mineral ergitilir ve soğumaya
bırakılırsa kurşun kristalleşir. Bu kristallerin sürekli olarak süzgeçli kaşıklarla
alınmasıyla geride % 2 kadar gümüş içeren gümüş – kurşun alaşımı kalır.
Parkes yöntemi: Bu yöntem Pattinson yöntemi ile elde edilen gümüş
alaşımından gümüş elde edilmesini sağlamak üzere kullanılır. Yöntem,
gümüşün ergimiş çinkoda ergimiş kurşundakinden çok daha fazla çözünmesi
temeline dayanır. Gümüşün çinkoda çözünürlüğü kurşundakinden 300 kez daha
fazladır. Kurşun ise çinkoda çözünmez.
Parkes yönteminde gümüş içeren karışım ergitilir ve bir miktar çinko eklenerek
iyice karıştırılır. Gümüşün büyük bir kısmı çinkoda çözünür. Karıştırma
durdurulduğunda çinko – gümüş alaşımı yüzeyde toplanır ve katılaşır. Buradan
alınan alaşım damıtılarak daha uçucu olan çinko uzaklaştırılır ve az miktarda
kurşun içeren gümüş geride kalır.
Kupellet yöntemi: Parkes yöntemiyle elde edilen gümüşün daha çok
saflaştırılması amacıyla kullanılır. Bunun için, içinde az miktarda kurşun
bulunan gümüş, kemik külünden yapılmış Kupellet adı verilen sığ kaplar içinde
ergitilir. Hava üflenerek kurşun oksitlenir ve dışarıya alınır. Gümüş (varsa altın)
değişmeden kalır.
Buradan elde edilen gümüşte de kısmen safsızlık bulunur. Çok saf gümüş elektrolitik
saflaştırma ile elde edilir.
3.2.2. Minerallerinden Gümüş Elde Edilmesi
Gümüş minerallerinden gümüş elde ederken en önemli olay, çözünmeyen gümüş
bileşiklerinin çözeltiye geçmesini sağlamaktır. Bunun için değişik yöntemler kullanılır.
3.2.2.1. Siyanürleştirme Yöntemi
Metalik gümüş ve bütün gümüş bileşikleri, oksijenli ortamda alkali siyanürlerde
kolayca çözünerek gümüş komplekslerini verir.
4 Ag + 8 NaCN + 2 H2O + O2 4 Na Ag(CN)2 +
4 NaOH
AgCl + 2 NaCN Na Ag(CN)2 + NaCl
2 Ag2S + 8 NaCN + O2 + 2 H2O 4 Na Ag(CN)2 + 4 NaOH + 2 S
26
Yabancı maddelerden süzülerek arındırılan kompleks, toz hâlinde metalik çinko veya
alüminyum eklenerek gümüşe indirgenir.
2 Na Ag(CN)2 + Zn Na2 Zn(CN)4 + 2 Ag
3 Na Ag(CN)2 + Al + 4 NaOH 3 Ag + NaAlO2 + 6 NaCN + 2 H2O
Burada elde edilen gümüş kısmen safsızlık içerir. Elektrolitik saflaştırma ile çok saf
gümüş elde edilebilir.
3.2.2.2. Amalgam Yöntemi
Bu yöntem, metalik hâlde gümüş veya gümüş klorür içeren minerallerden gümüşün
elde edilmesinde kullanılır. Bunun için toz hâline getirilen mineral su ve cıva ile karıştırılır.
Cıva metalik gümüşü çözer, gümüş klorürü de metalik gümüşe indirgeyerek amalgam
oluşturur.
2 AgCl + 2 Hg Hg2Cl2 + 2 Hg
n Hg + Ag Ag(Hg)n amalgam
Oluşan amalgam diğer safsızlıklardan ayrılır. Demirden yapılmış damıtma kaplarında
ısıtılırsa cıva uçar, yoğunlaştırılarak tekrar kullanılır, gümüş ise geride kalır. Buradan elde
edilen gümüş de kısmen safsızlık bulunduğundan elektrolitik saflaştırma ile saflaştırılır.
3.3. Elektrolitik Saflaştırma
Burada saf gümüş, katodu; saf olmayan gümüş ise anodu oluşturur. Elektrolit olarak
seyreltik nitrik asit içeren gümüş nitrat çözeltisi kullanılır. Saf gümüş katoda toplanır.
3.4. Gümüşün Özellikleri
Gümüş yumuşak, beyaz ve parlak bir metaldir. Isı ve elektriği iyi iletir. Kolaylıkla
şekil verilebilir. Normal koşullarda oksijenden etkilenmez, ancak hidrojen sülfür veya sülfür
içeren maddelerin yanında (yumurta, hardal gibi) oksijenden kolaylıkla etkilenir ve
parlaklığını kaybeder. Gümüşün bazı özelliklerini Tablo1.2’de görebilirsiniz
4 Ag + 2 H2S + O2 2 Ag2S + 2 H2O
Halojenler gümüşle tepkimeye girerek halojenürlerini oluşturur.
2 Ag + X2 2 AgX
Nitrik asit ve sülfürik asit gibi yükseltgen asitlerle tepkimeye girerek tuzlarını
oluşturur.
27
3 Ag + 4 HNO3 3 AgNO3 + NO + 2 H2O
2 Ag + 2 H2SO4 Ag2SO4 + SO2 + 2 H2O
Aktiflik sırasında hidrojenin altında olduğu için gümüş, yükseltgen olmayan
hidroklorik asit gibi asitlerde çözünmez. Gümüş tuzlarının çoğu suda çok az, gümüş nitrat ise
çok çözünür. Gümüşün değerliği + 1’dir. Ancak AgO ve Ag2O3 ve birçok kompleks
bileşiklerinde + 2 ve + 3 değerlikli olabilir.
3.5. Kullanıldığı Yerler
Ev eşyaları yapımında: Çatal, kaşık, vazo ve süs eşyalarının yapımında
kullanılır.
Kaplamacılıkta: Gümüş kaplama yapılırken kaplanacak eşya katodu, saf gümüş
anodu oluşturacak şekilde bir elektroliz hücresi hazırlanır. Elektrolit olarak
sodyum gümüş siyanür kompleks bileşiğinin çözeltisi kullanılır. Şekil 3.1’de
böyle bir kaplama hücresi görülmektedir.
Şekil 3.1: Gümüş kaplama hücresi
Anot ve katot tepkimeleri aşağıda olduğu gibi gösterilebilir.
Anot : Ag + 2 CN - Ag(CN)2 - + e Katot : Ag(CN)2 - + e - Ag + 2 CN –
Anotta çözünen gümüş, katotta metalik hâle geçerek kaplanacak maddenin üzerini
ince bir tabaka hâlinde kaplar. Kaplama düz, beyaz bir görünümdedir.
Gümüş ayna yapımında: Gümüş aynaların yapımında cam üzerinde ince bir
gümüş tabakası oluşturulur. Amonyaklı gümüş nitrat çözeltisi çok kuvvetli
28
olmayan bir indirgenle (glikoz veya formaldehit) ısıtılırsa metalik gümüşe
indirgenir. Amonyaklı gümüş nitrat ve indirgenden oluşan karışım cam üzerine
dökülüp ısıtılırsa metalik gümüş ayrılıp cam üzerinde ince bir tabaka oluşturur.
Daha sonra yıkanan cam kurutulursa ayna meydana gelir.
Ag(NH3)2 + + e - Ag + 2 NH3
veya 2 Ag(NH3)2 OH + HCOH 2 Ag + 3 NH3 + HCOONH4 + H2O
diamin gümüş
hidroksit
formaldehit
gümüş
aynası
amonyum
formiyat
Fotoğrafçılıkta: Fotoğraf film ve camlarının üzeri AgNO3’den elde edilen AgBr
ün sıcak jelatinli emülsiyonu ince homojen bir tabaka hâlinde sürülür.
Soğuduğunda gümüş bromür – jelatin çözeltisi donar, böylece fotoğraf filmi
hazırlanmış olur.
Alaşımlarının yapımında: Bakınız 3.7
Dişçilikte: Diş dolgu maddelerinin yapımında ve diş kaplamasında kullanılır.
3.6. Önemli Bileşikleri
Gümüş bileşiklerinde en çok + 1 değerlikli olur, buna argentus adı verilir. Gümüş (I)
iyonları fazla hidroliz olmaz, iyi bir yükseltkendir.
Ag+
+
e - Ag
E = - 0,80 volt
3.6.1. Gümüş Oksit [Ag2O ]
Gümüşün ozonla tepkimesiyle toz hâlindeki gümüşün basınç altında oksijen içinde
ısıtılmasıyla veya gümüş nitrat çözeltisine kuvvetli bazların etkisiyle koyu kahverengi amorf
bir madde olarak elde edilir.
6 Ag + O3 3 Ag2O
4 Ag + O2
2 Ag2O
2 AgNO3 + 2 NaOH Ag2O + 2 NaNO3 + H2O
Gümüş oksit suda çok az çözünür, çözeltisi baziktir.
Ag2O + H2O 2 Ag+ + 2 OHAncak amonyaklı çözeltilerde çok az çözünür, kuvvetli bir baz verir.
Ag2O + 4 NH3 + H2O 2 Ag(NH3)2 + + 2 OH-
29
Bu diamin gümüş kompleks çözeltisi gümüş kaplamacılığında ve ayna yapımında
kullanılır. Çözelti buharlaştırılırsa kompleksten amonyak ayrılmaz, patlayıcı bir çökelek
oluşur. Bu patlayıcı bileşiklerin gümüş amin veya gümüş nitrür (AgNH2 veya Ag3N)
yapısında olduğu sanılmaktadır.
Gümüş oksit havada ısıtılırsa kolaylıkla oksijen vererek bozunur.
2 Ag2O
C
300
4 Ag + O2
3.6.2. Halojenürleri
En önemli gümüş bileşikleri gümüş halojenürleridir. Gümüş florür suda çok çözünür,
diğerlerinin çözünürlükleri ise klorürden iyodüre doğru azalır.
Bileşik
AgCl
AgBr
AgI
Çözünürlük çarpımı (Kç)
2,8.10–10
5,0.10–13
8,5.10–17
Tablo 3.1: Gümüş halojenürlerin çözünürlük çarpımları
Gümüş florür, gümüş oksidin sulu hidroflorik asitte çözünmesiyle elde edilir.
Ag2O + 2 HF 2 AgF + H2O
Çözelti buharlaştırılırsa suda çok çözünen AgF . 2 H2O kristalleri ayrılır. Bu kristaller
40 C dolayında ısıtılırsa suyunu kaybeder.
Suda çözünmeyen gümüş halojenürleri gümüş tuzları çözeltisine halojenür iyonlarının
eklenmesiyle elde edilir.
Ag + + X- AgX
Gümüş florür beyaz, gümüş klorür kirli beyaz, gümüş bromür açık sarı ve gümüş
iyodür ise sarı renktedir.
Gümüş klorür; derişik nitrik asit, derişik hidroklorik asit ve alkali klorürlerde klor
kompleksleri yaparak çözünür. Ayrıca amonyak, siyanür ve tiyosülfat çözeltilerinde de
kompleks vererek çözünür.
AgCl + HCl AgCl2 - + H+
AgCl + 2 NH3 Ag (NH3)2 + + Cl –
AgCl + 2 KCN KAg(CN)2 + KCl
30
AgCl + 2 Na2S2O3 Na3Ag(S2O3)2 + NaCl
Gümüşün florürü dışında bütün halojenürleri ışığa duyarlıdır. Işıkta elementlerine
ayrışarak önce menekşe, daha sonra siyah renge dönüşür.
2 AgX + ışık (hν) → 2 Ag + X2
Bu nedenle özellikle gümüş bromür, ışığa duyarlı fotoğraf çözeltilerinin yapımında
kullanılır.
3.6.3. Gümüş Sülfür [ Ag2S ]
Gümüş sülfür, doğada argentit minerali hâlinde bulunur. Gümüş metali üzerinden kızıl
derecede kükürt buharı geçirilmesi veya gümüş tuzları çözeltisinden hidrojen sülfür gazı
geçirilmesiyle siyah renkte elde edilir.
2 Ag + S → Ag2S
2 AgNO3 + H2S → Ag2S + 2 HNO3
Gümüş sülfür sıcak nitrik asitte çözünür.
3 Ag2S + 8 HNO3 → 6 Ag NO3 + 3 S + 2 NO + 4 H2O
Gümüş, bileşikleri arasında suda en az çözünenidir. Kç = 5,5.10–51 dir. Siyanürlü
ortamlarda kolay çözünür.
Ag2S + 4 CN - → 2 [Ag(CN)2] - + S -2
3.6.4. Gümüş nitrat [ AgNO3 ]
Gümüş nitrat, gümüşün nitrik asitte çözünmesi ve suyunun buharlaştırılmasıyla
kristaller hâlinde elde edilir.
3 Ag + 4 HNO3 → 3 AgNO3 + 2 H2O + NO
Bu bileşik diğer birçok elementlerin nitratları gibi suda kolay çözünür, fakat bunlardan
farklı olarak nem çekici değildir, çözeltisi nötraldir. Isıtılırsa azotdioksit vererek bozunur.
2 AgNO3 → 2 Ag + 2 NO2 + O2
Gümüş nitrat, organik maddelerle siyah renkte metalik gümüşe indirgenir. Bu nedenle
bezlere kalıcı yazı yazmada kullanılır. Işığa karşı çok duyarlıdır, ışıkta hemen bozunarak
metalik gümüşe indirgenir. Cehennem taşı adı altında tıpta tümörlerin tedavisinde,
makyajcılıkta yapay ben yapımında kullanılır.
31
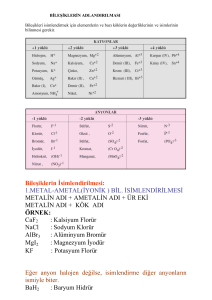
3.7. Alaşımları
Gümüş metali çok yumuşak olduğundan çoğunlukla diğer metallerle alaşımları
hâlinde kullanılır. Çatal, kaşık gibi gümüşten yapılmış ev eşyalarının yapısında % 90 gümüş
ve % 10 bakır bulunmaktadır. İngiliz gümüşü denilen ve % 92,5 gümüş, % 7,5 bakır içeren
alaşımı ise daha çok mücevher ve para yapımında kullanılır. Gümüş metali geniş çapta
dişçilikte, süs eşyalarının yapımında ve kaplamacılıkta kullanılır.
3.8. Laboratuvarda Gümüş Aynası Elde Edilmesi
Deney tüpüne 2 ml gümüş nitrat çözeltisi alınır, üzerine çökelek oluşup çözününceye
kadar 2 M NH3 çözeltisi ilave edilir. Karışıma doymuş glikoz çözeltisi veya formaldehit
katılıp bek alevinde gezdirerek ısıtıldığında deney tüpünün çevresinde parlak gümüş aynası
oluşur.
Araç ve gereçler: Bek, deney tüpü, glikoz çözeltisi veya formaldehit, 2 M NH3
çözeltisi ve 0,5 M gümüş nitrat çözeltisi
32
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Deney tüpüne 2 mℓ gümüş nitrat çözeltisi alınız.
Öneriler
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı hazırlayınız.
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve gereçlerin
temizliğine dikkat ediniz.
Gümüş nitrat çözeltisini
cildinize ve elbisenize temas
ettirmeyiniz.
Karışıma amonyak ekleyiniz.
Amonyak kokusu, çevre
kirliliği yapar. Ayıraç şişesinin
kapağını uzun süre açık
bırakmayınız.
Çözününceye kadar amonyak çözeltisi ekleyiniz.
Çözünme tepkimesinin
denklemini yazmaya çalışınız.
33
Doymuş glikoz çözeltisinden 2 mℓ ekleyiniz.
Dikkatli ve titiz çalışınız.
Karışımı bek alevinde gezdirerek ısıtınız.
Bek alevini düşük ayarda
tutunuz.
Deney tüpü çevresinde parlak gümüş
oluştuğunda bek alevini kısınız ve tüpünün
çevresinde oluşan aynayı inceleyiniz.
Deney tüpünü alev içerisinde
uzun süre tutmayınız.
Karışımın kaynamasını
önleyiniz.
Deney tüpünde gerçekleşen
tepkimenin denklemini
yazmaya çalışınız.
34
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Aşağıdakilerden hangisi bir gümüş mineralidir?
A) Galen
B) Pirit
C) Boksit
D) Zinkit
2.
Ag2S + HNO3 → Ag NO3 + S + NO + H2O
Yukarıdaki tepkime denklemi denkleştirilirse AgNO3’ün kat sayısı kaç olur?
A) 3
B) 6
C) 8
D) 2
3.
Elektrolitik olarak bir eşyanın üzeri gümüşle kaplanmak isteniyor. Eşyanın üzerinde 1
gram gümüş oluşması için devreden kaç Coulomb yük geçmesi gerekir? Bulunuz.
(Ag : 108)
A) 500
B) 765
C) 894
D) 9650
4.
Cehennem taşı da denilen madde aşağıdakilerden hangisidir?
A) CaCO3
B) CuSO4
C) Na2CO3
5.
D) AgNO3
3 Ag + 4 HNO3 3 AgNO3 + NO + 2 H2O tepkimesine göre 0,1 mol gümüş
metali yeterince nitrik asitle tepkimeye girdiğinde NŞA’da kaç litre NO gazı oluşur?
Bulunuz.
A) 0,747
B) 1,12
C) 2,24
D) 22,4
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
35
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Deney tüpüne gümüş nitrat çözeltisi aldınız mı?
Çökelek oluşup çözününceye kadar amonyak çözeltisi eklediniz
mi?
Doymuş glikoz çözeltisini ilave ettiniz mi?
Karışımı bek alevinde gezdirerek ısıttınız mı?
Deney tüpü çevresinde parlak gümüş oluştuğunda bek alevini
kıstınız mı?
Deney tüpünün çevresinde oluşan aynayı gözlemlediniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
36
ÖĞRENME FAALİYETİ-4
ÖĞRENME FAALİYETİ-4
AMAÇ
Gerekli ortam sağlandığında kuralına uygun çinko hidroksitin amfoter özelliğini
inceleyebilecek bilgi, beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Çatı kaplamalarında yağmur suyunu önlemek için niçin başka metal değil de
çinko metali kullanılır? Araştırınız.
Ülkemizde çinko mineralleri nerelerde bulunur? Araştırınız.
Bir çözeltide çinko iyonunun bulunduğu nasıl anlaşılır? Araştırınız.
Galvanize demir kaplarda her türlü yiyecekler uzun süre korunamaz. Bunun
nedenini araştırınız.
4. ÇİNKO
4.1. Grup II B Elementleri
Çinko, kadmiyum ve cıva metallerinden oluşan düşey sütuna grup IIB elementleri
denir.
H
Li
He
Be
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
8B
Na
Mg
3B 4B
5B 6B
7B
1B
2B
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
30Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
48Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
80Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lw
Tablo 4.1: Periyodik çizelge
37
4.2. Grup II B Elementlerinin Özellikleri
4.2.1. Fiziksel Özellikleri
Bu grup elementlerinin son yörüngelerinde iki elektron, bunun altındaki yörüngede ise
toplam 18 elektron bulunur. Elementlerin d yörüngelerinin tam dolu olması ve elektronların
bağ yapmaya katkısı bulunmaması nedeniyle grup II A elementlerinde de olduğu gibi sadece
son yörüngedeki ns2 elektronları bileşik oluşturmada kullanılır. Elementler bu 2 elektronu
kolaylıkla vererek +2 değerlikli olur. Ancak, grupta aşağıya doğru inildikçe + 1 değerlikte
bileşik oluşturma eğilimi de görülür.
Her üç metal de gümüş parlaklığındadır, elektrik ve ısıyı iyi iletirler. Oda sıcaklığında
çinko ve kadmiyum katı, cıva ise sıvıdır. Çinko ve kadmiyum işlenebilir, tel ve levha hâline
getirilebilir. Cıva ise oda sıcaklığında sıvı olan tek metaldir. Sıvı hâlde iken genleşme kat
sayısı sıcaklıkla değişmez, buharları elektriği iyi iletir ve mor ötesi ışınlar yayar. Bu grup
elementlerin bazı özellikleri Tablo 4.2’de verilmiştir.
4.2.2. Kimyasal Özellikleri
Çinko ve kadmiyum seyreltik asitlerde ve derişik alkalilerde çözünür, cıva çözünmez.
Çinko ve kadmiyum bileşikleri çoğunlukla iyonik yapıdadır. Cıva ise kovalent bileşikler
yapar. Kadmiyum ve cıva + 2 değerliği yanı sıra + 1 değerlikli bileşikler de yapar, çinko ise
yalnız + 2 değerlikli bileşikler oluşturur.
Bu grup elementler, kompleks bileşikler de yapar. Kompleks bileşik yapma eğilimi
kadmiyumda en fazla, cıvada ise en azdır. Her üç metal de halojenlerle birleşerek
halojenürleri verir. Cıva aktif olmayan bir metaldir, diğer metallerle amalgam adı verilen bir
tür alaşım yapar. Aktiflik sırasında cıva, hidrojenin altında çinko ve kadmiyum ise hidrojenin
üstünde yer alır. Ancak çinko, kadmiyumdan daha aktiftir. Bu nedenle çinko ve kadmiyum
asitlerden hidrojen açığa çıkarır, cıva ise çıkaramaz. Her üç metal de suda hidrojen açığa
çıkaracak kadar aktif değildir.
İyon yarıçaplarının çinkodan cıvaya doğru artması nedeniyle metalik özelikleri artar.
Bu nedenle de metallerin oksitlerinin asit özelliği azalır, buna karşın baz özelliği artar. Çinko
oksit amfoterik, kadmiyum ve cıva oksit bazik özelliktedir.
Grup içinde elementlerin atom numarası arttıkça oksitlerinin ısıya dayanıklılığı azalır,
halojenürleri daha az hidroliz olur, sülfürleri suda daha az çözünür, bileşiklerinin renkleri
daha çok koyulaşır.
38
Özellikler
Sembolü
Atom numarası
Atom kütlesi
Elektron dizilişi
Erime noktası(°C)
Kaynama noktası(°C)
Öz kütlesi (g/cm3)
Değerliği
İyon yarıçapı(A°)
Atom yarıçapı(A°)
Birinci
iyonlaşma
enerjisi (kcal/mol)
İkinci iyonlaşma enerjisi
(kcal/mol)
Elektronegatifliği
Erime ısısı(kcal/mol)
Buharlaşma
ısısı(kcal/mol)
Özgül ısısı(cal/g/°C)
Elektrik
iletkenliği(mikroohm–1)
Isı
iletkenliği
(cal/cm2/cm/°C/Sn)
Standart
indirgenme
potansiyeli
(volt)
(M+2/M)
Atom hacmi(w/d)
Çinko
Zn
30
65,37
[Ar] 3d10 4s2
419,5
906
7,14
+2
1,25
1,38
Kadmiyum
Cd
48
112,40
[Kr] 4d10 5s2
320,9
765
8,65
+2
1,48
1,54
Civa
Hg
80
200,59
[Xe] 4f14 5d10 6s2
-38,4
357
13,6
+2, +1
1,49
1,57
216
207
241
416
391
434
1,6
1,76
1,7
1,46
1,9
0,56
27,4
23,9
13,9
0,0915
0,055
0,033
0,167
0,146
0,011
0,27
0,22
0,02
-0,76
-0,40
0,85
9,2
13,1
14,8
Tablo 4.2: II B Grubu elementlerinin bazı özellikleri
4.3. Çinkonun Doğada Bulunuşu
Çinko, yer kabuğunun yaklaşık % 1,3.10–2 sini oluşturur. En önemli minerali çinko
blend [ZnS] dir. Daha az bulunan diğer mineralleri ise zinkit [ZnO], simitsonit [ZnCO3],
villemit [Zn2SiO4.H2O ] ve franklinit [ (Zn, Mn)O.Fe2O3 ]’tir.
4.4. Çinkonun Elde Edilmesi
Çinko elde edebilmek için en çok çinko blend veya simitsonit mineralleri kullanılır.
Bunun için çinko blend kavrularak oksidine çevrilir.
2 ZnS + 3 O2
2 ZnO + 2SO2
39
Eğer simitsonit minerali kullanılmışsa mineral doğrudan ısıtılır.
ZnO + CO
ZnCO3
2
Bu oksitler karbonla 1200 °C de indirgenerek çinko elde edilir.
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
Tepkime sıcaklığında elde edilen çinko, gaz hâlindedir. Gaz hâlindeki çinko buharları
hızla soğutulursa toz hâlinde çinko elde edilir. Bu şekilde elde edilen çinkonun içinde demir,
kadmiyum, kurşun ve arsenik gibi birçok safsızlıklar bulunur. Saf çinko elde etmek için ya
ayrımsal damıtma (fraksiyonlu destilasyon) veya elektrolitik yöntem kullanılır.
Ayrımsal damıtmada saf olmayan çinko, çinkonun kaynama noktası olan 906 °C’ye
kadar ısıtılır ve bu sıcaklıktaki buharlar soğutulursa saf çinko elde edilir. Elektrolitik
yöntemde ise anot olarak saf olmayan çinko, katot olarak alüminyum levha, elektrolit olarak
ise asit katılmış çinko sülfat çözeltisi kullanılır. Saf çinko katotta toplanır.
Çinko elde etmede kullanılan bir diğer yöntemde ise çinko blend kavrularak çinko,
sülfata dönüştürülür.
ısı
ZnS + 2 O2
ZnSO4
Sönmüş kireç eklenerek safsızlık olarak bulunan demir ve alüminyum gibi diğer
metaller çöktürülür. Süzüntüye asit katılarak elektroliz edilir. Katotta çinko toplanır.
4.5. Çinkonun Özellikleri
Çinko; mavi - beyaz görünümde, sert ve kırılgan bir metaldir. Yüzeyi kolaylıkla
matlaşarak metal parlaklığını kaybeder. Çinko 100°C’ye kadar ısıtılırsa yumuşar ve kolay
işlenebilir. Soğutulduğunda bu özelliği değişmez. Isıtma 200°C’nin üstüne çıktığında ise
tekrar kırılganlık kazanır.
Çinko kuru havada oda sıcaklığında etkilenmez, fakat nemli havada üzeri bazik bir
karbonat tabakasıyla örtülür. Ancak bu koruyucu bir tabaka olup daha fazla oksitlenmesini
önler. Havada ısıtıldığında yeşil – mavi bir alevle yanar ve lifler hâlindeki çinko oksidi verir.
Bu okside eskiden filozof yünü denirdi.
Çinko oldukça aktif bir metal olduğundan su buharına etki ederek hidrojen gazı açığa
çıkarır.
Zn + H2O → ZnO + H2
40
Çinko, klor ve kükürtle doğrudan birleşir, azotla birleşmez. Ancak kızıl derecede
ısıtılmış çinko metali üzerinden amonyak gazı geçirilirse çinko nitrür bileşiğini verir.
3 Zn + 2 NH3 → Zn3N2 + 3 H2
Çok saf çinko, seyreltik asitlerden hidrojen açığa çıkarmaz. Ancak ortamda çok az
safsızlık varsa hidrojen çıkışı olur. Bunun nedeni, bu tepkimenin oluşmaması değil; oluşan
hidrojen moleküllerinin çinko metalinin yüzeyinden çıkmasındaki güçlüktür. Çünkü oldukça
aktif bir metal olan çinkonun yüzeyi Zn+2 iyonlarıyla örtüldüğünden H+ iyonlarına karşı itici
etki yapar. Ancak, sistemde bir safsızlık varsa oluşan H2 molekülleri safsızlığın yüzeyinden
kolayca çıkacağından tepkime hızla olur.
Zn
+ 2 HCl → ZnCl2 + H2
Zn
+ H2SO4 → ZnSO4 + H2
Yükseltgen asitler, sıcak ve derişik olarak çinkoya etki ettiğinde tuzunu ve asidin
indirgeme ürününü verir. Yükseltgen asitlerden sülfürik asit seyreltik olduğunda hidrojen
gazı açığa çıkardığı hâlde nitrik asit hiç bir şartta hidrojen gazı çıkarmaz. Nitrik asit, şartlara
göre değişik ürünler oluşturur. Seyreltik nitrik asitle amonyak, daha derişikte ise azot
oksitleri oluşur.
4 Zn + 9 HNO3 → 4 Zn(NO3)2 + NH3 + 3 H2O
3 Zn + 8 HNO3 → 3 Zn(NO3)2 + 2 NO + 4 H2O
Çinko, amfoter özelikte bir metaldir. Kuvvetli bazlarda çözünerek hidrojen gazı açığa
çıkarır ve çinkat iyonunu oluşturur.
Zn + 2 NaOH + 2 H2O → Na2Zn(OH)4 + H2
Oda sıcaklığında çinko, alkil hâlojenürleri ile birleşerek çinko alkali bileşiğini verir.
2 Zn + 2 C2H5I → Zn(C2H5)2 + ZnI2
4.6. Çinkonun Kullanıldığı Yerler
Kaplamacılıkta (Galvanizleme): Çinko, büyük ölçüde galvanize demir
yapmakta kullanılır. Bu metodun esası, demir metalinin üzerini çinko ile
kaplayarak paslanmasına engel olmaktır.
Kuru pil yapımında: Galvanik pillerde negatif kutup olarak kullanılır.
Yapı endüstrisinde oluk yapılmasında: Dam ve çatıların örtülmesinde
kullanılır.
Alaşımlarının yapımında kullanılır.
Bileşiklerinin yapımında kullanılır.
41
4.7. Önemli Bileşikleri
Çinko, bileşiklerinde yalnız + 2 değerlikli olur. Bileşikleri iyonik yapıdadır, ancak
organik bileşiklerinde kovalent özellik görülür. Çinko iyonları çoğunlukla basit iyonlar
hâlinde olmayıp kompleks iyonlar hâlinde bulunur. Örneğin su ile [Zn(H2O)4]+2, amonyak ile
[Zn(NH3)4]+2, siyanür ile [Zn(CN)4]-2 kompleks iyonunu verir. d yörüngeleri tam dolu
olduğundan çinko bileşikleri renksizdir. Çinkonun en önemli bileşikleri; oksijenli bileşikleri,
hâlojenürleri ve sülfürleridir.
4.7.1. Çinko Oksit [ ZnO ]ve Çinko Hidroksit [ Zn(OH)2]
Çinko oksit, doğada zinkit minerali hâlinde bulunur. Simitsonit ve blend
minerallerinden de elde edilebilir. Laboratuvarlarda çinko metalinin yakılmasıyla veya çinko
hidroksitin ısıtılmasıyla elde edilir.
Çinko oksit sıcakken sarı, soğuduğunda beyaz renkte bir maddedir. Amfoterik özellik
gösterir. Asitlerde çözündüğünde tuzlarını, bazlarda çözündüğünde ise çinkatları verir.
ZnO + 2 HCl → ZnCl2 + H2O
ZnO + 2 NaOH + H2O → Na2Zn(OH)4 veya (Na2ZnO2 + 2H2O)
En önemli çinkatlardan biri rinman yeşili denilen kobalt çinkat CoZnO2 tir.
Çinko oksit, kömürle ısıtılırsa kolaylıkla çinko metaline indirgenir. Çinko oksit, krom
oksitle karıştırılarak su gazı ve hidrojenden metil alkol elde edilmesinde katalizör olarak etki
eder.
CO + H2 + H2 → CH3OH
Su gazı
Çinko oksit suda çözünmediği hâlde asitlerde çözünerek çinko tuzu çözeltilerini verir.
Bu tuz çözeltilerine bir baz eklenirse beyaz ve peltemsi çinko hidroksit çöker.
ZnO + H2SO4 → ZnSO4 + H2O
ZnSO4 + 2 NaOH → Zn(OH)2 + Na2SO4
Çinko hidroksit de amfoterik özelliktedir. Asitlerde çinko tuzlarını, bazlarda ise
çinkatları verir.
Zn(OH)2 + 2 HCl → ZnCl2 + 2 H2O
Zn(OH)2 + 2 NaOH → Na2ZnO2 + 2 H2O
42
Çinko hidroksit, amonyak çözeltisinde tetramin çinko hidroksit kompleksini vererek
çözünür.
Zn(OH)2 + 4 NH3 → [ Zn(NH3)4](OH)2
Çinko oksit, çinko beyazı veya Çin beyazı olarak bilinir ve beyaz boya olarak
kullanılır. Ayrıca birçok plastik ve kauçuklarda dolgu maddesi olarak merhemlerin ve
boyaların yapımında da çinko oksit kullanılır.
4.7.2. Çinko Halojenürleri
Çinko, bütün halojenürlerle birleşerek halojenür bileşiklerini verir. Bunların tamamı
oda sıcaklığında katı, beyaz renkte maddelerdir. Susuz halojenürler, elementlerin doğrudan
birleşmesiyle elde edilebilir. Ancak, en çok kullanılan şekil sulu şekildir ve halojen
asitlerinin çinko metalleri, çinko oksit, çinko hidroksit veya çinko karbonat üzerine etkisiyle
elde edilir.
Zn
+ 2 HCl → ZnCl2 + H2
ZnO + 2 HI→ ZnI2 + H2O
Zn(OH)2 + 2 HBr → ZnBr2 + 2 H2O
ZnCO3 + 2 HF → ZnF2 + CO2 + H2O
Çinko florür dışında diğer halojenürler suda çok çözünür. Çinko halojenür
bileşiklerinde elementler arasındaki bağ; çinko florürde daha çok kovalent; diğerlerinde ise
iyonik özelliktedir. Bunun sonucu olarak çinko florürün erime noktası çok yüksektir ve suda
çok az çözünür.
Çinko halojenürleri içinde en önemlisi çinko klorürdür. Susuz çinko klorür, özellikle
bazı organik tepkimelerde nem çekici olarak kullanılır. Susuz çinko klorür elementlerinden
veya sulu çinko klorürden kuru hidrojen klorür gazı geçirilerek elde edilir.
Çinko klorür çözeltisi, diğer halojenür bileşiklerinin çözeltileri gibi asidiktir. Bunun
nedeni, çinko (II) iyonlarının suda hidroliz olmasıdır.
Zn +2 + 4H2O → [Zn(H2O)4]+2
[Zn(H2O)4]+2 [Zn(H2O)3(OH)]+ + H+
Bu asidik özelliği nedeniyle çinko klorür çözeltisi, amonyum klorürle birlikte
lehimcilikte, metal yüzeyindeki oksitlerin çözünmesinde kullanılır. Derişik çinko klorür
çözeltileri selülozu çözer ve bundan bir tür tahta yapılır. Derişik çinko klorürde çözünmüş
çinko oksit sert bir kütle oluşturur. Bu da dişçilikte dolgu maddesi olarak kullanılır.
43
4.7.3. Çinko Sülfür [ ZnS ]
Çinko sülfür, doğada çinko blend minerali hâlinde bulunur. Laboratuvarda bir çinko
tuzu çözeltisine amonyum sülfür eklenmesiyle elde edilir.
ZnCl2 + (NH4)2S → ZnS + 2 NH4Cl
Asetik asitte çözünmez, diğer asitlerde çözünür. Beyaz renkte bir katıdır.
ZnS + 2 HCl → ZnCl2 + H2S
Çinko sülfür, fosforesans özellik gösterir. Üzerine düşen çok küçük dalga boylu ışığı,
daha yüksek dalga boylu ışığa çevirir. Burada kullanılan çinko sülfür, saf olmayıp içinde az
miktarda safsızlık bulunanıdır. Bu etkinin nedeni oldukça karışık olup katı yapısındaki
düzensizlikle ilgili olduğu bir gerçektir. Çinko sülfür, üzerine düşen yüksek enerjili ışın
safsızlık bölgelerinden bir kısım elektronu koparır. Serbest hâle geçen bu elektronlar, bütün
kristal boyunca dolaşarak en kararlı olabileceği bir yerde yerleşir. Böylece enerjisi düşer,
azalan enerji dışarıya ışık olarak verilir. Ancak bu ışık, çinko sülfür üzerine düşen ışıktan
daha büyük dalga boyludur ve görünen ışıktır.
Çinko sülfür, fosforesans özelliği nedeniyle televizyon ekranlarında, X- ışınlarının
yerinin belirlenmesinde ve elektron mikroskoplarının gözlem levhâlarında kullanılır. Çinko
sülfürün diğer önemli kullanımı, tek başına ya da çinko oksit veya baryum sülfat karışık
hâlde beyaz boya olarak kullanılmasıdır. Baryum sülfatla karışımına litofon denir.
4.7.4. Çinko Sülfat [ ZnSO4 ]
Çinko sülfürün az oksijenli ortamda yakılmasıyla veya sülfürik asidin çinko veya
çinko oksit üzerine etkisiyle elde edilir.
ZnS + 2 O2
ZnSO4
ZnO + H2SO4
Zn + H2SO4
→ ZnSO4 + H2O
→ ZnSO4 + H2
Çözeltilerinden yedi mol kristal suyu ile birlikte ayrılır. Diğer sülfatlar gibi çinko
sülfat da çift tuzlar yapar. Bunlardan en önemlisi çinko amonyum sülfat
Zn(NH4)2(SO4)2.6H2O’tır. Kristal suyu içeren çinko sülfat, ısıtıldığında 100 °C dolayında
6 mol suyunu, 450 °C’de ise suyunun tamamını kaybeder. Daha yüksek sıcaklıklarda
ısıtılırsa kükürttrioksit vererek bozunur.
ZnSO .H O + 6 H O
ZnSO4.7 H2O
4
2
2
ZnSO + 7 H O
ZnSO4.7 H2O
4
2
44
ZnO + SO
ZnSO4
3
Çinko sülfat, en çok litofon boyası yapımında ve laboratuvarlarda kullanılır. Litofonu
elde etmek için baryum sülfür çözeltisine çinko sülfat eklenmesi yeterlidir.
BaS + ZnSO4 → BaSO4 + ZnS
4.8. Alaşımları
Çinkonun en önemli alaşımları aşağıda verilmiştir:
Pirinç alaşımı: % 10 - 40 Zn ve % 60 - 90 Cu karışımıdır.
Tunç alaşımı: % 1– 25 Zn, % 1–18 Sn ve % 70 - 95 Cu karışımıdır.
Alman gümüşü: % 20 Zn, % 20 – 25 Ni ve % 50 – 60 Cu karışımıdır.
Devarda: % 5 Zn, % 45 Al ve % 50 Cu karışımıdır.
4.9. Çinko Hidroksidin Amfoter Özelliğinin İncelenmesi
Deney tüpüne bir miktar toz çinko alınır. Üzerine 3 M NaOH çözeltisi ilave edilir.
Oluşan çökelek iki ayrı deney tüpüne alınır. Birinci deney tüpündeki çinko hidroksit çökeleği
üzerine 0,1 M HCl asit çözeltisi, diğer deney tüpündeki çinko hidroksit çökeleği üzerine 3 M
NaOH çözeltisi katılırsa her iki deney tüpündeki çinko hidroksit çökeleğinin çözündüğü
görülür.
Zn(OH)2 + 2 HCl → ZnCl2 + 2 H2O
Zn(OH)2 + 2 NaOH → Na2ZnO2 + 2 H2O
Araç ve gereçler:
Deney tüpü
Zn tozu
3 M NaOH çözeltisi
0,1 M HCl çözeltisi.
45
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Deney tüpüne çinko tozu alınız.
Öneriler
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı
hazırlayınız.
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve
gereçlerin temizliğine
dikkat ediniz.
Çökelek oluşuncaya kadar sodyum hidroksit çözeltisi
ekleyiniz.
Çinkonun sodyum
hidroksitle verdiği
tepkimenin denklemini
yazmaya çalışınız.
46
Elde edilen çökeleği iki deney tüpüne ayırınız.
Dikkatli ve titiz çalışınız.
Deney tüplerinden birine sodyum hidroksit çözeltisi
ekleyerek gözlemleyiniz.
Çinko hidroksit
çökeleğinin NaOH ile
verdiği tepkimenin
denklemini yazmaya
çalışınız.
Deney tüplerinden diğerine hidroklorik asit çözeltisi
ekleyerek gözlemleyiniz.
Çinko hidroksit çökeleğinin
HCl asit ile verdiği
tepkimenin denklemini
yazmaya çalışınız.
47
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Aşağıdakilerden hangisi çinko minerali değildir?
A) Zinkit
2.
B) 9
C) 3
D) 1
B) Na2ZnO
C) NaZnO2
D) Na2ZnO2
1,25 g ZnCO3 üzerine yeterince HCl asit etki ettiğinde NŞA’da kaç mℓ CO2 gazı
oluşur? (Zn : 65, C : 12, O : 16, H : 1, Cl : 35.5)
A) 0,224
5.
D) Simitsonit
Zn(OH)2 + 2 NaOH → ............. + 2 H2O
Yukarıda denkleştirilmiş tepkime denkleminde boş bırakılan yere aşağıdakilerden
hangisi yazılmalıdır?
A) Na2Zn
4.
C) Franklinit
Zn + HNO3 → Zn(NO3)2 + NH3 + H2O
Yukarıdaki tepkime denklemi denkleştirildiğinde Zn(NO3)2’in kat sayısı kaç olur?
A) 4
3.
B) Siderit
B) 22,4
C) 224
D) 2240
Zn(NH4)2(SO4)2. 6 H2O çift tuzundaki Zn %’si aşağıdakilerden hangisidir?
(Zn : 65, N : 14, H : 1, S : 32, O : 16)
A) 162
B) 16,2
C) 10,62
D) 1,62
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
48
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetlerinde kazandığınız becerileri aşağıdaki tablo doğrultusunda
ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Deney tüpüne çinko tozu aldınız mı?
Çökelek oluşuncaya kadar soyum hidroksit çözeltisi eklediniz
mi?
Elde edilen çökeleği iki deney tüpüne ayırdınız mı?
Deney tüplerinden birine sodyum hidroksit diğerine hidroklorik
asit ekleyip çökelekleri çözmeye çalıştınız mı?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
49
ÖĞRENME FAALİYETİ-5
ÖĞRENME FAALİYETİ-5
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak sodyum kromat elde edebilme
bilgi, beceri ve deneyimine sahip olabileceksiniz.
ARAŞTIRMA
Bir bileşiğin yapısında krom metalinin bulunduğu nasıl anlaşılır? Araştırınız.
Krom metalinin teknik önemini açıklayınız.
5. KROM
5.1. Grup VI B Elementleri
Geçiş elementlerinden, krom (Cr), molibden (Mo) ve tungsten (W) elementlerinin
oluşturduğu düşey sütuna Grup VI B elementleri denir.
H
Li
He
Be
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
8B
Na
Mg
3B 4B
5B
6B 7B
Mn
24Cr
K
Ca
Sc
Ti
V
Rb
Sr
Y
Zr
Nb
42Mo
Cs
Ba
La
Hf
Ta
Fr
Ra
Ac
1B
2B
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
74W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lw
Tablo 5.1: Periyodik çizelge
5.2. Grup VI B Elementlerinin Özellikleri
Krom ve molibdenin elektron dizilişi genel kurala uymaz. Bu elementlerin s
yörüngelerinde ikişer elektron bulunması gerekirken birer elektron vardır. Bunun nedeni, en
50
dış yörüngedeki bir elektronun içteki yörüngeci yarı dolmuş hâle getirerek daha kararlı bir
yapı kazandırmasıdır.
Bu gruptaki elementler, atom hacimleri küçük olan metallerdir. Erime ve kaynama
noktası çok yüksektir. Örneğin tungsten, erime noktası en yüksek olan metaldir. Saf hâlde
iken gümüş parlaklığında ve yumuşak, safsızlık bulunduğunda ise serttir. Isı ve elektriği çok
iyi iletirler.
Bu elementlerin birinci iyonlaşma enerjileri diğer geçiş elementlerinkinden çok farklı
değildir. Ancak, aktiflikleri diğerlerine oranla daha azdır. Standart indirgenme potansiyeli
değerlerine bakılırsa kromun kuvvetli, molibdenin ise orta kuvvette bir indirgen olduğu
söylenebilir. Ancak yüzeylerinde kolayca bir oksit tabakası oluştuğundan aktiflikleri
beklendiğinden çok daha azdır. Bu grup elementlerinden krom, yalnız + 6 değerlikte iken
kuvvetli bir yükseltgendir. Bu özellik, çözeltinin asitlik derecesine doğrudan bağlıdır.
Çözeltinin pH değeri yükseldikçe indirgenme potansiyelinin değeri de azalır.
Örneğin;
Cr2O7–2 + 14 H+ + 6 e- → 2 Cr+3 + 7 H2O
tepkimesinde pH= 0 iken E°=1,33 volt, pH=7 iken E°=0,43 volttur.
Kromun + 3 değerlikli iyonları, dördüncü periyottaki diğer geçiş elementleri arasında
önemli bir yer tutar. Kromdan önce gelen Ti+3 ve V+3 iyonları indirgen, kromdan sonra gelen
Mn+3, Fe+3 ve Co+3 iyonları ise yükseltgendir. Bu özellik, iyonların dış yörüngelerindeki
elektron dizilişi ile ilgilidir. Soy gaz elektron dizilişine ulaşmak için kromdan önceki iyonlar
elektron vermeye, kromdan sonraki iyonlar ise elektron almaya daha isteklidir. Kromun + 2
değerlikli iyonları sulu çözeltilerde bilinen en kuvvetli indirgendir.
Molibden ve tungsten kimyasal özellikleri bakımından birbirine çok benzer ve
kromdan farklılık gösterir. Tablo 5.2’de görüldüğü gibi krom, + 6, + 3 ve + 2 değerlik aldığı
hâlde molibden ve tungsten çözeltilerinde çoğunlukla + 6 değerliklidir ve yükseltgen özellik
gösterir. Grup VI elementlerinin bazı özellikleri Tablo 5.2’de verilmiştir.
51
Özellikler
Krom
Molibden
Tungsten
(volfram)
Sembolü
Atom numarası
Atom kütlesi
Elektron dizilişi
Erime noktası(°C)
Kaynama noktası(°C)
Öz kütlesi (g/cm3)
Değerliği
Cr
24
51,9
[Ar] 3d5 4s1
1875
2665
7,19
+ 6, + 3, + 2
İyon yarıçapı(A°)
Atom yarıçapı(A°)
Birinci iyonlaşma
enerjisi (kcal/mol)
İkinci iyonlaşma enerjisi
(kcal/mol)
Elektronegatifliği
Erime ısısı(kcal/mol)
Buharlaşma
ısısı(kcal/mol)
Özgül ısısı(cal/g/°C)
Elektrik
iletkenliği(mikroohm–1)
Isı iletkenliği
(cal/cm2/cm/°C/sn)
Standart indirgenme
potansiyeli (volt)
Atom hacmi(w/d)
1,18
1,30
156
Mo
42
95,94
[Kr] 4d5 5s1
2610
4612
10,20
+ 6, + 5, + 4,+
3, + 2
1,30
1,39
166
W
74
183,85
[Xe] 4f14 5d4 6s2
3410
5660
19,30
+ 6, + 5, + 4,+ 3,
+2
1,36
1,41
184
381
374
409
1,6
3,30
72,97
1,8
6,60
128
1,7
8,15
185
0,11
0,078
0,061
0,19
0,032
0,181
0,16
0,35
0,40
(M+2/M) =0,20
(M+3/M)= -0,74
7,23
M+3/M)= -0,20
M+4/M)= 0,05
9,4
9,53
Tablo 5.2: Grup VI B elementlerinin bazı özellikleri
5.3. Kromun Doğada Bulunuşu
Doğada az bulunan bir elementtir, yer kabuğunun yaklaşık % 0,037’sini teşkil eder.
En önemli minerali kromit FeO.Cr2O3’tir. Bir diğer minerali de krokit denilen PbCrO4’tır.
Ülkemizde özellikle kromit hâlinde zengin krom yatakları vardır. Türkiye, dünya
krom ihtiyacının % 20’sini karşılar. Krom elde eden memleketlerin başında gelir. Balıkesir,
Bursa, Elazığ, İçel, Konya, Kütahya ve Muğla illerinde krom yatakları ve işletmeleri
bulunmaktadır.
5.4. Kromun Elde Edilmesi
Daha çok kromit mineralinden faydalanılır. Kromit minerali karbonla elektrik
fırınlarında indirgenirse ferro krom adı verilen ve % 60 dolayında krom içeren bir alaşım
elde edilir ki bu alaşım çelik üretiminde kullanılır.
52
FeO.Cr2O3 + 4 C
2 Cr + Fe + 4 CO
Saf krom metali, krom (III) oksidin alüminyumla indirgenmesiyle elde edilir. Bunun
için kromit minerali önce sodyum karbonatla veya potasyum karbonatla yüksek sıcaklıkta
havada kavrulur.
4 (FeO. Cr2O3) + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
Elde edilen sodyum kromat suda kolayca çözündüğü hâlde demir (III) oksit çözünmez.
Bu özellikten yararlanılarak sodyum kromat kolaylıkla Fe2O3’ten süzülerek ayrılır. Daha
sonra çözeltiye derişik sülfürik asit eklenmesiyle kromat, sodyum bikromata dönüştürülür.
2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Çözelti soğutulursa sodyum sülfat kristalleşir. Geride kalan çözeltinin buharlaştırılarak
deriştirilmesiyle sodyum bikromat kristalleri ayrılır. Sodyum bikromatın önce karbonla krom
(III) okside indirgenmesiyle saf krom elde edilir.
Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO
Cr2O3 + 2 Al → Al2O3 + 2 Cr
5.5. Kromun Özellikleri
Krom, oldukça sert ve gümüş beyazlığında bir metaldir. Toz hâlinde iken çok aktif
olan kromun bu aktifliği kütle hâlinde iken görülmez, üzerini kaplayan ince bir oksit (Cr2O3)
tabakası metali korur. Normal koşullarda koruyucu oksit tabakası nedeniyle havadan, sıcak
ve soğuk sudan ve deniz suyundan etkilenmez. Ancak yüksek sıcaklıkta su buharını
ayrıştırır.
2 Cr + 3 H2O → Cr2O3 + 3 H2
Yükseltgen olmayan asitler, HCl ve H2SO4, kroma soğukta yavaş sıcakta ise sıcaklığa
ve asidin derişimine bağlı olarak hemen etki eder ve hidrojen çıkışıyla açık mavi renkteki
krom (II) iyonunu verir.
Cr + 2 HCl → CrCl2 + H2
Ancak bu iyon, hava oksijeni ile hemen yeşil renkteki krom (III) iyonuna dönüşür.
4 Cr +2 + O2 + 4 H+ → 4 Cr +3 + 2 H2O
Sıcak ve derişik sülfürik asit kroma kükürt dioksit çıkışıyla etki eder ve krom (III)
sülfat verir.
2 Cr + 6 H2SO4 → Cr2(SO4)3 + 3 SO2 + 6 H2O
53
Nitrik asit (seyreltik veya derişik) soğukta, metal yüzeyinde oluşan koruyucu tabaka
nedeniyle etki etmez. Bu şekilde pasif hâle getirilmiş krom, sülfürik asit veya hidroklorik
asitten etkilenmez. Pasif olmayan krom, bakır, kalay ve nikel elementlerini çözeltilerinden
açığa çıkarabilir. Oldukça aktiftir.
3 Cu+2 + 2 Cr
→ 3 Cu + 2 Cr +3
Krom, ısıtıldığında klor, oksijen, azot, kükürt ve karbonla birleşerek krom (III) klorür
CrCl3, krom (III) oksit Cr2O3, krom (III) sülfat Cr2(SO4)3, krom nitrür CrN ve krom karbür
Cr2C3 verir. Bu tepkimeler için gerekli sıcaklık klordan karbona doğru artar.
Sodyum hidroksit çözeltisi kroma etki ederek sodyum kromit ve hidrojen verir.
2 Cr + 2 NaOH + 6 H2O → 2 NaCr(OH)4 + 3 H2 veya
2 Cr + 2 NaOH + 2 H2O → 2 NaCrO2 + 3 H2
5.6. Kullanıldığı Yerler ve Alaşımları
Kaplamacılıkta kullanılır (kromaj): Kaplama, isteğe göre dekoratif (5.10–5 cm
kalınlığında) veya koruyucu (7,5. 10–3 cm kalınlığında) olabilir. Kaplama işlemi
çoğunlukla elektro kaplama yolu ile yapılır. Elektrolit olarak sodyum bikromat
ve sülfürik asidin sudaki çözeltisi kullanılır.
Alaşımlarının yapımında kullanılır: Demir, nikel, mangan ve alüminyumla
önemli alaşımlar yapar. Bunlardan ferrokrom denilen alaşım % 60 – 70 krom, %
30 – 40 demir içerir. Kromit mineralinin elektrik fırınlarında kömürle
indirgenmesiyle elde edilir. Nikrom adıyla bilinen alaşımı % 60 Ni, % 25 Fe ve
% 15 Cr içerir. Kızıl derecede bile dayanıklı oluşu nedeniyle elektrik fırınlarının
yapımında kullanılır. Paslanmaz çelik ise % 12 – 14 kadar krom içeren çeliktir.
İçine az miktarda gümüş eklenmesi deniz suyuna karşı dayanıklılık kazandırır.
Diğer alaşımları aşağıda verilmiştir.
Alaşımın adı
İnkonel
Krom çeliği
Stellit
Kromel
Bileşimi
% 14 Cr, % 6 Fe ve % 80 Ni
% 1 Cr , % 98 Fe ve % 1 C
% 20 Cr, % 60 Co, %10 Mo ve % 10 W
% 10 Cr ve % 90 Ni
Tablo 5.3: Kromun diğer önemli alaşımları
54
5.7. Önemli Bileşikleri
Krom, bileşiklerinde en çok + 6, + 3 ve + 2 değerlikte olur. Bileşiklerinin hepsi
renklidir, krom ismi de Yunancadaki kroma ( renk) sözcüğünden gelmektedir.
5.7.1. Oksijenli Bileşikleri
Kromun en önemli oksitleri; krom (III) oksit Cr2O3, krom (VI) oksit CrO3, kromat
CrO4-2 ve bikromat Cr2O7-2 larıdır.
5.7.1.1. Krom (III) Oksit (Kromik Oksit) [Cr2O3 ]
Krom (III) hidroksit veya amonyum bikromatın ısıtılmasıyla elde edilir.
2 Cr(OH)3 → Cr2O3 + 3 H2O
(NH4)2Cr2O7 → Cr2O3 + N2 + 4 H2O
Endüstride, çoğunlukla sodyum bikromatın karbon veya kükürtle indirgenmesiyle elde
edilir.
Na2Cr2O7 + 2 C → Cr2O3 + Na2CO3 + CO
Na2Cr2O7 + S → Cr2O3 + Na2SO4
Yeşil renkte bir tozdur. Alüminyumla indirgenir. Krom (III) oksit elde edilirken uzun
süre ısıtılırsa asit ve bazlara karşı dayanıklılık kazanır. Normal olarak amfoterik özellik
gösterir. Asitlerle tuzlarını, bazlarla ise kromitleri verir.
Cr2O3 + 6 HCl → 2 CrCl3 + 3 H2O
Cr2O3 + 2 NaOH → 2 NaCrO2 + H2O
Sodyum kromit
5.7.1.2. Krom (VI) Oksit [CrO3 ]
Potasyum veya sodyum bikromat üzerine derişik sülfürik asit eklenmesiyle CrO3
kırmızı renkte elde edilir.
Na2Cr2O7 + 2 H2SO4 → 2 CrO3 + 2 NaHSO4 + H2O
Su ile çeşitli oranlarda birleşerek değişik asitleri verir.
CrO3 + H2O → H2CrO4
2 CrO3 + H2O → H2Cr2O7
55
3CrO3 + H2O → H2Cr3O10
Erime noktasının (197 °C) üstündeki sıcaklıklarda oksijen vererek krom (III) okside
dönüşür.
4 CrO3
→ 2 Cr2O3 + 3 O2
5.7.2. Kromatlar [ CrO4-2]ve Bikromatlar [ Cr2O7-2]
Kromun + 6 değerlikte olduğu en önemli bileşikler kromat ve bikromatlarıdır. Alkali
metaller, magnezyum ve kalsiyumun kromatları suda çözünür. Diğer bütün kromatlar suda
çözünmez. Kromat iyonu sarı, suda çözünmeyen bazı kromatlar ise (Ag2CrO4 gibi) kırmızı
renktedir.
Kromatlar, krom (III) tuzlarının yükseltgenmesiyle elde edilir. Yükseltgenme, sodyum
peroksit eritişiyle veya sodyum peroksitin krom (III) tuzu çözeltilerine eklenmesiyle
yapılabilir.
2 Cr+3 + 3 O2 + 4 OH- → 2 CrO4–2 + 2 H2O
Kromatlar, asidik ortamda portakal sarısı rengindeki bikromatlara dönüşür.
2 CrO4–2 + 2 H+ Cr2O7–2 + H2O
Kromat bileşiği, suda çözünmeyen bir metalin katyonu, bikromat çözeltisine eklenirse
metalin kromatı çöker.
2 Pb+2 + Cr2O7–2 + H2O → 2 PbCrO4 + 2 H+
Sodyum bikromat, kromit mineralinin sodyum karbonatla bol oksijenli ortamda
ısıtılmasıyla oluşan sodyum kromatın asitle tepkimesiyle elde edilir.
4 (FeO. Cr2O3) + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Potasyum bikromat; sodyum bikromat çözeltisine potasyum klorür eklenmesiyle elde
edilir, daha az çözünen potasyum bikromat çöker.
Na2Cr2O7 + 2 KCl → K2Cr2O7 + 2 NaCl
Potasyum bikromat çözeltisi içinden sülfürik asitli ortamda kükürttrioksit geçirilirse
potasyum – krom şapı elde edilir.
K2Cr2O7 + H2SO4 + 3 SO2 → K2SO4 + Cr2(SO4)3 + H2O
veya
56
[2 KCr(SO4)2 . 12 H2O]
Bikromatın veya kromatın sülfürik asitle karışımı, laboratuvarlarda cam
malzemelerinin temizlenmesinde kullanılır. Bu karışımda temizleme görevini, oluşan krom
(VI) oksit yapar.
Na2Cr2O7 + 2 H2SO4 → 2 CrO3 + 2 NaHSO4 + H2O
5.7.3. Halojenürleri
Kromun + 2’den + 6’ya kadar bütün değerliklerde, halojenür bileşikleri vardır.
Florürlerinden krom (II) florür, kızgın metal üzerinden hidrojen florür gazı geçirilmesiyle
elde edilir. Renksiz bir katıdır, suda çözünmez.
Cr + 2 HF → CrF2 + H2
Krom (III) florür, krom (III) klorürün hidrojen florürle birlikte ısıtılmasıyla elde edilir.
CrCl3 + 3 HF → CrF3 + 3 HCl
Değişik sayıda kristal suyu içerebilir. Susuz iken yeşil renktedir. 1400 °C’de erir. Açık
havada ısıtılırsa bozunur. Flor gazıyla birlikte 350- 500 °C’ye ısıtılırsa krom (IV) ve krom
(V) florür verir.
4 CrF3 + 3 F2 → 2 CrF4 + 2 CrF5
Bunlardan krom (IV) florür kırmızı renktedir ve 30 °C’de erir. Krom (V) florür ise
yeşil renktedir ve 100 °C’de süblimleşir. Krom (VI) florür, krom (V) florüre flor gazı
etkisiyle elde edilir. Ancak -100 °C’nin üstündeki sıcaklıklarda kararlı değildir.
Krom klorür bileşiklerinden krom (II) klorür, krom metali üzerinden 600 - 700 °C’de
hidrojen klorür gazı geçirmekle veya krom (III) klorürün 500- 600 °C’de hidrojenle
indirgenmesiyle elde edilir.
Cr + 2 HCl
CrCl2 + H2
2 CrCl + 2 HCl
2 CrCl3 + H2
2
Krom (II) klorür, krom halojenürlerinin en önemlisidir. Suda kolayca çözünerek
serbest Cr+2 iyonlarını verir. Çözeltisi açık mavi renktedir ve çok iyi bir indirgendir. Krom
(III) klorür, krom (III) oksidin karbon ve klor gazıyla birlikte ısıtılmasıyla elde edilir.
2 CrCl + 3 CO
Cr2O3 + 3 C + 3 Cl2
3
Mor renktedir, 1300 °C’de süblimleşir suda az çözünür. Kristal suyu ile birlikte
[Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2. H2O ve [Cr(H2O)4 Cl2]Cl. 2 H2O yapılarında bulunur.
57
5.7.4. Diğer Bileşikleri
Krom (II) sülfat, krom (II) klorürün sülfürik asitle tepkimesiyle elde edilir.
Çoğunlukla yedi mol kristal suyu içerir. Alkali metallerin sülfatlarıyla çift tuz
yapar.
Krom (III) sülfat, krom metali üzerine sülfürik asit etkisiyle elde edilir.
2 Cr + 3 H2SO4 → Cr2(SO4)3 + 3 H2
Kristal suyu bulunmadığında kırmızı renktedir, kristallendirilmesi zordur. Krom
şapında olduğu gibi kompleks yapıdadır. Bu tuz amonyum veya alkali metallerin
sülfatlarıyla 12 mol kristal suyu içerecek şekilde birleşerek krom şapını verir. En önemli
krom şapı, potasyumla yaptığı K2SO4. Cr2(SO4)3 . 12 H2O’dur.
Krom (III) fosfat, krom (III) tuzları çözeltisine disodyum fosfat eklenmesiyle
elde edilir.
Cr+3 + Na2HPO4 → CrPO4 + H+ + 2 Na+
Kristal suyunun sayısına göre değişik renklerdedir. Örneğin altı mol kristal suyunu
içerdiğinde mor; iki veya dört mol içerdiğinde yeşil; ısıtılarak suyunu kaybettiğinde ise siyah
renktedir.
Kromil klorür (CrO2Cl2) krom (VI) okside hidrojen klorür etkisiyle elde edilir.
CrO3 + 2 HCl → CrO2Cl2 + H2O
Bu bileşik kuvvetle hidroliz olur. Oda sıcaklığında kırmızı renkli bir sıvıdır. Kapalı bir
tüpte 180 °C’de ısıtılırsa siyah renkte bir toz verir. Flor veya hidrojen florürle birlikte
ısıtılırsa kahve renkli ve uçucu bir bileşik olan kromil florüre dönüşür.
CrO F + 2 HCl
CrO2Cl2 + 2 HF
2 2
Kromil florür uzun süre bekletilirse beyaz renkteki polimerik bir maddeye dönüşür.
5.8. Laboratuvarda Sodyum Kromat Elde Edilmesi
Deney tüpüne 2 mℓ krom (III) sülfat çözeltisi alınır. Çökelek oluşup çözününceye
kadar 2 M NaOH çözeltisinden azar azar ilave edilir. Karışıma spatülün ucu ile az miktarda
sodyum peroksit katısı katılıp su banyosunda dikkatlice ısıtılır. Oluşan sarı renkli çözelti
sodyum kromatın oluştuğunu belirtir.
Araç ve gereçler: Isıtıcı, beher, deney tüpü, katı Na2O2, 2 M NaOH, 2 M Cr2(SO4)3
58
Şekil 5.1: Sodyum kromat kristalleri
59
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Öneriler
Deney tüpüne 2 mℓ krom (III) çözeltisi alınız.
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı
hazırlayınız
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve
gereçlerin temizliğine dikkat
ediniz.
Çökelek oluşup çözününceye kadar sodyum
hidroksit ekleyiniz.
Çökelek oluşumu ve
çözünme olaylarının
denklemlerini yazmaya
çalışınız.
60
Çözelti üzerine spatül ucu ile sodyum peroksit
ekleyiniz.
Na2O2’yi azar azar kontrollü
olarak katmalısınız, aksi
hâlde aşırı gaz çıkışını
olabilir.
Oluşan sarı renkli çözeltiyi gözlemleyiniz.
Yükseltgenme olayının
denklemini yazmaya
çalışınız.
61
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Kromun aşağıda verilen hangi değerlikli bileşiği yoktur?
A) +7
2.
B) Kırmızı
C) Mor
D) Sarı
B) Na2Cr2O7
C) Na2CrO7
D) NaCr2O7
1,04 gram krom üzerine yeterince seyreltik sülfürik asit etki ettiğinde NŞA’da kaç litre
H2 gazı açığa çıkar? (Cr : 52)
A) 0,112
5.
D) +3
2 Na2CrO4 + H2SO4 → .................+ Na2SO4 + H2O
Yukarıda denkleştirilmiş tepkime denkleminde boş bırakılan yere aşağıdakilerden
hangisi yazılmalıdır?
A) Na2CrO4
4.
C) +5
Na2CrO4 bileşiğinin rengi aşağıdakilerden hangisidir?
A) Turuncu
3.
B) +6
B) 0,224
C) 0,672
D) 1,12
5 kg kromel (% 10 Cr ve % 90 Ni ) alaşımı yapmak için kaç gram krom gerekir?
A) 5
B) 50
C) 500
D) 5000
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak, tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
62
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Deney tüpüne krom (III) çözeltisi aldınız mı?
Çökelek oluşup çözününceye kadar sodyum hidroksit eklediniz
mi?
Çözelti üzerine spatül ucu ile sodyum peroksit eklediniz mi?
Oluşan sarı renkli çözeltiyi gözlemlediniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
63
ÖĞRENME FAALİYETİ-6
ÖĞRENME FAALİYETİ-6
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak asidik ve bazik ortamda potasyum
permanganatı inceleyebilecek bilgi, beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Bir çözeltide Mn+2 iyonunun varlığını nasıl belirleyebilirsiniz? Araştırınız.
Manganometri ne demektir? Niçin yapılır? Araştırınız.
6. MANGAN
6.1. Grup (VII) B Elementleri
Geçiş metalleri olan mangan (Mn), teknetyum (Tc) ve renyum (Re) elementlerinin
oluşturduğu düşey sütuna Grup (VII) B elementleri denir. Grup elementlerinden en
önemlisi mangandır. Teknetyum doğada bulunmaz, kısa ömürlü radyoaktif izotopları hâlinde
görülür. Renyum ise doğada çok az miktarlarda bulunur.
H
Li
He
Be
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
8B
Na
Mg
3B 4B
5B
6B
7B
1B
2B
K
Ca
Sc
Ti
V
Cr
25Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
43Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
75Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lw
Tablo 6.1: Periyodik çizelge
64
Özellikler
Sembolü
Atom numarası
Atom kütlesi
Elektron dizilişi
Erime noktası (°C)
Kaynama noktası (°C)
Öz kütlesi (g/cm3)
Değerliği
İyon yarıçapı (A°)
Atom yarıçapı (A°)
Birinci iyonlaşma
enerjisi (kcal/mol)
İkinci iyonlaşma enerjisi
(kcal/mol)
Elektronegatifliği
Erime ısısı (kcal/mol)
Buharlaşma ısısı
(kcal/mol)
Özgül ısısı (cal/g/°C)
Elektrik iletkenliği
(mikroohm–1)
Isı iletkenliği
(cal/cm2/cm/°C/sn)
Standart indirgenme
potansiyeli (volt)
Atom hacmi (w/d)
Mangan
Mn
25
54,94
[Ar] 3d5 4s2
1245
2150
7,43
+7, + 6, + 4,+ 3
+2
1,17
1,35
171
Teknetyum
Tc
43
98
[Kr] 4d5 5s2
2140
11,5
+7
1,27
1,36
167
Renyum
Re
75
186,2
[Xe] 4f14 5d5 6s2
3180
5900
21,0
+7,+ 6, + 4, + 2
-1
1,28
1,37
182
362
353
384
1,5
3,50
53,7
1,9
5,50
120
1,9
7,90
152
0,115
0,054
-
0,033
0,051
-
-
0,17
(M+2/M) = -1,18
M+2/M)= 0,4
M+4/M)= 0,25
7,39
-
9,85
Tablo 6.2: Grup VII B Elementlerinin bazı özellikleri
6.2. Genel Özelikleri
Gruptaki bütün elementler gümüş parlaklığında metallerdir. Kolayca kararırlar. Erime
noktaları ve yoğunlukları bulundukları periyottaki diğer elementlerin çoğundan daha
fazladır. Örneğin renyum, tungstenden sonra erime noktası en yüksek olan ikinci elementtir.
Mangan başka metallerle alaşımlar yapar, çeliğin sertleşmesinde önemli bir rol oynar.
Grup elementlerinden hiçbiri ferromanyetik özellikte olmadığı hâlde alaşımları
ferromanyetik özelliktedir. Bu, alaşımı oluşturan metal bağlarındaki elektron bantlarının
demir, kobalt ve nikel gibi ferromanyetik elementlerdeki elektron yapısında olduğunu
gösterir.
65
Gruptaki genel eğilim, atom numarası arttıkça yüksek değerliğin (oksitlenme
sayısının) kararlılığının artmasıdır. Ancak, renyumdaki – 1 değerlik bir ayrıcalık. Yüksek
oksitlenme sayısında mangan iyi, renyum ise zayıf bir yükseltgendir. Düşük oksitlenme
sayısında ise renyum iyi, mangan zayıf bir indirgendir. İncelenen az sayıdaki bileşiklerinde
teknetyum, renyuma benzer. Bu grup elementleri + 7 değerlikli iken grup VII A
elementlerine (halojenlere) benzer. Örneğin, mangan (VII) oksit Mn2O7, klor (VII) oksit
Cl2O7 gibi uçucu ve kararsız bir sıvıdır. Potasyum permanganat KMnO4 da potasyum
perklorat KClO4 gibi yükseltgendir.
Grup içinde mangandan renyuma doğru yüksek değerliğin kararlılığının ve kovalent
bağ yapma özelliğinin artması, kompleks bileşikler oluşturma eğilimini artırır. Renyum + 3,
+ 4 ve + 5 değerliklerde iken birçok kompleksler verirken mangan + 2, + 3 ve + 4
değerliklerde daha az sayıda kompleks bileşikler oluşturur. Bu metallerin tek basit katyonu
+ 2 değerlikteki mangan katyonudur. Grup VII B elementlerinin bazı özellikleri Tablo 6.2’de
verilmiştir.
6.3. Manganın Doğada Bulunuşu
Mangan, doğada az bulunan bir elementtir. Yer kabuğunun yaklaşık % 0,08’ini teşkil
eder. En önemli minerali siyah renkteki pirolusit [MnO2 ]’tir. Daha az önemli mineralleri ise
braunit [Mn2O3]( çoğunlukla demir oksitle birlikte bulunur), manganit [Mn2O3 . H2O],
hauzmanit [Mn3O4] ve rodokrosit ( mangan spatı)[MnCO3 ]ve manganez blendi [MnS ]’dir.
Ülkemizde Eskişehir, Fethiye, Ereğli, Afyon ve Kütahya çevresinde zengin mangan
mineralleri vardır.
6.4. Manganın Elde Edilmesi
Mangan, en çok çelik üretiminde çeliğin özelliklerini iyileştirmede kullanılır ve bu
amaçla kullanılan ise ferromangan adı verilen alaşımıdır. Ferromangan % 80’e kadar
mangan bulunabilir ve pirolusit, demir oksit ve kömür karışımının yüksek fırında
indirgenmesiyle elde edilir.
Saf mangan, alüminotermi tepkimesiyle elde edilir. Bu amaçla pirolusit ısıtılarak önce
Mn3O4 e çevrilir. Daha sonra alüminyumla indirgenerek saf mangan elde edilir.
3 Mn3O4 + 8 Al → 9 Mn + 4 Al2O3
6.5. Manganın Özellikleri
Mangan, gümüş parlaklığında bir metaldir. Yoğunluğu kromunkinden biraz daha fazla
olduğu hâlde erime ve kaynama noktaları kromunkinden düşüktür. Bunun nedeni manganın
yarı dolmuş d yörüngeleriyle ilgilidir. Bu onun kararlılığını artırır ve daha az metalik bağ
yapmasını sağlar.
66
Mangan, kroma oranla daha çok elektropozitiftir. Bu durum periyotta beklenenin
tersidir, dördüncü periyottaki geçiş elementleri içinde en aktifidir.
Mangan, normal koşullarda havada kararlıdır. Geçiş elementleri içinde suda hidrojen
açığa çıkarabilen tek metaldir. Bunun nedeni, aktifliğinin yüksek oluşu ve oluşan hidroksidin
koruyucu özellikte olmayışıdır. Hidroklorik asit ve seyreltik sülfürik asit hidrojen çıkışıyla
etki eder ve Mn+2 iyonlarını verir. Soğuk ve çok seyreltik nitrik asit de hidrojen çıkışı ile etki
eder.
Mn + 2 HCl → MnCl2 + H2
Ancak derişik nitrik asit azot oksitleri çıkışıyla tepkime verir. Derişik ve sıcak sülfürik
asit kükürtdioksit çıkışıyla etki eder. Alkali baz çözeltileri mangana hiç etki etmez veya çok
az etki eder.
6.6. Manganın Kullanıldığı Yerler
Manganın büyük bir kısmı çelik üretiminde kullanılır. Mangan, çeliğe özel bir
sertlik ve aşınmaya karşı dayanıklılık verir.
Mangan tuncu, % 30 mangan ve % 70 bakırdan ibarettir. Tuzlu su korozyona
karşı dayanıklı olduğundan özellikle gemi endüstrisinde çok kullanılır.
Manganın % 84 bakır, % 12 mangan ve % 4 nikel bulunduran bir alaşımdır. Bu
alaşım elektrik araçlarının ve standart dirençlerin yapımında kullanılır. Çünkü
alaşımın elektrik direnci sıcaklıkla çok az değişir.
Mangan oranı % 5 – 20 arasında olan demir alaşımı, parlak görünümü nedeniyle
demir aynası olarak adlandırılır. Mangan, çeliğe özel bir sertlik ve aşınmaya
karşı dayanıklılık verdiği gibi çelikteki oksijen, azot ve kükürt gibi safsızlıkları
da giderir.
6.7. Manganın Önemli Bileşikleri
Mangan bileşiklerinde + 2, + 3, + 4, + 5, + 6 ve + 7 değerlikler de bulunabilir.
Bunlardan + 2 ve + 3 değerlikli olanlar suda bazik, + 4 değerlikli olanlar amfoterik, diğer
değerliklerde olanlar ise asidik özellik gösterir.
6.7.1. İki Değerlikli Mangan Bileşikleri
Manganın Mn+2 iyonu, sulu çözeltilerinde en kararlı iyonudur. Mangan (II) nin klorür,
bromür, iyodür, nitrat, sülfat ve perklorat tuzları suda kolayca çözünür. Bu bileşikler
genellikle açık pembe renkte ve kristal suyu içeren kristaller oluşturur. Öte yandan karbonat,
oksalat, florür, fosfat ve sülfat tuzları suda çözünmez, seyreltik asitlerde çözünür.
67
6.7.7.1 Mangan (II) Oksit [ MnO ]ve Mangan (II) Hidroksit [Mn(OH)2 ]
Mangan (II) oksit yeşil renkte, suda çözünmeyen bir katıdır. Mangandioksidin
hidrojen veya karbonmonoksitle indirgenmesiyle,
MnO2 + 2 H2 → MnO + 2 H2O
MnO2 + CO → MnO + CO2
veya mangan karbonat ya da mangan hidroksidin azot akımında ısıtılmasıyla elde
edilir.
MnO + CO
MnCO3
2
MnO + H O
Mn(OH)2
2
Mangan (II) oksit bazik özelliktedir. Seyreltik asitlerle mangan (II) tuzlarını verir.
MnO + 2 HCl → MnCl2 + H2O
Mangan (II) oksit indirgendir, havada kolayca mangan (III) okside ve zamanla
mangandiokside yükseltgenir.
4 MnO + O2 → 2 Mn2O3
2 Mn2O3 + O2 → 4 MnO2
Mangan (II) hidroksit, mangan (II) tuzu çözeltilerine kuvvetli bir baz eklenmesiyle
beyaz renkte çöker.
Mn+2 + OH- → Mn(OH)2 Kç = 2.10–13
Mangan (II) hidroksit orta kuvvette bir bazdır. Mangan (II) oksit gibi indirgendir.
Havada hidrata mangandioksit verir.
Mn(OH)2 + ½ O2 → MnO2.H2O
6.7.1.2. Mangan (II) Klorür [MnCl2 ]ve Mangan (II) Sülfat [ MnSO4 ]
Mangandioksidin asitli ortamda klorürle indirgenmesiyle elde edilir.
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
MnO2 + 2 NaCl + 2 H2SO4 → MnSO4 + Na2SO4 + 2 H2O + Cl2
68
Mangan (II) klorür dört mol kristal suyu varken açık pembe renktedir. Mangan
dioksitten klor elde edilmesinde yan ürün olarak görülür. Mangan (II) sülfat, ısıtmakla
bozunmayan ve değişik sayıda (1, 2, 3, 4, 5, veya 7 ) kristal suyu bulunan bir tuzdur. Boya
endüstrisinde kullanılır.
6.7.2. Üç Değerlikli Mangan Bileşikleri
Mangan (II) tuzlarının yükseltgenmesiyle mangan (III) elde edilir. Ancak mangan (III)
iyonu çözeltilerde kararsızdır, kolaylıkla mangan (II) iyonuna indirgenir. Mangan (II) tuzu
hidroflorik asitli ortamda potasyum permanganatla yükseltgenirse oluşan mangan (III) ,
potasyum pentafloromanganat [K2MnF5] hâlinde kararlıdır.
4 Mn+2 + KMnO4 + 8 H+ → 5 Mn+3 + 4 H2O + K+
Mn+3 + 5 F- + 2 K+ → K2MnF5
MnPO4. H2O formülü ile gösterilen mangan (III) fosfat da Mn2Mn(PO4)3. 3 H2O
şeklinde kompleks bir tuzdur.
6.7.2.1 Mangan (III) Oksit [Mn2O3 ]
Siyah renkte bir tozdur. Mangandioksitin 700 °C’de uzun süre ısıtılmasıyla elde edilir.
Daha fazla ısıtılırsa karışık oksit Mn3O4 oluşur.
4 MnO2 → 2 Mn2O3 + O2
Mn O + O
3 MnO2
3 4
2
Mangan (III) oksit, derişik asitte çözünerek yeşil renkte mangan (III) sülfat kristalleri
verir, kararsız bir bileşiktir.
Mn2O3 + 3 H2SO4 → Mn2(SO4)3 + 3 H2O
6.7.3. Dört Değerlikli Mangan Bileşikleri
+ 4 değerlikteki en önemli mangan bileşiği mangandioksittir.
6.7.3.1. Mangan (IV) Oksit [ MnO2 ]
Mangan (IV) oksit siyah renkli bir katıdır. Doğada pirolusit minerali hâlinde bulunur.
Mangan (II) nitratın ısıtılmasıyla
MnO + 2 NO
Mn(NO3)2
2
2
veya mangan (II) tuzlarının herhangi bir yükseltgenle yükseltgenmesiyle elde edilir.
69
Mn+2 + K2S2O8 + 2 H2O → MnO2 +2 H2SO4
Mangan (IV) oksit suda ve seyreltik asitlerde çözünmeyen amfoterik bir oksittir.
Alkali bazlarda çözünerek manganinleri verir.
MnO2 + 2 NaOH → Na2MnO2 + H2O
Mangan (IV) oksit derişik hidroklorik aside çözünerek hekzakloro manganatı verir.
MnO2 + 6 HCl → H2MnCl6 + 2 H2O
Hekzakloro manganatı iyonu, mangan tetraklorürden de elde edilebilir, fakat mangan
(IV) klorür kararsız olup kolaylıkla mangan (II) klorüre indirgendiğinden elde
edilememektedir. Kararlı bir iyon olmayan hekzakloro manganat klor gazı vererek bozunur.
MnCl6–2 → Mn+2 + 4 Cl- + Cl2
Bu nedenle mangan (IV) oksit derişik hidroklorik asidi klor gazına, sülfit iyonunu
ditiyonata yükseltgenir.
MnO2 + 2 SO3–2 + 4 H+ → Mn+2 + S2O6–2 + 2 H2O
Oksalik asitle olan yükseltgeme tepkimesi pirolusit mineralindeki mangan (IV) oksit
yüzdesini bulmak için kullanılır.
MnO2 + (COOH)2 + H2SO4 → MnSO4 + 2 CO2 + 2 H2O
Bu işlem için pirolusit mineraline katı mangan (IV) oksit kayboluncaya kadar standart
oksalik asit çözeltisinden belli miktarda eklenir. Asidin fazlası standart permanganatla geri
titre edilir.
Mangan (IV) oksidin kullanım alanı oldukça geniştir. En çok ferromangan alaşımının
ve mangan bileşiklerinin yapımında kullanılır. Ayrıca seramik endüstrisinde sır yapımında
ve camın rengini gidermede kullanılır. Renk giderici etkisi, yeşil renkteki demir (II)
silikatları daha az belirgin renkteki demir (III) bileşiklerine yükseltgenmesindendir. Yine
yükseltgen etkisi nedeniyle kuru pillerde ve yağlı boyaların havada oksitlenip sertleşmesini
geciktirmede uygun bir kurutucu olarak kullanılır.
6.7.4. Altı Değerlikli Mangan Bileşikleri
Mangan, + 6 değerlikteki bileşiklerinde hep kovalent bağ yapar. Serbest Mn +6 iyonu
bulunmamaktadır. Mangan (VI) oksit [MnO3]kararsız olduğundan elde edilemez. Buna
karşın manganat kompleks iyonu [MnO4–2] , mangan (VI) okside oranla daha kararlıdır ve
tuzları hâlinde elde edilir.
70
6.7.4.1. Potasyum Manganat [ K2MnO4 ]
Potasyum manganat, manganın + 6 değerlikte kararlı olduğu MnO4–2 iyonunu içerir.
Bu bileşik mangan (IV) oksidin potasyum hidroksit ve bir yükseltgenle (KNO3, KClO3 ve
hava akımı gibi) tepkimesi sonucu elde edilir.
2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O
Potasyum manganat koyu yeşil kristallerden oluşur. Suda çok çözünür ve K+ ve
iyonlarını içeren yeşil renkte bir çözelti oluşturur. Manganatlar kuvvetli yükseltgen
dirler ve bir dereceye kadar dezenfekten olarak kullanılırlar.
MnO4–2
Manganat iyonu permanganata [MnO4-] kolayca yükseltgenir.
2 MnO4–2 + Cl2 → 2 MnO4- + 2 ClAlkali çözeltilerde kararlı, zayıf bazik ve nötral çözeltiler ile zayıf asidik çözeltilerde
kararsızdır. Kendiliğinden permanganata yükseltgenir ve mangan (IV) okside indirgenir.
3 MnO4–2 + 2 H2O 2 MnO4- + MnO2 + 4 OHYeşil
mor- menekşe
6.7.5. Yedi Değerlikli Mangan Bileşikleri
Manganın + 7 değerlikteki bileşiklerinden en önemlisi mangan (VII) oksit ve
potasyum permanganattır.
6.7.5.1. Mangan (VII) Oksit [ Mn2O7 ]
Mangan (VII) oksit, potasyum permanganat üzerine derişik sülfürik asit eklenmesiyle
elde edilir.
2 KMnO4 + H2SO4 → Mn2O7 + K2SO4 + H2O
Koyu kahve renkli, ağır yağımsı bir maddedir. Oda sıcaklığında yavaş, ısıtıldığında ise
patlama şeklinde bozunur.
4 MnO + 3 O
2 Mn2O7
2
2
Bu nedenle laboratuvar çalışmalarında potasyum permanganat üzerine derişik sülfürik
asit eklememeye dikkat etmek gerekir. Mangan (VII) oksit kuvvetli bir yükseltgen
olduğundan organik maddeleri yükseltger.
71
6.7.5.2. Potasyum Permanganat [ KMnO4 ]
Değişik yöntemlerle elde edilebilir. Potasyum manganat çözeltisinin elektroliziyle
anottan (nikel anot, demir katot)
MnO4–2 → MnO4- + eveya endüstride mangan (IV) oksidin potasyum hidroksitle karıştırılıp eritilmesi, hava
oksijeni ile oksitlenmesi ve içinden klor gazı geçirilmesiyle permanganat elde edilebilir.
2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O
2 K2MnO4 + Cl2 → 2 KMnO4 + 2 KCl
Çözelti ısıtılırsa suyunun bir kısmını kaybeder ve daha az çözünen KMnO4 kristalleri
dipte toplanarak ayrılır. Mangan (II) tuzları çözeltilerinin bir yükseltgenle ( persülfat iyonu
S2O8–2) yükseltgenmesiyle de permanganat elde edilir.
2 Mn+2 +5 S2O8–2 + 8 H2O
Ag
2 MnO4- + 10 SO4–2 + 16 H+
Bu tepkime Ag+ iyonlarının katalizörlüğü altında olur.
Potasyum permanganat, manganın en önemli bileşiğidir. Koyu mavi - kırmızı
prizmalar hâlindedir. Suda kolayca çözünüp permanganat iyonunun karakteristik rengi olan
mor renkte bir çözelti verir. Kuvvetli bir yükseltgendir, dezenfektan olarak kullanılır.
Analitik kimya laboratuvarlarında en çok kullanılan maddelerden biridir. İndirgenme
ürünleri ortamın asitlik derecesine göre farklıdır. Örneğin, asidik ortamda 5 elektron alarak
Mn+2 ye,
MnO4- + 8 H+ + 5 e- → Mn+2 + 4 H2O
nötral ve zayıf bazik çözeltilerde 3 elektron alarak MnO2’e
MnO4- + 2 H2O + 3 e- → MnO2 + 4 OHkuvvetli bazik çözeltilerde ise yalnız bir elektron alarak manganat iyonuna indirgenir.
MnO4- + e- → MnO4–2
6.8. Asidik ve Bazik Ortamda Potasyum Permanganatı
Özelliklerinin İncelenmesi
Bir deney tüpünün içine 2 mℓ KMnO4 çözeltisi alınır. Üzerine 1, 2 damla sülfürik asit
katılır ve karışıma 1,2 damla hidrojen peroksit ilave edildiğinde potasyum permanganatın
mor – menekşe renginin kaybolduğu görülür.
2 KMnO4 + 3 H2SO4 + 5 H2O2 → K2SO4 + 2 MnSO4 + 8 H2O + 5 O2
Bir başka deney tüpüne 2 mℓ KMnO4 çözeltisi alınır. Üzerine 1, 2 damla sodyum
hidroksit katılır ve karışıma 1, 2 damla hidrojen peroksit ilave edildiğinde potasyum
permanganatın mor – menekşe renginin kaybolduğu ve siyah bir çökeleğin oluştuğu görülür.
Araç ve gereçler: Deney tüpü, 0,1 M KMnO4 çözeltisi, 4 M H2SO4, 2N NaOH
çözeltisi, % 3’lük H2O2 çözeltisi
72
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Öneriler
İki adet deney tüpü alınız.
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı
hazırlayınız.
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve
gereçlerin temizliğine dikkat
ediniz.
Birinci deney tüpüne potasyum permanganat
çözeltisi alınız.
Dikkatli ve titiz çalışınız.
Üzerine sülfürik asit ekleyiniz.
Sülfürik asidi damla damla ve
dikkatli bir şekilde ilave ediniz.
H2SO4 asit yakıcıdır, giysi ve
cildinize temas etmesini
önleyiniz, temas etmiş ise bol
su ile yıkayınız.
73
Karışıma hidrojen peroksit damlatıp renk
değişimini gözlemleyiniz.
Tepkime esnasında bir gaz çıkışı
olup olmadığını gözlemleyiniz.
Hidrojen peroksidin aşırısını ekleyip gözleminizi
yazınız.
Tepkimenin denklemini
yazmaya çalışınız.
İkinci deney tüpüne potasyum permanganat
çözeltisi alınız.
Dikkatli ve titiz çalışınız.
74
Üzerine sodyum hidroksit ekleyiniz.
Dikkatli ve titiz çalışınız.
Üzerine hidrojen peroksit çözeltilerini ekleyip
renk değişimini gözlemleyiniz.
Siyah renkli bileşiğin
formülünü yazmaya çalışınız.
Hidrojen peroksit aşırısını ekleyip gözleminizi
yazınız.
Tepkimenin denklemini
yazmaya çalışınız.
75
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Mn3O4 + Al → Mn + Al2O3
Yukarıdaki tepkime denklemi denkleştirildiğinde alüminyum metalinin kat sayısı kaç
olur?
A) 2
2.
B) K2MnO4
C) 2 K2MnO4
D) 4KMnO4
B) 100
C) 200
D) 400
Manganın hangi değerlikli bileşiği amfoter özelliktedir?
A) 4
5.
D) 8
5,5 g mangan metalinin tamamının tepkimeye girebilmesi için 2M HCl asit
çözeltisinden kaç mℓ gerekir? Hesaplayınız. (Mn: 55)
A) 10
4.
C) 6
2 MnO2 + 4 KOH + O2 → ............ + 2 H2O
Yukarıdaki tepkime denkleminde boş bırakılan yere aşağıdakilerden hangisi
yazılmalıdır?
A) KMnO4
3.
B) 4
B) 3
C) 2
D) 5
2KMnO4 + 3 H2SO4 + 5 H2O2 → K2SO4 + 2 MnSO4 + 8 H2O + 5 O2
Yukarıdaki tepkime denkleminde mangan kaç elektron alarak indirgenmiştir?
A) 7
B) 5
C) 4
D) 3
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
76
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
İki adet deney tüpü aldınız mı?
Birinci deney tüpüne potasyum permanganat çözeltisi aldınız
mı?
Üzerine sülfürik asit ve hidrojen peroksit damlattınız mı?
Renk değişimini gözlemlediniz mi?
İkinci deney tüpüne potasyum permanganat çözeltisi aldınız mı?
Üzerine sodyum hidroksit ve hidrojen peroksit çözeltilerini
eklediniz mi?
Renk değişimini gözlemlediniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
77
ÖĞRENME FAALİYETİ-7
ÖĞRENME FAALİYETİ-7
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak demir (II) klorür elde edebilecek
bilgi, beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Demirin insan sağlığına etkisi nelerdir? Araştırınız.
Demir mineralleri ülkemizde nerelerde bulunur? Araştırınız.
7. DEMİR
7.1. Grup VIII B Elementleri
Demir (Fe), kobalt (Co), nikel (Ni), rutenyum (Pu), rodyum (Rh), paladyum (Pd),
osmiyum (Os), iridyum (İr) ve platin(Pt) elementlerinin oluşturduğu gruba grup VIII
elementleri denir.
H
Li
He
Be
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
8B
Na
Mg
3B 4B
5B
6B
7B
1B
2B
K
Ca
Sc
Ti
V
Cr
Mn
26Fe
27Co
28Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lw
Tablo 7.1: Periyodik çizelge
Bu grup elementlerinin kimyasal özellikleri, periyodik çizelgede daha çok yana doğru
benzerlik gösterdiğinden diğer grup elementlerinden farklı olarak yukarıdan aşağıya değil,
yana doğru incelenir.
78
Birinci sıradaki elementlerin özellikleri birbirine çok benzer. Bu nedenle demir, kobalt
ve nikel elementleri demir üçlüsü olarak, diğerleri platin grubu elementleri olarak incelenir.
7.2. Demir Grubu Metallerinin Genel Özellikleri
Genel olarak tel ve levha hâline getirilebilirler, elektrik ve ısıyı çok iyi iletirler. Bu
grup elementlerinin bazı özellikleri Tablo 7.2’de verilmiştir. Çizelgede de görüldüğü gibi
kobalt ve nikelin fiziksel özellikleri demirden çok birbirine benzer. Bu benzer özellik, kobalt
ve nikelin kimyasal özelliklerinde de görülür. Her üç element paramanyetik özellik
göstermekle birlikte demir daha kuvvetli paramanyetiktir. Her üç elementin erime noktası
yüksektir. Demir, nemli havada paslandığı hâlde kobalt ve nikel havada ısıtılırsa oksitlenir.
Kızıl dereceye ısıtılmış demir üzerinden su buharı geçirilirse hidrojen vererek manyetik
demir oksit Fe3O4 oluşur. Öte yandan kobalt ve nikel, kobalt (II) oksit ve nikel (II) oksit
oluşturur. Her üç metalin toz hâlindeki şekli katalizör olarak önemli bir rol oynar. Demir,
özellikle amonyağın yükseltgenmesinde, nikel ise doymamış hidrokarbonların
hidrojenlenmesinde önemli birer katalizördür.
Saf hâlde demir, oldukça yumuşak bir metalken; kobalt sert, nikel ise daha serttir.
Metallerin üçü de çeşitli kompleks bileşikler yapar. Ancak nikelin kompleks bileşik yapma
eğilimi daha azdır. Bu yönüyle kobalt demire, nikel ise bakıra benzer.
Demirin en çok görülen değerlikleri + 2 ve + 3 tür. Bu değerliklerinde hem basit hem
de kompleks bileşikler yapabilir. Kobalt basit bileşiklerinde + 2 değerlikte görülür.
Kompleks bileşiklerinde ise + 3 değerlik kararlıdır. Nikelin + 3 değerliği kararlı değildir ve
çoğunlukla + 2 değerlikte bulunur. Grup içinde yüksek değerliklerin kararlılığı demirden
nikele doğru azalır.
Grup içinde demir, en aktif elementtir. Her üç metal kuvvetli asitlerin seyreltik
çözeltilerinde tepkime verir. Tepkime demirde en hızlı, nikelde ise daha yavaştır.
M + 2 H+ → M+2 + H2
Yükseltgen asitlerle tepkimede kobalt ve nikel + 2 değerlikte katyonlar oluştururken
demir + 3 değerliğe yükseltgenir.
Fe + 4 HNO3 → Fe(NO3)3 + NO + 2 H2O
Co + 8 HNO3 → 3 Co(NO3)2 + 2 NO + 4 H2O
Hâlojenler oda sıcaklığında üç metale de etki etmez, ancak 200 °C dolayında ısıtılırsa
klor; demirle demir (III) klorür, kobalt ile kobalt (II) klorür ve nikel ile nikel (II) klorür verir.
79
Özellikler
Sembolü
Atom numarası
Atom kütlesi
Elektron dizilişi
Erime noktası (°C)
Kaynama noktası (°C)
Öz kütlesi (g/cm3)
Değerliği
İyon yarıçapı (A°)
Atom yarıçapı (A°)
Birinci iyonlaşma
enerjisi (kcal/mol)
İkinci iyonlaşma enerjisi
(kcal/mol)
Elektronegatifliği
Erime ısısı (kcal/mol)
Buharlaşma ısısı
(kcal/mol)
Özgül ısısı (cal/g/°C)
Elektrik iletkenliği
(mikroohm–1)
Isı iletkenliği
(cal/cm2/cm/°C/sn.)
Standart indirgenme
potansiyeli (volt)
Atom hacmi (w/d)
Demir
Fe
26
55,85
[Ar] 3d6 4s2
1536
3000
7,86
+ 2, + 3
1,17
1,26
182
Kobalt
Co
27
58,93
[Ar] 3d7 4s2
1495
2900
8,9
+ 2, + 3
1,16
1,25
181
Nikel
Ni
28
58,71
[Ar] 3d8 4s2
1453
1730
8,9
+ 2, + 3
1,15
1,24
176
375
495
420
1,8
3,67
84,6
1,8
3,64
93,0
1,8
4,21
91,0
0,11
0,10
0,099
0,16
0,105
0,145
0,18
0,16
0,22
(M+2/M) = -0,44
(M+3/M) = -0,016
7,1
M+2/M)= -0,28
M+2/M)= - 0,25
6,7
6,6
Tablo 7.2: Grup VIII B elementlerinin bazı özellikleri
7.3. Demirin Doğada Bulunuşu
Demir, yer kabuğunun yaklaşık % 4,7’sini oluşturur. Yüzlerce mineralin yapısında
demir vardır. En önemli demir mineralleri hematit [Fe2O3], manyetit [Fe3O4], limonit
[Fe2O3. 3 H2O], siderit [FeCO3] ve pirit [FeS2]’tir.
7.4. Demirin Elde Edilmesi
Demirin minerallerinden elde edilmesi için, mineralin oksit hâlinde olması gerekir.
Mineral, oksit hâlinde değilse kavurma işlemi ile oksidine çevrilir.
4 FeCO3 + O2 → 2 Fe2O3 + 4 CO2
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
Oksit hâlindeki demir, yüksek fırında karbonla indirgenerek ham demir elde edilir.
80
7.4.1. Yüksek Fırında Ham Demirin Elde Edilmesi
Şekil 7.1: Yüksek fırın
Demir üretimi yüksek fırında yapılır. Bu fırın, koni şeklinde iki parçanın geniş
tarafından birleştirilmesiyle yapılmıştır. Oluşan tepkimelerin ara ürünü gaz hâlinde, buna
karşın ham maddeler ve ürün maddeler katı hâlde olmaları nedeniyle fırının orta kısmının
geniş olması gerekir. Böylece, gaz oluşumu ile meydana gelen yüksek basınç, daha geniş
hacme yayılarak azaltılır. Bu fırının yüksekliği 30 – 40 m, iç hacmi 1500 – 5000 m3 ve en
geniş kısmının çapı 6 – 9 m’dir. İç tarafı ateş tuğlalarıyla kaplanarak 2000 °C’a kadar
dayanıklılığı sağlanır. Yerden yaklaşık 2,5 m yükseklikte bir platform bulunur ve burada
1,5 – 1,8 m aralıklarla fırın çevresine hava giriş mazgalları yerleştirilir. Bu mazgallarda
1 – 2 atm ve 500- 800 °C’ ta hava içeriye doğru üflenerek kok kömürünün yanması sağlanır.
Havanın ısınması, baca gazı ile ısınan odalarda yapılmaktadır.
Demir minerali, kok ve kireç taşı ile birlikte önceden ısıtılmış fırına yüklenirken
fırının altından da sıcak hava veya oksijen verilir. Meydana gelen ergimiş demir, alttaki
toplama kabında toplanır ve zaman zaman alınır. Yüksek fırındaki kimyasal tepkimeler tam
olarak bilinmemekle birlikte indirgen maddenin karbon değil, karbonmonoksit olduğu
sanılmaktadır. Karbonmonoksit, kok kömürünün oksijenle yükseltgenmesiyle oluşur.
2 C + O2 → 2 CO + 53,7 kkal
Tepkimede açığa çıkan ısı, fırının devamlı sıcak kalmasını sağlar. Karbonmonoksit,
fırının değişik sıcaklık bölgelerinde farklı demir oksitleri indirger. En üstte, sıcaklığın en
düşük olduğu 250 °C dolayında, demir (III) oksit manyetik demir okside indirgenir.
3 Fe2O3 + CO → 2 Fe3O4 + CO2
Meydana gelen manyetik demir oksit aşağıya doğru indikçe daha yüksek sıcaklıkta,
yaklaşık 400 °C’ ta, demir (II) okside indirgenir.
81
Fe3O4 + CO → 3 FeO + CO2
Fırının daha aşağı kısımlarında yaklaşık 700 °C’ta demir (II) oksidin hepsi metalik
demire dönüşür.
Fe2O3 + 3CO → 2 Fe + 3 CO2
Meydana gelen katı hâldeki demir, süngerimsi bir görünümdedir. Aşağı doğru
inildikçe 1400 °C dolayında bir kısım ergimiş demir, karbon veya karbonmonoksitle demir
karbür (sementit) oluşturur.
3 Fe + C → Fe3C + CO2
3Fe + 2 CO → Fe3C + CO2
Bu şekilde meydana gelen karbonlu ham demir, ergimiş hâlde fırının en altında
toplanır. Fırına yüklenen ergiticinin görevi, demir mineralindeki safsızlıkları
uzaklaştırmaktadır. Demir mineralinde çoğu kez ana safsızlık olarak silisyum bulunur. Bu
durumda ergitici olarak kireç taşı kullanılır. Ancak bazen ana safsızlık kireç taşı olabilir, bu
durumda ise ergitici olarak kum kullanılır.
Karışım içindeki kireç taşı 900 °C dolayında bozunarak kalsiyum oksit ve karbon
dioksite dönüşür. Kalsiyum oksit ise mineraldeki kum ile birleşerek kalsiyum silikatı verir,
buna cüruf denir.
CaCO3 → CaO + CO2
CaO + SiO2 → CaSiO3
Cüruf daha hafif olduğundan sıvı hâldeki demirin üstünde toplanır ve zaman zaman
dışarı alınır. Böylece ergitici, bir yandan safsızlıkları giderirken diğer yandan ergimiş
demirin üzerini örterek oksitlenmesini önler. Ayrıca, bozunmasıyla oluşan karbondioksit de
karbonla birleşerek karbonmonoksit yaptığından fırında gerekli karbonmonoksit oranını
artırır.
Cüruf, genellikle çimento endüstrisinde ham madde olarak kullanılır. Baca gazı ise
% 20 – 30 CO, % 8 – 12 CO2, % 13 CH4 , % 2 – 3 H2 ve % 50 – 55 N2 içerir ve fırına
gönderilen havayı ısıtmada kullanılır.
Yüksek fırında demir mineralindeki bütün safsızlıklar cüruf hâline geçmez. Özellikle
mangan, fosfor, silisyum ve kükürt ergimiş demir içerisinde kalabilir. Elde edilen ham demir
(pik demir) içinde genellikle % 2 – 4,5 karbon, % 2 – 3 silisyum, % 1 – 2 fosfor, % 2 – 3
mangan ve % 0,1 kükürt vardır. Pik demirdeki karbon ya sementit [Fe3C] ya da grafit
şeklinde demir metali içinde dağılmış olarak bulunur. Mangan yüzdesi silisyumdan fazla
olan pik demir çabuk soğutulursa manganın katalitik etkisiyle grafit hâlindeki karbon da
sementite dönüşür. Elde edilen pik, beyaz renktedir ve beyaz pik adını alır. Bu tür pik çok
sert olup işlenemez, döküme uygun değildir, çeliğin elde edilmesinde kullanılır. Silisyum
oranı % 2,5 dolayında olan ergimiş pik yavaş soğutulursa karbonun çoğu grafit hâlinde
ayrılır. Bu pik gri renkte olduğundan gri pik adını alır. Gri pik daha yumuşaktır, döküme
uygundur ve endüstride kullanılır. Pik demir içindeki kükürt, genellikle kırılganlığı artırır.
82
7.4.2. Ham Demirden Çelik Elde Edilmesi
Yüksek fırında elde edilen pik demirin büyük bir kısmı çelik üretiminde kullanılır. Pik
demir içindeki safsızlıklar yakılarak alınır ve istenilen oranda karbon ve diğer özellik
kazandırıcı maddeler katılarak çelik elde edilir.
Çeliğin elde edilmesi için kullanılan yöntemler üç ana grupta toplanabilir. Bunlar,
basınçlı hava veya oksijenin alttan sisteme verildiği Bessemer ve Thomas yöntemleri, alevin
ham demirin üstünden yayılarak geçirildiği Siemens Martin yöntemi ve ısının elektrik
arkıyla sağlandığı elektrik fırını yöntemidir.
7.4.2.1. Bessemer ve Thomas yöntemleri
Bu yöntemlerde fırın aynıdır. Ancak iç örtüleri, yani astarları farklıdır. Bessemer
yönteminde fırın içi asidik (kum veya kil), Thomas yönteminde ise bazik (kireç taşı,
magnezit veya dolomit) bir astarla kaplıdır. Bessemer yönteminde silisyum ve mangan
safsızlıkları fazla olan pik demir, Thomas yönteminde ise fosfor safsızlığı fazla olan pik
demir işlenir.
Şekil 7.2: Bessemer konvertörünün (a) doldurulmuş durumu, (b) üfleme durumu
Burada kullanılan fırın, yumurta şeklinde olup yatay bir eksen etrafında dönebilir.
Fırında oluşan aşağıdaki tepkimeler sonucu, pik demir içindeki Si, C, Mn ve P safsızlıkları
giderilir.
83
Bessemer fırınındaki tepkimeler:
Si + O2 → SiO2 + Q1
2 C + O2 → 2 CO + Q2
2 Mn + O2 → 2 MnO + Q3
2 Fe + O2 → 2 FeO + Q4
SiO2 + MnO → MnSiO3
Cüruf
Thomas fırınındaki tepkimeler:
4 P + 5 O2 → 2 P2O5 + Q1
2 C + O2 → 2 CO
+ Q2
2 P2O5 + 6 CaO → 2 Ca3(PO4)2
2 P2O5
+ 6 MgO → 2 Mg3(PO4)2
Cüruf
Cüruf
Bessemer yönteminde silisyumun ekzotermik olan yanma tepkimesi, sıcaklığın
ergimiş pik demirin sıcaklığı olan 1200 °C’ tan 1600 °C’a kadar yükselmesini ve bu
sıcaklığın devamını sağlarken bu durum Thomas yönteminde fosforun yanmasıyla sağlanır.
Çünkü fosfor ve silisyumun yanmasıyla açığa çıkan ısı, fırında oluşan diğer ekzotermik
tepkimelerde açığa çıkan ısıdan çok fazladır.
Bu yöntemlerde işlemin sonuna doğru pik demirdeki karbon oranı istenilenin de altına
düşer ve bu arada bir miktar demir de demir okside yükseltgenir. Karbon oranını istenilen
düzeye yükseltmek, oksitlenen demiri tekrar geri kazanmak ve çeliğe istenilen diğer
özellikleri kazandırmak için karbon oranı yüksek bir alaşım (örneğin, ferromangan alaşımı)
ve özellik kazandırıcı maddeler (Al, Cr, Mn, W, Ni gibi metaller) işlemin sonuna doğru
eklenir. Böylece ferromangan içindeki karbon, demir oksidi tekrar demire indirgerken
karbon oranı da istenilen düzeye getirilir. Diğer katkı maddeleri de istenilen özellikleri verir.
7.4.2.2. Siemens – Martin Yöntemi
Bu yöntemde kullanılan fırın, sistemi ısıtmada kullanılan gaz ve havanın ısıtıldığı
ısıtıcılar ile pik demirinin ergitilerek içindeki safsızlıkların yakıldığı bir tekneden ibarettir.
84
Şekil 7.3: Simens – Martin fırını
Bu yöntemle pik demir içindeki P, C, S ve Si safsızlıkları giderilebilir. Isıtıcılar,
teknenin yanlarında iki tanedir. Her ısıtıcı iki kısımdan oluşup bunlardan birinden hava,
diğerinden gaz girer. Önceden ısıtılmış olan bir ısıtıcıya gaz ve hava verilir. Isınan karışım
fırının tekne kısmının girişinde yanar. Alev, teknedeki karışımı ergittikten sonra diğer
ısıtıcıya geçer, burayı ısıttıktan sonra bacadan çıkar. Böylece ısıtıcılardan biri, soğuk hava ve
gazı ısıtıp kendisi soğurken diğeri baca gazlarıyla ısınır. Her 15 – 20 dakikada gaz ve hava
giriş yönleri değiştirilerek fırında yanan gazların ısınması sağlanır.
Teknenin içi ateş tuğlalarıyla örülmüş olup pik demir içindeki safsızlıklara göre asidik
(kil veya kum gibi) veya bazik (kireç taşı, magnezit veya dolomit gibi) bir astarla
kaplanmıştır. Tekneye yüksek fırından gelen ergimiş pik demir, % 50 oranına kadar hurda
demir, bir miktar demir minerali ve ergitici yüklenir. Demir minerali ve hurda demirdeki
demir oksit, ham demir içindeki karbon, silisyum, kükürt, fosfor, mangan gibi safsızlıkların
oksitlenip ayrılmasını sağlar.
Isıtıcılardan gelen hava ve gazın yanmasıyla oluşan alev, karışımı ergitir ve içindeki
karbon ve diğer safsızlıkları oksitler. Burada pik demir içindeki karbon ve kükürt, karbon
monoksit ve kükürtdiokside, diğer safsızlıklar ise cürufu oluşturarak ayrılır. Fırının çalışma
süresi sekiz saat kadar olup zaman zaman analizler yapılarak safsızlıkların tamamen
temizlenip temizlenmediği kontrol edilir. Fırın, çoğu kez demir içindeki karbonu istenilenin
de altına indirir. Fırına karbonca zengin ferromangan alaşımı veya kok ve diğer özellik
kazandırıcı maddelerin eklenmesiyle istenilen özellikte çelik elde edilir.
Bu yöntemde ham demir içindeki safsızlıklara göre oluşabilecek tepkimeler şu şekilde
sıralanabilir.
Fe2O3 + 3 C → 2 Fe + 3 CO
2 Fe2O3 + 3 S → 4 Fe + 3 SO2
2 Fe2O3 + 3 Si → 4 Fe + 3 SiO2
85
10 Fe2O3 + 12 P → 20 Fe + 3 P4O10
Fe2O3 +
3 Mn → 2 Fe + 3 MnO
CaCO3 → CaO + CO2
6 CaO + P4O10 → 2 Ca3(PO4)2
cüruf
CaO + SiO2 → CaSiO3
cüruf
MnO + SiO2 →
cüruf
CaSiO3
Siemens – Martin ve Bessemer – Thomas yöntemlerinin karşılaştırılması şu sonuçları
verir:
Bessemer – Thomas fırınında az miktarda pik demir çeliğe çevrilebilir. Burada
kapasite 15 – 35 ton iken Siemens – Martin fırınlarında 35 – 50 tondur.
Pik demir içindeki kükürdün giderilmesi, ancak Siemens – Martin yönteminde
mümkündür.
Siemens – Martin yönteminde hurda demirin % 50 oranında kullanılması eski
demirlerin değerlendirilmesi bakımından önemlidir.
Bessemer – Thomas yönteminde sürenin çok kısa oluşu (15 – 20 dakika) bir
üstünlük gibi görünse de sürenin uzun olduğu (sekiz saat) Siemens – Martin
yönteminde analizlerin yapılması, safsızlıkların kontrolü bakımından ona bir
üstünlük kazandırır.
Siemens – Martin yönteminde gaz yakıt gerektiği hâlde Bessemer – Thomas
fırınları basınçlı hava ile bile çalışabilirler.
7.4.2.3. Elektrik Fırınlarında Çelik Elde Edilmesi
Bu fırınlar çok çeşitli olup en çok kullanılanı ark tipi elektrik fırınlarıdır. Fırının
çalışması Siemens – Martin fırınına benzer, ancak burada ısıtma elektrik enerjisiyle sağlanır.
Fırın çelikten yapılmış olup içi ateşe dayanıklı bir bazik astarla kaplıdır.
Fırına hurda demir ( % 100 ‘ e kadar çıkabilir, çoğunlukla % 70 kadar), yüksek
fırından gelen ergimiş pik ve demir cevheri yüklenir. Karbon elektrotlar, karışımın yüzeyine
değecek kadar indirilip elektrotlar arasında elektrik arkı sağlanır. Ark sıcaklığında karışım
ergir, yabancı maddeler oksitlenir. Zaman zaman ergimiş çelik elde edilir. Demir içindeki
uzaklaştırılması güç, fakat istenmeyen kükürt ve fosfor safsızlıkları en az değere indirilebilir.
Hatta diğer yöntemlerle elde edilen çelikler, bu yöntemle daha da saf hâle getirilebilir. İşlem
indirgen bir ortamda yapıldığından demirin tekrar oksitlenmesi önlenir. Sıcaklık çok yüksek
değerlere çıkabileceği için erime noktası yüksek özel çeliklerin yapılması mümkündür.
Bunlara elektro çeliği denir ve eğe matkap, ameliyat bıçağı, jilet, saat yayları, araba dingili,
şaft, dişliler gibi sert, dayanıklı, kırılgan olmayan ve esnek özellikli araçların yapımında
kullanılır. Bu yöntemin tek olumsuz yönü, elektrik enerjisi ile çalışması nedeniyle pahâlı
oluşudur.
86
7.5. Demirin Özellikleri
Gri beyaz renkte, yumuşak, dövülebilen, işlenen, kolayca tel ve levha hâline
getirilebilen bir metaldir. Demirin bir kısım özellikleri Tablo 7.2’de görülmektedir.
Demir oldukça aktif bir metal olup, aktif ametallerle birleşir.
Fe
+ S → FeS
2 FeCl
2 Fe + 3 Cl2
3
Kızdırılmış demir, oksijen içerisinde etrafa kıvılcımlar saçarak tepkimeye girer ve
magnetik demir oksidi oluşturur.
3 Fe + 2 O2
Fe3O4
Kızdırılmış demir tozu üzerinden su buharı geçirilirse magnetik demir oksit meydana
gelir ve hidrojen gazı açığa çıkar.
3 Fe + 4 H2O Fe3O4 + 4 H2
Normal sıcaklıkta kuru hava demire etki etmez. Fakat nemli havada CO2’nin etkisiyle
yüzeyden kolayca oksitlenir ve üzeri kırmızı demir oksitle kaplanır ki bu olaya demirin
paslanması denir. Pas, (Fe2O3. x H2O) formülü ile gösterilen demir (III) oksittir.
Paslanma sırasında önce demir bikarbonat oluşur.
Fe + ½ O2 + H2O + 2 CO2 → Fe(HCO3)2
Sonra, demir bikarbonat, su ve havanın oksijeninin etkisiyle karbondioksitini
bırakarak pasa dönüşür.
2 Fe (HCO3)2 + H2O + ½ O2 → 2 Fe(OH)3 + 4 CO2
Demirin paslanmasında tepkimelerde de görüldüğü gibi CO2 gazı. katalizör görevi
yapar. Demir eşyanın üzerini örten pas katmanı, gözenekli bir yapıya sahip olup alt
katmanları daha fazla paslanmaktan koruyamaz.
Bundan dolayı, demir eşyaların üzeri koruyucu bir katmanla örtülmelidir. Bunun için
galvanizleme, yağlı boya ile boyama, alaşım yapma ve demirin üzerine kimyasal koruyucu
bir katman oluşturma işlemlerinden biri yapılmalıdır.
Seyreltik asitler. demire kolaylıkla etki ederek hidrojen gazı açığa çıkarır.
Fe + 2 HCl → FeCl2 + H2
Yükseltgen asitlerle tepkimede demir + 3 değerliğe yükseltgenir.
Fe + 4 HNO3 → Fe(NO3)3 + NO + 2 H2O
87
7.6. Kullanıldığı Yerler
İçinde % 1,5’dan fazla karbon bulunduran demire ham demir denir. Yüksek fırından
elde edilen demir ham demirdir. Bu demir sert ve kırılgandır, işlenmeye uygun değildir,
döküm işlerinde kullanılır.
İçinde % 1,5’ten az karbon bulunan demire çelik denir. Çelik, içindeki karbon oranına
göre değişik isimler alır. Karbon oranı % 0,25’ten az olana yumuşak çelik, % 0,25 – 0,7
arasında olanına orta karbonlu çelik ve % 0,7 – 1,5 arasında olanına da yüksek oranlı çelik
adı verilir.
Yumuşak çelik, kolayca çekilir ve levha hâline getirilebilir. Kızıl dereceye kadar
ısıtılıp hızla soğutulduğunda (su verildiğinde) sertleşmez. Geçici olarak mıknatıslanır. Bu tür
çelik, saf demir yerine kullanılabildiği gibi demir levha ve tel yapımında da kullanılır. Orta
karbonlu çelik, su verildiğinde sertleşir. Sert ve kırılgandır, şekil verilebilir, kalıcı
mıknatıslanma özelliği gösterir. Demir yolları ve buhar kazanları gibi araçların yapımında
kullanılır. Yüksek karbonlu çelik ise orta karbonlu çeliğin özelliklerinin çoğunu gösterir. Su
verildiğinde sertleşir, sert ve kırılgandır, kalıcı mıknatıslanma özelliği gösterir. Jilet, delici
araçlar, ameliyat aletleri ve yay yapımında kullanılır.
Su verilen, yani sertleşen çeliğin kırılganlığını kısmen gidermek için tavlama yapılır.
Tavlama, yapı değişiminde önemli bir sıcaklık olan 723 °C’ın altındaki bir sıcaklıkta çeliği
ısıtıp birdenbire soğutma işlemidir. Bu yeniden ısıtma işlemiyle çeliğe sertlik ve dayanıklılık
verilir, kırılganlığı büyük ölçüde azaltılır. Tavlamanın yapılacağı sıcaklık, çeliğin hangi
amaçla kullanılacağına bağlıdır ve genellikle 200 – 300 °C arasında değişir.
7.7. Laboratuvarda Demir (II) ve Demir (III) Klorür Elde Edilmesi
Erlene bir miktar demir tozu alınır. Üzerine ayırma hunisinden demirin tamamı
tepkimeye girene kadar damla damla 3 M HCl asit çözeltisi ilave edilir. Tepkime
tamamlanınca erlende oluşan yeşil renkli demir (II) klorür çözeltisinden 2 mℓ alıp deney
tüpünün içine konur ve beklenirse kirli sarı renkte demir (III) klorürün oluştuğu gözlenir.
Araç ve gereçler: Üçayak, kristalizuvar, gaz toplama borusu, erlen, ayırma hunisi,
demir tozu ve 3 M HCl asit çözeltisi.
88
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Öneriler
Erlene demir tozu koyunuz.
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı
hazırlayınız.
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve
gereçlerin temizliğine
dikkat ediniz.
Ayırma hunisinden demir tozu tükeninceye kadar
hidroklorik asit ekleyiniz.
Ayırma hunisine asit
koymadan önce, ayırma
hunisinin musluğunu
kontrol ediniz, sıvı
kaçırıyorsa vazelinleyiniz.
Dikkatli ve titiz çalışınız.
89
Açığa çıkan hidrojen gazını toplayınız.
Hidrojen gazı patlayarak
yanar, kontrollü yakınız.
Tepkime tamamlandığında oluşan yeşil renkli
çözeltiden 2 mℓ alarak bir deney tüpüne koyunuz.
Dikkatli ve titiz çalışınız.
Bir süre sonra renk değişimini gözlemleyiniz.
Renk değişiminin nedenini
araştırınız ve olayın
denklemini yazmaya
çalışınız.
90
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
5,6 gram demir ve bakır metalleri karışımı üzerine yeterince seyreltik HCl asit etki
ettiriliyor. NŞA’da 1,12 L H2 gazı açığa çıktığına göre karışımın % kaçı demirdir?
(Fe:56, Cu:64 )
A) 10
2.
B) Manyetit
C) Siderit
D) Pirit
B) 2,24
C) 3,36
D) 6,72
Kızdırılmış demir üzerinden su buharı geçirildiğinde 40 gram H2 gazı elde ediliyor.
Buna göre kaç gram demir tepkimeye girmiştir? (Fe:56, O:16)
A) 56
5.
D) 100
Demir (III) oksit bileşiği karbonmonoksit gazı ile indirgendiğinde 2,8 gram demir
metali elde ediliyor. Buna göre tepkimede kullanılan karbonmonoksit gazının hacmi
kaç litredir?
A) 1,68
4.
C) 50
Aşağıdaki demir filizlerinden hangisinde demir %’si en fazladır?
A) Hematit
3.
B) 25
B) 112
C) 168
D) 840
Demirin paslanması olayında aşağıdaki maddelerden hangisi katalizör görevi yapar?
A) CO2
B) H2O
C) O2
D) N2
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
91
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Erlene demir tozu koydunuz mu?
Ayırma hunisinden demir tozu tükeninceye kadar hidroklorik
asit eklediniz mi?
Açığa çıkan hidrojen gazını topladınız mı?
Tepkime tamamlandığında oluşan yeşil renkli çözeltiden 2 mℓ
alarak bir deney tüpüne koydunuz mu?
Bir süre sonra renk değişimini gözlemlediniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
92
ÖĞRENME FAALİYETİ-8
ÖĞRENME FAALİYETİ-8
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak demir (III) sülfat elde edebilecek
bilgi, beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Çevrenizde demir alaşımlarının yapıldığı işletme veya işletmeler var mı?
Araştırınız.
Çevrenizde demire su verme işlemi yapan işletme veya işletmeler var mı?
Araştırınız.
Demir üretimi veya tüketiminin ülke ekonomisine ne gibi bir etkisi olur?
Araştırınız.
8. DEMİRİN ÖNEMLİ BİLEŞİKLERİ
Demir, bileşiklerinde çoğunlukla + 2 ve + 3 değerliklerde bulunur. Bunlardan + 2
değerlikli olan bileşiklerine ferro, + 3 değerlikli olan bileşiklerine ise ferri bileşikleri adı
verilir.
Demirin + 2 değerlikli iyonları ancak asitli ortamda kararlıdır, diğer ortamlarda
havadaki oksijenin etkisiyle kolayca + 3 ‘ e yükseltgenir. Ferro bileşiklerinin sudaki çözeltisi
yeşil renktedir. Bir baz eklenirse beyaz demir (II) hidroksit çöker. Demir (II) hidroksit
havada bırakılırsa kahve renkli hidrata, demir (III) okside dönüşür.
Fe+2 + 2 OH- → Fe(OH)2
4 Fe(OH)2 + O2 + (x–4) H2O → 2 Fe2O3 . x H2O
Bu oksit çoğunlukla Fe(OH)3 formülü ile gösterilir, ancak bugüne kadar saf Fe(OH)3
elde edilmemiştir.
Ferri bileşiklerinin sudaki çözeltisi renksizdir, ancak hidroliz olduğunda sarı kahve
renkli FeOH+2 iyonlarına dönüşür.
Fe+3 + H2O FeOH+2 + H+
93
8.1. Oksijenli Bileşikleri
Demirin oksijenli bileşikleri içersinde FeO, Fe2O3, Fe3O4, Fe(OH)2 ve Fe(OH)3 en
önemli bileşikleridir.
8.1.1. Demir (II) Oksit (Ferro Oksit) [FeO ]
Demir (II) oksalatın vakumda, yüksek sıcaklığa kadar ısıtılıp hızla soğutulmasıyla
siyah toz hâlinde elde edilir. Düşük sıcaklıkta kararsızdır. Elde edilmesi sırasında soğutma
yavaş yapılırsa demir (II) oksit değil, ayrışma ürünleri olan metalik demir ve manyetit
meydana gelir.
4 FeO → Fe + Fe3O4
8.1.2. Demir (III) Oksit (Ferri Oksit) [Fe2O3 ]
Doğada hematit ve limonit mineralleri hâlinde bulunur. Demir (III) klorür çözeltisinin
200 °C dolayında ısıtılmasıyla, demir (II) oksidin yükseltgenmesiyle, manyetik demir
oksidin dikkatle yükseltgenmesiyle, demir (III) hidroksidin yakılmasıyla veya pirit
cevherinin kavrulmasıyla elde edilir.
2 FeCl3 + 3 H2O
Fe2O3 + 6 HCl
4 Fe(OH)2 + O2
2 Fe2O3 + 4 H2O
6 Fe O
4 Fe3O4 + O2
2 3
2 Fe(OH)3
Fe2O3 + 3 H2O
4 FeS2 + 11 O2
2 Fe2O3 + 8 SO2
Demir (III) oksit, bir miktar amfoterik özellik gösterir. Çok kuvvetli bazlar ve klorla
tepkimeye girerse ferratları [FeO4–2] verir. Bazik ortamda kararlı olan ferratlar nötral ve asitli
ortamlarda bozunur. Ferrat iyonları, permanganattan bile daha kuvvetli bir yükseltgendir.
Fe2O3 + 10 OH- + 3 Cl2 → 2 FeO4–2 + 6 Cl - + 5 H2O
4 FeO4–2 + 20 H+ → 4 Fe+3 + 3 O2 + 10 H2O
8.1.3. Demir (II, III) Oksit (Manyetik Demir Oksit) [ Fe3O4 ]
Doğada siyah renkli manyetit minerali hâlinde bulunur. Demir (II, III) oksit, demir
metali üzerinden kızgın derecede su buharı geçirilmesiyle, demir (III) oksidin karbon
monoksitle indirgenmesiyle veya demir (III) oksidin 1400 ºC’nin üzerinde kuvvetle
yakılmasıyla elde edilir.
94
3 Fe + 4 H2O → Fe3O4 + 4 H2
3 Fe2O3 + CO → 2 Fe3O4 + CO2
4 Fe O + O
6 Fe2O3
3 4
2
Manyetik demir oksit; manyetik özelliği, iletkenliğinin fazlalığı ve klora karşı
ilgisizliği nedeniyle sodyum klorürün elektrolizinde elektrot olarak ve mıknatıs yapımında
kullanılır.
Manyetik demir oksitte demirin değerliği + 8 / 3 olarak görülmekle birlikte bu oksidin
demir (II) oksit ve demir (III) oksit karışımı olduğu bilinmektedir ve ferro ferri oksit olarak
da adlandırılır. Bu yapı nedeniyle iletkenliği demir (III) oksidin yaklaşık 10 katı daha
fazladır.
8.1.4. Demir (II) Hidroksit (Ferro Hidroksit) [Fe(OH)2]
Bu bileşik demir (II) tuzu çözeltisine bir baz eklenmesiyle beyaz renkte elde edilir.
Fe+ 2 + 2 OH- → Fe(OH)2
Ancak oluşan hidroksit, havanın oksijeni ile hemen önce yeşile daha sonra
kahverengine ve en sonunda da siyaha dönüşerek demir (III) hidroksidi verir.
4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3
Bu nedenle normal koşullarda saf demir (II) hidroksit elde edilmez. Saf demir (II)
hidroksidin elde edilmesi oksijensiz ortamda ve indirgen hidrojen atmosferinde bir demir (II)
tuzu çözeltisine potasyum hidroksit eklenmesiyle mümkündür.
Demir (II) hidroksit bir, miktar amfoterik özellikte olmakla birlikte daha çok bazik
özellik gösterir. Kuvvetli bazlarda [Fe(OH)6- 4] kompleks tuzunu verirken seyreltik asitlerde
bile Fe+ 2 tuzlarını verir.
Fe(OH)2 + 4 NaOH → Na4[Fe(OH)6]
Fe(OH)2 + 2 HCl → FeCl2 + 2 H2O
Demir (II) hidroksit, sıcak derişik sodyum hidroksit ile uzun süre kaynatılır ve
soğutulursa mavi yeşil kristaller hâlinde Na4[Fe(OH)6] elde edilir. Stronsiyum ve baryumun
da buna benzer tuzları elde edilebilir.
8.1.5. Demir (III) Hidroksit (Ferri Hidroksit) [Fe(OH)3]
Bir demir (III) tuzu çözeltisine bir baz veya sodyum karbonat eklenmesiyle peltemsi
ve kırmızı kahve renkli bir çökelek hâlinde Fe(OH)3 elde edilir.
Fe+ 3 + 3 OH- → Fe(OH)3
Bu hidroksit ısıtılırsa suyunu kaybederek sarı veya kırmızı renkteki demir (III) okside
dönüşür.
95
8.2. Halojenürleri
Demir, halojenlerin çoğu ile bileşik yapar. Önemli halojenürleri florür ve klorürdür.
8.2.1. Demir (II) ve Demir (III) Florür (Ferro ve Ferri Florür) [ FeF2, FeF3 ]
Demir (II) florür, demirin doğrudan flor gazı ile tepkimesiyle beyaz renkte elde edilir.
Suda az çözünür. Kristallendirildiğinde yeşil renkte FeF2. 8 H2O veya beyaz renkte
FeF2 . 4 H2O hâlinde ayrılır.
Fe + F2 (g) → FeF2
Demir (III) florür, demir (III) klorür üzerinde flor gazı geçirilmesiyle elde edilir.
2 FeCl3 + 3 F2 → 2 FeF3 + 3 Cl2
Açık gri renktedir, suda az çözünür. Florür içeren çözeltilerde hegzafloro ferrat (III)
kompleks iyonunu vererek çözünür.
FeF3 + 3 F- → [FeF6] - 3
8.2.2. Demir (II) ve Demir (III) Klorür ( Ferro ve Ferri) [ FeCl2 ve FeCl3 ]
Demir (II) klorür, demir üzerinden sıcakta hidrojen klorür gazı geçirilmesiyle veya
demir (III) klorürün hidrojenle indirgenmesiyle beyaz kristaller hâlinde elde edilir.
Fe + 2 HCl → FeCl2 + H2
FeCl3 + 1 / 2 H2 → FeCl2 + HCl
Susuz demir (II) klorür, kısmen kovalent yapıdadır. 1300 – 1500 °C arasında FeCl2
yapısında iken düşük sıcaklıklarda 2 moleküllü Fe2Cl4 yapısındadır. Kristal sulu demir (II)
klorür, demirin oksijensiz ortamda seyreltik HCl asitle tepkimesiyle elde edilir. Sulu
çözeltilerinde, yeşil renkte FeCl2. 6 H2O ve beyaz renkte FeCl2. 2 H2O kristalleri elde edilir.
Demir (II) klorüre amonyak eklenirse kompleks yapıdaki Fe (NH3)6Cl2 tuzu elde edilir.
FeCl2 + 6 NH3 → [ Fe (NH3)6]Cl2
Demir (III) klorür, demirin klor akımında ısıtılmasıyla elde edilir, koyu kırmızı pullar
hâlinde kristaller oluşturur. Bu bileşik 440 °C’a kadar Fe2Cl6 formülünde 520 °C’a kadar ise
FeCl3 formülündedir. Daha yüksek sıcaklıklarda bozunarak demir (II) klorür ve klor gazı
verir.
2 FeCl + Cl
2 FeCl3
2
2
Demir (III) klorür nem çekici bir maddedir, suda kolaylıkla çözünür ve değişik sayıda
kristal suyu ile kristalleşir. En çok rastlananı 6 mol su içerenidir ve sarı renktedir. Bu
kristallerin ısıtılmasıyla susuz demir (III) klorür elde edilmez, ancak tiyonil klorürle [SOCl2]
ısıtılırsa kristal suyunu kaybeder ve susuz olarak elde edilebilir.
Fe Cl + 24 HCl + 12 SO
2 FeCl3. 6 H2O +12 SOCl2
2 6
2
96
Demir (III) klorür, amonyak gazıyla [ Fe (NH3)6]Cl3 kompleks bileşiğini verir.
FeCl3 + 6 NH3 → [ Fe (NH3)6]Cl3
Bu kompleks ısıtılırsa tekrar demir (III) klorür vermez.
8.3. Sülfürleri
Demirin sülfür bileşikleri içinde demir (II) sülfür, demir (III) sülfür ve pirit önemlidir.
8.3.1. Demir (II) Sülfür [ FeS ]
Demirin yüksek sıcaklıkta kükürtle tepkimesiyle, pirit minarelinin 700 °C dolayında
ısıtılmasıyla, demir (II) sülfatın ısıtılmasıyla veya demir (II) tuzu çözeltilerinden belirli
asitlikte hidrojen sülfür gazı geçirilmesiyle elde edilir.
Fe + S
FeS
FeS + SO
FeS2 + O2
2
FeSO4 + 2 S
FeS + 2 SO2
Fe + 2 +
S – 2 → FeS
Nitrik asit dışındaki seyreltik asitler, demir (II) sülfüre etki ederek hidrojen sülfür gazı
açığa çıkarır. Laboratuvarlarda hidrojen sülfür elde edilmesi için bu bileşik kullanılır.
FeS + 2 H+ → Fe + 2 + H2S
Demir (II)
dönüşür.
sülfür, siyah renkli bir bileşiktir. Havada yakılırsa demir (II) okside
4 FeS + 7 O2 → 2 Fe2O3 + 4 SO2
8.3.2. Demir (III) Sülfür [ Fe2S3 ]
Demir (II) sülfür 450 °C’ta kükürtle birlikte ısıtılmasıyla, bazik ortamda demir (III)
tuz çözeltilerinden H2S gazı geçirilmesiyle elde edilir.
2 FeS + S → Fe2S3
2 Fe+3 + 3 S – 2 → Fe2S3
Siyah ve gri renktedir. Oksijensiz ortamda ve oda sıcaklığında birkaç günde 60°C
sıcaklıkta ise birkaç saatte demir (II) sülfür ve pirit karışımına dönüşür.
97
Fe2S3 → FeS + FeS2
Kuru iken kararlı olan demir (III) sülfür, nemli iken oksijenle kolayca yükseltgenip
demir (III) oksit ve kükürt verir.
2 Fe2S3 + 3 O2 → 2 Fe2O3 + 6 S
Hidroklorik asitle demir (III) klorür ve kükürt verir.
Fe2S3 + 2 HCl → 2 FeCl3 + 3 S + 3 H2
8.3.3. Pirit [ FeS2 ]
Doğada bulunan demir minerallerinden biridir. Laboratuvarlarda elde edilebilir.
Kristal yapıları farklı iki şekli vardır. Metalik parlaklık gösterir. Halk arasında aptalın altını
denir.
Fe2O3 + 4 H2S → 2 FeS2 + 3 H2O + H2
FeS(suda) + S
Isı
FeS2
Pirit havasız yerde ısıtılırsa S, oksijenle yakılırsa SO2 verir.
FeS2
FeS + S
2 Fe O + 8 SO
4 FeS2 + 11 O2
2 3
2
8.4. Kompleks Bileşikleri
Demirin + 2 ve + 3 değerliklerde çok sayıda kompleks bileşikleri vardır. Bu kompleks
bileşiklerde demirin koordinasyon sayısı 6’dır. Bir başka deyişle bu bileşiklerin şekli düzgün
8 yüzlüdür. Demirin kompleks bileşiklerinden potasyum ferrosiyanür ve potasyum
ferrisiyanür önemlidir.
8.4.1. Potasyum Ferrosiyanür [ K4[Fe(CN)6] ]
Bir demir (II) tuzu çözeltisine potasyum siyanür çözeltisi eklenirse sarı renkli
potasyum ferrosiyanür kompleks çözeltisi elde edilir.
FeSO4 + 6 KCN → K4[Fe(CN)6] + K2SO4
Çözelti buharlaştırılırsa 3 mol kristal suyu ile sarı renkte kristalleşir.
98
Potasyum ferrosiyanür suya potasyum ve ferrosiyanür kompleks iyonu vererek
çözünür.
K4[Fe(CN)6] → 4 K + + [Fe(CN)6] - 4
Bu kompleks bileşik, havada yükseltgenmez, ancak klor, bromat, permanganat gibi
kuvvetli yükseltgenlerle ferrisiyanüre yükseltgenir.
2 K4[Fe(CN)6] + Cl2 → 2 K3[Fe(CN)6] + 2 KCl
Gümüş ve bakır iyonlarıyla beyaz renkte gümüş ferrosiyanür ve kahve renkli peltemsi
bakır (II) ferrosiyanür komplekslerini verir.
4 AgNO3 + K4[Fe(CN)6] → Ag4[Fe(CN)6] + 4 KNO3
2CuSO4 + K4[Fe(CN)6] → Cu2[Fe(CN)6] + 2 K2SO4
8.4.2. Potasyum Ferrisiyanür [ K3[Fe(CN)6] ]
Bir demir (III) tuzu çözeltisine potasyum siyanür çözeltisi eklenmesi veya potasyum
ferrosiyanürün yükseltgenmesi ile koyu kırmızı kristaller hâlinde K3[Fe(CN)6] elde edilir.
Fe + 3 + 6 KCN → K3[Fe(CN)6] + 3 K+
Potasyum ferrosiyanürden daha az kararlıdır. Sulu çözeltilerde serbest hâldeki demir
(III) iyonu kolaylıkla demir (II)’ye indirgenirken, ferrisiyanür kompleks iyonu hâlinde daha
kararlıdır. Yani daha zayıf bir yükseltgendir. Kompleksleşme, demir (III) iyonlarını daha
kararlı hâle getirmiştir.
Bir demir (III) tuzları çözeltisi, potasyum ferrosiyanür çözeltisi ile karıştırılırsa Prusya
mavisi(veya Berlin mavisi) denilen koyu mavi renkli potasyum ferri ferrosiyanür çökeleği
elde edilir. Öte yandan bir ferro tuzu çözeltisi, bir potasyum ferrisiyanür çözeltisi ile
karıştırılır ise trumbol mavisi denilen yine koyu mavi renkte potasyum ferri ferrosiyanür
çökeleği oluşur.
FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6] + 3 KCl
Prusya mavisi
FeSO4 + K3[Fe(CN)6] → KFe[Fe(CN)6] + K2SO4
Trumbol mavisi
Her iki çökeleğin formülü aynı olmakla birlikte bunların aynı madde olup olmadığı
tam olarak bilinmemektedir. Birçok bileşiklerde olduğu gibi burada da görülün koyu renk
aynı elementin aynı bileşikte iki ayrı değerlikte bulunmasından ileri gelir. Her iki şekilde
elde edilen çökelekler birer mol kristal suyu içerir.
99
Demir (III) tuzları çözeltisi, potasyum ferrisiyanür ile karıştırılırsa hiçbir çökelek
olmaz, kahve renkli bir çözelti oluşur. Öte yandan demir (II) tuzu çözeltisine potasyum
ferrosiyanür çözeltisi eklenirse beyaz renkte potasyum ferro ferrosiyanür çöker.
Fe + 2 + K4[Fe(CN)6] → K2Fe[Fe(CN)6]
+ 2 K+
Bu tepkimeler çözeltideki ferro ve ferri iyonlarının ayrılmasında kullanılır. Demirin
siyanür kompleksleri tekstil endüstrisinde ve mürekkep yapımında kullanılır.
8.5. Diğer Bileşikleri
8.5.1. Demir (II) Sülfat [ FeSO4 ]
Demir (II) sülfat, susuz olduğunda beyaz, 7 mol kristal suyu içerdiğinde ise yeşil
renktedir. Seyreltik sülfürik asidin demirle olan tepkimesi sonucu elde edilir. Çözeltiden
FeSO4 .7 H2O kristalleri hâlinde ayrılır. Demir (II) sülfatın elde edilmesi sırasında ortamda
oksijenin bulunmaması gerekir; bulunursa demir (II) sülfat, demir (III) hidroksi sülfata
dönüşür.
Fe + H2SO4 → FeSO4 + H2
4 FeSO4 + O2 + 2 H2O → 4 Fe(OH) SO4
Demir (II) sülfat, dikkatle ısıtılırsa suyunu kaybederek susuz demir (III) elde
edilebilir. Ancak kuvvetle ısıtılırsa bozunur.
Fe O + SO + SO
2 FeSO4
2 3
2
3
Demir (II) sülfat, amonyum sülfatla Mohr tuzu adı verilen bir çift tuz yapar, bu tuz
kararlı bir bileşiktir.
FeSO4 + (NH4)2SO4 + 6 H2O → Fe(NH4)2(SO4)2.6 H2O
Demir (II) sülfat ve mohr tuzu, potasyum permanganat çözeltilerinin ayarlanmasında
kullanılır.
10 FeSO4 + 2 KMnO4 + 8 H2SO4 → 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8 H2O
Demir (II) sülfat ve diğer demir (II) tuzu çözeltileri azotmonoksidi soğurur, nitrat
denemelerinde oluşan kahve renkli halka bu soğurma ürünüdür. Demir (II) sülfatın birçok
kullanım alanları vardır. Tekstil endüstrisinde astar boya, mürekkep yapımında mavi boya,
tarımda istenmeyen otları yok edici olarak ve radyasyon dozunu ölçmede kullanılır.
Demirli mürekkepler, demir (III) sülfat çözeltisine gallik asit [C7H6O5] veya tannik
asit [C14H10O9] eklenmesi ve havada kısmen oksitlenmesi sonucu meydana gelen demir (III)
tannatlardır. Demir (II) tannat renksizken, demir (III) tannat siyahtır. Demirli
mürekkeplerinin lekesi, lekenin amonyum oksalat çözeltisine batırılıp bir müddet
beklenmesiyle çıkarılabilir.
100
8.5.2. Demir (II) Karbonat [ FeCO3 ]
Doğada siderit minerali hâlinde bulunur. Laboratuvarlarda, demir (II) tuzu
çözeltilerine havasız ortamda karbonat iyonu eklenmesiyle beyaz renkte elde edilir.
Fe+ 2 + CO3- 2 → FeCO3
Havada uzun süre bekletilirse karbondioksit vererek bozunur.
4 FeCO3 + O2 + 6 H2O → 4 Fe (OH)3 + 4 CO2
Sudaki çözünürlüğü çok azdır. Yüksek sıcaklıkta bozunur.
FeO + CO
FeCO3
2
Demir (II) karbonat, karbonik asit içeren suda toprak alkali karbonatlar gibi bikarbonat
vererek çözünür ve çelikli sular denilen maden sularını oluşturur. Bu tür sular sarılık
hastalığına iyi gelir.
8.5.3. Demir (II) Nitrat [ Fe(NO3)2 ] ve Demir (III) Nitrat [ Fe(NO3)3 ]
Demir (II) nitrat, demir metalinin soğuk ve seyreltik nitrik asit çözeltisi ile
tepkimesinden elde edilir.
Fe + 2 HNO3 → Fe(NO3)2 + H2
Kararlı bir bileşik değildir, havada oksitlenerek bozunur. Çoğunlukla 6 mol kristal
suyu içeren yeşil renkli kristaller hâlinde bulunur. Oksitlenme olanağının az olduğu diğer bir
elde ediliş yöntemi de demir (II) sülfat çözeltisinin kurşun nitrat çözeltisiyle tepkimesinden
elde edilir.
FeSO4 + Pb(NO3)2 → Fe(NO3)2 + PbSO4↓
Kurşun sülfat çökerek karışımdan ayrılır. Kalan çözeltinin suyunun büyük bir kısmı
buharlaştırılır, kurşun (II) nitrat 6 mol kristal suyu ile kristalleşir.
Demir (III) nitrat, demirin % 20’lik nitrik asitle oda sıcaklığında tepkimesiyle elde
edilir. Kristal suyu bulunmayan şekli beyaz, 9 mol kristal suyu içeren şekli ise mor renktedir.
Fe + 4 HNO3 → Fe(NO3)3 + NO + 2 H2O
Bu bileşik 47 °C’ta ergir, 125 °C’ta bozunur.
101
8.6. Demirin Önemli Alaşımları
Çeliğin özelliği, içindeki karbon ve diğer özellik kazandırıcı maddelerin oranlarına,
ısıtma ve soğutma işlemlerine bağlı olarak değişir. Çelikte fosfor ve kükürt bulunması
istenmeyen elementlerdir. Çünkü fosforlu çelik normal sıcaklıkta, kükürtlü çelik ise
ısıtıldığında kırılgan olur. Buna karşın az oranda bulunan silisyum, döküm kolaylığı sağlar,
mangan, sertlik ve kırılganlık verir. Krom ve nikel mekanik sağlamlık ve oksitlenmeye karşı
dayanıklılığı artırır. Bu nedenle istenilen özellikleri vermek üzere bazı elementler eklenerek
özel çelikler yapılabilir. Bazı özel çeliklerin özellikleri ve kullanıldığı yerler aşağıda
verilmiştir.
Çeliğin
Adı
Mangan
Çeliği
Silisyum
Çeliği
Nikel
Çeliği
İnvar
Çeliği
Permalloy
Çeliği
Krom
Çeliği
Krom – V
Çeliği
Molipten
Çeliği
Volfram
Çeliği
Kobalt
Çeliği
Vanadyum
Çeliği
Eklenen
Element
(%)
Özelliği
Kullanılması
12-14Mn
Sert, kolay aşınmaz.
Demir yolu rayları, kasa,
zırh, miğfer, buldozer.
1 – 5 Si
2 – 4 Ni
Sert, dayanıklı, manyetik özellikte,
korozyona ve asitlere dayanıklıdır.
Sert esnek ve korozyona
dayanıklıdır.
36 Ni
Genleşme kat.sayısı küçüktür.
78 Ni
Manyetik geçirgenliği yüksektir.
1 – 20
Cr
5 –10 Cr
0 – 15 V
Dinamo, yay, asit tankları
Dişli takımı ve kablo
Kronometre, sarkaç,
meteoroloji araçları
Transformatör,
okyanuslara döşenen
kablolar
Sert ve sağlamdır. Güç paslanır.
Zırh, dingil, eğe ve yay
Sert esnek ve dayanıklıdır.
Otomobil dingili
Yüksek sıcaklıkta bile sert, esnek
ve dayanıklıdır.
Yüksek sıcaklıkta bile sert, esnek
ve dayanıklıdır.
Hızla dönen makine
parçaları, matkap, torna
Hızla dönen makine
parçaları, matkap, torna
2,5 – 15
Co
Yüksek sıcaklıkta dayanıklıdır.
Burgu, testere
0,1 – 2 V
Esnek, sert ve dayanıklıdır.
Oto yayları, krank, şaft,
dingil
4 – 5 Mo
4–8W
Tablo 8.3: Özel çelikler
8.7. Laboratuvarda Demir III Sülfat Elde Edilmesi
Erlene bir spatül demir tozu alınır. Üzerini örtecek kadar derişik H2SO4 ilave edilir.
Düşük ayarda ısıtılır. Gaz çıkışı bitince ısıtıcı kapatılır. Erlendeki sarı - kahve renk demir
(III) sülfatın oluştuğunu belirtir.
Deney çeker ocakta yapılmalıdır.
Araç ve gereçler: Demir tozu, derişik sülfürik asit, erlen, ısıtıcı
102
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Öneriler
Erlene demir tozu alınız.
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı
hazırlayınız.
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve
gereçlerin temizliğine
dikkat ediniz.
Demir tozu örtülecek şekilde sülfürik asit ekleyiniz.
H2SO4 asit yakıcıdır, giysi
ve cildinize temas etmesini
önleyiniz, temas etmiş ise
bol su ile yıkayınız.
H2SO4 asit almak için
kullandığınız pipeti hemen
çeşme suyu ile yıkamayı
unutmayınız.
Düşük ısıda ısıtınız.
Isıtma işlemini çeker
ocakta yapınız. Oluşan
SO2 gazı oldukça
zehirlidir, dikkatli ve titiz
çalışınız.
103
Gaz çıkışı tamamlanınca ısıtıcıyı kapatınız.
Erlendeki karışım
soğuyuncaya kadar çeker
ocakta bekletiniz.
Erlendeki çözeltinin rengini gözlemleyiniz.
Oluşan bileşiğin
formülünü yazmaya
çalışınız.
104
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Fe Cl + 24 HCl + 12 SO
2 FeCl3. 6 H2O +...............
2 6
2
Yukarıdaki denkleştirilmiş tepkime denkleminde boş bırakılan yere aşağıdakilerden
hangisi yazılmalıdır?
A) 12 SOCl2
2.
3.
B) 12 SCl2
C)12 SOCl
D) 24 SOCl
Fe2O3 + H2S → FeS2 + H2O + H2
Yukarıdaki denklem denkleştirildiğinde hidrojen gazının kat sayısı kaç olur?
(Cevap 1 olmalı)
A) 2
B) 3
C) 4
D) 6
Prusya mavisi aşağıdaki hangi iyonlar arasındaki tepkime sonucunda oluşur?
+3
A) Fe + [Fe(CN)6]- 4 B) Fe+2 + [Fe(CN)6]- 4 C) Fe+ 3 + [Fe(CN)6]- 3 D) Fe+ 2 + [Fe(CN)6]- 3
4.
Formülü Fe(NH4)2(SO4)2 . 6 H2O olan çift tuzunun adı aşağıdakilerden hangisidir?
A) Adi şap
5.
B) Alçı
C) Mohr tuzu D) Trumbol tuzu
56 gram karbonmonoksit tarafından indirgenen Fe2O3 bileşiğinden ne kadar demir
elde edilir? (Fe.56, O:16, C:12)
A) 11,2
B) 22,4
C) 67,2
D) 74,6
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
105
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Erlene demir tozu aldınız mı?
Demir tozu örtülecek şekilde üzerine sülfürik asit eklediniz mi?
Karışımı düşük ısıda ısıttınız mı?
Gaz çıkışı tamamlanınca ısıtıcıyı kapattınız mı?
Erlendeki çözeltinin rengine dikkat ettiniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
106
ÖĞRENME FAALİYETİ-9
ÖĞRENME FAALİYETİ-9
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak kobalt klorür ile nem belirleyecek
bilgi, beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Kobalt mineralleri ülkemizde nerelerde bulunmaktadır? Araştırınız.
Bir çözeltide kobalt iyonlarının varlığı nasıl anlaşılır? Araştırınız.
9. KOBALT
Grup VIII B elementlerinden demir grubunun ikinci elementidir.
9.1. Doğada Bulunuşu
Kobalt, yer kabuğunun yaklaşık % 2,3.10–3 ünü oluşturur. Çoğunlukla kobaltit
[CoAsS], smaltit [CoAsS2], linnalit [Co3S4] ve eritrit [Co3(AsO4).8 H2O] mineralleri hâlinde
bulunur.
9.2. Elde Edilmesi
Kobalt, teknikte çoğu kez minerallerinden değil; daha çok nikel, demir, bakır ve
kurşun gibi metallerin elde edilmesinde yan ürün olarak görülür. Bu minerallerden kobaltın
elde edilmesi için değişik kimyasal işlemlerden sonra kobalt diğer metallerden arındırılır,
kobalt oksidine dönüştürülür. Alüminotermi yöntemiyle veya H2 gibi indirgenle
indirgenmesiyle kobalt elde edilir.
3 Co3O4 + 8 Al → 4 Al2O3 + 9 Co
Co2O3
+ 3 H2
→ 2 Co
+ 3 H2O
Çok saf kobalt, ham kobaltın elektrolitik saflaştırılmasıyla elde edilir.
107
9.3. Özellikleri
Kobalt metali, görünüşte demire benzemekte olup açık pembe renktedir.
Ferromanyetik özelliği demir ve nikelden fazladır, bu nedenle mıknatıs yapımında kullanılır.
Kobaltın bazı özellikleri Tablo7.2’de görülmektedir.
Kobalt, seyreltik hidroklorik asit ve sülfürik asitle yavaş tepkime verir. Seyreltik nitrik
asitle ise daha hızlı tepkime verir.
Co + 2 HCl → CoCl2 + H2
3 Co + 8 HNO3
3 Co(NO3)2 + 2 NO + 4 H2O
Derişik nitrik asitle tepkime vermez. Havadan etkilenmez, kızıl dereceye kadar
ısıtılırsa su buharı ve oksijenle tepkime verir.
2 Co + O2
2 CoO
Co + H2O (g)
CoO + H2
Hidrojen ve azotla tepkime vermez, bu nedenle kobalt hidrür ve kobalt nitrür
bilinmemektedir. Halojenler kobaltla tepkime verir. Flor dışındaki diğer halojenler, kobalt
(II) halojenürleri; flor ise kobalt (III) florürü verir.
Co + Cl2 → CoCl2
9.4. Kullanıldığı Yerler
Kobalt alaşımları hâlinde kullanılır. Özellikle demirle yaptığı alaşımlar hâlinde
kullanılır. Kesiciler, ameliyat araçları, mıknatıslı araçlar çoğunlukla kobalt alaşımlarından
yapılır.
9.5. Laboratuvarda Kobalt Klorür ile Nem Belirlemek
Adi süzgeç kâğıdı üzerine spatül ile CoCl2 katısı alınır. Bir süre beklenir. Oluşan
mavi, mor, açık pembe ve pembe renklerine göre havadaki nem belirlenir.
CoCl2.H2O mavi, CoCl2.2 H2O mor, CoCl2.4 H2O açık pembe, CoCl2.6 H2O pembe
Araç ve gereçler: Katı CoCl2, süzgeç kâğıdı, spatül
108
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Süzgeç kâğıdı üzerine kobalt klorür katısı
koyunuz.
Öneriler
Laboratuvar önlüğünüzü giyiniz.
Çalışma ortamınızı hazırlayınız.
Laboratuvar güvenlik
kurallarına uygun çalışınız.
Kullandığınız araç ve gereçlerin
temizliğine dikkat ediniz.
Süzgeç kâğıdı üzerine kobalt klorür katısını
yayınız.
Fazla madde tüketmeyiniz.
Bir süre bekleyiniz.
Renk değişimini dikkatli olarak
gözlemleyiniz.
109
Oluşan renge göre havadaki nemi belirleyiniz.
Gözlemlerinizi yazınız.
Havadaki nem yüksek ise süzgeç kâğıdını
ısıtınız.
Havadaki nem oranı çok
yüksekse renk değişimi olmaz.
Bu durumda süzgeç kâğıdını
kısık bek alevine tutarak renk
değişimini gözlemleyebilirsiniz.
110
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki sorularda uygun seçeneği işaretleyiniz.
1.
Aşağıdaki minerallerden hangisi kobalt minerali değildir?
A) Smaltit
2.
B) 0,5
C) 0,8
B) 3
C) 5
D) 2,7
D) 8
Aşağıdaki kobalt klorür kristallerinden hangisi mavi renklidir?
A) CoCl2.6 H2O
C) CoCl2.2H2O
5.
D) Siderit
Co + HNO3
Co(NO3)2 + NO + H2O
Yukarıdaki tepkime denklemi denkleştirildiğinde kobalt nitratın kat sayısı kaç olur?
A) 2
4.
C) Eritrit
Alüminotermi yöntemiyle 1 kg kobalt elde etmek için kaç kg alüminyum metali
gerekir? (Al : 27, Co : 59 )
A) 0,4
3.
B) Linnalit
B) CoCl2.4 H2O
D) CoCl2.H2O
Aşağıdakilerden hangisi kobaltın özelliklerinden biri değildir?
A) Derişik nitrik asitle tepkime vermez.
B) Hidrojenle tepkime vermez.
C) Kızıl dereceye kadar ısıtılırsa su buharı ile tepkime vermez.
D) Azotla tepkime vermez.
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
111
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuar önlüğünüzü giyip çalışma masanızı düzenlediniz mi?
Kullanılacak malzemeleri temin ettiniz mi?
Süzgeç kâğıdı aldınız mı?
Süzgeç kâğıdı üzerine kobalt klorür katısı koydunuz mu?
Bir süre beklediniz mi?
Oluşan renge göre havadaki nemi belirlediniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
112
ÖĞRENME FAALİYETİ-10
ÖĞRENME FAALİYETİ-10
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak kobalt klorür inceleyebilecek bilgi,
beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Kobaltın insan sağlığına etkisini nelerdir? Araştırınız.
Kobalt günlük olarak tükettiğimiz besinlerin yapısında var mıdır? Araştırınız.
10. KOBALTIN ÖNEMLİ BİLEŞİKLERİ
Kobalt, demirde olduğu gibi bileşiklerinde + 2 ve + 3 değerliktedir. Bunlardan + 3
değerlikli iyonları çok kuvvetli yükseltgendirler. Örneğin, suyu kolayca yükseltgeyerek
oksijen açığa çıkarır.
4 Co+3 + 2 H2O → 4 Co+2 + 4 H+ + O2
Kobalt bileşiklerinde daha çok + 2 değerliktedir. Kobalt (III) ‘ün Co2(SO4)3.18 H2O,
CoF3, gibi bileşikleri bilinmekteyse de bu bileşikler suda kararlı değildir, kolaylıkla oksijen
açığa çıkararak kobalt (II)’ye indirgenir. Kobalt (II) iyonu suda serbest olarak bulunmaz,
pembe renkli [Co(H2O)6]+2 hidrat iyonu hâlinde bulunur. Kompleks hâlinde ise kobalt (III)
iyonları su içinde daha kararlıdır. Örneğin, [Co(NH3)6]+3 kompleks iyonu [Co(NH3)6]+2
iyonundan daha kararlıdır.
10.1. Oksijenli Bileşikleri
Kobaltın oksijenli bileşikleri arasında kobalt (II) oksit ve kobalt (II) hidroksit
önemlidir. Kobalt (III)’ün oksit ve hidroksitleri kararlı değildir, ancak bileşik oksidi olan
kobalt (II, III) oksit kararlıdır.
10.1.1. Kobalt (II) Hidroksit [ Co(OH)2 ]
Kobalt (II) tuzu çözeltisine baz eklenmesiyle mavi renkte bir çökelek elde edilir.
Ancak, bu mavi renk zamanla maddenin hidrat olması sonucu önce mor, sonra pembe renge
dönüşür. Kobalt (II) hidroksit amfoter özelliktedir. Seyreltik asitlerde ve derişik bazlarda
çözünerek koyu mavi renkteki [Co(OH)4]-2 kompleksini verir. Kobalt (II) hidroksit amonyak
çözeltisinde [Co(NH3)6](OH)2 kompleksini verir. Bu kompleks havada Co+3 e yükseltgenir
ve rengi koyulaşır.
113
10.1.2. Kobalt (II) Oksit [ CoO ]
Kobalt mineralinin yüksek sıcaklıkta su buharı ile tepkimesi, kobalt hidroksit, kobalt
karbonat veya kobalt oksalatın ısıtılmasıyla elde edilir, yeşil renktedir. Kuru havada kararlı
olduğu hâlde, nemli havada siyah renkteki CoO(OH)’e dönüşür.
2 Co + O2
2 CoO
Co
+ H2O
CoO + H2
Kobalt (II) oksit bazı metal oksitlerle renkli bileşikler oluşturur. Bunlardan
yararlanılarak magnezyum, çinko ve alüminyum gibi metallerin tanımı yapılır. Bunun için
tanımı yapılacak kuru madde bir kömür parçası üzerinde kızdırıldıktan sonra kobalt (II)
nitrat çözeltisi ile ıslatılıp tekrar ısıtılır. Maddede çinko varsa yeşil (Rinman yeşili),
alüminyum varsa mavi (Thenard mavisi), magnezyum varsa pembe renk görülür.
Kobalt (II) oksit ve kobalt (II) hidroksidin havada ısıtılmasıyla kobalt (III) oksit elde
edilmez, kobalt (II, III) okside [Co3O4] dönüşür. Kobalt (III) oksit, ancak kristal suyu ile
(Co2O3. H2O gibi ) kararlıdır. Ayrıca kobalt (II) nitratın çinko, nikel ve mangan nitratla kızıl
dereceye kadar ısıtılmasıyla kararlı yapıda ZnCo2O4, NiCo2O4, MnCo2O4 bileşikleri oluşur.
10.1.3. Kobalt (II, III) Oksit [ Co3O4 ]
Kobalt (II) oksit ve kobalt (II) hidroksit ile kobalt oksalat; kobalt karbonat ve kobalt
nitratın havada ısıtılmasıyla [Co3O4] (kobalt (II, III) oksit) siyah bir toz olarak elde edilir. Bu
oksit 900 °C’ a kadar ısıtılırsa kobalt (II) okside dönüşür.
Kobalt (II, III) oksit [Co3O4], asitlerle tepkimeye girer, sülfürik asit ve nitrik asitlerle
oksijen gazı, hidroklorik asitle ise klor açığa çıkarır.
Co3O4 + H2SO4 → 3 CoO + O2 + SO2 + H2O
Co3O4 + 2 HNO3→ 3 CoO + O2 + 2 NO2 + H2O
Co3O4 + 2 HCl → 3 CoO + Cl2 + H2O
10.2. Halojenürleri
Kobaltın en önemli halojenür bileşiği kobalt (II) klorür [CoCl2]’dür. Susuz kobalt (II)
klorür, kobalt metalinin klor gazıyla ısıtılmasıyla elde edilir. Susuz kobalt (II) klorür ise
kobalt (II) oksit veya hidroksidin HCl asit ile tepkimesiyle ve çözeltinin suyunun
buharlaştırılmasıyla CoCl2.6 H2O kristalleri hâlinde elde edilir. Kobalt (II) klorür, kristal
suyunun sayısına göre değişik renklerdedir. Örneğin CoCl2.H2O mavi, CoCl2.2 H2O mor,
CoCl2.4 H2O açık pembe, CoCl2.6 H2O ise pembe renktedir. Bu özelliği nedeniyle kobalt (II)
klorür, görünmez mürekkep olarak kullanılır.
114
Pembe renkte olan CoCl2.6 H2O ‘ ün seyreltik çözeltisi hazırlanıp bununla bir kâğıda
yazılırsa pembe renk hemen hemen görülmez. Eğer bu kâğıt bir alev üzerinde ısıtılırsa 5 mol
kristal suyunu kaybedeceğinden yazı mavi renkte ortaya çıkar. Kobalt (II) klorürün aynı
özelliğinden yararlanılarak nemölçer (hidrometre) yapımında kullanılır. Üzeri kobalt (II)
klorür emdirilmiş bir kâğıt parçası havada bırakılırsa havadaki nem oranına göre pembe, mor
veya mavi renk alır.
10.3. Kompleks Bileşikleri
Kobalt, + 2 ve + 3 değerlikte iken birçok iyon veya moleküllerle kovalent bağlı
kompleks bileşikler yapar. Bunların içinde en yararlı olanları kobalt (III) kompleksleridir.
Komplekslerinde kobaltın koordinasyon sayısı 4 veya 6 olabilir. Kobalt (II) , 6 veya 4
koordinasyon sayısında bileşik verirken kobalt (III) yalnız 6 koordinasyon sayısında görülür.
Koordinasyon sayısı 4 olduğunda kompleks düzlem yapıda, 6 olduğunda ise 8 yüzlü
yapıdadır. Kobaltla kompleks yapan en önemli moleküller (ligand) NH3, NO2-, CN-, X- ve
birçok organik moleküllerdir.
Kobalt (II)’nin en önemli ve en çok rastlanan kompleksleri amonyakla yaptığı
komplekslerdir. Bunlar CoX2. nNH3 genel formülüyle gösterilebilir. Burada n
koordinasyondaki amonyak sayısını gösterir ve 2, 4 veya 6 değerlerini alır. Bunlardan en
önemlisi koordinasyon sayısı 6 olanı CoX2. 6 NH3 dır, çözeltilerde Co(NH3)+2 iyonları
hâlinde bulunur.
Kobalt (III) ün en önemli ve en çok rastlanan kompleksleri amonyak, siyanür, nitrit ve
organik maddelerle yaptığı komplekslerdir. Bunlardan amonyakla yaptığı kompleks olan
[Co(NH3)6]Cl3 kobalt(II) tuzunun amonyak ve amonyum tuzu veren çözeltisinin aktif kömür
gibi bir katalizörün etkisi altında O2 veya H2O2 ile yükseltgenmesiyle elde edilir.
4 CoCl2 + 4 NH4Cl + O2 + 20 NH3 → 4 [Co(NH3)6]Cl3 + 2 H2O
Kobaltın nitrit kompleksi olan Na3[Co(NO2)6] , kobalt nitrat çözeltisinin asetik asitle
asitlendirilmesinden sonra aşırı miktarda derişik sodyum nitritle tepkimesiyle elde edilir.
Co(NO3)2 + 7 NaNO2 + 2 CH3COOH →
Na3[Co(NO2)6] + 2 NaNO3 + 2 NaCH3COO + NO + H2O
Bu kompleks, potasyumun aranmasında kullanılır. Çünkü sodyum yerine potasyum
geçtiğinde oluşan K3[Co(NO2)6], sarı renkte bir çökelek verir. Buna Fischer tuzu denir.
Kobaltın siyanür kompleksi olan [Co(CN)6]-3 ise kobalt (II) tuzu çözeltisine aşırı
miktarda potasyum siyanür eklenmesi ve havada yükseltgenmesiyle elde edilir.
4 Co(NO3)2 + 24 KCN + O2 + 2 H2O → 4 K3[Co(CN)6] + 4 KOH + 8 KNO3
115
10.4. Kobalt (II) Nitrat [Co(NO3)2]
Kobalt metali, kobalt oksitleri veya kobalt (II) karbonatın seyreltik nitrik asitle
tepkimesiyle kırmızı renkte ve 6 mol kristal suyu ile kristallendirilerek elde edilir.
Co + 4 HNO3 + 4 H2O → Co(NO3)2 + 2 NO2 + 6 H2O
CoO + 2 HNO3 + 5 H2O → Co(NO3)2 .6 H2O
CoCO3 + 2 HNO3 + 5 H2O → Co(NO3)2.6 H2O + CO2
Kobalt nitrat, nikel analizlerinde, alüminyum aranmasında, Thenard mavisi
oluşturmada kullanılır.
10.5. Kobalt (II) Sülfat [CoSO4]
Kobalt metali, kobalt oksitleri veya kobalt (II) karbonatın sülfürik asitle tepkimesiyle
7 mol kristal suyu ile kristallendirilerek elde edilir. Kristal suyu ile kırmızı renkte olup kristal
suyunu kaybettiğinde mavi renge dönüşür. Kobalt (II) sülfat amonyum sülfatla Mohr tuzu
olarak bilinen çift tuz [(NH4)2Co(SO4)2.6 H2O] yapar. Bu tuz kobalt kaplamacılığında
elektrolit olarak kullanılır.
10.6. Kobalt (III) Sülfat [Co2(SO4)3]
Kobalt (II) sülfatın derişik sülfürik asitte ozon, flor veya elektrolizle
yükseltgenmesiyle 18 mol kristal suyu ile birlikte mavi – yeşil renkte kristaller hâlinde elde
edilir.
6 CoSO4 + 3 H2SO4 + O2 → 3 Co2(SO4)3 + 3 H2O
2 CoSO4 + H2SO4 + F2 → Co2(SO4)3 + 2 HF
2 CoSO4 + SO4-2
Elektroliz
Co2(SO4)3 + 2 e-
Kobalt (III) sülfat, kararsız olup suda oksijen çıkışı ile kobalt (II) sülfata dönüşür.
2 Co2(SO4)3 + 2 H2O → 4 CoSO4 + O2 + 2 H2SO4
Kobalt (III) sülfat, MCo(SO4)2. 12 H2O genel formülünde şaplar yapar. Burada M: Na,
K, Rb, Cs veya amonyum olabilir. Bu şaplar kuru hâlde kararlı, ancak çözeltilerde
kararsızdır. Hepsi de mavi renklidir.
10.7. Kobaltın Alaşımları
En önemli kobalt alaşımları: alniko (kobalt, alüminyum, nikel, demir alaşımı), stellit
(kobalt, tungsten, krom, molibden), hiperko (kobalt, demir, krom alaşımı), vikalloy (kobalt,
demir, vanadyum). Ayrıca toz hâlindeki kobalt metali, karbonmonoksit ve karbon dioksidin
hidrojenlenerek hidrokarbonlara dönüştürülmesinde katalizör olarak kullanılır.
116
10.8. Kobalt Klorür Çözeltisine Isının Etkisinin İncelenmesi
Pembe renkte olan CoCl2.6 H2O’ün seyreltik çözeltisi hazırlanıp bununla bir kâğıda
yazı yazılırsa pembe renk hemen hemen görülmez. Eğer bu kâğıt bir alev üzerinde ısıtılarak
veya güneşte kurutulursa 5 mol kristal suyunu kaybedeceğinden yazı mavi renkte ortaya
çıkar.
CoCl2.6 H2O → CoCl2.H2O + 5 H2O
Pembe
Mavi
Araç ve gereçler: CoCl2 çözeltisi, süzgeç kâğıdı ve kibrit çöpü veya kürdan
117
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
Kobalt klorür çözeltisine alınız.
Laboratuvar önlüğünüzü giyiniz.
Çalışma ortamınızı hazırlayınız.
Laboratuvar güvenlik kurallarına
uygun çalışınız.
Kullandığınız araç ve gereçlerin
temizliğine dikkat ediniz.
Kibrit çöpü batırıp bir kâğıda yazı yazınız.
Renk değişimini görmek için
kâğıdınızı kuru bir ortamda
tutunuz.
Kâğıdın güneşe tutulup kuruduktan sonra ortaya
çıkan durumu gözlemleyiniz.
Havadaki nem oranı yüksek ise
süzgeç kâğıdını bek alevinde
kurutunuz.
118
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki cümlelerin doğru mu yoksa yanlış mı olduklarını belirtiniz.
1.
Üzeri kobalt (II) klorür emdirilmiş bir kâğıt parçası havada bırakılırsa havadaki nem
oranına göre pembe, mor veya mavi renk alır.
( D / Y)
2.
Kobalt, hidrojen ve azotla tepkime vermez.
( D / Y)
3.
Kobaltın ferromanyetik özelliği demir ve nikelden fazladır.
( D / Y)
4.
Kobalt, seyreltik hidroklorik asit ve sülfürik asitle yavaş tepkime verir. Seyreltik nitrik
asitle ise daha hızlı tepkime verir.
( D / Y)
5. Kobalt bileşiklerinde + 2 ve + 4 değerliktedir.
( D / Y)
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
119
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Kobalt klorür çözeltisine kibrit çöpü batırdınız mı?
Bir kâğıda yazı yazdınız mı?
Kâğıt güneşe tutulup kurutulduktan sonra ortaya çıkan yazıyı
gözlemlediniz mi?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
120
ÖĞRENME FAALİYETİ-11
ÖĞRENME FAALİYETİ-11
AMAÇ
Gerekli ortam sağlandığında kuralına uygun olarak nikel oksit elde edebilecek bilgi,
beceri ve deneyime sahip olabileceksiniz.
ARAŞTIRMA
Nikelaj ile kromaj işlemlerinin benzer ve farklı yönleri nelerdir? Araştırınız.
Bir çözeltide nikel iyonunun varlığı nasıl anlaşılır? Araştırınız.
11. NİKEL
Grup VIII B elementlerinden demir grubunun üçüncü elementidir.
11.1. Doğada Bulunuşu
Nikel, gök taşlarının bileşiminde kobalt ve demirle beraber, metal hâlinde bulunur.
Yer kabuğunun yaklaşık % 8.10-3 ünü oluşturur. En önemli mineralleri; nikelit [NiAs] ,
mineralit [NiS], pentlantid [(NiFe) S] ve garniyerit [(Ni,Mg)SiO3.x H2O] tir. Teknik değeri
olan bir minerali de (NiS, 2FeS) bileşiminde olan perrotindir.
Ülkemizde Afyonkarahisar, Sivas ve Muğla çevresinde bulunmaktadır.
11.2. Elde Edilmesi
Cevherlerinde nikel oranı genellikle az olduğundan cevher önce yüzdürme yöntemi ile
zenginleştirilir. Zenginleştirilen cevher, önce havada daha sonra yüksek fırında kavrularak
metallerin oksitlerine dönüşmesi sağlanır. Elde edilen bu oksitler karbon veya su gazı ile
indirgenirse nikel, diğer safsızlıklarla birlikte elde edilir. Saf nikel elde etmek için elektroliz
veya Mond yöntemi uygulanır.
Mond yönteminde ince toz hâline getirilmiş saf olmayan nikel üzerinden karbon
monoksit gazı geçirilir. Oluşan nikel karbonil Ni(CO)4 karbonmonoksit fazlasıyla buhar
hâlinde ( e.n = 43 °C ) tepkime ortamından uzaklaştırılır. Geride diğer metal safsızlıkları
kalır. Bu bileşik 200 °C’a ısıtılırsa karbonmonokside ve nikele ayrışır.
Ni + 4 CO
Ni(CO)4
121
11.3. Özellikleri
Nikel, gümüş beyazlığında parlak ve sert bir metaldir. Özellikleri kobalta çok benzer,
ancak kobalttan daha az ferromanyetik ve kimyasal tepkimelere daha zor girer. Normal
şartlarda havadan etkilenmez. Bu nedenle parlaklığını uzun süre korur. Nikelin bazı
özellikleri Tablo7.2’de görülmektedir.
Kuvvetli asitlerin seyreltik çözeltileriyle tepkimeye girerek H2 gazı açığa çıkarır.
Tepkime yavaştır.
Ni + 2 HCl → NiCl2 + H2
Hâlojenlerle oda sıcaklığında tepkime vermez. Ancak 200 °C dolayında ısıtılırsa
klorla nikel (II) klorürünü verir.
Ni + Cl2 → NiCl2
11.4. Kullanıldığı Yerler ve Önemli Alaşımları
Nikel; sert, korozyona dayanıklı ve parlak olması nedeniyle metal kaplamada önemli
bir yer tutar. Özellikle demir, çelik ve bakır, nikelle kaplanır. Üretilen nikelin yaklaşık
% 65’ten fazlası önemli demir alaşımları yapımında kullanılır. Bu alaşımların en önemlileri
Tablo 11.1’de görülmektedir.
Kimyasal maddelere karşı dayanıklılığı nedeniyle nikel laboratuvarlarda kullanılan
araçların (örneğin, kroze ve spatül gibi) yapımında kullanılır. Nikelin, birçok organik
tepkimede (hidrojenleme tepkimeleri gibi) katalizör olarak da kullanılır.
Alaşımın
Adı
Monel metal
Alman gümüşü
Alniko
Konstantan
Bileşimi
Alaşımın
Adı
Permalloy
Nikrom
Para alaşımı
Platinnit
Ni, Cu, Fe
Ni, Zn, Cu
Al, Ni, Fe, Cu
Cu, Ni
Bileşimi
Ni, Fe
Ni,Fe, Cr
Cu, Ni
Fe, Ni, C
Tablo 11.1: Nikelin önemli alaşımları
11.5. Önemli Bileşikleri
Nikel bileşiklerinde çoğunlukla + 2 değerliktedir. Ancak bazı bileşiklerinde + 1, + 3,
ve + 4 değerlikte de olabilir. Bazı uygun maddeler kullanılarak + 2 değerlikli nikel + 3 ve
+ 4 değerliğe yükseltgenebilir. [ Ni (CN)4] - 2 kompleksi sodyum alaşımıyla indirgenirse
[ Ni (CN)3] - 2 iyonu elde edilir. Ancak bu bileşik kolayca yükseltgenebilir.
122
Nikelin kırmızı toz K2NiF6 ve siyah nikelat K2NiO3 gibi + 4 değerlikli bileşikleri
bilinmektedir. Nikelin + 1, + 3 ve + 4 değerlikte olan bileşiklerinden Ni2O3 dışındakiler
önemli değildir. Bu nedenle nikelin en önemli değerliği + 2 olarak düşünülebilir.
Sulu çözeltilerde nikel, yeşil renkte hidrat [ Ni (H2O)3]+2 veya diğer kompleks hidrat
iyonları hâlinde bulunur. Nikel (II) tuzları, sulu çözeltilerde yeşil renkte iken susuz nikel (II)
tuzları çoğunlukla sarı renktedir. Bu renk, tuzu oluşturan anyona bağlı olarak değişir.
Örneğin nikel bromür sarı, nikel tiyosiyanat kahverengi, nikel iyodür ise siyah renktedir.
11.5.1. Oksijenli Bileşikleri
Nikelin oksijenli bileşikleri içinde nikel (II) oksit, nikel (II) hidroksit ve nikel (III)
oksit bulunmaktadır. Nikel (III) oksit Edison üreteçlerinde kullanılmaktadır.
Nikel (II) tuzu çözeltisine baz eklenirse açık yeşil renkte Ni(OH)2 çöker.
Ni+2 + 2 OH- → Ni(OH)2↓
Nikel (II) hidroksidin suyu alınırsa siyah renkte nikel (II) oksit oluşur.
Ni(OH)2 → NiO + H2O
Ni(OH)2 bazik ortamda hipoklorit [ClO-], klor veya hidrojen peroksit gibi kuvvetli bir
yükseltgenle yükseltgenirse koyu renkli nikel (IV) oksit, orta kuvvette bir yükseltgenle ise
(brom gibi) Ni2O3 (H2O) bileşiminde siyah bir katı verir.
Ni(OH)2 + ClO - → NiO2 + Cl - + H2O
2 Ni(OH)2 + Br2 + 2 OH - → Ni2O3(H2O) + 2 Br - + 2 H2O
Bu oksitler, çok iyi yükseltgendir. Bu nedenle Edison üreteçlerinde Ni2O3
kullanılmaktadır.
Nikel (II) oksit, nikel (II) hidroksit amonyak çözeltisinde çözünür ve koyu mavi renkli
hegzamin nikel (II), hidroksit kompleksini verir.
NiO + 6 NH3 + H2O → [ Ni(NH3)6](OH)2
Ni(OH)2 + 6 NH3 → [ Ni(NH3)6](OH)2
Nikel (II) oksit; nikel (II) hidroksit, nikel karbonat veya nikel nitratın ısıtılmasıyla elde
edilir. Koyu yeşil renktedir. Seramik, cam ve emaye endüstrisinde boya olarak kullanılır.
123
11.5.2. Diğer Bileşikleri
Nikel bileşikleri genel olarak NiO, Ni(OH)2 veya NiCO3’ın elde edilecek tuzun
asidiyle tepkimesinden elde edilir.
NiO + H2SO4 → NiSO4 + H2O
Nikelin halojenür bileşikleri ise halojen asitlerinin yanı sıra doğrudan doğruya metalik
nikelin halojenlerle yüksek sıcaklıkta birleşmesiyle de elde edilebilir.
Basit nikel tuzlarından en önemlisi nikel (II) sülfattır. Bu tuzun 6 veya 7 mol kristal
suyu vardır. Bunlardan 6 mol su bulunduran şekli amonyum sülfatla bir çift tuz yapar. Bu
çift tuz nikel kaplamacılıkta elektrolit olarak kullanılır.
(NH4)2SO4 + NiSO4.6 H2O → (NH4)2Ni(SO4)2. 6H2O
Nikelin bazı kompleks bileşiklerinde önemlidir. Nikel, komplekslerinde 4 ya da 6
koordinasyon sayısındadır. Nikel iyonları NH3, CN-, H2O ve birçok organik moleküllerle
kompleksler yapar. Bunlardan en önemlisi nikel dimetil glioksimdir. Bu kompleks nikel
katyonunun tanınmasında kullanılır.
Ni+2 + 6 NH3 → [Ni(NH3)6]+2
Ni+2 + 4 CN- → [Ni(CN)4]-2
Ni+2 + 6 H2O → [Ni(H2O)6]+2
Ni+2 + 2 [C4H6O2N2H2]→ (C4H6N2H)2Ni + 2 H+
11.6. Laboratuvarda Nikel Oksit Elde Edilmesi
Deney tüpüne 2 mℓ nikel (II) tuzu çözeltisi alınır, çökelek oluşuncaya kadar NaOH
çözeltisi ilave edilip oluşan çökelek NH3 çözeltisinde çözülüp ve bek alevinde ısıtılırsa NiO
oluşmasından dolayı karışım siyah renge dönüşür.
Araç ve gereçler: Bek, maşa, kibrit, deney tüpü, doymuş nikel (II) sülfat, 2 M NaOH
ve 6 M NH3 çözeltisi
124
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem Basamakları
Deney tüpüne nikel sülfat çözeltisi alınız.
Öneriler
Laboratuvar önlüğünüzü
giyiniz.
Çalışma ortamınızı hazırlayınız.
Laboratuvar güvenlik kurallarına
uygun çalışınız.
Kullandığınız araç ve gereçlerin
temizliğine dikkat ediniz.
Çökelek oluşuncaya kadar sodyum hidroksit
ekleyiniz.
Çökeleğin formülünü yazmaya
çalışınız.
Çökeleği çözününceye kadar amonyak ekleyiniz.
Çökelek amonyakla kompleks
vererek çözünür. Olayın
denklemini yazınız.
Deney tüpünü bek alevinde siyah renk
Isıtma işlemini çeker ocakta
125
oluşuncaya kadar ısıtınız.
yapınız.
Renk değişimini gözlemlemeniz
için karışımı kuruluğa kadar
ısıtmanız gerektiğini
unutmayınız.
Olayın denklemini yazmaya
çalışınız.
126
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
OBJEKTİF TEST (YETERLİK ÖLÇME)
Aşağıdaki ilk 3 soruda uygun seçeneği işaretleyiniz. 4 ve 5. sorulardaki
cümlelerin doğru mu yoksa yanlış mı olduklarını belirtiniz.
1.
Hegzamin nikel (II) hidroksit ( [Ni(NH3)6](OH)2 ) kompleksindeki nikel %’si
aşağıdakilerden hangisidir? ( Ni:58, N:14, H:1, O:16 )
A) 10
2.
D) 40
B) 15,4
C) 154
D) 30,9
10 mℓ 0,1 M Ni+2 çözeltisindeki Ni+2 iyonlarını, Ni(OH)2 hâlinde çöktürmek için 0,4
M sodyum hidroksit çözeltisinden kaç mℓ gerekir? Hesaplayınız.
A) 5
4.
C) 30
7,4 gram nikel (II) oksit yeterince sülfürik asitle tepkimeye girdiğinde kaç gram nikel
(II) sülfat oluşur? ( Ni:58, O:16, S:32 )
A) 1,54
3.
B) 20
B) 7,5
C) 10
D) 15
Nikel kuvvetli asitlerin seyreltik çözeltileriyle tepkimeye girerek H2 gazı açığa çıkarır.
( D / Y)
5.
Nikel (II) tuzlarının sulu çözeltileri kırmızı renklidir.
( D / Y)
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
127
UYGULAMALI TEST (YETERLİK ÖLÇME)
Uygulama faaliyetinde kazandığınız becerileri aşağıdaki tablo doğrultusunda ölçünüz.
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz
mi?
Kullanılacak malzemeleri temin ettiniz mi?
Deney tüpüne nikel sülfat çözeltisi aldınız mı?
Çökelek oluşuncaya kadar sodyum hidroksit eklediniz mi?
Çökeleği çözününceye kadar amonyak eklediniz mi?
Deney tüpünü bek alevinde siyah renk oluşuncaya kadar ısıttınız
mı?
Deney araç ve gereçlerini temizleyerek öğretmeninize teslim
ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız modül değerlendirmeye geçiniz. Yetersiz olduğunuzu düşünüyorsanız
öğretmeninize danışınız.
128
MODÜL DEĞERLENDİRME
MODÜL DEĞERLENDİRME
Aşağıdaki soruların seçeneklerinden doğru olanını işaretleyiniz.
1.
0,2 M 100 mℓ Cu+2 çözeltisindeki bakır iyonlarının tamamını metalik bakıra
indirgemek için kaç g demir metali gerekir?( Cu : 64, Fe : 56 )
A) 1,12
2.
D) 1787
B) 4.48
C)6,72
D) 44,8
B) 672
C) 896
D) 1435
B) 5
C) 3
D) 2
Demir (III) oksit bileşiği karbonmonoksit gazı ile indirgenerek demir metali elde
ediliyor. Tepkimede NŞA’da 10 ℓ karbonmonoksit gazı kullanıldığına göre kaç gram
Fe elde edilmiştir?
A) 5,25
7.
C) 894
KMnO4 + H2SO4 + H2O2 → K2SO4 + MnSO4 + H2O + O2
Yukarıdaki tepkime denklemi denkleştirildiğinde suyun kat sayısı aşağıdakilerden
hangisidir?
A) 8
6.
B) 765
2,08 gram krom üzerine yeterince seyreltik HCl asit etki ettiğinde N.Ş.A. da kaç mL
H2 gazı açığa çıkar? (Cr : 52)
A) 224
5.
D) 5,6
25 g ZnCO3 üzerine yeterince H2SO4 asit etki ettiğinde N. Ş. A da kaç mℓ CO2 gazı
oluşur?( Zn : 65, C : 12, O : 16, H : 1, Cl : 35.5 )
A) 2.24
4.
C) 4,48
Elektrolitik olarak bir eşyanın üzeri gümüşle kaplanmak isteniyor. Eşyanın üzerinde 2
gram gümüş oluşması için devreden kaç Coulomb yük geçmesi gerekir? Bulunuz.
(Ag:108)
A) 500
3.
B) 2,24
B) 10,8
C) 16,6
D) 26,72
Aşağıdaki kobalt klorür kristallerinden hangisi mor renklidir?
A) CoCl2.6 H2O
B) CoCl2.4 H2O
C) CoCl2.2H2O
D) CoCl2.H2O
DEĞERLENDİRME
Yukarıdaki teste verdiğiniz cevapları, cevap anahtarı ile karşılaştırınız. Eksik
konularınız varsa bu eksikliğin neden kaynaklandığını düşünerek arkadaşlarınızla tartışınız.
Öğretmeninize danışarak tekrar bilgi konularına dönüp eksiklerinizi gideriniz.
129
PERFORMANS TESTİ
FeSO4.7 H2O kristalleri elde ediniz ve raporunuzu yazınız. İşlemlerden sonra
aşağıdaki kontrol listesini doldurunuz. Cevabı “Hayır” olan soruları öğretmeninize danışınız.
Kullanılacak malzemeler:
1. Destek
2. Bek
3.Üçayak
4.Amyantlı tel
5. Hâlka
6. Huni
7. Pipet
8.Beher
9.Mezür
10. Saf su
11. Demir tozu
12. Sülfürik asit
Değerlendirme Ölçütleri
Evet
Hayır
Laboratuvar önlüğünüzü giyip çalışma masanızı düzenlediniz mi?
Kullanılacak malzemeleri temin ettiniz mi?
Beher içerisine 4 – 5 gram demir tozunu tartarak aldınız mı?
Demir tozu üzerine çeker ocakta 2 M H2SO4 asit çözeltisinden 100
mℓ ilave ettiniz mi?
Gaz çıkışı azalınca kaynatmadan hafifce ısıttınız mı?
Gaz çıkışı tamamlanınca karışımı az sıcakken süzdünüz mü?
Süzüntüyü beher içerisinde 10 – 15 mℓ kalana kadar çeker ocakta
kaynatmadan buharlaştırdınız mı?
Beheri çeşme suyu ile dışarıdan soğuttuğunuz da yeşil renkli kristal
oluştu mu?
Çözeltiyi aktararak kristallerden ayırdınız mı?
Kristalleri kurutarak ambalajladınız mı?
Araç ve gereçleri temizleyerek öğretmeninize teslim ettiniz mi?
DEĞERLENDİRME
Bu yeterlik sırasında bilgi konularında veya uygulamada anlamadığınız veya beceri
kazanamadığınız konuları tekrar ediniz. Konuları arkadaşlarınızla tartışınız. Kendinizi yeterli
görüyorsanız diğer modüle geçiniz. Yetersiz olduğunuzu düşünüyorsanız öğretmeninize
danışınız.
130
CEVAP ANAHTARLARI
CEVAP ANAHTARLARI
ÖĞRENME FAALİYETİ-1’İN CEVAP ANAHTARI
1
A
2
D
3
D
4
B
5
A
ÖĞRENME FAALİYETİ -2’NİN CEVAP ANAHTARI
1
B
2
A
3
C
4
A
5
D
ÖĞRENME FAALİYETİ-3’ÜN CEVAP ANAHTARI
1
A
2
B
3
C
4
D
5
A
ÖĞRENME FAALİYETİ-4’ÜN CEVAP ANAHTARI
1
B
2
A
3
D
4
C
5
B
ÖĞRENME FAALİYETİ-5’İN CEVAP ANAHTARI
1
A
2
D
3
B
4
C
5
C
ÖĞRENME FAALİYETİ-6’NIN CEVAP ANAHTARI
1
D
2
C
3
B
4
A
5
B
ÖĞRENME FAALİYETİ-7’NİN CEVAP ANAHTARI
1
C
2
B
3
A
131
4
D
5
A
ÖĞRENME FAALİYETİ-8’İN CEVAP ANAHTARI
1
A
2
B
3
A
4
C
5
D
ÖĞRENME FAALİYETİ-9’UN CEVAP ANAHTARI
1
D
2
A
3
B
4
D
5
C
ÖĞRENME FAALİYETİ-10’UN CEVAP ANAHTARI
1
DOĞRU
2
DOĞRU
3
DOĞRU
4
DOĞRU
5
YANLIŞ
ÖĞRENME FAALİYETİ-11’İN CEVAP ANAHTARI
1
C
2
B
3
A
4
DOĞRU
5
YANLIŞ
MODÜL DEĞERLENDİRME CEVAP ANAHTARI
1
A
2
D
3
B
4
C
132
5
A
6
C
7
C
KAYNAKÇA
KAYNAKÇA
BAYIN Ömer, Kimya, Lise 2 , Emel Ofset, İstanbul, 1977.
Prof.Dr. DEMİR Mustafa, Prof.Dr. Şahinde DEMİRCİ, Prof.Dr.Ali
USANMAZ, Anorganik Kimya ve Uygulaması II, Milli Eğitim Basımevi,
İstanbul, 1997.
Prof.Dr. DEMİR Mustafa, Prof.Dr. Şahinde DEMİRCİ, Prof.Dr.Ali
USANMAZ, Anorganik Kimya, 4.Akşam Sanat Okulu Matbaası, Ankara,
2002.
EREN Adnan, Anorganik Kimya Laboratuvarı Ders Notları, Darıca, 1997.
IŞIK Etem, Adnan EREN, Temel Kimya Laboratuvarı Ders Notları, Eylül,
1996.
YÜCESOY Ferah, Anorganik Kimya Laboratuvarı, SHÇEK Basımevi,
Ankara, 2001.
133