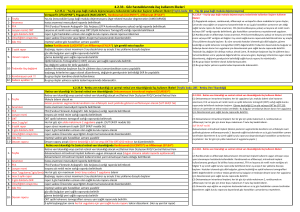
“YAŞ TİP YAŞA BAĞLI MAKULA DEJENERASYONU”NDAN KAYNAKLANAN GÖRME BOZUKLUĞU “DİYABETİK MAKÜLER ÖDEM”DEN KAYNAKLANAN GÖRME BOZUKLUĞU
TEDAVİSİNDE RANİBİZUMAB (LUCENTİS) VE AFLİBERSEPT (EYLEA) ETKEN MADDELİ İLAÇLAR:
1.YAŞ TİP YAŞA BAĞLI MAKULA DEJENERASYONU” TEDAVİSİNDE YÜKLEME DOZU HER İKİ ETKEN MD İÇİN: 3 (ÜÇ) DOZ
2.DİYABETİK MAKÜLER ÖDEM YÜKLEME DOZU:
a) RANİBİZUMAB (LUCENTİS) ETKEN MADDELİ İLAC 3 (ÜÇ), DOZ
b) AFLİBERCEPT (EYLEA) ETKEN MADDELİ İLAC 5 (BEŞ) DOZ
SAĞLIK UYGULAMA TEBLİĞİNİN “GÖZ HASTALIKLARINDA İLAÇ KULLANIM İLKELERİ” BAŞLIKLI
4.2.33. MADDESİ HAKKINDA DUYURUSU: (08.05.2017)
AÇIKLAMA:
1-Yükleme Dozu;
“Yaş tip yaşa bağlı makula dejenerasyonu”ndan kaynaklanan görme bozukluğu tedavisinde
ranibizumab ve aflibersept etken maddeli ilaçların yükleme dozunun 4 (dört)-6 (altı) hafta
ara ile 3 (üç) doz olarak, “diyabetik maküler ödem”den kaynaklanan görme bozukluğu
tedavisinde yükleme dozunun 4 (dört) - 6 (altı) hafta ara ile ranibizumab etken maddeli ilacın
3 (üç), aflibercept etken maddeli ilacın da 5 (beş) doz olarak yapılması gerekmektedir.
Yükleme dozları arasındaki sürenin hastaya bağlı sebeplerle 6 (altı) haftanın üzerine çıkması
söz konusu olduğu takdirde bu durumun belirtildiği sağlık kurulu raporuna istinaden 4-6
hafta ara ile yükleme dozunun yeniden tekrarlanması gerekmektedir.
A.YÜKLEME DOZU:
1. YÜKLEME DOZU (İLK 3 DOZ) PERİYOTLARININ UYGULANMA ARALIĞI EN
FAZLA 6 HAFTA OLABİLİR.
2. YÜKLEME DOZU (İLK 3 DOZ) PERİYOTLARININ UYGULANMA ARALIĞI 6
HAFTAYI AŞMASI HALİNDE YENİDEN BAŞLANGIÇ TEDAVİSİ DÜZENLENİR VE
‘’BAŞLANGIÇ YÜKLEME TEDAVİSİNDE 6 HAFTANIN ÜZERİNDE ARA VERİLMESİ
SEBEBİ İLE YENİDEN BAŞLANGIÇ YÜKLEME DOZU BAŞLANDIĞI’’ RAPOR
AÇIKLAMALARINDA BELİRTİLİR.
B. DEVAM TEDAVİSİ : DEVAM TEDAVİ İÇİN İLAÇ KISA ÜRÜN BİLGİSİNDE
2-Devam tedavisi; Yükleme dozu tamamlanan vakalarda tedavinin devamı, ilacın “Kısa Ürün BELİRTİLEN KURALLARA UYULACAK OLUP TEDAVİYE DEVAM KARARI İDAME
Bilgisi”nde yer alan esaslar doğrultusunda sürdürülecek olup tedaviye devam kararı her UYGULAMASI İÇİN HER DÜZENLENEN RAPORDA BELİRTİLMELİDİR
uygulama için düzenlenecek yeni sağlık kurulu raporunda belirtilecektir.
3-İlaç Değişimi; İlaç değişimi bir defaya mahsus olmak üzere, ilk tedaviye başlanan ilaç ile
yükleme dozu tamamlandıktan sonra devam edecek tedaviler esnasında yapılacak
değerlendirme sonucuna göre, hekim tarafından uygun görülen durumda başlangıç
kriterlerine uygun olarak düzenlenmiş, değişimin gerekçesinin belirtildiği sağlık kurulu raporu
ile mümkün bulunmaktadır. İlaç değişimi yapıldığında yeniden yükleme dozu yapılması şartı
aranmayacaktır
C.İLAÇ DEĞİŞİMİ:
1.,İLAÇ DEĞİŞİMİ BAŞLANGIÇ YÜKLEME DOZUNUN TAMAMLANMIŞ OLMA
ŞARTI İLE TEDAVİNİN DEVAMINDA HERHANGİ BİR AŞAMADA YAPILAN
DEĞERLENDİRME İLE MÜMKÜNDÜR .
2. İLAÇ DEĞİŞİMİ İÇİN VE BAŞLANGIÇ KRİTERLERİNE UYUGUN RAPOR
DÜZENLENECEK VE DEĞİŞİM GEREKÇESİ RAPORDA BELİRTİLECEKTİR.
3. YENİDEN YÜKLEME DOZU YAPILMASINA GEREK YOKTUR.
D.İLACA ARA VERİLMESİ.
4-İlaca ara verilmesi; Tedaviye alınan olumlu cevaba göre “Kısa Ürün Bilgisi”nde yer alan
esaslar doğrultusunda tedaviye ara verilmesi durumunda yeniden tedavi, başlangıç
kriterlerine uygun olarak düzenlenmiş sağlık kurulu raporuna istinaden ara vermeden önce
kullanılan ilaç ile mümkündür. Bu durumda yeniden yükleme dozu şartı aranmayacaktır.
1.HASTANIN YAPILMIŞ OLAN TEDAVİSİ SONRASI TEDAVİYE YANIT ALAN
HASTALARIN TAKİBİNDE HEKİM DEĞERLENDİRMESİ SONUCU YENİDEN
TEDAVİ MÜMKÜNDÜR
2. HASTALARDA TEDAVİYE ARA VERMEDEN ÖNCE KULLANDIĞI İLAÇ İLE
YENİDEN BAŞLANABİLİR
3. RAPOR BAŞLANGIÇ KRİTERLERİNE UYGUN DÜZENLENMELİDİR.
4. YENİDEN YÜKLEME DOZU YAPILMASINA GEREK YOKTUR.
E. DUYURU TARİHİNDEN ÖNCE BAŞLANMIŞ TEDAVİLER
5-; Bu Duyuru tarihinden önce başlanmış tedaviler açısından; Yükleme dozunun yukarıda
belirtilen süreler haricinde de olsa tamamlanmış olduğunun sağlık kurulu raporunda
belirtilmiş olması koşuluyla tedavilerin en son uygulanan etken madde ile devamı mümkün
bulunmaktadır. Diğer yandan Kurum reçete inceleme birimlerince inceleme aşamasında olan
reçeteler açısından yükleme dozunun yukarıda belirtilen süreler haricinde de olsa
tamamlanmış olduğunun belirlenmesi durumunda tedavilerin devamı sağlanacak şekilde
uygulama yapılması gerekmektedir. Bu madde kapsamında yer almakta olan hastaların
tedaviye devam kararı da her uygulama için düzenlenecek yeni sağlık kurulu raporunda
belirtilecektir. Daha önce ilaç değişimi yapılmış vakalar için yeniden ilaç değişimi
yapılmayacaktır
1. DÜZENLENEN RAPORLARDA TANIYA GÖRE TEDAVİNİN BAŞLANGIÇ DOZ
UYGULAMASININ (3 DOZ YADA 5 DOZ) YAPILMIŞ OLMASININ BELİRTİLMİŞ
OLMASI TEDAVİ İDAMESİNİN YAPILMASI İÇİN YETERLİDİR.
2.BAŞLANGIÇ DOZ UYGULAMASININ BELİRTİLEN 4 VEYA 6 HAFTA ARA İLE
YAPILMIŞ OLUP OLMADIĞINA BAKILMAYACAKTIR.
3. TEDAVİ BAŞLANGIÇ DOZU TAMAMLANAN İLAÇ İLE YAPILACAKTIR
4. DEVAM RAPORLARI İÇİN TEDAVİYE DEVAM KARARI HER RAPORDA
BELİRTİLECEKTİR
5.DAHA ÖNCE İLAÇ DEĞİŞİMİ YAPAN HASTALARDA YENİDEN İLAÇ DEĞİŞİMİ
YAPILMAYACAKTIR.
ÖNEMLİ NOT:
İNCELEME AŞAMASINDA OLAN REÇETELER İÇİN RAPOR AÇIKLAMALARINDA
TEDAVİNİN BAŞLANGIÇ TEDAVİSİNİN YAPILMIŞ OLDUĞUNUN BELİRTİLMESİ
KOŞULU İLE TEDAVİ DEVAMI UYGUN KABUL EDİLEREK İŞLEM YAPILACAKTIR.