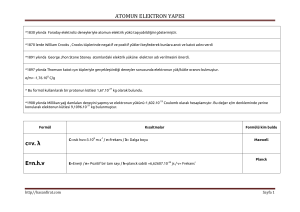
1. ÜNİTE: MODERN ATOM TEORİSİ
1.2.Atomun Kuantum Modeline Yönlendiren
Bulguların Tarihsel Gelişimi
Elektromanyetik ışınların tanecik karakterine ilişkin çalışmalar yapan Einstein, fotoelektrik olayı açıklarken ışığın fotonlardan oluşan tanecikli bir yapıya sahip olduğunu düşünmüştü.
Ancak beyaz ışığın prizmadan geçirilmesiyle bir spektrum oluşturacak şekilde kırılması ve girişim olayları, ışığın dalga özelliği taşıdığını göstermişti. Önceki konumuzda öğrendiğiniz gibi
Bohr Atom Modeli, tek elektronlu türler için elde edilen spektrumları başarı ile açıklarken birden fazla elektron içeren türlerin spektrumlarını açıklamada yetersiz kalmıştı. Bohr modeli,
hidrojen elektronuna ilişkin enerjilerin neden kuantlaştığına
bir açıklama getirememesi nedeniyle bilim insanları tarafından
sorgulanıyordu. Bu modelde ileri sürüldüğü gibi elektronun neden çekirdek etrafında, belirli uzaklıklardaki yörüngelerle kısıtlı
Şekil 1.12: Enerjisi azalan elektronun
hızı düşer, gittikçe yörünge çapı küçülür ve çekirdeğe çarpar.
çizgilerde bulunması gerektiği açıklanamıyordu.
a. Bohr Atom Modelinin Yetersizliği
Hidrojenin ışıma spektrumu manyetik alanda incelendiğinde
tek bir çizgi gibi görünen, bir renge ait, dalga boyları birbirine
yakın alt çizgilerin varlığı da gözlenir. Bohr modeli bu alt çizgileri
açıklayamamıştır.
Fizik kurallarına göre çekirdek çevresindeki dairesel yörüngelerde belli bir hızla dönen elektronlar, bir süre sonra enerji kaybederek çekirdeğe yaklaşmalı ve sonunda çekirdeğe çarpmalıdır
(Şekil 1.12). Ancak atomda bu olay gözlenmemiştir.
Bohr modeli, katı ya da sıvı maddelerdeki atomların bağlarını
Bilgi Kutusu
Bohr Atom Modeli, sadece
tek elektronlu atom veya iyonların spektrumlarını açıklayabilir. Bu modelde dalga-tanecik
ikiliği göz önüne alınmamıştır.
ve birleşerek molekülleri nasıl oluşturduğunu açıklayacak bilgiler
içermemektedir. Bohr modelinin açıklayamadığı bir diğer olay,
atom çekirdeğinin 1. enerji düzeyindeki elektronunu yakalayarak
başka bir çekirdeğe dönüştüğü radyoaktif değişimlerdir.
Bohr modeli, birden fazla elektronlu element atomlarında,
elektronların çekirdekle ve birbirleriyle etkileşimlerini hesaba
katmamış, elektronlar arası elektrik ve manyetik alan etkilerini
dikkate almamıştı. Atom üç boyutlu olduğu hâlde, elektronun çizgisel bir yörüngede bulunduğunu kabul etmişti.
Elektronların dalga özelliklerinin keşfi, bir dalganın konumunun nasıl belirleneceği problemini ortaya çıkarmıştı. Dalganın
uzayda yayılması konumunun tam olarak belirlenebilmesini engelliyordu. Ayrıca elektronun çok küçük bir kütleye sahip olması
da dalga-tanecik ikiliğini anlamayı zorlaştırmıştı. 1920’li yıllarda
Werner Heisenberg (Vernır Hayzınbörg, Resim 1.19) bir dalga
Resim 1.19: Werner Heisenberg
(1901-1976)
35
1. ÜNİTE: MODERN ATOM TEORİSİ
gibi davranabilen elektron gibi küçük taneciklerin konumunun
belirlenmesi amacıyla çalışmalar yaptı. Uyguladığı deneyler sonucunda yaptığı hesaplamalarda, elektronun konumundaki belir-
sizlik ( x) ile elektronun momentumundaki belirsizliğin ( p) çarh
pımının, toplam belirsizlik c
m ’den küçük olamayacağını buldu.
2r
h
Bu durumu Tx ·Tp H
şeklinde bir matematiksel bağıntı ile
2r
ifade etti.
Heisenberg’e göre elektronun atom içindeki yeri ne kadar be-
lirlenirse hızı o kadar belirsizleşir. Elektronun hızı ne kadar net
belirlenirse yeri o kadar belirsizleşir. Bu nedenle elektronun, tam
olarak tanımlanmış yörüngelerde dönen bir tanecik olarak düşünülmesi doğru değildir.
Heisenberg bu durumu açıklarken ölçüm yapmak için kulla-
nılan araçların, ölçülen şeyin özelliklerini değiştirebileceğini dü-
şünmüştü. Bu da belirsizliğe neden olmaktaydı. Elektronların
yerini ve hızını belirlemek için ışık, araç olarak kullanılır. Elektron gibi küçük bir cismi görebilmek için kullanılacak ışığın dalga
Bilgi Kutusu
Heisenberg belirsizlik ilkesine göre bir elektronun hem yeri
hem de hızı aynı anda belirlenemez. Bu durumda Bohr atom
modelinde ileri sürülen yörünge
kavramı yanlıştır.
boyu kısa olmalıdır. Bu ışık elektrona çarptığında, enerji kazanan elektronun hızını ve yerini değiştirir. Elektrondan yansıyarak
gözümüze ulaşan ışık demeti elektronun gerçek yerini ve hızını
yansıtamaz. Bu nedenle elektronların atom içinde hareket ettiği
kesin bir çizgiden söz edilemez.
Heisenberg’ün 1925’te ileri sürdüğü görüşleri, atom içi hare-
ketlerin ve dolayısıyla atomun kuantum modelinin temelini oluşturdu.
b. De Broglie Hipotezi
“Işık bir dalga mı yoksa tanecik midir?” soruları yıllar sonra
ışığın hem dalga hem de tanecik olabileceği düşüncesini ortaya
çıkarmıştır. 1924 yılında De Broglie (Dö Brogli), ışık dalgalarının
foton olarak davranabilmesinden yola çıkarak elektron gibi küçük
taneciklerin dalga özelliği gösterebileceğini ileri sürdü.
n = 5, 4, 3, 2, 1,
Bohr’a göre bir tanecik olan elektron, atom içinde elektrostatik
ve merkezcil kuvvetlerin etkisinde belirli çizgiler olan yörünge-
lerde dolanmaktaydı. De Broglie tanecik ve dalganın birbirinden
bağımsız olmayıp birbirlerini tamamlayan parçalar olduğunu düşündü. De Broglie’ye göre hareket hâlindeki taneciklere dalgalar
eşlik edebilirdi. Bazen taneciklerin elektromanyetik radyasyonlar
gibi bazen de elektromanyetik radyasyonların tanecik gibi davrandığını ileri sürerek elektronlara sanal bir dalganın eşlik ettiğini
düşünmüştü. De Broglie modeline göre farklı elektron yörüngeŞekil 1.13: De Broglie dalga modelinin
Bohr Atom Modeli’ne uygulanması
36
leri Şekil 1.13’de gözlendiği gibi çekirdek etrafında kapalı dalga
hareketi oluşturmaktaydı.
1. ÜNİTE: MODERN ATOM TEORİSİ
De Broglie, daha çok elektron dalgaları üzerinde çalışmalar
yaptı. Ancak elde ettiği sonuçların her türlü tanecikli yapı için geçerli olduğunu kabul etti.
Planck bir fotonun enerjisini hesaplamak için;
E = h·o
formülünü kullanmıştı.
Einstein’ın bir fotonun enerjisini kütlesine bağlı olarak hesapladığı eşitlik;
E = m·c
2
Bunları Biliyor musunuz?
Davisson ve Germer, büyük
bir nikel kristalinden tesadüfen
elektron kırınımı deseni elde ettiler. Aynı yıl Thomson’un oğlu
G.P. Thomson, ince bir altın levhadan elektron demeti geçirerek
elektron kırınımını gerçekleştir-
şeklindeydi.
di. Davisson ve G.P. Thomson,
De Broglie, Planck ve Einstein’ın eşitliklerini birleştirerek aşağıdaki eşitliği oluşturdu.
rindeki çalışmaları ile 1937 yı-
h · o = m · c2
c
formülde o yerine yazılırsa
m
c
h · = m · c2
m
elektronların dalga özelliği üzelında Nobel Fizik Ödülü’nü paylaştılar. İlginç olan J. J. Thomson,
oğlundan 31 yıl önce elektronun
tanecik özelliği gösterdiğini ileri
sürerek Nobel Fizik Ödülü’nü almıştır.
bağıntısı elde edilir.
Bu durumda bir fotonun dalga boyu,
h
m = m·c
eşitliği ile hesaplanır.
Maddesel bir taneciğin dalga boyu hesaplanırken eşitlikte ışık
hızı ^ch yerine tanecik hızı ^vh alınır. Eşitlik
h
m = m· v
şeklinde yazılır.
De Broglie’nin formülle açıkladığı dalga-tanecik ikiliği ancak
dalga boylarının atom ve çekirdek boyutlarına yakın olması durumunda önem kazanır. Çünkü büyük cisimlerde dalga boyu ölçülemeyecek kadar küçüktür.
De Broglie’nin ileri sürdüğü hipotezi değerlendiren Clinton Davisson (Kılintın Devissın) ve Lester Germer, (Lestır Cirmır) 1927
yılında elektronların dalga özelliği taşıdığını ilk kez deneysel olarak kanıtlamıştır. Davisson ve Germer düşük enerjili bir elektron
demetinin nikel bir kristal ile kırınıma uğradığını göstererek elektronların dalga boylarını ölçtüler. Aynı dönemde J. J. Thomson’un
oğlu George Paget Thomson (Corc Pecıt Tamsın) da bir elektron
demetini ince bir metal levhadan geçirerek X-ışınlarıyla elde edilene
benzer (Şekil 1.14.a, b) kırınım ve girişim desenlerini gözlemlemiş ve elektronun dalga özelliğini kanıtlamıştır.
Şekil 1.14.a: X-ışınlarının kırınımı
Şekil 1.14.b: Metal levhanın elektron kırınımı
37
1. ÜNİTE: MODERN ATOM TEORİSİ
c. Atomun Kuantum Modeliyle Taneciklerin Dalga
Karakteri Arasında Nasıl Bir İlişki Vardır?
Heisenberg’le aynı tarihlerde çalışmalar yapan Erwin Schrödinger (Örvin Şödingır) de Heisenberg’i destekleyen kuvvetli deliller ileri sürmüştü (Resim 1.20). Schrödinger’a göre atom içinde
hareket eden elektronların yerlerini net olarak belirlemek mümkün değildi. Ancak elektronun bulunma olasılığının yüksek olduğu yerler belirlenebilirdi.
Schrödinger’ın bu görüşlerini hidrojen atomu için değerlendiResim 1.20: Erwin Schrödinger
(1887-1961)
rirsek bir elektronun atom içinde bulunabileceği yerler, çekirdekten itibaren sonsuza kadar bir alan olarak düşünülebilir. Fakat
belirli bir uzaklıktan sonra bu ihtimal çok zayıflar. Bu durumda
elektronun bulunma olasılığı çekirdekten sonra belirli uzaklıklarda çok yüksektir (Grafik 1.1). Çekirdekten belirli uzaklıkta bulunan, elektronun bulunma olasılığının yüksek olduğu uzay parçalarına orbital adı verilir.
Bilgi Kutusu
Orbitaller, elektronların çekirdeğin etrafında hangi konumda bulunacağını veren fonksiyonlardır. Kuantum sayıları
Schrödinger denkleminin çözümünden elde edilen sayılardır.
Elektronun orbitallerde bulunma ihtimali
ortalama uzaklık
0
50
100
ortalama uzaklık
0
50
0
50
150
3p
100
ortalama uzaklık
3s
150
3d
100
150
Çekirdeğe olan uzaklık (pm)
Grafik 1.1: Atomda elektronun orbitallerde bulunma ihtimalinin çekirdekten uzaklığa bağlı olarak çizilen grafiği
Atomların çizgi spektrumlarının manyetik alanda incelenmesiyle ortaya çıkan bazı çizgilerin daha alt çizgilere ayrılması olayı
enerji seviyelerinin belirlenmesinde başka faktörlerin de rol aldığı fikrini ortaya çıkarmıştı. Schrödinger, atoma matematiksel bir
yaklaşımla bakmış ve elektronların bazı özelliklerinin bunlara ait
dalga denklemi ile ifade edilebileceğini göstermiştir. Böylece dalga mekaniğini kurarak kendi adıyla anılan denklemi oluşturmuştur. Schrödinger denklemi elektronların enerjileri, hızları ve atom
içerisindeki yerleri hakkında tatmin edici cevaplar vermektedir.
38