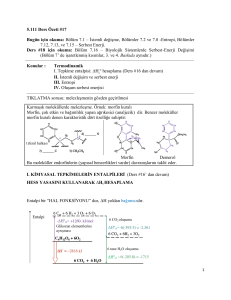
Bölüm 4 Notlar
CHEM 1411 Genel Kimya
4
Kimyasal Nicelikler ve
Sulu Reaksiyonlar
Bölümün Amacı:
• Her bir kimyasalın miktarının mol kavramı ile
nasıl ilişkilendirileceğini ve kullanılacağını
öğrenmek(stokiyometri).
• Sınırlayıcı reaktif problemlerinde teorik
verimin nasıl bulunacağını öğrenmek.
• Çözelti stokiyometrisini içeren molarite
hesaplarını öğrenmek.
• Çökelme,nötrleştirme,redoks ve diğer tüm
kimyasal reaksiyonlarda ürünleri nasıl
tanıyacağımızı ve ürünler hakkında nasıl
tahminde bulunacağımızı öğrenmek.
Mr. Ke
Kevin A. Boudreaux
Ang
Ange
elo Stat
State Univer
University
sity
1
www.angelo.edu/f
www.angelo.edu/fa
aculty/kb
culty/kboudre
oudrea
a
Hatice Nur ERSOY
Erciyes University
GİRİŞ
• Kimyanın birçok kısmında(hem biyolojik,hem de
biyolojik olmayan) dünya üzerindeki su bazı
biçimlerde yer alır.
– Dünya yüzeyinin yaklaşık %75'i su ve buzlardan,
İnsan vücudunun ise yaklaşık %66'sı sudan oluşmaktadır.
– Önemli kimyasal reaksiyonların çoğu
çözücünün su olduğu sulu çözeltilerde
gerçekleşirler.
• Bu bölümde,bazı kimyasal reaksiyonların nasıl
gerçekleşeceğini ve farklı durumlarda nasıl
oluşturulacağını göreceğiz.Bu reaksiyonların
çoğu sulu ortamda gerçekleşecektir.
2
Bölüm 4 Notlar
Stokiyometri
3
Moleküllerden Mollere ve Gramlara
• Dengeli kimyasal reaksiyonlardaki katsayılar,mol
atomları veya molekülleri aynı oranda birleştirmek
için tepkimeye katılan maddelerin mol miktarını
belirtir.
H2
molekülleri
O2 molekülleri
ile reaksiyona
girer
H2O oluşur
2 H2 (g) + 1 O2(g) → 2 H2O(g)
Bir miktar
H2
Bir miktar O2 ile
reksiyona girer
Bir miktar H2O
oluşur
4
Bölüm 4 Notları
Stokiyometri:Kimyasal Aritmetik
stoicheion + metron
element
ölçüm
• Stokiyometri kimyasal formüller ve
reaksiyonların sayısal ilişkileri ile ilgili
çalışmaktadır.
– Bir formülün stokiyometrisini bilmek,belirli
reaktif ve ürünler için mol ve gram ilişkisi
kurmamızı sağlar.
Yunan:
– Bir reaksiyonun stokiyometrisini
bilmek,birbirinden farklı maddelerin miktarları
ile ilgili ilişki kurmamızı ve ne kadar ürünün
oluşacağı veya ne kadar reaktife ihtiyaç
duyulacağı hakkında tahmin yürütmemizi
sağlar.
5
Reaksiyon Stokiyometrisi: Örnek
2 H2 (g) + 1 O2(g) → 2 H2O(g)
•
Reaksiyonda 32.0 gram O2 vardır.Bu reaksiyon için
ne kadar H2 gerekmektedir?Kaç gram H2O oluşur?
– H2 veya H2O kütlelerini direkt olarak O2
'nin kütlesinden hesaplayamayız.
– Ancak,O2 mol sayısını hesaplar ve dengeli
denklemin katsayılarını H2 ve H2O'nun mol
sayılarını bulmak için kullanılır ve bu sayılarla
kütle hesaplarız.
6
Bölüm 4 Notlar
Reaksiyon Stokiyometrisi:Örnek
2 H2 (g) + 1 O2(g) → 2 H2O(g)
O2 'nin mol sayısı bulunur:
1 mol O 2
= 1.00 mol O 2
32.00 g O 2
O2'nin mol sayısından H2'nin mol sayısı bulunur:
32.0 g O 2 ×
1.00 mol O 2 ×
2 mol H 2
= 2.00 mol H 2
1 mol O 2
H2'nin kütle miktarı bulunur:
2.00 mol H 2 ×
2.02 g H 2
= 4.04 g H 2
1 mol H 2
7
Reaksiyon Stokiyometrisi:Örnek
2 H2 (g) + 1 O2(g) → 2 H2O(g)
Ya da hepsini bir araya getiririz:
32.0 g O 2 ×
1 mol O 2
2 mol H 2 2.02 g H 2
×
×
= 4.04 g H 2
32.00 g O 2 1 mol O 2 1 mol H 2
Kaç gram H2O oluşur?
32.0 g O 2 ×
1 mol O 2
2 mol H 2 O 18.02 g H 2 O
×
×
= 36.0 g H 2 O
32.00 g O 2 1 mol O 2
1 mol H 2 O
8
Bölüm 4 Notlar
Örnekler:Reaksiyon Stokiyometrisi
C3H 8 ( g ) + 5O 2 ( g ) → 3CO 2 ( g ) + 4H 2 O( g )
1a. 2.0 mol C3H8'den kaç mol CO2 oluşur?
1b. 2.0 mol C3H8'den kaç mol H2O oluşur?
1c. 2.0 mol C3H8 ile reaksiyon için kaç mol O2 gerekir?
1d. 3.5 mol O2'den kaç mol CO2 oluşur?
1e. 50.0 g C3H8'den kaç gram CO2 oluşur?
9
Örnekler:Reaksiyon Stokiyometrisi
2. 2004'yılında dünyada 3.0×1010 varil petrol
kabaca eşdeğer 3.4×1015
benzin(C8H18)yandı.Bu kadar benzinin
yanması sonucu atmosfere ne kadar CO2
salınmıştır?
2C8H18(s) + 25O2(g) → 16CO2(g) + 18H2O(g)
Cevap: 1.0×1016 g CO2
10
Bölüm 4 Notlar
Örnekler:Reaksiyon Stokiyometrisi
3. Sulu sodyum hipoklorit(NaOCl),(en iyi
bilinen, çamaşır suyu), klor ile sodyum
hidroksitin reaksiyonu sonucu oluşur:
2NaOH(aq) + Cl2(g) → NaOCl(aq) + NaCl(aq) + H2O
25.0 g Cl2 ile reaksiyona girebilmesi için kaç gram
NaOH gerekir?
Cevap: 28.2 g NaOH
11
Örnekler:Molekül Stokiyometrisi
4. Silisyum tetraklorür SiCl4 oluşturmak için 24.4 g
Si atomu ile kaç gram Cl atomu reaksiyona
girmelidir?
Cevap: 123 g Cl
12
Bölüm 4 Notlar
Örnekler:Reaksiyon Stokiyometrisi
5. Alüminyumun en muhteşem reaksiyonundan biri olan termit
reaksiyonunda,demir(III)oksitten metalik demir
oluşur.Demirin sıvı hale geçmesi için çok fazla ısı
gerekir.Denklemi;
2Al(k) + Fe2O3(k) → Al2O3(k) + 2Fe(s)
Tekrar tekrar kullanılan belirli bir kaynak
işleminde,her defasında en az 86 g Fe üretilmesi
gerekir.(a) Her işlemde minimum kaç gram Fe2O3
kullanılır?(b)Kaç gram alüminyuma ihtiyaç
vardır?
Cevap: (a) 123 g Fe2O3; (b) 41.5 g Al
13
Kimyasal Reaksiyonlarda Verim
• Örneklerde gördüğümüz gibi,bütün reaksiyonlarda
'tamamlamaya git'komutu vardır.Bu tüm tepkime
moleküllerini ürüne dönüştürür.Gerçek hayatta bazı
ürünler küçük aksaklıklar ve kirlenmeler yüzünden
istenilen şekilde oluşmazlar.
• Reaksiyonun tamamlanmasıyla elde edilen miktar
teorik verimdir(yapılabilir maksimum miktar).
• Reaksiyonun gerçek verimi elde edilen gerçek
miktardır(tahmin edilebilir).
14
Bölüm 4 Notlar
Kimyasal Reaksiyonlarda Verim
• Gerçek verimin teorik verim yüzdesi olarak ifade
edilmesine yüzdelik verim denir.
% verim =
gerçek verim
teorik verim
× 100%
• Reaksiyon verimini sınırlayan reaktif önce
tükenir.Buna sınırlayıcı reaktif denir.
• Fazlalık reaktan,sınırlayıcı reaktif tükendikten
sonra hala ortamda bulunan reaktana denir.
15
Örnekler:Yüzdelik Verim
6. Oktan güçlendirici olarak kullanılan metil ter-bütil
eter(MTBE,C5H12O),izobütilenin(C4H8) metanol
(CH3OH) ile reaksiyonu sonucu oluşur.26.3 g
izobütilen ile yeterli miktarda metanol reaksiyonu
sonucu 32.8 g MTBE oluşuyorsa reaksiyonun
yüzdelik verimi kaçtır?
C4H8(g) + CH3OH(s) → C5H12O(s)
Cevap: 79.4%
16
Bölüm 4 Notlar
Sınırlayıcı Reaktan
• İki veya daha fazla reaktifin bulunduğu bir
reaksiyonda,bir reaktif diğerinden önce tamamen
tükenebilir.Bu noktada reaksiyon durur.
• Bu reaktanların miktarı daha sonra oluşan
maximum ürün miktarını belirler.Buna sınırlayıcı
reaktan denir.
• Örneğin;standart 4 kapılı araba yaptığımızı
düşünelim ve elimizde aşağıdaki (eksik) 'maddeler'
listesi vardır.Kaç tane araba yapılabilir?
4 motor
4 direksiyon
15 kapı
8 far
4 sürücü koltuğu
4 dikiz aynası
8 cam sileceği
11 tekerlek
17
Sınırlayıcı Reaktan ve Dondurma
18
Bölüm 4 Notlar
Sınırlayıcı Reaktan ve Pizza
Pizza tarifi:
1 hamur + 5 kutu domates sosu + 2 kalıp peynir → 1 pizza
Eğer elimizde 4 parça hamur,10 kalıp peynir ve 15 kutu
domates sosu olsaydı,kaç pizza yapabilirdik?
1 pizza
4 hamur × 1hamur = 4 pizza
1 pizza
10 kalıp peynir ×
= 5 pizza
2 kalıp peynir
15 kutu domates sosu ×
1 pizza
5 kutu domates sosu
= 3 pizza
Domates sosu sınırlayıcı reaktandır ve teorik
.
yüzde 3 pizzadır.
19
Sınırlayıcı Reaktan ve Pizza
20
Bölüm 4 Notlar
Sınırlayıcı Reaktan
N2(g) + 3H2(g) → 2NH3(g)
• 1.00 mol N2 ve 5.00 mol H2. karıştırılırsa maxsimum
ne kadar NH3 oluşur?
• 2.15 mol N2 ve 6.15 mol H2 karıştırılırsa NH3 'ün
teorik yüzdesi kaç olur?
N2 'nin hepsinin tükendiğini varsayarsak,ne kadar NH3 oluşur?
2.15 mol N 2 ×
2 mol NH 3
= 4.30 mol NH 3
1 mol N 2
H2'nin hepsinin tükendiğini varsayarsak,ne kadar NH3 oluşur?
2 mol NH 3
6.15 mol H 2 ×
= 4.10 mol NH 3
3 mol H 2
H2 sınırlayıcı reaktandır; NH3 'ün teorik yüzdesi 4.10 moldür.
21
Örnekler:Sınırlayıcı Reaktan
7. Bütanın (C4H10) oksijen(O2) ile yanması sonucu
karbondioksit ve su oluşur:
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(g)
58.12 g/mol
32.00 g/mol
44.01 g/mol
18.02 g/mol
100. g C4H10 ve 100. g O2 karıştırılırsa,
a. Hangi reaktan sınırlayıcı reaktiftir?Kaç gram CO2
oluşur?
b. Kaç gram H2O oluşur?
c. Geriye kaç gram reaktif kalır?
d. Eğer CO2'nin gerçek verimi 75.0 g
ise,reaksiyonun yüzdelik verimi nedir?
.
Cevap: (a) O2 sınırlayıcı; 84.6 g CO2; (b) 43.3 g
H2O; (c) 72 g C4H10; (d) 88.6%
22
Bölüm 4 Notlar
Örnekler:Sınırlayıcı Reaktan
8. Amonyak(NH3) aşağıdaki reaksiyonla
sentezlenebilir:
2NO(g) + 5H2(g) → 2NH3(g) + 2H2O(g)
86.3 g NO ve 25.6 g H2 ile başlayan
reaksiyonda amonyağın teorik yüzdesinin kaç
gram olduğunu bulunuz.
Cevap: NO sınırlayıcı; 49.0 g NH3.
23
Örnekler:Sınırlayıcı Reaktan
9. Fosfor triklorür sentezinde,12.0 g P ile 35.0 g Cl2
reaksiyonu sonucu 42.4 g PCl3 oluşuyor.PCl3'ün
yüzdelik verimi kaçtır
2P(k) + 3Cl2(g) → 2PCl3(s)
Cevap: 93.8%
24
Bölüm 4 Notlar
Çözelti
Stokiyometrisi
25
Çözeltiler
• Bir kimyasal reaksiyonun oluşması için reaksiyona
giren maddeler birbirleriyle etkileşim içinde
bulunmalıdırlar.Bir çok kimyasal reaksiyon katı
fazdan çok çözelti içinde ya da gaz fazında
gerçekleşir.
• Bir çözeltide,miktarı az olan maddeye çözünen
(genellikle sıvı veya katı),miktarı çok olan
maddeye çözücü(genellikle sıvı) denir.
– Ayrıca diğer çözeltilere örnek olarak;iki veya
daha fazla katının oluşturduğu (ö;metal
alaşımlar),katı içinde çözünmüş gazlar veya gaz
içinde çözünmüş gazlar(ö;atmosfer)
gösterilebilir.
• Çözücüsü su olan çözeltiler 'sulu çözeltiler' olarak
adlandırılır.
26
Bölüm 4 Notlar
Seyreltik ve Konsantre (Derişik,Yoğun) Çözeltiler
• İçerisinde az miktarda çözünen bulunduran
çözeltilere seyreltik çözelti denir.
• İçerisinde çok miktarda çözünen bulunduran
çözeltiere derişik çözelti denir.
27
Çözelti Stokiyometrisi-Molarite
• Mevcut maddelerin çözelti içerisindeki hacmi
ölçüm ve hesaplamalar için bilinmelidir.
• Konsantrasyonun ortak birimi olan molarite
(M) ;çözeltide litre başına çözünen madenin mol
sayısına denir(çözeltinin,çözücünün değil).
Molarite (M ) =
çözünenin mol miktarı mol / L = mol L-1
=
çözeltinin hacmi
• Bir çözeltinin molaritesi,çözünen mol sayısını
mevcut çözeltinin hacmi ile ilişkilendirmek için
bir dönüşüm faktörü olarak kullanılabilir.
28
Bölüm 4 Notlar
İstenilen Molaritede Çözelti Hazırlamak
• Bir molar çözelti,bir mol çözücüye bir mol çözünen
eklenerek yapılamaz.Çünkü çözeltinin hacmi
çözünen ve çözücünün hacminden oluşur.
• İstenilen molaritede çözelti hazırlanırken,hacmi
bilinen bir şişeye(volümetrik şişe) uygun miktarda
çözünen eklenir ve
şişenin sınır
çizgisine kadar
çözücü ilave edilir.
29
Figure 4.5
Çözeltinin Seyreltilmesi
• Seyreltik çözeltiler yoğun çözeltilerin
seyreltilmesi ile de elde edilebilir.
Yoğun çözelti + Çözücü → Seyrek çözelti
• Yoğun çözeltinin ilk molaritesi (M1) ve hacmi (V1)
seyrek çözeltinin son molaritesi(M2) ve hacmi
(V2) ile aşağıdaki denklemde gösterildiği gibi
orantılıdır:
M1 V1 = M2 V2
Hacim birimleri bu
denklemde
önemli
değildir.
30
Figure 4.6
Bölüm 4 Notlar
Örnekler:Molarite
10. Su ile çözünen 2.355 g sülfirik asitin 50.0 ml'ye
seyreltilmesi sonucu çözeltinin molaritesi nedir?
Cevap: 0.480 M H2SO4
31
Örnekler:Molarite
11. Hacmi 1.75 L molaritesi 0.460 M olan sodyum
monohidrojen fosfat çözeltisinde kaç gram
çözünen vardır?
Cevap: 114 g
32
Bölüm 4 Notlar
Örnekler:Molarite
12. Molaritesi 0.125 olan NaOH
çözeltisinde,NaOH 0.255 moldür.Buna göre
kaç litre çözelti vardır?
Cevap: 2.04 L çözelti
33
Örnekler:Çözeltiyi Seyreltme
13. Kontakt lenslerin bakımı ve burun içi
nemlendirmede kullanılan izotonik salin 0.150
M NaCl sulu çözeltisinde iyonların toplam
konsantrasyonuna benzer.6.00 M mevcut
solüsyondan 800. mL izotonik salin nasıl elde
edilir?
Cevap: 20.0 mL
34
Bölüm 4 Notlar
Örnekler:Çözeltiyi Seyreltme
14. Molaritesi 15.0 M olan NaOH çözeltisi 0.200
L'dir.NaOH'ın molaritesinin 3.00 M
olabilmesi için kaç litre çözücü eklenmesi
gerekir?
Cevap: 1.00 L
35
Örnek:Çözeltinin Toplam Tepkime Stokiyometrisi
15. Mide asiti olan sulu HCl çözeltisi sodyum
bikarbonat ile aşağıdaki gibi tepkimeye girer;
HCl(aq) + NaHCO3(aq) → NaCl(aq) + H2O(s) + CO2(g)
0.100 M 18 mL HCl çözeltisi ile 0.125 M kaç
mL NaHCO3 tepkimeye girer?
Cevap: 14.4 mL
36
Bölüm 4 Notlar
Örnek:Çözeltinin Toplam Tepkime Stokiyometrisi
16. Kurşun(II) klorür,kurşun(II) nitratın sodyum
klorür ile reaksiyonu sonucu aşağıdaki denklemde
elde edilir;
Pb(NO3)2(aq) + 2NaCl(aq) → PbCl2(k) + 2NaNO3(aq)
2.00 M 15.0 mL Pb(NO3)2ve 1.15 M 45.0 mL NaCl
reaksiyonu sonucu kaç gram PbCl2 oluşur?
Cevap: 7.20 g PbCl2
37
38
Bölüm 4 Notlar
Güçlü
Elektrolitler,Güçsüz
(Zayıf) Elektrolitler
ve Elektrolit
Olmayanlar
39
Çözücü ve Çözünen Etkileşimleri
• Su gibi bir sıvı çözeltiye bir katı ilave edildiği
zaman çözeltinin parçacıkları arasında ve çözelti
molekülleri arasında çekim kuvveti oluşur.
Figure 4.7
40
Bölüm 4 Notlar
Bir Çözücü Olarak Suyun Rolü
• Bir çok reaksiyon sulu çözelti içinde yer alır.
• Bir çok iyonik madde suyun içinde çözünür(belirli
ölçülerde).Su katyon ve anyonları çözmede iyi bir
çözücüdür.
– Bir su molekülünün O ucu negatif (kısmi
negatif yük δ+)H uçları ise pozitif yüklüdür
(kısmi pozitif yük δ-)
– Aynı zamanda su genel olarak eğik bir şekile sahiptir.
– Dengesiz elektron dağılımına sahip olan
eğik şekildeki polar bağların birleşim etkisi
suyu polar molekül yapar.
41
Suyun Polarlığı ve Şekli
H
Figure 4.8
O
O
H
H
H
42
Bölüm 4 Notlar
Bir Çözücü Olarak Su
• Sodyum klorit suda çözüldüğünde,Na+ ve Cliyonları birbirini çeker.Ayrıca bu iki iyon su
moleküllerinide çeker.
– Na+ iyonları kısmi negatif O atomunu
çeker.
– Cl- iyonları kısmi pozitif H atomunu çeker.
– Su ve iyonlar arasındaki çekim,iyonlar
arasındaki çekimden daha kuvvetlidir ve
sodyum klorür çözünmüş olur.
43
Figure 4.9
Bir Çözücü Olarak Su
• İyonlar birbirinden ayrılır ve çözeltiye doğru gelişi
güzel hareket ederler.Daha sonra su molekülleri
tarafından iyonların etrafı sarılır
Figure 4.10
44
Bölüm 4 Notlar
Bir Çözücü Olarak Su
• Sükroz (sofra şekeri, C12H22O11) suda
çözünür,çünkü şeker molekülündeki atomun
parçacıkları suyun atomlarının parçacıkları ile güçlü
bir şekilde etkileşir.Fakat şeker molekülleri
birbirinden ayrılmaz.
45
Figure 4.12
Sulu Çözeltilerdeki Elektrolitler
• Suda çözünen maddeler elektrolit ve elektrolit
olmayan olarak sınıflandırılabilir.
– Elektrolit,suda çözündüğü zaman hareketli
olan anyon ve katyonlar halinde ayrışarak
elektriği yönetirler.
NaCl(k) ⎯H2⎯O⎯ → Na + (aq) + Cl - (aq)
– Elektolit olmayan,suda çözündüğü zaman
elektriği yönetemez.Çünkü iyonlarına
ayrışmayan moleküllerdir:
2O
C12 H 22 O11 (k) ⎯H⎯
⎯
→ C12 H 22 O11 (aq)
46
Bölüm 4 Notlar
Sulu Çözeltilerdeki Elektrolitler
Figure 4.11
47
Güçlü ve Zayıf Elektrolitler
• Elektrolitler iki kategoride incelenir:
– Güçlü elektrolitler ,tepkimeye katılan
maddelerin büyük bir kısmı (%70-100)
(hemen hemen hepsi) iyonlarına ayrışırlar.
– Zayıf elektrolitler ,tepkimeye katılan
maddelerin çok az bir kısmı herhangi bir anda
iyonlarına ayrışırlar.
• Zayıf elektrolitlerin ayrışması genellikle çift yönlü ok
işareti ile gösterilir.
h
Bu işaret dinamik bir denge işleminin hem ileri hemde
geri yönde gerçekleştiğini gösterir.
48
Bölüm 4 Notlar
Güçlü ve Zayıf Elektrolitler
• Güçlü elektrolitlerde denge, hemen hemen
tamamıyla sağa doğru(ayrışmış türe doğru,)
gider.
• Zayıf elektrolitlerde,denge ayrışmamış türlerle solda
yer alır.
• Zayıf elektrolit çözeltisindeki parçacıkların çoğu
iyonlaşmamıştır.Zayıf elektrolit çözücüdeki
elektriği zayıf bir şekilde iletir.
• Denge süreci kimyadaki bir çok kısım için
önemlidir ve daha sonra detaylı bir şekilde
tartışılacaktır.
49
Güçlü ve Zayıf Elektrolitler
Figure 4.13
50
Bölüm 4 Notlar
Çözünür ve Çözünmez
• Bazı durumlarda iyonik bileşiklerdeki elektrostatik
güç su tarafından kapılması için çok büyüktür ve
madde suda çözünmez.
• Basitleştirilmiş olmasına rağmen gerçekte
çözünebilirlik vardır ve maddeler suda az
miktarda bile olsa çözünür.
– 25ºC'de NaCl'nin sudaki çözünürlüğü = 357 g/L d
– 25ºC'de AgNO3'ün çözünürlüğü= 216 g/L
– 25ºC'de AgCl'nin çözünürlüğü= 0.0019 g/L
l
51
Elektrolit Asitler
• Asitler dışında bir çok moleküler bileşik
elektrolit değildir.
• Genel formülü HA olan asitler suda çözündüğü
zaman H+ ve A- olarak iyonlaşır.
HA(g, s) ⎯H2⎯O⎯ → H + (aq) + A - (aq)
– HCl gibi güçlü asitler tamamen
iyonlaşılar.HCl'nin tüm molekülleri H+ ve Clolarak bölünür:
HCl(g) → H+(aq) + Cl-(aq)
– HC2H3O2 gibi zayıf asitler tamamen
iyonlaşmazlar.Moleküllerin sadece küçük bir
oranı H+ ve C2H3O2- olarak bölünür:
HC2H3O2(g) h H+(aq) + C2H3O2-(aq)
52
Bölüm 4 Notlar
Elektrolitlerin Sınıflandırılması
• Güçlü Elektrolitler:
– Çözünebilen iyonik bileşikler.
– Güçlü asitler: HCl, HBr, HI, HNO3, HClO4, H2SO4
• Zayıf Elektrolitler:
– Güçlü asitler dışındaki tüm asitler zayıf
elektrolitlerdir: HF, HC2H3O2, HNO2, H2SO3
• Elektrolit olmayan:
– Moleküler bileşikler(asitler hariç):su,şeker ve
tüm organik bileşikler.
53
Örnekler:İyonik Bileşiklerin Ayrışması
17. Na2S, HBr, AlCl3, ve Pb(NO3)2 'nin sudaki
ayrışma denklemlerini yazınız.
54
Bölüm 4 Notlar
Örnekler:İyonik Bileşiklerin Ayrışması
18. 1 mol CaCl2'nin her iyonundan kaç mol
vardır?
55
Örnekler:İyonik Bileşiklerin Ayrışması
19. 23.4 g Na2S'in her bir iyonu kaç moldür?
Cevap: 0.600 mol Na+, 0.300 mol S2-
56
Bölüm 4 Notlar
Örnekler:İyonik Bileşiklerin Ayrışması
20. Tamamının ayrıştığı düşünülürse 0.225 M sulu
demir bromür çözeltisindeki demir(III) iyonları ve
brom iyonlarının molar yoğunluğu nedir(M)?
İyonların toplam yoğunluğu nedir(M)?
Cevap: 0.225 M Fe3+, 0.675 M Br-, 0.900 M iyon
57
Örnekler:Elektrolitlerin Sınıflandırılması
21. Aşağıdaki bileşikleri güçlü elektrolit,zayıf elektrolit
ve elektrolit olmayan olarak sınıflandırınız.
a. HCl
b. SCl2
c. AgNO3
d. H2O
e. CH3CH2OH
f.
Na2SO4
g. HNO2
h. HNO3
58
Bölüm 4 Notlar
Çökelme
Reaksiyonları
59
Çökelme Reaksiyonları
• Çökelme iki iyonun birleşme reaksiyonu sonucu
oluşur.Buna çökelme reaksiyonu denir. Reaksiyonda
çözelti içinde çözünmeyen madde çöker.
• Bu reaksiyonlar çift-yerdeğiştirme veya metathesis
reaksiyonu olarak bilinir.Çünkü reaktanların anyon
veya katyonları birbiri ile yerdeğiştirerek ürünleri
oluşturur.
AB + CD → AD + CB
• Bu reaksiyon içerdiği iyonlar arasındaki çözünençözünen etkileşimi çözücü-çözünen etkileşiminden
daha güçlü olduğunda gerçekleşir.
• Çözeltide kalan diğer iyonlarada seyirci (izleyici) iyonlar denir.
60
Bölüm 4 Notlar
Çökelme Reaksiyonları
• NaNO3 ve KI çözeltileri karıştırılırsa çözünmüş
iyonlar karışımı elde edilir.Hiçbir ürün suda
çözünmediğinden reaksiyon gerçekleşmez.
NaCl(aq) + KI(aq) → KCl(aq) + NaI(aq): NR
61
Figure 4.15
Çökelme Reaksiyonları
• Diğer taraftan, Pb(NO3)2 ve KI karıştırılırsa katı
PbI2 elde edilr.
Pb(NO3)2(aq) + 2KI(aq) → 2KNO3(aq) + PbI2(k)
Figure 4.14
62
Bölüm 4 Notlar
Çözelti Reaksiyonlarının Tahmini
AB(aq) + CD(aq) → AD(aq) + CB(k)
• Bir reaksiyonun çökelme reaksiyonu olup olmadığını
anlamak ve reaksiyondaki potansiyel ürünlerde
herhangi bir çözünme olup olmadığını bulmak için
aşağıdaki çözünürlük kuralları kullanılır:
– Reaksiyon ürünlerinden biri çözünmezse
(zayıf elektrolit, gaz veya elektrolit olmayan )
reaksiyon gerçekleşir ve uygun şekilde
dengelenir.
– Ürün çözünür formda ise, reaksiyon
gerçekleşmez ve bütün iyonlar seyirci iyonlar
gibi çözeltide kalır.
63
Sudaki İyonik Bileşikler İçin Çözünme Kuralları
64
Bölüm 4 Notlar
Sulu İyonik Bileşikler İçin Çözünme Kuralları
Çözünür İyonik Bileşikler
1. Tüm 1A grubu bileşiklerin ortak iyonları (Li+, Na+,
K+, etc.) ve amonyum iyonu (NH4+) çözünür.
2. Bütün bilinen nitrat bileşikleri (NO3-), asetat
bileşikleri (C2H3O2-), ve perklorat bileşikleri(ClO4-)
çözünür.
3. Bilinen bütün klorürler (Cl-), bromürler (Br-), ve
iyodürler (I-) çözünür ( Ag+, Pb2+ ve Hg22+ hariç).
4. Bilinen bütün sülfatlar (SO42-) çözünür (Ca2+, Sr2
+, Ba2+, Pb2+ ve Ag+ hariç).
65
Sulu İyonik Bileşikler İçin Çözünme Kuralları
Çözünmeyen İyonik Bileşikler
5. Bütün metal hidroksitler (OH-) çözünmezler.
(Çözünür olan 1A grubu metalleri, NH4+ ve az
çözünür olan Ca2+, Sr2+ ve Ba2+ hariç)
6. Bütün sülfürler (S2-) çözünmezler. (1A
grubu metalleri, NH4+, Ca2+, Sr2+ ve Ba2+
hariç)
7. Bütün karbonat (CO32-) ve fosfat bileşikleri
(PO43-) çözünmezler . (1A grubu ve NH4+ hariç )
66
Bölüm 4 Notlar
Örnekler: Çözünürlük Tahmini
22. Her bir bileşiğin çözünürlüğünü bulunuz
a. CaCO3
g. Hg2Cl2
b. Mg(OH)2
h. NH4C2H3O2
c. Na2S
i. AgC2H3O2
d. PbSO4
j. Pb(NO3)2
e. (NH4)3PO4
k. K2CO3
f. HgCl2
l. AgCl
67
Sulu Tepkimelerin Gösterimi
• İyonik bileşikler içeren sulu bir reaksiyonun
denklemi 3 şekilde yazılabilir:
– Molekül Denklemi — eğer molekül
bozulmamışsa formül yazılır (örneğin, NaCl)
– Tam İyonik Denklem — çözünür güçlü
elektrolitlerin (çözünür iyonik bileşikler ve güçlü
asitler)iyon halleri yazılır. (örneğin, Na+, Cl-)
• Çözünmeyen çökeltilere,zayıf elektrolitlere
ve moleküllere dokunulmaz.
• Gerçek bir kimyasal değişime uğramayan
iyonlara 'seyirci iyonlar'denir.
– Net İyon Denklemi — seyirci iyonları ortadan
kaldırarak sadece değişime uğramış iyonlar
gösterilir.
68
Bölüm 4 Notlar
Moleküler,İyonik ve Net İyon Denklemi
Moleküler denklem:
Pb(NO3)2(aq) + 2KI(aq) → 2KNO3(aq) + PbI2(k)
İyonik denklem:
Pb2+ + 2NO3- + 2K+ + 2I- → 2K+ + 2NO3- + PbI2(k)
Seyirci iyonlar: K+ ve NO3Net iyon denklemi:
Pb2+(aq) + 2I-(aq) → PbI2(k)
69
Örnek:Molekül,İyon ve Net İyon Denklemi
23. Aşağıdaki reaksiyonların iyon ve net iyon
denklemlerini yazınız.
2AgNO3(aq) + Na2CrO4(aq) → Ag2CrO4(k) + 2NaNO3(aq)
H2SO4(aq) + MgCO3(k) → MgSO4(aq) + H2O(s) + CO2(g)
70
Bölüm 4 Notlar
Örnek:Çökelme Reaksiyonlarının Tahmini
24. Sulu çözeltideki CaCl2 ve Na2CO3 karışımının
çökelme reaksiyonu olup olmadığına bakınız.Net
iyon denklemini yazınız.
71
Örnek:Çökelme Reaksiyonlarının Tahmini
25. Sulu çözeltideki sodyum nitrat ve lityum sülfat
karışımının çökelme reaksiyonu olup olmadığına
bakınız,net iyon denklemini yazınız.
72
Bölüm 4 Notlar
Örnek:Çökelme Reaksiyonlarının Tahmini
26. CuCO3 çözeltisi elde etmek için çökelme
reaksiyonu nasıl kullanılır?Net iyon denklemini
yazınız.
73
Örnek:Çökelme Reaksiyonlarının Tahmini
27. Aşağıda gösterilen çözelti çiftleri karıştırıldığında
reaksiyonların gerçekleşip gerçekleşmediğini
bulunuz.Eğer reaksiyon gerçekleşiyorsa molekül
denge,iyon ve net iyon denklemlerini yazıp
seyirci iyonları gösteriniz.
a. Gümüş nitrat (aq) ve sodyum klorit (aq)
b. Potasyum nitrat ve amonyum klorit
c. Pb(NO3)2 ve Fe2(SO4)3
d. Demir(III) klorit (aq) ve sezyum fosfat (aq)
e. Sodyum fosfat ve kalsiyum klorit
f.
Ca(OH)2 ve Na2SO4
74