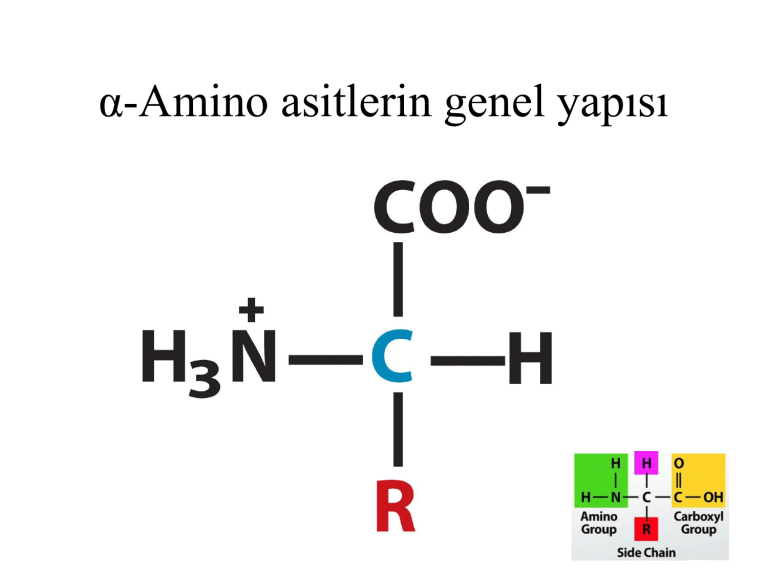
α-Amino asitlerin genel yapısı
Optikçe aktif molekül nedir?
Optikçe akttif moleküller R,S isimlendirmesi
yanında daha kolay olan D,L sistemiyle de
isimlendirilebilir.
Gliser aldehitte aldehit grubu yukarı gelecek şekilde molekülü yazın. Kiral
karbona bağlı –OH size göre sağ tarafta ise ona D izomeri denmiştir. Buna
benzeyen tüm optikçe aktif moleküller D izomeridir. Onun ayna görüntüsü
ise L izomeridir.
Perspektif formül gösterimi: Bağların şekline dikkat edin.
Düz çizgi bağlar kağıt düzlemini,
Kalın çizgi bağın size doğru olduğunu,
Kesikli çizgi bağın size zıt yönde olduğunu gösterir.
Alanin amino asitinin farklı şekilde gösterimleri
Glisin dışındaki tüm aminoasitler kiral karbon
içerirler. L-amino asitler bizim için daha önemlidir.
Amino asitler iyonlaşan gruplar içerir
Amino asitlerin pKa değerleri
Amino asitlerin pKa değerleri
Amino asitlerin sınıflandırılması: 20 çeşit standart
amino asiti beş gruba ayırabiliriz.
•
•
•
•
•
Apolar R grubu olan amino asitler
Polar ve yüksüz R grubu olan amino asitler
Aromatik R grubu olan amino asitler
Pozitif yüklü R grubu olan amino asitler
Negatif yüklü R grubu olan amino asitler
•
Not: R gruplarının negatif veya pozitif yüklü olması ortamın pH’ına göre değişir.
Sınıflandırmada R gruplarının fizyolojik pH’daki yükleri göz önüne alınır.
Apolar R grubu olan amino asitler
Polar ve yüksüz R grubu olan amino asitler
Aromatik R grubu olan amino asitler
Pozitif yüklü R grubu olan amino asitler
Negatif yüklü R grubu olan amino asitler
Spektrofotometre
Aromatik amino asitler 280 nm’de absorbans verirler. Bir
numunenin 280 nm’deki absorbansına bakılarak numunedeki
protein miktarı hakkında bilgi sahibi olunabilir. Numune
çözelti olmak zorundadır.
Disülfit bağı: Bir proteindeki alt birimler genellikle disülfit
bağıyla bir arada tutulur. Disülfit bağı alt birim içinde de
olabilir.
Saçtaki proteinler disülfit bağı içerir. Bağı kopar, şekil ver ve
bağı tekrar oluştur. Saçınıza perma yaptırdığınızda sırasıyla
bu işlemler yapılır.
Not: Bir molekül H
aldıkça indirgenir;
oksijen aldıkça
yükseltgenir.
Standart olmayan amino asitler
Amino asitler ortamın pH’ına göre farklı net yüklere sahip
olurlar. Çünkü amino ve karboksil grubu proton alıp verebilen
gruplardır. Proton vermek negatif yük lehine, almak ise
pozitif yük lehine katkı yapar. Amino asitlerin bulunduğu
ortamın pH’ını düşürdükçe onların pozitif yükü artar.
pI: Amino asitin net
yükünün sıfır olduğu
pH’tır. Proteinlerin de pI
değeri vardır. Ortam pH’ı
pI ile aynı olduğunda o
proteinler elektriksel
alandan etkilenmezler.
Çünkü net yükleri sıfırdır.
Amino asitin pI değerini bulmak için amino asitin iyonlaşma
reaksiyonlarını yazın. Zwitter iyonun sağ ve solundaki pK
değerlerini toplayın ve ikiye bölün.
pI=(pKa1+pKa2)/2
pI=(pKa1+pKa3)/2
Peptit bağının oluşumu
Bir oligopeptit
Peptit bağı, rezonanstan dolayı çift bağ
karakteri taşır. Bağ kendi etrafında dönemez.
Bazı proteinler
İki proteinin amino asit bileşimi
Konjuge proteinler
Proteinlerin üç boyutlu yapısı
Protein zincirinin yapısı:
Primer, sekonder, tersiyer
ve quaterner yapı
Primer yapı
• Polipeptit zincirinin amino asit sırasını ifade
eder.
• Primer yapı diğer yapıları belirleyen ana
faktördür. Yani amino asit sırasındaki bir
değişiklik proteinin üç boyutlu yapısını
etkiler. O sebeple amino asit sırasını
belirleyen DNA üzerşndeki mutasyonlar
tehlikelidir.
Seconder Yapı: Yakın amino asitler
arasındaki etkileşmelerden doğar
• Alfa sarmal yapı
• Beta kırmal yapı
– Paralel
– Antiparalel
Tersiyer yapı: Uzak amino asitler arasındaki
etkileşmeleri ifade eder
• Tersiyer yapı polipeptit zincirindeki
atomların üç boyutlu olarak düzenlendiği
yapıyı ifade etmektedir.
Quaterner yapı
• Birden fazla alt birimden meydana gelen
proteinlerin tüm alt birimleri ile beraber
olduğu yapıyı ifade eder.
Proteinleri
saflaştırma teknikleri
Genel olarak kromatografi
Kromatagrafi, bir
ortamda maddelerin
farklı hızlarda
sürüklenmesi
esasına dayanır.
Sabit faz genelde
katıyken hareketli
faz sıvıdır.
İyon değişim kromatografisi
Jel ile protein zıt
yüklü olmalıdır.
Jel filtrasyon kromatografisi
Büyük proteinler, sabit
fazın porlarına daha az
takıldığı için daha hızlı
ilerler.
Afinite kromatografisi
Bana mazlumu
getirin
Bir elektroforez çeşidi:
SDS-PAGE
Elektroforez, net
bir yükü olan
moleküllerin
elektriksel alanda
göçlerine
dayanmaktadır.
SDS-PAGE’de proteinler + kutba doğru
hareket ederler. Sebebi ise – yüklü olan
SDS deterjan ile muamele edilmeleridir.
Betamerkapto etanol, altbirimler
arasındaki disülfit bağlarını koparır.
Büyük proteinler daha yavaş hareket eder.
Boyamadan sonra bir elektroforez jelinin
görünümü (solda).
SDS-PAGE, genellikle proteinin saflığını
ve alt birimlerin mol kütlelerini
belirlemek için kullanılır.
SDS-PAGE ile protein alt birimlerin de belirlenebilir
Betamerkapto etanol,
altbirimler arasındaki
disülfit bağlarını koparır.
Bu sebeple
İnsülin iki alt
birimden oluşur
Elektroforezle proteininizin mol kütlesini
bulabilirsiniz.
İzoelektrik fokuslama
Her protein pI
noktasında elektriksel
alanda göç edemez.
Çünkü o noktada net
yükü sıfırdır.
Bazı proteinlerin izoelektrik noktaları
İki boyutlu elektroforez
Proteinlerin ana fonksiyonları
•
•
•
•
•
•
•
Kasılma ve hareket: Aktin, miyozin, tubulin
Yapı ve destek: Keratin, kollejen
Taşıma: Hemoglobin, albümin, membran proteinleri
Savunma: Antikorlar, pıhtılaşma proteinleri
Depo: Ferritin, cuprein
Kataliz: Enzimler
Biyolojik sinyal: Bazı hormonlar (insülin, glikagon)
Proteinlerin amino asit
sırasının belirlenmesi
Disülfit bağını parçalamanın yolları
Polipeptit zincirlerini parçalamak için kullanılan bazı metotlar
DNA baz sırası biliniyorsa proteinin amino asit sırasını
deneysel olarak belirlemeye gerek duyulmaz. Ancak DNA,
post-translasyonel modifikasyonlar hakkında bilgi içermez.
Kütle spektroskopisi ile de oligopeptitlerin
amino asit sırası belirlenebilir
Laboratuvarda
protein zinciri sentezi
Bir protein canlıdan canlıya farklı amino asit
dizilimine sahiptir. Dizide benzerlikler de bulunur.










