Bohr kuramının görkemli başarısını bir dizi hayal kırıklığı
izledi. Bohr yaklaşımı ile, helyum ve lityum gibi birden fazla
elektron içeren atomların yayınım spekturumları açıklanamıyordu.
Aynı şekilde, manyetik bir alan uygulanması sonunda hidrojen
spekturumunda ortaya çıkan yeni çizgiler de açıklanamıyordu.
Ayrıca elektronların özelliklerinin keşfi, bir dalganın
konumunu belirleme problemini de beraberinde getirmiştir. Dalganın
uzayda yayılması, konumunun tam olarak belirlenememesi sorununu
ortaya çıkarmıştı.
Bilim adamları Bohr kuramını hem büyük bir şaşkınlıkla
karşıladılar, hem de büyük bir ilgi duydular ve hidrojen elektronuna
ilişkin enerjinin neden kuantlaştığını sorguladılar. Bu çalışmalar
sonucunda elektronun tanecik özelliğinin yanı sıra, bir dalga gibi
davrandığı ortaya konmuştur.
1924 yılında Louis de Broglie, dalgalarının parçacık
(fotonlar) seli gibi davranabilmesinden yola çıkarak; elektron gibi
parçacıklarında dalga özelliği gösterebileceğini öne sürdü.
De Broglie’ye göre çekirdeğe bağlı durumdaki bir elektron,
duran bir dalga gibi davranmaktadır. De Broglie’nin görüşüne göre,
hidrojen atomundaki elektronun durgun bir dalga gibi
davranabilmesi için, dalga boyunun yörüngenin çevresine tam
uyması gerekir. Aksi takdirde her tam dönme sonrası dalganın
kısmen kendini yok etmesi ve sonuçta dalga grafiğinin sıfıra
ulaşarak, dalganın ortadan kalkması durumunu ortaya çıkaracaktır.
De Broglie’nin bulguları, dalgaların tanecik,
taneciklerinde dalga benzeri özellik sergileyebilecekleri
sonucuna ulaşmasını sağlamıştır. De Broglie, tanecik ve dalga
özelliklerini aşağıdaki eşitlikte bir araya getirebileceği
sonucuna varmıştır.
Burada, λ, m ve v hareketli bir taneciğe ilişkin
dalgaboyu, kütle ve hızı belirtmektedir.
Eşitlik, hareket halindeki bir taneciğin dalga gibi
tasarlanabileceğini, dalganın da tanecik özellik gösterebileceğini
ifade etmektedir.
Elektronlar hem dalga, hem de tanecik özelliğine
sahiptirler. Atomların yapısı açıklanırken, elektronların dalga
özelliğinin hesaba katılması gerekir.
1927’de C.J.Davisson ve L.H. Garmer yavaş hareket
eden bir elektron demetinin nikel kristal tarafından kırınıma
uğradığını gösterdiler. Aynı yıl G.P.Thomson bir elektron
demetini ince bir metal yaprağa gönderdi ve X–ışınları ile elde
edilen bir kırınımın aynısını elde etti. G.P. Thomson, J.J.
Thomson’un oğludur. Bu çalışmaları nedeniyle bilim
adamlarına 1937 yılında Nobel Fizik Ödülü verilmiştir.
1920’li yıllarda Werner Heisenberg atomlardan küçük
taneciklerin davranışlarını belirlemek için kutuda parçacık modeli
geliştirdi. Üç boyutlu ortamda hareket eden bir parçacığın aynı
anda hem yerinin hem de hızının belirlenemeyeceğini ispatladı.
Bunun sonucunda Heisenberg Belirsizlik ilkesi olarak
bilinen bir prensibi bilim dünyasına sundu ve kabul ettirdi.
Daha açık bir ifade ile elektronun herhangi bir andaki yeri
ve hızı aynı zamanda kesin olarak belirlenemez.
Heisenberg’in ulaştığı sonuca göre ölçümlerde daima bir
belirsizlikle karşılaşmaktadır. Bu belirsizlik;
Elektron gibi küçük tanecikleri tespit etmek için gönderilen
uygun dalga boyundaki ışık, elektronun yerini ve momentumunu
değiştirir. Bu yüzden, aynı anda elektronun yeri ve hızı ölçülemez.
Yerinde ve momentumunda bir belirsizlik vardır. Bu
nedenle de elektronlar çekirdek çevresinde belirli dairesel
yörüngelerde değil orbital adı verilen belirli enerji seviyelerinde
bulunurlar.
Yörünge yerine elektronların çekirdek etrafında
bulunma olasılığından bahsetmek gerekir.
Elektronun, tam olarak yörüngelerde dönen bir tanecik
olarak tasarlanması doğru değildir.
Çünkü bir taneciğe ilişkin hem konum hem de momentum
(kütle.hız) aynı anda tam olarak belirlenemez.
1926 yılında, karmaşık bir matematiksel teknikten
yararlanan Erwin Schrödinger, mikroskopik taneciklerin
enerjilerini ve genel davranışlarını betimleyen bir denklem
geliştirmiştir. Schrödinger Denklemi.
Schrödinger Denklemi
Schrödinger denklemi, kuantum mekaniği olarak adlandırılan
yeni bir dönem başlatmıştır. Kuantum mekaniği, bir atomdaki
elektronun tam yerinin belirlenemeyeceğini açıklayabilmektedir.
Elektron yoğunluğu kavramı, atomun belirli bir bölgesinde bir
elektronun bulunma olasılığını verir.
Schrödinger denklemi , atom çekirdeği etrafındaki üç boyutlu
uzayda elektron yoğunluğu dağılımını göstermektedir. Bu bölgelere
orbital denilmektedir.
Orbital, atom içindeki bir elektronun dalga fonksiyonu olarak
düşünülebilir.
Kuantum mekaniğinde, hidrojen ve diğer atomlardaki
elektron dağılımlarını açıklamak için dört kuantum sayısı
gereklidir. Bu kuantum sayıları Schrödinger denkleminin
hidrojen atomu için gerçekleştirilen matematiksel çözümden elde
edilmiştir ve bu sayılar
1.Baş kuantum sayısı,
2.Açısal momentum kuantum sayısı,
3.Manyetik kuantum sayısı ve
4.Spin kuantum sayısı olarak adlandırılırlar.
İlk üçü, atom orbitallerinin ve bu orbitallerde yer alan
elektronların belirlenmesinde kullanılırlar. Dördüncü kuantum
sayısı ise elektronun davranışını açıklar.
1-Baş kuantum sayısı (n), belirli bir orbitaldeki elektronun
çekirdeğe olan ortalama uzaklığı ile ilişkilidir. Baş kuantum
sayısı ne kadar büyük olursa, orbitaldeki elektronun çekirdeğe
olan ortalama mesafesi ve buna göre de orbital o kadar büyük
olur.
2-Açısal Momentum Kuantum Sayısı ( l)
Açısal momentum kuantum sayısı (l ) orbitallerin
şekillerini açıklar. Bu kuantum sayısının (l ) olabileceği değerler,
baş kuantum sayısı n’nin değerlerine bağlıdır. Herhangi bir n
değeri için l’nin alabileceği değerler 0 ile n – 1 arasındaki tam
sayılardır.
Eğer n = 2 olursa, 0 ve 1 olmak üzere l’nin alabileceği iki
değer vardır. l’nin değerleri s, p, d, f …harfleri ile belirtilir.
Aynı n değerine sahip orbitaller topluluğu genellikle
kabuk olarak adlandırılır.
Aynı n ve l değerlerine sahip bir veya daha fazla
sayıdaki orbitaller ise altkabuk olarak adlandırılır.
3-Manyetik Kuantum Sayısı (ml )
Orbitalinin uzaydaki yönlenmesini gösterir. Bir alt kabuk
için ml’nin alabileceği değerler açısal momentum sayısı l‘nin
değerlerine bağlıdır. Verilen bir l değeri için, toplam 2l + 1 adet
farklı mldeğeri bulunabilir.
l = 0 olursa, 2.0+1=1 olmak üzere ml’ninbir değeri olur. ml= 0
l = 1 olursa, 2.1+1=3 olmak üzere ml’ninüç değeri olur. ml= -1, 0 ve 1
l = 2 olursa, 2.2+1=5 olmak üzere ml’ninbeş değeri olur.
ml=–2, –1,0, +1,+2
4-Elektron Spin Kuantum Sayısı (ms)
Elektromanyetik kuramına göre, dönen yüklü bir tanecik
manyetik bir alan yaratır ve bu hareket elektronun bir mıknatıs
gibi davranmasına neden olur.
Şekilde elektronun saat yönü ve
tersi yönde olmak üzere iki olası
dönmesi gösterilmiştir. Elektronun bu
spin hareketlerinin göz önüne
alınmasıyla, spin kuantum sayısı (ms)
olarak adlandırılan ve
-1/2 +1/2 değerleri alabilen, dördüncü
kuantum sayısı tanımlanmıştır.
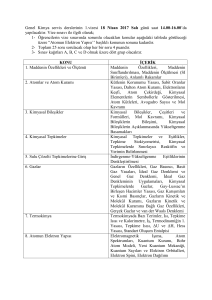
Kabuk
(n)
Alt Kabuk Notasyon
(l)
0 ile n-1
arası
Orbital
(ml) 2l-1
Orbital Elektron
Sayısı Sayısı
n2
2n2
1
0
1s
0
1
2
2
0
1
2s
2p
0
-1 0 +1
1
3
2
6
3
0
1
2
3s
3p
3d
0
-1 0 +1
-2 -1 0 +1 +2
1
3
5
2
6
10
4
0
1
2
3
4s
4p
4d
4f
0
-1 0 +1
-2 -1 0 +1 +2
-3 -2 -1 0 +1 +2 +3
1
3
5
7
2
6
10
14
Her orbitalin neye benzediğinin tam ifade edilmesi
zordur. Buna karşın, özellikle atomlar arasındaki kimyasal bağ
oluşumlarını açıklarken orbitallerin belirli özgün şekillere sahip
olduklarını varsaymak çok yararlıdır.
s orbitalleri küreseldir. Tüm s orbitalleri, farklı
büyüklüklerdeki küresel şekillere sahiptir ve kuantum
sayısı arttıkça orbitalin büyüklüğü de artmaktadır.
n = 2 vel= 1 durumunda, 2px, 2py ve 2pz
olmak üzere üç tane p orbitali ortaya çıkar. p orbitalinin alt
indisleri, orbitalinin yönlendikleri eksenleri göstermektedir.
Bu üç orbitalin enerjileri, büyüklükleri ve şekilleri
özdeş olmasına karışn, yönelişleri farklıdırlar. ml’nin p orbitalleri
için üç değeri olduğu ve bu üç p orbitalinin farklı yönlenmeye
sahip olduğu unutulmamalıdır.
ml değerleri ile x, y ve z yönlenmeleri arasında herhangi
bir bağıntı yoktur. Şekilde verilen p orbitallerinin sınır yüzey
diyagramlarından görüldüğü gibi, orbitaller çekirdeğin iki zıt
tarafından uzanan iki lop gibi düşünülebilir. Aynen s orbitallerinde
olduğu gibi p orbitalinin boyutları da 2p den 3p ye, 4p ye baş
kuantum sayısı ile artar.
Açısal momentum kuantum sayısı l= 2 olduğunda, beş
farklı ml değeri ve buna bağlı olarak beş d orbitali ortaya çıkar.
d orbitallerine ilişkin en küçük n değeri 3 tür. Zira l
değerinin n – 1 den büyük olmaması nedeniyle; n = 3 iken l= 2
olması durumunda, 3dxy, 3dyz, 3dxz, 3dx2–y2 ve 3dz2 olmak
üzere beş adet3d orbitali ortaya çıkar.
Tüm 3d orbitallerinin enerjileri özdeştir. Baş kuantum
sayısının 3 ten büyük olduğu (4d, 5d, …) diğer d orbitallerinde de
benzer durum söz konusudur.
Elektron dağılımı, elektronun spinini de gösteren
orbital diyagramı yardımıyla gösterilebilir.
Bir atomda herhangi iki elektron, aynı dört kuantum
sayısına sahip olmaz.
Aynı orbitali sadece iki elektron işgal edebilir ve bu
elektronlar da zıt yönlü spinlerde olması zorunludur.
Paramanyetik; maddeler belirli sayıda eşleşmemiş
elektrona sahipse mıknatıs tarafından çekilebilirler.
Bu tür elektron dağılımına sahip olan taneciklere paramanyetik
denir.
Lityum atomunda bir adet eşleşmemiş elektron
bulunur ve bu nedenle lityum metalinin atomu paramanyetiktir.
Diyamanyetik; Elektron spinleri eşleşmiş olmaları
durumunda manyetik etkileri birbirini yok eder. Buna göre,
eşleşmemiş elektronu bulunmayan ve mıknatıs tarafından
etkilenmeyen taneciklere diyamanyetik denir.
Berilyum atomunda eşleşmemiş elektron
bulunmadığından berilyum metalinin atomu diyamanyetiktir.
Bir alt kabuktaki elektronların en kararlı dağılımı, paralel
spinin en fazla olduğu haldir. Buna göre, eşit enerjili orbitallere
elektronlar aynı spinle dolarlar.
Çok elektronlu atomlarda 3d
enerji düzeyi 4s orbitalinin enerji
düzeyinden yüksektir. Bir atomun toplam enerjisi sadece orbital enerjilerinin
toplamına bağlı değil, aynı zamanda bu
orbitallerde yer alan elektronlar arası
itme kuvvetlerine de bağlıdır.
Buna göre, bir atomda 4s
orbitalinin 3d orbitalinden önce
doldurulması toplam enerjinin daha
düşük olmasına neden olacaktır.
Çok elektronlu atomlarda alt kabukların doldurulması 1s
orbitalinden başlayarak aşağıya doğru oklar yönünde hareket
edilir. Buna göre, sıralama
Temel haldeki elektron dizilişini yapmak için elektronlar
çekirdeğe en yakın olan, en düşük enerjili orbitalden başlanarak
sıra ile doldurulur. Buna Aufbau kuralı denir.
KÜRESEL SİMETRİ
Bir alt enerji seviyesindeki orbitallerin dolu ve yarı
dolu olması haline küresel simetri denir. Bu şekildeki elektron
dizilişine sahip olan atomlar küresel simetri yük dağılımına
sahiptir. Çekirdek, elektron bulutlarını her yöne eşit düzeyde ve
daha dengeli çeker. Bu tür atomlar diğerlerine göre daha düşük
enerjili olup daha kararlıdır.
Elektron Diziliminin Yazılması
Elektron dağılımları yazılırken , orbital türü sembolünün
önüne hangi enerji katmanında olduğu ( Baş kuantum sayısı ).
sağ üst kısmına üst indis olarak ise içerdiği elektron sayısı yazılır.
Örneğin
3. katmanda bulunan p orbitallerindeki 4 elektron,
ve 35Br elementleri atomlarının elektron
dizilimlerini yapınız.
8O, 12Mg, 27Co
ATOM MODELLERİ TOPLU GÖSTERİMİ