MÜHENDİSLİK MALZEMELERİ
Problem çözümü
• Fonksiyona uygun
• Yeterince emniyetli
• Ekonomik
Torna vida, su ısıtıcısı…vs
• Nobel Yayıncılık
N
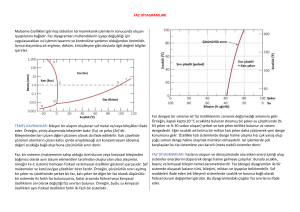
Mühendislik uygulamalarında saf malzemelerden
özellikle ısı ve elektrik iletiminin önemli ve bazı özel
uygulamalarda yararlanılır.
Bunun dışında, yüksek dayanımın arandığı örneğin bir
otomobilin aksında veya traktörün aktarma organları gibi
zorlanmanın önemli olduğu uygulamaların tamamında
alaşım malzemeler tercih edilir.
Örneğin saf bakırın dayanım değerleri yeterince yüksek
olmadığı gibi talaşlı imalatı da sorunludur. Bu haliyle
otomobil radyatör imalatı için düşünülebilir. Ancak
ağ.%40 Zn ilavesiyle elde edilen alaşımın (pirinç)
- Bakıra göre akma ve çekme dayanımı çok daha
yüksektir.
- Korozyon direnci yükselmiştir.
- Talaşlı imalat kabiliyeti önemli oranda iyileşmiştir.
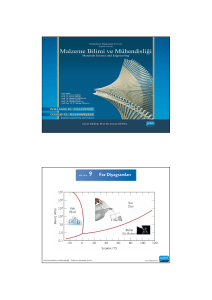
Saf suya ait faz diyagramı .
Değişkenler; dış basınç (düşey eksende ve logaritmik ölçekte) ve sıcaklıktır.
Bu üç farklı fazın (katı—buz, sıvı—su ve gaz—buhar) bölgelerini tanımlayan bir
haritadır. Kırmızı çizgiler, faz bölgelerini ayıran sınırları temsil etmektedir.
Her bir bölge içinde yer alan fotoğraflar o bölgelerdeki fazları ve küp şeklindeki
buz,bardağa konan su, çaydanlıktan çıkan buhar gibi bulunduğu durumları
göstermektedir.
Şekerin,
şeker-su karışımı
içindeki
çözünürlüğü
Birçok alaşım sisteminde belirli bir sıcaklıkta çözünen atomların, çözen kafes içinde
ulaşabileceği ve çözünebilirlik (çözünürlük) sınırı olarak isimlendirilen bir üst
konsantrasyon sınır değeri vardır. Su ve şeker olarak sadece iki bileşen bulunduğundan,
herhangi bir bileşim için bu bileşenlerin oranlarının toplamı % 100’dür.
Başlangıçta şekerin suya karıştırılmasıyla şeker-su karışımı meydana gelmektedir.
Daha fazla şeker ilave edildiğinde çözünürlük sınırına ulaşana veya su şeker açısından
doyana kadar çözelti daha da yoğunlaşmaktadır. Bu anda çözelti daha fazla şeker çözme
yeteneğini kaybeder ve şekerin fazlası çözeltinin dibine katı halde çökelir. Böylece sistem
sıvı durumdaki şeker-su karışımı ve çözünmemiş katı durumdaki şeker kristalleri olmak
üzere iki farklı maddeyi birden içermektedir.
Bileşen deyimi, çoğunlukla alaşımı oluşturan saf metaller ve/veya
bileşikler için kullanılır. Örneğin bir bakır-çinko alaşımı olan pirinçte
Cu ve Zn bileşenlerdir.
Yeralan ve arayer
empürite atomlarının iki
boyutta
şematik gösterimi
Bir katı çözelti en az iki farklı element atomlarından çözünenlerin çözen
atomların kristal kafesindeki arayer ve yeralan kafes noktalarına
yerleşmesiyle meydana gelmektedir.
FAZLAR
• Faz, bir sistemin homojen fiziksel ve kimyasal özellikler gösteren
parçası olarak tanımlanabilir.
• Her saf malzeme bir faz olarak düşünülebildiği gibi her katı, sıvı ve
gaz çözelti de faz olarak değerlendirilebilir. Örneğin üzerinde
durulan şeker-su karışım çözeltisi bir fazdır ve katı şeker de diğer bir
fazı oluşturur.
• Tek fazlı bir sistem homojen olarak nitelendirilmektedir. Birden fazla
faz içeren sistemler karışım veya heterojen sistemler olarak
tanımlanır. Çoğu metal alaşımları, seramik, polimer ve kompozit
sistemler heterojen özellik gösterir.
• Genellikle çok fazlı sistemler yapılarındaki fazlar birbirleriyle
etkileşerek fazların her birine ait özgün özelliklerinden daha farklı ve
daha cazip özellik kombinasyonları sunar.
Katı
Çözelti
2.Faz
(a) Sıvı durumda Cu-Ni sınırsız (tam)
çözünürlük.
(b) Cu-Ni katı durumda sınırsız
oranda birbirlerinde (tam)
çözünürler.
(c) Cu ve Zn alaşımları sınırlı
çözünmeden dolayı % 30 dan fazla
Zn çözemez, ikinci faz bölgeleri
oluşturur.
Mikroyapı
Bir malzemenin fiziksel özellikleri, özellikle
de mekanik özellikleri sahip olduğu iç yapıya
yani mikroyapıya bağlıdır.
Üstte tek fazlı
(homojen) , altta iki
fazlı alaşıma ait
mikroyapılar.
Bir alaşımın mikroyapısı sahip olduğu
1) alaşım elementlerine,
2) bunların kimyasal bileşimdeki oranlarına
3) gördüğü ısıl işleme (örneğin alaşımın
belirlenen sıcaklığa ısıtılması, bekletilmesi
ve bu sıcaklıktan farklı hızlarda oda
sıcaklığına soğutulması gibi) bağlıdır.
FAZLARDA DENGE HÂLİ
Denge hâli, serbest enerji adı verilen bir
termodinamik büyüklükle tanımlanır. Kısaca
serbest enerji bir sistemin iç enerjisi ile atom veya
moleküllerinin rastgeleliği veya düzensizliğinin
(entropi) bir fonksiyonudur. Bir sistemin serbest
enerjisi tanımlanan sıcaklık, basınç ve kimyasal
bileşim için en düşük durumda ise bu sistem
dengededir.
Faz dengesi bir sisteme ait faz özelliklerinin
zamanla değişmediğini ifade eder. Denge
durumunda şeker su karışımı ağırlıkça % 65 şeker –
% 35 su içerir ve bu kimyasal bileşim ile
bileşenlerin oranları zamanla değişmez.
Sistemin sıcaklığı aniden örneğin 100oC’ye
yükseltildiğinde, bu denge hali geçici olarak
bozulur ve şekerin çözünebilirlik sınırı ağırlıkça %
80’e yükselir.
Özellikle katı sistemlerde denge haline ulaşma
hızı çok yavaş olduğundan, tam denge haline
ulaşılmaz ve bu tür sistemler dengesiz veya yarıkararlı (meta stabil) halde bulunur.
Yarı-kararlı hal veya mikroyapı zamanla birlikte
ya değişmeyerek ya da fark edilmeyecek boyutta
çok az değişerek devamlılığını ve sürekliliğini
korur
BİR BİLEŞENLİ FAZ DİYAGRAMLARI
Belirli bir sistemin faz yapısının kontrol edilmesine ait bilginin birçoğu, faz diyagramları
veya denge diyagramları olarak da isimlendirilen grafikler yardımıyla elde edilir.
Faz diyagramlarını etkileyen üç dış parametre sıcaklık, basınç ve kimyasal bileşim olup, faz
diyagramları bunların çeşitli kombinasyonlarının birinin diğerine göre çizilmesiyle belirlenir.
Her bir faz ilgili alanının sınırladığı sıcaklık-basınç aralığında kalmak üzere denge halindedir.
Grafikte yer alan ve aO, bO ve cO olarak işaretlenen üç eğri aynı zamanda faz sınırlarını
belirtmekte ve bu eğriler üzerindeki herhangi bir nokta eğrinin her iki tarafında bulunan
fazların birbiriyle denge halinde bulunduğunu göstermektedir. NOT: O noktası üçlü nokta
değişmez nokta olarak adlandırılır.
• Bir elemente diğer bir element karıştırılacak olursa,
her zaman toplam iç enerji mimimum olacak
şekilde yeni atom düzenleri meydana gelir.
•
Hem sıvı hem de katı hallerde tam çözünürlük gösteren sistemler izomorfik olarak
nitelendirilir. Örn: Cu-Ni, bunun nedeni, her ikisinin de YMK kristal yapıda , atom
yarıçaplarının ve elektronegativitelerinin birbirine yakın ve benzer valans özelliğe
sahip olmalarındandır.
Cu-Ni faz diyagramı
Alaşımda Hume-rothery kuralı gerçekleşmişse tam ve sınırsız bir çözünme (karışma)
sağlanabilir.
Atom çapları arasında fark %15 küçük olmalı , kafes türü aynı, elektronegativite
özell. yakın, bağıl valans faktörü uygun olmalıdır
İZOMORFİK ALAŞIMLARDA MİKROYAPININ OLUŞMASI
Dengeli Soğuma Hali
Dengesiz Soğuma Hali
9.10 İZOMORFİK ALAŞIMLARIN MEKANİK ÖZELLİKLERİ
9.11 İKİLİ ÖTEKTİK SİSTEMLER
E noktasında : ÖTEKTİK REAKSİYON
Ağırlıkça:
9.12 ÖTEKTİK ALAŞIMLARDA MİKROYAPI OLUŞUMU
9.13 ARA FAZLAR VEYA BİLEŞİKLER İÇEREN DENGE DİYAGRAMLARI
9.14 ÖTEKTOİD VE PERİTEKTİK REAKSİYONLAR







![yenilik ve kalite [Uyumluluk Modu]](http://s1.studylibtr.com/store/data/003168596_1-ac5f525757334e1d54ccb79832a0ccb9-300x300.png)