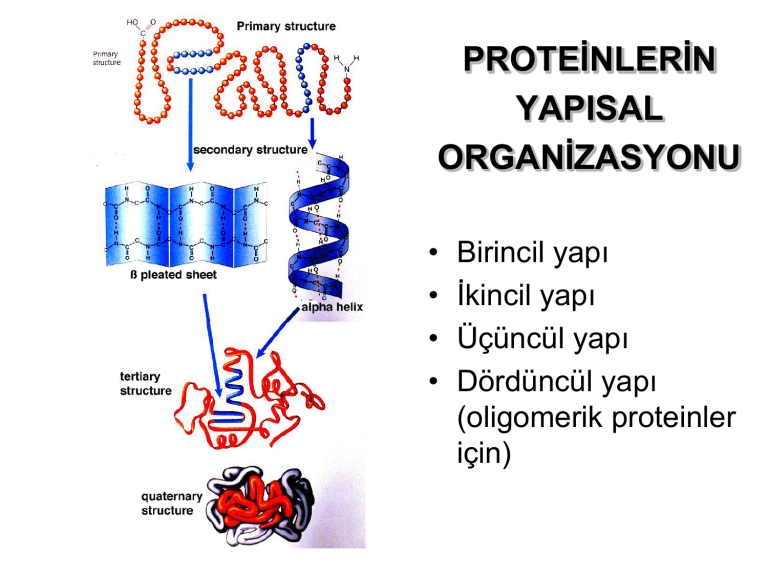
PROTEĠNLERĠN
YAPISAL
ORGANĠZASYONU
•
•
•
•
Birincil yapı
Ġkincil yapı
Üçüncül yapı
Dördüncül yapı
(oligomerik proteinler
için)
HER AġAMA BELLĠ
KURALLAR
ÇERÇEVESĠNDE
MEYDANA GELĠR.
Proteinler belli bir amino asit
dizisine sahip polipeptitlerdir. Bu
dizilime PRĠMER (BĠRĠNCĠL) YAPI
denir.
Ġnsan ve balinanın
miyoglobin
moleküllerindeki
amino asit
dizilerinin
karĢılaĢtırılması
• Bu örnekte verilen miyoglobin 153 amino
asitten oluĢur. Birkaç yüz hatta birkaç bin
amino asit içeren proteinler de vardır.
• Bu iki miyoglobinin amino asit dizileri
benzer olmakla beraber özdeĢ
değildir.Ortak amino asitler, her ikisinin de
aynı biyokimyasal amaca hizmet etmeleri
için yeterlidir. Bu yüzden ikisine de
miyoglobin diyoruz.
PROTEĠNLER TÜRE
ÖZGÜDÜRLER!
Mutant miyoglobin geni taĢıyan bir
balina olmadığı sürece, tüm
balinaların miyoglobini aynı amino
asit dizilimine sahiptir.
Farklı türlerin homolog proteinleri benzerdir, fakat
identik (aynı) değildir!
BaĢka bir örnek:
Sitokrom c. 100 amino asitten oluĢan, biyolojik
oksidasyonda elektronları taĢıyan bir protein. 100
amino asitin 35’i tüm türlerde aynı!!! Geri kalan
amino asitler türden türe değiĢir.
• Bunlardan bazılarına koruyucu (konservatif)
değiĢimler diyoruz. Bunlarda yan zincirin
karakteri değiĢmez. Örneğin, Asp yerine Glu
geçer.
• Bazıları ise koruyucu olmayan (non-konservatif)
tiptedir. Bunlarda daha köklü bir değiĢim vardır.
Örneğin, Asp yerine Ala geçer.
SEKONDER (ĠKĠNCĠL) YAPI
Polipeptidin belli bir Ģekle kıvrılmıĢ hali
• Ana zincirdeki
karbonil grupları
ile imit grupları
arasında meydana
gelen H bağları
tarafından kurulur.
Random walk: GeliĢigüzel sarmal
Üstten
görünüĢ
-sarmal yapı
• Polipeptit omurgasında yer alan bir amino asidin
CO (H alıcısı) grubu, kendisinden sonra gelen 4.
amino asidin NH (H vericisi) grubuna hidrojen bağı
ile bağlanır. Böylece aralarında 3-4 amino asit
bulunan amino asitler uzayda birbirine çok yaklaĢır.
• Prolin, valin, izolösin, yüklü amino asitler ve triptofan
bu yapıyı bozar.
• Dolayısıyla -sarmal yapısı polipeptidin tamamında
oluĢmaz.
Sarmal yapının
farklı tipleri
-kıvrımlı yaprak yapısı
(-tabakası)
• Ana zincirdeki CO grupları ile
NH grupları arasında meydana
gelen H bağları, molekülün
akordeona benzer Ģekilde
kıvrılmasına yol açar.
• Bu yapı aynı peptidin farklı
bölgelerini biraraya getirir.
• Zincirler birbirine paralel (N- ve
C-uçları aynı tarafa bakacak
Ģekilde) veya antiparalel (N- ve
C-uçları zıt yönlere bakacak
Ģekilde) konumda bağlanabilir.
-sarmal
-tabaka
Alfa sarmal
Beta tabaka
Sekonder yapısını kazanmıĢ protein daha
da kıvrılıp katlanırsa
TERSĠYER (ÜÇÜNCÜL) YAPISINI
kazanır.
TERSĠYER (ÜÇÜNCÜL YAPI)
Polipeptidin daha da kıvrılıp katlanmıĢ
hali
Amino asit yan zincirleri
arasındaki
•H bağları
•Ġyonik bağlar
•Hidrofobik etkileĢimler
•Disülfit bağları
•van der Waals etkileĢimleri
tarafından kurulur.
Birden fazla polipeptit zincirinden oluĢan
proteinlerde daha da ileri bir yapısal oluĢum
vardır: KUATERNER (DÖRDÜNCÜL) YAPI
Bazı proteinler kovalent veya kovalent
olmayan bağlarla bir arada tutulan
1’den fazla sayıda polipeptit zinciri
içerirler. Örneğin hemoglobin (kovalent
olmayan bağlarla bir arada tutulan 4
polipeptit zinciri içerir):
KUATERNER (DÖRDÜNCÜL) YAPI
Birden fazla polipeptit zinciri içeren
(oligomerik) proteinlerde zincirler arası
etkileĢim
Alt birimlerin R yan
zincirleri arasındaki
•H bağları
•Ġyonik bağlar
•Hidrofobik
etkileĢimler
•Disülfit bağları
•van der Waals
etkileĢimleri
tarafından kurulur.
Ribozomdan ayrılan her protein
BĠTMĠġ sayılmaz !!!
POSTTRANSLASYONEL
MODĠFĠKASYONLAR
• Doğru üç boyutlu yapısına katlanmalı ya
da disülfit bağları oluĢturmalıdır.
• Amino asitlere bazı küçük grupların
bağlandığını daha önce görmüĢtük.
• Bazı proteinler ise spesifik proteazlarca
kesilip kısaltılarak aktif Ģeklini kazanır. Ör.
insülin
Pankreasta tek bir polipeptit zinciri
(preproinsülin) sentezlenir (110 a.a.).
ER’ye geçtikten sonra 24 a.a. Lik
sinyal peptit otokatalitik olarak
(molekülün bir ucunun proteolitik
etkisiyle) kesilir, uygun katlanmalar ve
disülfit bağlarının oluĢumu ile
proinsüline çevrilir.
Golgi’de baĢka enzimlerin etkisiyle
önce 33 a.a.lik, sonra 2 a.a.lik
kısımları kesilip atılır.
A ve B zincirlerinden oluĢan aktif form
meydana gelmiĢ olur.
Ġnsülin hormonunun tersiyer yapısı
[kovalent bağlarla (disülfit bağları) bir
arada tutulan 2 polipeptit zinciri içerir] :
Ġnsülin 2 veya 6 monomerin biraraya gelmesiyle
dimer veya heksamer oluĢturabilir (Kuaterner yapı).
Ancak aktif formu MONOMER dir. (iki zincir tek bir
zincirden geldiği için monomer kabul edilir)
1901-1994
1950’lerde X-ıĢınları kırınımı yöntemiyle çalıĢan
Linus Pauling ve ark. nın önerilerine göre:
• Polipeptit omurgasında yer
alan bağ açıları (, phi ve ,
psi) ve uzunlukları hemen
hemen sabittir.
• Ġki atom van der Waals
yarıçaplarından daha kısa bir
mesafede birbirine
yaklaĢamaz.
• Amit grubu düzlemsel ve
trans konumundadır.
• Dolayısıyla sadece -C
atomuna bitiĢik bağların
çevresinde rotasyona izin
verilir.
• Kovalent olmayan bağlar
(baskın olarak H bağları)
kurallı bir Ģekilde katlanmayı
sağlarlar.
Buna göre önerdikleri sekonder yapılar:
-sarmal
-tabaka
(- kıvrımlı yaprak)
Bugün de bu yapıları proteinlerde yaygın
olarak bulunduğu bilinmektedir.
Sarmal tiplerini sayısal
adlandırma kuralı:
nN
n= her bir dönümdeki kalıntı sayısı
N= H bağlı ilmekte yer alan atom sayısı
-sarmal (3.613 sarmal)
310 sarmal
-sarmal (4.416 sarmal)
gibi yapılar oluĢabilir.
Sterik olarak
oluĢması mümkün.
Ancak bugüne kadar
proteinlerde
bulunduğu
belirlenmemiĢ!
Proteinlerde varlığı
belirlenmiĢ !
310-sarmal
-sarmal
(4.416)-sarmal
Moleküller için önerilen bazı ideal
sarmal yapılar
n= her bir dönümde yer alan amino asit sayısı
p= diĢ açıklığı (vida gibi)
n azaldıkça sarmal yapı açılır. Giderek Ģerit Ģeklini alır.
n pozitif ise sarmal SAĞA DÖNÜMLÜ,
n negatif ise sarmal SOLA DÖNÜMLÜ’dür.
Bu yapıları hepsi proteinlerde bulunmaz!
Bir proteindeki her bir kalıntının konformasyonu
Ramachandran krokisi denilen bir haritadaki
tek bir noktaya karĢılık gelir.
Her bir amino
asit kalıntısı için,
(phi) ve
(psi) bağ
açılarından
yararlanılarak
çizilen bu harita
proteinlerin
sekonder yapısı
hakkında bilgi
edinmemizi
sağlar.
Beyaz alanlar (yan zincirin büyüklüğüne
göre) izin verilen konformasyonları gösterir.
Buradaki kalıntıların hepsi L-alanin’dir.
Proteinlerin yapısında yer alan
amino asitler L-formunda olduğu için
SAĞA DÖNÜMLÜ SARMAL
tercih edilir.
Çünkü ancak böyle bir yapıda yan zincirler
ile omurga arasındaki sterik engelleme en
az düzeydedir.
Polipeptitlerin sekonder yapıları için
geçerli bazı parametreler
Sekonder ve tersiyer yapıları
etkileyen faktörler:
•Proteinlerin üç boyutlu yapısını
büyük oranda primer yapı (amino
asit dizisi) belirler. Bunu ispatlayan
en önemli bulgu Ģudur:
Ortam Ģartlarını değiĢtirerek (ör.,
sıcaklığı artırarak, pH’ı aĢırı asidik
veya bazik yaparak, alkol üre gibi
belli organik maddeleri katarak,
doğal (“native”) proteini denatüre
ettikten sonra (DENATÜRASYON)
proteinin doğal Ģekli ortadan
kaybolur ve protein geliĢigüzel bir
zincir halini alır.
Ribonükleazın
termal
denatürasyonu
Isıtılınca denatüre olan
ribonükleazda disülfit bağlarının
korunduğu görülür.
Denatürasyon sonucunda
viskozitesi (), 365 nm.deki
optik çevirmesi () ve 287
nm’deki absorbansı () değiĢir.
Soğutulduktan sonraki
absorbans değerleri ()
baĢlangıçtaki değerlerle aynı
olduğundan denatürasyonun
geri dönüĢümlü olduğu anlaĢılır.
Buna göre:
• Protein kendisi için elveriĢli katlanma
biçimini önceden “bilmektedir”. Yani
katlanma sentezi takiben kendiliğinden
baĢlar.
• Ancak in vivo koĢullarda bazen proteinin
“yardıma” ihtiyacı olabilir. Kendisini yanlıĢ
katlanmadan ya da baĢka moleküllerle
birlik oluĢturmaktan koruyacak moleküllere
gereksinim duyabilir.
ĠĢte bu yardımcı moleküllere
ġAPERONĠNLER
(MOLEKÜLER ġAPERONLAR)
denir.
Bu moleküllerin iĢi proteinleri
kötülüklerden korumak!
[chaperon: bir genç kıza veya gençler grubuna himaye gayesiyle
refakat eden (hamisi gibi) kimse]
Bu moleküllere Polipeptit Zincir
Bağlayıcı (PCB) Proteinler de
denir.
KÖTÜLÜK: YanlıĢ katlanma ve
agregasyon (birlik oluĢturma)
• Agregasyon daha büyük bir tehlike! Çünkü
ribozomlarda yeni sentezlenen bir protein
katlanmadan önce hidrofobik bölgelerinin
baĢka proteinlerle etkileĢime girmesi
sonucunda kolaylıkla birlik oluĢturabilir.












