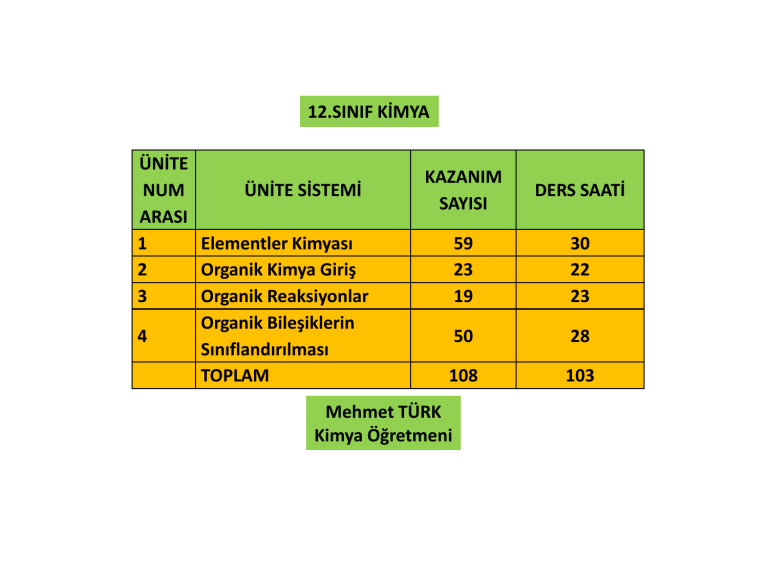
12.SINIF KİMYA
ÜNİTE
NUM
ÜNİTE SİSTEMİ
ARASI
1
Elementler Kimyası
2
Organik Kimya Giriş
3
Organik Reaksiyonlar
Organik Bileşiklerin
4
Sınıflandırılması
TOPLAM
KAZANIM
SAYISI
DERS SAATİ
59
23
19
30
22
23
50
28
108
103
nnn
Mehmet TÜRK
Kimya Öğretmeni
1. Ünite : ELEMENTLER KİMYASI
I. Ünitede Önerilen Konu Baslıkları
1. Evrende ve Dünyada Elementler
2. Elementler Nasıl Elde Edilir?
3. Alaşımlar
4. Hidrojen
5. Alkaliler ve Toprak Alkaliler
6. Toprak Grubu Elementleri
7. 4A Grubu Elementleri
8. 5A Grubu Elementleri
9. Kalkojenler
10. Halojenler
11. Geçis Elementleri
I.BÖLÜM// Elementler Kimyası// Tavsiye edilen süre süre: 30 ders Saati
KONU BAŞLIKLARI
KAZANIMLAR
1.1. Büyük patlama ve
1.1. Hafif elementlerin oluşumunu, evrenin başlangıcı
evrende hafif elementlerin
sayılan “büyük patlama” teorisi ile açıklar.
oluşumunu,
1.2. Evrendeki elementlerin bolluk oranlarını, büyük
1.2. Büyük Patlama sonrası
patlama teorisi ve yıldızlarda ağır element oluşumu ile
daha ağır elementlerin
ilişkilendirir.
oluşumu
1.3. Yer kabuğundaki 1.3. Yer kabuğundaki element bolluk oranları ile
dünyanın kozmik geçmişi arasında ilişki kurar.
element bolluk oranları,
1.4. Yer kabuğunda yüksek oranda bulunan bileşiklerin
1.4. Yer kabuğunda yüksek
oluşumunu elementlerin bolluk
oranları ile
oranda bulunan bileşiklerin
ilişkilendirir.
oluşumu,
1.1. Büyük Patlama ve Hafif elementlerin oluşumu;
1922 yılında Rus bilgin Alexander Friedmann (Aleksandır
Freydmın), evrenin genişliyor olabileceğini fark etti.
Friedmann’dan bağımsız olarak çalışan Belçikalı kozmoloji
uzmanı Georges Lemaitre (Corc Lömatr) de 1927’de
evrenin genişlediğini iler, sürdü.
Ünlü astronom Edwin Hubble 1929 yılında yaptığı
gözlemler sonucunda evrenin devamlı genişlemekte
olduğunu ispatladı,
Hubble'ın bu buluşu teorinin büyük bir bilim kesimi tarafından kabul görmesini
sağladı, teoriyi kabullenmek istemeyen ve genişleyen evren modeline uygun değişik
teoriler oluşturmaya çalışan bir kaç bilim adamı ise ancak1989 yılındaki "Big Bang"
teorisinin kesin zaferine kadar dayanabildiler.
Teorik hesaplamalara göre büyük patlamadan arda kalması gereken radyasyonu
araştırmak üzere NASA tarafından 1989 yılında fırlatılan CUBE uydusu bu radyasyonu
fırlatılışından sekiz dakika sonra belirleyerek "Big Bang" teorisini kesin olarak
kanıtladı. Bu kanıttan sonra artarda gelen diğer kanıtlar teoriyi desteklemeğe devam
etti.
1.1. Büyük Patlama ve Hafif elementlerin oluşumu;
Bilim insanlarının evrenin oluşumu ile ilgili öne sürdükleri teoriye Büyük
Patlama Teorisi (Big Bang Theory) adı verilmiştir.
Big-Bang Theorisine işaret eden bulgular:
1. Gök adaların birbirinden sürekli
uzaklaşması,
2. Merkezden daha uzak gök adaların
uzaklaşma hızlarının daha yüksek olması,
3. Uzayın görünürde boş bölgelerinden
mikrodalga ışınlarının yayılıyor olması,
4. Uzayın her doğrultusunda birim hacim
içine düşen kütle yoğunluğunun yaklaşık aynı
kalması
1.1. Büyük Patlama Sonrası Gelişen Olaylar;
•Büyük Patlama Sonrası Gelişen Olaylar;
• Patlamadan 10-43. saniyeye kadar geçen süre Planck
Zamanı olarak adlandırılıyor.
• 10-43. saniyeden 10-32. saniyeye kadar evren aşırı
derecede genişledi.
Bu dönemde evren bir atom
boyutundan bir portakal boyutuna ulaştı. Ortamda temel
parçacıklar (kuarklar, leptonlar, gluonlar...) vardı.
• 10-32. saniyeden 10-6. saniyeye kadar geçen süre ön büyüme evresidir.
Genişleme nedeniyle sıcaklık 1027 0C’a kadar düşmüştü. Ancak evren hâlâ çok
sıcaktı ve elektron, kuark ve diğer parçalardan oluşmuş kaynayan bir çorbaya
benzemekteydi.
• 10-6. saniyede hızlı bir soğuma evresi başladı ve sıcaklık 1013 0C’a kadar düştü.
Böylece kuarklar proton ve nötronları oluşturabildi.
1.1. Büyük Patlama ve Hafif elementlerin oluşumu
10-2 sn ila 3.dk arasında nükleer tepkime
sonucunda ilk hidrojen çekirdeği ortaya
çıktı.
Bu çekirdekler, daha sonra döteryum
çekirdeklerini oluşturdu. Ama oluşan
çekirdekler, kararsız olduğu için, izleyen
çarpışmalar sonucunda
hemen parçalandı.
3.dk dan sonra sıcaklık düşmeye devam
eder ve %75 proton ve %25 nötrondan
ibaret olan evrende, döteryum çekirdeği
oluşur. Döteryum çekirdeği, tepkimelerde
olduğu gibi yeni element çekirdeklerini
oluşturur.
Tüm nötronlar tükendikten sonra, verilen
süreçler durmuş ve evren yaklaşık %25 He
(helyum çekirdeği) içerir duruma gelmiştir.
1
0
n 11 H+ 1-1e+Ve (nötrino)
1
1
H+10 n 12 H+Enerji (2,2MeV)
2
1
H+10 n 13 H
ya da 12 H+11H 32 He
3
2
He+10 n 42 He+
Büyük Patlama ve Hafif elementlerin oluşumu
300.000 yıl ila 1 milyar yılları arasındaki sürece Atom Çağı diyoruz. Büyük
Patlama’dan 300000 yıl sonra sıcaklık 10000 0C’a düştü. Elektronlar, proton ve
nötronlarla bir araya gelerek atomları oluşturdu.
2
1
H+ 42 H 63 Li ve ya
2
1
H+ n H daha sonra
4
2
He+ 23 He 74 Be ya da
4
2
He+ 42 He 48 Be
1
0
3
1
Bu aşamada evren çok hızlı soğuduğu için Beliryumdan
daha ağır çekirdekler oluşamadı. Bu çekirdeklerin
oluşabilmesi için gereken basınç ve sıcaklığı sağlayacak
ortama ihtiyaç vardı.
1.2. Büyük Patlama sonrası daha ağır elementlerin oluşumu,
Büyük Patlama’dan 1 milyar yıl sonra evrenin sıcaklığı oldukça (-200 0 C) düştü.
Hidrojen ve helyum gazları arasındaki kütle çekimi sayesinde dev bulutlar oluştu.
Dev bulutlar, gök adaları; daha küçük gaz yığınları ise kütlesi, Güneş’in kütlesinden
10 ila yüzlerce kat büyüklükteki ilk yıldızları oluşturdu. İlk yıldızlardaki hidrojen
atomu çekirdekleri, nükleer füzyon tepkimeleri (yüksek basınç ve sıcaklığın etkisi)
sayesinde birbirleriyle kaynaşarak helyuma dönüştü.
İlk yıldızların helyumdan daha ağır elementleri oluşturamadan çok şiddetli
patlamalarla dağıldığı sanılmaktadır. Bu patlamalarda ortaya çıkan sıcaklık ve
basıncın çok yüksek olması hidrojen ve helyumdan daha ağır çekirdeklerin ortaya
çıkmasını sağladı. Fakat bu şekilde oluşan ağır çekirdeklerin miktarı çok azdı. Bu
ağır çekirdekler, ikinci nesil yıldızların kimyasal bileşiminde rol oynadılarsa da
evrendeki elementlerin bolluk oranları çok fazla etkilenmedi. Daha sonra yeni
yıldızlar ve gezegenler oluştu. İkinci nesil yıldızların sayısı ilk yıldızların sayılarına
göre daha fazlaydı. İkinci nesil yıldızlarda az da olsa ağır elementlerin bulunması,
merkezlerindeki sıcaklığın 100000000 0C’in üzerine çıkmasını sağladı. Bu sıcaklık bir
dizi nükleer füzyon tepkimesi için gerekli şartı sağlamış oldu.
Büyük Patlama ve Hafif elementlerin oluşumu
Yıldızın yaşı ilerledikçe merkezindeki basınç ve
sıcaklık yükselir. Sıcaklık 100 milyon Kelvin’e
ulaştığında merkezdeki helyum çekirdekleri
kaynaşmaya ve (üç helyum çekirdeğinin kaynaşması
ile) karbon çekirdekleri oluşturmaya başlar. İç
katmanda üretilen karbon çekirdekleri, daha ağır
olduklarından daha iç katmana doğru ilerler.
Sıcaklık arttıkça karbonlar, helyumlarla nükleer
füzyon tepkimesiyle oksijen üretmeye başlar.
12
6
C+ 42 He 16
8 O+
•Büyük Patlama Sonrası Gelişen Olaylar;
Büyük patlama sonunda açığa çıkan taneciklerin incelenmesi çok zor ve karmaşıktır.
Ancak yapılan çalışmalar sonunda aşağıdaki olayların gerçekleştiği tahmin edilmektedir.
1.2. Büyük Patlama sonrası daha ağır elementlerin oluşumu,
Protoyıldız ve galaksilerde kütle-enerji dengesi, kütle
lehine dönüştüğünden, ışımanın artık genleşme ve
soğumayı başlatması beklenemez. Ancak, kütlesel
büzülme, sıcaklığın 108 K üzerine çıkmasına neden
olmuştur. Bu esnada, madde yoğunluğu yaklaşık 105
g/cm3 tür. Bu koşullarda artan çekirdek çarpışmaları,
birbiriyle etkileşen kararsız çekirdekleri oluşturmaya
başladı. Yıldızlarda bir miktar helyum kalıncaya kadar
helyum çekirdeğinin tam katları olan çekirdekler
oluştu.
Helyum çekirdeğinin tam katları olan çekirdeklere
dönüşmesi sürecine "helyum yanması" denir. oksijen
çekirdeğinin oluşumunu, şekil deki karbon-azot
çekirdek dönüşümünü başlattı.
Hala yüksek olan sıcaklıkta, karbon ve oksijen yanması
gibi prosesleri ile helyumun katları olmayan
çekirdekler de oluştu,
12
6
C+ 42 He 16
8 O+
12
6
C+126 C 1224 Mg+Enerji
12
6
C+126 C 1123 Na+11H
12
6
C+126 C 1020 Ne+ 24 He
Karbon yanması
16
8
O+168 O 1632 S+Enerji
16
8
O+168 O 1531 P+11H
16
8
O+168 O 1632 S+10 n
Oksijen yanması
1.2. Büyük Patlama sonrası daha ağır elementlerin oluşumu,
Enerji salan tüm bu yanma prosesleri, 40Ca
çekirdeğinden
daha
hafif
çekirdekleri
oluşturmaktadır.
Atom numarası 20 den büyük ve helyumun katları
olan bir çekirdek, ya elektron yakalayarak ya da
pozitron yayarak yeni bir çekirdek oluşumu ile kararlı
hale gelmiş olabilir:
52
26
0 +
Fe 52
25 Mn + +1e (Pozitron yayımlama)
44
22
44
Ti+0-1e 21
Sc (elektron yakalama)
Periyodik tabloda demirden sonra gelen çekirdekler, nükleer füsyon tepkimeleri ile
enerji açığa çıkarmazlar.
68
1
69
69
0
30 Zn+0 n 30 Zn 31 Ga+ -1e
69
31
70
70
Ga+10 n 31
Ga 32
Ge+-10 e
Bu proses, yıldızlarda çok hızlı gerçekleşen, enerji açığa çıkaran ve hafif çekirdekleri
oluşturan nükleer tepkimeler başlatabilir ve bunun sonucunda daha ağır çekirdekler
oluşa bilir.
1.2. Büyük Patlama sonrası daha ağır elementlerin oluşumu,
Atom numarası 26’ya (Fe elementine) kadar olan elementler yıldızların içinde
oluşur. Bu elementler, yıldızlarda gerçekleşen nükleer füzyon ürünleridir.
Bu kararlılık nükleon başına
bağlanma enerjisi (çekirdek
bağlanma
enerjisi)
ile
ilgilidir.
Bağlanma enerjisi ne kadar
büyükse çekirdek o kadar
kararlıdır. Nükleon başına
düşen bağlanma enerjisi
Fe
elementinde
en
yüksektir.
1.2. Büyük Patlama sonrası daha ağır elementlerin oluşumu,
98
42
C+10 n 99
42 Mo+
Evrendeki atomların büyük bir kısmı
(hidrojen) Büyük Patlama’nın kısa bir süre
sonrasında oluştu ardından füzyon sonucu He
çekirdeği oluştu. Yıldızlarda (karbon, oksijen,
demir) oluşmasıyla daha ağır çekirdekler
oluştu.
Evrende bulunan daha ağır elementlerin
(iyot, molibden vb.) oluşabilmesi için
yıldızlardaki koşullardan daha fazlası gerekir.
Bu koşullar çok büyük kütleli yıldızlar
patladıklarında (süpernova patlaması) ortaya
çıkar.
Süpernova Patlamalarında çekirdek, yoğun
bir nötron bombardımanına uğrar. Bunun
sonucunda çekirdek yakaladığı nötronlarla
daha ağır bir izotopa dönüşür.
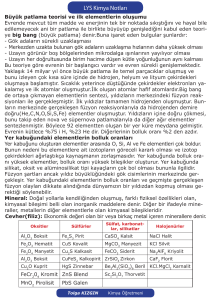
1.3. Evrendeki ve Dünya’daki bazı elementlerin bolluk yüzdesi
Element
Hidrojen
Helyum
Karbon
Azot
Oksijen
Sodyum
Magnezyum
Alüminyum
Silisyum
Fosfor
Kükürt
Klor
Potasyum
Kalsiyum
Demir
Atom Evrendeki Dünya'daki
1
91
0,14
2
9
*
6
0,02
0,03
7
0,04
*
8
0,06
47
11
*
2,8
12
*
2,1
13
*
8,1
14
*
27,7
15
*
0,07
16
0,03
17
*
0,01
19
*
2,6
20
*
3,6
26
*
5,0
* Eser miktarı ifade etmektedir.
Elementler nükleer füzyon tepkimeleri
ile oluşmuştur. Füzyontepkimelerinin
gerçekleşebilmesi için yüksek sıcaklık ve
basınca ihtiyaç vardır. Bu şartlar yıldız
büyüklüğünde
gök
cisimlerinin
merkezlerinde gerçekleşir.
Dünya’daki
elementler
ve
bu
elementlerin bolluk oranları dikkate
alınarak geliştirilen teorilere göre Güneş
sistemimiz,
dolayısıyla
Dünya’mız
ömrünü
tamamlamış
bir
yıldızın
kalıntılarından oluşmuştur.
Dünya’daki oksijen, silisyum, alüminyum
ve demir elementlerinin bolluk yüzdesi;
evrendeki oksijen, silisyum, alüminyum
ve
demir
elementlerinin
bolluk
yüzdesinden daha fazladır. Bunun nedeni
kararlılık kuşağıyla açıklanabilir.
1.3. Evrendeki ve Dünya’daki bazı elementlerin bolluk yüzdesi
ELEMENT
BOLLUK
(kütlece
%)
Oksijen
47
Silisyum
27
Alüminyum
8,1
Demir
5,0
Kalsiyum
3,6
Sodyum
2,8
Hidrojen
0,14
Klor
0,01
Fosfor
0,07
Tablodan da anlaşıldığı gibi, yerkabuğunun ağırlıkça % 99'unu 7-8
elementin oluşturur. Bu temel 7-8 element, çeşitli kombinasyonlar
halinde bir araya gelerek mineralleri, mineraller de kayaları
oluşturmaktadır. Dolayısıyla, kaya ve mineralleri tanıyıp anlayabilmek için
daha fazla elementi tanıma zorunluluğu yoktur. Kayaların hacimce %
90'nını oksijen oluşturur. Tabloda bazı elemenler genellikle mineralleri
halinde bulunduğu görülmektedir.
Bizmuttan (Z=83) sonra çoğu izotoplar kararsız olduğundan çekirdekleri,
bölünme eğilimindedir. Bu nedenledir ki, yıldızlarda atom numarası 30-60
arasında olan elementler daha çok Bulunmaktadır.
Bazı elementler yer kabuğunda bulunmazlar. Eser miktarda neptünyum
(Z=93) ve plütonyum (Z=94) uranyum mineralleri içinde bulunursa da,
atom numaraları 92 den daha büyük elementler doğada bulunmazlar.
Ementlerin pek çoğu doğada serbest halde, yani bileşik yapmamış halde
bulunmaz. Yalnızca %20 si serbest halde (element halinde) bulunur, geri
kalanlar başka elementlerle birleşmiştir.
1.3. Yer kabuğundaki element bolluk oranları, başlıca mineralleri
ELEMENT
BOLLUK
BAŞLICA MİNERALLER
(kütlece %)
Oksijen
47
Silisyum
27
Alüminyum
8,1
Demir
5,0
Kalsiyum
3,6
Sodyum
2,8
Hidrojen
0,14
Klor
0,01
Sodyum tuzu (kaya tuzu, deniz suyu) ,
Fosfor
0,07
Fosfat kayası; organik maddeler ,
Su; silika; silikatlar; metal oksitleri; atmosfer,
Silika (kum kuvartz, akik, çakmaktaşı); silikatlar ; kil; fel-dispat) ,
Alüminyum silikatlar,
Oksit (hematit, magnetit ,
Karbonat (kireç taşı, mermer, tebeşir); sülfat (jips); florür (florit); silikatlar (feldispat, zeolitler) ,
Klorür (kaya tuzu, deniz suyu); silikatlar (feldispat, zeolitler) potasyum magnezyum ,
Oksit (su); doğal gaz ve petrol; organik maddeler ,
Eğer bütün evreni göz önüne alırsak, atomların % 90'ı, kütlenin % 75 i hidrojen , geriye kalanın
büyük çoğunluğu helyumdur.
Eğer yalnızca dünyayı göz önüne alırsak, en bol elementin silisyum ve demir olduğunu
söyleyebiliriz. Ancak, çoğu demirin dünyanın çekirdeğinde olduğuna inanılmaktadır. Kolay
ulaşılabilen ve yararlanılabilen elementler havada, denizde ve katı yer kabuğunda bulunanlardır.
EVRENİN OLUŞUMU
ZAMAN
0 ila 10-43 sn
Planck Çağı
SICAKLIK
Çok yüksek
10-43 sn ila 10-32 sn
Gut Çağı
Çok yüksek
10-32 sn ila 10-6 sn
ön büyüme evresi
10-6 sn -10-2 sn
Parçacık Çağı
1027 0C
civarında
1013 0C
civarında
10-2 sn -3.dk
Nükleosentez Çağı
3 dk-300 .000 yıl
Çekirdek Çağı
Sıcaklık
düşüyor
Sıcaklık
düşüyor
300 .000 yıl ila 1 milyar
yıl
10000 0C
Atom Çağı
1 milyar yıl-Günümüze
kadar
Galaksiler Çağı
-200 0 C
OLAY
Bu çağ bilinmiyor. Evren ağacının çekirdeğinin toprağa atıldığı zaman olabilir.
Evren aşırı derecede genişledi. Bu dönemde evren bir atom boyutundan bir portakal
boyutuna ulaştı. Ortamda temel parçacıklar (kuarklar, leptonlar, gluonlar...) oluştuğu
devredir.
Genişleme nedeniyle sıcaklık düşmüştü. Ancak evren hâlâ çok sıcaktı ve elektron, kuark ve
diğer parçalardan oluşmuş kaynayan bir çorbaya benzemekteydi.
Hızlı bir soğuma evresi başladı ve sıcaklık düştü. Böylece kuarklar proton ve nötronları
oluşturabildi. Bu sebeple bu çağa parçacık çağı denir.
10-2 sn ila 3.dk arasında nükleer tepkime sonucunda ilk hidrojen çekirdeği ortaya çıktı. Bu
çekirdekler, daha sonra döteryum çekirdeklerini oluşturdu. Ama oluşan çekirdekler, kararsız
olduğu için, izleyen çarpışmalar sonucunda hemen parçalandı.
3.dk dan sonra sıcaklık düşmeye devam eder ve %75 proton ve %25 nötrondan ibaret olan
evrende, döteryum çekirdeği oluşur. Döteryum çekirdeği, yeni element çekirdeklerini
oluşturur. Tüm nötronlar tükendikten sonra, evren yaklaşık %25 He (helyum çekirdeği) içerir
duruma gelmiştir.
Büyük Patlama’dan 300000 yıl sonra sıcaklık 10000 0C’a düştü. Elektronlar, proton ve
nötronlarla bir araya gelerek atomları oluşturdu. Bu aşamada evren çok hızlı soğuduğu için
Beliryumdan daha ağır çekirdekler oluşamadı.
Hidrojen ve helyum gazları arasındaki kütle çekimi sayesinde dev bulutlar oluştu. Dev
bulutlar, gök adaları; daha küçük gaz yığınları ise kütlesi, Güneş’in kütlesinden 10 ila yüzlerce
kat büyüklükteki ilk yıldızları oluşturdu. İlk yıldızlardaki hidrojen atomu çekirdekleri, nükleer
füzyon tepkimeleri (yüksek basınç ve sıcaklığın etkisi) sayesinde birbirleriyle kaynaşarak
helyuma dönüştü.
İlk yıldızların helyumdan daha ağır elementleri oluşturamadan çok şiddetli patlamalarla
dağıldığı sanılmaktadır. Bu ve daha sonraki patlamalar sonunda sıcaklığın 100000000 0C’in
üzerine çıkmasını sağladı. Bu sıcaklık bir dizi nükleer füzyon tepkimesi için gerekli şartı
sağlamış oldu ve daha ağır elementler oluştu.
Kıyamet Seneryosu:
Evrenin genişleme hızının kütle çekim enerjisini yenecek kadar büyük
olmaması (kapalılık), genişleme hızının kütle çekim kuvvetini yenecek kadar
büyük olması (açık olması) anlamına gelmektedir.
Evren kapalı ise genişlemesi bir gün duracak ve Big Bang'in tersi bir şekilde,
kütle çekiminin etkisi altında kalan everen zamanla küçülecek, ısınacak ve
sonuçta sonsuz yoğunluk ve sıfır hacme ulaşarak yok olacaktır.
Eğer evren açık ise, üzerine çöküş gerçekleşmeyecek, fakat geçen zamanla
birlikte genişleyen evren soğuyacak ve üzerindeki maddeyi oluşturan tüm
enerjiyi harcayarak yok olacaktır.
Şimdilik everenin sonu hakkında ancak bu iki olasılıktan birinin
gerçekleşebileceği tahmin edilmektedir.
Evren yok olduktan sonra yeni bir evrenin oluşup oluşmayacağı ise insan
oğlunun cevaplandırılamayacağı bir soru olarak gizemini korumaktadır.
2. BÖLÜM: Elementlerin Eldesi
KONU BAŞLIKLARI
KAZANIMLAR
• Mineral
• Cevher
• Zenginleştirme
• Kavurma
2.1. Metalurjile ilgili bazı kavramlar,
• Karbon ile indirgeme
2.2. Kömürle indirgeyerek metal elde etme yöntemini
tepkimeleriyle örneklendirir.
• Hidrojenle indirgeme
yönteminin üstünlükleri,
2.3. Hidrojenle indirgeme yönteminin tercih edildiği
durumlara örnekler verir.
2.4. Aktif bir metal kullanarak indirgeme yöntemiyle başka
bir metal üretiminin hangi durumlarda gerekli olduğunu
•Aktif metal ile İndirgeme
açıklar.
•Elektroliz ile metal
üretimi
2.5. Elektroliz ile metal üretimine
örnekler verir.
2.1. Metalurjile ilgili bazı kavramlar:
Metalürji, Mineral, Cevher:
Metallerin, doğal kaynaklaran elde
edilmesi ve kullanım amacına uygun
bir biçimde hazırlanmasına metalürji
denir. Metalurji terimi genel olarak
metallerin incelenmesini ifade eder.
Ekstraktif
metalurjide
metal
Manyezit minerali
Manyezit cevheri
cevherlerinden metallerin eldesi
incelenir.
Homojen veya homojen görünüşlü doğal olarak değişik şekillerde oluşmuş ve insanoğlunun
kullanımı için yerkabuğundan elde edilen ve genellikle katı olan maddelere mineral denir.
Elde edilmeye değer miktarda bir veya birden çok element içeren minerallere cevher ya da
filiz denir.
Cevher, madenci açısından kârlı bir şekilde çıkarılabilen veya metalürjist açısından kârlı bir
şekilde işleme tabi tutulabilen az veya çok gang mineralleri ile karışık metalik mineral veya
metalik mineraller topluluğudur.
2.1. Metalurjile ilgili bazı kavramlar:
Bazı mineraller (opal (SiO2-nH2O) gibi) amorf katılardır.
Minerallerin büyük bir kısmı ise kristal durumdadır. Kristalllerin düzgün yüzeylerle çevrilmiş
geometrik şekilleri ve muntazam, periyodik olarak sıralanmış düzenli bir atomik yapıları vardır.
Kuvars (SiO2), tuz (NaCI), kristal hâldeki minerallerdir.
Elmas (C), zümrüt (Be3AI2(SiO3)6) ve topaz AI2SiO4(OH,F)2 gibi kıymetli ve renkli taşlar
(mücevherler) da kristaller için en güzel örneklerdir.
Her mineralin kimyasal bir formülü vardır.
MİNERAL
Soy metaller
Oksitler
SEMBOL/FORMÜL
Cu, Ag, Au, Pd, Pt
AI2O3.2H2O (boksit), Fe2O3 (hematit), Fe3O4(manyetit) FeCr2O4 (kromit), FeWO4
(volframit), SnO2 (kasiterit), MnO, (pirolisit), TiO, (rutil), Cu7O (kuprit)
Sülfürler
Ag2S (arjantit), Cu2S (kalkasit), CuS (kovalit), PbS (galen), ZnS (blend), HgS (zinnebar),
FeS2 (pirit), FeCuS2(kalkopirit), Bi2S3,(bizmutit)
Sülfat ve
Karbonatlar
Halojenürler
Silikatlar
Fosfatlar
CaSO4(kalsit), MgCO3 (manyezit), CaMg(CO3)2 (dolamit), FeCO3 (siderit), PbCO3,
BaCO3, CuCO3
NaCI (halit), KCI (sılvit), AgCI, KCI-MgCI2(karnalit). CaF2 (florıt), Na3AIF6(kriyolit)
Be3AI2(SiO3)6 (beril), ZrSi04 (zirkon) Sc2Si2O7 (thorvetit), NiSiO3, MgSiO3
CePO4, LaPO4, Ca3(PO4)2,
2.1. 1. Elementler nasıl elde edilir:
Cevherlerden metal elde etme sürecindeki işlem
basamaklarını kısaca:
1.Kırma-öğütme
Gang'ın (Cevherler genellikle kum, kil ve granit gibi
istenmeyen mad­deler içerir. Bu madddelere gang
denir.) uzaklaştırılma işlemine ilk olarak kırmaöğütme ile başlanır. Bu amaçla cevher birkaç defa
öğütülür. Son öğütme, yeni oluşan yüzeylerin
oksitlenmesini önlemek için genellikle su altında
yapılır.
2.1. 1. Elementler nasıl elde edilir:
Zenginleştirme: Madencilikte, metalin elde edileceği mineral,
madenin küçük bir yüzdesi (çoğu kez yüzdenin kesirleri)
kadardır. Daha ileri metalurji işlemlerine geçmeden önce
istenen maden cevherini kaya parçalarından ayırmak gerekir.
Bunun için uygun yöntem yüzdürme (flotasyon) dir.
Toz haline getirilen cevher büyük bir tekne içindeki suya bazı
katkı maddeleri ile birlikte dökülür ve içinden basınçlı hava
geçirilir. Hava kabarcıklarına yapışan cevher parçacıkları
suyun yüzeyine çıkar ve dışarı alınan köpükle birlikte toplanır.
istenmeyen kaya parçacıklarından (gang) teknenin dibinde
kalır. Yüzdürme işleminde köpük oluşur.
Birçok cevhere, özellikle Cu, Pb, ve Zn cevherlerine
uygulanan bir yöntemdir.
2.1. 1. Elementler nasıl elde edilir:
Arıtma: Değişik yöntemlerle ile elde edilen metal, çoğu kez istenen saflıkta değildir.
Safsızlıklar giderilerek, metal arıtılmandır. Seçilen arılaştırma işlemi safsızlığın niteliğine
bağlıdır. Çinkodaki safsızlığın başlıcaları Cd ve Pb olup, sıvı çinkonun ayrımsal
damıtılmasıyla uzaklaştırılabilirler.
Bununla birlikte, dünyada üretilen çinkonun büyük çoğunluğu elektrolizle saflaştrılır.
Genellikle indirgeme ve arılaştırma ile birlikte yapılır. Bunun için, kavurma ile elde edilen
ZnO sulu H2SO4 içinde çözülür. Ancak ortamda bulunan Cd ve Pb de H2SO4 içinde çözülür.
Daha az etkin metalleri (Cd ve Pb) uzaklaştırmak için Zn tozu eklenir.
Sonra ZnSO4 çözelti elektroliz edilir.
Örnek: ZnO(k) 2H+(aq) SO4
-2
(aq)
Zn +2(aq) +SO4
-2
(aq)
H2O(s)
2.1. 1. Elementler nasıl elde edilir:
Kavurma: Sülfürlerin ya da karbonatların bol hava ile ısıtılarak oksidine dönüştürülmesi
işlemine kavurma denir. Sülfür tipi cevherlerden kükürdü uzaklaştırmak için bu yöntem
kullanılır. Cevher, metal bileşiklerini sonradan indirgenebilen oksitlerine çevirmek için
kavrulur (yüksek sıcaklığa kadar ısıtılır).
Örnek olarak çinkoyu incelersek;
Ticari önemi olan çinko cevherleri sülfür (sfalerit) ve karbonat (smitsonit) şeklindedir.
Şiddetle ısıtıldığında ZnCO3(k), ZnO(k) ve CO2(g)’ e parçalanır. Havada şiddetle ısıtıldığında
ZnS(k) ile O2(g ) tepkimeye girer, ZnO(k) ve SO2(g) meydana gelir. Çağdaş tasviye işlemlerinde
SO2(g) havaya verilmeyip, sülfürik asit eldesinde kullanılır.
ısı
ZnCO3(k)
ZnO (k) +CO 2(g)
ısı
2ZnS(k) +3O 2
2ZnO (k) +2SO 2(g)
ısı
2ZnS(k) +3O2
2ZnO+2SO2(g)
ZnO+C
Zn+CO
ısı
ısı
HgS(k) +O2
Hg+SO2(g)
ısı
Cu2S(k) +O2
2Cu+SO2(g)
2PbS(k) +3O 2 2PbO (k) +2SO 2(g)
ısı
CaCO3(s)
2CaO (s) +CO 2(g)
ısı
Mg(OH) 2
MgO (s) +H 2O (g)
2.1. 1. Elementler nasıl elde edilir:
Termal Bozunmayla İndirgeme: Bazı maddeler termal bozunmayla indirgene bilirler. Bazı
metal oksitler, yüksek sıcaklıkta termal bozunmaya (piroliz) uğrayarak metallere indirgenir.
Aşağıdaki tepkimelerde de metaller termal bozunma ile serbest hâle indirgenmiştir. Bu
bozunma aynı zamanda bir redoks tepkimesidir.
450°C
[Ni(CO) 4 ]
Ni + 4CO
Nikelkarbonil
1920°C
ZrI 4
Zr + 2I 2
CuO
Cu + 1/2O 2
İndirgeme işlemi için yüksek sıcaklıklara çıkmak ekonomik açıdan uygun değildir. Bu nedenle
bir metali bileşiğinden indirgeyerek ayırmak için ayrılacak metalden daha elektropozitif bir
metal kullanılır. Bu amaçla C, H2, Al, Mg, Ca, K, Si, CaC2 gibi kuvvetli indirgenler tercih edilir.
2.1. 1. Elementler nasıl elde edilir:
Karbon ile İndirgeme: Teorik olarak bütün metal oksitleri karbon ile indirgenebilir.
Metalürjide karbon kaynağı olarak çeşitli kömürler kullanılır. Eğer mümkünse, indirgen olarak
hem ucuz hem de kullanılması kolay karbondan (kok ya da kömür tozu halinde) yararlanılır.
Burada aynı anda pek çok tepkime olur ve bu tepkimelerde hem C(k), hem de CO(g) indirgen
olarak davranır.
ZnO nun indirgenmesi yaklaşık 1100 °C ta gerçekleştirilir. Bu sıcaklık çinkonun kaynama
noktasından yüksektir ve buhar halinde elde edilen çinko, sıvı çinkoya yoğunlaştırılır.
ZnO(k) C(k) Zn
(g)
+CO(g)
ZnO(k) CO(g) Zn (g) +CO2(g)
Cu 2O(k) C(k) 2Cu (s) +CO(g)
PbO(k) C(k) Pb(k) +CO(g)
FeO(k) C(k) Fe(k) +CO(g)
FeO(k) CO(g) Fe(k) +CO2(g)
1500 0C
SiO2(k) 3C(k)
Si(s) +2CO(g)
ısı
2C(grafit) +O 2(g)
2CO
ısı
Fe 2 O3(k) 3CO
2Fe (k) +3CO 2 (g)
2.1. 1. Elementler nasıl elde edilir:
Hidrojenle indirgeme: Bazı yöntemler sonunda oluşan Cu +2 iyonları, aşağıdaki tepkimede
olduğu gibi, H2'ye da demir ile indirgenir:
Cu +2(aq) H2(g) Cu (k) +2H+(aq)
SiCl4(k) 2H2(g) Si (k) +4HCl(aq)
CuSO4(k) H2(g) Cu (k) +H2SO4(s)
WO3(k) +3H2 W(k) +3H2O
MO3(k) +3H 2 Mo (k) +3H 2 O
Yarı iletkenlik için ham silisyum
SiCl4 gibi uçucu bileşiklere
dönüştürülür. Bileşikler fraksiyonlu
damıtma ile saflaştırılır ve H2 ile
indirgenir. Böylelikle oldukça saf
silisyum elde edilir.
2.1. 1. Elementler nasıl elde edilir:
Aktif metal ile İndirgeme
AlCl3 +3K Al +3KCl
ısı
TiO 2 +2Cl2 +2C
TiCl 4 +2CO
TiCl 4 +2Mg Ti+2MgCl 2
TiCl 4 +4Na Ti+4NaCl
2Au (s) +4CN
+O2(g) +2H 2O(s) 2 Au(CN) 2 (aq) +4OH -(aq)
-
-
(aq)
2 Au(CN)2 (aq) +Zn(s) 2Au (s) +Zn(CN) 2 (aq)
-
-
2.5. Elektroliz ile metal üretimi
Örnek: Ag + nın sulu çözeltisinin elektrolizinde saf gümüşün eldesi için kimyasal
eşitlikleri yazınız?
Ag'ün sulu çözeltisinde;(Ag + , H 2O)
Anot:H 2 O(s) 1 2 O 2(g) +2H + 2e (Yükseltgenme)
Katot:2Ag + (aq) 2e 2Ag (k) ( İmdirgenme)
2Ag + (aq) H 2 O(s) 2Ag (k) 2H + (aq) 1 2 O 2(g)
2.5. Elektroliz ile metal üretimi
Örnek: Kavurma sonunda elde edilen ZnO sulu H2SO4 içinde çözülür elde edilen
ZnSO4 ün sulu çözeltisi elektroliz edilerek Zn elde edilir. ZnSO4 ın elektroliziyle ilgili
olarak kimyasal eşitlikleri yazınız?
ZnSO4 çözeltisinde: Zn +2(aq) +SO4
-2
(aq)
H2O(s)
Anot:H 2 O (s) 1 2 O 2(g) +2H + 2e (Yükseltgenme)
Katot:Zn
Zn
+2
(aq)
+2
(aq)
+SO 4
2e Zn (k) ( İmdirgenme)
-2
(aq)
H 2O (s) Zn (k) 2H + (aq) SO 4
-2
(aq)
1 2 O 2(g)
Örnek: Aşağıdaki olayların kimyasal eşitliklerini yazınız?
a- Cu2S ün kavrulması
b- WO3 in H2(g) ile indirgenmesi
c- HgO in sıcaklıkta elementlerine ayrışması.
d- CaCO3 ün sıcaklıkta ayrışması.
e-NaCl nin ayrışması.
a) 2Cu 2S(k) +3O 2 2Cu 2O (k) +2SO 2(g)
b) WO3(k) +3H2 W(k) +3H2O
c) 2HgO (k) +ısı 2Hg (k) + O 2(g)
d) 2CaCO3(k) +ısı CaO(k) + CO2(g)
elektroliz
e) NaCl
Na (k) + Cl2(g)
3.BÖLÜM: Alaşımlar
KONU BAŞLIKLARI
KAZANIMLAR
3. Alaşımlar ile ilgili olarak öğrenciler;
3.1. Element özelliklerinin ıslahı ve 3.1. Element özelliklerinin ıslahını
alaşımlar;
alaşım temelinde açıklar.
3.2.1.Heterojen alaşım
3.2.2.Homojen alaşım
3.2.3. Yer değiştirme tipi alaşım
3.2.4. Örgü boşluğu tipi alaşım
3.2.5. Metaller arası bileşik tipi
alaşım,
3.2. Alaşımları sınıflandırıp örnekler verir.
3.3.1.Yaygın alaşımların özellikleri, 3.3. Yaygın alaşımların özelliklerini bileşimleri ve kullanım
bileşimleri ve kullanım alanları
alanları ile ilişkilendirir.
3.1. 1. Element özelliklerinin ıslahı ve alaşımlar;
Bazı metaller korozyona karşı dayanıklıdır; fakat kuvvet etkilerine karşı
pek dayanıklı değildir. Bazıları da kuvvet etkilerine karşı dayanıklıyken
korozyona karşı dayanıksızdır. Bazı metaller aktif tir ve hemen
paslanırlar.
Metallerin dayanıklılığını ve korozyona karşı dayanımını arttırmak için
alaşımlar üretilmiştir.
Normal bir çeliğin (%95 demir- %1,5 karbon) korozyondan etkilenme
oranı 100 kabul edilirse çeliğe katılan %1 oranındaki krom çeliğin
korozyondan etkilenme oranını %30 azaltır. Katılan krom oranı arttıkça
korozyona karşı dayanım da artar. Paslanmaz çeliklerde kroma ilaveten
nikel de bulunur. Paslanmaz çeliklerin bileşiminde genellikle %18 krom,
%10 nikel bulunur.
Kısaca, alaşımlar belli amaçlar için üretilmişlerdir. Bunlar:
•Metallerin fiziksel ve mekaniksel özelliklerini değiştirmek suretiyle
daha elverişli malzemeler üretmek.
•Çok sayıda ve değişik özelliklere sahip metaller geliştirerek ihtiyaçlara
cevap vermek.
•Isıl işlemlere uygun metaller üretmek.
•Malzemelerin maliyetini düşürmek.
•Malzemenin aşınma ve dış şartların yıpratıcı etkilerden korunmasını
sağlamak.
3.1.2. Alaşım
Alaşım, bir metal elementin en az bir başka element
(metal,ametal,yarımetal) ile karışarak oluşturduklar metal
karakterli malzemye denir.
Alaşımda bileşenlerden biri cıva ise malgama adını alır. Cıva yalnız
demir ve platin madenleriyle malgama yapmaz.
Elementler alaşım hâline getirilerek kullanım alanları
arttırılır.
Örneğin, çinko metalinin doğrudan doğruya kullanıldığı
alanlar oldukça sınırlı olmasına rağmen ikili ve üçlü
alaşımlarının kullanıldığı alanlar daha fazladır.
Pirinç; % 63 Cu, %37 Zn içeren ikili alaşımdır. Kolay
işlenebildiği için boru, tel ve süs eşyası yapımında kullanılır.
% 60 Cu, % 38 Zn, % 2 Fe içeren delta alaşımı ise üçlü
alaşımdır. Bu alaşım esnek olup, kopmaya karşı
dayanıklıdır.
3.1.3. Alaşım
Alaşımda fazla miktarda olan metale asıl metal adı verilir. Alaşımı elde etmek için bu metale
karıştırılanlara da alaşım elemanları denir. Metallerin büyük çoğunluğu kafes yapısı içinde
belirli sayıda yabancı atom barındırabilirler. İlave edilen element, kristal içinde ya katı çözelti
veya ara bileşikler halinde bulunur.
Yabancı atomların asıl metalin kafes sistemindeki yerleşimlerine göre, metalik katı eriyiklerin
iki türü vardır:
1. Ara-yer Katı Eriyiği
2. Yeralan Katı Eriyiği (Asal Yer Katı Eriyiği) Yabancı atom esas metalin atomu yerine
yerleşiyor ise Yeralan Katı Çözeltisi oluşur.
Bu türde çözünen metalin atomları çözücü
metalin kristal atomlarının bazılarının yerini
almıştır.
Kafes aralarındaki boşluklara yerleşiyor ise
Arayer Katı Çözeltisi meydana gelir. Atomik
yarı çapı 10 -8 cm' den küçük olan H, C, B ve
N gibi çözünen metalin atomları, çözücü
metalin atomlarının arasındaki boşluklara
dağılmışlardır.
3.1.4. Alaşım
ADI
Nikel
Inkonel
Alman
gümüşü
Duranikel
Kupronik
el
Monel
BİLEŞEN(%)
99,5 Ni
ÖZELLİKLERİ
sı ve korozyona
karşı dayanıklı,
mağnetik özelliğe
sahip, kolay işlenebilir.
30 Ni, 14 Cr,
Yüksek sıcaklığa ve
6 Fe
korozyona dayanıklı,
KULLANIM ALANLARI
Gıda, sabun ve çelik endüstrisinde,
eczacılıkta, mağnetik cihaz ve alaşım
yapımında.
Süt, şarap, meyve suyu, yağ ve
kostik alkali kabı yapımında,
10-30 Ni, 5Korozyona dayanıklı,
Sofra takımı, süs eşyası, müzik ve
50 Zn 1-10 Pb güzel görünümlü ve
dişçilik aletlerinin yapımında.
ve Cu
kolay işlenebilir
94 Ni, 4 Al
Dayanıklı ve sert
30 Ni, 70 Cu
Korozyona dayanıklı
67 Ni, 30 Cu Sert yapılı ve
ve 3 Mn
korozyona dayanıklı
El aletleri ve kalıp yapımında.
Isı değiştirici borular, buhar türbin
pervaneleri ve para yapımında.
Para, mutfak eşyası, mimari ve
dekoratif amaçla kullanılır.
3.2.1. Alaşımları sınıflandırılması;
Alaşımlar; homojen ve heterojen alaşımlar, yer değiştirme tipi alaşım, örgü boşluğu tipi
alaşım, metaller arası bileşik tipi alaşım olmak üzere değişik biçimlerde sınıflandırıla
bilir.
3.2.1,2. Homojen ve Heterojen alaşımlar:
Farklı element atomlarının düzgün bir şekilde yerleşmesiyle oluşan alaşımlar,
homojen alaşımlardır, iki veya daha çok fazdan oluşanlar ise heterojen
alaşımlardır.
Alaşımların büyük bir kısmı heterojendir.
Örneğin Au-Cu veya Au-Ag alaşımları heterojen, yani ikili sistemlerdir. Homojen
alaşımlara örnek olarak Cu-Sn, Cu-Zn, Cu-Ni, Fe-Nİ, Pb-Sn alaşımları verilebilir.
Bu konu diğer alaşım
incelendikten
sonra
anlaşılacaktır.
tipleri
daha
3.2.3. Yer değiştirme tipi alaşım
Yer değiştirme (sübstitutional) alaşımlar: Yer değiştirme
alaşımlarında çözünen metal atomlar çözücü metal atomlarının
bazılarının yerlerini işgal eder.
Bu tür alaşımların oluşabilmesi için iki metalin aşağıdaki
koşulları sağlaması gerekir.
a) İki metalin kristal yapları aynı olmal,
b) İki metal benzer kimyasal özellikler göstermelidir.
c) Metalik yarıçaplarının farkının oranı = ± %15 olmalı,
Örnekler:
Na ve K kimyasal olarak birbirlerine benzer yapıdadır,
Metalik yarı çaplar sırasıyla 1,86 0A ve 2,26 0A )
Yarıçaplar oranı % 18 olması nedeniyle bu iki katı birbiriyle homojen alaşımlar yapamazlar.
Örnekler:
Cu ve Ni’ i ele alırsak,
İkisi de kimyasal olarak birbirlerine benzer yapıdadır,
Yarıçapları sırasıyla 1,28 0 A ve 1,25 0 A ,
Metalik yarıçaplar farkının oranı % 2,3, olduğundan bu iki metal birbiriyle her oranda
karışan alamlar yaparlar.
3.2.3. Yer değiştirme tipi alaşım
a) Rastgele Yer Değiştirme İle Oluşan Alaşımlar:
Alaşım oluşurken birbiriyle tam olarak karışabilen iki
metalin erimesi sırasında, miktarca az olan metal atomları,
miktarca fazla olan metal atomlarıyla rastgele yer değiştirir.
Bu tip alaşımı oluşturan elementlerin atom yarıçaplarından
fark %15'ten azdır.
Element atomlarının büyüklüklerinde ve elektronik
yapılarında küçük farklılıklar olduğu için yer değiştirme ile
oluşan alaşımlardaki atomlar metal örgünün şeklini bozar
ve elektron akışını engeller. Metal örgü yapısı bozulduğu
için bu tip alaşımların elektriksel ve termal iletkenliği saf
elemente göre daha azdır. Ancak sertlikleri ve sağlamlıkları
daha fazladır.
Yer değiştirme alaşımlarına Cu-Zn ve Au-Ag karışımları
örnek verilebilir.
3.2.3. Yer değiştirme tipi alaşım
b)Süper Örgü Alaşımı: Bazı özel durumlarda yer de
ğiştirme ile oluşan alaşımlardaki atomların yeri
düzenlilik gösterir.
Bu tip alaşımlara süper örgü alaşımı denir.
Süper örgü alaşımlarına Cu-AI-Ni örnek verilebilir.
Bu alaşım şekil hafızalı alaşımlarda kullanılır.
Şekil hafızalı alaşım; martensitik (kristal) yapıda iken
belli bir dış kuvvete maruz kalmaları sonucu değişen
orijinal şekillerini, östenit faz sıcaklığına geçtiklerinde
büyük oranda geri kazanabilen alaşımlardır. Alaşım
östenit fazda iken, herhangi bir sıcaklık değişimi
olmaksızın, sadece uygulanan stresin ortadan kalkması
sonucu malzemenin orijinal formunu tekrar kazanması
ise süperelastisite olarak tanımlanır.
3.2.4. Örgü boşluğu tipi alaşım
Örgü boşluğu tipi alaşımlar, çözücü metal örgüsünün boşluklarına
sığabilen küçük ametallerle yapılır. Esas katının orijinal kristal yapısı
bozulmaz. Genellikle stokiyometrik olmayan maddeleri oluştururlar.
«Araya sıkıma»lı katı eriyikler sadece, ilâve metalin atomlarının öbür
metalinkilerine göre çok küçük olup bunun kristal kafesinin boşluklarına
yerleşebilmeleri halinde oluşabilirler.
En sık paket yapısında en büyük boşluk oktahedral boşluktur. Bu boşluğa
girebilecek atomun yar çap 0,414 r kadar olacaktır (r = esas örgüyü
oluşturan metalin yar çapı). Bu nedenle temel yapıyı bozmadan H, B, C,
ve N atomların yerleştirmek için metal atomları sırasıyla 0,90 ; 1,95; 1,88
ve 1,80 0 A den daha küçük olmamalıdır.
Bununla birlikte d-blokunun ilk sırasının sonundaki elementler yarı çapları 1,60 0 A dan daha
küçük olmalarına rağmen B, C ve N’ la katı çözelti serisi oluştururlar . Bunu, özel metal-ametal
bağlanması olarak düşünebiliriz. Bu nedenle bu alaşımlara ametallerin bileşikleri olarak
bakabiliriz. Örgü boşluklarındaki atomlar alaşımı daha sert ve sağlam yaparlar.
Örneğin; 0,9 C içeren 10/90 çeliği, 0,2 C içeren 10/ 20 çeliğinden daha sert ve krılgandr. Bazen
de örğü boşluğuna daha büyük atomların girmesi ile daha gevşek -yumuşak alaşımlar
yapılabilir.
3.2.5.Metaller Arası Bileşikler
İki metal aynı potada eritildiğinde genellikle bir alaşım teşekkül eder, yani belirli bir sıcaklığın
üstünde, her iki bileşenin oranları ne olursa olsun, bir homojen sıvı veya sıvı faz edilir. Bu sıvı
yavaş yavaş soğutulduğunda homojen kristaller vererek katılaşır; kristaller her iki metalin
atomlarını içerirler ve aynı kimyasal tabiatlı kristaller bir katı faz adı verilen hali meydana
getirirler.
Bir alaşımda denge halinde bulunan fazların sayı ve kimyasal tabiatı bu alaşımın kimyasal
yapısını tanımlar.
Katılaşma ilerledikçe her iki metal birbirlerini kimyasal olarak etkileyerek bir metaller arası bileşik
(intermetallic compound) oluştururlar.
Kısaca; alaşımı oluşturan atomlar arasındaki elektronegatiftik farkı büyük olduğunda metaller
arası bileşikler oluşabilir. Bunlar gerçek bir bileşik gibi düşünülür. MgZn2, Cu3Au ve Na5Zn21 en çok
bilinen metaller arası bileşiklerdir.
Ancak belli ve sabit bir stokiyometriye sahip alaşımların hepsinin "metaller arası bileşik" sayılması
bir kavram yanılgısıdır. Atomlar arasındaki boşluklara yerleşmeyle oluşan bazı alaşımların (Fe3C
vb.) stokiyometrileri sabittir.
Örnek:
NaTI (sodyum talyumür) bir bileşiktir; çünkü Na+ katyonu ve (Tl)4-4 anyonu arasındaki
etkileşmeyle oluşmuştur.
Fe3C alaşımında ise, Fe ve C atomları, Fe örgüsündeki boşluklar içine C atomlarının yerleşmesi
dışında hiç değişikliğe uğramamıştır.
3.2.5. 1.Metaller Arası Bileşikler
NaTI
(sodyum talyumür)
Ara bileşiklerde atomlar arası bağlar metalik bağ ile
kimyasal bağ arasında değişen bir yapıya sahiptir ve
kimyasal bileşiklere benzeyen AnBm şeklinde bileşikler
oluşur.
Bu bileşikler kendilerini oluşturan farklı atomların
aralarında oluşturdukları kuvvetli bağlar nedeniyle
oldukça farklı mekanik ve fiziksel özellikler gösterirler.
Metaller arası bileşikler, hem kullanım sıcaklığı hem de
mekanik özellikler açısından (seramik kadar kırılgan değil)
metalik malzemeler ile seramik malzemeler arasındaki
boşluğu doldurmaya aday malzemelerdir.
Atomlar arası kuvvetli bağlar nedeni ile süper
alaşımlardan daha yüksek mukavemet gösterirken,
bağlanmanın hala metalik karakterde olmasından dolayı
seramiklere göre daha az kırılgandırlar.
3.2.5.2.Metaller Arası Bileşikler
Metaller arası bileşikler üzerindeki ilk araştırmalar oksitleyici
ortamlarda oldukça koruyucu olan ince alüminyum oksit
filmi oluşturmak için oldukça yüksek miktarda alüminyum
içeren alüminatları oluşturmakla olmuştur. Bunlar içinde
nikel, demir ve titanyum alüminatlar en çok ilgi çekenlerdir.
Fe3Al demir alüminatlar, yüksek sıcaklıklarda oksidasyon ve
sülfidasyonun oluştuğu endüstriyel uygulamalar için çok ilgi
çekici olmuştur. Nikel esaslı süper alaşımlarda en önemli
kuvvetlendirici Ni3Al’dir.
NiAl’ın dört kilit avantajı vardır:
•Yoğunluğu nikel esaslı süper alaşımların yaklaşık üçte ikisidir,
•Termal iletkenliği bileşime ve sıcaklığa bağlı olarak nikel esaslı süperalaşımların 4 ile 8 katı,
Mükemmel oksidasyon direnci gösterirler,
•Bir çok intermetalik bileşikle karşılaştırıldığında plastik deformasyon kabiliyetini kolaylaştıran
basit düzenli hacim merkezli kübik (CsCl) kristal yapısıdır,
•Ti3Al ve TiAl esaslı titanyum aluminatlar çok düşük yoğunluklarından dolayı geliştirilmiş uçak
motoru uygulamaları için çekici adaylardır.
•Mg2Si metaller arası bileşiği havacılık ve taşımacılık sistemleri için kullanılabilecek cazip bir
malzemedir.
3.2.5.3.Metaller Arası Bileşikler
Demir aluminatların
hazırlanmasında
%99,98 saflıkta
elektrolitik demir ve
%99,7 saflıkta
elektrolitik aluminyum
kullanılmıştır. Ergitme
işlemi alümina
Nikel aluminatların
hazırlanmasında
%99,99 saflıkta
elektrolitik nikel ve
%99,7 saflıkta
elektrolitik
aluminyum
kullanılmıştır.
Titanyum
aluminatların
hazırlanmasında
%99 saflıkta Ti ve
%99,7 saflıktaki
aluminyum
kullanılmıştır.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Çelik ;
Yüksek fırından elde edilen demire pik demir adı verilir. İçinde %
95 Fe, % 3-4 C ve çeşitli oranlarda başka safsızlıklar vardır.
Fırının üstünden demir
cevheri, kok kömürü ve kireç
taşı konur
ve alttan sıcak hava verilir.
Sıvı demirin ve curufun
alındığı fırın tabanında
sıcaklık en yüksektir.
3CO+Fe2O3
2Fe + 3CO2 (9000C)
3H 2 +Fe2O3
2Fe + 3H 2O (9000C)
Pik demirden çelik elde etmek için yapılması gereken başlıca
değişiklikler:
1.Pik demirdeki karbon miktarı % 3-4 den % 0-1,5 değerine
indirilir.
2.Si, Mn, P (pik demirdeki yüzdeleri 1 ya da daha fazladır) ve
diğer ikinci derecedeki safsızlıklar curuf oluşturularak
uzaklaştırılır.
3.İstenen özelliklerde çelik elde etmek için gerekli elementler (Cr,
Ni, Mn, V, Mo ve W gibi) eklenir.
Eriyik hâlde elde edilen alaşım, donduktan hemen sonra
bükülebilir. Bileşimine göre bini aşkın çelik türü elde
edilebilmesine karşın günümüzde kullanılanlar, karbon çelikleri,
alaşım çelikleri, paslanmaz çelik ya da ısıya dayanıklı çelik ana
gruplarında toplanabilir.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Tunç (bronz):
Kalayın diğer önemli alaşımları bronzdur. Bronz; % 82 Cu, % 16 , Sn % 2 Sb içerir Tuç;
madalya ve heykellerin yapımında kullanılır.
Bronz bakırdan daha serttir, daha kolay erir ve kalıba daha kolay dökülür.
Bazı bronzlar demirden da daha de serttir. Bu tür bronzlar silah namlusu ve makina
yataklarının imalinde kullanılır. Alet ve silahlarda demir alaşımlarının daha çok
kullanılmakta olması, demirin bakır ve kalaya oranla daha bol bulunmasındandır.
Bakırın içinde bazı metallerin çözünebilme sınırları vardır. Mesela berilyum % 2,
silisyum % 5, kalay % 15 ve çinko % 38 nispetinde çözünebilir. Bir metalin miktarı
çözünme sınırının üzerinde olduğu zaman alaşım homojen olmaz.
Bunun yanında nikel ve alüminyum gibi sınırsız olarak bakırla karışabilen metaller de
vardır.
Silisyum, alüminyum ve kalay bronzda en fazla bulunan elementlerdir. Bu metallerin
nispeti arttıkça alaşımın sertlik ve direnci artar. Ancak parlaklığı azalır. Bronzda az bir
miktarda bulunabilen diğer mühim elementler de mangan, demir, kurşun ve
fosfordur.
Fosfor bronzu, pompaların, vanaların , burçların yapımında kullanılır.
Bronzun çok kullanıldığı alanlardan biri de metal para imalidir.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Pirinç:
Pirinç, bakır ve çinko katılarak elde edilen sarı renkteki alaşımların genel ismidir. Pirinçte bulunabilen diğer
bazı elementler, kalay, kurşun, nikel, mangan, demir, alüminyum, arsenik, antimun ve fosfordur.
Piriç oldukça tok ve kolay işlenebilen bir malzemedir. Dövülebilirliği bakır muhtevasına bağlıdır.
İçeriğine göre baz prinç türleri:
Amiral Pirinç :30% çinko ve 1% kalay ihtiva eder. Kalay çinkosuzlaşma tepkimesini engellemeye yardımcı olan
bir elementtir.
Alfa Pirinç (Pirincin kralı olarak da adlandırılır): %35'den az çinko içerir, eriyebilme özelliğine sahiptir, soğuk
işlenebilir ve dövülebilir. Sadece bir faz içerir (Yüzey merkezli kübik kristal yapı).
Alfa-Beta Pirinci : İki fazlı pirinç olarak da adlandırılır. 35-45 % çinko ihtiva eder ve sıcak işlemeye uygundur.
Hem alfa hem beta fazı içerir; beta fazı şekil merkezli kristal yapıya sahip olup alfa fazından daha sert ve
güçlüdür. Alfa-beta pirinçleri genellikle sıcak işlemine tabi tutulurlar.
Aluminyum bazlı pirinç : Aluminyum korozyon dayanıklılığını artırcı olarak katkı sağlar.
Beta pirinç : 45-50 % çinko ihtiva eder, sadece sıcak olarak işlem görür, ve daha sert, güçlü olmasıyla döküm
için uygundur.
Ortak pirinç veya perçin pirinci : 38% çinko içerir, ucuz ve soğuk işlemeye uygundur.
Yüksek bakır oranlı pirinç : 65% bakır ve 35% çinko içerir, yüksek çekme kuvvetine sahip olup yay, civata ve
perçin yapımında yaygın olarak kullanılır.
Kurşunlu pirinç : Alfa beta pirinç alaşımına kurşun eklenmesiyle elde edilir. Kurşun içermesinden dolayı
işlenebilirliği artmıştır. (kolay talaş kaldırma olanığı sağlamıştır.)
Düşük çinko alaşımlı pirinç : 20% çinko içerip açık altın rengine sahiptir. Mükemmel sünek özelliğine sahip
olup metal hortumları gibi esnek yerlerde tercih edilir.
Deniz mavisi pirinci : Amiral pirincine yakındır, 40% çinko ve 1% kalay içerir.
Kırmızı pirinç : CuZnSn alaşımı için verilen amerikan terimidir.Ayrıca silah metali olarak da adlandırılır.
Beyaz pirinç : 50 % çinko içerir ve genel kullanım için çok kırılgandır.
Sarı pirinç : 33% çinko içeren alaşımlar için verilen amerikan terimidir.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Amalgam:
Cıva içeren alaşımlara amalgam ya da malgama denir. Cıva bir
çok metalle amalgam denen alaşımlar yapar.
Amalgamlar, bileşimine bağlı olarak, bazıları sıvı, bazıları
katıdır.
Amalgamlardan bazıları ticari bakımdan önemlidir.
Dişçilikte kullanılan gümüş amalgam, başlıca cıva içerir. %70
Hg, %20 Sn, %30 Cu, %1 Zn dan oluşmuştur.
Amalgam yapmayan bir kaç metalden biri demirdir. Cıva
genellikle demir kaplarda saklanır ve taşınır.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Duralümin :
Mekanik direnci yüksek, hafif alüminyum alaşımıdır.
Bileşiminde %4 bakır, %0,7 manganez, %1 magnezyum, %0,5
silisyum ve az miktarda demir bulunur. Alüminyumun en çok
kullanılan alaşımıdır. Dökme levhalar ya da profil hâlinde,
klasik usullerle soğukta ya da 400°C dolayında işlenebilir. Isıl
işleme tutulabilen ilk alaşımdır. Oda sıcaklığında üç-dört gün
bırakıldığında sertliği artar.
Başlıca çeşitleri, çelik üstüne sürtmeye ve aşınmaya dirençli
nikelli duralümin, yapımı özen gerektiren süperduralümin,
işlendiği zaman mekanik direnci yüksek olan kromlu
duralümin ve yine aşınmaya karşı yüksek dirençli ve
kaynaklama işlemlerini kolaylaştıran vedaldir.
Duralüminin; uçak, otomobil, gemi sanayiinde, ayrıca
fotoğrafçılık, spor malzemeleri, ev eşyaları ve kimya sanayii
gibi kullanım alanları vardır.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Nikrom:
Saf nikel özellikle sağlamlığı nedeniyle kullanılır. Kimyasal etkenlerden (pas)
etkilenmez, hava değişimlerinden bozulmaz. Bu özelliği yüzünden nikel, birçok
alaşım türünün yapımında aranan bir elemandır. Bu alaşımlardan bazılarında
yüksek oranda nikel bulunur.
Nikrom; bunlar az genleşir, yüksek ısılara dayanır ve deniz suyundan et­kilenmez.
Bazı alaşımlar da çelik esasına dayandırılır. Nikelkromlu çelikler, hiç
oksitlenmediklerinden, sanayide pek çok yerde kullanılır.
Birçok sanayi dalında bir nikel tuzunun elektrolitik ayrışmasıyla madenî parçalar
nikelle kaplanır. Nikel kaplama yöntemi 1841′de Ruolz tarafından icat edilmişti.
Nikelaj özellikle otomobillerin çelik parçalarının süslenmesinde ve ev âletlerinin
yapımında kullanılır. Aşındırıcı ortamlara girecek bütün eşya için, kromajdan önce
de genellikle nikelaj işlemine başvurulur.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
Konstantan alaşımı:
Konstantan alaşımı, sıcaklıkla direnci değişmeyen
alaşım olarak, özellikle ölçme cihazlarında tek
başlarına yada bakır-konstantan, demir-konstantan
gibi termoçift ( Bimetal ) olarak kullanılırlar.
Ayrıca, pahalı termoelemanlarda da dengeleme
iletkeni olarak bu malzemeden yararlanılır.
Bakır-nikel alaşımlarının diğer kullanım yerleri,
madeni para yapımı, vitrin, süs eşyası, gümüş
kaplanacak parçalar gibi dekoratif amaçlıdır.
3.3.1.Yaygın alaşımların özellikleri, bileşimleri ve kullanım alanları
ALAŞIM
BİLEŞEN (%)
Saçma, mermi 99.5 Pb, 0.5 As
ÖZELİKLERİ
KULLANIM ALANLARI
Esnekliği, sertliği ve şok direnci Asma köprü yapımında
yüksektir.
Korozyon direnci yüksektir.
Mutfak malzemesi
Eriyince yuvarlak damla
Saçma ve mermi yapımı
oluşturur.
Matbaa
metali
82 Pb, 15 Sb, 3 Sn
Kolay dökülür, zor aşınır.
Malgamalar
Hg+SnCu, Ag, Au
Plastik özellik gösterir, zamanla Metal elde etmek ve diş dolgusunda
katılaşır.
Britanya
metali
Lehim
93 Sn, 5Sb, 2 Cu
Gümüş parlaklığına sahiptir.
Süs eşyasında
Düşük sıcaklıklarda erir.
Metalleri birleştirmekte
Duralumin
60 Sn. 40 Pb
94 Al, 4 Cu, 1 Mg, 1
Mn
Sert ve dayanıklı
Uçak endüstrisinde
Mağnalyum
90 Al, 10 Mg
Sert ve dayanıklı
Uçak endüstrisinde ve kaplamacılıkta
Pirinç
Bronz
65 Cu, 35 Zn
82 Cu. 16 Sn. 2 Zn
Kolay işlenir.
Kolay dökülür.
Elektrik malzemesi imalinde
Madalya ve heykel yapımında
Alman
gümüşü
50 Cu, 25 Ni, 25 Zn
Korozyona dayanıklı, güzel
görünümlü ve kolay işlenebilir.
Sofra takımı, süs eşyası, müzik ve
dişçilik aletleri.
Nikel para
75 Cu. 25 Ni
Sert yapılı ve kozyona dayanıklı. Parada
Nikel çeliği
94 Fe. 6 Nİ
Krom çeliği
85 Fe, 3 Si, 3 Cr
Harf dökümünde
Alaşımların üretilme amacı ve tarihçesi
Alaşımlar, uygulamaların gerektirdiği fiziksel özelliklere sahip malzemelerin üretilmesi
amacıyla oluşturulmaktadır. Bu konu Metalurjide önemli bir konudur. Bu gün bu husustaki
çalışmalar hayli mesafe kat etmiştir.
Yüksek sıcaklıklar, aşınma, kimyasal etkiler, metal yorgunluğu … vb. gibi her türlü etkilere saf
metallerin yetersiz kaldığı durumlarda, gerekli olan özellikleri sağlayan niteliklerde alaşımlar
kullanılır. Örneğin; demirin sertliğinin yeterli olmadığı uygulamalarda, daha sert yapıdaki
demir alaşımları olan çelikler kullanılır.
En bilinen alaşımlara; tunç (bakır-kalay), pirinç (bakır-çinko), lehim (kalay-kurşun) ve cıva
alaşımları olan amalgamlar örnek verilebilir.
Alaşımların tarihi milattan önce 4. bin yıllara kadar uzanmaktadır. İran ve Mezopotamya
bölgelerinde bulunan tunç (bronz) örnekleri bu zaman diliminde tarihlenmiştir. Demirden
daha sert olan tunç; silah, kesici ve delici aletler, mutfak aletleri, süs eşyaları vb. yapımında
günümüze değin kullanılagelmiştir.
Yapılan arkeolojik çalışmalarda Çin'in Sincan bölgesinde M.Ö. 1000 yıllarına ve Hindistan'ın
Merkez Ganj Vadisi ve Doğu Vindhyas bölgesinde M.Ö. 1800 yıllarına tarihlenen çelik
buluntulara rastlanmıştır. Söz konusu buluntular çelik kullanımının en az 3000 yıllık bir
tarihinin olduğunu belgelemektedir. Tunça göre daha sert ve dayanıklı olan demir-karbon
alaşımı çelik çeşitli araç gereç yapımında yaygın olarak kullanılmıştır.
Alaşımlar ve özellikleri
Alaşımlar, yoğun olup maden parlaklığında, ısı ve elektriği iletirler.
Alaşımların bazıları beyazdır. Fakat bakır ve altın gibi renkli madenler yeteri miktarda
bulunursa alaşımlar renklidir.
Genel olarak alaşımlar, kendini teşkil eden maddelerden daha sert, fakat daha az levha
haline gelebilir ve dayanıklıdırlar. (Çok fazla levha ve yaprak haline gelebilen altın, antimon
veya kurşun ile karıştırıldığı zaman sert ve kırılabilir. Bakırda, kalayla birleştiği zaman levha
haline gelebilme özeliğini kaybeder.)
Alaşımlarda her iki metal, hem katı hem de sıvı halinde birbiri içerisinde ergimiştir.
Metaller birbiri içerisinde erimezler. Bu takdirde alelade bir karışım meydana gelmiştir. Bu
alaşım mikroskop altında iki çeşit kristal gösterir. Kurşun-Antimon alaşımı gibi.
Alaşım kristali, her iki atom sayıları oranında ihtiva eder. (Sodyum malgaması, Bakır-Çinko
alaşımı, Alüminyum-Bakır alaşımı, Demir- Karbon alaşımı gibi. Fakat bu şekildeki alaşımlar
teknik bakımdan kullanılmaya elverişli değildir. Çünkü bunlar çok kırılıcıdır.)
Alaşımlar genellikle kendilerini meydana getiren metallerden daha az aktiftirler. Örneğin,
sodyum malgaması suyu daha yavaş ayrıştırır. Halbuki sodyum suya çok kuvvetli etki yapar.
Alaşımlar ve özellikleri
•
•
•
Alaşımlar, yapılarına giren (az eriyebilen) madenlerden daha fazla ve daha kolaylıkla eriyebilir.
Mesela, kurşun 335 0 C, bizmut 264 0 C, kalay 228 0 C eridiği halde Bi ,Pb, Sn kısımlardan ibaret
olan alaşım 94,5 0 C de erir.
Elektronik endüstrisinde kullanılan lehim,kalay ve kurşun değişik oranlarda karıştırılmasıyla elde
edilen bir metal alaşımdır.
Sn 63 lehimi dendiği zaman; % 63 Kalay, % 37 Kurşun içeren alaşım olduğu anlaşılır.
Tüm lehim alaşımları ( Sn 63 ) hariç erime noktası belirli bir alt sıcaklıkta başlar ve belirli bir üst
sıcaklıkta biter. Bu bölgeye plastik bölge denir.
Örnek : Sn 50 lehimi için ; Erimenin başladığı nokta = 183 C, Erimenin tamamlandığı nokta = 216 C
Yani Sn 50 lehimi 33 C’lik bir plastik bölgeye sahiptir.
Sn 63 lehimi için ;
Erimenin başladığı nokta = 183 C
Erimenin tamamlandığı nokta = 183 C
Yani Sn 63 lehimi yaklaşık 0 C ’lik bir plastik bölgeye sahiptir. Bu tür lehimlere öteklik lehim denir.
Alaşımların Kimyasal Özellikleri
•Alaşımlar, alaşımları teşkil eden maddelerden daha az oksitlenebilen ve asitlerden daha az
etkilenebilen karışımlardır.
•Uçabilen bir madeni bulunan alaşımları ısı analiz eder. Bundan altın ve gümüş elde etmekte
faydalanılır. Altın veya gümüş tozu önce cıva ile karıştırılır. Güderiden süzülerek cıvanın fazlası
çıkarılır ve sonra alaşım ısıtılarak uçabilen madde ayırt edilir.
•Genel olarak oksijen, alaşımlar üzerine etki eder. Bu halde madenden biri bir asit oksidi,
diğeri, bir baz oksidi yapar. İşte bunun içindir ki kalay ve kurşun, antimon ve potasyumdan
ibaret alaşımlar alevle yanar. Bazı madenler kimyaca birleşmişler ve birtakım alaşımlar
yapmışlardır.
•Mesela; (Sodyum cıva malgaması),(Bakır çinko),(Alüminyum bakır),(Demir karbon)
bileşikleridir. Fakat bu alaşımların teknikte kullanılmaları elverişli değildir. Çabuk kırılabilirler.
Bu alaşımlar belirli oranlar kanununa göre teşekkül etmişlerdir.
•Alaşımların mikroskopla incelenmelerine gelince; bir alaşımın parlak yüzeyi üstüne asitler
veya bazı kimyasal ayıraçlar dökülürse alaşımda muhtelif renkler görülür. Etkimeler birbirinden
farklıdır. Madenin cinsine göre çeşitli irili ufaklı çukurlar meydana gelir eski şekliyle
karşılaştırılır. Mikroskopta incelenir ve fotoğrafı alınır.
Büyük Patlama Teorisine göre Büyük Patlamadan
sonra oluşan ilk element hidrojendir. Bu sebeple
hidrojen, evrende en çok bulunan elementtir.
Hidrojenin evrendeki bolluğu % 91 olmasına
rağmen, dünyadaki bolluk oranı çok daha azdır.
Bunun nedeni, hidrojen atomlarının çok hafif
olmasıdır. Bu sebeple hidrojen atomları çok
yüksek ortalama hıza sahiptirler ve Dünyanın yer
çekiminden kolaylıkla kurtulabilirler. Yeryüzünde
bulunan hidrojenin büyük bir kısmı bileşikler
halindedir. En önemli bileşiği de sudur. Hidrojen,
karbonla hidrokarbonları oluşturur. Hidrokarbonlar;
kömür, doğal gaz ve petrolün bileşiminde bulunur.
IV.BÖLÜM:HİDROJEN ELEMENTİ
3.BÖLÜM
KONU BAŞLIKLARI
KAZANIMLAR
4. Hidrojen elementi ile ilgili olarak öğrenciler;
4.1.Hidrojen elde etme
yöntemleri,
4.1. Laboratuarda ve endüstride hidrojen elde etme
yöntemlerini karşılaştırır.
4.2. Hidrojen izotopları ve
kullanım alanları,
4.2. Hidrojen izotoplarını tanır ve kullanım alanlarına
örnekler verir.
4.3. Hidrojenin kimyasal ve fiziksel 4.3. Hidrojenin kimyasal ve fiziksel özellikleriyle
özellikleri ve kullanım alanları,
kullanım alanlarını ilişkilendirir.
4.4. İkincil enerji kaynağı olarak
hidrojenin önemini, maliyet
ve sağlıklı çevre
4.4. İkincil enerji kaynağı olarak hidrojenin önemini,
maliyet ve sağlıklı çevre bakımından irdeler.
4.1.Hidrojen elementi ve hidrojenin elde etme yöntemleri,
4.1. Hidrojen
Evrende en bol bulunan hidrojen, dünyada 15. sırada yer alır.
Hidrojenin protonyum, döteryum ve trityum olmak üzere üç
izotopu vardır. İzotopların bollukları, sırasıyla, %99.98 , %0.016 ve
%I 0-16 dır. Bu, doğal hidrojenin büyük ölçüde protyumdan ibaret
olduğunu gösterir.
Yalnızca bir proton ve bir elektrona sahip olan hidrojen, periyodik tabloda 1A grubunda
gösterilir. Bu gösterimin nedeni, alkali metaller gibi s orbitalinde bir tane değerlik elektronuna
sahip olması ve sulu çözeltilerinde hidroliz olabilen tek yüklü iyon (H+1) oluşturmasıdır.
Bir ametal olan hidrojen, bazı özellikleri bakımından halojenlere de benzer. Örneğin NaH ve
CaH2 gibi iyonik bileşikler oluşturabilir ve bu bileşiklerde halojenler gibi tek negatif yüklü iyon
(hidrür, H) oluşturur.
Hidrojen, renksiz, kokusuz, tatsız ve zehirsizdir. Hidrojen saf haliyle ve oda sıcaklığında iki
atomlu bir gaz olarak bulunur. Havanın yoğunluğundan 14 kat daha az yoğunluğa sahip olan
hidrojen, havanın içinde hızla yayılır. Hidrojenin sıvı hâle getirilmesi için -253 °C'a kadar
soğutulması gerekir. Bu işlem yüksek enerji gerektirir.
4.1.1. Hidrojenin Laboratuarda Eldesi;
Aktif metallerin (1A grubu metalleri ve
Ca, Sr, Ba) oda sıcaklığında suyla
tepkimesinden H2 gazı elde edilir
Na (k) +H 2 O (s) NaOH (aq) +1/2H 2(g)
Aktif (Mg, Al, Mn, Zn, Cr, Fe, Cd, Ca, Ni,
Sn ve Pb) metallerin asitlerle
etkileşiminden elde edilir.
Al(k) +3H 2SO 4(aq) Al2 (SO 4 )3(k) +3H 2(g)
Zn(k) +2HCl(aq) ZnCl2(k) +H2(g)
NaBH 4(k) +2H 2 O (s) NaBO 2(aq) +4H 2(g)
Sodyum hidrür ve Sodyum
borohidrürün (NaBH4) su ile
tepkimesinden H2 gazı elde edilir.
Sodyum borohidrürün (NaBH4) su ile
tepkimesinden H2 gazı elde edilir.
NaH (k) +H 2 O (s) NaOH (aq) +H 2(g)
Anot: H 2O(s) 1/2O 2(g) 2H + +2e Katot:2H + +2e- H 2(g)
elektroliz
H 2O
2H 2(g) +O 2(g)
4.1.1. Hidrojenin Endüstride Eldesi;
Kızıl dereceye kadar ısıtılan metallerin (Fe, Mg) üzerlerinden su buharı geçirilerek hidrojen
elde edilebilir. Bu yöntemde genellikle hurda demir kullanılır.
3Fe(k) +4H 2O (g) Fe3O 4(k) +4H 2(g)
Daha önceleri endüstride kok ile su buharı etkileştirilerek hidrojen üretilirdi. Su gazı
tepkimesi olarak adlandırılan bu tepkimede oluşan H2 (g) ve CO(g) karışımına sentez gazı
veya su gazı denir.
1000 C
C(k) +H2O(g)
H2(k) +CO(g)
0
Günümüzde yaygın olarak kullanılan yöntemde, metan içeren doğal gaz yüksek sıcaklıkta su
buharı ile katalitik olarak etkileştirilir.
Ni/700-1000 C
CH4(g) +H2O(g)
3H2(k) +CO(g)
0
Ni/
C2H6(g) +2H2O(g)
5H2(g) +2CO(g)
Su gazı kaydırma tepkimesi, yaklaşık 400°C'de kendiliğinden yürür. CO2'nin kimyasal
yöntemlerle uzaklaştırılmasıyla %99 saflıkla H2 gazı elde edilir.
400 C
CO(g) +H2O(g)
H2(k) +CO2(g)
0
4.2. Hidrojen izotopları ve kullanım alanları,
Hidrojenin protyum, döteryum ve trityum olmak üzere üç izotopu vardır. İzotopların
bollukları, sırasıyla, %99.98 , %0.016 ve % 10-16 dır. Bu, doğal hidrojenin büyük ölçüde
protyumdan ibaret olduğunu gösterir. Trityum radyoaktiftir ve β- bozunmasına uğrar.
3
1
H 23 He + -10 -
1
0
n 11 p + -10 -
Bu tepkimenin yarılanma ömrü 12.35 yıldır. β- bozunmasında bir nötron, proton
ve elektrona dönüşür.
Atmosferde trityumun bulunması, kozmik ışınlarının neden olduğu çekirdek
tepkimelerinin bir sonucudur.
14
7
Kozmik Işınlar
N+ 01 n
126 C + 31 H
Bir nükleer reaktörden çıkan nötronlar lityum üzerine gönderilerek trityum
üretilir.
6
3
Li+ 01 n 42 He + 31 H
4.2. Hidrojen izotopları ve kullanım alanları,
İZOTOP
BOLLUK %
KÜTLE
NUMARASI
EN (K)
KN(K)
BAĞ ENERJİSİ
(kj mol-1)
Hidrojen
99.98
1.0078
13.96
33.19
435.9
Döteryum
0.016
2.0141
18.73
38.15
443.3
Tridyum
10-16
3.0160
20.62
40.6
446.9
Hidrojen izotoplarının kütleleri arasındaki büyük fark, kimyasal ve fiziksel farkları daha kolay
gözlenebilir kılmaktadır. Bu olgu, izotop etkisi olarak bilinir.
Bağ Kuvvet
Sabitleri
Bağ Titreşim
Frekansları
H2
5.70
4395
HD
5.73
3817
D2
5.74
3118
izotop
H2, HD ve D2 moleküllerinin bağ kuvvet
sabitleri birbirine oldukça yakın olmasına
karşın, bağ titreşim frekansları arasında
büyük
farklar
vardır.
Titreşim
frekanslarındaki bu farklar, izotop kütleleri
arasındaki farktan kaynaklanmaktadır.
4.2. Hidrojen izotopları ve kullanım alanları,
•Hidrojen zehirsiz ve havadan 14,4 kez daha hafif bir gazdır bu sebeple kullanım alanı oldukça
fazladır.
•Güneş ve diğer yıldızların termonükleer tepkimeyle vermiş olduğu ısının yakıtı hidrojen olup,
evrenin temel enerji kaynağıdır.
•Hidrojen bilinen tüm yakıtlar içerisinde birim kütle başına en yüksek enerji içeriğine sahiptir
(Üst ısıl değeri 140,9 MJ/kg, alt ısıl değeri 120,7 MJ/kg). 1 kg hidrojen, 2,1 kg doğalgaz veya
2,8 kg petrolün sahip olduğu enerjiye sahiptir.
•Petrol yakıtlarına göre ortalama 1,33 kat daha verimli bir yakıttır.
•Isı ve patlama enerjisi gerektiren her alanda kullanımı temiz ve kolay olan hidrojenin yakıt
olarak kullanıldığı enerji sistemlerinde, atmosfere atılan ürün sadece su ve/veya su buharı
olur. Bunun dışında çevreyi kirleten hiçbir gaz ve zararlı kimyasal madde üretimi olmaz.
•Döteryum ve bileşikleri; döteryum lambalarında, nükleer reaktörlerde karanlıkta
soğutma/nötron yavaşlatma sistemlerinde ve bilimsel araştırmalarda (kimyasal tepkimelerde
radyoaktif olmayan etiketlemelerde), çözücü olarak kullanılır.
•Trityum kendi kendine ışık veren nesnelerin yapımında da kullanılır. İç yüzeyi fosforla
kaplanmış borosilikat camlarının içine yüksek basınçta trityum gazı konulur. Trityum, düşük
seviyeli beta ışıması yapar. Fosfor bu ışıma sayesinde ışığa ihtiyaç duymaksızın 12,43 yıl ışık
verebilir. Bu yöntemle kendinden ışıldayan yazı ve işaretler (saat, trafik işaretleri gibi)
yapılabilir. Ayrıca trityum nükleer füzyon sistemlerinde de kullanılır.
4.3. Hidrojenin kimyasal ve fiziksel özellikleri ve kullanım alanları,
Normal şartlarda elementel hidrojenin kararlı hali, IUPAC tarafından dihidrojen
olarak adlandırılan H2 dir. Hidrojen molekülünün, yüksek bağ enerjisi ve aktivasyon
enerjisi nedeniyle, birçok element ile verdiği tepkimeler yavaştır. Bazı özel
koşullarda H2'nin tepkimeleri oldukça hızlıdır.
a. H–H bağının bir metal yüzeyinde ya da bir kompleks ile homolitik bölünmesi:
Homolotik bölünme, bağ elektronlarnın atomlar tarafından eşit paylaşımı sonucu
bağın kırılmasıdır. H–H bağı için homolotik bölünme ;
H-H H + H kısaca H 2 2H
şeklinde gösterilebilir.
Gaz fazında gerçekleşmesi için gerekli enerji, H–H bağının ayrışma enerjisidir.
4.3. Hidrojenin kimyasal özellikleri;
platin metalinin yüzeyinde
homolitik bölünme
Bir kompleks ile tepkimesinde
homolitik bölünme
Platin yüzeyinde H2'nin homolitik bölünmesi, alkenlerin hidrojenlenmesinde platinin neden
katalizör olarak kullanıldığını açıklar.
Platin bu özelliğinden dolayı H+ nin H2'ye indirgenmesinde elektrot olarak kullanılır. Platin
elektrotta H2, oluşumu için aşırı potansiyel oldukça düşüktür. Ayrıca platin yüzeyi Holuşumuna yatkındır.
oluşan komplekste hidrojen H- halindedir. H2 katılmasıyla iridyumun yükseltgenme basamağı
(+1) den (+3)'e yükselmektedir. Böyle tepkimelere yükselltgen-katılma tepkimeleri denir.
4.3. Hidrojenin kimyasal özellikleri;
H2 molekülü σ-moleküler orbitaldeki
elektron çiftini metale verirken aynı
anda metalden bir çift elektron σmoleküler orbitaline almaktadır.
Diğer bir anlatımla, H2 ile metal
arasındaH2'nin σ-moleküler orbitali ile
metalin
boş
d
orbitalinin
örtüşmesinden σ bağı, H2'nin boş
orbitali ile metalin dolu d orbitalinin
örtüşmesinden ¶ bağı oluşmaktadır.
4.3. Hidrojenin kimyasal özellikleri;
b. H bağının bir yüzeyde veya bir metal iyonu ile heterolitik bölünmesi:
Heterolitik bölünme; bağ elektronlarını bir atomun alması sonucu bağın kırılmasıdır. Çinko
oksit yüzeyinde H2 heterolitik olarak bölünür.
heterolitik bölünme
H 2
H + +H -
Zn veya Cu katalizörlüğünde H2 ve CO'dan metil alkolün
sentezlenmesinde, H—H bağının heterolitik bölünmesi rol
oynamaktadır.
Zn/Cu
CO(g) +2H2(g)
CH3OH
H—H bağının heterolitik bölünmesiyle ilgili bir
diğer örnek, bakırın hidrometalurjik indirgenme
tepkimesidir:
H2 +Cu +2 CuH+ H+ Cu+2H+
Hidrojeni hidrür olarak bulunduran CuH+,
bir ara ürün olup ömrü oldukça kısadır.
4.3. Hidrojenin kimyasal özellikleri;
Isı/Foton
Başlama: Cl2(g)
2Cl
İelrleme:Cl +H 2 HCl+H
H Cl 2 HCl+Cl
Sonlanma:H H H 2
:Cl Cl Cl 2
:H Cl HCl
Bir radikal ile H2'den hidrojen radikalinin
oluşturulması: Radikaller oldukça aktiftirler, bir
moleküle atak yaparak bağlanır ve molekülden
yeni bir radikal oluştururlar. Böylelikle bir radikal
zincirleme tepkimesi başlar. H2'nin oksijen ve
halojenlerle
tepkimesinde
radikal
zincir
tepkimeleri çok yaygındır.
Örneğin, H2 ve Cl2'den HCI'yi sentezlemek için
önce ısı ya da fotonla (fotokimyasal yolla) Cl—Cl
bağı homolitik olarak bölünür ve klor radikali
elde edilir. Bu aşama radikal zincir
tepkimelerinde başlatma olarak bilinir.
Klor radikali H2'ye atak yapar ve H2'den hidrojen radikalini oluşturur. Bunu,
hidrojen radikalinin CI2'den klor radikalini oluşturması izler. Böylelikle hem radikal
hem de HCI oluşumu zincirleme olarak devam eder.
4.3. Hidrojenin kimyasal özellikleri;
Hidrojenin ikili Bileşikleri (Hidrürler) :
Hidrojen, hemen hemen periyodik tablodaki tüm elementlerle ikili bileşikler
oluşturur. Alkali ve toprak alkali metallerle oluşturduğu ikili bileşiklerde hidrojen (-1)
yükseltgenme basamağındadır. Yani, bu bileşikler H- (hidrür) iyonu içerir. Hidrür
teriminin bu bileşikler için kullanılması daha uygun olmakla birlikte, çoğu
kaynaklarda hidrojenin tüm ikili bileşikleri hidrürler olarak tanımlanmaktadır.
Hidrürler iyonik, moleküler (kovalent), metalik ve ara hidrürler olmak üzere dört
grupta toplanabilir.
4.3. Hidrojenin kimyasal özellikleri;
İyonik Hidrürler :
Hidrojenin, berilyum ve magnezyum dışında, alkali ve toprak alkali
metallerle oluşturduğu ikili bileşikleridir. Alkali ve toprak alkali metal
hidrürleri, sırasıyla, MH ve MH2, şeklinde formüle edilebilir. Bu
bileşiklerde hidrojen H- halindedir.
iyonik hidrürler, iyonik katıların karakteristik özelliklerini gösterirler:
a. Normal koşullarda katı halde bulunurlar ve elektriği iletmezler.
b. Erime ve kaynama noktaları yüksektir.
c. Erimiş halde iletkendirler.
d. LiH dışında, apolar ve organik çözücülerde çözünmezler.
Na (k) +1/2 H 2 NaH H f =-57 kJmol-1
0
Cs (k) +1/2 H 2 CsH H f =-83 kJmol
0
Mg (k) + H 2 MgH 2
Ca (k) + H 2 CaH 2
-1
H f =-76,1 kJmol -1
0
H f =-189,1 kJmol -1
0
MgH2 bir ara hidrürdür. H-Mg-H
bağındaki kovalent karakter
nedeniyle açığa çıkan enerji değeri
beklenenden düşüktür.
4.3. Hidrojenin kimyasal özellikleri;
İyonik hidrürlerin eriyiklerinin elektrolizi:
İyonik hidrürlerin eriyikleri
elektroliz edildiğinde katotta
metal, anotta H2 gazı açığa
çıkar.
Bu,
iyonik
hidrürlerde
hidrojenin
hidrür
halinde
bulunduğunun denel kanıtıdır.
Elektroliz
MH (s)
M (k) +1/2 H 2
Elektroliz
MH 2(s)
M (k) + H 2
NaH (s) +H 2 O (s) Na + (k) +OH - (aq) + H 2
CaH 2(s) +2H 2O (s) Ca +2 (k) +2OH - (aq) +2H 2
4.3. Hidrojenin kimyasal özellikleri;
Metal hidrürlerin çözeltileri tepkimeleri oldukça şiddetlidir. Çok ince öğütülmüş NaOH
nemli hava ile temas ettiğinde tutuşabilir. Böylesi yangınları söndürmek güçtür. Çünkü
kızgın metal hidrürleri ile temas eden CO, bile indirgenir. Böyle yangınları söndürmede
silisli kum kullanılır.
Eser miktarda su bulunduran çözücülerde suyu uzaklaştırmak için ucuzluğu nedeniyle
genellikle CaH, tercih edilir. İyonik hidrürler güçlü indirgen olarak davranırlar.
Eser miktarda su bulunduran çözücülerde suyu uzaklaştırmak için ucuzluğu nedeniyle
genellikle CaH, tercih edilir. İyonik hidrürler güçlü indirgen olarak davranırlar.
NaH (s) + S Na 2S+ H 2
Dietil eter çözücüsünde NaH ile B(C2H5)3'ün etkileşmesinden, H- kaynağı olan bir
hidrür kompleksi oluşur.
NaH+B(C 2 H5 )3 Na HB(C 2 H5 )3
4.3. Hidrojenin kimyasal özellikleri;
Moleküler (Kovalent) Hidrürler : Hidrojen ile moleküler hidrür oluşturan elementler;
B,C,N,O,F,Si,P,S,Cl,Ga,Ge,As,Se,Br,Sn,Sb,Te,I,Pb,Bi,Po,At dir. Moleküler hidrürler normal koşullarda ya gaz ya da
uçucu sıvı halde buluntular. M-H bağının kovalent karakteri yüksektir ve bu nedenle, bağ elektronlarının
ortaklaşa kullanımı daha baskındır.
Moleküler hidrürler, oktet kuralına göre üç grupta toplanabilir:
a. Oktedini Tamamlamamış Hidrürler: Bu gruba giren hidrürlere bor ve
galyum hidrürleri örnek verilebilir. Bir merkezi atomlu moleküller (BH3 gibi)
oktedini tamamlamadığından, kararsızdır ve dimer yapıda bulunurlar. Şekilde
görüldüğü gibi, diboranın iskeletini kurmak için gerekli değerlik elektron sayısı
16 dır. Oysa, dimer yapı 14 değerlik elektronu içerir. Bu nedenle böyle yapılara
elektronca yoksun yapılar denir.
b. Oktedini tamamlamış hidrürler: IVA Grubu hidrürlerinde merkezi atomun
tüm değerlik elektronları bağlanmaya girmiştir. Yapıları tetrahedral olup,
apolar moleküllerdir. Bilindiği gibi, bu hidrürlerde moleküllerarası tek
etkileşim, anlık dipol-indüklenmiş dipol (London) etkileşimidir. VA Grubu
hidrürlerde bir elektron çifti, VIA Grubu hidrürlerde iki elektron çifti ve VIIA
Grubu hidrürlerde üç elektron çifti merkezi atom üzerinde bulunmaktadır.
Tüm bu hidrürlerin molekülleri polardır. Moleküller arasında London
etkileşimine ilaveten dipol-dipol etkileşimi söz konusudur.
Azot, oksijen ve flor elementlerinin hidrürleri arasında ayrıca kuvvetli
hidrojen bağları oluşmaktadır. Oktedini tamamlamış hidrürlerin elektronnokta yapıları ve geometrik yapıları Şekilde gösterilmiştir.
4.3. Hidrojenin kimyasal özellikleri;
c. Oktedini aşan hidrürler: VA Grubunun 3. ve daha alt periyotlarındaki bazı elementlerin
oluşturduğu hidrürlerdir. Merkezi atom, beş hidrojene kovalent bağlıdır. Bunun en iyi bilinen
örneği, PH5'tir . Yapısı üçgen bi piramidal olup, apolar bir moleküldür.
Ara Hidrürler
Ara hidrürler, iyonik hidrürler ile moleküler (kovalent) hidrürler arasında özelliklere
sahip hidrürlerdir. Tümü LiH'den daha fazla, diborandan daha az kovalenttir. Yapıları
genellikle polimeriktir. Bu yapılarda birimler, hidrojen köprüleri ile birbirine bağlıdır.
Ara hidrürleri oluşturan elementler Be,Mg;Cu,Ag,Au;An,Cd,Hg;In elementleridir.
Metalik (Stokiyometrik olmayan) Hidrürler :
Birçok geçiş metali, hidrojen ile bir katı çözelti oluşturur. Böyle bir çözeltide hidrojen atomları
metalik kristalin boşluklarında bulunur. Metal atomları ile hidrojen atomları arasında
stokiyometrik bir ilişki mevcut değildir. Böyle hidrürlere metalik hidrür denir. Metalik
hidrürlerde, metal atomu başına düşen hidrojen atomu sayısı hidrürün hazırlanma koşullarına
göre değişmektedir. MHx ile gösterilen metalik hidrürlerde x, genellikle bir tam sayı değildir.
Örneğin, H2 atmosferinde ısıtılan toz halindeki titanyum TiH1,26, paladyum ise PdH0,7 'den
PdH 0,8 'e değişen hidrürler oluşturur.
4.3. 2.Hidrojenin kimyasal kullanım alanları,
1. Hidrojen, metalürjide indirgen olarak kullanılır. Metal oksitlerini metale indirger. Bu
tepkime sonucunda hidrojen, oksijenli bileşiklerle etkileşerek su oluşturur. Çevreye
zarar vermeyen ürün oluşturması hidrojenin olumlu özelliklerinden biridir.
CuO(k) +H 2(g) Cu (k) +H 2O(s)
FeO(k) +H2(g) Fe(k) +H 2O(s)
2. Hidrojen, anorganik kimya endüstrisinde amonyak sentezinde kullanılır. Amonyak sentezi,
N2 ile H2'nin yüksek sıcaklık ve basınç altındaki katalizörlü tepkimesiyle oluşur. Elde edilen
NH3 gübre ham maddesi olarak kullanılır.
N2(g) +3H2(g) 2NH3(g)
Fe,380 0C ve200 atm
3. Besin endüstrisinde sıvı yağlardan margarin elde edilmesinde hidrojen kullanılır.
Doymamış hidro karbonların doyurulması ,
200 C ve 30 atm, Ni veya Pt
C2 H4(g) +3H2(g)
C2 H6(g)
0
4.3. 2.Hidrojenin kullanım alanları,
4. Yakıt olarak kullanılır:
Hidrojen gazı çelik tanklarda depolanır. Depolandığı tanktan sızabilir ve bir çatlak olması
durumunda çok hızlı boşalır. Hidrojen ortamdaki hava ile karışınca patlayıcı ve yanıcı bir hâle
gelir. Yanma olayında hidrojen gazı hemen yanar ve hızla yukarı doğru çıkar. Diğer yakıtlar ise
yanarken çevrelerinde tahribata yol açar. Hidrojenin oda sıcaklığındaki kimyasal aktivitesi çok
yüksek değildir. Havada tutuşturulduğu zaman soluk mavi bir alevle yanarak su verir.
2H2(g) +O2(g) 2H2O(g) H=-242,8 kJ mol-1
Hidrojen ile oksijen gazlarından yararlanarak yüksek sıcaklık elde etmeye
yarayan alete hidrojen hamlacı adı verilir. H2 ve O2 gazları, Hidrojen
hamlacı ağzına gönderilir ve burada karışım yakılır. Hidrojen metalleri
eriterek kaynak yapmaktadır. Burada oksijenin yanmasıyla oluşan alevin
sıcaklığı 2700 °C'a kadar çıkabilir.
4.4. İkincil enerji kaynağı olarak hidrojenin önemini, maliyet ve sağlıklı çevre
Endüstri devrimi ile 1750 yılından bu yana, ekonominin gelişmesi, peş peşe beş
ayrı dalgalanma biçiminde sürmüştür.
1750-1825 yılları arasındaki birinci dalgalanmanın başat enerji kaynağı kömürdür.
1825-1860 arasındaki ikinci dalgalanmada, ekonomiye ivme kazandıran elektrik
olmuştur.
1860-1910 yılları arasındaki üçüncü dalgalanmada elektrik etkisini sürdürmüş, ama
yeni kaynak olarak petrol ortaya çıkmıştır.
1910-1970 arasındaki dördüncü dalgalanmada ekonomiyi büyüten yeni enerji kaynağı
nükleer enerjidir. Nükleer enerji ucuz ve temiz enerji olması hasebiyle hala tüm
dikkatleri üzerine çekmeye devam etmektedir.
Hidrojen ise 21. yüzyıla damgasını vurmaya çalışılan bir enerji kaynağıdır. Ancak
eldesi, depolanması gibi zorluklar insanları bu çalışmalardan alıkoyan faktörlerden bir
kaçıdır.
Bununla beraber, hidrojen kullanım verimi yüksek bir yakıttır. Çevre dostudur.
Teknolojik gelişim, çevre etkisini de içeren efektif maliyetinin diğer yakıtlardan düşük
olmasını sağlar duruma gelmiştir.
4.4. İkincil enerji kaynağı olarak hidrojenin önemini, maliyet ve sağlıklı çevre
Hidrojen bir doğal yakıt olmayıp, birincil enerji kaynaklarından
yararlanılarak değişik hammaddelerden üretilebilen bir sentetik yakıttır.
Birincil enerji kaynaklarının, fiziksel durum değişimi içeren biçimde
dönüştürülmesi ile elde edilen ikincil enerjilere, "enerji taşıyıcısı" denir.
Hidrojenin kullanılmasını gerektiren başlıca iki neden vardır.
Birincisi, fosil yakıtların yanma emisyonu karbon dioksitin artmasından
kaynaklanan, global ısınmaya neden olan çevre sorunu.
İkincisi, petrol ve doğal gaz gibi akışkan hidrokarbonların bilinen
üretilebilir rezerv ömürlerinin gittikçe azalmasıdır.
Bununla beraber gelişmiş ülkeler hidrojen enerjisi kullanma yerine
güvenilir nükleer enerj santralleri kurarak daha temiz ve çevre dostu
enerji elde etme yollarını denemektedirler.
4.4. Hidrojen Üretimi, Depolanması ve Taşınması
Hidrojen üretiminde tüm enerji kaynakları kullanılabilmektedir.
1. Suyun direkt elektrolizi: Elektroliz için elektrik ihtiyacı, fosil yakıtlardan,
hidroelektrik kaynaktan, nükleer güçten, jeotermal enerjiden, güneş, rüzgar ve
deniz dalga enerjilerinden elde olunabilir. Gelecek için üzerinde en çok durulan
yöntem güneş enerjisinin kullanılmasıdır.
2. Suyun ısıl parçalanması (termal kraking): Suyun ısıtılarak (katalizörler
yardımıyla) bileşenlerine ayrılması dır.
3. Doğal gazın ve gaz hidrokarbonların buhar reformasyonu: Doğalgazın
bozunmasıyla hidrojen elde edilir.
4.Kömür gazifikasyon yöntemi: Termal gazifikasyon yüksek sıcaklıkta ve oksijenli
ortamda organik atıklardan sentetik gaz üretilmesi prosesidir. Gazifikasyon işlemi
kolaylıkla kükürtün elimine edilmesine olanak tanıdığından çekici bulunmaktadır.
Ortalama olarak 6 kg kömürden 3.785 lt benzine eşdeğer 1 kg hidrojen elde olunur.
4.Diğer yöntemler: Fotoelektrokimyasal, biyolojik ve biyokimyasal yöntemlerle de
hidrojen üretilmektedir. Ayrıca, denizlerde direkt güneş enerjisi çevrimi ile hidrojen
üretimi, uzay güneş güç istasyonlarının enerjisiyle hidrojen üretimi gibi yöntemler
üzerinde çalışılmaktadır.
4.4. Hidrojen Üretimi, Depolanması ve Taşınması
Hidrojenin depolama yöntemleri;
1.Tüplenmiş alçak basınçlı gaz (12 bar) biçiminde;
2.Tüplenmiş yüksek basınçlı gaz (150 bar) biçiminde;
3. Sıvılaştırılmış gaz (150 bardan yüksek) biçiminde;
4. Kriyojenik (dondurulmuş) (220 kPa) biçiminde;
5. Metalik hidrid biçiminde biçiminde;
6. Zeolit (gözenekli maddeler) ortamlarda depolanmaktadır.
Hidrojenin Taşınması;
1. Doğal gaz boru hatlarının gelecekte hidrojen taşınması için kullanılabileceği
düşünülmektedir.
2. Hidrojen gaz biçiminde boru hatlarıyla taşınabildiği gibi, yüksek basınçlı gaz ve
sıvılaştırılmış biçimde tankerlerle taşınabilmektedir.
3. Hidrojenin hidridlerle depolanması ve taşınması da önemle ele alınmaktadır.
Anlaşıldığı gibi hidrojen üretimi, depolanması ve taşınması beraberinde
önemli zorluklar getirmektedir. Bu zorluklar düşünüldüğünde nükleer enerjinin
önemi daha da anlaşılmaktadır. Bu sebeple ülkemizde de de diğer gelişmiş
ülkelerde olduğu gibi nükleer enerji çalışmaları başlamış ve davam etmektedir.
V.BÖLÜM: ALKALİ VE TOPRAK ALKALİ METALLER
1A grubu elementlerinin sem bolleri; H, Li, Na, K, Rb, Cs ve Fr
5.Alkali metalleri ile ilgili olarak öğrenciler;
KONU BAŞLIKLARI
KAZANIMLAR
5.1. Alkali metallerin doğal
kaynakları,
5.2. Alkali metallerin fiziksel
ve kimyasal özellikleri,
5.3. Alkali metallerin genel
elde edilişi yöntemleri,
5.4. Alkali metallerin
kullanım alanları,
5.5. Alkali metallerin önemli
bileşiklerinin, ad, formül ve
kullanım alanları,
5.1. Alkali metallerin doğal kaynaklarını sıralar.
5.2. Alkali metallerin fiziksel ve
kimyasal
özelliklerini açıklar.
5.3. Alkali metallerin genel elde ediliş yöntemlerini
örneklerle açıklar.
5.4. Alkali metallerin kullanım alanlarına örnekler
verir.
5.5. Alkali metallerin önemli bileşiklerinin, ad,
formül ve kullanım alanlarını listeler.
5.1.1. Alkali alkali metallerin doğal kaynakları,
Alkali Metaller: Alkali metaller doğada nispeten bol bulunurlar.
Bu elementlerin bazı bileşikleri tarih öncesi yıllardan beri bilinmekte
ve kullanılmaktadır. Alkali metal bileşiklerini sıradan kimyasal
yollarla bozmak zor olduğundan, bu elementlerin keşfedilmesi
zaman almıştır. Sodyum (1807) ve potasyum (1807) elektroliz ile
keşfedilmiştir. Sezyum (1860) ve rubidyum (1861) yayılma
spektrumlan ile yeni elementler olarak tanınmışlardır. Fransyum
(1939) aktinyumun radyoaktif bozunma ürünü olarak elde edilmiştir.
Önemli bir lityum kaynağı olan spodümen minerali LiAl(SiO3)2 dir.
Alkali metal bileşiklerinin çoğu suda çözündükleri için Li, Na ve K
bileşikleri (klorürler, karbonatlar ve sülfatlar) deniz suyundan elde
edilirler.
NaCl, KCl ve Na2CO3 gibi bazı alkali metal bileşikleri katı birikinti
halinde madenlerden çıkarılırlar. Sodyum klorür ayrıca deniz
suyundan da elde edilir.
Rubidyum ve sezyum, lityum yataklarının işlenmesi sırasında yan
ürün olarak elde edilirler.
Alkali metaller yüksek metalik karakterler göster diklerinden
elektrot potansiyelleri yüksek negatif değerlerdedir.
5.1.1. Alkali alkali metallerin doğal kaynakları,
Li: Magmatik kayalar (pegmatit)
Na: NaCI ( kaya tuzu ve deniz suyu), feldspat
(Na2O. Al2O3. 6SİO2)
K: Feldspat (K2O. Al2O3. 6SiO2), göl/deniz suyu,
güherçile (KNO3)
Rb ve Cs: Diğer alkali metal bileşiklerinde safsızlık
olarak bulunur.
5.2. 1. Alkali metallerin fiziksel ve kimyasal özellikleri,
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Alkali metallerin erime ve kaynama noktaları düşük olup, grupta aşağıya doğru inildikçe erime ve
kaynama noktaları daha da düşer. Sezyumun erime noktası o kadar düşüktür ki, sıcak günlerde sıvı
halde bulunabilir.
Bıçakla kesilebilecek kadar yumuşaktır. İlk kesildiklerinde yüzeyleri gümüş parlaklığındadır.
Diğer metallerin aksine, yoğunlukları ve erime noktaları oldukça düşüktür. Lityum, sodyum ve
potasyum yoğunlukları ilginç bir şekilde sudan daha küçüktür.
Atom çapları aynı periyotta bulunan diğer elementlerden daha büyüktür.
Elektrik akımını ve ısıyı iletirler.
Dış orbitaldeki tek elektronu kolaylıkla verip elektron sistemlerini asal gazlara benzeterek +1
değerlikli iyon (katyon) halinde bileşikler oluştururlar.
Alkali metal atomlarında elektronlar, çekirdekten uzakta olduklarından koparılmaları kolay,
iyonlaşma enerjileri düşük ve dolayısıyla en kuvvetli elektropozitif elementlerdir.
Işıklandırıldıklarında elektron yayabilirler. Bu sebepten potasyum ve sezyum foto-elektrik
hücrelerde kullanılırlar.
Tabiatta en bol bulunanları sodyum ve potasyumdur. Yer kabuğunda bulunan elementler içinde
altıncı ve yedinci sırayı alırlar. Lityum daha az bulunmasına rağmen, hemen hemen bütün kayalarda
az miktarda rastlanır. Rubidyum ve sezyum çok az bulunur. Radyoaktif bir element olan fransiyum
tabiatta hiç bulunmaz. Ancak nükleer reaksiyonlarla eser miktarlarda oluşabilir.
Alkali metaller tabiatta serbest halde bulunmazlar ancak bileşikleri halinde bulunurlar.
Alkali metaller, genellikle, eritilmiş tuzların elektroliziyle elde edilirler.
Alkali metaller, aleve tutulduklarında çeşitli renkler oluştururlar; Li, Na ve K tuzu çözeltisine
batırılmış bir platin tel, alevi sırasıyla; kırmızı, sarı ve menekşe renge boyar.
Alkali metaller su ile reaksiyona girip, hidrojen gazı verirler. Alkali metallerin su ile etkileşimi oldukça
şiddetlidir. Reaksiyonun şiddeti yukarıdan aşağı inildikçe artar.
5.2. 1. Alkali metallerin fiziksel ve kimyasal özellikleri,
Alev Renkleri : 1A metallerinin dış kabuk s ve p orbitalleri arasındaki enerji farkları, görünür
ışığın belli dalga boylarına karşılık gelir. Sonuç olarak, 1 A grubu metalleri alevde
ısıtıldıklarında karakteristik alev renkleri verirler.
NaCl(g) Na (g) +Cl(g)
Na (g) Na (g)
3s1
3p1
Na (g) Na (g) hv(589nm sarı)
Su ile tepkimeleri: 1A grubu elementleri suyla tepkimeye girerek metal hidroksitleri ve
hidrojen gazı oluştururlar
2Na (k) +2H 2O( s ) 2NaOH (aq) +H 2( g )
2K (k) +2H 2O( s ) 2KOH (aq) +H 2( g )
5.2. 1. Alkali metallerin fiziksel ve kimyasal özellikleri,
•Alkali metaller havayla temas ettiklerinde havadaki oksijenle birleşerek oksitlerini
oluştururlar. Lityum, oksijenle lityum oksidi oluşturur.
•Li dışındaki diğer alkali metaller oksit veya peroksit oluştururlar.
•Potasyum, rubidyum ve sezyum elementleri oksijenle oksit ve peroksit dışında süperoksit
de oluştururlar.
4Lİ(k) +O2( g ) Li 2 O(k) (oksit )
4Na (k) +O 2( g ) 2Na 2 O(k) (Oksit )
2Na (k) +O 2( g ) Na 2 O 2(k) ( peroksit )
4K (k) +O2( g ) 2K 2 O(k) (Oksit )
2K (k) +O2( g ) K 2 O 2(k) ( peroksit )
4K (k) +O2( g ) 2KO 2(k) ( Süperoksit )
5.3. Alkali metallerin genel elde edilişi yöntemleri,
Lityum ve sodyum erimiş klorürlerinin elektrolizinden elde edilirler.
elektr
2NaCl(s)
2Na (s) +Cl2(g) (600 °C de)
NaCl ün erime noktası 801 °C olup, elektrolizin ekonomik olması için fazla yüksek bir
sıcaklıktır. Karışıma CaCl2 katılarak erime noktası düşürülür. Elektrolizde kalsiyum metali de
oluşur, sıvı metal soğutulduğunda Na(s) dan çökerek ayrlır. Son ürün % 99,95 Na içerir.
Potasyum metali, erimiş KCl ün sıvı sodyum ile indirgenmesinden elde edilir.
850 c
KCl(s) Na (s)
NaCl(s) K (g)
0
Bu tepkime tersinirdir; düşük sıcaklıkta KCl(s) ün pek çoğu teplkimeye girmez.
Buna karşın, 850 °C de erimiş karışımdan K(g) un uzaklaştırılmasıyla denge sağa
kayar (Le Châtelier ilkesinin bir uygulaması) ve tepkime ileri yönde ilerletilir.
Rb ve Cs, Ca metalinin indirgen olarak kullanılmasıyla hemen hemen aynı
yoldan elde edilir.
5.4. Alkali metallerin kullanım alanları,
Lityum metali alüminyum ve magnezyum ile çok sert, düşük yoğunluklu alaşımlar verir. Bu
alaşımlar uzay araçları ve uçak endüstrisinde kullanılır. Lityumun yükseltgenmesi kolay
olduğundan ve küçük bir lityum kütlesi çok sayıda elektron verdiğinden, lityum metali pillerde
anot olarak gittikçe artan bir kullanıma sahiptir. Lityum pilleri, uzun ömürlü ve yüksek
güvenirliğe sahip pillerdir ve kalp pili gibi sık değiştirilmeyen durumlarda özellikle kullanışlıdır.
Cep telefonlarından, kameralarda ve dizüstü bilgisayarlarda kullanılan yeniden yüklenebilir,
çok yeni lityum pilleri lityum-iyon hücreleri olarak adlandırılırlar.
Sodyum metalinin indirgen olarak kullanıldığı en önemli alanlar, titan, zirkonyum ve hafniyum
gibi metallerin elde edilmesidir.
TiCl 4 4Na
4NaCl Ti
Sodyum metali nükleer reaktörlerde ısı transfer ortamı olarak da kullanılır. Bu amaç
için sıvı sodyum özellikle çok uygundur; çünkü erime noktası düşük, kaynama
noktası yüksek ve buhar basıncı düşüktür. Ayrıca ısı geçirgenliği ve özgül ısısı diğer
sıvı metallerin çoğundan daha büyüktür. Düşük yoğunluğu ve düşük viskositesi
kolay pompalanmasını sağlar. Sodyum, sodyum buharı lambalarda çevre
aydınlatılmasında yaygın bir şekilde kullanılmaktadır. Her lambada sadece birkaç
miligram Na kullanıldığından, bu uygulamada toplam olarak harcanan miktar
oldukça düşüktür.
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Halojenürler:
Alkali metallerin tümü halojenlerle şiddetli olarak, bazen patlayarak tepkimeye girer ve
iyonik halojenür tuzlarını oluştururlar. Bunların en önemlileri NaCl ve KCl dür.
Kimyasal maddelerin üretimi için tüm mineraller içinde en fazla sodyum klorür kullanılır. Bu
bileşik doğadan doğrudan doğruya elde edilir. Amerika Birleşik Devletlerinde yıllık kullanılan
sodyum klorür miktarı yaklaşık 50 milyon tondur. Tuz, mandıralarda et ve balığın
bozunmasını önlemede, yollarda buzlanmaya karşı ve su yumuşatıcılarmı yenilemede
kullanılır. NaCl, kimya sanayiinde sodyum metali, klor gazı, hidroklorik asit, ve sodyum
hidroksit gibi pek çok kimyasal maddenin eldesinde çıkış maddesidir.
Potasyum klorür doğal olarak oluşan tuzlu sulardan (tuzların derişik çözeltisi) elde edilir.
Bitki büyümesinde potasyum temel bir element olduğundan, KCl bitki gübrelemede oldukça
yaygın kullanılır. KOH, KNO3 ve sanayide önemli diğer potasyum bileşiklerinin elde
edilmesinde KCl den yola çıkılır.
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Karbonatlar ve Sülfatlar:
Li2CO3 dışında alkali metal karbonatlarının tümü ısıya dayanıklı bileşiklerdir. Gerçekte,
lityumu grubun diğer üyelerinden ayıran birkaç özelliği vardır:. Bunlar; Nitrür (Li3N)
oluşturabilmesi, karbonatının suda az çözünmesi ve yüksek sıcaklıkta oksidinin
karbonatından daha kararlı olmasıdır.
Bu yönden Li tümüyle Mg un özelliklerine benzemektedir. Bu benzerlik diyagonal ilişki
olarak adlandırılır. Böyle bir ilişki Be ve Al arasında ve B ve Si arasında da vardır.
Lityum karbonat manik-depresif hastalann tedavisinde kullanılır. Günlük doz olarak 1-2 g
Li2CO3, kandaki Li+ düzeyini litrede 1 milimol civarında tutar. Bu tedavi Na+ ve K+ ile Mg2+ ve
Ca2+ iyonlarının hücre zarından geçiş dengelerini etkiler.
Sodyum karbonat başlıca cam yapımında kullanılır. Birleşik Devletlerde üretilen Na2CO3
çoğunlukla doğal kaynaklardan gelir. Trona minerali, Kaliforniya'da kuru göl yataklarında ve
batı Wyoming'te uçsuz-bucaksız birikintilerde bulunur.
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Solvay Yöntemi:
Belçikalı kimyacı Ernest Solvay tarafından 1963’te bulunan bir yöntemle, başlıca
NaCl, CaCO3ve NH3 ten Na2CO3 aşağıdaki denklem gereği elde dilmekte idi.
Na + +Cl- +NH3 +CO 2 +H 2 O NaHCO3(k) +NH 4 + +Cl
NaHCO3(k)
Na 2 CO3(k) +CO 2(g) +H 2 O(g)
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Sodyum sülfat; kısmen doğal kaynaklardan, kısmen nötürleşme tepkimelerinden ve
kısmen Johann Rudolph Glauber tarafından 1625 te bulunan yöntemle elde edilir.
Na2SO4 en çok kağıt sanayiinde kullanılır. Kağıt yapımındaki kraft (sülfat) işleminde,
NavS ün alkali çözeltisinde hamur haline gelen ağaçtan, istenmeyen lignin
uzaldaştırıhr. Na2SO4 ın karbon ile indirgenmesi Na2S verir.
H 2SO 4(der) +NaCl (k)
NaHSO 4(k) +HCl(g)
NaHSO 4(k) +NaCl(k)
Na 2SO 4(k) +HCl(g)
Na 2SO4(k) +4C(k)
Na 2S(k) +4CO(g)
Alkali Metal Oksitleri;Alkali metaller oksijenle hızlı bir şekilde tepkimeye girerek
birkaç değişik iyonik oksit verirler. Uygun koşullarda (genellikle az oksijende) alkali
metallerin M2O formülünde oksitleri hazırlanabilir. Li aşırı oksijenle Li2O ve az
miktarda peroksit Li202, oluşturmak üzere tepkimeye girer.
Na ise, aşırı oksijenle çok miktarda peroksit Na2O2 ve az mik-tarda Na2Ooluşturmak
üzere tepkime verir.
K, Rb ve Cs oksijenle tepkimeye girerek süper oksitleri, MO2 oluştururlar.
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Peroksitler O22- iyonunu içerirler ve oldukça kararlıdırlar. Sodyum peroksit ağartıcı
ve güçlü oksitleyici olarak kullanılır. Li2O2 ve Na2O2 denizaltılarda ve uzay
gemilerinde ilk yardım solunum cihazlarında kullanılırlar. Çünkü bunlar karbon
dioksit ile tepkimeye girerek oksijen üretirler.
2M2O2(k) +2CO2(g)
2M2CO3(k) +O2(g) (M=Li,Na)
Bu amaçla KO2 (potasyum süperoksit) de kullanılabilir.
Alkali metallerin oksitleri, peroksitleri ve süperoksitleri su ile tepkimeye girerek
bazik çözeltiler oluştururlar. O2- iyonunun su ile tepkimesi bir asit-baz tepkimesi
olup, hidroksit iyonlan oluşturur. Peroksit ve süperoksit iyonları su ile tepkimeye
girerek yükseltgenme-indirgenme tepkimesiyle hidroksit iyonlan ve O2 verirler.
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Alkali Metallerin Hidroksitleri:
Alkali metal hidroksitleri, alkali metallerinin su ile tepkimesinden de elde
edilebilirler.
Alkali metallerinin hidroksitleri kuvvetli bazdır. Çünkü bunlar sulu çözeltide
ayrışarak hidroksit iyonlarını verirler.
Sodyum hidroksit ticari olarak NaCl(aq) ün elektrolizi ile elde edilir.
KOH ve LiOH benzer şekilde elde edilirler.
Alkali hidroksitlerinin önemli bir kullanım alanı sabun ve deterjan yapımı dır.
Sodyum sabunları bildiğimiz katı (kalıp) sabunlardır.
Potasyum sabunlarının erime noktası düşüktür ve yumuşak sabunlardır.
Lityum stearat evlerde kullanılmayacak bir sabundur, yağları gresler şeklinde
kalınlaştırır. Bu gresler çok başarılı su iticilerdirler ve hem düşük hem de yüksek
sıcaklıklarda kaydırıcı özellikleri vardır. Gresler normal yağların uzaklaşacağı
koşullarda hareketli metal parçaları ile temasta karışırlar.
5.5. Alkali metallerin önemli bileşiklerinin,ad,formül ve kullanım alanları,
Alkali
Metal
Bileşikleri
Kullanım alanları
Li
Li2CO3
Tıp ta bazı uygulamalarda,
Na
Na2CO3
Sabun, deterjen, ilaç ve yiyecek katkı maddelerinin elde
edilmesinde, suyun arıtılmasında, cam endüstrisinde,
Na
NaHCO3 (soda)
Gıda endüstrisinde
NaOH
Birçok anorganik ve organik bileşik sentezinde, sabun üretiminde,
Na
NaCI
Sofra tuzu olarak,
Na
Na2SO4.10H2O
Tekstil endüstrisinde,
K
KNO3
Gübre endüstrisinde, kibritlerde, barut yapımında,
K
KCl
İlaç endüstrisinde, fotoğrafçılıkta ,
KOH
Bazı akümülatörlerde elektrolit olarak, sabun üretiminde,
RbAg4I5
(Rubidyum pentaiyodoargenta)İnce film şeklindeki pillerin
yapımında,
Na
Rb
2A grubu elementleri
Be, Mg, Ca, Sr, Ba, Ra
5.Toprak alkali metalleri ile ilgili olarak öğrenciler;
KONU BAŞLIKLARI
KAZANIMLAR
5.6. Toprak alkali metallerin
5.6. Toprak alkali metallerin doğal kaynaklarını sıralar.
doğal kaynakları,
5.7. Toprak alkali metallerin
5.27. Toprak alkali metallerin fiziksel ve kimyasal
fiziksel ve kimyasal özellikleri, özelliklerini açıklar.
5.8. Toprak alkali metallerin
5.8. Toprak alkali metallerin genel elde ediliş
genel elde edilişi yöntemleri, yöntemlerini örneklerle açıklar.
5.9. Toprak alkali metallerin
kullanım alanları,
5.9. Toprak alkali metallerin kullanım alanlarına
örnekler verir.
5.10. Toprak alkali metallerin
önemli bileşiklerinin, ad,
formül ve kullanım alanları,
5.10. Toprak alkali metallerin önemli bileşiklerinin, ad,
formül ve kullanım alanlarını listeler.
5.6. Toprak alkali metallerin doğal kaynakları,
Zümrüt
Magnezit
2A grubu elementleri 1A grubu elementleri kadar yaygındır.
Kalsiyum ve magnezyumun yer kürede çok bol bulunurlar, en az
bulunan üyesi de berilyuma dur.
Berilyum;beril minarellerinde, diğer elementler çoğunlukla
karbonatlar, sülfatlar ve silikatlar halinde bulunurlar. Radyum komşu
gruptaki fransiyum gibi radyoaktiftir ve sadece eser miktarda
bulunur.
Be: Zümrüt (Be3AI2Si6O18) ve kedi gözü
Mg: Magnezit (MgCO3)
Ca: Kireç taşı / kalsit (CaC03)
Sr: Stronsiyonit (SrCO3)
Ba: Barit (BaSO4), viterit (BaCO3)
Toprakta ve alkali topraklarda 1Ave 2A grubu elementlerinin oksitleri
de bulunur. Bunlara Li20, Na20, K20, BeO, CaO örnek verilebilir
Barit
5.7. Toprak alkali metallerin fiziksel ve kimyasal özellikleri,
1. Toprak alkali metallerin erime ve kaynama noktaları yüksek olup, grupta aşağıya doğru
inildikçe erime ve kaynama noktaları genellikle azalır.
2. Toprak alkali metaller bıçakla kesilebilecek kadar yumuşaktır.
3. İlk kesildiklerinde yüzeyleri gümüş parlaklığındadır. Hızlı oksitlendiklerinden zamanla
metalik renklerini kaybederler.
4. Berilyum yerkabuğunda çok nadir bulunur.
5. Kalsiyum dünyada en bol bulunan 5. Elementtir.
6. Yoğunlukları ve erime noktaları 1 A grubu elementlerine göre yüksek, diğer metallere göre
genelde düşüktür.
7. Atom çapları aynı periyottaki 1A grubu elementlerine göre daha küçüktür. 11. Elektrik
akımını ve ısıyı iletirler.
8. Dış orbitaldeki 2 elektrondan dolayı kısmen de olsa kararlı maddelerdir. Bu sebeple
iyonlaşma enerjileri 3A grubu elementlerinden daha yüksektir.
9. Kimyasal tepkimelerinde yapılarını asal gazlara benzeterek +2 değerlikli iyon (katyon)
halinde bileşikler oluştururlar.
10. 2A grubu elementleri tabiatta bileşikleri halinde bulunurlar. Genellikle bileşiklerinde elde
edilirler.
11. Ca, Sr, Ba elementleri Be’ göre çok aktiftirler
12. Gene Ca, Sr, Ba tuzları alev denemesinde iyi sonuç verirler. Ca tuzları portakal sarısı, Sr
tuzlarının kırmızı, Ba tuzları alev rengi ise sarı, yeşildir.
5.7. Toprak alkali metallerin fiziksel ve kimyasal özellikleri,
2A grubu elementlerinden berilyum ve magnezyumun bazı bileşikleri iyonik bileşik
özelliğinden daha çok molekül yapılı bileşik özelliği gösterir.
Berilyum su buharı ile tepkimeye girmez. Magnezyum ise su buharı ile tepkimeye girer.
Kalsiyum, stronsiyum ve baryum soğuk suyla bile tepkimeye girer.
Be(k) +2H 2 O (g) Tepkime vermez
Ca (k) +2H 2 O (g) Ca(OH) 2(suda) +H 2(g)
Ba (k) +2H 2 O (g) Ba(OH) 2(suda) +H 2(g)
Kalsiyum, stronsiyum ve baryum oda sıcaklığında oksijenle tepkimeye girerek oksitlerini
oluştururlar. Berilyum ise ancak yüksek sıcaklıkta oksijenle tepkimeye girerek berilyum oksidi
oluşturur.
2Me(k) +O 2(g) 2MeO(k) Me=Ca,St,Ba
Magnezyum, havada magnezyum oksit ve magnezyum nitrit vermek üzere parıltılı bir şekilde
yanar.
2Mg (k) +O2(g) 2MgO(k)
2Mg (k) +N2(g) 2Mg3 N2(k)
5.7. Toprak alkali metallerin fiziksel ve kimyasal özellikleri,
Berilyum bazı fiziksel özelliklerinin diğer grup elementleriyle karşılaştırılması;
• Berilyum daha yüksek erime noktasına sahiptir ve diğerlerine göre daha serttir.
•Be su ve hava ile tepkime vermez.
•BeO su ile tepkime vermez, diğer MO oksitleri M(OH)2 oluştururlar.
•Be ve BeO kuvvetli bazik çözeltilerde BeO22- iyonun oluşturmak üzere çözünürler.
•BeCl2 ve BeF2 erimiş halde elektriği az iletirler; kovalent bileşiklerdir.
•Berilyumun kimyasal davranışlarını atomlarının küçüklüğüne ve yüksek iyonlaşma
enerjilerine bağlayabiliriz. •Berilyumun, Be2+ iyonu oluşturma eğilimi çok azdır;
berilyumun oluşturduğu bileşikler onun kovelent bağ yapma yeteneğinin
olmasındandır.
•Ametal oksitler genelde metal oksitlerden daha asidik olmamasına karşın, BeO bir
asidik oksittir. Bu davranış berilyum iyonlarının küçüklüğü ve iyonik 2+ yükün bağıl
büyüklüğünden ileri gelmektedir. Berilyum atomları kovalent bileşiklerinde melez
orbitallar kullanılırlar.
5.8. Toprak alkali metallerin genel elde ediliş yöntemleri ve kullanıldığı yerler
•Berilyum elementinin; beril mineralleri doğal kaynağıdır. Bu mineral BeF2 e dönüştürülür ve
Mg ile indirgenir.
•Berilyum metali alaşımların yapılarında kullanılır. (Bunun başlıca nedeni, hafif olmasıdır.)
• Metal yorulmasına karşın dayanıklı olduğundan, yaklaşık % 2 Be içeren bakır alaşımı yay,
pens ve elektrik kontaklarında kullanılır.
•Be atomu X-ışınlarını ve nötronları kolay soğurmaz ve bu nedenle berilyum metali X-ışınları
tipleri için "pencere" ve nükleer reaktörlerde çeşitli parçaları yapmada kullanılır.
•Berilyum bileşikleri son derece zehirlidir ve fazla kullanım alanı yoktur.
•Buna ek olarak havada 0,002 ppm kadar düşük bir seviyede bulunmalarının bile, kansere
neden olmasından şüphelenilmektedir.
Gaz halindeki BeCl2 molekülleri şemada gösterildiği gibi bağ yaparlar. Katı haldeki BeCl2 de
iki Cl atomu Be atomuna normal kovalent bağ ile bağlanmışlardır. Diğer iki Cl atomu ise
klor atomlarının eşleşmemiş elektronlarını vermesi (oklarla gösterilmiştir) ile oluşan
koordine kovalent bağlarla bağlanmışlardır.
5.8. /5.8. Toprak alkali metallerin genel elde ediliş yöntemleri ve kullanıldığı yerler
Magnezyum metali, sıvı klorüründen Dow yöntemi ile elde edilir.
Magnezyumun kaynağı deniz suyu ya da doğal tuzlu sulardır. Deniz suyunda Mg2+ yaklaşık 1350 mg/L
oranında bulunur. Dow yönteminin ilk basamağı, OH- kaynağı olarak sönmüş kireç [Ca(OH)2] kullanmak
suretiyle Mg(OH)2(k) in çöktürülmesidir. Sönmüş kireç, sönmemiş kireç (CaO) in su ile tepkimesiden oluşur.
Çöken Mg(OH)2(k) yıkanır, süzülür ve HCl(aq) de çözülür. Oluşan derişik MgCl2(aq) buharlaştırılarak kurutulur,
sonra eritilir ve saf Mg metali ve Cl2(g) vermek üzere elektroliz edilir. Cl2(g) HCl e dönüştürülür ki, bu yeniden
çevrime girer.
Magnezyum herhangi bir yapı metalinden daha az yoğundur ve hafifliği nedeniyle değerlidir. Uçak
parçaları gibi nesneler, magnezyumun alüminyum ve diğer metallerle oluşturduğu alaşımından yapılırlar.
Magnezyum iyi bir indirgendir ve daha önce sözü edilmiş olan berilyumun üretiminde olduğu gibi, birçok
metalurjik işlemde kullanılır. Magnezyumun kolay oksitlenmesi, aşınan anotların korozyonunu önlemede
de kullanılmasının temelini oluşturur. Ancak, magnezyumun en çarpıcı kullanım alanı havai fişeklerdir.
5.10. Toprak alkali metallerin önemli bileşiklerinin, ad, formül ve kullanım alanları,
Halojenürler :
Grup 2 metalleri doğrudan halojenlerle tepkiyerek halojenürleri verirler. Bu
halojenürler, berilyumunkiler dışında, oldukça iyoniktirler.
M+X 2
MX 2 (M=Mg,Ca, Ca)(X=F,Cl,Br ve I)
Halojenürler değişik alanlarda kullanırlar.
Örneğin, MgCl2, magnezyum metali eldesi yanında, yanmaz kereste yapımında ve
yangın söndürücülerde kullanılır. Ayrıca, özel çimentoların eldesinde, seramiklerde,
tekstil sanayiinde ve soğutucu tuzlu sularda kullanılan başlıca bileşiklerdendir.
Karbonatlar ve Sülfatlar; 2A karbonatları, Ca, Sr ve Ba un sülfatları, suda
çözünmezler. Bu nedenle grubun en önemli mineralleri bu bileşiklerdir.
Dünyada en çok bilinen mineral, bir kalsiyum minerali olan kireç taşıdır (CaCO3).
Eğer kireçtaşı %5 den fazla MgCO3 içerirse dolomitik kireçtaşı veya dolomit olarak
adlandırılır. Kireç taşında bir miktar kum, kil veya kuvartz bulunabilir. Kireç taşının
en çok kullanıldığı (yaklaşık %70) yer inşaatlardır. Ayrıca kireçtaşı, sönmemiş kireç
ve sönmüş kireç üretiminde, camda katkı maddesi ve metalürji işlemlerinde akı
olarak kullanılır. Akı metal üretimi sırasında metaldeki mineral safsızlıklarını
soğuran ve onları serbest akışkan sıvı halinde alan maddedir.
CaCO3
5.10. Toprak alkali metallerin önemli bileşiklerinin, ad, formül ve kullanım alanları,
Kireç taşından saf CaCO3 üç basamakta elde edilir:
1. Kireç taşının ısısal bozunması (kalsinasyon)
2. CaO in su ile tepkimesi (söndürme)
3. Sulu Ca(OH)2(k)süspansiyondan CaCO3 ün çöktürülmesi (karbonasyon).
Kalsinasyon: CaCO3(k)
CaO(k) + CO2(g)
Söndürme: CaO(k) + H 2O(s)
Ca(OH)2(k)
Karbonasyon: Ca(OH)2(k) + CO2(g)
CaCO3(k) + H 2 O(s)
Karbonatlar suda çok çözünmemesine rağmen bunlar bazdır; bu nedenle asidik çözeltilerde
kolayca çözünürler. CaCO3 (k) + H2O+ CO2 → Ca(HCO3) 2(aq)
Bu çözünme süreci kireçtaşı yatağında büyük oyuklar (mağaralar) açabilir. Verilen tepkime
tersinirdir, çözeltinin buharlaşması suyun ve CO2 in kaybına ve Ca(HCO3) 2(aq) ün CaCO 3 (k) a
(sarkıt)dönüşmesine neden olur.
Beyaz renkli saf CaCO3 pek çok ürünün yapımında kullanılır.
Örneğin, kağıt yapımında kağıda parlaklık, düzgünlük ve iyi mürekkep emme özelliklerini
kazandırır. Raf ömrünün 300 yıl veya daha uzun olması beklenen asitsiz (alkali) kağıt yapımı olan
yeni kağıt teknolojisinde CaCO3 kullanımı uygundur. CaCO3 plastik, lastik, taban döşemesi,
yapıştırıcı yapımında olduğu kadar parfümeri ve gıda imalatında dolgu maddesi olarak kullanılır.
Asit giderici olarak ve kemiklerin gözenekli ve kırılgan hale gelmesine (osteoporos) engel olmak
için uygulanan diyette destek maddesi olarak kullanılmaktadır.
5.10. Toprak alkali metallerin önemli bileşiklerinin, ad, formül ve kullanım alanları,
2A grubu karbonatlanmn (MCO3) diğer bir özelliği, yüksek sıcaklıklarda bozunmalarıdır.
MCO 3 (k) → MO (k) + CO 2(g)
Bu tepkime, 2A grubu metal oksitlerinin elde edilmesinde ana yöntemdir.
1A grubu metallerinin karbonatlan, Li2CO3 dışında, bu ısısal bozunma özelliğine sahip değildir.
Bu nedenle, Solvay yönteminde NaHCO3 ısıtılması Na2CO3 verir, fakat daha ileri bir bozunma
meydana gelmez.
Kalsiyum içeren diğer önemli mineral alçı taşı CaSO4.1/2 H2O, dir.
CaSO4+2H2O +ısı → CaSO4.1/2 H2O(k) +3/2 H2O(g)
Alçı su ile karıştırıldığında alçı taşına dönüşür. Katılaşırken genişlemesi nedeniyle, su ve alçı
karışımı bir cismin keskin ayrıntılarının alınması için kalıp yapmada kullanılır. Alçı mücevher
yapımında ve dişçilikte yaygın olarak kullanılır. Bununla birlikte, en önemli kullanma alanı,
alçı duvar (hazır duvar) üretimidir. Alçıtaşı, yapı endüstrisinde diğer iç duvar kaplayıcıların
yerine geçmiştir.
Baryum X -ışınlarını geçirmez ve bu nedenle, baryum sülfat röntgen çekiminde önemli bir
kullanım alanı bulur. Baryum iyonu zehirli olmakla birlikte, mide veya üst sindirim sistemi
bölgesinin "baryum sütü bulamacı" ile ve daha alt bölgenin "baryum şırıngası" ile sıvanması,
BaSO4 ın suda çözünmemesi nedeniyle, oldukça güvenlidir.
5.10. Toprak alkali metallerin önemli bileşiklerinin, ad, formül ve kullanım alanları,
Oksitler ve Hidroksitler:
Berilyumunkiler dışında, 2 A grubu metallerinin oksitlerinin ve hidroksitlerinin tümü bazdır.
Şekilde görüldüğü gibi, oksit iyonunun ayrılması X'in elektronegatifliğine bağlıdır. X'in
elektronegatifliği arttıkça, oksijenin bağ elektronlarını yatılı çift olarak alması ve dolayısıyla
oksijenin oksit iyonu olarak ayrılması güçleşir. Aksi durumda ise oksit iyonunun ayrılması
kolaylaşır. O halde, X'in elektronegatifliği ile asitlik artarken, bazlık azalacaktır. Bunun bir
sonucudur ki, genel olarak metalik oksitler bazik, avmetalik oksitler asidik ve yarı metalik
oksitler amfoterik özellik gösterirler.
Bir gruptaki elementlerin aynı yüklü katyonlarının oluşturduğu oksitlerin bazlığı grupta
yukarıdan aşağıya doğru artar, buna karşın asitliği azalır. Çünkü yukarıdan aşağıya doğru X'in
elektronegatifliği azalmaktadır.
BeO, MgO,CaO,SrO,BaO
Na 2O, MgO,Al2O3 ,P2O5
asitlik
bazlık
bazlık
asitlik
5.10. Toprak alkali metallerin önemli bileşiklerinin, ad, formül ve kullanım alanları,
Talkali
Metal
Bileşikleri
Kullanım alanları
Be
BeO
Seramik eşya ve özel tip camlar yapmada, floresan
tüplerinde, nükleer reaktörlerde kullanılır, zehirlidir.
Mg
MgO
Ateşe dayanıklı tuğla yapımında, ilaç endüstrisinde,
Mg
MgCO3
MgO eldesinde, izolasyon, lastik, mürekkep, cam, seramik,
boya, ilaç ve kozmetik endüstrisinde,
Mg
MgSO4.7H2O
Eczacılık, yapay gübre endüstrisinde
Ca
CaCO3
Sönmemiş ve sönmüş kireç yapımında ve inşaatlarda.
Ca
CaO
Çimento yapımında, metalürjide, suların yumuşatılmasında,
Ca
Ca(OH)2
İnşaatlarda harç yapımında,
Ca
CaSO3.2H2O
Alçı şeklinde dekoratif işlerde, dişçilikte kalıp alınmasında,
hazır duvar üretiminde,
Sr
Sr(N03)2
Piroteknik sanayinde
Sr
SrCI2
Şeker üretiminde
Ba
BaS
Fosforesans özellik
Ba
BaSO4
Bazı röntgen çekiminde
Ba
Ra(OH)2
Kuvvetli baz olarak
6. 3A grubu (13. grup) elementleri ile ilgili olarak
öğrenciler;
KONU BAŞLIKLARI
KAZANIMLAR
6. 3A grubu (13. grup) elementleri ile ilgili olarak öğrenciler;
6.1. 3A grubu elementlerinin ortak
6.1. 3A grubu elementlerinin ortak özelliklerini,
özellikleri,
atomlarının elektron dizilimleri ile ilişkilendirir.
6.2. Bor elementinin doğal
6.2. Bor elementinin doğal minerallerini tanır.
mineralleri,
6.3. Bor ve alasımlarının elde edilisini
6.3. Bor ve alaşımlarının elde edilişi,
açıklar ve özellikleri ile kullanım alanları arasında iliski
özellikleri ve kullanım alanları,
kurar.
6.4. Bor bileşiklerinin özellikleri,
6.4. Bor bileşilerinin özelliklerini, kullanım alanlarını ve
kullanım alanları ve Türkiye için
Türkiye için önemini açıklar.
önemi,
6.5. Alüminyumun üretim yöntemlerini irdeler; metalin ve
6.5. Alüminyumun üretim yöntemleri;
alasımlarının zellikleri ile kullanım alanlarını iliskilendirir.
metalin ve alaşımlarının özellikleri ve
kullanım alanları,
6.6. Yaygın alüminyum bileşkleri ve
6.6. Yaygın alüminyum bileşiklerini ve kullanım alanlarını
kullanım alanları,
betimler.
6.7. 3A grubundaki diğer metallerin ve
6.7. 3A grubundaki diğer metallerinve bunların
bunların bilesiklerinin endüstri
bileşiklerinin endüstri açısından önemini irdeler.
açısından önemi,
6.1. 3A grubu elementlerinin ortak özelliklerini,
Periyodik tablonun p-blokunda yer alan bu elementlerin değerlik kabuğu elektron
konfigürasyonu ns2np1 dir. Bir elektron vererek dolu konfigürasyona, üç elektron vererek
kendilerinden önceki soy gaz konfigürasyonuna ulaşırlar. Bu nedenle, bu elementlerin
bileşiklerinde (+1) ya da (+3) yükseltgenme basamaklarında bulunmaları beklenir.
Alüminyum ve galyum için (+3), indiyum ve talyum için (+1) daha yaygın bir yükseltgenme
basamağıdır.
IIA Grubundaki berilyumda olduğu gibi, bu grupta ise bor, birçok yönden grubun diğer
elementlerinden farklı özellikler sergilemektedir. Bor ametal, diğer dördü metalik özellik
gösterir. Bunun sebebi, borun iyonlaşma enerjisi diğerlerinkinden oldukça yüksek ve yarıçapı
ise küçüktür. Grup elementleinin bazı fiziksel özellikleri;
Elem
ent
B
Al
Ga
In
Tl
∆H
(kJ mol-1)
563
326
277
243
182
İE1
(kJ mol-1)
801
578
579
558
589
IE3
Eİ
(kJ mol-1) (kJ mol-1)
3660
-27
2745
-44
2963
-29
2704
-29
2878
-29
En
(0C)
2300
660
30
157
303
Kn
(0C)
2550
2467
2403
2080
1457
R Kov
(pm)
82
118
126
144
152
6.2. Bor elementinin doğal mineralleri,
Doğada serbest halde bulunmayan bor, oksijenli bileşikleri hâlinde bulunur. Ükemizde de bol
bulunan başlıca bor minerallerinden kolemanit, pandermit ve borakstır.
Minearal
Kolemanit
Pandermit
Boraks
Formülü
Kristal Biçimi
Ca2B6O11.5H2O
Çoğunlukla eş boyutlu ve
kısa prizmatık kristalli, tek
parça, kristalleri belirli bir
konum içinde dizilmiş iç
yapıya sahiptir.
Na2B4O11.3H2O
Yumru biçiminde ya da
düzensiz kütleler hâlinde,
tebeşirimsi ve kompakt
Beyaz
Kısa prizmatik kristalli,
bazen levhamsı
Renksiz, beyaz,
grimsi, yeşilimsi,
mavimsi, şeffafyarı şeffaf
Na2B4O7.10H2O
Renk
Renksiz, beyaz,
şeffaf-yarı şeffaf
Ayırt edici Özellikleri
HCI'de çözünür.
Çözelti soğuyunca
borik asit ayrılır.
Şekli, akkor ateşte
erimesi, suda
çözünmemesidir.
Kristal şekli, düşük
yoğunluğu, suda
çözünebilirliğidir.
6.2. Bor elementinin doğal mineralleri ve elde edilişi,
Bor cevherleri (Na2B4O7 10 H2O) (boraks) ağırlıklı
olarak İtalya, Rusya, Tibet, Türkiye ve Kalifornia'nın
bozkır bölgeleri gibi sadece birkaç yerde
yoğunlaşmıştır.
Na2B4O7.10H2O, H2SO4 ile tepkimeye sokularak
B(OH)3 e dönüştürülür. B(OH) 3, kuvvetli bir şekilde
ısıtıldığı zaman B2O3 e çevrilir. Bor içeren değişik
türdeki bileşikler ve elementel bor, B2O3 den elde
edilebilirler.
3B(OH)3
3HBO 2 3H 2 O
ısı
ısı
2B(OH)3
B2 O3 +3H 2 O
ısı
B2 O3 +3Mg
2B+3MgO
H3BO3 zayıf asittir. Formülde görüldüğü gibi
triprotik değil de monoprotiktir bu sebeple
B(OH)3 şeklinde gösterilir. Suyun iyonlaşmasıyla
oluşan bir OH- iyonunu alır ve B(OH) 4-1 kompleks
iyonu oluşur.
Daha saf olan kristal bor, bor triklorürün hidrojen ile indirgenmesiyle de elde edilir.
2BCl3 +3H 2 2B+6HCl
Yüksek saflıkta bor potasyum floroborat (KBF4)ın, elektrolizi ile elde edilir.
6.3. Bor allotroları ve ve alaşımlarının elde edilişi, özellikleri ve kullanım alanları,
Borun çeşitli allotropları vardır.
Amorf bor kahverengi bir tozdur; kristal bor ise siyah olup son derece
serttir.
Amorf bor, bakırın oksitlerinin giderilmesinde, alüminyumun iletkenliğinin
arttırılmasında ve çeliğin sertleştirilmesinde kullanılır. Erime noktası 2300
°C, kaynama noktası 2550 °C olan borun elektrik iletkenliği çok azdır.
Kristal bor, elmastan sonra elementlerin en sertidir.
Bor, geçiş elementi olan demir, nikel ve kobalt ile alaşımları oluştururlar. Borun, küçük boyutlu
olması geçiş elementlerinden demir, nikel ve kobalt ile çok çeşitli alaşım oluşturmasını sağlar.
Ferro-Bor Alaşımları: Ferro bor ağırlık bakımından %10-20 arasında bor ihtiva eden bir demir-bor
alaşımıdır. Ferro bor parlak gümüş rengindedir. Ancak uzun süre rutubetli havada kalırsa, parlak
gümüş rengi kaybolur ve yüzeyin rengi kırmızı lekeler içeren mat griye dönüşür.
Üretim metodları:
1. Karbotermik reaksiyonla, ferro bor üretimi elektrik ark fırınlarında yapılır. Ark fırınına şarj
edilen hammaddeler; borik asit, kömür ve demir tozudur.
2. Alüminotermik reaksiyonla; ferro bor üretimi ise potalarda yapılır. Alümino termik reaksiyon
için potaya borik asit, demir cevheri, alüminyum tozu veya bazen magnezyum tozu yüklenir.
Kullanım alanı:
Ferro bor; Çelik üretimi, dökme demir üretimi, sürekli manyetik malzemeler ve amorf metallerin
üretiminde kullanılır.
6.3. Bor elementinin özellikleri
Bor elementi, donuk metalik parlaklığa sahiptir.
Bu görünüşü nedeniyle metallere benzetilebilir. Fakat elektriği iyi
iletmez.
Borun elektrik iletkenliği çok azdır. Fakat yüksek sıcaklıkta serbest
hâle geçen elekron sayısı artar ve elektrik akımını daha fazla iletir.
Bu özelliği sayesinde magnezyumla yaptığı alaşımlar bilgisayarların
4 kat daha hızlı çalışmasını sağlamaktadır.
Katı hâlde çok sert olduğundan kırılgandır.
Bor yarı iletken olup sıcaklık arttıkça iletkenliği artar. Kimyasal özellikleri alüminyum,
galyum, indiyum ve talyumdan daha çok, silisyum ve karbona benzer.
Borun kimyasal aktifliği; saflığına, kristal yapısına ve sıcaklığa bağlıdır.
Oda sıcaklığında sadece flor gazıyla reaksiyon verir ve yüzeyi oksijen tarafından
etkilenir, diğer durumlarda inert bir maddedir.
Yüksek sıcaklıklarda asal gazlar ve H, Ge, Te elementi hariç bütün ametallerle
doğrudan reaksiyon verir. Bor, alt gurubundaki metaller hariç, yüksek sıcaklıklarda
hemen hemen bütün metallerle kolaylıkla reaksiyon verir.
Borun kimyasal davranışı daha çok küçük çapı ve yüksek iyonlaşma enerjisiyle
belirlenir. Bu özelliklerle birlikte B, C ve H'nin elektronegatifliklerindeki benzerlik,
çok sayıda ve alışılmışın dışında kovalent bileşikler oluşturmasını sağlar.
Borun kovalent bileşiğe 3 elektronla katkıda bulunabilmesi, elektron çifti alıcısı
olmasını (Lewis asidi) ve çok merkezli bağlanmasını sağlar.
6.3. Bor elementinin kullanım alanları,
Borun kararlı iki izotopu yüksek derecede nötron soğurma kapasitesine sahiptir. Bu
özellikleri nedeniyle nükleer reaktörlerde nötron soğurucu olarak kullanılır.
10
5
B+10 n 115 B
Elektron absorblama özelliğinden dolayı nükleer reaktörlerde kontrol çubuğu
olarak kullanılır. Radyoaktif bor, alfa ışıması yapar. Bu sayede kanser tedavisinde
kullanılır, α ışınları kanserli hücreyi yok eder.
11
5
B 73 Li+ 24 He +2
Bor telleri, plastik ve metallerle kullanılırsa, bu malzemelerin dayanıklılığını
arttırır.
Bor, deterjan endüstrisinden uzay endüstrisine kadar birçok alanda
kullanılmaktadır.
Bor hidrürler, organik bileşiklerin sentezinde katalizör olarak büyük çapta
kullanılmaktadır ve kimyada yeni ve ilgi çekici gelişmelere katkı sağlamaya devam
etmektedir.
6.3. Bor ve alaşımlarının kullanım alanları,
Ferrobor, nikel bor ve kobalt bor alaşımları Yüksek Teknoloji Seramik ve Kompozitleri
Araştırma Merkezi (YTSKAM) laboratuvarlarında geliştirilmiş derin daldırmalı ark ocağında,
borik asidin yüksek sıcaklıkta karbonla indirgenmesi ile üretilmektedir.
% 0,04-4,2 B içeren demir bor (ferrobor) alaşımları ve yüzeyinde ince FeB tabakası olan
horlanmış çelikler, 800-1000 °C'a kadar oksidasyona dayanıklıdır. Bu nedenle yüksek
sıcaklıkta korozyona uğrayabilecek alanlarda kullanılır.
Ferroborun kullanıldığı önemli alanlardan biri de Nd-Fe-B (Neodyum Ferrobor)
mıknatıslarıdır. Nd-Fe-B mıknatısları ticari olarak en yüksek mukavemete ve yüksek
yoğunluğuna sahiptirler. 850 g Nd-Fe-B mıknatısı 3 kg'lık ferritin yaptığı işi yapmaktadır.
Ferrobor, yüksek oranda Mn, Ni, Cr ve Mo'in sağlayabileceği sertleşebilirlik özelliğini
sağlamada, paslanmaz çeliklerde kaynak kabiliyetini yükseltmede, nükleer reaktörlerde
regülatör çubuğu yapımında, hadde merdaneleri üretiminde, çeliklerde yüzey
sertleştirmede, nötron absorbsiyonunu arttırmada, yassı ve derin çekme işlemine tabi
tutulacak çeliklerde, otomobillerin sileceklerinde ve marş motorlarında, manyetik ayırımda,
cep telefonlarında, sensörlerde, metalik cam üretiminde, yüksek frekanslı trafo
çekirdeklerinde, EKG vb. cihazların sensörlerinde kullanılmaktadır.
6.3. Bor ve alaşımlarının kullanım alanları,
Cam sanayii
Seramik sanayii
Temizleme ve beyazlatma sanayii
Yanmayı önleyici (geciktirici) maddeler
İlaç ve Kimya Sanayii
Tarım
Metalurji
Enerji depolama
Arabalardaki hava yastıklarında
Atık temizleme işlemleri
Pigment ve kurutucu olarak
Nükleer uygulamalar
6.4. Bor bileşiklerinin özelliklerini, kullanım alanlarını ve Türkiye için önemi,
Boranlar, hidrojence zengin oldukları için enerji ham maddesi olarak kullanılırlar. Metalik Mg,
bortrioksit ile ısıtıldığında oluşan ürün asitlerle etkileştirilirse bir gaz oluşur. Bu gaz uçucu bir
madde olan bor hidrür bileşiklerini içerir. Bor hidrürler, bor atomunun sayısına göre diboran
(B2H6), tetraboran (B4H10), pentaboran (B5H9), gibi isimler alır.
BH3 molekülü (boran) bir tepkime ara ürünü olarak mevcut
olabilirse de kararlı bir bileşik olarak izole edilememiştir. BH3 da,
etrafı sadece altı elektronla çevrili olan merkez B atomunda bir
oktet boşluğu bulunduğuna dikkat ediniz. Izole edilebilen en basit
bor hidrür, diborandır(B2H6).
İki B atomu ve dört H atomu aynı düzlemdedir (sayfa düzlemine dik
bir düzlem). Burada dört H atomunu bağlamak için B atomları
tarafından kullanılan orbitaller sp3 olarak düşünülebilir. Bu dört
bağda sekiz elektron bulunur. Böylece geride kalan dört elektron iki
H atomunu iki B atomuna bağlamak için kullanılır. Sonuçta dolaylı
olarak iki B atomu da birbirine bağlamış olur. Bu durum, iki H
atomunun herbiri ayni anda her iki B atomunu bağlarsa
başarılabilir. üç atom arasında sadece iki elektronun paylaşıldığı BH-B köprüleri olağandışıdır. Böyle bağlara bazen "üç merkezli"
bağlar da denir.
6.4. Bor bileşiklerinin özelliklerini, kullanım alanları,
Pentaboranın, B5H9 yapısı Bor atomlan, B—B—B çoklu merkez bağlarıyla
bağlanırlar. Her B atomuna beş H atomu bağlanır. Diğer dört H atomu ise B
atom çiftleri arasında köprü oluşturur.
Bor hidrürler, organik bileşiklerin sentezinde katalizör olarak büyük çapta
kullanılmaktadır ve kimyada yeni ve ilgi çekici gelişmelere katkı sağlamaya
devam etmektedir.
Borik
asit
(H3BO3),
doğada
ılıcalarda
bulunur.
Borik
asit,
beyaz
yapraklar şeklinde kristallenen bir maddedir. Boraksın asitle tepkimesinden elde edilir.
Na2B4O7 + 2H+ + 5H2O → 4H3BO3 + 2Na+
Borik asit, tıpta antiseptik madde olarak en çok göz damlalarında, göz pomatlarında ve talk
pudralarında kullanılır. Bu ilaçların içine genellikle % 5-10 konsantrasyonunda katılmaktadır.
Borik asit, kağıt gibi selülozik malzemelerin alev almasını önlediği için, evlerde kullanılan duvar
kağıtlarına yangın riskini azaltmak için %5 oranında eklenir.
6.4. Bor bileşiklerinin özelliklerini, kullanım alanları,
Boraks (Na2B407.10H2O), tetraborik asidin (H2B4O7) bir Na tuzu olup sulu çözeltisi bazik özellik
gösterir. Boraksın 320-400 °C ısıtılmasıyla susuz boraks kristalleri elde edilir. Boraks; porselen
eşya, glazür ve ısı değişikliğine dayanıklı cam (pyrex) yapımında kullanılır.
Toz hâlindeki boraks, renkli cam imalinde camı renklendirmek için katkı maddesi olarak kullanılır.
Örneğin boraks, kobalt oksitle ısıtılırsa mavi renkli bir pigment oluşturur. Bu pigment cama
katıldığında mavi renkli emaye imalinde de kullanılan cam elde edilir.
Na2B4O7 + CoO → 2NaBO2 + Co(BO2)2
Boraks incisi
Boraks ve borik asit, bakterileri öldürücü niteliği, su içinde kolay çözünürlüğü ve mükemmel su
yumuşatıcı özellikleriyle sabunlarda, temizleyicilerde, deterjanlarda, çok çeşitli ilaçların
yapımında, tekstil boyamalarında, çeşitli malzemelerin uzun süre korunmasında, hafif dayanımlı
alaşımların yapılmasında ve tarım sanayiinde çok yaygın kullanım alanlarına sahiptir.
Perborat iyonu
Sodyum perborat (NaBO3.4H2O): Boraks ve hidrojen peroksidin
bir çözeltisinden kristallendirerek elde edilebilen yararlı bir
bileşik sodyum perboratar, NaBO3. 4H2O. Bu formül aldatıcı basit
bir formül olup daha kesin formül N Na2[B2(O2)2(OH)4 6H2O dir.
Bu bileşik, renkleri soldurmayan ağartıcıların yapılmasında
kullanılır. Ağartma etkisinin anahtarı, per borat iyonundaki bor
atomlarına köprü şeklinde bağlanmış olan peroksi gruplandır (—
O — O —).
6.4. Bor bileşiklerinin özelliklerini, kullanım alanları,
Sodyum borohidrür (NaBH4), oto endüstrisi bakımından önemli bir bileşiktir. Susuz bir çözücüde çözünmüş
bor triklorürün sodyum hidrür ile tepkimesinden elde edilir.
4NaH + BCI3 → NaBH4+ 3NaCI
Sodyum borohidrürün iyi bir hidrojen kaynağı olması nedeniyle füze katı yakıtlarında, yüksek enerjili jet
motorlarda ve roketlerde saf hidrojen kaynağı olarak kullanımı konusunda çalışmalar yapılmaktadır.
Sodyum borohidrür özellikle organik kimyada çok kullanılan bir indirgendir. Ayrıca herhangi bir yüzeyin nikel
ile kaplanmasında da kullanılır. Bor bileşikleri birçok endüstri alanında kullanılmaktadır.
Bazı bor bileşiklerinin özelliklerine göre kullanıldığı alanlar
İsıya karşı dayanıklılık ve yüzey sertliği gibi özelliklerin istendiği özel camların üretiminde borik asit ve
Cam sanayii
boraks kullanılmaktadır. Pencere camı ve şişe camı sanayiinde ender olarak kullanılır.
Seramik
Yer karoları gibi seramiklerin yüzeylerindeki kaplamalar emaye fritten yapılır. Bu emayelerin
sanayii
akışkanlıklarını arttırıp yoğunluklarını ve doygunlaşma ısılarını düşürmek için boraks ve borik asit kullanılır.
Sabun ve deterjanlara mikrop öldürücü ve su yumuşatıcı etkisi nedeniyle.
Temizlik
% 10 boraks ve toz deterjanlara da beyazlatıcı etkisini arttırmak için % 10-20
sanayii
arasında sodyum perborat katılır
Yanmayı
Borik asit ve boratlar, selülozik maddelerin ateşe karşı dayanıklılığını sağlarlar. Tutuşma sıcaklığına
Önleyici
gelmeden selülozdaki su moleküllerini uzaklaştırırlar ve oluşan kömürün yüzeyini kaplayarak daha ileri bir
Maddeler
yanmayı engellerler.
Susuz boraks ve boraks pentahıdrattan oluşan karışım bitki örtüsünün geliştirilmesi için gübre sanayiinde,
Tarım
sodyum klorat ve bromosol gibi bileşiklerle birlikte otların temizlenmesi veya toprağın sterilleştirilmesı
için kullanılmaktadır.
Bor bileşkleri, elektrolit kaplama sanayiinde, elektrolit elde edilmesinde kullanılmaktadır. Borik asit nikel
Metalürji
kaplamada, floroboratlar ve floroborik asitler; kalay, bakır, nikel gibi demir dışı metaller için elektrolit
sanayii
olarak, ferrobor ise çeliğin sertliğinin arttırılmasında kullanılır.
Ahşap malzemelerin kullanım sürelerinin uzatılması için, borik asit ve borakstan elde edilen % 30'luk
Ahşap sanayii sodyum oktaborat çözeltisi ile muamele görmüş ahşap malzemeler, yavaş yavaş kurutulduğunda
bozulmadan ve çürümeden uzun sure kullanılabilir.
6.4. Bor bileşiklerinin Türkiye için önemi,
Bor, en fazla ham ve rafine bor ürünleri olarak kullanılmaktadır. Türkiye bor madeni varlığı
bakımından dünyanın en önemli ülkesidir. Çünkü dünya bor rezervlerinin % 67'si ülkemizde
bulunmaktadır. Bor madenleri. 2172 Sayılı Kanunla devlet eliyle işletilecek madenler kapsamına
alındığı için ülkemizde bor madenleri Eti Maden işletmeleri Genel Müdürlüğü tarafından
işletilmekte, üretilmekte ve pazarlanmaktadır. Eti Maden dünyadaki en büyük bor üreticisi olup
dünya bor üretiminin % 39'unu üretmektedir.
Eti Maden işletmeleri'nin bor mineralleri ve rafine bor ürünleri üretimi konusunda sürdürdüğü
çalışmalar sonucunda; konsantre ve rafine bor ürünleri üretimi her geçen yıl artmaktadır.
Ülkemizdeki konsantre ve rafine bor üretimi, Eti Maden'e ait Kırka, Emet, Bandırma, Bigadiç ve
Kestelek işletmelerinde yapılmaktadır. Bu işletmelerde üretilen ürünler şunlardır:
Konsantre kolemanit
Konsantre tinkal, Konsantre üleksit, Boraks pentahidrat , Boraks dekahidrat, Borik asit, Sodyum
perborat monohidrat, Sodyum perborat tetrahidrat, Susuz boraks Kalsine tinkal Boroksit (Susuz
borik asit) Zirai bor
Ayrıca İ.T.Ü. Yüksek Teknoloji Seramik ve Kompozitleri Araştırma Merkezi'nde (YTSKAM) üretim
teknolojileri geliştirilen başlıca bor, bor bileşikleri ve alaşımları şunlardır:
Amorf bor, Kristalin bor, Bor karbür, Hekzagonal ve kübik bor nitrür, Bor alaşımları (ferro bor,
nikel bor, kobalt bor)
Türkiye; rezerv, üretim ve cevher kalitesi açısından önemli avantajlara sahiptir.
MEB KİMYA
6.5. Alüminyum,
Yer kabuğunda oksijen ve silisyumdan sonra en çok rastlanan element alüminyumdur.
Alüminyum doğada oksit, hidratlanmış oksit ve silikat hâlinde bulunur. Alüminyum oksit
doğada bulunan hemen hemen her mineralde mevcuttur. Fakat alüminyum eldesinde bu
minerallerin hepsi kullanılamaz. Çünkü bu minerallardeki alüminyum miktarı azdır.
Alüminyumun en önemli mineralleri boksit, feldspat ve killerdir.
Boksit, hidratlanmış alüminyum oksit mineralidir, alüminyum oksidin monohidrat (AI2O3.H2O)
ve trihidratlarının (AI2O3.3H2O) karışımıdır. Türkiye'de Konya (Seydişehir), Antalya, Adana,
Gaziantep ve Muğla'da geniş boksit yatakları bulunmaktadır.
Feldspat (K2O.AI2O3.6SiO2), silikat yapısındadır ve bol bulunan alüminyum minerallerinden
biridir.
Kil adı ile bilinen çok çeşitli mineral vardır. Feldspat minerallerinin su ve karbon dioksit etkisi
ile ayrışması sonucu kaolin (AI2O3.2SiO2.2H2O) oluşur. Kaolin, killerden en saf olanıdır.
Kil mineralleri, tabakaları arasına giren birtakım anorganik ya da organik anyon ve katyonları
adsorplama ve değişebilir konumda tutma özeliğine sahiptir. Bu iyonlar sulu çözeltideki
iyonlarla muamale edilerek değiştirilebilir. Kil minerallerinin tabakaları arasında bulunan Na+,
K+, Ca2+ ve Mg2+ gibi katyonlar, inorganik ve organik tüm katyonlarla yer
değiştirebildiklerinden, değişebilen katyonlar olarak adlandırılırlar. Değişebilen katyon olarak
Na+ içeren bir kil CaCI2 çözeltisi ile karıştırıldığında çözeltideki her bir Ca2+ iyonu, iki Na+
iyonunun yerini alır. Bu işleme katyon değiştirme denir. Kil minerallerinin kullanıldığı ve
çalışıldığı her alanda katyon değişimi ve katyon değişimi reaksiyonu önemlidir.
Alümina
Alümina olarak bilinen alüminyum oksidin (Al2O3) çeşitli yapıları
mevcuttur. Kristal yapıdaki alüminyum okside korundum denir. Beyaz
safir olarak da bilinen saf korundum, değerli bir taştır. Yukarıdaki
resimlerde de gördüğünüz bazı değerli taşlar korundumun yanı sıra az
miktarda geçiş metali içerir.
Yakut ve safir minerallerinin iyi kristallileri, mücevhercilikte; diğerleri de
metal kesme, parlatma ve aşındırma işlerinde kullanılır.
Nurol Teknoloji sertlik, ısıl şoka dayanım, kimyasal korozyona karşı
direnç gibi özelliklere sahip alümina bazlı malzemeleri; balistik zırh
plakaları, döküm filtresi, seramik fırın malzemeleri, tekstil seramikleri,
kağıt seramikleri, laboratuvar seramiklerinde kullanmaktadır
6.5. Alüminyumun üretim yöntemleri,
Boksitten saf alümin (Al2O3) üretimi:
En önemli alüminyum maden cevheri boksittir. Boksit (AI2O3.H2O) safsızlık olarak Fe2O3 içerir
ki, bunun uzaklaştırılması gerekir. Ayırmada kullanılan ilke, Al2O3 ün amfoter bir oksit oluşu ve
NaOH(aq) de çözüntilesine karşın, demir oksidin bazik bir oksit olup çözünmemesidir.
Al2 O3(k) +2OH - (aq) +3H 2O (s) 2 Al(OH) 4
(aq)
Al(OH)4 (aq) H3O+(aq) Al(OH)3(k) +2H 2O(s)
Al(OH)3(k)
Al2O3(k)(saf) +3H 2O (g)
Deneyin yorumu:
a. Al3+(aq) ve Fe3+(aq) içeren
çözeltiye aşırı OH- katıldığında
Fe3+, Fe(OH)3 olarak çöker ve
önceden
oluşan
Al(OH)3(k),
[Al(OH)4](aq)
vermek
üzere
yeniden çözünür.
b. Fe(OH)3(k) süzülür ve [Al(OH)4]
(aq) CO2in etkisiyle biraz asidik
yapılır. Burada CO2 kuru buz
olarak katılmıştır.
(c) Çökmüş olan Al(OH)3(k)
berrak, renksiz çözeltinin dibinde
toplanır. Isıtıldığında saf Al2O3
elde edilir.
6.5. Alüminyumun üretim yöntemleri,
Alüminin elektrolizi ile metalik alüminyum üretimi:
Al2O3 in erime noktası (2020 °C) çok yüksektir ve elektrik iletkenliği zayıf olan bir sıvı oluşturur.
Bu nedenle, iyi bir iletken çözücü olmaksızın elektrolizi yapılamaz.
Al2O3 in erimiş kriyolitteki (Na3AlF6) elektrolizi başarı ile sonuçlanmıştır.
Yükseltgenme:6O -2 3O 2(g) 12e
İndirgenme:4(Al 3 3e - Al(s) )
Net Tepkime : 3C (k) +4Al +3 4Al(s) +3CO 2(g)
Elektroliz işleminde oluşan sıvı hâldeki metalik alüminyum, hücrenin dibine çöker ve belirli
sürelerle buradan alınır. Hücreden alınan alüminyum, genellikle % 99,5-99,9 arasında bir
saflıktadır ve içerdiği ana safsızlıklar demir ve silisyumdur.
Elektrolizle aluminyum üretiminde tüketilen enerji çok fazla olup, bir ton Al için yaklaşık
15,000 kWsaattir. NaCl(aq) ün elektrolizinde bir ton Cl2 için 3000 kWsaat elektrik kullanılır.
Bu sebeple, alüminyum üretim kompleksleri, hidroelektrik santralleri gibi düşük maliyetli
enerji üretim kaynaklarına yakın olmalıdır. Alüminyumu yeniden işlemek için gerekli enerji,
boksitten metali elde etmek için gerekenin sadece yaklaşık % 5 idir.
6.5. Alüminyumun ve alaşımlarının özellikleri ve kullanım alanları,
Alüminyum,iletken,yumuşak ve hafif bir metal olup mat gümüşümsü renktedir.
Alüminyumun rengi, havaya maruz kaldığında üzerinde oluşan ince oksit tabakasından ileri
gelir. Alüminyum, zehirleyici ve manyetik değildir. Kıvılcım çıkarmaz. Saf alüminyumun
çekme dayanımı yaklaşık 49 Mega Paskal (MPa) iken alaşımlandırıldığında bu değer 700
MPa'a çıkar. Yoğunluğu, çeliğin veya bakırın yaklaşık üçte biri kadardır. Kolaylıkla dövülebilir,
makinede işlenebilir ve dökülebilir. Çok üstün korozyon özelliklerine sahip olması, üzerinde
oluşan oksit tabakasının koruyucu olmasındandır.
Alüminyum,iyi bir indirgendir. Asitlerle ve bazlarla tepkimeye girer. Toz alüminyum hava ile
veya diğer yükseltgenlerle kolayca yükseltgenir.
Alüminyum, folyo yapımında, roket yakıtlarında ve patlayıcılarda kullanılır.
Alüminyum katılan alaşım elemanları, Alüminyumun mukavemet özelliklerini yükseltir.
Başlıca alaşım elemanları: Magnezyum,silisyum, bakır, çinko ve bazen de kurşun, nikel ve
titandan elementleridir.
Alüminyum alaşımları imal tarzına göre iki ana gruba ayrılabilir:
1) Hadde alaşımları (dövülmüş alaşımlar)
2) Döküm alaşımlar
Başlıca döküm alaşımları şunlardır. AlCu, AlZnCu, AlCuNi, AlSi, AlSiNi, AlSiMg, AlMg, AlMgSi.
6.5. Alüminyumun ve alaşımlarının özellikleri ve kullanım alanları,
İsim
Al
Duralumin
Bileşimleri
Özellikleri
Kullanım alanları
%100 Al
İyi biır indirgendir. Asitlerle ve
bazlarla tepkimeye girer. Toz
alüminyum hava ile veya diğer
yükseltgenlerle kolayca
yükseltgenir
Alüminyum, folyo yapımında,
roket yakıtlarında ve patlayıcılarda
kullanılır.
% 94 Al %
Sert, hafif, fiziksel ve kimyasal
4 Cu % 1
aşındırıcılara dayanıklıdır.
Mg % 1 Mn
Havacılık sanayii, otomobil sanayii,
gemi sanayii, fotoğrafçılık
malzemeleri, spor malzemeleri, ev
eşyaları, kimya sanayii, hassas ölçü
aletlerinde
Kimya endüstrisinde kullanılan
metal kapların yapımında
Silumin
% 84 Al %
16 Sı
Kimyasal etkilere dayanıklı
Magnoks
Mg Al
Korozyona karşı dayanıklı
Nükleer reaktörlerde
Titanal
% 85,5 Al %
2,5 Mg % 7
Zn % 1.7 Cu
% 0.1 Zr
Yüksek mekanik özellikler
(darbe direnci, çekme
dayanımı, esneklik gibi)
Yüksek performans sağlaması
istenen spor malzemelerinin
üretiminde (kayak, snowboard)
6.6. Yaygın alüminyum bileşikleri ve kullanım alanları,
Alüminyum Halojenürler:
Alüminyum florür, AlF3, oldukça iyonik karakterlidir. Yüksek bir erime noktasına (1040 °C)
sahiptir ve eridiğinde elektrik akımın iletir. Bunun aksine, diğer halojenürler formülü Al2X6
(burada X = Cl, Br veya I) an moleküler yapıda bulunurlar. Bu molekülü, iki AlX3 den oluşmuş
gibi düşüne biliriz.
Aynı iki molekül birimi bir araya geldiğinde oluşan moleküle
dimer denir. Al2Cl6 nın dimerik yapısı, iki Cl atomunun tek olarak
herbir Al atomuna bağlanır ve iki Cl atomunun iki metal atomu
ile köprü oluşturduğu biçimde yazılabilir. Bu moleküldeki
bağlanma iki Al atomunun sp3 melezleşmesi yapmasıyla
açıklanabilir. Köprü oluşturan Cl atomları iki Al atomuna da
bağlanır. Köprü Cl ların bağlarından biri bildiğimiz kovalent bağ,
diğeri her iki elektronun da Cl atomundan geldiği koordine
kovalent bağdır.
Aluminyum halojenürler tepkime vermeye oldukça
yatkın Lewis asitleri olup, bir çift elektronu kolayca kabul
ederek katılma bileşiği olarak adlandırılan bir asit-baz
bileşiği oluştururlar.
6.6. Yaygın alüminyum bileşikleri ve kullanım alanları,
Hidrürler:
Hidrür iyonu, H-, halojenür iyonuna benzer olarak düşünülebilir ve AlH4- iyonu, AlH3 ve H- nun
bir katılma bileşiği olarak düşünülebilir. Lityum alüminyum hidrür, LiAlH4, organik kimyada
önemli bir indirgendir.
Alüminyumun diğer önemli halojenür kompleksi kriyolit (Na3AlF6) tir. Kriyolit, Hall-Heroult
yöntemine göre alüminyum metalini elde etmede çözücü ve elektrolit olarak kullanılır.
6 HF+Al(OH)3 + 3 NaOH Na 3 AlF6 +6H 2 O
Alüminyum Oksit ve Hidroksit:
Alüminyum oksidin yaygın olarak kullanılan birkaç adı vardır. En sık kullanılan adı alüminadır.
Kristal yapısında ise korundum adını alır. Saf korundum değerli bir taş olup, beyaz safir olarak
ta bilinir. Diğer bazı değerli taşlar az miktarda geçiş metali iyonlan ile korundumdan oluşurlar.
örneğin, yakutta Cr3+ ve mavi safirde Fe3+ ve Ti4+ vardır.
Alüminanın bağlanma ve kristal yapısı fiziksel özelliklerini belirler. Küçük Al3+ iyonu ve küçük
O2- iyonu kuvvetli iyonik bağ yapar. Kristal, düzgün sekizyüzlünün oyuğunu dolduran Al3+
iyonlan ile O2- iyonlarının sıkı istiflenmiş kübik yapıya sahiptir. Bu yapı nedeniyle, alumina çok
sert bir maddedir ve çoğu kez aşındırıcı olarak kullanılır. Isıya karşı da dirençlidir (en 2020 °C),
yüksek sıcaklık fırınlarında iç kaplamada kullanılır ve katalizör olarak endüstriyel kimyasal
işlemlere yardımcı olur. Çok yüksek sıcaklıklar dışında, alüminyum oksit bağıl olarak tepkimeye
yatkın değildir; sözde ısıya dayanıklı madde adını alır.
6.6. Yaygın alüminyum bileşikleri ve kullanım alanları,
Alüminyum öncelikle pH = 4,5-8,5 aralığında ince bir Al2O3 tabakası ile kaplandığı için su ile
tepkimeye girmesi önlenmiştir. Bu kaplamanın daha kalınlaştınlması ile metalin korozyona
direncinin arttırılması mümkündür. Bu işleme anodlaştırma denir. H2SO4(aq) elektrolit olarak
kullanıldığı banyoda, alüminyumdan yapılmış nesne anot ve grafit elektrot ise katot olarak
kullanılır. Elektroliz sırasında anot da oluşan yarı tepkime aşağıda verilmiştir.
2Al(k) +3H2O(s) Al2O3 +6H+(aq) +6eÇeşitli kalınlık ve gözeneklilikte Al2O3 tabakası elde edilebilir. Bununla birlikte boyar madde ve
diğer katkı maddelerini soğuran oksit de yapılabilir. Anotlaştırılmış alüminyum, bronz veya siyah
pencere çerçevesi gibi binaların mimari kısımlarında kullanılır.
Alüminyum hidroksit amfoterdir. Asitlerle tipik metal hidroksiti gibi tepkimeye girer.
Al(OH)3(k) + 3 H3O+(aq)
Al(H2O)4 (aq)
-
Hidroksi kompleks iyonun oluşumunda gösterildiği gibi aynı zamanda bazlarla da tepkime
verir.
Al(OH)3(k) + OH-(aq) Al(OH)4 (aq)
-
6.6. Yaygın alüminyum bileşikleri ve kullanım alanları,
Alüminyum Sülfat ve Saplar:
Alüminyum sülfat ticari olarak kullanılan alüminyum bileşiklerinin en önemlisidir. Derişik sıcak
H2SO4(aq) ile Al2O3(k) arasındaki tepkime ile elde edilir. Çözeltiden kristallenen bileşik Al2(SO4)3.
18H2O dur. Bu uygulamada suyun pH sı, alüminyum sülfat ilavesi ile Al(OH) 3(k) nın çökebileceği
şekilde ayarlanır. Al(OH)3(k) çökerken suda asılı katıları uzaklaştırır.
Diğer bir uygulama alanı da kağıt boylandırmasıdır. Boylandırma terimi mum, zamk veya yapay
reçinenin kağıda katılarak suya daha dayanıklı hale getirilmesi anlamında kullanılmıştır.
Al2(SO4)3(aq) dan çöktürülen Al(OH)3 boylandırıcı maddelerin kağıt içinde depolanmasını sağlar.
şap
Eşit mollerde Al2(SO4)3 ve K2SO4 ın sulu çözeltisi kristallenmeye
bırakıldığında, elde edilen kristaller potasyum alüminyum sülfattır,
KAl(SO4)2•12H2O, Bu büyük bir sınıf olan ve şaplar diye adlandırılan çift
tuzlardan sadece birisidir.
Şapların genel formülü M(I)M(III)(SO4)2. 12H2O olup M(I) tek artı bir yüklü
bir katyondur (Li+ hariç) ve M(III) artı üç yüklü bir katyondur: Al3+, Ga3+,
In3+, Ti3+, V3+, Cr3+, Mn3+, Fe3+, Co3+, Re3+, ya da Ir3+.
Şaplarda bulunan gerçek iyonlar ise [M(H2O)6]+, [M(H2O)6]3+ ve SO42-dur. Çok yaygın olarak
bulunan şaplarda M(I) = K+, Na+ veya NH4+ ve M(III) = Al3+. dir. Li+ şap oluşturamaz, çünkü bu
iyon, kristal yapının oluşturulabilmesinde çok küçük kalır. Sodyum aluminyum sülfat kabartma
tozlarında, potasyum alüminyum sulfat boyacılıkta kullanılır. Boyanacak olan dokuma şap
çözeltisine daldırılır ve buharda ısıtılır. [Al(H2O)6]3+ hidroliz olduğunda Al(OH)3 dokumanın
liflerine depolanır ve boya Al(OH)3 üzerinde soğrulur.
6.7. 3A grubundaki diğer metallerin ve bunların bileşiklerinin endüstri
açısından önemi,
Galyum metali elektronik sanayiinde artan bir öneme sahiptir.
Daha çok galyum arsenür (GaAs) elde edilmesinde kullanılır. Bu bileşik ışığı
doğrudan elektriğe dönüştürebilir (fotoiletkenlik). Yarı iletken olan bu madde ışık
yayan diyotlarda (LED ler) ve transistörler gibi katı hal düzeneklerinde de kullanılır.
İndiyum yumuşak gümüşe benzer bir metal olup, düşük eriyen alaşımların
yapımında kullanılır.
GaAs gibi, InAs de optik düzeneklerde fotoiletIken olarak ve düşük sıcaklık
transistörlerinde kullanım alanı bulmuştur.
Talyum bileşikleri son derece zehirlidir ve sanayide pek kullanılmazlar. Bununla
birlikte, heyecan verici yeni olası bir kullanım alanı yüksek sıcaklık
süperiletkenleridir. Şimdiki durumda, yaklaşık formülü Tl2Ba2Ca2Cu3O8+x olan talyum
içeren bir seramikte süperiletken aktiflik için maksimum sıcaklık rekoru 125 K dir.
6.7. 3A grubundaki diğer metallerin ve bunların bileşiklerinin endüstri
açısından önemi,
Bileşik
Özellikler
Kullanım alanları
GaAs
GaN
Işığı doğrudan elektiriğe
dönüştürebilir (foto iletkenlik).
Işık yayan diyotlarda (Led ve transistor)
kullanılır.
In As, In2S3 , InP
Matlaşmayı önler, dış etkilere
karşı dayanıklılık kazanır.
TI2(SO4)3 TKCO3)2
TIBr3
Suda çözünürler ve çok zehirlidir.
Fare öldürücü olarak kullanılır.
TI2S3
İR ışınlarına maruz kaldığında
elektrik iletkenliği değişir.
Fotosellerde kullanılır.
Başarılar /MT
Yarı iletkenlerin üre­timinde kullanılır.
VII.BÖLÜM: 14.GRUP ELEMENTLERİ
KONU BAŞLIKLARI
7.1. Karbon allotropları, bağ yapıları ve
kullanım alanları,
7.2.Nano teknoloji ve nanotüplerinin yapısı,
gelecekte kullanım alanları,
7.3. Karbonun oksitleri (CO,CO2) ve Karbonik
asit ve karbonatların özellikleri, doğada ve
hayattaki işlevleri,
7.4. Silisyumun doğal bileşiklerinin yapıları,
özellikleri ve kullanım alanları,
7.5. Yarı iletkenlik ve metalik iletkenlik,
KAZANIMLAR
7.1. Karbon allotroplarınının bağ yapılarını karşılaştırır;
kullanım alanlarına örnekler verir.
7.2. Nanoteknolojide önemli olan karbon nanotüplerinin
malzeme bilimi açışından önemini, yapışı ile ilişkilendirir.
7.3. Karbon oksitlerinin, karbonik asitin ve karbonatların
özellikleri ile doğadaki ve hayattaki işlevlerini açıklar.
7.4. Şilisyumun doğal bileşiklerinin yapılarını, özellikleri ve
kullanım alanları ile ilişkilendirir.
7.5. Yarı iletkenliği metalik iletkenlik ile karşılaştırır.
7.6. Silisyumun ileri teknoloji açışından önemi, 7.6. Şilişyumun ileri teknoloji açışından önemini irdeler.
7.7. Yarı iletkenlerde doplama (doping) ve
depolamanın diyot, transistör gibi temel
elektronik bileşenleri,
7.8. 4A grubundaki diğer metallerin ve
bileşiklerinin kullanım alanları,
7.7. Yarı iletkenlerde doplama (doping) kavramını ve
doplamanın diyot, transistör gibi temel elektronik
bileşenlerin çalışmasındaki önemini açıklar.
7.8. 4A grubundaki diğer metallerin ve bileşiklerinin
kullanım alanlarına örnekler verir.
7.1. Karbon allotropları, bağ yapıları ve kullanım alanları,
Elmas: Elmas olarak adlandırılan allotropunda, bir karbon atomu,
çevresindeki dört karbon atomu ile dört σ bağı oluşturmuştur. Karbon
atomları bir tetrahedral düzenlemeye sahiptir. Hibridleşme modeli, elmasta
karbon atomlarının sp3 hibridleşmesi yaptığını ve σ bağlarımn sp3
hibridlerinin örtüşmesinden oluşmuştur. Her karbon atomu kendisini
çevreleyen dört karbon atomuyla düzgün dörtyüzlü meydana getirecek
şekilde bağlanmıştır. İki tâne kare tabanlı piramidin taban tabana gelmiş şekli
görünümündedir. 12 yüzlü ve kübik kristal yapıları da vardır. Kristallerin rengi
beyaz, kahverengi, siyah veya renksiz olabilir.
Elmas yapısında elektronlar, kovalent bağlarla bir bölgede bulunduklarından
yapı boyunca hareketleri kısıtlanmıştır. Bu nedenle, elmas iletken değildir.
Elmasın, ışığı kırma indisi çok yüksektir. Yâni içeri kabul ettiği ışın yansıttığı
ışına göre fazladır. Beyaz ışını renklere ayırma kâbiliyeti de oldukça yüksektir.
Radyasyonları tutma özelliklerine göre iki tiptedirler.
Birinci tip, görünen ışını absorbe edenler (soğuranlar, emenler); ikinci tip ise,
mor ötesi ve kızıl ötesi ışınları absorbe edenlerdir. İkinci tip elmaslar tabiî
hâlde mâvi renklidirler.
7.1. Karbon allotropları, bağ yapıları ve kullanım alanları,
Mücevherler:
Değerli taşlar olarak kullanılan elmaslar genel
olarak doğal elmaslardır. Endüstriyel amaçlar
için ya sıradan doğal elmaslar ya da, gittikçe
artarak, yapay elmaslar kullanılır.
Kömürün elmasa dönüştürme hevesleri eski
çağlardan beri düşünülmektedir. Termodinamik
hesaplamalar grafitin elmasa dönüştürülmesi
için en az 10.000 atmosfer basınç gerektiğini
göstermiştir. Bununla beraber ilk defa 1955
yılında 100.000 atmosfer basınç altında 2500°C
sıcaklıkta ve krom katalizör kullanılarak sentetik
elmas elde edilmiştir. Ancak parçalar genellikle
küçük ve siyah renkli olup, nâdiren mücevher
evsafında olabilmektedir. 1962’de yapılan bir
çalışmada 200.000 atmosfer basınç ve 5000°C
sıcaklıkta katalizörsüz olarak grafit elmasa
dönüştürülmüştür. Ancak bu elmasların hiçbir
zaman doğal elmasların yerini tutmadığı
görülmüştür.
Elmasın özellikleri:
•Elmasta C atomları sp3 hibritleşmesi yapmışlardır.
•Her C atomu 4 kovalent bağ yapmıştır.
•Elmaslar, bağ yapısından dolayı aşırı derecede sert maddelerdir. (Mohs
sertlik ölçeğine göre 10)
•Yine bağ yapısından dolayı elektrik akımını iletmezler.
•Yüksek bir ısısal iletkenliğe sahiptir(ısıyı çabucak dağıtırlar).
•Bir diğer özelliği ise fazla kırılgan olmamasıdır.
•Molekül yapısından dolayı elmasın içine girebilen tek şey ışıktır.
•Elmas, karbonun çok yüksek basınçlarda daha kararlı olan bir şeklidir. Teorik olarak, 1000-2000
°C sıcaklık aralığında ısıtılmış grafite, 105 atm ya da daha yüksek bir basınç uygulanarak, elmas
elde edilebilir.
•Oda sıcaklığında ve basıncında, elmasın grafite dönüşeceğini bekleyebiliriz. Ancak elmas gibi
kuyumculuk endüstrisinde kullanılan değerli taşların bağ ve kristal yapılarında yeni düzen
gerektiren faz değişmeleri çoğu kez aşırı derecede yavaş yürür.
Elmasın kullanım alanları:
Elmastan daha sert bir madde yoktur. Bu sebeple aşındrıcı madde olarak kyllanılır.
Elmaslar yüksek bir ısısal iletkenliğe sahip olup çelik ve diğer sert maddelerin kesme ve delme
işlemlerinde kullanılan matkapların uçlarına takılır.
Isının hızlı bir şekilde dağılması, delme ve kesme işlemini hızlandırır ve matkabın ucundaki elmas
parçalarının ömrünü uzatır.
Yeni bir buluş sonucu, metallerin üzerine doğrudan çöktürülüp kaplanmasıyla elmas filimler
hazırlanmıştır.
7.1. Karbon allotropları, bağ yapıları ve kullanım alanları,
Grafit: Karbonun diğer allotropu olan grafitte, karbon atomlarının
kovalent bağlarla oluşturduğu altıgen halkalar içeren tabakalar
bulunur. Hibridleşme modeline göre, grafitte karbon atomları sp2
hibritleşmesi yapmıştır. Altıgen halkalarda C-C, σ
bağı sp2
hibridlerinin örtüşmesinden oluşmuştur.
Hibridleşmeye girmeyen ve altıgen halkalara dik olan p orbitallerinin örtüşmesiyle oluşan π
moleküler orbitaller tüm tabakayı kapsamıştır. Bu orbitallerde π elektronlarının kristal
boyunca hareket etmesi nedeniyle grafit elektriksel iletkendir. Tabakaları bir arada tutan kuvvet
van der Waals kuvvetleridir. Bu nedenledir ki, tabakalara dik uygulanan kuvvete grafit, dikkate
değer ölçüde direnç gösterirken, yatay uygulanan kuvvet ile kolayca kırılabilmektedir.
Yerkabuğunda geniş bir alana yayılmıştır ve ticari amaçlar için yeterince zengin grafit yatakları
vardır. Bununla birlikte, endüstriyel grafitin büyük bir kısmı kok kömürü gibi karbon içeriği olan
maddelerden sentezlenir. Bunun için, karbon içeriği yüksek olan bir madde bir elektrik fırınında
3000 °C civarındaki bir sıcaklıkta ısıtılır. Bu yöntemde karbon atomları, grafit yapısı oluşuncaya
kadar büyük halkalı yapılar halinde birbiriyle kaynaşır.
Yapay ipek gibi karbon esaslı lifler, yüksek sıcaklıklara kadar dikkatli bir şekilde ısıtılır ve uçucu
maddenin tümü uzaklaştırıldıktan sonra geriye grafit yapısındaki karbon kalır.
7.1. Karbon allotropları, bağ yapıları ve kullanım alanları,
Grafitin Özellikleri:
•Şekilde verilen karbon faz diyagramından görüldüğü gibi, grafit
sadece oda sıcaklığında değil, 3000 °C ye yakın sıcaklık bölgesinde ve
104 atm ve daha yüksek basınçlarda bile kararlıdır.
•Grafit, kuru olsa bile, çok iyi yağlama özelliğine sahiptir. Bunun
nedeni, karbon atomu tabakalarının birbirlerini oldukça zayıf
kuvvetle çekmeleri olup birbirleri üzerinden kolayca kayabilmeleridir.
•Grafit ve kil karışımından yapılan ve ince bir çubuk şeklinde dökülen
kurşun kalem, kağıt üzerinden kolayca kayar.
•Elektrik akımı iletme yeteneğine sahiptir.
•Grafitin, döküm kalıplarında, fırınlarda ve diğer yüksek sıcaklıklı
ortamlarda kullanılması, onun yüksek sıcaklıklara dayanma
yeteneğine dayanır.
Grafitin kullanım alanları:
•Grafit kayganlık özelliğinden dolayı "kurşun" kalem yapımında kullanılır.
•Elektrik akımı iletme yeteneğinden dolayı grafit, pil ve endüstriyel elektrolizlerin
elektrotlarını yapmak için kullanılır.
•Grafitin yeni geliştirilmiş bir kullanım alanı, grafit lifleri ile değişik plastiklerin
karışımından ibaret olan çok dayanıklı hafif bileşimlerin (alaşımların) yapımıdır. Bu
alaşımlar, tenis raketlerinden hafif uçaklara kadar birçok üründe kullanılır.
7.1. Karbon allotropları, bağ yapıları ve kullanım alanları,
Amorf Karbon (Aktif Karbon):
Karbonun belirgin, kendilerine özgü bir yapısı ya da
biçimi olmayan allotropuna amorf karbon denir.
Odun, kömür, hindistancevizi gibi maddelerin çeşitli
işlemlerden geçirilmesiyle elde edilir. Hazırlanma işlemi
sırasında organik madde yaklaşık olarak 2000 F°'a
kadar ısıtılır ve maddeye yüksek basınç uygulanır.
Böylece karbon gözenekli yapıya bürünür, yüzeyi artar.
Öyleki 1 gramında -kullanım alanına bağlı olarak200m² ile 1500m² arasında bir yüzey elde edilir.
Gaz halindeki maddelerin adsorpisyonu için mümkün olduğunca küçük gözenekli karbonlar
tercih edilir, hindistan cevizi gibi. Eriyik haldeki maddeler için ise daha çok torf ve bitümlü kömür
kullanılır. Karbon siyahı, lastik tekerleklerde dolgu maddesi olarak (tekerlek başına birkaç kg),
matbaa mürekkeplerinde bir pigment olarak, karbon kâğıdında, daktilo şeritlerinde ve fotokopi
makinelerinde kullanılır.
7.1. Karbon allotropları, bağ yapıları ve kullanım alanları,
Fullerenler:
Son yıllarda, karbon siyahının elde edildiği tepkimeye benzer bir tepkimeden,
karbonun yeni allotroplan izole edilmiştir. Bu allotroplar; fullerenler ve
grafenler olarak bilinir.
Fulleren:
Grafen:
Fulleren: 60 C atomundan oluşan çok kararlı ve küresel (futboltopugibi) yapı,
1985’te keşfedildi. C60 molekülünden başka C20, C24 ve C82 gibi çok sayıda,
başka fullerenler de vardır.
Bu bileşikler, helyum atmosferi altında grafitin lazerle bozundurulması sonucu
elde edilirler. Azot ve oksijen fulleren oluşumunu engellediğinden, elde edilen
kurum (hava ile hidrokarbonların yanması sonucu) fulleren içermez.
Grafen: Karbon atomları 1s ve 2p orbitallerinin birleşimi ile 120 derece açılı sp2
melezleşmesi yaparken boşta kalan pz orbitalleri de grafen malzemesine sıra
dışı özellikler kazandırmaktadır.
Grafen yapısında karbon-karbon bağ uzaklığı yaklaşık olarak 1.42 Angstrom iken
grafen tabakalarının üst üste gelmesi ile meydana gelen grafitte iki grafen
tabakası arasındaki mesafe yaklaşık 3.35 Angstrom'dur. Grafendeki güçlü
karbon bağları ona yeryüzündeki bilinen en sağlam malzemelerden biri olma
özelliğini kazandırmıştır. Bununla birlikte grafitteki grafen katmanlar arasındaki
bağlar oldukça zayıftır. Kurşun kalemi kağıda sürtünce bu zayıf bağlar kırılmakta
ve kağıda yayılan grafen ve grafit tabakalar yazı izlerini oluşturmaktadır.
7.2.Nano teknoloji ve nanotüplerinin yapısı, gelecekte kullanım alanları,
Nanoteknoloji maddeyi atomik ve moleküler
seviyede kontrol etme bilimidir.
Genel olarak 100 nm ve daha küçük boyutta
malzeme ve aygıt geliştirmekle ilgilidir. (1 nm,
metrenin milyarda biridir.) Nonoteknoloji, malzeme
bilimi, elektronik, kimya, biyoloji gibi dallardan bilim
araştırmacıları,
nanoteknoloji
çalışmaları
yapmaktadır.
Günümüzde nanoteknolojinin tıp, elektronik ve
enerji üretimi gibi alanlarda uygulanma potansiyeli
vardır.
Nanoteknolojinin gelişmesini sağlayan buluş ise Tarama Tünelleme
Mikroskobu'nun keşfedilmesidir. Bu mikroskop sayesinde iletken bir yüzeydeki
atomların yerleri değiştirilebiliyordu. Bu gelişmeyi 1986'da fullerinelerin ve
karbon nanotüplerin keşfi izledi. 2000'de ABD'nin nanoteknolojiye yatırım
yapması sonucu tüm Dünya'nın birçok ülkesinde nanoteknoloji araştırmaları
başlamış oldu.
7.2.Nano teknoloji ve nanotüplerinin yapısı, gelecekte kullanım alanları,
Karbon nanotüpleri:
Karbon nanotüpleri kıvrılmış grafin yüzeyi gibi düşünebiliriz. Beyaz
kağıdı grafin olarak düşünürsek, boylamasına kıvırıp elde ettiğimiz
silindir karbon nanotüptür. Uçları açık ya da kapalı olabilir. Bu kadar
basit bir yapıya sahip olmasına rağmen, çok karmaşık bir maddedir.
Uzunluk ve çap değerine göre fiziksel ve kimyasal özellikleri çok rahat
değişebilir, kendilerine has elektriksel özelliklere sahiptirler. Isıyı iyi
iletirler.
Karbon nanotüplerin uzunluk-çap oranı 1.000.000 dur. Bu oranı şöyle
de hayal edebiliriz: 10 cm çapa sahip 100 km uzunluğunda bir
hortumun da uzunluk-çap oranı 1.000.000'dur.
İlk tek katmalı
nanotüpler (C-NT)
1994 yılında
Japonyada üretildi,
1996 da seri olarak
üretime geçti.
Fulleren C-NT için bir ara üründür. İlkin Fulleren oluşturulur. Takiben
Fulleren buharlaştırılır ve C-NT elde edilir. Fullerenler Graphenelere
ayrışır ve buradan farklı özellikte C-NT üretilir.
7.2.Nano teknoloji ve nanotüplerinin yapısı, gelecekte kullanım alanları,
Karbon nanotüplerin belirgin özellikleri :
•Fulleren C-NT için bir ara üründür,
•İnsan saçından 10.000 kat daha incedir,
•Tek katmanlı (TKNT) ya da çok katmanlı (ÇKNT) karbon atomlarından oluşur,
•Mekanik olarak çok sağlam kovalent bağ ile bağlı,
•Farklı yarı çaplarda çok kararlı yapılar,
•İletken ve elektrik alana duyarlı,
•Kimyasal olarak inerttirler,
7.2.Nano teknoloji ve nanotüplerinin yapısı, gelecekte kullanım alanları,
Karbon nanotüplerin uygulama alanları :
Enerji Depolama;
Hidrojen depolama, Lityum iyon pillerde elektrot, Elektrokimyasal Süper
kapasitörler,
Elektronik;
Magnetik alan yayma cihazları, Tranzistörler,
Nano-Cihazlar;
Nano-proplar, Nano-sensörler, Nano-yatak ve dişliler.
Karbon nanotüplerin gelecekte uygulama alanları :
C Nanotüplerde iyon ve sıvı taşınımı tasarlanıyor. Amaç, ilaçtaşınımı, iyon
taşınımı, enerji taşınımı vs.
C nanotüplerle H taşınımı planlanıyor. Ancak H C tüpe yapışıyor. Yapışma
aşılırsa H içeren yakıtlar kullanılabilecek. Bi nanotüp elektron taşınımını
sağlar.
Damarların karbon nanotüplerden yapılması düşünülmektedir.
C nanotüpe fonksiyonel grupların bağlanması. Örnek doku tamirinde
kullanılabilir (Adale yırtılması)
Kanser tedavisinde nanotüpler kullanılması hedeflenmektedir.
Nanotüplerin Gelecekte Muhtemel Kullanım alanları,
•Mikro-elektronik/ yarı iletken
•İletken Kompozitler,
•Kontrollü İlaç iletimi,
•Yapay Adaleler,
•Süper kapasitörler,
•Piller,
•Alan Yayıcı düz kare monitörler,
•Alan Etkili Tranzistörler,
•Tekli Elektron Tranzistörleri,
•Nano Lithografi,
•Nano Elektronik,
•Doplama,
•NanoTeraziler ve Denge,
•Nano Cımbızlar,
•Data Saklama,
•Magnetik nanotube,
•Nano Dişliler,
•Nanotüp Hareketlendiriciler,
•Molekülerr Kuantum Telleri,
•Hidrojen Depolama,
•Soy Radyoaktif Gaz Depolama,
•Güneş Enerjisi Depolama,
•Atık Geri Dönüşüm,
•Elektromagnetik Kalkan,
•Diyaliz Filtreleri,
•Termal Koruma,
•Nanotüp Takviyeli Kompozitler,
•Savaş Malzeme ve Cihazları i çin Takviye Elemanı
•Polimerler İçin Takviye Elemanı,
•Havacılık,
•Çarpma Korumalı Malzemeler,
•Sürtünmesiz Tekerlekler,
•Uzay asansörleri,
7.3. Karbonun oksitleri (CO,CO2) ve Karbonik asit ve karbonatların özellikleri,
doğada ve hayattaki işlevleri,
Karbonun önemli oksitleri karbon monoksit (CO) ve karbon dioksittir (CO2) tir. Havada yaklaşık
370 ppm (hacimce %0,037) CO2 bulunur. CO ise çok daha azdır. Bu gazlar havada çok az
bulunmalarına karşın, bir çok bakımdan önemlidir.
Karbon oksitlerin oluşumu;
Karbon ye karbon bileşikleri yandığında yalnızca karbon dioksit oluşur.
Örneğin; Benzinin bir bileşeni olan oktan yanınca;
C8 H18(s) + 25 2 O 2(g) 8 CO 2(g) + 9 H 2O (s)
Eğer bu yanma sınırlı miktarda hava içinde olursa, karbon monoksitte oluşur. Bu durum,
otomobil motorunda yağlı yakıt karışımı yakıldığında da meydana gelir.
Oktanın tam yanmadığı durumlarda;
C8 H18(s) + 12O2(g) 7 CO 2(g) +CO(g) + 9 H 2 O(s) tepkimesi gerçekleşir.
Hava kirliliğine neden olan CO, fosil yakıtların otomobil motorlarında tam yanmamasından
ileri gelir. CO solunum yoluyla zehirleyen bir gazdır. Çünkü, O2 taşıyan hemoglobinin Fe
atomlarına CO bağlanır ve O2 molekülleriyle yer değiştirir.
Yakıtın tam yanmaması yalnız hava kirliliğine değil, verim kaybına da neden olur. Yanma ürünü
olarak CO2(g) dan çok CO(g) oluştuğunda, belirli miktardaki benzinin yanmasından daha az ısı
elde edilir.
Karbon dioksitin eldesi:
Kok gibi karbon içeren bazı yakıtların yanmasından oluşan
baca gazından geri kazanma;
C(k) + O 2(g) CO 2(g)
Amonyak üretimin kullanılan hidrojenin eldesinde
meydana gelen karbondioksidi geri kazanma;
CH4(g) + 2H2O(g) CO2(g) 4H2(g)
Kireç taşının 900 0C ta bozunmasıyla,
CaCO3(k)
CaO(k) CO2(g)
CaCO3(k)
CaO(k) CO2(g)
Karbon monoksit eldesinde en önemli yol, doğal gazın buhar
ile muamelesidir.
CH 4(g) + H 2 O(g) CO(g) + 3 H 2(g)
Metalurjide metal oksitlerinin indirgenmesinde;
Örneğin; Taş kömürünün havasız ortamda ısıtılmasıyla oluşan ve oldukça saf karbon olan
kok, yüksek fırınlarda karbon monokside çevrilir. Bu CO de demir oksidi demire indirger.
Fe 2 O3(k) +3CO (g) 2Fe (s) + 3CO 2(g)
Karbon dioksitin özellikleri ve kullanım alanları;
Karbon dioksit çoğunlukla (yaklaşık %50 si) kuru buz halinde
gıdaların korunması, dondurulması ye taşınmasında soğutucu
olarak kullanılır. Yaklaşık %20 si içecek sanayiinde tüketilir.
Diğer önemli kullanım alanları petrol yataklarında petrol
kuyularının iyileştirilmesi ve yangın söndürme cihazlarının
yapımıdır.
Karbon dioksiti insanlardan çok bitkiler kullanır. Bitkilerde tüm
karbon içeren bileşiklerin kaynağı atmosferdeki karbon dioksittir.
Karbonmonoksit,(CO, Ma: 28.01 g/mol)
Renksiz, kokusuz bir gazdır. Bazen görüldüğü gibi, sobalarda mavi bir alevle yanar.
Çok kuvvetli bir zehirdir. Solunan havada konsantrasyonu artarsa, kana geçer ve
CO, kanın hemoglobininin merkez atomu demir iyonuna bağlanarak ölüme
sebep olur. Zehirlenme tablosunda baş ağrısı, görme bozuklukları, uyku hali, zihni
bulanıklık ve komadır.
CO endüstride jeneratör gazı, su gazı, kuvvet gazı ve hava gazı içinde kullanılır.
Yakıt olarak da kullanılmaktadır.
Sigara dumanıyla insanların kanına geçme ihtimali de yüksektir.
Karbonmonoksitin eldesi; ve kullanım alanları
Metan veya diğer hidrokarbonlardan elde edilen ye sentez gazı olarak bilinen CO
ve
karışımı metanol gibi yeni bir organik bileşiğe dönüştürülebilir.
COH
(g)2 + 2H 2(g) CH 3 OH (s)
CO endüstride jeneratör gazı, su gazı, kuvvet gazı ve hava gazı içinde kullanılır.
CO in üçüncü kullanım alanı yakıt olarak kullanılır. Genellikle CH4, H2 ve diğer
yanabilen gazlarla karıştırılarak kullanılmaktadır.
Karbonatlar:
CO2(g) suda çözünerek, genellikle karbonik asit, H2CO3 , denen çözeltiyi oluşturur. H2CO3 zayıf
asittir ve iki basamakta iyonlaşır. Bu asit birinci basamakta nötrleştirilirse, hidrojen
karbonat, asit karbonat ya da bikarbonat denen bir tuz elde edilir.
H 2 CO3(aq) + Na+OH - Na + + HCO3 + H 2O (s)
-
Sodyum Hidrojen Karbonat
Na + + HCO3 + Na + + OH - 2Na + + CO 3 + H 2O (s)
-
2-
Sodyum Karbonat
Yukarıdaki tepkimeler, karbonata bir asit eklenirse tersine dönerler. Karbonik asit CO2 ye
H2O ya parçalanır. Bu yöntemle laboratuarda CO 2(g) elde edilir.
Na 2CO3(aq) +2 H+(aq) 2Na +(aq) + H2O(s) + CO2(g)
Karbonatların Özellikleri:
•1A grubu metallerinin karbonatları suda çözünürler ve doğada maden suyu olarak
bulunurlar.
•2A grubu ye diğer metallerin karbonatları ise suda çözünmezler ve doğada genellikle
mineraller olarak bulunurlar. Kalsit (CaCO3) böyle bir mineraldir. Dolomit (CaCO 3.MgCO3) ise
diğer bir karbonat mineralidir.
•Karbonik asit/karbonat kimyasının önemi, kanın asitliğinin (pH) sabit tutulmasından,
mağraların ve sert suların olu§umuna kadar uzanır.
7.4. Silisyumun doğal bileşiklerinin yapıları, özellikleri ve kullanım alanları,
Silisyumun doğal bileşikleri;
Silisyum, yer kabuğunda en bol bulunan elementlerden biridir. Yer
kabuğunda silika(SİO2) (kum kuvartz, akik, çakmak taşı); silikatlar
(mika; kil; feldispat) minerallerinde bulunurlar.
Silisyum ilk kez 1823 yılında J. J. Berzelius tarafından K2SiF6'nın
potasyumla indirgenmesinden elde edilmiştir.
Silisyumun Eldesi;
Kuvars ya da kum (SiO2) bir elektrik ark fırınında kok ile indirgendiğinde elementel silisyum
oluşur.
SiO 2 + 2C Si + 2CO (g)
Güneş pilleri için gerekli çok saf Si, Na2SiF6 ın metalik Na ile indirgenmesiyle elde edilebilir.
Na2SiF6 ın fosfat gübrelerinin oluşumunda bir yan üründür.
7.4. Silisyumun doğal bileşiklerinin yapıları, özellikleri ve kullanım alanları,
Silisyum Karbür
Silisyumun Özellikleri;
•Silisyum, oksijenden sonra yer kabuğunda en bol bulunan (%25,7)
elementtir.
•Doğada serbest hâlde bulunmaz, bileşikleri hâlinde bulunur.
•Cam yapımında kullanılan kumun ana bileşeni olan kuvars, silisyum (IV)
oksitten (SiO2) oluşur.
•Kararlı, elmas-türü bir kristaldir.
•Oda sıcaklığında kararlı olan sadece katı bir oksit (SiO2) oluşturur; ikinci bir
oksit (SiO) sadece 1180-2480 °C sıcaklık aralığında kararlıdır.
•Silisyumun en önemli özelliği yarı iletken olmasıdır.
•Silisyum Karbür, oldukça sert ve aşınmaya karşı direnç gösterir. Silisyum
Karbür kimyasal olarak daha istikrarlı bir ürün olup, direnci yüksek
olduğundan çok daha geniş kullanım imkanına sahiptir. Metallerin elektrik
iletkenliği sıcaklıkla azalırken yarı iletkenlerin iletkenlik özellikleri sıcaklıkla
artar.
•Bazik ortamda çözünür, H2(g) ve SiO44-(aq) oluşur.
•Ana oksianyon SiO42- olup dörtyüzlü yapıya sahiptir.
•Yaklaşık altı silisyum atomu ile sınırlı silisyum atom zincirleri oluşturabilme
eğilimi gösterirler.
•Çoklu bağ oluşturması karbona göre daha az yaygındır.
•Yaklaşık tek bağ enerjileri, kJ/mol
•Si-Si=226, Si-H=318, Si-O= 464
7.4. Silisyumun doğal bileşiklerinin yapıları, özellikleri ve kullanım alanları,
Silisyum Oksitleri
Katı fazda silisyum dioksit polimerik yapıdadır. Her silisyum atomunun
çevresinde kovalent bağlarla bağlandığı dört oksijen atomu bulunmaktadır.
Silisyumun merkezde ve oksijen atomlarının köşelerde yer aldığı bir
tetrahedral geometri mevcuttur. S—O bağları, silisyumun sp3 hibrid orbitali ile
oksijenin p orbitalinin örtüşmesinden oluşan bağlarıdır. Silisyum dioksitin hal
değiştirmesinde dört σ bağı, iki σ bağı ve daha zayıf olan iki π bağına
dönüşmektedir. Bu sebeple silisyum dioksitin erime (1710°C) ve kaynama
(2200°C) noktası oldukça yüksektir.
Silisyum Karbür,
Piyasada iki çeşit silisyum karbür bulunmaktadır.
Yeşil Silisyum Karbür özellikle sert ve çok kırılgan bir aşındırıcıdır. Çarpma ve
darbelere karşı duyarlıdır. Başlıca sert metal ve seramik gibi malzemelerin,
cam ve aside dayanıklı östenitik içyapılı çeliklerin işlenmesinde kullanılır.
Siyah Silisyum Karbür çok sert fakat yeşil Silisyum Karbüre nazaran daha az
kırılgandır.
Yüksek mekanik mukavemet, yüksek oksitlenme direnci ve termal şok direnci
gibi özelliklere sahip silisyum karbür bazlı malzemeler, pişirilme fırınlarında
kullanılan refrakterler içerisinde önemli bir yere sahiptir. Balistik zırh plakalar,
aşınmaya dirençli nozul, döküm filtresi, döküm potası ve seramik fırın
malzemelerinde silisyum karbür bazlı malzemeler kullanmaktadır.
7.4. Silisyumun doğal bileşiklerinin yapıları, özellikleri ve kullanım alanları,
Organosilisyum Bileşikleri;
Birkaç silisyum-hidrojen bileşiği bilinmesine karşın özellikle Si-Si tekli bağlarının kuvvetli
olmamasından dolayı, silanlar denen bu bileşiklerdeki zincir uzunluğu altı Si atomu ile sınırlı
kalır. Silanların bir ya da daha çok H atomu yerine başka atom ya da gruplar geçirilerek
organosilanlar denen bileşikler elde edilebilir. Si ile metil klorürün doğrudan verdiği tepkime
buna tipik bir örnektir. (CH3)2SiCl2 nin suyla verdiği tepkime ilgi çekici bir bileşik olan
dimetilsilanolu, (CH3)2Si(OH)2, oluşturur.
2CH3C1 + Si (CH3 ) 2SiCl 2
CH3)2SiCl2 nin suyla verdiği tepkime
ilgi
çekici
bir
bileşik
olan
dimetilsilanolu,
(CH3)2Si(OH)2,
oluşturur.
(CH3 ) 2SiCl2 + H 2O (CH3 ) 2Si(OH) 2 2HCl
Çok sayıda silanol molekülünden H2O moleküllerinin ayrılmasıyla bir polimer oluşabilir. Bu
polimerleşme sonucunda, silikonlar denen ve uzun Si- O zinciri içeren moleküllerden ibaret
bir madde oluşur.
Bir evin "kışa hazırlanması" için,
silikon kauçuğu ile pencerelerin
macunlanması yararlı olur.
7.4. Silisyumun doğal bileşiklerinin yapıları, özellikleri ve kullanım alanları,
Silikat Anyonu:
Silikat anyonu, SiO44-, genellikle silikatlarda bulunur. Si
atomu düzgün dört yüzlünün merkezinde, dört O atomu
da düzgün dört yüzlünün köşelerindedir.
En basit silikat anyonu ortosilikat olarak adlandırılan
SiO44- dir.
Pirosilikat (Si2O76-) iyonunda bir oksijen iki SO4 birimi
tarafından paylaşılmıştır. Her silisyum atomunda iki
oksijen atomunun paylaşılmasıyla tek sıra bir zincir
yapıya da halkalı bir yapı oluşabilir. Son iki yapıya
metasilikat denir ve genel formülleri (SİO3)x2x-
7.4. Silisyumun doğal bileşiklerinin yapıları, özellikleri ve kullanım alanları,
Silisyumun kullanım alanları:
Hidratlaşmış silikat polimerleri seramik endüstrisinde önemlidir. Bir kalıba
dökülebilen kolloit (sol), sıvının önemli bir miktarı uzaldaştınlınca bir jele
dönüşür. Jel sonra işlenerek son seramik ürününe çevrilebilir. Bu sol-jel
işlemiyle bazı son derece hafif seramik maddeler elde edilebilir.
Sodyum ve kalsiyum karbonatlar kumla kanştırılıp yaklaşık 1500 °C de
sıvılaştmlırsa, sodyum ve kalsiyum silikatların bir sıvı karışımı oluşur. Bu
sıvı soğutulduğu zaman daha yapışkan olur ve sonunda ışığa karşı saydam
olan katı haline dönüşür. Bu katıya cam denir.
Kristal katılarda tanecikler düzenli bir şekilde dizildikleri halde camlar
amorf katılar olup tanecikler gelişi güzel dizilmiştir. Camdaki yapı birimleri
(silikat anyonları) karmaşık bir şekilde dizilmişlerdir. Ayrıca cam ve kristal
katı erime davranışlarında farklılık gösterirler. Cam geniş bir sıcaklık
aralığında önce yavaş yavaş yumuşayıp sonra eridiği halde, kristal katı
belirli ve kesin bir erime noktasına sahiptir.
7.5. İletkenlik (metalik iletkenlik),Yalıtkanlık, Yarı iletkenlik,
Elementler; elektrik enerjisine gösterdikleri tepkiye bağlı olarak başlıca 3 gruba ayrılırlar.
İletkenler, Yalıtkanlar, Yarıiletkenler,
7.5. İletkenlik (metalik iletkenlik),Yalıtkanlık, Yarı iletkenlik,
İletken Maddeler;
Elektrik akımı ileten maddelere iletken denir.
Örnek; Bakır, gümüş, altın ve alüminyumu iletken
maddelere örnek vere biliriz.
Bu maddelerin ortak özelliği çok az valans elektronuna
sahip olmalarıdır. Dolayısı ile atomlar bu elektronlarını
kolaylıkla kaybederler aradaki yasak bandı geçerek (bant
kuramı müfredat dışıdır) iletkenlik bandına kolaylıkla geçer
ve elektrik akımının iletilmesini sağlarlar.
Bu yüzden metallerin durumu deniz elektron modeliyle
açıklanmaktadır.
7.5. İletkenlik (metalik iletkenlik),Yalıtkanlık, Yarı iletkenlik,
Yalıtkan Maddeler;
Normal şartlarda elektrik akımına direnç gösteren ya da
iletmeyen maddelere yalıtkan denir. Yalıtkan maddeler son
yörüngelerinde 5 ile 8 arasında valans elektron bulundururlar.
Serbest elektron bulundurmazlar.
Bu walens elektronları çekirdek tarafından sıkıca çekildikleri için
yasak bandı aşıp iletkenlik bandına geçemediklerinden elektrik
akımını iletmezler.
Yalıtkan maddelere örnek olarak bakalit, ebonit,
plastik,cam..v.b ametalleri sayabiliriz.
7.5. İletkenlik (metalik iletkenlik),Yalıtkanlık, Yarı iletkenlik,
Örnek;Silisyum ve Germenyum elementlerinin yarı iletkenlik durumlarının incelenmesi;
Silisyum ve Germenyumun elektronik yapısı şekildeki
gibidir. Son yörüngedeki elektronların paylaşılmasıyla
oluşan bu tür bağlara kovalent bağ denir. Her ne
kadar kovalent bağ, valans elektronları ile ana
atomlar arasında daha sağlam bir bağa yol açsa da,
valans elektronlarının doğal sebeplerle yeteri kadar
kinetik enerji alıp kovalent bağdan koparak serbest
duruma geçmeleri mümkündür.
Bu doğal sebepler arasında foton şeklindeki ışık enerjisini ve çevreleyen ortamdaki ısı enerjisini
sayabiliriz. Sıcaklık mutlak sıfırdan (0ºK) yükselmeye başladıkça, kristal yapının kazandığı ısıl
enerji nedeniyle bazı kovalent bağlar çözülerek serbest elektronlar oluşur. Oluşan bu serbest
elektronlar iletkenlik oranını artıracak ve daha düşük bir direnç düzeyine yol açacaktır.
İletkenlerin ise birçoğunun direnci sıcaklıkla artmaktadır. Bunun nedeni, iletkendeki taşıyıcı
sayısının sıcaklık ile önemli ölçüde artmaması, fakat nispeten sabit olan konumlarının üstündeki
titreşme deseninin elektronların geçişini giderek zorlaştırmasıdır. Bu nedenle sıcaklıktaki bir
artış, direncin artmasıyla ve bir pozitif sıcaklık katsayısıyla sonuçlanmaktadır.
Ge ve Si gibi artan sıcaklıkla dirençlerinde düşüş görülen maddelere, negatif sıcaklık katsayısına
sahiptir denir.
7.5. İletkenlik (metalik iletkenlik),Yalıtkanlık, Yarı iletkenlik,
Elektron ve Delik (hole) akımı,
Bazı valans elektronlar enerji aralıklarından geçerek, valans
bandından iletkenlik bandına atlarlar. Bunlara serbest
elektron veya iletkenlik elektronları denir. Bir elektron;
valans bandından iletkenlik bandına atladığında, valans
bandında boşluklar kalacaktır. Bu boşluklara "delik=boşluk”
veya "hole” denir. Isı veya ışık enerjisi yardımıyla iletkenlik
bandına çıkan her elektron, valans bandında bir delik
oluşturur.
Bu durum, elektron boşluk çifti diye adlandırılır. İletkenlik bandındaki elektronlar enerjilerini
kaybedip, valans bandındaki boşluğa geri düştüklerinde her şey eski haline döner.
Şekilde iletkenlik bandındaki serbest elektronların negatif uçtan pozitif uca doğru gittikleri
görülmektedir. Bu; serbest elektronların hareketinin oluştuğu akımın bir türüdür. Buna elektron
akımı denir.
Akımı oluşturan bir diğer tip ise valans devresindeki değişimlerdir. Bu ise; serbest elektronlar
neticesinde boşlukların oluşması ile meydana gelir. Valans bandında kalan diğer elektronlar ise hala
diğer atomlara bağlı olup serbest değillerdir. Kristal yapı içerisinde rasgele hareket etmezler. Bununla
birlikte bir valens elektronu komşu boşluğa taşınabilir. (enerji seviyesindeki çok küçük bir değişimle).
Böylece bir boşluktan diğerine hareket edebilir. Sonuç olarak kristal yapı içerisindeki boşluklarda bir
yerden diğer yere hareket edecektir. Bu durum yukarıdaki şekilde gösterilmiştir. Boşlukların bu
hareketi de ”akım” diye adlandırılır.
7.6. Silisyumun ileri teknoloji açışından önemi,
Silisyum ya da silikon, kullanım alanı en geniş olan elementlerden biridir. Kum ve kil formu,
beton ve tuğla yapımında kullanılır. Yüksek sıcaklıklarda çalışma koşullarına çok dayanıklı bir
elementtir. Silikat formuysa, mine, emaye ve çanak-çömlek yapımında önemlidir.
Teknolojide başlıca kullanım alanları;
Çeliğin bileşimine de katılır.
Kusursuz mekanik, optik, termal ve elektriksel özellikler taşıyan en ucuz madde olan kum
halindeki silika, camın da esas bileşenidir.
Aşırı saf silisyum, bor, galyum, fosfor ya da arsenik ile güçlendirildiğinde; transistörler, güneş
gözeleri ve doğrultucular gibi, elektronik endüstrisinde büyük önem taşıyan aygıtların
yapımında kullanılan silikon karışımları elde edilir.
Elektronik mikroçiplerin yapımında yarıiletken olarak kullanılır.
Diatomlar ve radyolaryalar gibi omurgasızların dış iskeletlerinin yapısına katılması nedeniyle
de, yaşamsal önem taşımaktadır. Bu dış iskeletler, daha sonra dibe çökerek, çeşitli kayaçların
yapısına katılır.
Bitkilerin ve insan iskeletinin yapısında da silisyum bulunur.
Silikon karbid (SiC), bilinen en sert maddelerden biridir.
7.7. Yarı iletkenlerde doplama (doping),
Doplama (doping),
Silisyum veya germanyum kristalinin yarıiletkenlik özelliklerini arttırmak için grup III ve grup V
elementlerinden eser miktarda ilave edilmesi işlemine doplama denir.
P ve N tipi yarı iletken maddelerin oluşturulması,
P ve N tipi yarı iletkenler germanyum ya da silisyuma belli oranlarda yabancı madde
katılmasıyla oluşturulmaktadır. Son yörüngesinde (valans yörünge) 3 elektron bulunduran
maddeler (Indiyum, galyum, alüminyum, bor) kullanıldığında P tipi bir yarı iletken
oluşurken, 5 elektron bulunduran maddeler (Arsenik, antimuan, fosfor) kullanıldığında ise N
tipi yarı iletken elde edilmektedir.
7.7. Yarı iletkenlerde doplama (doping),
a- N (negatif) tipi yarı iletkenin oluşumu;
Son yörüngesinde 4 elektron bulunduran silisyum ya
da germanyumun içine (yaklaşık olarak 100
milyonda 1 oranında), son yörüngesinde 5 elektron
bulunduran arsenik (fosfor, antimun) maddesi
katılmışsa,
arseniğin
4
elektronu
komşu
elektronlarla kovalent bağ yapar. Bir elektron ise
boşta kalır. Serbest hale geçen beşinci arsenik
elektronu, kristal yapıdaki madde içinde dolaşır. İşte
elektron yönünden zengin olan bu karışıma N tipi
yarı iletken denir.
Kristal yapı içine katılan 5 elektronlu madde bir
elektronunu yitirdiği için elektriksel olarak pozitif (+)
yüklü iyon duruma geçer. Bu elektriksel durum basit
olarak gösterilirken, çekirdek (+) yüklü, serbest
halde dolaşan elektronlar ise (-) yüklü olarak ifade
edilir. N tipi yarı iletkenin oluşumunda kullanılan
maddeler
elektron
çoğalmasına
neden
olduklarından, bunlara verici (donör) adı verilir.
7.7. Yarı iletkenlerde doplama (doping),
N tipi yarı iletken haline gelmiş olan maddenin
serbest hale geçmiş elektronları çok olduğu için,
bunlara çoğunluk taşıyıcılar denir. Yani, N tipi
maddede elektrik akımını taşıması işinde
"çoğunluk" olan elektronlar görev yapar. N tipi yarı
iletkenlerde
elektronlar
çoğunluk
taşıyıcı
durumundayken, çok az sayıda olan oyuklar ise
azınlık taşıyıcısı durumundadır. N tipi yarı iletkene
DC gerilim uygulanırsa, serbest haldeki elektronlar,
gerilim kaynağının (+) ucunun çekme kuvveti ve (-)
ucunun da itme kuvvetiyle, katyon (+) ucuna doğru
akar. Üretecin uçları ters çevrilerek devre
gözlenecek olursa elektronların bir öncekinin tersi
yönde aktığı görülür.
7.7. Yarı iletkenlerde doplama (doping),
P (pozitif) tipi yarı iletkenin oluşumu;
Son yörüngesinde 4 elektronu bulunan silisyum ya da germanyumun içine (yaklaşık 100
milyonda 1 oranında) son yörüngesinde üç elektron bulunan bor ( galyum, indiyum,
alüminyum) karıştırılırsa, indiyumun üç elektronu komşu elektronlarla kovalent bağ yapar.
Silisyum ya da germanyumun elektronlarından birisi ise bağ yapacak indiyum elektronu
bulamaz ve dışarıdan elektron kapmak ister. İşte elektron yönünden fakir olan bu karışım
elektriksel olarak pozitif yüklü iyon kabul edilir. Elektrona ihtiyaç olan yer bir oyuk (hole,
delik,boşuk) ile ifade edilir ve bu pozitif yüklü kabul edilir. Zira oyuk, her an elektron
çekmeye uygun durumdadır. Oyuk yönünden zengin olan bu tip karışım da P tipi madde
denir.
7.7. Yarı iletkenlerde doplama (doping),
P tipi maddenin durumu basitçe gösterileceği zaman,
çekirdek eksi (-) yüklü, oyuklar ise artı (+) yüklü olarak
ifade edilir. P tipi yarı iletkenin oluşumunda kullanılan
maddeler (indiyum, galyum, bor) elektron azalmasına
neden olduklarından, bunlara alıcı (akseptor) adı verilir.
P tipi yarı iletkenlerde oyuklar çoğunluk taşıyıcı
durumundayken, çok az sayıda olan elektronlar ise
azınlık taşıyıcısı durumundadır. P tipi yarı iletkene DC
gerilim uygulanırsa, oyuklar gerilim kaynağının eksi (-)
ucunun çekme kuvveti ve artı (+) ucunun da itme
kuvvetiyle, kaynağın eksi (-) ucuna doğru akar. Üretecin
uçları ters yönlü çevrilerek devre gözlenecek olursa
oyukların bir öncekinin tersi yönde aktığı görülür.
7.8. Sn,Pb elementlerinin özellikleri ve kullanım alanları,
4 A gubunun altındaki kalay ve kurşun başlıca metalik özelliklere sahiptirler. Yarı iletken davranış
gösteren germanyuma bazan yarı metal denir. Silisyum da yarı iletkendir ve kimyasal bakımdan
ametal özellikleri gösterir. Grubun ilk üyeleleri olan karbon ametaldir.
Özellikleri,
•Her ikisi de yumuşak, dövülebilir ve düşük sıcaklıklarda erirler.
•İki metalin standart elektrot potansiyelleri ve iyonlaşma enerjileri de yaklaşık aynıdır.
•Kalay ve kurşunun ikisi de +2 ve +4 yükseltgenme durumunda bulunurlar.
•Kalay +4 yükseltgenme basamağını, kurşuna göre daha çok yeğler.
•Bir grupta aşağıya inildikçe düşük yükseltgenme basamağında bulunmaya doğru bir eğilim
gözlenir ki, bu grup 13 için de geçerlidir.
•Kalay ve kurşun arasındaki bir diğer fark, kalayın yaygın iki kristal şeklinde (α ve β) bulunmasıdır.
Oysa kurşun tek bir katı şekilde bulunur. Kalayın α (gri) ya da ametal şekli 13 °C ın altında,
/β(beyaz) ya da metal şekli 13 °C ın üstünde karar lıdır. Genel olarak β (beyaz) kalay
soğutulduğunda, α (gri) kalaya dönüşmesi için 13 °C m altında uzun bir süre tutulmalıdır. Bir kez
dönüşüm başlayınca oldukça hızlı meydana gelir ve belirgin şekilde sonuçlanır.
•α (gri) kalay β (beyaz) kalaydan daha yoğun olduğundan, kalay genişler ve toz halinde ufalanır. Bu
dönüşüm kalaydan yapılmış eşyaların parçalanmasına neden olur. Bazı org boruları kalaydan
yapılmış olduğundan, bu durum soğuk iklimlerde kiliselerde özel bir sorun olmuştur. Kuzey
Avrupa'da bu dönüşüm kalay hastalığı, kalay vebası ya ada kolay belası olarak adlandırılır.
7.8. Sn,Pb elementlerinin özellikleri ve kullanım alanları,
Kalay üretimi;
En önemli kalay cevheri kassiterit, SnO2, dir. İlk başta saflaştırılan cevherdeki kalay (IV) oksit,
sonra kalay metalini vermek üzere karbon (kok) ile indirgenir.
SnO2(k) + C(k)
Sn(s) + CO2(g)
Kalayın kullanım alanları;
Üretilen kalay metalinin hemen hemen yarısı kalayla kaplamada, özellikle besinIeri saklamada
kullanılan konserve kutuları için demiri kaplamada kullanılır.
Ikinci olarak en önemli kullanım alanı (yaklaşık % 25), telleri ya da metal parçalarını birleştirmede
kullanılan düşük sıcaklıkta eriyen alaşımlar, yani lehim yapımıdıır.
Kurşun üretimi;
Kalayın diğer önemli alaşımları bronz (% 90 Cu, % 10 Sn) ve pevter (% 85 Sn, % 7 Cu, % 6 Bi, % 2
Sb) dir.
Kalay ve kurşun alaşımları org borusu yapımında kullanılır.
Kurşun başlıca galen ( PbS) şeklinde bulunur. PbS önce havada ısıtılarak (kavurma) kurşun okside
dönüştürülür. Daha sonra oksit kok kömüırü ile indirgenir ve Pb metali elde edilir.
2 PbS(k) + 3 O 2(g)
2 PbO(k) + 2 SO2(g)
2 PbO(k) + C(k)
2 Pb (s) + CO 2(g)
Üretilen kurşunun yarısından fazlası kurşun-asit (akümülatör) bataryasında kullanılır.
Diğer kullanıldığı yerler, lehim yapımı ve başka alaşımlar, cephane ve radyasyon kalkanı (Xışınlarına karşı koruma) dır.
7.8. Sn,Pb elementlerinin özellikleri ve kullanım alanları,
Kalay ve kurşunun bileşikleri;
Kalay başlıca iki oksit, SnO ve SnO2 oluşturur.
SnO havada ısıtılarak SnO2 e dönüştürülebilir. SnO2 mücevher aşındırıcı olarak kullanılır.
Kurşunun en iyi bilinen oksitleri sarı PbO (litarj), kırmızı-kahve renli kurşun dioksit, (PbO2) ve
kırmızı kurşun(Pb3O4) olarak bilinen karışık değerlikli oksittir.
Kurşun oksitler kurşun-asit akümülatörleri, cam, seramik sırlama, çimentolar (PbO), metal
koruyucu yağlı boyalar (Pb3O4) ve kibritlerin (PbO2) yapımında kullanıhrlar. Diğer kurşun
bileşikleri genellikle oksitlerden elde edilirler. Kurşun +2 yükseltgenme basamağında olmayı
yeğlediğinden, Pb (IV) bileşikleri Pb(II) ye indirgenme eğilimi gösterirler ve bu nedenle iyi
yükseltgendirler. Bu nedenle, PbO2 önemlidir.
PbO2(k) + 4 H+(aq) + 2 e- Pb2+(aq) + 2 H2O(s)
Halojenürler
Kalayın klorürleri (SnCl2 ve SnCl4) sanayide önemli kullanıma sahiptirler. SnCl2 iyi bir indirgendir
ve sulu çözeltide Fe(III) ü Fe(II) ye indirgeyerek demir cevherinin kantitatif analizinde kullanılır.
SnCl4, kalay ile Cl2(g) un doğrudan tepkimesinden oluşur; hurda kalay kaplamalardan kalayın
yeniden kazanılmasım sağlar. Kalay(II) florür, SnF2 (stannöz florür), diş macununda boşluk
dolduran katkı maddesi olarak önemli bir kullanıma sahiptir.
7.8. Sn,Pb elementlerinin özellikleri ve kullanım alanları,
Kurşun Zehirlemesi
Kurşun biyokimyasal tepkimelere zarar vererek hemoglobindeki demir içeren "hem" grubunu
çıkarır. Kanda 10-15 pg/100 mL kadar az Pb, özellikle küçük çocuklarda fizyolojik etki meydana
getirir. Kurşunlu benzinin kullanılmasının bırakılması kandaki Kurşun zehirlenmesinin yavaş şekli
sinirliliğe ve zihinsel depresyona neden olur. Daha ciddi durumlar kalıcı sinir, beyin ve böbrek
tahribatına götürür.
Kurşunlu benzinin kullanılmasının bırakılması kandaki ortalama kurşun düzeyinin belirgin şekilde
düşmesini sağlamıştır. Günümüzde kurşun kirliliğinin başlıca kaynağı olarak, eski yapıların kurşun
esaslı yağlı boyalı yüzeyleri ve tesisatların lehimlenmiş ek yerleri görülmektedir. Modern tesisat
lehiminden kurşun çıkartılmış olup, şimdi % 95 Sn % 5 Sb karışımı kullanılır.
NOT: Bu konu MEB kimya kitabında daha kısa anlatılmış, ama kazanımlarda detaylara girilmiştir.
MT
8.BÖLÜM:5A GRUBU ELEMENTLERİ
KONU BAŞLIKLARI
KAZANIMLAR
8.1. Havadan azot elde etme yöntemi, 8.1. Havadan azot elde etme yöntemini açıklar.
8.2. Azot molekülünün yapısı özellikleri 8.2. Azot molekülünün yapısını özellikleri ve kullanım
ve kullanım alanları,
alanları ile iliskilendirir.
8.3.
Azotun
farklı
yükseltgenme 8.3. Azotun farklı yükseltgenme basamaklarında
basamaklarında bulunduğu bileşikleri, bulunduğu bileşiklerine örnekler verir.
8.4. Azot oksitlerinin oluşumu ve çevre 8.4. Azot oksitlerinin olusumunu ve çevre çin zararlı
için zararlı etkileri,
etkilerini tartısır.
8.5. Başlıca azot bileşiklerinin elde ediliş 8.5. Baslıca azot bilesiklerinin elde edilis yöntemlerini ve
yöntemleri ve kullanım alanları,
kullanım alanlarını açıklar.
8.6. Fosfor elementinin elde ediliş 8.6. Fosfor elementinin elde edilis yöntemini ve
yöntemini ve allotroplarının özellikleri, allotroplarının özelliklerini açıklar.
8.7. Fosforik asitlerin ve tuzlarının 8.7. Fosforik asitlerin ve tuzlarının kullanım alanlarını
kullanım alanları, özellikleri,
özellikleri ile iliskilendirir.
8.8. Fosfatlı gübreler ve deterjanlardan 8.8. Fosfatlı gübreler ve deterjanlardan kaynaklanan çevre
kaynaklanan çevre sorunlarını,
sorunlarını sorgular.
8.9. 5A grubundaki diğer elementlerin ve 8.9. 5A grubundaki diğer elementlerin ve bileşiklerinin
bileşiklerinin kullanım alanları,
kullanım alanlarına örnekler verir.
8.1. Havadan azot elde etme yöntemi,
Temiz hava kompresöre
beslenir
ye
soğutma
biriminde soğutulur. Soğuk
hava genleşme vanasından
geçirilir ve sıvılaşıncaya
kadar soğutulur. Sıvı hava,
içindeki
katı
CO2
ye
hidrokarbonlardan
arındırmak için süzülür ve
daha sonra damıtılır. Sıvı
hava damıtma kolonunun
üst tarafına gönderilir.
Burada en uçucu (kaynama noktası en düşük) bileşen olan azot ortamdan ayrılır.
Kolonun ortalarında argon gaz haline gelerek ayrılır. En az uçucu bileşen olan sıvı
oksijen kolonun dibinde toplanır. Azot,argon ye oksijenin kaynama noktaları, sıra ile
77,4, 87,5 ve 90,2 K dir.
8.2. Azot molekülünün yapısı özellikleri ve kullanım alanları,
Azot birçok bileşikte bulunmasına rağmen, N2 oldukça inerttir.
N2'nin inertliği ve tepkime verme hızının düşük oluşu birkaç
etkenden ileri gelmektedir.
1. NΞN bağının kuvvetli olması nedeniyle aktivasyon enerjisi
yüksektir.
2. 2. N2 molekülünün polarlanabilirliği düşüktür. Bu durum,
nükleofil ya da elektrofil yer değiştirme tepkimelerinde ara
ürün (polar geçiş hali) oluşumunu güçleştirmektedir.
N
N
Bunların bir sonucudur ki, azotun allotropları mevcut değildir.
Oda sıcaklığında birkaç güçlü indirgenden elektron
alabilmektedir. Bu indirgenlerden biri Iityumdur. Lityum ile
oda sıcaklığında yavaş bir etkileşim sonucu Li3N oluşmaktadır.
8.2. Azot molekülünün yapısı özellikleri ve kullanım alanları,
Özellikleri;
•Her şeyden önce elektronegatifliği oldukça yüksektir.
•Değerlik kabuğunda d alt kabuğunun olmaması nedeniyle, dörtlü koordinasyondan yüksek
moleküler bileşikleri yok denecek kadar azdır.
•Bakterilerin oda sıcaklığında N2'yi birçok bileşiğe dönüştürmesi, N2'nin etkinleştirilmesi
konusunda önemli ipuçları vermektedir.
•N2, nitrojenaz enzimi ile NH4+ ya dönüşmektedir. Bu enzim üzerinde yapılan araştırmalarda
enzimin demir ve molibden içerdiği belirlenmiştir.
Kullanıldığı yerler;
•Atmosferin hacimce %78'ini oluşturan azot, sıvı havanın damıtılmasıyla üretilir.
•Üçlü bağ içerdiğinden oldukça kararlıdır ve tepkimeye girme yatkınlığı düşüktür.
•Bu nedenle, oksijen ve neme duyarlı tepkimelerin gerçekleştirilmesinde, inert ortam olarak
azot gazı kullanılır.
•Sıvı azot düşük sıcaklıkta gerçekleştirilen tepkimeler için uygun bir soğutucudur.
8.3. Azotun farklı yükseltgenme basamaklarında bulunduğu bileşikleri,
Azot değişik bileşiklerinde farklı değerliklere sahip olabilmektedir.
Eksi yükseltgenme basamağı sadece -3 değil, -2,-1 (NH2OH, N2H4) yükseltgenme
basamağında da buluna bilirler.
Azit ya da trinitrit (N3-) iyonunda azotun yükseltgenme basamağı -1/3 tür.
Azit iyonu, hidrazoik (HN3) asidinin eşlenik bazıdır.
Azot +1 ben +5 e kadar farklı pozitif yükseltgenme basamaklarında da buluna bilirler.
Örnek olarak; N2O, NO, N2O3, NO2 ve N2O5 bileşikleri verile bilir.
8.4. Azot oksitlerinin oluşumu ve çevre için zararlı etkileri,
Azotun Oksitieri :
Azot oksitlerin ilginç özelliklerinden birisi oluşum serbest enerjilerinin pozitif olmasıdır.
2N2O(g) 2N2(g) + O2(g) G0 =-208 kJ (298 K de)
Bu özellik oksitlerin termodinamik olarak kararsızlığının bir ölçüsüdür. N2O tin oda sıcaklığında
bozunmamasının sebebi bozunma entalpisinin yüksek olmasından kaynaklanmaktadır.
32,5 °C ve 1 atm basınçta süblimleşen bir katı olan N2O5 hariç, azotun tüm oksitleri 25 °C de
gazdır. Kahverengi NO2(g) ve onun renksiz dimeri N2O4(g) arasındaki denge nedeniyle; yaklaşık
-10 °C ile 140 °C arasındaki sıcaklıklarda bu gazları saf olarak elde etmek mümkün değildir.
Düşük sıcaklıklarda N2O4 saf bir katı olarak elde edilebilir. 140 °C nin üzerindeki gaz fazı
dengesinde, dengenin yönü daha çok NO2(g) lehinedir. N2O3 katı halde açık mavi, sıvı halde
daha canlı mavi bir renktedir.
8.4. Azot oksitlerinin oluşumu ve çevre için zararlı etkileri,
8.4. Azot oksitlerinin oluşumu ve çevre için zararlı etkileri,
8.4. Azot oksitlerinin oluşumu ve çevre için zararlı etkileri,
8.5. Başlıca azot bileşiklerinin elde ediliş yöntemleri ve kullanım alanları,
Azot Hidrürler
Azotun oluşturduğu hidrürler NH3 (amonyak), N2H4 (hidrazin), N2H2 (diazen ya da diimit) ve
HN3 (hidrazoik asit)'tür.
8.5. Başlıca azot bileşiklerinin elde ediliş yöntemleri ve kullanım alanları,
Doğada amonyak, atmosferik N2'den azotbağlayıcı bakteriler tarafından üretilir.
Bakterilerde bulunan nitrojenaz enzimi NH3
oluşumunu katalizlemektedir. Endüstride ince
öğütülmüş demir katalizörlüğünde H2 ve
N2'den NH3 elde edilir:
380 C/200 atm
3H2 + N2
2NH3
0
Üretilen amonyak gübrelerde, patlayıcı
maddelerin sentezinde, sentetik elyaf
üretiminde, çok çeşitli organik ve inorganik
bileşiklerin sentezinde kullanılır.
N 2 H 4 + O2 N 2 + 2H 2 O H° = - 622 kJ mol-1
Hidrazinin oksijen ile yükseltgenmesi ekzotermiktir. Bu nedenle hidrazin ve metil
türevleri roket yakıtlarında kullanılmaktadır
8.5. Başlıca azot bileşiklerinin elde ediliş yöntemleri ve kullanım alanları,
Nitrürler:
Azot, İyonik (tuz benzeri) nitrürlerde, azot N3- iyonu olarak bulunur. Bu bileşikler lityum ve
grup 2 deki metallerle oluşur. Sözgelimi, magnezyum havada yandığı zaman, ana ürün olarak
meydana gelen magnezyum oksit yanında, az miktarda magnezyum nitrür de vardır.
Nitrür iyonu çok kuvvetli bir bazdır. Sulu çözeltide, su molekülünden protonları alarak
amonyak ve hidroksit iyonlan oluşturur.
3Mg (k) + N 2(g) Mg 3 N 2(k)
N3-(aq) + 3H2O(s) NH3(aq) + 3OH-(aq)
8.5. Başlıca azot bileşiklerinin elde ediliş yöntemleri ve kullanım alanları,
Azit:
Azotun, azit ya da trinitrit (N3-) iyonunda azotun yükseltgenme basamağı -1/3 tür. Azit iyonu,
hidrazoik (HN3) asidinin eşlenik bazıdır. Yüksek sıcaklıkta NO3- ya da N2O'nun NaNH2 (sodarnit)
ile yükseltgenmesinden elde edilir.
N3- iyonu metal katyonlarına karşı iyi bir liganddır. Pb(N3)2 ve Hg(N3)2 gibi ağır metal
kompleksleri patlayıcıdırlar. NaN3 tuzları termodinamik alarak kararsız, buna karşın kinetik
olarak kararlıdır. Alkali metal tuzları ısıtıldığında N2 açığa çıkar.
3NH 2 + NO3 N3 + 3OH - + NH3
-
-
-
2NH 2 + N 2O N3 + OH - + NH3
-
-
8.6. Fosfor elementinin elde ediliş yöntemini ve allotroplarının özellikleri,
8.6. 1. Fosfor elementinin elde ediliş yöntemi,
Fosfor, yeryüzünde kütlece % 0,11 lik bir oranla onbirinci
sırada yer alan bir element olmasına rağmen, 1669 yılına
kadar keşfedilemedi. İlk olarak bozunmuş idrardan (hoş
olmayan ama iyi bir kaynak) elde edildi.
Günümüzde fosfor bileşiklerinin ana kaynağı, apatitler olarak
bilinen florapatit [Ca5(PO4)3F, 3Ca3(PO4)2. CaF2] ve bir mineral
sınıfı olan fosfat kayalarıdır. Elementel fosfor, fosfat kayası,
silisyum dioksit (SiO2) ve kok (C) karışımının bir elektrik
fırınında ısıtılmasıyla elde edilir. Net tepkime eşitliği aşağıdaki
gibidir.
2 Ca3 (PO4 )2(k) +10C(k) +6SiO2(k)
6 CaSiO3(s) +10CO(g) + P4(g)
P4(g), yoğunlaştırılıp toplanır ve beyaz fosfor olarak su altında saklanır.
8.6.2.Fosfor elementinin allotropları ve özellikleri,
Fosforun yaygın olarak kullanılan iki allotropu beyaz fosfor ve kırmızı
fosfordur.
Beyaz fosfor;
Beyaz fosfor beyaz, mumsu ve bıçakla kesilebilen fosforesan (fosforesan
bir madde karanlıkta ışıldar) bir katıdır. Beyaz fosfor, elektriği iletmeyen,
havada kendiliğinden tutuşabilen (bu yüzden su altında saklanır) bir
maddedir.
Beyaz fosforun temel yapı birimleri P4 molekülleridir. P4 molekülü her köşede bir P atomunun
olduğu dörtyüzlü yapıdadır. P4 de P-P bağlan 3p orbitallerinin örtüşmesiyle oluşur. Normal
olarak böyle örtüşmeler 90° bağ açıları 60° dir. Bu bağlara gerilimli bağlar denir ve beklenildiği
gibi, gerilimli bağlar içeren moleküller etkindir.
Beyaz fosfor havada kendiliğinden yanarak fosfor trioksit ve pentaoksit verir. Halojenlerle,
kükürt ve bazı metallerle de tepkimeye girer. Kibrit, cephane, böcek öldürücü, çelik, fosfor
tuncu, fosforik asit ve fosfatlı gübre yapımında kullanılır. Beyaz fosfor, sodyum hidroksit
çözeltisiyle kaynatıldığında renksiz, son derece zehirli bir gaz olan fosfin (PH3)e dönüşür. Bu
gaz kimyasal silâh olarak kullanılmıştır. Fosfor yaşam için de gerekli bir elementtir. Kemikte
kalsiyum fosfat biçiminde bulunur. Canlı dokulardaki yüksek enerjili bir dizi bileşiği de fosfatlar
(özellikle adenosin trifosfat, ATP) oluşturur.
8.7. Fosforik asitlerin ve tuzlarının kullanım alanları, özellikleri,
Krmızı fosfor;
Beyaz fosfor havasız yerde 300 °C dolayında ısıtıldığı zaman kırmızı fosfora dönüşür. Burada,
her P4 mülekülündeki bir P-P bağı kopar ve böylece oluşan parçalar uzun zincirler
oluşturmak üzere birbirlerine bağlanırlar. Kırmızı P beyaz P dan daha az etkindir. Kırmızı ve
beyaz fosforun temel yapı birimlerindeki atom düzenleri farklı olduğundan, bunlara fosforun
allotropları denir. Kırmızı fosforun üçlü noktası 590 °C ve 43 atm dir. Bu nedenle yaklaşık 420
°C civarında erimeden süblimleşir.
Kırmızı Fosfor, beyaz fosforun polimerleşmesi gibi düşünüle bilir. Elementel fosfor kolayca
oksitlenir ve bu yüksek reaktivite sonucunda tehlikeli sonuçlar oluştura bilir ancak, kırmızı
fosfor daha az reaktiftir. Kırmızı fosfor kibrit yapımında kullanılır.
Kiprit Üretimi:
1831 yılında kullanılışı basit ilk kibrit beyaz fosfor kullanılarak yapılmıştır.
Kokusuz kibrit olmasına rağmen beyaz fosforun zehirli olmasından dolayı pek
tutulmamıştır. 1855'de İsveçli Johan Edvard Lundstrom ilk güvenlik kibritinin
patentini almayı başarmıştır. Yaptığı kibrit ise bir kutunun dış yüzeyine kırmızı
fosfor sürüp kalan kimyasal maddeleri ise kibrit çöpünün uç kısmına
yerleştirilmesi sonucu meydana geliyor. Beyaz fosforun zehirinden ve sürtünme
kibritlerinde görünen şiddetli alev alma sorunlarını gidermiştir. 1889'da Joshua
Pusey, ilk kibrit kutusunu icat edip patentini almış, 1896'da patentini Diamond
Match Company'ye 4000 dolar ve bir iş karşılığında satmıştır.
8.7. Fosforun önemli bileşiklerinin kullanım alanları ve özellikleri, (Oksitleri,
asitleri ve tuzları)
Fosforun oksitleri:
Fosforun en önemli bileşikleri, fosforun +3 ve +5 yükseltgenme
basamaklarına sahip olduğu oksit ve oksiasitlerdir.
P4 un sınırlı miktarda O2(g) ile tepkimesi P4O6 oluşturur ve aşırı
O2(g) kullanılırsa P4O10 elde edilir. Fosfor oksitler için
yazabileceğimiz en basit formüller ve adları sıra ile P2O3 (fosfor
trioksit) ve P2O5 (fosfor pentoksit) dir. Bununla beraber P2O3 ve
P2O5 sadece basit formüllerdir. Bu oksitlerin gerçek molekül
formülleri, P4O6 ve P4O10 dır.
Her bir oksit molekülünün yapısı P4 dörtyüzlüsüne dayanır ve
bunun için her molekül dört P atomuna sahip olmalıdır. P4O6
molekülündeki P4 dörtyüzlüsünde P atomlan birbirlerine çifter
çifter O atomlanyla bağlanır ve bu da her P4 dörtyüzlüsü başına
altı O atomu anlamına gelir. P4O10 molekülünde ise altı O köprü
atomuna ek olarak her köşe P atomuna bir O atomu daha
bağlanır. Bu da, P4 dörtyüzlüsü başına toplam on O atomu
anlamına gelir.
8.7. Fosforun önemli bileşiklerinin kullanım alanları ve özellikleri, (Oksitleri,
asitleri ve tuzları)
Fosforun oksi asitleri;
P2O3 (fosfor trioksit) ve P2O5 (fosfor pentoksit) her ikisi de asit anhidrit olan fosfor oksitleri
suyla etkileşince oksi asitler verirler.
P4 O6(s) + 6 H 2 O(s) 4 H 3 PO3(aq)
fosforöz asit
P4 O10(k) + 6 H 2 O(s) 4H 3PO 4(s)
fosforik asit
Fosforik asidin çoğu, sülfürik asidin fosfat kayası ile etkileştirilmesinden elde edilir.
3Ca 3 (PO4 )2 .CaF2(k) +10 H2SO4(der aq) + 20H2O(s) 6H3PO4(aq) + 10 CaSO4 .2H2O(k) + 2 HF(aq)
fkorapatit
alçı taşı
8.7. Fosforun önemli bileşiklerinin kullanım alanları ve özellikleri, (Oksitleri,
asitleri ve tuzları)
Yapıları zincir şeklinde olan fosforik asitlere polifosforik asitler ve tuzlarına da polifosfatlar
denir. Özellikle canlı organizmalarda bulunan polifosforik asitlerin iki önemli türevi ADP ve
ATP dir.
8.7. Fosforun önemli bileşiklerinin kullanım alanları ve özellikleri, (Oksitleri,
asitleri ve tuzları)
Fosforun tuzları (fosfatlar): PO4 -3 iyonunun
değişik element ve köklerle yaptıkları
bileşiklere genel anlamda fosfatlar denir.
Tabiatta en yaygın bulunan fosfat minerali
apatit [Ca5(PO4)3(F,Cl,OH)] olup yapısı şekilde
gösterilmektedir.
(PO4) gruplarının oksijenleri iki farklı yapısal yerde bağlantı gösterirler. Ca, bunlardan birinde
düzensiz 9’lu koordinasyon diğerinde ise 8’li koordinasyon halindedir. Her F (Cl veya OH) üç
Ca ile bir üçgen meydana getirir. Apatit hem anyonlar hem de katyonlar ile çeşitli katı
eriyikler yapar.
Florapatit [Ca5(PO4)3F] en yaygın bulunan apatit türüdür. Klorapatit [Ca5(PO4)3F] ve
hidroksilapatit [Ca5(PO4)3OH] ise daha seyrek olarak bulunurlar. F, Cl ve OH, birbirinin yerini
alarak tam katı eriyik serileri meydana getirebilirler.
Seyrekte olsa doğada bulunan diğer fosfat bileşikleri;
Litiofilit: Li(Mn, Fe)PO4, Monazit (Ce,La,Y,Th)PO4, Apatit: Ca5(PO4)3(F,Cl,OH)
Piromorfit: Pb5(PO4)3Cl, Ambligonit LiAlPO4F, Lazulit: (Mg,Fe)Al2(PO4)2(OH)2
Skorzalit: (Fe,Mg)Al2(PO4)2(OH)2, Vavellit : Al3(PO4)2(OH)3.5H2O, Turkuaz:
CuAl6(PO4)4(OH)8.4H2O
8.8. Fosfatlı gübreler ve deterjanlardan kaynaklanan çevre sorunlarını,
Gübre ve deterjanların içerdiği fosfatlı bileşikler değişik
yollarla çevreye yayılmakta ve çevresel sorunlara yol
açmaktadır. Fosfor, bitkilerin büyümesi için zorunlu bir besin
olduğundan, fosfatlar gübre olarak çok kullanılır. Fazla gübre
kullanımı, göl ve akarsuların fosfat kirlenmesine ve bunun
sonucunda da özellikle deniz yosunları olmak üzere bir bitki
büyümesi patlamasına neden olabilir. Deniz yosunları suda
çözünmüş O2 derişimini düşürür ve O2 nin bu eksikliği de
balıkları öldürür. Besin maddeleri ile zenginleşmelerinin bir
sonucu olarak tatlı su kitlelerinde oluşan bu tür değişmeye
ötrofikasyon denir. Bu, jeolojik çağlar boyunca meydana
gelen doğal bir süreç olup insan etkinlikleriyle büyük çapta
hızlandırılır.
Bunun için çevreye fosfat ulaşımının azaltılması, lağım
sularının arıtma tesislerinde işlenmesi ve fosfatın lağım
sularından uzaklaştırılması gerekmektedir.
8.9. 5A grubundaki diğer elementlerin ve bileşiklerinin kullanım alanları,
Arsenik, As sembolü ile gösterilen ve periyodik cetvelin 5A grubunda
bulunan bir elementtir. Arsenik, bileşiklerinde 5+, 3+ ve -3 değerlikleri
alabilir.
Arsenik, arsenik içeren metal sülfürler ısıtılarak elde edilir. Örneğin, FeAsS
ısıtıldığında FeS ve As(g) verir. As(g), As(k) halinde yoğunlaştırılıp toplanır ve sonra
diğer bileşiklerin elde edilmesinde kullanılabilir. Arseniğin bir kısmı CO(g) ile arsenik
(III) oksitin indirgenmesinden de elde edilebilir.
Arseniğin üç allotropu mevcuttur. Bunlardan gri arsenik metalik halde bulunur ve
kararlıdır. Bunun yoğunluğu büyüktür. Sarı arsenik ametalik halde olup dört atomlu
As4 moleküllerden meydana gelir ve uçucudur. Bu, arsenik buharının ani
soğutulması ile elde edilir. Amorf olan siyah arsenik, arsin'in (AsH3), ısı ile
bozunmasından
elde
edilir.
Arsenik; bronz eldesinde, pirotekni alanında, mermi ve güllelerin sertliğinin ve
şeklinin sağlanmasında kullanılır. Bazı bileşikleri tarım alanında böcek öldürücü ya
da zehir olarak kullanılmaktadır. Transistörler gibi hareketli parçaları bulunmayan
aygıtların yapımında da son zamanlarda önem kazanmıştır. Lazerlerin, LED'lerin ve
yarıiletkenlerin de yapısına katılır. Solunduğunda güçlü bir karsinojen (kanser yapıcı)
olan arsenik, bağırsaklar ve karaciğer üzerinde yüksek derecede tahribata neden
olur. Zararlılarla mücadele için kullanılan kimyasalların ve ahşap koruyucuların
bileşiminde bulunan arsenik, yutulması durumunda zehir etkisi gösterir.
8.9. 5A grubundaki diğer elementlerin ve bileşiklerinin kullanım alanları,
Antimon (Sb), periyodik tablonun 5-A grubunda yer
alan elementtir. Periyodik tablonun 51. Elementidir
(Atom numarası: 51). Erime noktası 630, kaynama
noktası ise 1380 derecedir.
Doğal antimon, sülfürlerden (Sb2S3) elde edilir.
Metale benzeyen, kırılabilen ve kolayca toz durumuna
getirilebilen gümüş beyazı renginde bir katıdır.
Antimon türevleri tıpta balgam söktürücü olarak
kullanılır.
Kimyada da alaşımlarda kullanılır. Bazı tuzları bazı
hastalıkların tedavisinde etkili maddelerdir. Ayrıca
akülerde de kullanıldığı bilinir. Cephane yapımında,
cam ve seramik sanayinde ve renklendirmede
kullanılır.
8.9. 5A grubundaki diğer elementlerin ve bileşiklerinin kullanım alanları,
Antimon (Sb), periyodik tablonun 5-A grubunda yer
alan elementtir. Periyodik tablonun 51. Elementidir
(Atom numarası: 51). Erime noktası 630, kaynama
noktası ise 1380 derecedir.
Doğal antimon, sülfürlerden (Sb2S3) elde edilir.
Metale benzeyen, kırılabilen ve kolayca toz durumuna
getirilebilen gümüş beyazı renginde bir katıdır.
Antimon türevleri tıpta balgam söktürücü olarak
kullanılır.
Kimyada da alaşımlarda kullanılır. Bazı tuzları bazı
hastalıkların tedavisinde etkili maddelerdir. Ayrıca
akülerde de kullanıldığı bilinir. Cephane yapımında,
cam ve seramik sanayinde ve renklendirmede
kullanılır.
8.9. 5A grubundaki diğer elementlerin ve bileşiklerinin kullanım alanları,
Bizmut (sembolü Bi), periyodik tabloda 5-A grubunda yer alan
atom numarası 83 olan elementtir. Atom ağırlığı 208,98 g/mol,
oda sıcaklığındaki yaklaşık yoğunluğu 9,8 g/cm³, atom yarıçapı
160pm'dir. Erime noktası 271,3 santigrat derece, kaynama
noktası 1564 santigrat derecedir.
Bizmut gri renkli bir metaldir. Doğada serbest olarak ya da sülfür ve oksitleri halinde
bulunur. Bizmut filizlerinin hidrometalik ya da pirometalurjik işlemler sonucu
yoğunlaştırılmasıyla ya da bakır ve kurşun cevherlerinin saflaştırılmasından yan ürün olarak
elde edilir.
Bizmutun, katı hale geçerken %3,32 oranında genleşmek gibi ilginç ve farklı bir özelliği
vardır. Bu yüzden alaşımları, yüksek sıcaklıklardan zarar görebilecek malzemelerin yapısında
kullanılmaya son derece uygundur. Bu alaşımlar ayrıca, bizmutun soğudukça genleşme
özelliği nedeniyle, sıvı olarak döküldükleri kapta soğuyup katı hale geçerken, kabın şeklini
alırlar. Kalay ve kadmiyum gibi metallerle oluşturduğu, erime noktası düşük alaşımlar,
yangın alarmları ve söndürücü güvenlik donanımlarının yapımında kullanılır. İşlenebilir
demir yapımında ve akrilik elyaf eldesinde katalizör olarak kullanılır. Bilinen en yüksek
elektronegatifliğe sahiptir. Lastik üretiminde, cam ve seramik sanayinde, eczacılıkta ve
parfümeride de kullanımı vardır. Isıluç olarak da kullanılan bizmut, nükleer santrallerde U235 ve U-233 izotoplarını içeren yakıtların taşınmasında kullanılmaktadır. MnBi'den elde
edilen "Bismanol" adlı alaşım, yüksek kaldırma kuvvetine sahip, kalıcı bir mıknatıstır.
9.bölüm
KONU BAŞLIKLARI
9.1. Laboratuvarda ve endüstride
oksijen üretim yöntemleri,
KAZANIMLAR
9.1. Laboratuvarda ve endüstride oksijen
üretim yöntemlerini açıklar.
9.2. Oksijen elementinin kullanım
alanları,
9.3. Oksit tipleri ve oksitlerin
sınıflandırması,
9.4. Ozonun molekül yapısı ile
özellikleri ve kullanım alanları,
9.2. Oksijen elementinin kullanım
alanlarına örnekler verir.
9.3. Oksit tiplerini ve sınıflandırma
esaslarını açıklar.
9.4. Ozonun molekül yapısı ile özellikleri
ve kullanım alanları arasında iliski kurar.
9.5. Atmosferdeki ozonun
oluşumunu ve çevre açısından
önemini,
9.6. Kükürt üretimi ve kullanım
alanları,
9.5. Atmosferdeki ozonun oluşumunu ve
çevre açısından önemini açıklar.
9.7. Baslıca kükürt bileşiklerinin
üretimi ve kullanımı çevre kirliliği
ile ilişkileri,
9.7. Baslıca kükürt bileşiklerinin üretimini
ve kullanımını çevre kirliliği ile de
ilişkilendirerek irdeler.
9.6. Kükürdün üretimini ve kullanım
alanlarını tepkimeleriyle açıklar.
9.1. Laboratuarda ve endüstride oksijen üretim yöntemleri,
Normal koşullarda 6A Grubunun gaz halinde tek elementi olan oksijenin 16O, 17O ve 18O
olmak üzere üç izotopu vardır. Bunların bollukları, sırasıyla, %99.7, %0.2 ve %0.1 dir.
Oksijen atmosferde büyük oranda O2 ve çok az miktarda O3 halinde bulunur.6A Grubunun
ilk elementi olan oksijen, yer kabuğunda kütlece %46, atmosferde %21 oranında bulunur.
Bolluğu yüksek olmasına rağmen, saf oksijen elementi 1770 yılında C. W. Scheele ve J.
Priestly tarafından keşfedilmiştir. Priestly'in bir cam balonda HgO‘ti ısıtarak oksijen gazını
elde etmesi klasik kimya tarihinde bir dönüm noktası olmuştur.
•Labaratuarda oksijen suyun elektroliziyle elde edilir.
•Endüstride ise oksijen, sıvı havanın damıtılmasıyla büyük ölçekte üretilir.
9.1. 1. suyun elektrolizi,
Suyun elektrolizi;
Deneyin yapılışı: Temiz bir kaba 500cm3 saf su konur. 60 gr çamaşır
sodasını (Na2 CO3.H2O) azar azar su içine döküp karıştırarak çözünüz.
Daha sonra çözeltiye, 1000cm3’e çıkıncaya kadar saf su ilave edilir.
Böylece yaklaşık %5’lik çözelti hazırlanmış olur. 250 cm3’lük temiz bir
beherin üçte ikisine kadar çözelti konur. İki deney tüpü alarak bunlar
ağızlarına kadar ağızlarına kadar çözeltiyle doldurulur.
Kesiti tüp ağzından daha geniş bir tıpayı parmağınızla bu tüpün ağzında tutarak tüp ters
çevrilir ve beherdeki çözeltiye daldırılır. Daha sonra parmak çekilir ve tıpa çözeltiden alınır.
Böylece tüp içine hava girmesi önlenmiş olur. İkinci tüp için de aynı işlem yapılır. İki çelik
elektrot alınarak bunları, birer uçları çözelti içindeki tüpler içine girecek şekilde yerleştirilir.
Elektrotların çözelti dışında kalan uçlarına tel tutturucuları ile iletken teller bağlanır. İletken
tellerden birinin ucunu seri bağlı pillerin veya doğru akım güç kaynağının (+) ucu ile
birleştirilir. Diğer iletken ucunu pil veya güç kaynağının (-) ucuna dokundurulup çekilir.
Elektroliz kabındaki elektrotlardan güç kaynağının (+) ucuna bağlanmıştı. Şimdi de diğer
elektrotu güç kaynağının (-) ucuna bağlanıp saate bakılır.5, 10, 15. dakikada tüplerde
toplanan gaz miktarları tüpler üzerinde işaretlenir ve devre kesilir. Güç kaynağının (-) ucuna
bağlı elektrotun bulunduğu tüpte hidrojen gazı diğer tüpte de oksijen gazı toplanır.
Sonuç: Su, kendini meydana getiren hidrojen ve oksijene ayrışmış olur.
Endüstride ise oksijen, sıvı havanın damıtılmasıyla büyük ölçekte üretilir. Sıvı havanın
damıtılması olayı N2 eldesinde anlatılmıştır.
9.2. Oksijen elementinin kullanım alanları,
Oksijen elementi, bitkilerin ve hayvanların yaşamlarını devam ettirebilmeleri, solunum gazı
olan oksijenin (O2) varlığına bağlıdır. Atmosferin %21'i, oksijen gazından oluşmaktadır.
Hastanelerde, solunum rahatsızlıkları gösteren hastaların tedavisi için de oksijen gazı sıkça
kullanılır.
Ayrıca kaynak yapımında, suyun saflaştırılmasında ve beton eldesinde de oksijen kullanılır.
Paslanma da, oksijenin varlığında gerçekleşir.
O2, endüstride çelik yapımında kullanılır.
Oksijenin kokla tepkimesinden CO ya da CO2 oluşur. Her iki tepkime de ekzotermiktir.
C(k) + 1 2 O2(g) CO(g) H=-110,5 kJmol-1
C(k) +O2(g) CO2 (g) H=-393,5 kJmol-1
CO(g) + 1 2 O2(g) CO2 (g) H=-283 kJmol-1
9.3. Oksit tipleri ve oksitlerin sınıflandırması,
Elementlerin oksijen ile oluşturdukları bileşiklere oksit
denir.
Lavoisier'in geliştirdiği kimyasal adlandırma kurallarına
göre, (oksijenle birleşen elementin adı+ oksit) şeklinde
isimlendirilirler.
Na2O=Sodyum oksit
CaO=Kalsiyum oksit
CuO=Bakır (II) oksit
SO2=Kükürt di oksit
N2O5=Di azot penta oksit … gibi.
9.3.1 Oksit tipleri
a) Metal Oksitler:
Metallerin oksijen ile oluşturdukları
bileşiklere metal oksitler denir.
Na2O → Sodyum Oksit.
K2O → Potasyum Oksit.
Li2O → Lityum Oksit.
MgO → Magnezyum Oksit.
BeO → Berilyum Oksit.
BaO → Baryum Oksit.
CaO → Kalsiyum Oksit.
FeO → Demir (II) Oksit.
Fe2O3 → Demir (III) Oksit.
ZnO → Çinko Oksit.
Al2O3 → Alüminyum Oksit.
b) Ametal Oksitler :
Ametallerin oksijen ile oluşturdukları
bileşiklere ametal oksitler denir.
SO2 → Kükürt Di Oksit.
SO3 → Kükürt Tri Oksit.
CO2 → Karbon Di Oksit.
N2O3 → Di Azot Tri Oksit.
N2O5 → Di Azot Penta Oksit.
P2O3 → Di Fosfor Tri Oksit.
CO → Karbon Mono Oksit.
NO → Azot Mono Oksit.
9.3.2 Oksitlerin sınıflandırması,
Oksitler, oksijenin yükseltgenme basamağına göre dört grupta toplanabilirler.
a. Ozonürler (Trioksitler): Oksijenin (-1/3) yükseltgenme basamağında bulunduğu ikili
bileşikleridir. En iyi bilinen ozonür, potasyum ozonürdür. Bu bileşik, KOH ile ozonun
tepkimesinden elde edilir.
3KOH + 2O3 2KO3 +KOH H 2 O +1/2O2
KO3'te oksijen, O3- iyonu halindedir. Bu iyon kararsız olduğundan KO3,
KO3 KO 2 + 1/2O 2
tepkimesine göre bozunarak süper oksitleri oluştururlar.
b. Süperoksitler: Oksijenin (-1/2) yükseltgenme basamağında bulunduğu ikili
bileşikleridir. Potasyum, rubidyum ve sezyum elementlerinin havada yanmasıyla
süperoksitler oluşur. Sodyum süperoksit (NaO2), sodyum peroksidin yüksek sıcaklık ve
basınçta oksijen ile tepkimesinden elde edilir.
500 0C, 300 atm
Na 2 O2 + O2
2NaO 2
Süperoksitler iyonik bileşikler olduğundan oksijen O2- halindedir.
9.3.2 Oksitlerin sınıflandırması,
c.Peroksitler: Oksijenin (-1) yükseltgenme basamağında bulunduğu ikili bileşikleridir. 1A ve
2A Grubu elementlerin tümünün peroksitleri bilinmektedir. H2O2 dışındaki peroksitler
iyoniktir ve bu oksitlerde oksijen O22- iyonu halindedir. H2O2 ise kovalent bir peroksittir.
Hidrojen peroksit (H2O2) soluk mavi renkte; sulandırıldığında ise renksiz
hale gelen bir bileşiktir. Çok zayıf bir sit olan bileşik; özellikle kâğıt sanayinde
kağıtlara beyaz renk vermek için üretilmektedir. Bileşik ayrıca
dezenfektasyon, oksitlenme, antiseptik üretimi ve roket yakıtı üretiminde
de kullanılmaktadır.
Bileşiğin doğru formülünün H-O-O-H şeklindedir ve açık yapıları şekillerde
görülmektedir.
9.3.2 Oksitlerin sınıflandırması,
d.Oksitler: Oksijenin (-2) yükseltgenme basamağında bulunduğu ikili bileşikleridir. Oksijenin
ikili bileşiklerinin çoğu bu gruba girer.
Oksijen, alkali, toprak alkali ve elektropozitif geçiş elementleri ile iyonik oksitler oluşturur. Bu
bileşiklerde O2- iyonu halinde bulunur.
Ametal ve yarımetaller ile oluşturduğu oksitlerde metal-oksijen bağının kovalent karakteri
dikkate değer ölçüde yüksektir. Bu nedenle, ametal oksitler genellikle moleküler yapıdadır.
Yarımetal oksitlerde hem moleküler hem de polimerik yapılar yaygındır.
METAL
OKSİT (-2)
PEROKSİT(-1)
SÜPER OKSİT(-1/2)
OZONÜER(-1/3)
Lİ
Na
K
Rb
Cs
Be
Mg
Ca
Sr
Ba
Li2O
Na2O
K2O
Rb2O
Cs2O
BeO
Mg O
Ca O
Sr O
Ba O
Li2O2
Na2O2
K2O2
Rb2O2
Cs2O2
BeO2
Mg O2
Ca O2
Sr O2
Ba O2
-NaO2
KO2
RbO2
CsO2
------
--KO3
-CsO3
------
9.3.2 Oksitlerin Asitlik ve Bazlığı:
Periyodik tabloyu dikkate alarak elementlerin oksitlerinin asitliği ve bazlığını karşılaştıra biliriz. Aynı
periyotta soldan sağa doğru oksitlerin asitliği artarken, bir grupta yukarıdan aşağıya doğru azalmaktadır.
Bu eğilim, metalin yük / yarıçap oranı ve dolayısıyla metal-oksijen bağının kovalent karakteri ile uyum
içindedir.
O-2 + H 2O 2OH 1. iyonik oksitlerde oksijen, iyon (O2-, O22- ya da O2-)
-2
O2 + H 2O HO2 + OH halindedir. Böyle oksitler suda çözündüğünde, oluşan iyonlar
-2
OH-'den daha kuvvetli baz olduklarından, sudan H+ alarak
2O2 + H 2O O2 HO2 + OH OH- oluştururlar.
tepkimelerinin bir sonucudur ki, oksijenin iyonik ikili bileşiklerinin sulu çözeltileri baziktir.
Metal oksitleri genel anlamda iyonik oksitlerdir ve bu sebeple metal oksitlerin sulu çözeltileri baz özelliği
gösterir.
Na2O → Sodyum Oksit. Sulu çözeltisi: Na2O + H2O → 2NaOH
K2O → Potasyum Oksit. Sulu çözeltisi: K2O + H2O → 2KOH
Li2O → Lityum Oksit. Sulu çözeltisi: Li2O + H2O → 2LiOH
MgO → Magnezyum Oksit. Sulu çözeltisi: MgO + 2H2O → Mg(OH)2
BeO → Berilyum Oksit. Sulu çözeltisi: BeO + H2O → Be(OH)2
BaO → Baryum Oksit. Sulu çözeltisi: BaO + H2O → Ba(OH)2
CaO → Kalsiyum Oksit. Sulu çözeltisi: CaO + H2O → Ca(OH)2
FeO → Demir (II) Oksit. Sulu çözeltisi: FeO + H2O → Fe(OH)2
Fe2O3 → Demir (III) Oksit. Sulu çözeltisi: Fe2O3 + 3H2O → 2Fe(OH)3
Bazik oksitler bazanhidritidirler. Diğer bir anlatımla, metal hidroksitlerden suyun uzaklaştırılması sonucu
oluşurlar. Ca(OH) 2
CaO + H 2O
İyonik hidroksitlerde hidroksit grubu OH- şeklindedir. Suda çözündüğünde çözeltiye OH- iyonu verir.
H2O
Ca(OH)2
Ca 2+ (aq) + 2OH-(aq)
9.3.2 Oksitlerin Asitlik ve Bazlığı:
2. Oksijenin kovalent ikili bileşiklerinin sulu çözeltileri genellikle asidiktir. Bu bileşikler sudan yalın çift
alarak çözeltide H+ iyonu oluştururlar.
CO2 + H2O H2CO3 H + + HCO3
-
Ametal oksitleri genellikle kovalent karakterli oksitlerdir. Ametal oksitlerin sulu çözeltileri asit özelliği
gösterir.
• SO2 → Kükürt Di Oksit . Sulu çözeltisi: SO2 + H2O → H2SO3
• SO3 → Kükürt Tri Oksit. Sulu çözeltisi: SO3 + H2O → H2SO4
• CO2 → Karbon Di Oksit . Sulu çözeltisi: CO2 + H2O → H2CO3
NOT: A metallerin oksijence zayıf bileşiklerine nötr oksitler denir ve nötr oksitler su ile tepkimeye
girmezler.
• CO → Karbon Mono Oksit
• NO → Azot Mono Oksit
Asit anhidriti olan asidik oksitler ise asitten suyun uzaklaştırılmasıyla elde edilir.
ISI
H 2 CO3
CO 2 + H 2O
9.3.2 Oksitlerin Asitlik ve Bazlığı:
3. Metalin yükseltgenme basamağının yüksek olduğu bazı metalik oksitler de suya karşı asit olarak
davranır.
B(OH)3 gibi kovalent karakterli hidroksitler (ki bunlar aynı zamanda bir oksiasittir) suya H+ iyonu verirler.
Mn2O7 + H2O 2HMnO4 H+ + MnO4
-
Genel olarak, bir iyonik hidroksitte M-O–H yapısından OH-, bir kovalent hidroksitte (oksiasitte) ise H+
ayrılır.
H2O
B(OH)3
(OH) 2 BO -(aq) + H + (aq)
Genel olarak, bir iyonik hidroksitte M-O–H yapısından OH-, bir kovalent hidroksitte (oksiasitte) ise H+
ayrılır.
4. Kompleks iyon oluşturma eğilimi olan çinko, alüminyum ve kalay gibi metallerin oksitleri amfoterik
özellik gösterir. Aside karşı baz, baza karşı asit olarak davranırlar.
Örneğin, ZnO'nun amfoterik özelliği aşağıdaki tepkimelerden anlaşılır.
ZnO + 2HC1 ZnCl2 + H 2O
ZnO + 4OH- Zn(OH)4
2-
9.3.2 Oksitlerin Asitlik ve Bazlığı:
NOT: Kısaca oksitlerin asitlik ve bazlığını özetlemek istersek;
•Metal oksitleri genellikle iyonik karekterlidirler ve
bazik oksitlerdir. Suda çözündüklerinde bazları
oluştururlar.
•Ametallerin oksitleri kovalent karekterlidirler. Suda çözündüklerinde genellikle asitleri oluşturlar.
•NO, N2O, CO ve OF2 oksitlerinin sulu çözeltileri nötraldir. Diğer tüm ametal oksitleri asidik özellik gösterir.
Ametal oksitler tek tek molekül halindedir ve uçucudurlar.
•Yarımetal oksitleri genellikle polimerik yapıya sahiptirler. Normal koşullarda katıdırlar.
•Bir geçiş metali çeşitli yükseltgenme basamaklarına sahiptir. Bu nedenle, bir metal birden fazla oksit
oluşturabilir. Geçiş metal oksitleri normal koşullarda katıdırlar ve genellikle suda çözünmezler. Düşük
yükseltgenme basamaklı oksitleri iyonik ya da polimerik yapıdadır. Yüksek yükseltgenme basamaklı oksitleri
kovalent ve moleküler yapıdadır.
•Örneğin; Vanadyumun VO, V2O3, VO2 ve V2O5 şeklinde dört oksidi bulunmaktadır. İlk ikisi bazik, VO2
amfoterik ve V2O5 ise asidik özellik gösterir.
•Örneğin; MnO iyonik, MnO2 polimerik ve Mn2O7 ise molekülerdir. Öte yandan, ilk oksit bazik, ikincisi
amfoterik ve sonuncusu asidiktir.
9.3.2 Oksitlerin Asitlik ve Bazlığı:
NOT: Kısaca oksitlerin asitlik ve bazlığını özetlemek istersek;
•Metal oksitleri genellikle iyonik karekterlidirler ve
bazik oksitlerdir. Suda çözündüklerinde bazları
oluştururlar.
•Ametallerin oksitleri kovalent karekterlidirler. Suda çözündüklerinde genellikle asitleri oluşturlar.
•NO, N2O, CO ve OF2 oksitlerinin sulu çözeltileri nötraldir. Diğer tüm ametal oksitleri asidik özellik gösterir.
Ametal oksitler tek tek molekül halindedir ve uçucudurlar.
•Yarımetal oksitleri genellikle polimerik yapıya sahiptirler. Normal koşullarda katıdırlar.
•Bir geçiş metali çeşitli yükseltgenme basamaklarına sahiptir. Bu nedenle, bir metal birden fazla oksit
oluşturabilir. Geçiş metal oksitleri normal koşullarda katıdırlar ve genellikle suda çözünmezler. Düşük
yükseltgenme basamaklı oksitleri iyonik ya da polimerik yapıdadır. Yüksek yükseltgenme basamaklı oksitleri
kovalent ve moleküler yapıdadır.
•Örneğin; Vanadyumun VO, V2O3, VO2 ve V2O5 şeklinde dört oksidi bulunmaktadır. İlk ikisi bazik, VO2
amfoterik ve V2O5 ise asidik özellik gösterir.
•Örneğin; MnO iyonik, MnO2 polimerik ve Mn2O7 ise molekülerdir. Öte yandan, ilk oksit bazik, ikincisi
amfoterik ve sonuncusu asidiktir.
9.4. Ozonun molekül yapısı ile özellikleri ve kullanım alanları,
O3 molekülü açısal yapıda olup, rezonans yapıları şekildeki
gibidir. Ozonun gerçek yapısı, (I) ve (II) yapılarının eşit oranda
katkı yaptığı bir melez yapıdır. Melez yapıda merkezi oksijenin
format yükü (+1), uçtaki oksijenlerinki ise (-1/2) dir.
Merkezi oksijenin pozitif format yüke sahip olmasının ozonun kararlılığını azaltacağı açıktır.
Merkezi atom üzerindeki yalın çiftler nedeniyle ozonun bağ açısı 120°'den küçük olup 117° dir.
Hibridleşme modeline göre merkezi oksijenin hibridleşmesi sp2, uçtaki oksijenlerinki ise sp2 ve
sp3 hibridleşmelerinin aritmetik ortalaması olan sp2,5 tir. Merkezi oksijen uçtaki oksijenlerden
daha elektronegatiftir. O-O bağları polardır ve O3 molekülü polar bir moleküldür.
9.5. Atmosferdeki ozonun oluşumu ve çevre açısından önemi,
Atmosferdeki ozonun oluşumu: Oksijenin allotropu olan O3, atmosferin üst tabakalarında
O2'den oluşur. Doğada güneşin UV ışınları veya yıldırımlar vasıtasıyla medyana gelir. Ozon 200360 nm dalga boyu aralığındaki ultraviyole (morötesi) ışınları soğurur. Böylelikle atmosferin
üzerinde koruyucu bir örtü işlevini görür. Yüksek enerjili elektromagnetik ışınların
zararlarından yeryüzünü korur. Ozon tarafından ultraviyole ışınlarının soğurulması,O2
bozunmasına neden (O3 oluşumu) olur.
Ozon tabakası atmosferin yaklaşık 20-40 km arasındaki stratosfer tabakasında yoğun olarak
bulunur. Bu tabaka güneşten gelen zararlı ultraviyole ışınlarının (UV-B) dünyaya ulaşmasını
önler. UV-B ışınları bütün yaşayan organizmalar üzerinde zararlı etkilere sahiptir; bitkilerin
büyüme hızını azaltır, insanlarda cilt kanserine sebep olur, göze zarar verir, enfekte hastalıklara
(sıtma vb.) gibi yakalanma riskini artırır.
hv
O2
2O
H° = 494 kJ mo1-1
O +O2
O3 H° = - 104.5 kJmo1-1
9.5. Atmosferdeki ozonun oluşumu ve çevre açısından önemi,
Ozon tabakasının incelmesine neden olan maddeler ;
Başta aerosellerde itici olarak kullanılan floroklorohidrokarbonlar (CCl2F2) ve yüksekte uçan
uçaklardan oluşan azot oksitler, ozon tabakasının bozulmasında katalizör olarak rol
oynamaktadır . Laboratuar çalışmalarından elde edilen bulgular, azot oksitler ve
floroklorohidrokarbonların aşağıda verilen mekanizmalara göre ozonu O2 ye dönüştürdüklerini
ortaya koymaktadır.
NO 2 +O3 NO3 +O 2
NO3 NO+O 2
NO+O3 NO 2 +O 2
NO2
2O3
3O 2
Cl+O 3 ClO+O 2
ClO+O Cl+O 2
Cl
O 3 +O
2O 2
Bu maddelerin teknik isimleri :
•kloroflorokarbonlar (CFC)
•halonlar
•metil kloroform
•karbon tetraklorid
•hidrobromoflorokarbonlar (HBFC)
•hidrokloroflorokarbonlar (HCFC)
•metilbromid
9.5. Atmosferdeki ozonun oluşumu ve çevre açısından önemi,
Ozonun çevre açısından önemi:
Atmosferde ozon derişimin çok küçük olduğu
bölgeler, ozon tabakasındaki delikler olarak
adlandırılır. Bu bölgelerde zararlı olan ultraviyole
ışınları rahatlıkla yeryüzüne ulaşmaktadır.
Ozon tükenmesinin bir sonucu olarak dünyaya erişen ek UV-B radyasyon,
•En basit tek hücreli hayvanlardan, böceklere, balıklara, kuşlara ve memeli hayvanlara kadar
insanlar da dahil bütün canlılar üzerinde zararlı etkilere sahip olabilir.
•Özellikle insanlarda cilt kanserine sebep olabilir.
•Bitkilerin büyüme ve gelişme süreçlerini etkileye bilir.
•Suda yaşayan canlıların yapısını değiştire bilir.
•Havada oluşa bilecek kimyasal tepkimeleri hızlandırarak hava kirliliğine sebep olabilir.
9.6. Kükürtün molekül yapısı allotropları ve özellikleri:
Periyodik cetvelin 6A grubunda bulunan, Atom numarası 16, Atom ağırlığı 32.064 ile -2,
+4, +6 arasındaki değerlikleri alabilen bir elemendir. Oksijensiz bileşiklerinde kararlı
olup, daima -2 değerliklidir. Reaksiyon verme kabiliyeti oldukça iyi olup soy gazlar hariç
diğer elementlerin hepsi ile reaksiyon verir. Kütle numarası 29 ile 38 arasında oluşan 9
izotopu vardır. Tabiatta bulunan kükürdün tamamı %95 S ve -32 kararlı izotop‘dur.
Diğer elementler içinde kükürt en fazla allotropa sahiptir. Kükürdün, katı halde en çok
bilinen allotropu S8 halkasıdır.
Uygun koşullar altında kükürt buharında S, S2, S4, S6 ve S8 yapılarının hepsi de
bulunabilir. Kükürt atomlarının uzun zincirli molekülleri sıvı
9.6. Kükürtün molekül yapısı allotropları ve özellikleri:
Periyodik cetvelin 6A grubunda bulunan, Atom numarası 16, Atom ağırlığı 32.064 ile -2,
+4, +6 arasındaki değerlikleri alabilen bir elemendir. Oksijensiz bileşiklerinde kararlı
olup, daima -2 değerliklidir. Reaksiyon verme kabiliyeti oldukça iyi olup soy gazlar hariç
diğer elementlerin hepsi ile reaksiyon verir. Kütle numarası 29 ile 38 arasında oluşan 9
izotopu vardır. Tabiatta bulunan kükürdün tamamı %95 S ve -32 kararlı izotop‘dur.
Diğer elementler içinde kükürt en fazla allotropa sahiptir. Kükürdün, katı halde en çok
bilinen allotropu S8 halkasıdır.
Uygun koşullar altında kükürt buharında S, S2, S4, S6 ve S8 yapılarının hepsi de
bulunabilir. Kükürt atomlarının uzun zincirli molekülleri sıvı
9.6. Kükürtün molekül yapısı allotropları ve özellikleri:
95,5 C
119 C
160 C
445 C
1000 C
2000 C
S
S
S
S
S8( g )
S6( g )
S4( g )
S4( g )
S( g )
0
0
0
0
0
0
Oda sıcaklığında kararlı bir katı olan rombik kükürt (Sα), halkalı S8 moleküllerinden
oluşmuştur. 95,5 °C de rombik kükürt (Sα) monoklün kükürde (Sβ) dönüşür.
Monoklinik kükürt de S8 moleküllerinden oluşmuştur. Ancak, Sα dan daha farklı bir kristal
yapıya sahiptir. 119 °C de Sβ eriyerek, saman renkli ve akışkan olan sıvı kükürde (Sλ)
dönüşür. Sλ içeriğinde, çoğunluğu S8 molekülleri olmak üzere, 6 dan 20 ye kadar farklı
sayıda S atomlarının oluştuğu diğer halkalı yapılar da bulunur.
160 °C de, halkalı moleküller açılarak tekrar uç uca bağlanır ve uzun sarmal zincirli
molekülleri oluşturarak, koyu renkli ve viskoz olan sıvı kükürtü (Sµ) meydana getirir.
Zincir uzunluğu ve viskozite 180 °C civarında en yüksek değere ulaşır. Daha yüksek
sıcaklıklarda zincirler kırılır ve viskozite düşer.
445 °C de sıvı kaynar ve kükürt buharını oluşturur. Kaynama noktasında kükürt bubarında
S8 molekülleri vardır. Ancak, daha yüksek sıcaklıklarda daha küçük moleküllere parçalanır.
Eğer sıvı Sµ, soğuk su içine dökülürse plastik kükürt oluşur. Plastik kükürt, uzun sarmal
zincir molekülleri içerir ve kauçuk benzeri özelliklere sahiptir. Bekletilen plastik kükürt
kırılgan hale gelir ve rombik kükürde dönüşür.
9.6. Kükürtün molekül yapısı allotropları ve özellikleri:
Kükürtün bazı makroskopik şekilleri: (a) Rombik kükürt. (b) Monoklin
kükürt (c) Solda, henüz eritilerek portakal renkli bir sıvı oluşturmuş
olan monoklin kükürt. Sağda, daha fazla ısıtmayla elde edilmiş olan
kırmızı ve daha viskoz sıvı. (d) Plastik kükürt oluşturmak için su içine
dökülmüş sıvı kükürt.
9.6. Kükür üretimi ve kullanım alanları,
Kükürt, kütlece % 0,0384 oranıyla
yerkabuğunda bulunma bakımından
onaltıncı sırada yer alır. Kükürt, doğada
elementel kükürt, sülfür ve sülfat
mineralleri şeklinde, doğal gazda H2S ,
petrol ve kömürde ise organokükürt
bileşikleri olarak bulunur.
Kükürt
Frasch
yöntemi
denen
alışılmadık bir yöntemle elde edilir. Bu
işlemde, aşırı ısıtılmış su (yaklaşık 160 °C
ve 16 atm) yeraltı kükürt yatağına
indirilmiş olan ve iç içe geçmiş üç
borudan oluşan sistemdeki en dıştaki
boru ile ikinci boru aralığından
pompalanır. Bu sırada kükürt eriyerek
bir sıvı göl oluşturur. Sonra en içteki
borudan aşağı doğru sıcak hava (20-25
atm de) basılır ve sıvı kükürt su karışımı
aynı boru sistemiyle yukarı çıkarılır.
9.6. Kükür üretimi ve kullanım alanları,
Frasch yöntemi bir zamanlar elementel kükürt eldesinin ana kaynağı olduğu halde şimdi çokta
kullanılmamaktadır. Bu değişikliğin nedeni endüstriyel çalışmalardan çevreye yayılan kükürdün
kontrol edilme isteğinden kaynaklanır. Bu sebeple günümüzde değişik yöntemlerle kükürt elde
edilmektedir.
H2S, petrol ve doğal gazın bir safsızlığıdır. H2S gaz akımı iki kısma ayrılır ve bir alaşımı (gaz
akımının yaklaşık üçte biri) yakılarak SO2 e dönüştürülür. Sonra bu iki gaz akımı, 200-300 °C deki
katalitik bir dönüştürücüde (konvertör) yeniden karıştırılarak aşağıdaki tepkime gereği S elde
edilir
2 H 2S(g) + SO 2(g) 3S(g) + 2H 2O (g)
Maden kömürlerinin destinasyonu esnasında elde edilen H2S, oksijen ile reaksiyona sokulur ve
elementel kükürt doğrudan elde edilebilir.
2H 2S + O 2 2H 2O + 2S
Pirit (FeS2 ) de önemli bir kükürt kaynağıdır. Piritten elde edilen kükürt dioksit(SO2) H2S ile
reaksiyona sokularak serbest kükürt elde edilir.
2 H 2S(g) + SO 2(g) 3S(g) + 2H 2O (g)
Kükürt dioksit, karbon mono oksitle tepkimesinden kükürt elde edilir.
SO2 + 2CO S + 2CO 2
9.6. Kükür üretimi ve kullanım alanları,
Kükürtün kullanım alanları;
Üretilen bütün kükürdün yaldaşık %90 ı, SO2(g) oluşturmak için yakılır ve elde edilen SO2(g)
nin çoğu sülfürik aside, H2SO4, dönüştürülür.
Elementel kükürdün de birkaç kullanım alanı vardır. Bunlardan biri kauçuğun vulkanize
edilmesi ve diğeri de, örneğin üzüm asmalarının küllenme hastalığına karşı, bir fungisit (küf
öldürücü) olarak kullanılmasıdır.
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Kükürdün bir düzineden fazla oksidi varsa da, en çok karşılaşılanlar kükürt dioksit, SO2, ve
kükürt trioksittir, SO3.
Kükürt Dioksit (SO2 )
Kükürt dioksit renksiz ve boğucu kokusu olan bir gazdır. Erime ve kaynama
sıcaklıkları sırayla -75 oC ve -10 oC ’dur. Katı hâlde beyaz kristaller hâlinde
bulunur. O=S=O molekülünün bağ açısı 119,5 oC ve bağ uzunluğu 143
pmm’dir. Suyun içinde 20 oC de
çözünürlüğü, ağırlıkça % 10’dur ve zayıf asittir. Havada bulunan SO2
yağmur su partikülleri ile tepkimeye girerek asit meydana getirmekte ve
yağmurlarla birleşerek yeryüzüne asit yağmurları olarak inmektedir. Bu da
doğaya ve yer altı sularına zarar vermektedir.
Kükürt Dioksit (SO2 )in Eldesi:
SO2 gazının üretilmesindeki ticari yöntemlerin başında kükürtün doğrudan yakılması ve metal
sülfürlerin "kavrulması" gelmektedir.
S(k) + O 2(g)
SO 2(g)
2ZnS(k) + 3O2(g)
2ZnO(k) + 2SO 2(g)
2 FeS2 + 11 2 O 2
Fe 2O3 + 4SO 2(g)
Ayrıca, Müler-Kühne yöntemi ile; CaSO4
kömür ile 700-1200 oC tepkimesiyle SO2 elde
edilir.
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Kükürt Trioksit (SO3):
Kükürt trioksit, atmosfer basıncı altında ve oda sıcaklığında renksiz bir sıvıdır. Havada sis
yapar. Ergime ve kaynama sıcaklıkları sırasıyla 16.8 oC ve 44.8 oC’dir. Katı hâlde iken eser
miktarda su veya sülfürik asit ile polimerleşir. SO2 bileşiğinin başlıca kullanım alanı, H2SO4
eldesi için gerekli olan SO3 bileşiğinin eldesidir.
Kükürt Trioksit (SO3) Eldesi:
Kontak yöntemi:
Kontak yöntemi denen çağdaş yöntemde, önce SO2(g) elde edilir. Sonra SO2(g) ekzotermik ve
tersinir bir tepkime olan (1) tepkimesiyle kükürt triokside dönüştürülür. Bu tepkime
yöntemin kilit basamağı olup katalizör kullanılmazsa çok yavaş yürür. En önemli katalizör
alkali metal sülfatlarıyla karıştırılmış V2O5 dir. SO3 suyla birleşerek H2SO4 oluşturur(2).
2 SO2(g) +O2(g) 2SO3(g) + 98.3kJ
SO3(g) H 2 O (s) H 2SO 4(s)
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Kükürt Trioksit (SO3) Eldesi:
SO3(g) H 2SO4(s) H 2S2O7(s)
H 2S2O7(s) H 2O(s) H 2SO4(s)
H2O
H 2SO4(s)
H 2SO4(aq)
Kontak yöntemi:
Kontak yöntemi denen çağdaş yöntemde, önce SO2(g) elde edilir. Sonra SO2(g) ekzotermik ve
tersinir bir tepkime olan tepkimesiyle kükürt triokside dönüştürülür. Bu tepkime yöntemin
kilit basamağı olup katalizör kullanılmazsa çok yavaş yürür. En önemli katalizör alkali metal
sülfatlarıyla karıştırılmış V2O5 dir. SO3 suyla birleşerek H2SO4 oluşturur.
Fakat SO3(g) ve suyun doğrudan tepkimesi H2SO4(aq) damlacıklarından ibaret ince bir sis verir.
Sis oluşumu önemli ölçüde ürün kaybına ve kirlilik sorunlarına neden olur. Bundan
kaçınmak için, SO3(g), seramik parçalarıyla doldurulmuş kulelerde, %98 lik H2SO4 içine
gönderilir. SO3(g), hemen sülfürik asit içinde çözünür ve sülfürik asit derişimini arttırmak için
ortamda bulunan az miktardaki suyla tepkimeye girer. Sonuçta, bazen oleum denen, fakat,
genel olarak dumanlı sülfürik asit adı verilen sülfürik asit elde edilir. Yeni ürünün H2SO4
yüzdesi bir anlamda %100 den daha büyüktür. Gerekli derişimi sağlamak için kulede
devreden aside yeterli miktarda su katılır. Daha sonra suyla seyreltilerek istenen derişimde
sülfürik asit elde edilir. Oleum için H2S2O7 (disülfürik asit) formülünü kullanırsak, söz konusu
tepkimeleri aşağıdaki gibi yazabiliriz.
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Sülfürik Asit ( H2SO4 ):
Oda sıcaklığında renksiz bir sıvıdır. Havada sis yapar. Ergime ve kaynama sıcaklıkları sırasıyla
16.8 oC ve 44,8 oC’dir. Çoğunlukla sülfürik asit sentezinde ara ürün olarak kullanılır. Nem
çekme özelliği vardır. Türkiye’de ihtiyacı karşılayacak kadar H2SO4 üretilmektedir.
Sülfürik Asit ( H2SO4 ) Eldesi:
Sülfirik asit kontak yöntemi dışında (%98) Kurşun Odalar Yöntemi ile de (%78) , 1746
yılından üretilmektedir.
SO3(g) H 2SO4(s) H 2S2O7(s)
S + O2 SO2
H 2S2O7(s) H 2O(s) H 2SO4(s)
2NO + O2 2NO2
H2O
H 2SO4(s)
H 2SO4(aq)
Kontak Yöntemi
NO2 + SO2 + H 2O H 2SO4 + NO
Kurşun odalar yöntemi
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Sülfürik Asit ( H2SO4 )in Kimyasal Özelllikleri;
Sülfürik asitin birçok amaç için kullanımına devam edilmekle birlikte, büyük bir çoğunluğu
gübre üretiminde kullanılmaktadır. Ayrıca, çeşitli metalürji süreçlerinde, sıvı yağların
saflaştırılmasında, beyaz titan dioksit pigmentinin üretiminde ve otomobil akülerinde olduğu
gibi başka yüzlerce kullanım alanı vardır. Sonuç olarak sülfürik asit eski ekonominin işleyen bir
çarkıydı diyebiliriz.
Seyreltik sülfürik asit, H2SO4(aq), bazların nötürleştirilmesi, metallerin H2(g) çıkararak çözülmesi
ve CO2(g) açığa çıkararak karbonatların çözülmesi gibi, kuvvetli bir mineral asidin bütün yaygın
tepkimelerini verir.
Derişik sülfürik asit bazı ayırt edici özelliklere sahiptir.
•Suya karşı büyük bir ilgisi vardır. Bazı bileşiklerden H ve O atomlarını (H2O daki oranlarda) bile
uzaklaştırabilecek derecede kuvvetlidir. Derişik sülfürik asidin çay şekeri (sakkaroz) gibi bir
karbonhidrat ile verdiği tepkimede bütün H ve O atomları uzaklaşır ve geride saf karbondan
ibaret bir artık kalır. (Şekil a ve b)
H2SO4
C12H22O11(k)
12 C(k) + 11H2O(s)
Derişik sülfürik asit, orta kuvvette, iyi bir yükseltgendir.
Örneğin, metalik bakırı yükseltgeyerek çözebilir.
Cu(k) +2H2SO4(derişik) Cu 2+(aq) +SO4
2(aq)
+2H2O(s) +SO2(g)
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Sülfüroz asiti (H2SO3(aq)):
SO2(g) suyla etkileştiği zaman sülfüröz asit, H2SO3(aq), oluşur, fakat bu asit, hiç bir zaman saf
olarak elde edilemez. Sülfüröz asit ve tuzları (sülfitler) iyi birer indirgendir ve O2(g) tarafından
kolayca yükseltgenir.
SO2(g) + H 2 O(s) H 2SO3
O2(g) + 2SO3
2(aq)
2SO4
2(aq)
NOT:
H2SO3 ve H2SO4 in her ikisi de iki değerli asitlerdir. Bunlar iki basamakta iyoltaşırlar ve her
iyonlaşma basamağı için bir tane olmak üzere, iki tür tuz oluştururlar. NaHSO3 ve NaHSO4
gibi tuzlara, anyonları iyonlaşarak proton verebildiğinden, asit tuzlar adı verilir. H2SO3 her iki
iyonlaşma basamağında da zayıf asit olduğu halde, H2SO4 in asitliği birinci iyonlaşma
basamağında kuvvetli, ikinci iyonlaşma basamağında biraz zayıftır. Bununla birlikte, bir H2SO4
çözeltisi yeter derecede seyrettik ise (aşağı yukarı 0,001 M dan küçük), her iki iyonlaşma
basamağı da tamamlanmış kabul edebiliriz.
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Kükürtün Oksianyonları:
Kükürtün sülfit ve sülfat iyonları en çok bilinen
kökleridir. Formülleri yan tarafta gösterilmiştir.
Sülfit ve sülfat iyonlarına ek olarak diğer önemli bir
kükürt-oksijen iyonu tiyosülfat iyonudur(S2O32- ).
("tiyo" ön eki bir bileşikteki bir oksijen atomunun bir S
atomuyla yer değiştirdiğini belirtir.) Böylece tiyosülfat
iyonu, bir O atomunun bir S atomu ile yer değiştirdiği
bir sülfat iyonu, SO42-, olarak dönüşülebilir.) S2O32deki S ün format yükseltgenme basamağı, +2 ise de iki
kükürt atomunun eşdeğer olmadığı görülebilir.
Merkez S atomunun yükseltgenme basamağı +6, uç S
atomunun -2 dir.
Tiyo sülfata benzer şekilde diğer bazı tiyo anyonlarının yapıları da Şekil de gösterilmiştir.
Tiyosülfatlar, bazik bir sodyum sülfit çözeltisine elementel kükürt karıştınp kaynatılarak elde
edilebilirler. Burada elementel kükürt yükseltgenirken sülfit iyonu indirgenir ve tiyosülfat
iyonu verir. SO 2-(aq) S S O 2-(aq)
3
(k)
2
3
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Başlıca Kükürt Bileşiklerinin Kullanım Alanları:
Kükürt (S)
Siyah barutun ve pillerin temel bileşenlerinden biri olan kükürt, mantar öldürücü kimyasalların
(fungusitlerin) ve doğal kauçuğun yapımında kullanılır. Fosfat içerikli gübrelerin bileşimine de
katılan kükürtün, ticarî açıdan en fazla değer taşıyan bileşiği sülfürik asittir.
Sülfit kağıdı başta olmak üzere çeşitli kağıtların yapımında, buharla dezenfekte işlemlerinde ve
kurutulmuş meyvelerin ağartılmasında kullanılır.
Yağların, vücut sıvılarının ve iskelet için gerekli minerallerin yapısında yer alması nedeniyle de,
yaşamsal önem taşır.
Hidrojen Sülfür (H2S)
Deri sanayinde kılları sıyırmak amacı ile kullanılır. Boya sanayinde, cevher zenginleştirmede,
kükürdün organik bileşiklerinin sentezinde kullanılır.
Karbon Disülfür (CS2)
İlaç sanayinde, bitki korumada, korozyon önlemede, cevher zenginleştirmede, Lastik
sanayinde kullanılır.
Kükürt Dioksit (SO2)
Tekstil ve gıda sanayilerinde, ağartıcı ve küf oluşumunu önleyici olarak kullanılır
(Kuru Meyveleri). Şarap üretiminde Fermantasyon sırasında katkı maddesi olarak eklenir.
Kâğıt sanayinde kullanılır.
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Sülfürik Asit (H2SO4)
Gübre yapımında, Boya Sanayinde, Tekstil, Deterjan, Alkol, Patlayıcı, Petrol
Rafinelerinde, nem çekme özelliği vardır.
Sodyum Sülfat (Na2SO4)
Cam sanayinde, kâğıt, sabun, gübre, kimyasal madde üretiminde, yapay ipek
yapımında kullanılır.
Bakır Sülfat (CuSO4)
Elektroliz işlemlerinde elektrolit, mikrop ve bakteri öldürücü olarak suların temizlenmesinde
kullanılır.
Demir -II Sülfat (FeSO4)
Tekstil endüstrisinde astar boya olarak, mavi mürekkep yapımında, tarımda
istenmeyen otların yok edilmesinde kullanılır.
Potasyum Sülfat (K2SO4)
Potasyum sülfat, gübre olarak fazla miktarda kullanılır. Klora duyarlı olan tütün, ıspanak, patates,
domates, fasulye gibi bitkilerde potasyum gübresi olarak K2SO4 kullanılır.
9.7. Başlıca kükürt bileşiklerinin üretimi ve kullanımı çevre kirliliği ile ilişkileri,
Kükürdün Oksitleri, Oksiasitleri ve Oksianyonları
Bir Çevre Sorunu: SO2 Yayılması
Endüstride oluşan dumanlı sisler başlıca katı tanecikler (kül ve duman), SO2(g) ve H2SO4 sisinin
karışımından ibarettir. Çeşitli endüstriyel işlemler önemli miktarda SO2(g) oluştururlar. Bununla
birlikte, atmosfere SO2(g) salan ana kaynaklar kömür ya da kükürt yüzdesi fazla akar yakıt
kullanan büyük santrallerdir. Atmosfere sanılan SO2, havadaki toz zerrelerinin yüzeylerinde
katalizlenerek ya da NO2 ile tepkime vererek SO3 e yükseltgenebilir.
SO 2(g) + NO 2(g) SO3(g) + NO (g)
Sonra SO3, asit yağmurunun bir bileşimi olan H2SO4 sisini oluşturmak üzere, atmosferdeki su
buhar' ile etkileşebilir. Aynı zamanda, H2SO4 in havada bulunan NH3 ile verdiği tepkime,
(NH4)2SO4 katı taneciklerini oluşturur. Vücut üzerine düşük derişimli SO2 ve H2SO4 in etkisinin
ayrıntıları henüz bilinmemektedir. Bu maddelerin solunum yollarını tahriş eden maddeler
olduğu açıktır. 0,10 ppm üstündeki düzeylerin zararlı olduğu kabul edilmektedir.
Endüstriyel duman ve asit yağmurunun kontrolü, yakıtlardan kükürdün uzaklaştırılmasına ve
SO2(g) yayılmasının kontrolüne bağlıdır. SO2in hava gazlarından uzaklaştırılması için düzinelerce
yöntem önerilmiştir.
10.BÖLÜM
KONU BAŞLIKLARI
10.1. Halojenlerin başlıca doğal
bileşikleri, ad ve formülleri,
10.2. Halojenlerin elde ediliş
yöntemleri ve kullanım alanları,
10.3. Önemli halojen bileşiklerinin
özellikleri ile kullanım alanları
KAZANIMLAR
10.1. Halojenlerin baslıca doğal bileşiklerinin ad ve
formüllerini esleştirir.
10.2. Halojenlerin elde ediliş yöntemlerini ve kullanım
alanlarını açıklar.
10.3. Önemli halojen bileşiklerinin özellikleri ile
kullanım alanları arasında ilişki kurar.
10.1. Halojenlerin başlıca doğal bileşikleri, ad ve formülleri,
Halojenler çok aktif elementler olduklarından doğada sadece
bileşikler halinde bulunurlar.
Doğadaki bollukları; flor, klor, brom ve iyot sırasına göre azalır.
Florun en önemli kaynağı florit (CaF2) tir.
Fluorit; CaF2 bileşiminde, saydam veya yarı saydam olan, sarı,
yeşil, mavi, mor, kırmızı veya renksiz olabilen bir mineraldir.
Doğada en fazla renk çeşitliliğine sahip minerallerden birisidir.
Yoğunluğu 3,2 g/cm³, sertliği ise Mohs sertlik cetveline göre 4'tür.
Kristal yapısı genelde kübik olmakla beraber oktahedral yapılara
da rastlanmaktadır. Flor için en önemli kaynak olan CaF2 suda çok
az çözündüğünden tortul kayalarda bulunur.
Diğer kaynakları ise Na3AlF6 (kriyolit) ve Ca5(PO4)3F (apetit) dir.
Apatit kristalde bulunan OH- ve F- , veya Cl- iyonlarının görece oranlarına göre adlandırılan
hidroksiapatit, floroapatit ve kloroapatit gibi fosfat mineraller grubudur. Bu minerallerin
formülleri; Ca5(PO4)3(OH), Ca5(PO4)3F and Ca5(PO4)3Cl şeklindedir.
iyot, metal nitratlar içinde KIO3 şeklinde bulunur. Klor ve bromun en önemli kaynağı deniz
suyudur. Bu elementler deniz suyunda halojenürler halinde bulunur. Halojenlerin son elementi
olan astatin radyoaktiftir.
Astatin 1940 yılında Carson ve Mackenzie tarafından 209Bi'nin α-parçacıkları ile bombardıman
211
1
edilmesiyle elde edilmiştir: 42 He + 209
83 Bi
85 At +2 0 n
10.2.1. Halojenlerin elde ediliş yöntemleri ,
Flor Eldesi:
Florun varlığı 19. yüzyılın başından beri bilinmekle birlikte, hiç kimse elementel floru,
bileşenlerinden eldesi için kimyasal bir tepkime önermemiştir. H. Moissan 1886 yılında F2(g)
gazını elektrolizle elde etmeyi başardı. Günümüzde bile en önemli ticari yöntem olan
Moissan yönteminde, sıvı KHF2 içinde çözülen HF elektroliz edilir.
Anot: 2 F- F2(g) +2 eKatot: 2H + 2e H 2(g)
elektroliz
2HF
H 2(g) + F2(g)
KF,2HF(s)
Klor Eldesi:
Klor, sanayide NaCl(aq) çözeltisinin elektrolizi ile elde edilir.
Kimi zaman da erimiş sodyum klorürden elde edilir.
2C1-(aq) + 2 H2O 2OH-(aq) +H2(g) +Cl2(g)
10.2.1. Halojenlerin elde ediliş yöntemleri ,
Brom Eldesi:
Brom deniz suyundan ya da iç deniz ve göllerin tuzlu sularından elde edilir. Deniz suyunda
yaklaşık 70 ppm Br- iyonu vardır. pH=3,5 değerine ayarlanan deniz suyuna ya da tuzlu suya
Cl2(g) gönderilerek, ortamdaki Br- iyonunun elementel broma (Br2) yükseltgenmesi sağlanır.
Cl2(g) +2Br-(aq) Br2(g) +2Cl-(aq) Epil =0,293 V
Açığa çıkan Br2, deniz suyundan hava akımıyla ya da tuzlu sudan buharla "süpürülerek" alınır.
Böylece elde edilen seyreltik brom buharı çeşitli yöntemlerle deriştirilir.
İyot Eldesi:
Deniz yosunu gibi bazı deniz bitkileri Cl- ve Br- yanında iyodürü (I-) seçimli bir şekilde
absorplar ve biriktirir. Az miktarda iyot bu tür bileşiklerden elde edilir.
İyodun bol bulunduğu diğer bir kaynak NaIO3 tir ve Şili'de geniş yataklar halinde bulunur.
IO3-, sodyum bisülfit ile I- iyonuna indirgenir. İkinci basamakta ise IO3- ile I- tepkimeye girerek
I2 elde edilir.
IO3 (aq) + 3HSO3 (aq) I- (aq) + 3SO 4
-
-
2(aq)
+ 3H + (aq)
5I- (aq) + IO3 (aq) + 6 H + (aq) 3I 2(k) +3 H 2 O(s)
-
10.2. Halojenlerin kullanım alanları,
Flor elementi:
•Politetrafloretilen (Teflon) eldesinde
•Klorflorkarbonların (CFC) (soğutucu) elde edilmesinde kullanılır. (Ancak, bir çok ülkede ozon
tabakasına zarar vermesi nedeniyle ClFC üretimi yasaklanmıştır.)
•Şimdilerde ise flor, CFC lara seçenek olarak çevreyle daha dost hidroklorflorkarbonlann
(HClFC) üretiminde kullanıl maktadır.
Klor elementi;
•Etilen diklorür (CH2ClCH2Cl) ve vinil klorür (CH2 = CHCl, polivinil klorür (PVC) monomeri) gibi
klorlanmış organik bileşiklerin üretimi (% 70),
•Kağıt ve tekstil endüstrilerinde ağartıcı olarak, yüzme havuzlarının, şehir sularının ve atık
sularının temizlenip dezenfekte edilmesi (%20),
•Klor içeren anorganik bileşiklerin üretimi (% 10).
10.2. Halojenlerin kullanım alanları,
Brom elementi;
Brom, brom içeren organik bileşiklerin elde edilmesinde kullanılır.
Bunların bazıları; yangın söndürücü ve böcek ilacıdır.
Diğer yaygın bir kullanım alanı boya ve ilaç sanayiidir.
Önemli bir anorganik brom bileşiği AgBr dür ve ışığa duyarlı olduğundan fotoğrafçılıkta
kullanılır.
İyot elementi;
İyot ve bileşikleri katalizör olarak, tıpta ve fotoğrafla ilgili emülsiyonların (AgI olarak)
hazırlanmasında kullanılmakla birlikte, klordan çok daha az ticari öneme sahiptir.
10.3. Önemli halojen bileşikleri, özellikleri ve kullanım alanları,
Hidrojen Halojenürler (HF,HCl,HBr,HI);
Hidrojen halojenürlerin sulu çözeltilerine hidrohalik asitler denir.
Hidroflorik asit dışında diğer hidrohalik asitlerin hepsi kuvvetli asitlerdir.
HF ün iyi bilinen bir özelliği, camı aşındırma (ve sonunda çözme) yeteneğine sahip
olmasıdır. Bu tepkimede cam, silisyum dioksit, SiO2, olarak düşünülebilir.
SiO 2(k) + 4HF(aq) 2H 2O (s) +SiF4(g)
tepkimesinden dolayı HF cam kaplarda değil, teflon ya da polietilenle kaplanmış özel
kaplarda saklanır.
10.3. Önemli halojen bileşikleri, özellikleri ve kullanım alanları,
Hidrohalik asitlerin eldesi:
Bir halojenür tuzu (florit gibi, CaF2), derişik H2SO4(aq) gibi uçucu olmayan bir asitle ısıtıldığı
zaman, bir sülfat tuzu ile uçucu hidrojen halojenür oluşur.
CaF2(k) + H2SO4(der. aq)
CaSO4(k) + 2HF(g)
Bu yöntemle HCl(g) de elde edilebilir. Ancak HBr(g) ve HI(g) elde edilemez. Bunun nedeni,
derişik H2SO4(aq) in Br- ü elementel broma (Br2) ve I- ü elementel iyoda (I2) yükseltgemesidir.
Ayrıca, bütün hidrojen halojenürler, elementlerin doğrudan birleştirilmesiyle elde
edilebilirler.
H 2(g) + X 2(g) 2HX (g)
H2(g) ile F2(g) un verdiği tepkime bazı koşullarda patlayarak oluşur. Ayrıca H2(g) ile Cl2(g) un
verdiği tepkime de ışıkta hızlı bir şekilde (patlayarak) yürür. Bununla birlikte, önemli
miktarda HCl ticari olarak bu şekilde elde edilir. Br2 ve I2 un H2 ile verdiği tepkimeler
yavaştır ve bir katalizör ister.
Hidrohalik asitlerin özellikleri:
Çizelgede verilerden anlaşılacağı gibi HF, HCl ve HBr ün standart
oluşum serbest enerjilerinin büyük ve negatif olması bize
tepkimesinin tersinin olmayacağını gösterir.
Diğer taraftan HI(g) ün ΔG0 i küçük ve pozitiftir. Bu durum oda
sıcaklığında bile HI(g) ün elementlerine bir dereceye kadar
ayrışacağı anlaşılır.
Bununla birlikte, eşik enerjisi büyük olduğundan, ayrışma tepkimesi ve bir katalizör
kullanılmaması durumunda oldukça yavaş yürür. Sonuç olarak, HI(g) oda sıcaklığında kararlı bir
bileşiktir. HI(g) ün oda sıcaklığında bozunması kinetik kontrollü (termodinamik kontrollü değil)
bir tepkimedir.
Aynı grupta yukardan aşağıya doğru gidildikçe hidrohalik asitlerin asit kuvvetleri azalır.
Halojenlerin oksitleri:
Halojenlerin oksijen ile oluşturduğu birçok ikili bileşiği bilinmektedir. Fakat bunların çoğu
kararsızdır ve laboratuarda yaygın olarak kullanılmazlar. Oksijen diflorür (OF2), flor ve oksijenin en
kararlı ikili bileşiğidir ve F2 gazının seyreltik hidroksit çözeltisinden geçirilmesiyle hazırlanır.
2F2 + 2OH - OF2 + 2F- + H 2O
Büyük ölçekte üretilen tek halojen oksit, klor dioksittir. Bu
amaçla kullanılan tepkime, CIO3- nin HCI ya da SO2 ile
indirgenmesidir
2CIO3 + 2C1- + 4H + 2ClO2 + C12 + 2H 2O
-
2C1O3 + SO2 2C1O2 + SO4
-
2-
Diklor oksit, Na2CO3 ile Cl2'nin etkileşmesinden elde edilir.
2CO3 + 2C12 + H2O Cl2O + 2HCO3 + 2C12-
-
Diklor heptaoksit (Cl2O7), perklorik asidin (HCIO4) anhidritidir ve asidin dehidrasyonu ile (suyun
uzaklaştırılmasıyla) elde edilir.
12HC1O 4 + P4 O10 6C12 O7 + 4H 3PO 4
Cl2O7, ClO2 ve Cl2O'dan daha kararlıdır. Fakat oldukça tepkindir.
Bromun en iyi bilinen iki oksidi dibrom oksit (Br2O) ve brom dioksit (BrO2) tir.
İyodun en kararlı oksidi, diiyot pentaoksit (I2O5) tir. İyodik asidin (HIO3) ısısal dehidrasyonundan
200 0C
elde edilir. 2HIO
I O +H O
3
2
5
2
Halojenlerin oksiasitleri ve yükseltgenme basamakları:
YB
+1
+3
+5
+7
KLOR
HOCl
HOCl2
HOCl3
HOCl4
BROM
HOBr
-HOBr3
HOBr4
İYOT
HOI
-HOI3
HOI4
Oksiasitler:H-O-Z şeklindeki asitlerdir.Buradaki Z nin
elektronegatifliği O2 'ye göre düşükse asit değil baz
olur.
n=0 →asit çok zayıftır. Örneğin; HOCI,HOBr,HOI
n=1 →asit zayıftır.Örneğin;HOCIO
n=2 →asit orta kuvvetlidir.Örneğin;HOCIO2
n=3 →asit kuvvetlidir. Örneğin;HOCIO3,HOIO3
Klor, oksiasitlerin tam bir serisini olşturduğu halde brom ve iyot oluşturmaz. Saf olarak
yalnızca bir kaç oksiasit (HClO4, HIO3, HIO4, H5IO6) elde edilebilir. Geri kalanı ancak sulu
çözeltide kararlı halde bulunur.
En elektronegatif element olan flor, bileşiklerinde -1 yükseltgenme basamağına sahiptir. Diğer
halojenler, oksijen gibi daha elektronegatif bir elemente bağlandığı zaman, birkaç pozitif
yükseltgenme basamağından (+1, +3, +5 ve +7) herhangi birine sahip olabilir.
Halojenlerin oksianyonları:
Halojenlerin XO-, XO2-, XO3- ve XO4- şeklinde
formüllendirilen oksoanyonları bulunmaktadır. Florun
tek oksoanyonu FO- dir. Diğer halojenlerin yukarıdaki
formüllere sahip oksoanyonları bilinmektedir.
Klordioksit, kağıt ve iplikler için önemli bir ağartıcıdır.
Kanalizasyon ve içme sularının dezenfeksiyonunda da
kullanılır.
2 C1O2(g) + O2
2-
2ClO2 (aq) +O2(g)
-
(aq)
Klordioksit, kağıt ve iplikler için önemli bir ağartıcıdır. Kanalizasyon ve içme sularının
dezenfeksiyonunda da kullanılır. Klordioksit, sulu çözeltilerinde peroksit iyonuyla
indirgendiğinde klorit tuzlan oluşur.
3C12(g) + 6OH-(aq) 5Cl-(aq) + ClO3 (aq) + 3H2O(s)
-
Kloratlar iyi birer yükseltgendirler. Ayrıca katı kloratlar O2 gazı oluşturarak bozunduklarından,
kibrit ve donanma fişeği yapımında kullanılırlar. Laboratuvarda O2(g) elde etmek için KClO3(k),
MnO2(k) katalizörlüğünde ısıtılır.
2KClO3(k)
KCl(k) + 3O2(g)
MnO2
Benzer bir tepkime uçaklarda ve denizaltılarda, acil oksijen ihtiyacım karşılamak için kullanılır.
Perklorat tuzları, başlıca klorat çözeltilerinin elektroliziyle elde edilir. ClO3- ın bir Pt anotda
yükseltgenmesi aşağıdaki yarı tepkimeye göre gerçekleşir.
C1O3 (aq) + H2O(s) ClO4 (aq) + 2H+(aq) +2e- -E° = -1,189 V
Halojenlerin oksianyonları:
Perklorat tuzları, başlıca klorat çözeltilerinin elektroliziyle elde edilir. ClO3- ın bir Pt anotda
yükseltgenmesi aşağıdaki yarı tepkimeye göre gerçekleşir.
C1O3 (aq) + H2O(s) ClO4 (aq) + 2H+(aq) +2e- -E° = -1,189 V
-
-
• ClO4-, sulu ortamda ligantlık gücü en zayıf olan iyonlardan biridir.
•Klor için +7 den daha fazla yükseltgenme basamağa olmadığından, perkloratlar bozunmazlar.
Perkloratlar diğer oksiasit tuzlarına göre oldukça kararlıdır.
•Bununla birlikte, yüksek sıcaklıklarda ya da kolayca yükseltgenebilen bir bileşik beraberinde,
perklorat tuzları patlayarak tepkimeye girebilirler. Bunun için perklorat tuzlan kullanılırken
dikkat edilmelidir.
•Amonyum perklorat ve alüminyum tozu karışımları uzay mekikleri gibi, bazı roketlerde katı
yakıt olarak kullanılırlar.
•Amonyum perkloratın kullanılması çok tehlikelidir. Çünkü, bir yükseltgen olan ClO4- bir
indirgen olan NH4+ üzerine etki ederek patlayıcı bir tepkime oluşturabilir.
Polihalojenür Iyonları:
Triiyodür iyonu (I3-), polihalojenür iyonları denen iyonlar grubundan biri olup, bir halojenür
iyonunun bir halojen molekülü ile verdiği tepkime sonucu oluşur. Bu tepkimede halojenür
iyonu bir Lewis-bazı (elektron-çifti vericisi) olarak, molekül ise bir Lewis-asiti (elektron-çifti
alıcısı) olarak etki eder.
Halojenler Arası Bileşikler :
Herbir halojen elementi, yalnızca X2 gibi diatomik molekülleri oluşturmakla kalmaz; XY gibi
farklı halojenlerin olduğu molekülleri de oluşturur. XY3, XY5 ya da XY7 gibi diğer halojenler
arası bileşikler çok atomlu moleküllerdir.
Halojenler arası bileşiklerin molekül yapılarında, hacmi daha büyük ve elektronegatifliği
daha küçük olan halojeni merkez atomu, daha küçük halojen atomları ise uç atomlar olarak
gösterilir. Halojenler arası bileşiklerin molekül geometrileri VSEPR kuramının
öngördükleriyle gayet iyi uyuşur. IF7 molekülü, bir pentagonal bipiramit yapı oluşturmak için
merkez atom etrafında dağılmış yedi elektron çiftli bir yapıya sahiptir. Halojenler arası
bileşiklerin çoğu çok etkindir.
Halojenler arası bileşiklerin çoğu çok etkindir.
Örneğin; ClF3 ve BrF3, su, organik maddeler ve bazı
anorganik maddelerle çok hızlı tepkime verirler. Bu iki
triflorür, gaz difüzyonu ile uranyum izotoplarının
ayrılmasında kullanılan UF6 ün elde edilmesinde olduğu
gibi, florlayıcı madde olarak kullanılır. ICl, organik kimyada
iyotlayıcı bir madde olarak kullanılır.
NOT: Halojenlerin olduğu gibi Halojen Bileşiklerininde önemli kullanım alanları
vardır.Bunlar;
HALOJEN
BİLEŞİĞİ
NO2AlF6
BF3
CaF2
ClF3
HF
LiF
NaF
SF6
SnF2
UF6
KULLANIM ŞEKLİ
Alüminyum üretimi,
Katalizör,
Optikle ilgili bileşenler,HF üretimi,metalorüjüyle ilgili madde,
Florlandırıcı madde,nükleer yakıtların tekrar işlenmesi,
F2,AlF3,Na3AlF6 ve Florkarbonlerın üretimi,
Seramik üretimi, kaynakçılık ve lehimcilik,
Florürlü su, diş koruma, sinek ilacı,
Yüksek voltajlı elektrik cihazlarda yalıtkan gaz,
Diş macunu üretimi
Nükleer reaktörler için uranyum yakıtının üre
11.BÖLÜM
11.BÖLÜM: GEÇİŞ ELEMENTLERİ
11.1. Önemli demir cevherleri ve bunlardan ham demir üretim yöntemleri,
Başlıca demir cevherleri oksitler ve karbonatlardır.
Bu cevherler: Hematit (Fe2O3), manyetit (Fe2O3.FeO), limonit (2Fe2O3.3H2O) ve siderit (FeCO3) tir.
Demir Üretimi:
1. Cevher, eritici ve kömürden oluşan
ham maddeleri; kırma, ufalama,
yakma (Piritlerin yakılması), kok
yapımı vb. ilk işlemlerden geçirerek
yüksek fırına atılabilecek şekle
dönüştürme aşaması.
İndirgenlerin oluşumu:
C + H 2 O CO + H 2 (600 °C)
C + CO 2 2 CO (1700 °C)
2C +O 2 2CO (1700 °C)
11.1. Önemli demir cevherleri ve bunlardan ham demir üretim yöntemleri,
2. Ham demir (pik) veya font elde edilişi ve iri döküm
ürünlerinin elde edilişi;
Demir metalürjisinde kullanılan yüksek fırında cevher,
kömür ile beraber 1900°C civarında yakılmakta ve
1300°C’de çabuk soğuma sonucu beyaz font üretilir.
Yavaş soğuma sağlanırsa esmer font elde edilir.
Fe3O 4(k) + 4CO(g) 3 Fe(s) + 4CO 2(g)
Artık maddeye (curuf) adı verilir.
3. Elde edilen font'a (demire) hava ve demir oksit etki
ettirilerek yumuşak demir üretilir(Puddling Yöntemi).
Çelik üretiminde ise beyaz fontun yakılarak fazla
karbonun alınması (Martin-Siemens Yöntemi) veya
yumuşak demire hava üflenerek karbonlanması
(Bessemer veya Thomas) yöntemi gibi işlemler uygulanır.
11.1. Önemli demir cevherleri ve bunlardan ham demir üretim yöntemleri,
3. Üçüncü aşamanın
ürünü olan kütüklerin
ya ingot kalıplara
dökülerek veya su ile
soğutulan bakır kokil ile
bir uçtan akıtılırken
öteki uçtan katılaşmış
şekilde dışarı çekilerek
sürekli olarak (sürekli
döküm) dökülerek
piyasada görülen saç,
değişik boy ve
şekillerdeki çubuk,
profil elemanlar olarak
yarı işlenmiş eşya
durumuna getirilmesi.
11.1. Demir üretimi,
1) İndirgenlerin oluşumu:
C + H 2O CO + H 2 (600 °C)
C + CO 2 2 CO (1700 °C)
2C +O 2 2CO (1700 °C)
2) Demir oksidin indirgenmesi;
3CO+ Fe2O3 2Fe+3CO2 (900 °C)
3H 2 +Fe2O3 2Fe + 3 H 2O (900 °C)
CaCO3 CaO + CO2 (800-900 °C)
4) Demir safsızlık oluşumu:
MnO + C Mn + CO (1400 °C)
CaO + SiO2 CaSiO3(s) (1200 °C)
SiO2 + 2C Si + 2CO (1400 °C)
6 CaO + P4O10 2 Ca 3 (PO4 ) 2(S) (1200 °C)
P4O10 + 10C 4P + 10CO (1400 °C)
3) Safsızlıkların Curuf oluşumumu;
Demir cevherinin demire indirgenmesinin basitleştirilmiş denklemi aşağıdaki gibidir.
Fe2O3(k) + 3CO(g) 2 Fe(s) + 3CO 2(g)
11.2. Çelik üretiminde oksijenin ve katkı metallerinin rolleri,
Pik demirden çelik elde etmek için yapılması gereken başlıca
işlemler;
•Pik demirdeki karbon miktan % 3-4 den % 0-1,5 değerine
indirilir.
•Si, Mn, P (pik demirdeki yüzdeleri 1 ya da daha fazladır) ve diğer
ikinci derecedeki safsızlıklar curuf oluşturularak uzaklaştırılır.
•İstenen özelliklerde çelik elde etmek için gerekli elementler (Cr,
Ni, Mn, V, Mo ve W gibi) eklenir.
Çelik üretiminde en önemli yöntem temel oksijen yöntemidir.
Yaklaşık 10 atm. basıncındaki oksijen, toz halindeki kireçtaşı ile
birlikte, suyla soğutulan tüpten geçirilir ve sıvı pik demir
üzerinden dışarıya atılır. Tepkime süresi genellikle 22 dakikadır.
Tepkime kabı eğilerek, demirin üzerindeki curuf dışarıya atılır ve
daha sonra istenen alaşım elementleri eklenir.
11.2. Çelik üretiminde oksijenin ve katkı metallerinin rolleri,
2C + O 2 2 CO
2 FeO + Si 2 Fe + SiO 2
FeO + Mn Fe + MnO
FeO + SiO 2 FeSiO3
CURUF
MnO + SiO 2 MnSiO3
CURUF
4 P + 5O 2 P4O10
6 CaO + P4O10 2 Ca 3 (PO 4 ) 2
CURUF
Demir cevherinden tek basamakta çelik eldesi için bir yöntem geliştirilmiştir. Demir cevheri, bu
işlemde kullanılan bütün maddelerin erime noktalanndan daha düşük bir sıcaklıkta demire
indirgenebilir. Demirin doğrudan indirgenmesinde kullanılan CO(g) ve H2(g), buhar ile doğal
gazın tepkimesinden elde edilir. Bu yöntemin ekonomik olabilmesi için doğal gazın bol olması
gerekir. Şu anda dünyadaki demir üretiminin ancak küçük bir yüzdesi bu yöntemle elde
ediliyorsa da, demirçelik endüstrisindeki kullanma alanı, özellikle Ortadoğu ve Güney
Amerika'da hızla genişlemektedir.