T. C.
ŞİŞLİ ETFAL EĞİTİM VE ARAŞTIRMA HASTANESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
VENTRİKÜLOPERİTONEAL ŞANT
ENFEKSİYONU SEBEBİYLE TEDAVİ EDİLEN
ÇOCUKLARIN RETROSPEKTİF
DEĞERLENDİRİLMESİ
TIPTA UZMANLIK TEZİ
Dr.FATMA ÇAVUŞOĞLU
DANIŞMAN
Doç. Dr. FEYZULLAH ÇETİNKAYA
İSTANBUL 2008
TEŞEKKÜR
Asistanlığım boyunca katkı ve desteklerinden dolayı başhekimimiz Sayın Doç.
Dr. Ali İhsan Dokucu’ya, bilgi ve deneyimlerini paylaşarak iyi bir hekim olmamız
için emek veren ve bugünlere gelmemi sağlayan başta tez hocam Sayın Doç. Dr.
Feyzullah Çetinkaya’ya, Sayın Prof. Dr. Asiye Nuhoğlu’na, bilgi, sevgisi ve
desteğini gördüğüm hocam Sayın Doç. Dr. Zeynep Yıldız Yıldırmak’a, değerli
uzmanlarıma saygı ve teşekkürlerimi sunarım.
Uzmanlık eğitimim boyunca dostluk ve arkadaşlıklarını esirgemeyen,
çalışmalarımda desteklerini gördüğüm tüm asistan arkadaşlarıma, kliniğimizin
özverli çalışan hemşire, labourant, teknisyen ve personel arkadaşlara teşekkürlerimi
sunarım.
Eğitimim boyunca iyi ve kötü günde beni hiç y alnız bırakmayan, sevgi ve
desteğini hiç
esirgemeyen sevgili eşim Gökhan Çavuşoğlu’na ve aileme
teşekkürlerimi sunarım.
Dr.Fatma Çavuşoğlu
İstanbul 2008
i
İÇİNDEKİLER
TEŞEKKÜR .............................................................................................................................. i İÇİNDEKİLER ........................................................................................................................ ii KISALTMALAR .................................................................................................................... iii TABLO LİSTESİ .................................................................................................................... iv ÖZET ....................................................................................................................................... v GİRİŞ VE AMAÇ .................................................................................................................... 1 GENEL BİLGİLER ................................................................................................................. 2 GEREÇ VE YÖNTEM .......................................................................................................... 24 BULGULAR .......................................................................................................................... 26 TARTIŞMA ........................................................................................................................... 37 SONUÇLAR .......................................................................................................................... 43 KAYNAKLAR ...................................................................................................................... 45 ii
KISALTMALAR
BOS
: Beyin omurilik sıvısı
BT
: Bilgisayarlı tomografi
CMV
: Cytomegalovirus
EVD
: Ekstraventriküler drenaj
GKS
: Glaskow koma skalası
İKK
: İntrakranial kitle
KİBAS
: Kafa içi basınç artış sendromu
MÖ
: Milattan önce
MRG
: Manyetik rezonans görüntüleme
MS
: Milattan sonra
PMNL
: Polimorfonüveli lokosit
OHKD
: Orta hat kapanma defekti
USG
: Ultrasonografi
VPŞ
: Ventriküloperitoneal şant
ŞET
: Şant enfeksiyon tipi
İU
: İntrauterin
iii
TABLO LİSTESİ
Sayfa no
Tablo 1:Hidrosefali nedenleri……………………………………………........
12
Tablo 2:Şant enfeksiyonlarında risk faktörleri...............................................
19
Tablo 3: Şant enfeksiyonlarında klinik semptom ve bulgular........................
21
Tablo 4:Ventriküloperitoneal şant enfeksiyonlu olguların yaş ve
cinsiyetlere göre dağılımları...............................................................
Tablo 5: Hidrosefali olgularımızın etyolojiye göre dağılımları......................
26
27
Tablo 6:Ventriküloperitoneal şant enfeksiyonlu hastalarda
prematür doğum öyküsü....................................................................
27
Tablo 7: Ventriküloperitoneal şant enfeksiyonlu olgularda
şant enfeksiyon tipi............................................................................
28
Tablo 8: Ventriküloperitoneal şant enfeksiyonlu olgularda
klinik semptom ve bulgular..............................................................
29
Tablo 9: Ventriküloperitoneal şant enfeksiyonlu hastalarda
laboratur bulguları............................................................................
30
Tablo 10: Ventriküloperitoneal şant enfeksiyonunda BOS’ta
üreyen mikroorganizmalar................................................................
31
Tablo 11: Ventriküloperitoneal şant enfeksiyonunda BOS örneklemesinde
Gram(+) mikroorganizmaların antibiyotik duyarlılıkları..................
32
Tablo 12: Ventriküloperitoneal şant enfeksiyonunda BOS örneklemesinde
Gram (-) mikroorganizmaların antibiyotik duyarlılıkları..................
33
Tablo 13: Ventriküloperitoneal şant enfeksiyonlu olgularımızın
hastanede yatış süreleri......................................................................
34
Tablo 14: Ventriküloperitoneal şant enfeksiyonlu hastaların BOS
bulgularının hastanede yatış sürelerine etkileri.................................
35
Tablo 15: Hastanede yatış sürelerini etkileyen faktörler.................................
36
iv
ÖZET
Bu çalışmada Şişli Etfal Eğitim ve Araştırma Hastanesi Çocuk Sağlığı ve
Hastalıkları Enfeksiyon Kliniğinde Aralık 2001-Ağustos 2008 tarihleri arasında şant
enfeksiyonu nedeniyle takip ve tedavi edilen 40 hastanın yaş ve cinsiyete göre
dağılımları, hidrosefali etyolojik faktörleri, fizik muayene ve laboratuvar bulguları,
BOS’ta üreyen mikroorganizmalar ve antibiyotik duyarlılıkları, uygulanan tedavi
yöntemleri, hastanede yatış süreleri ve bu süreyi etkileyen faktörler geriye dönük
olarak değerlendirilmiştir. Hidrosefali nedenleri arasında meningomyeloselin
çoğunlukta olduğu konjenital malformasyonlar (%60) ilk sırayı almaktadır. Şant
takılan hastalarda enfeksiyon gelişme zamanı (%70) ilk üç ay, (%17,5) 90–180 gün
arasında, (%12,5) 180 günden fazla olarak saptanmıştır. Hastaların klinik belirti ve
bulgularından en sık görülenler ateş(%95), kusma(%82,5), baş çevresinde büyüme
(%82,5), mental durum değişikliliği (%55) ve nöbettir(%47,5). BOS kültür sonuçları
incelendiğinde vakaların %42,5’unda miks üreme, %30’unda S.epidermitis ve S.
aureus, %7,5’unda P.aueroginosa, %5’inde brucella, %2,5’unda Candida albicans
saptanmıştır. Tedavi sonuçları
incelendiğinde
BOS
kültüründe
Gram (+)
mikroorganizmaların ürediği hastalarda en etkili antibiyotiklerin Rifampisin,
Linezolid ve Vankomisin olduğu görülmüştür. BOS kültürü sonrası Gram (-)
mikroorganizmaların saptandığı hastalarda ise en etkili antibiyotiğin Meropenem
olduğu saptanmıştır. Olgular hastanede yatış sürelerine göre değerlendirildiğinde; 21
hastanın 30 günden fazla, 19 hastanın 30 günden az hastanede yatış süresine sahip
olduğu görülmüştür. Hastanede yatış süresi ile bu süreyi etkileyen faktörler, klinik ve
laboratuar bulguları arasında yapılan istatiksel değerlendirmede; BOS/ Kan glukoz
oranı düşük olan hastaların istatiksel olarak anlamlı daha uzun süre hastanede tedavi
gördükleri belirlenmiştir. Tedavi gören beş hastada exitus gelişmiştir. Bu hastaların
ikisinde serebral herniasyon, ikisinde barsak perforasyonu, birinde ise Vankomisin
dirençli enterekok ve C.albicans miks üremesi saptanmıştır. Şant enfeksiyonları
komplikasyon ve mortalitesi yüksek bir hastalık grubudur. Bu hastalarda erken tanı
ve mikroorganizmaya yönelik uygun antibiyotik tedavisi prognoz ve sekellerin
önlenmesi için çok önemlidir.
v
GİRİŞ VE AMAÇ
Operasyon öncesi, sonrası ve operasyon sırasındaki tekniklerdeki gelişmelere
rağmen
hidrosefali
tedavisinde
uygulanan
ventriküloperitoneal
şant
(VPŞ)
operasyonlarından sonra gelişen şant önemli bir sorun olarak devam etmektedir
(1,3,4). Şant enfeksiyonları komplikasyonları günümüzde ve şant tıkanmaları
pediatrik dönemde en sık karşılaşılan VPŞ komplikasyonlarıdır (1,3). Bu
komplikasyonlar olgular için morbidite ve mortalite artışının yanı sıra, yüksek
ekonomik
maliyetleri
ile
de
sorun
oluşturmaktadırlar.
Bu
nedenle
şant
komplikasyonlarının önlenmesi amacıyla çeşitli çalışmalar halen sürdürülmektedir.
Bu çalışmada Aralık 2001-Ağustos 2008 tarihleri arasında hidrosefali
sebebiyle VPŞ takılan, şant enfeksiyonu gelişen Şişli Etfal Eğitim Araştırma
Hastanesi Çoçuk Enfeksiyon Kliniğinde takip ve tedavi edilen olguların dağılımı,
etiyolojik faktörleri, fizik muayene ve laboratuvar bulguları, şant enfeksiyonuna
sebep
olan
antibiyogramına
mikroorganizmanın
saptanması,
mikroorganizmanın
kültür
bakılarak hastanedeki antibiyotik dirençliliğinin saptanması ve
uygun antibiyotik tedavisinin başlanması , uzun süre hastanede yatan hastaların yatış
süresini uzatan risk faktörlerinin saptanması için hastaların geriye dönük olarak
değerlendirilmesi amaçlanmıştır.
1
GENEL BİLGİLER
TARİHÇE
Hidrosefali ile ilgili ilk kayıtlar Mısır ve Mezopotamya’dan başlar. M.Ö.
1500’lerde Ebers papiruslerinde hidrosefaliye ait bilgilere rastlanmıştır. İlk kez
Hippocrates hidrosefali tedavisinden ve ventriküler ponksiyondan ilk kez (MÖ 460–
377) söz etmiştir (4–5). 1545 yılında Thomas Phaire tarafından hidrosefalinin tanı ve
tedavisi ile ilgili önemli bilgiler literatürdeki yerini almıştır (1). Hidrosefalinin
anatomik ve patolojik özelliklerini ve ilk kez internal hidrosefalinin tanımını ise
Andreas Vesalius (1514–1564)yapmıştır (1, 2). Thomas Willis (1621–1675) BOS’un
venöz sisteme drenajını ve koroid pleksusların BOS sekresyonunu yaptığını ortaya
koymuştur (1). Franciscus Sylvius (1614–1672) aquadukt’u, Pacchioni (1701)
granüler cisimleri, Alexander Monroe (1713–1817) interventriküler foramenleri
tanımlamışlardır (2).1774’de Cotugno ventriküllerden BOS aspirasyonunu, Whytt
(1714–1766)ise ilk kez internal ve eksternal hidrosefaliyi tanımlamışlardır (2, 3).
1825’de Magendie, 1855’de Luschka foramen Magendie ve foramen
Luschka’ları tarif edip, BOS’un subaraknoid mesafeye geçişini tanımlamışlardır (1,
3). BOS üretimi, akım yolları ve emilimi konusunda ise Key ve Retzius tarafından
önemli
çalışmalar
yapılmış
ve
hidrosefalide
birçok
tedavi
yöntemi
geliştirilmişdir.(3,4,5). Dandy ve Blackfan hayvanlar üzerinde yaptıkları deneylerle
obstrüktif ve komminüke hidrosefali tanımlarını bildirmişlerdir (2,4).
Yirminci yüzyılın başlarında Weed koroid pleksusların embriyolojisi ve
araknoid villus absorbsiyon kapasitelerini göstererek, BOS’un subkütanöz bölgeye,
boyun venlerine ve venöz sinüslere drenajını göstermişdir. Yine bu dönemde değişik
vücut boşluklarına BOS’un drenajını sağlayan cerrahi yöntemler geliştirilmiştir (1).
Anton ve Bramann BOS’un subaraknoid bölgeye drenajını gösteren önemli deney
çalışmaları yapmışlardır (1, 3).
20.yüzyılın başlarında şant cerrahisinde önemli mesafeler katedilmiştir.
BOS’un cerrahi drenajı için distal üreter, fallop tüpleri, plevral kavite, mesane, mide,
2
sagital sinüs, sisterna magna, sağ atrium, peritoneal kavite gibi değişik vücut
boşlukları kullanılmış, ventrikül ile bu boşluklar ilişkilendirildiği gibi, lomber
subaraknoid mesafe ile periton arasında da drenaj kullanılmıştır.(3,4,5)
SİNİR SİSTEMİNİN EMBRİYOLOJİK GELİŞİMİ
Döllenmeden sonraki 3. haftanın sonunda insan embriyosu oval plak şeklinde
olup, dıştan içe doğru; ektoderm, mesoderm ve endoderm olmak üzere üç tabakadır.
Ektoderm hücreleri çoğalarak önden arkaya uzanan nöral plağı oluştururlar.
Merkezi sinir sistemi bu nöral plaktan gelişecektir. Birkaç gün içinde nöral plağın
santral kesiminden anteriordan posteriora doğru sulkus nöralis denilen çöküntü
oluşur. Ektoderm hücrelerindeki çoğalmayla birlikte sulkus derinleşmeye ve nöral
plikalar birbirine yaklaşmaya başlar. Nöral katlantılar biraraya gelerek nöral tüpü
oluştururlar. Nöral tüp kapanırken 1/3 orta kısımdan plikalar birleşmeye başlar.
Nöral tüpün ön ve arka uçları delik olarak kalır, bunlara nöroporus anterior ve
posterior denir. Nöroporus anterior posteriora göre daha önce kapanır, nöroporus
posterior ise 25 somitli evreye gelinceye kadar açık kalır. Bu seyir sırasında nöral tüp
yüzeyel vücut ektoderminden ayrılır, bütün sinir elemanları bu nöral tüpten gelişir (6,
7).
Nöral tüpün ön ucunda dört haftalık bir embriyoda 3 tane primer kesecik
belirir. Beşinci haftada ise nöral tüp ön ucunda üç vezikül bulunmaktadır. Bu
vesiküller ön (prosensefalon), orta (mesensefalon) ve arka (rhombensefalon) sırasına
göre dizilmişlerdir. Altıncı haftada prosensefalon; diensefalon ve telensefalon olmak
üzere iki alt gruba ayrılır. Telensefalon yanlara doğru daha fazla gelişir.
Diensefalonu üstten ve yanlardan örter. Bu fazla gelişen kısımlar beyin
hemisferlerini oluşturur. Korpus striatum, rhinensefalon ve serebral korteks
telensefalondan meydana gelir. Telensefalon içindeki nöral kanal genişler, sağ ve sol
iki odacığa ayrılır, foramen interventrikülare yoluyla bu odacıklar birbirleri
ilişkilidir. Bu odacıklara lateral ventrikül denir. Prosensefalonun ön duvarları sağ ve
sol hemisferleri birleştirir. Lamina terminalis denilen bu kısımdan daha sonra
3
anterior komissur, fornix ve korpus kallosum denen iki hemisferi birbirine bağlayan
yollar gelişir (6,7).
Diensefalon hemisferlerin gelişmesiyle yanlardan ve üstten sarılarak iki
hemisferin arasında kalır. Talamus, epitalamus ve hipotalamus kısımları altıncı
haftadan itibaren ayrılmaya başlar. Diensefalonun içinde kalan boşluk 3. ventrikülü
oluşturur ve lateral ventriküllerle bağlantısı bu foramen Monroe yoluyla sağlanır. Bu
ventrikülün tavanı tela koroidea ikinci ayın yarısında 3. ventrikül içine invajine olan
koroidal pleksusu meydana getirirler.
Mesensefalon ayrışmaz, basal laminanın kalınlaşıp gelişmesi ile önde
pedinkulus serebriler oluşur. Korpora quadrigemine alar laminadan gelişmektedir.
Kanalis nöralis burada dar olarak kalır ve 3. ventrikül ile 4. ventrikülü birleştiren
aquaduktus Sylvius’u meydana getirir (6).Pons pontin fleksuradaki alar ve basal
laminaların kalınlaşması sonucu oluşur. Bu kısımda nöral kanal yanlara doğru iki
çıkmaz yaparak romboid bir şekil alır. Tavan plağı bu bölgeyi ince bir membran
halinde örter(Velum medullare).Bir odacık halini alan bu kısım 4.ventriküldür.
Romboid fossanın yan ucundaki iki foramen Luschka ve velum medullarenin
ortasındaki foramen Magendie beyin boşluklarını subaraknoid aralığa birleştiren
delikler olarak açık kalırlar(6).
Ventriküllerin beyin yüzeyine yakın kısımlarının duvarlarını ince bir pia
epandim zarı oluşturur. Bu zar içindeki damarlar, bu kısımlarda ventrikül lümenine
doğru salkım şeklinde uzanarak koroid pleksusları oluştururlar (6).
BEYİN VENTRİKÜLLERİNİN ANATOMİSİ
Beyin ve beyin sapı içerisinde yer alan birbiri ile bağlantılı beyin omurilik
sıvısıyla dolu boşluklara ventrikül (karıncık) adı verilir. Her iki beyin hemisferi
içerisine yerleşmiş olan sağ ve sol lateral ventriküller, her iki talamus ve hipotalamus
arasında yer alan 3.ventrikül ve beyin sapı posterior kesimde 4.ventrikül olmak üzere
birbiri ile bağlantılı dört adet ventrikül mevcuttur.
4
Lateral ventriküller ile 3.ventrikül arası bağlantı foramen Monro’lar ile
sağlanırken 3. ve 4.ventriküller arası bağlantı aquaduktus sylvius ile sağlanır.
Medulla spinalis içerisinde uzanan canalis centralis ile bağlantılı olan 4.ventrikül
posteriorda foramen Magendi, lateralde foramen Lusckha’larla subaraknoid aralığa
açılır. Her iki hemisfer içinde epandimle döşeli boşluklar olan lateral ventriküller, her
biri kornu anterior, gövde, kornu posterior, kornu inferior ve trigonum kollateral
denilen kısımlardan oluşmuştur (8,9).
Kornu anterior; foramen Monroe’dan öne doğru uzanan bölümdür. İç
duvarını septum pellisidum yaparken, tabanını ve dış duvarını nükleus kaudatus başı,
tavanı ve ön ucu korpus kallosumun lifleri tarafından oluşturulmuştur (8,9). Gövde;
foramen Monroe’nun posteriorundan, korpus kallosumun spleniumuna kadar uzanır.
İç duvarını septum pellisidum oluştururken, tavanını korpus kallosum yapar. Dış
duvarını ise aşağıdan yukarı doğru koroid pleksus, talamusun dorsal yüzü, stria
terminalis, vena terminalis ve nükleus kaudatus oluşturmaktadır. (8,9).
Atrium; gövdenin arka ucunda arka ve alt boynuzların ayrıldığı bölgedir.
Kornu posterior; arkaya doğru oksipital lobun içine uzanır, korpus
kallosumun tapetumu tavanını ve yan duvarını oluştururken, iç duvarını korpus
kallosum radyasyonlarının oksipital kısımları yapar (9).
Kornu inferior; trigonum kollateraleden başlayıp, temporal lobların içine
doğru kıvrılan bölgedir. Tavanını temporal lobun beyaz cevheri, stria terminalis ve
nukleus kaudatusun kuyruğu oluşturur. Nükleus kaudatusun kuyruğunun ucunda
amygdaloid nükleus bulunur.
Medial duvarı medialden laterale doğru sırasıyla
fimbria, pleksus koroideus, hipokampus ve eminentia kollateralis tarafından
yapılmıştır (8).
Üçüncü ventrikül; yan duvarları üstte talamus, altta hipotalamus tarafından
yapılmıştır. Ön duvarını ise kiazma optikumdan anterior komissura kadar uzanan
lamina terminalis yapar. Kiazma ile bu laminanın alt kenarı arasında resessus optikus
bulunur. Ventrikülün tabanını ise optik kiazma, infundibulum, tuber sinereum,
5
korpus mamillare ve subtalamus oluşturmaktadır. Ventrikülün tavanı stria
medullarislerin arasına gerilmiş zayıf, ince bir pia tabakası ile örtülmüştür. Bu lamina
tela koroideayı yapar. Bu tabakanın katlantıları ventrikülün içine üzüm salkımı
şeklinde uzanarak koroid pleksusu meydana getirirler (8, 9).
Dördüncü ventrikül romboid fossanın posteriordan velum medullare ile
kapanmasından oluşmuş bir odacıktır. Dörtgen şeklinde olan romboid fossa 4.
ventrikülün döşemesini meydana getirir. Yanlardan serebellar pedinkuller ile
sınırlanmıştır. Alt ucuna obeks, yan çıkmazlarına resessus lateralis denir (9). Koroid
pleksus vasküler desteğini anterior ve posterolateral koroidal arterlerden alır, 3.
ventrikül içindeki kısmı ise posterior medial koroidal arter ve 4. ventriküldeki koroid
pleksus ise posterior inferior serebellar arterden (PİCA) beslenir. Venöz dönüşü
koroidal ven ile internal serebral venlere olmaktadır. 4. ventrikül koroid pleksusu ve
tela koroideayı drene eden medial ve lateral venöz segmentler ise serebellomedüller
fissür veni ve inferior pedinkül venlerine dökülürler (5, 9).
BOS FİZYOLOJİSİ, DOLANIMI VE FİZYOPATOLOJİSİ
BOS ventriküler sistemle subaraknoid boşluk arasında dolaşan berrak renksiz
bir sıvıdır.
Beyin için doğal bir yastık görevi yapar. Bununla birlikte beyin
metabolizmasının çeşitli substratlarının, metabolik ürünlerinin, hormonların ve
nörotransmitterlerin dolaşımını sağlayarak, santral sinir sisteminin iç ortamında
düzenleme görevi yapmak, beyini mekanik travmalara karşı korumak, beyinin
ekstrasellüler bölge ile direk temasını engellemek gibi birçok fonksiyonu vardır (10).
BOS’un büyük miktarının lateral ventriküldeki koroid pleksus tarafından
yapılmaktadır. Lateral ventriküllerde yapılan BOS foramen Monroe yoluyla 3.
ventriküle, buradan da aquadukt sylvius ile 4. ventriküle gelir ve foramen Magendie
ile foramen Luschkalar aracılığı ile subaraknoid aralığa geçer. BOS buradan yukarıya
yönelerek prepontin sisterna yoluyla interpedinküler sisternaya, buradan da
kiazmatik sistern yoluyla konveksiteye ulaşır. Dorsalden dolaşan BOS ise serebellar
hemisferlerin üzerinden quadrigeminal sisterne, ambient sisterne, vena serebri magna
sisterni yoluyla yine konveksiteye ulaşır. Aynı zamanda BOS spinal kord santral
6
kanalına ve spinal subaraknoid aralığa da geçer. Emilim ise araknoid villuslardan
venöz sinüslere olmaktadır (10-11).
Beyin ve omurilik etrafındaki subaraknoid mesafede, ventriküller ve canalis
centralisde bulunan BOS’un toplam miktarı 80-150 ml arasında değişmekle birlikte
ortalama 130 ml’dir. Bunun 15 ila 40 ml’si ventriküllerde geri kalan miktarı ise
subaraknoid mesafede bulunur. Lateral ventriküllerdeki koroid pleksus yüzey alanı
yaklaşık 40 cm2 olup BOS’un %70’i buradan salınır.
BOS
üretim
ve
dengededir.
Üretim
ve
emilimi
emilimdeki
normal
fizyolojik
değişiklikler
durumlarda
intrinsik
dinamik
kompensatuar
mekanizmalarla düzenlenir. Bu mekanizmalar bloke olursa BOS miktarı patolojik
düzeye ulaşır (5, 12, 13, 15).
Koroid pleksuslar gestasyonun 35. gününde mezenşimin lateral, 3. ve 4.
ventriküllerin tavanından girmesiyle oluşmaya başlar. İntrauterin hayatın 50.
gününde ise BOS yapımı başlar. (6).
Koroid pleksuslar villuslardan oluşmaktadır. Her villus üzerinde silialar olan
tek tabakalı kübik epitel ile örtülüdür. Bu hücreler kollagen, fibroblast ve sinir
liflerinden oluşan bir basal membran üzerine oturmaktadır. Her villusun ortasında
gevşek duvar yapısına sahip endotel hücreleri arasında sıkı bağlantıları olmayan bir
kapiller bulunmaktadır.
Koroid pleksustaki kan-beyin bariyeri, parankimin aksine kapillerdeki endotel
hücreleri arasındaki sıkı bağlantılarla değil, villus üzerindeki hücreler arasındaki sıkı
bağlantılarla oluşmaktadır (15). Bazal membranın üzerindeki epitelin apikal yüzeyi
sıkı olarak dizilmiştir ve apikal sıkı bağlantı kan-BOS bariyerini oluşturur (10, 15).
BOS’un yapım yeri olarak koroid pleksus, epandim tabakası ve parankim
gösterilmektedir. İzole edilmiş koroid pleksus preparatlarının incelenmesi sonucunda
BOS’un % 80’e yakın kısmının yapımından koroid pleksusun sorumlu olduğunu
7
gösterilmiştir. Ancak BOS’un ekstrakoroidal kaynağı ise iyi bilinmemektedir (5, 1011).
BOS’un üretim aşamalarından ilki villusun ortasındaki kapillerden, endotel
hücreleri arasındaki sıkı bağlantılar nedeni ile hidrostatik basınç sonucu damar dışına
sızan ultrafiltratın villusta birikmesidir. Bu birikinti koroid pleksus hücresi tarafından
BOS adı verilen sıvıya dönüştürülerek salgılanmaktadır. Basal membran tarafında
biriken ultrafiltrat Na+-K+ ATP’azın sodyumu aktif olarak hücre içine
pompalamasıyla hücre içine sodyum transportunu sağlamakta, su da sodyum ile
birlikte pasif olarak hücre içine girmektedir. Aynı pompa klora da yardımcı olmakta
veya klor bu pompadan bağımsız olarak hücre içine girmektedir. Hücre içinde BOS
özelliklerini alan sıvı yine Na+-K+ ATP’azın yardımıyla ventrikül içine bakan hücre
duvarı tarafından aktif olarak ventriküler boşluğa salgılanmaktadır. Bu olay bir denge
içerisinde sürdürülmektedir (5, 15). Normal fizyolojik durumlarda BOS üretimi
intrakranial basınçtan etkilenmez, ancak yeteri kadar yüksek intrakranial basınç,
BOS yapımının birinci aşaması olan ultrafiltrat yapımını etkileyeceğinden BOS
yapımında azalma görülebilir (5).
Günde 500 cc üretilen BOS’un ortalama üretim hızı saatte 20 ml’dir.
Yenidoğan döneminde ise bu oran daha düşüktür (10.11.12).
Vücut ısısı ve erum osmolaritesindeki değişiklikler BOS yapımında etkili
değildir.
BOS yapımını etkileyen maddelerden furosemidin karbonik anhidraza
etkiden çok hücre içine giren klorürü durdurması ile BOS yapımında azalmaya neden
olduğu sanılmaktadır (5). Asetazolamid ise, hücre içinde bikarbonat yapımında ve
BOS oluşumunda önemli rolü olan karbonik anhidraz enzim blokajı ile insanlarda ve
deneysel modellerde BOS yapımında azalmaya neden olmaktadır (5).
BOS emilimi daha çok süperior sagital sinüs boyunca yerleşmiş olan araknoid
granülasyonlarda olur. Subaraknoid bölgeden araknoid granülasyonlardaki venöz
gölcüklere gelen BOS buradan serebral venler içerisine emilir. Olfaktor sinir kılıfı
8
BOS emiliminde alternatif yoldur. Özellikle intrakranial basınç artışı sırasında bu
yolların daha fazla çalıştığı sanılmaktadır (5, 10, 15).
BOS emilimi basınca duyarlıdır. İntrakranial basınç arttığında BOS
absorbsiyonu artar, bir temel değerin altında ise absorbsiyon azalır. Yapılan
çalışmalarda bu değer 68 mmH2O’dur. (12, 15).
TANIM
Hidrosefali; BOS üretim ve emilimi arasındaki dengesizlik veya BOS
dolanım yollarında herhangi bir yerde tıkanma sonucu ventriküllerde BOS birikimi
ve bunlara bağlı olarak sıklıkla intrakranial basınç yükselmeleri ile karakterize
patolojik bir durumdur (12).Çocukluk dönemindeki ve çok yaşlı hastalarda devreye
giren kompensatuvar mekanizmalar ile BOS basıncı normal sınırlarda da olabilir
(12).
İNSİDANS
Genel popülasyonda hidrosefali insidansı tam olarak bilinmemektedir. Ancak
infantil dönemde 3-4/1000 canlı doğum, konjenital hastalıklarla ilişkili olarak gelişen
hidrosefali insidansı ise 0,9-1.5/1000 canlı doğum olarak bildirilmektedir (13).
Prematür infantlardaki inraventriküler kanamaya bağlı olarak gelişen hidrosefalinin
insidansı daha yüksektir (12, 13).
FİZYOPATOLOJİ
Hidrosefali oluşumunda üç önemli hipotez mevcuttur. (12);
1. BOS dolanım yollarında obstrüksiyon
2. BOS üretiminde artış
3. Yeterli olmayan venöz drenaj
1-BOS dolanım yollarında obstrüksiyon: BOS dolaşım yollarında iki tip
engel ile karşılaşılmaktadır. Bunlar ventriküler sistemde ve subaraknoid bölgede
tıkanmaya neden olan lezyonlardır. Buna göre hidrosefali kominikan ve
nonkominikan olmak üzere iki ana başlık altında incelenir. Ventriküler sistemde
BOS dolanımını engelleyici lezyonla varlığında oluşan hidrosefali nonkommunikan,
9
ventriküler sistemdeki BOS dolaşım yollarının dışında, subaraknoid bölgede
tıkanmanın olduğu durumlarda oluşan hidrosefaliler ise kommunike tip hidrosefali
olarak adlandırılmaktadır (12, 13).
2- BOS üretiminde artış: BOS dolanım yollarında herhangi bir tıkanıklık
olmadan, BOS’un aşırı üretimi sonucu oluşan hidrosefalinin tipik örneği ve en sık
nedeni koroid pleksus papillomudur. Bu olgularda BOS üretimi genellikle normalin
1,5-2 katı kadar artar. Bu durmda gelişen hidrosefalinin bir başka mekanizması ise,
papillomlardaki kanamaya bağlı olarak gelişen fibrozis ve BOS’un protein
içeriğindeki artış sonucu interventriküler foramenlerde, aquaduktta ve araknoid
granülasyonlarda tıkanmalar nedeni ile BOS dolaşımının bozulmasıdır (12).
Papillomlar 3 ve 4. ventriküldeki koroid pleksuslardan köken almışlarsa direkt
ventriküler sistem içerisindeki tıkanmaya bağlı olarak nonkommunike hidrosefali
nedeni olabilir.
3-Yeterli olmayan venöz drenaj: Sefalik venöz basınç artması sonucunda
araknoid villuslarda da basınç artacağı ve BOS emilimi için önemli olan basınç
gradienti azalacağından hidrosefali oluşabilir. (12, 13). BOS dolanım yollarındaki
tıkanmanın sebebine bakmaksızın hastaların yaşına bağlı olarak geniş bir yelpaze
oluşturan patolojik bulguların başında ventriküler genişleme gelir. Beyaz cevher
atrofisi, periventriküler beyin dokusunda yumuşak ödem, koroid pleksuslarda
fibrozis, epandimal epitelde belirgin incelme, ventriküler divertikül oluşumu, septum
pellisidumda fenestrasyon ve interhemisferik komissurda incelme ve uzama
ventriküler genişlemenin önde gelen patolojik etkileridir (12, 14).
HİSTOPATOLOJİ
Hidrosefali erken dönemde kortikal incelme ve ventriküler dilatasyona neden
olur. Bu değişiklikler daha çok oksipital hornlarda belirgindir. Ventriküler sistem
dilatasyonu yukarıdan aşağıya doğru önce lateral ventriküllerden başlar. Supraoptik
ve suprapineal çıkmazların da etkilenmesiyle 3. ventriküldeki dilatasyon oluşur. İnce
olan aquaduktus Sylvius ise dilatasyona dirençlidir. 4. ventrikül serebellum içine
doğru genişlemektedir. Ventriküler epandimal hücreler düzleşmekte ve siliasız bir
hal almaktadır. Ventral olarak epandimal membran yırtılmasıyla subepandimal ödem
10
ve skleroz gelişir. Beyaz cevherde harabiyet kortekslerde kan akımının fazlalığı
sebebiyle gri cevher ile karşılaştırıldığında daha büyük olur (12).
Şant takılması ile gliozis nöral elemanların yerini alır (12). Koroid
pleksuslarda fibrozis artar, septum pellisidumda seperasyon ve ventriküler divertikül
formasyonu oluşur. Rubin ve arkadaşları hidrosefalide, aksonlarda primer olarak
harabiyet ve sekonder olarak da miyelin kaybı ve kronik astrogliozis olduğunu rapor
etmişlerdir (12).
ETYOLOJİ
Hidrosefali edinsel ve konjenital olabilir. Edinsel hidrosefalinin nedenleri
çoğunlukla
bilinirken,
konjenital
hidrosefalide
etyolojiler
ise
sıklıkla
bilinmemektedir.
Konjenital hidrosefalide; maternal malnutrisyon, toksinler, İU TORCH grubu
enfekiyonların rol oynadığı gösterilmiştir. Edinsel hidrosefalinin etyolojisinde vuruk,
intrakranial kanama, menenjit ve tümör gibi patolojiler bulunmaktadır (12).
Ayrıca hidrosefali BOS dolanım yolundaki engelin yerine göre kominikan ve
nonkominikan hidrosefali olarak ta sınıflandırılmaktadır. Buna göre;
1)Kominikan Hidrosefali; Genellikle BOS emiliminin enfeksiyon ve başka
sebeplere sekonder bozulması sonucu oluşur.Ventriküler sistem dışında BOS akım
problemi söz konusudur.
2)Nonkominikan Hidrosefali; Ventriküllerden subaraknoid mesafeye geçiş
yolu üzerindeki bir tıkanma sonucu oluşan hidrosefalilerdir. Ventriküllerde
dilatasyon ve basınç artışı görülür.Fetal dönemde görülen hidrosefalilerin büyük bir
kısmı nonkominikan tiptedir.
Pediatrik dönemde görülen hidrosefaliler etyolojik nedenlerine göre
konjenital ve edinsel iki alt grupta toplanabilir. Bu alt gruplara göre yapılan sınıflama
aşağıda tablo 1 de verilmiştir. (5).
11
Tablo 1: Hidrosefali nedenleri
Konjenital nedenler
Aquadukt Sylvius stenozu
Dandy-Walker malformasyonu
Tip II Chiari malformasyonu
Bickers Adams sendromu
Foramen Monro agenezisi
Araknoid granülasyon agenezisi
Ensefalosel
İdiopatik
Edinsel nedenler
Neoplazmlar
Araknoid kist
Germinal matriks kanaması
Galen veni anevrizması
Enfeksiyon
Akondroplazi
Kraniosinostoz
İdiopatik
1)Akuadukt stenozu: 3 ve 4. ventrikül arasında ilişkiyi aquaduktus Sylvius
sağlar. Konjenital hidrosefaliler içerisinde %2 sıklıkla görülen tek başına aquaduktus
atrezisi veya stenozu X’e bağlı iletilmektedir. Bu olgularda doğumda hidrosefali ve
sefalopelvik
orantısızlık
mevcuttur.
IU
dönemde
yapılan
ultrasonografik
incelemelerde genellikle tanı konulur. Prenatal tanı konulan olgularda prognozun
kötüdür ve mortalite %40 civarındadır. (33). Konjenital aquaduktal stenoza bağlı
gelişen hidrosefaliler BOS’u azaltıcı medikal tedaviye yanıt vermezler ve ciddi bir
seyir gösterirler.%70-%80 oranında spina bifida ve diğer konjenital anomalilerle
birliktelik gösterir. Aquadukt stenozunun gelişimiyle ilgili bazı teoriler ortaya
sürülmüşse de etyolojisi hakkında kesin bir görüş birliği bulunmamaktadır (5).
Pediatrik dönemdeki hidrosefali olgularının yaklaşık %10’undan konjenital
veya edinsel aquadukt stenozu sorumludur (5). Bununla birlikte intrauterin
enfeksiyonlar ve intraventriküler kanama nedenleriyle oluşan subepandimal gliozis 3.
ve 4. ventrikül arasındaki BOS akımında tıkanmaya neden olarak ayrıca
periaquaduktal yerleşimli astrositomlarda yapmış oldukları kitle etkisiyle aquadukt
stenozuna neden olabilmektedir. Ayrıca nörofibromatozis olgularında da aquadukt
stenozu gelişebildiği gösterilmiştir (34).
2- Chiari malformasyonu: Servikomedüller bileşkenin kaudale yer
değiştirmesi ile serebellar tonsiller,
pons, 4. ventrikül ve medullanın foramen
magnumda veya altında olduğu bir patolojidir. Myelomeningoselli hastaların büyük
bir çoğunluğunda Chiari tip II malformasyonu görülebilir ve bunların % 80-90’ında
semptomatik hidrosefali gelişebilir (5).
12
3- Dandy Walker malformasyonu: Foramen Magendie ve Luschkaların
atrezisi, 4. ventrikül ile birleşen büyük bir posterior fossa kisti ve serebellar vermis
agenezisinin birlikte olduğu bir malformasyondur. Dandy-Walker malformasyonlu
infantların yaklaşık %80-90’ında kommunike veya nonkommunike tipte hidrosefali
bulunmaktadır (5, 34). Dandy-Walker varyant terimi ise serebeller vermis hipogenezi
ve 4.ventrikülün kistik genişlemesinin olduğu ancak posterior fossanın genişlemediği
durumlarda kullanılmaktadır.
4- Konjenital enfeksiyonlar: CMV, rubella, kabakulak, parainfluenza,
toksoplasmozis ve su çiçeği plasentayı geçerek intrauterin enfeksiyon ve ardından
hidrosefaliye neden olabilen belli başlı konjenital enfeksiyonlardır (5).CMV,
araknoidit sonrası BOS akımında direnç oluşturarak, bir protozoon olan
toksoplazmozis ise beyin parankiminde subaraknoid bölgede ve aquaduktta
enfeksiyon oluşturarak hidrosefaliye yol açabilirler (5).
5- Edinsel enfeksiyonlar: Üç aydan küçük infantlarda E.coli, S.aureus ve
gram negatif basiller gibi bakteriel enfeksiyonlara sık rastlanırken, üç yaşına kadar
olan çocuklarda H.influenzae, Pneumococcus, Meningococcus ve S.aureus görülür.
Üç yaşından büyük çocuklarda ise Meningococcus, Pneumococcus, Streptococcus,
Staphilococcus, Gonococcus ve H.influenzae’nın enfeksiyon etkeni olarak izole
edildiği
bildirilmektedir
(5).
Nörosistiserkozis
gibi
parazitik
enfeksiyonlar
ventriküler sistemin akut tıkanması ile hızla gelişen hidrosefaliye yol açabilirler (5).
6- İntrakranial kitle: İntrakranial kitle lezyonlarına bağlı olarak hidrosefali
gelişimi yaklaşık olarak %20 dolaylarındadır. İntrakranial kitleler konjenital ya da
edinsel olabilir. Bu kitleler tümör, kist veya apse şeklinde olabilirler. Konjenital
intrakranial
kitlelerin
erken
embriogenez
döneminde
anormal
hücre
proliferasyonunun bir ajan tarafından uyarılmasıyla oluştukları düşünülmektedir.
Posterior fossa tümörlerine bu popülasyon içerisinde daha sık rastlanır (5). Beyin
sapı gliomlu olguların %25’inde de hidrosefali görülmüştür. 3. ventrikül
bölgesindeki hidrosefaliye neden olan tümöral oluşumlar kraniofarengioma,
hipotalamik gliomlar ve optik gliomlardır. Koroid pleksus papillomları obstrüktif
13
proçesten çok aşırı BOS üretimi sebebiyle hidrosefaliye yol açarlar. Tümörün yol
açtığı
fibrozis
araknoid
granülasyonlarda,
aquaduktta
ve
interventriküler
foramenlerde tıkanmalara neden olarak nonkommunike tip hidrosefaliye de neden
olabilmektedir(35).
7- Germinal matriks kanamaları: Germinal matriks kanamaları çocukluk
çağı hidrosefalilerin sebepleri arasında %10-15 oranında görülür (5, 16). Bu grup
germinal matriks kanaması, travmatik kanama, vasküler malformasyonlara bağlı
kanamalar ve diğer nedenleri içerir. Doğum ağırlığı 1500 gr’ın altında olan düşük
doğum ağırlıklı infantlar ve gestasyonel yaşı 32 haftanın altında olan prematürlerin
1/3’de germinal matriks kanaması geliştiği bildirilmektedir (5, 17).
8 - İdiopatik hidrosefali: Çocukluk döneminde gelişen hidrosefalilerin
yaklaşık %10-15’inde herhangi bir neden bulunamamaktadır (5).
KLİNİK SEMPTOM VE BULGULAR
Hidrosefalide semptom ve klinik bulguların ortaya çıkması olguların yaş
grubuna göre değişmekle birlikte hidrosefali sebebinin oluşturduğu intrakranial
basınç artışına bağlıdır.(5). Semptom ve klinik bulgulardaki bu değişiklikler özellikle
hidrosefali oluşumu sırasındaki kranial süturların açık olup olmaması ile ilgilidir.
Kranial sütürlerin açık olduğu 2 yaşın altındaki çocuklarda baş çevresinde büyüme
en önemli bulgulardan biridir. Yenidoğan döneminde baş çevresi ortalama 33-36
cm’dir ve düzenli takiplerdeki haftalık 1cm’lik artış normal olarak kabul edilir.
Ancak haftalık 2cm ve üzerindeki artışlar ve ek diğer bulgularla birlikte hidrosefaliyi
düşündürebilir (5).
Ayrıca fontaneller açıksa fontanel kabarıklığı, kranial sütürlerde açılmalar,
skalp venlerinde dolgunluk, apne, bradikardi, oftalmopleji, kusma, iştahsızlık, kilo
alamama, uykuya eğilim, ilerlemiş olgularda ise frontal çıkıntı ve setting sun
fenomeni (batan güneş belirtisi) klinik olarak görülebilir (12).
14
Kranial sütürler ve fontanelleri kapanmış çocuklarda ise, hidrosefalinin neden
olduğu kafa içi basınç artış sendromuna (KİBAS) bağlı olaraken sık karşılaşılacak
semptom ve klinik bulgular arasında baş ağrısı, papil ödemi, kusma, şuur
değişiklikleri, kişilik değişiklikleri, hafıza kaybı, okul başarısında düşme, irritabilite
ve mental bozukluk gelmektedir.
TANI YÖNTEMLERİ
Hasta hikayesi, fizik ve nörolojik muayene hidrosefali tanısında en önemli
unsurlardır.
Radyolojik
tetkikler
ile
hidrosefali
tanısını
desteklemektedir.
Ultrasonografi, bilgisayarlı tomografi (BT) ve manyetik rezonans görüntüleme
(MRG) kullanılabilen radyolojik yöntemlerdir(5).
Ultrasonografi; Hidrosefalisi kanıtlanmış veya şüpheli olan prenatal
infantların takibinde kullanılabilir. Radyasyon içermemesi, taşınabilir olması ve
hastaya sedasyon gerektirmemesi gibi avantajları olmakla birlikte, yalnızca fontaneli
açık
olan
infantlarda
kullanılabilmesi
ve
yalnızca
supratentorial
yapıları
gösterebilmesi sebebiyle sınırlı kullanım alanına sahiptir (5).
BT; Hidrosefali tanısında kesin ve hızlı sonuç verebilmesinin yanısıra,
hidrosefalinin uzun süreli takibinde kullanılmaktadır. Ayrıca BT ile (2, 5);
-Ventriküler sisteme intraventriküler veya ekstraventriküler bası oluşturan yer
kaplayıcı lezyonların tanısı konulabilmekte,
-Temporal hornlardaki genişleme görülebilmekte (2 mm<)
-Transepandimal BOS geçişi sebebiyle oluşabilen periventriküler hipodansite
seçilebilmekte
-Kortikal
sulkuslarda
kompresyon,
subaraknod
bölgede
obliterasyon
izlenmekte
-Frontal hornlar arasındaki mesafe ve aynı düzlemdeki bifrontal çapın oranı
(Evans indeksi) %30’dan büyük olarak tespit edilebilmektedir. Evans indeksinin
büyüklüğüne göre ventriküler genişlemenin derecesi hesaplanabilir.
MRG; Radyasyon içermemesi, multiplanar görüntü verebilmesi, kesin ve
doğru tanıya varılabilmesi sebebiyle günümüzde diagnostik değeri oldukça yüksek
olan bir görüntüleme yöntemidir. MRG intrakranial patolojileri ve transepandimal
15
BOS absorbsiyonunu net olarak gösterebilmektedir. MRG ile BOS akım dinamikleri
ve intrakranial lezyonun kesin lokalizasyonunu belirleyebiliriz(5).
Ventrikülografi
ve
sisternografi
ise;
BOS
akım
alanları
arasında
komunikasyon olup olmadığını ortaya koyabilen diğer radyolojik yöntemlerdir (5).
Lomber ponksiyon; hidrosefalide basıncın normal veya yüksek olup
olmadığının değerlendirilmesini sağlayabilir. Nonkomunike hidrosefalide lomber
ponksiyon yapılması herniasyon riski sebebiyle kontrendikedir. (5).
Diğer tanısal tetkiklerden kraniografi; küçük çocuklarda sütür ayrılmalarını,
daha büyük çocuklarda ise dövülmüş bakır görünümü ve sella turcica erozyonunu
gösterebilmektedir (5).
TEDAVİ
Cerrahiye engel bir durum söz konusu olmadıkça hidrosefalide tedavi
cerrahidir.
Tıbbi Tedavi: Hızlı ilerleyen ve artmış intrakranial basınca bağlı klinik
bulguları olan hidrosefalik olgularda tıbbıi tedavi şant cerrahisinin yerine
düşünülemez. Ancak yavaş gelişen hidrosefali olgularında ve çok küçük infantlarda
şant cerrahisi belirgin bir risk taşıyorsa cerrahi müdahale yapılana kadar kısa bir
zaman için tıbbi tedavi denenebilir (18, 19).BOS üretimi 0.35 ml/dk olup emilim de
yaklaşık olarak üretim oranlarındadır (20). BOS üretiminden sorumlu mekanizmalar
ise koroidal kapiller hücre duvarındaki hidrostatik basınç, koroidal epiteldeki Na+/K+
ATPaz enzimi ile karbonik anhidraz enzimi kontrolündedir (19).BOS üretimini
azaltmak amaçlı yapılan medikal tedaviler; BOS üretimini enzimatik düzeyde
azaltmak veya beyin interstisyel sıvısını azaltmaya yönelik osmotik ajanlar ve
araknoid villuslarda emilim defekti varsa fibrinolitik ajanların kullanılması şeklinde
olmuştur (19). Bu amaçlarla karbonik anhidraz enzim inhibitörü olarak asetazolamid
ve furosemid, Na+/K+ATPaz enzim inhibitörü olarak bir kardiak glikozid olan
digoksin ve ouabain, interstisiel sıvı miktarını azaltmak için isosorbid ve osmotik
diüretik olan mannitol, üre ve gliserol, fibrinolitik ajan olarak da heparin ve ürokinaz
deneysel modellerde ve bazı hidrosefali hastalarında kullanılmıştır. Diüretikler
16
günümüzde halen kullanılan ilaçlardır. Özellikle infantil dönemde hemorajik BOS
içeren hidrosefali olgularında diüretikler uygun koşullar sağlanıp, şant uygulaması
yapılıncaya kadar kullanılmaktadır (19).
Koroid pleksus apikal yüzeyindeki Cl- transportunu engelleyen Furosemid
BOS üretimini yaklaşık %50 oranında azaltabilir (5). Furosemid 1mg/kg/gün
şeklinde kullanılmaktadır. Karbonik anhidraz enzim inhibitörü olan asetazolamid de
BOS üretimini aynı oranda azaltabilir. Asetazolamidin bu etkisinin yanı sıra bir diğer
etkisi de koroidal arterlerde vazokonstrüksiyon oluşturmasıdır. Asetazolamid 25
mg/kg/gün şeklinde başlanır ve 100 mg/kg/gün dozuna kadar çıkılabilir.
Asetazolamid’in böbrekte bikarbonat kaybı ile metabolik asidoza ve infantil
dönemde ise myelinizasyonda toksik etkiye yol açan yan etkileri mevcuttur. (18, 19).
Furosemid de böbrekte hidrojen atılımı etkisiyle metabolik alkoloza ve renal tübüler
kalsiyum atılımını arttırarak da nefrokalsinozise yol açabilir (5, 18).
Cerrahi tedavi: Hidrosefalinin cerrahi tedavisinde hidrosefalinin nedeni en
önemli rolü oynar. Cerrahi yöntemler (4);
-Tıkayıcı lezyonun eksizyonu
-BOS’un bir başka vucut boşluğuna drenajını sağlayan şant sistemleri
-Üçüncü ventrikülostomi
Tıkayıcı lezyonun eksizyonu: BOS dolanım yollarında tıkanıklık oluşturarak
hidrosefaliye yol açan konjenital veya edinsel çeşitli lezyonlar bulunabilir. Özellikle
çocukluk döneminde tıkayıcı tipte hidrosefalinin nedeni büyük çoğunlukla
tümörlerdir (4).
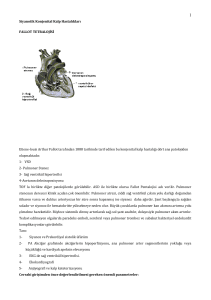
Şant sistemleri: Hidrosefali tedavisinde günümüzdeki en popüler yöntem
BOS’un periton, plevral boşluk ve atriuma drenajını sağlayan şant sistemlerinin
kullanılmasıdır.
Bu
amaçla
VPŞ,
ventriküloplevral,
ventriküloatrial
ve
lumboperitoneal şant sistemleri geliştirilmiştir (4, 21). Şant sistemleri BOS’un
ventrikülden bir rezervuara drenajını sağlayan ventriküler kateter, basınç kontrolünü
17
sağlayan bir valv sistemi ve BOS’un absorbe olacağı vücut boşluğuna geçişini
sağlayan distal kateter olmak üzere 3 bölümden meydana gelmiştir (21).
Üçüncü ventrikülostomi: 3. ventrikül tabanını açarak BOS’un 3.
ventrikülden interpedinküler sisterne geçişini sağlayan 3. ventrikülostomi hidrosefali
tedavisinde önemli bir seçenek olmuş olup ilk kez subfrontal yaklaşımla 1922 yılında
Dandy ve arkadaşları tarafından uygulanmıştır. (2). Günümüzde de endoskopik
yöntemlerin gelişmesi ile 3. ventrikülostomi özellikle aquadukt stenozu başta olmak
üzere tıkayıcı nedenli hidrosefali olgularında kullanılmaktadır (2).
VPŞ KOMPLİKASYONLARI
Günümüzde hidrosefali tedavisinde halen yaygın olarak kullanılan ventriküler
şantlar beraberinde yüksek oranda komplikasyonlar da getirmektedir. Şant
komplikasyonları medikal ve ekonomik anlamda ciddi bir sorundur. Bu sorunun
giderilmesi için çeşitli çalışmalar yapılmasına karşın, şant komplikasyon oranları
yeterince azaltılabilmiş değildir. Bu komplikasyonlar temelde cerrahi öncesi, cerrahi
sırasında ve cerrahi sonrasındaki teknik detaylardan köken almaktadır. Günümüz
şant cerrahisinde şant tıkanmaları ve enfeksiyonları ilk iki sırayı alan
komplikasyonlar olup, bunları daha azalan sıklıkla aşırı drenaj sendromu, slit
ventrikül
sendromu,
subdural
sıvı
kolleksiyonları,
edinsel
Chiari
Tip
I
malformasyonu, epileptik nöbetler, pnömosefalus, intraserebral ve intraventriküler
kanamalar,
batında
assit,
organ
perforasyonları,
şant
migrasyonları,
şant
malpozisyonları, ventriküloatrial şantlar için ise endokardit, şant nefriti ve
glomerülonefrit takip etmektedir (5).
ŞANT ENFEKSİYONLARI
Şant enfeksiyonları hemen her zaman mekanik olarak şant disfonksiyonuna
neden olurlar. Kauffman ve McLone (20) enfeksiyon oranını hidrosefalili olgu başına
%8-40, şant uygulaması başına %4.5-14 olarak rapor etmişlerdir. Şant enfeksiyon
riskini artıran faktörler şunlardır;
1)Yaş; Düşük doğum ağırlıklı infantlarda immunoloji, nütrisyonel ve
özellikle bakteriyel faktörlerle ilgili olarak infeksiyon riski artmiştır.
18
2)Hidrosefalinin etyolojisi; Literatürde açık nöral tüp defekti gibi
patolojilerde enfeksiyon riskinin belirgin derecede arttığını destekler yayınlar
mevcuttur.
3)Cildin durumu
4)Şant revizyonu
5)Şant tipi; Ventriküloatrial şantın ventriküloperitoneal şantlara kıyasla daha
fazla enfeksiyon riski taşıdığı ileri sürülmektedir.
6)Sistemik infeksiyonun eşlik etmesi; Şant enfeksiyon riskini belirgin artırır.
7)Uzamış cerahi prosedür
8)Deneyim ve cerrahi teknik
9)Deri bütünlüğü bozulması,florası veya infeksiyon varlığı
10)Operasyon odasında fazla kişi bulunması, operasyon sırası ve süresi
Tablo2: Şant enfeksiyonu risk faktörleri
Operasyon yaşı
Cildin durumu
Hidrosefalinin etyolojisi
Proflaktik antibiyotik kulanılmaması
Şant revizyon sayısı fazlalığı
Ameliyat odasında ilk olgu olmaması
Şant tipi
Eşlik eden sistemik enfeksiyon olması
Postoperatif yaranın durumu
Operasyon süresi
Operasyon odasındaki kişi sayısı
Şant enfeksiyonları internal ve eksternal olarak sınıflandırılabilir. Şant
kataterinin rezervuarı, valfi veya lümeninin infeksiyonu internal infeksiyon olarak
tanımlanır ve ventrikülite yol açması sebebiyle morbidite ve mortalitesi yüksektir.
Eksternal infeksiyon tanımı şant lümeni dışında lümenin geçtiği subkutanöz trase
boyunca gelişen infeksiyonlar için kullanılmaktadır.Yara yerinden başlayan selülite
bağlı olarak sık görülür.
Şant
enfeksiyonları
erken
ve
geç
şant
enfeksiyonları
olarak
ta
sınıflandırılabilir. Geç şant enfeksiyonu işlemden 6 ay sonra ortaya çıkan infeksiyon
için kullanılmakla birlikte birçok uzman sürenin 2 ay olarak belirlenmesini tercih
etmektedirler(45,49) Şant enfeksiyonları şant uygulamasını takip eden ilk iki ayda
sık olarak gözlenirken, bir yıldan sonra görülmeleri nadirdir (5). Şant
enfeksiyonlarının %69’u şant takılmasını takip eden ilk ayda, %86’sı ise ilk 6 ayda
görülür (5, 22). Tipik olarak izole edilen mikroorganizmalar cilt florasında bulunan
19
mikroorganizmalardır. Bu nedenle enfeksiyonların önlenmesinde kritik olan periyod
cerrahi sırasındaki implantasyondur ( 23, 24).
A- Şant Enfeksiyonlarında Etyoloji
Yenidoğan döneminde özellikle gram negatif mikroorganizmalar enfeksiyon
etkenidir. Bunun nedeni bu dönemde immün sistemin iyi gelişmemiş olması ve ciltte
patojen
mikroorganizmaların
kolonizasyonudur
(24).
Gram
negatif
mikroorganizmalara bağlı şant enfeksiyonlarında mortalite de diğerlerine göre daha
yüksektir (23, 24). Pediatrik popülasyonda şant enfeksiyonlarında genel olarak Gram
pozitif mikroorganizmalar görülür (5, 22-24). S.epidermidis pozitif olan kültürler
içerisinde % 40 oranında görülürken, ikinci sırayı % 20 ile S.aureus alır. Kültürlerde
daha
azalan
sıklıkta
Pseudomonas,
Escherichia,
Klebsciella,
H.influenza,
Propionobacter, S.faecalis, Corinebacteria ve Micrococcuslar görülmektedir. %20
oranında da multiple bakteri izole edilebilir (5, 24, 25). Şant infeksiyonlarında
karşımıza çıkan anaerob bakteriler, kateterin yerleştirilmesi sürecinde cerrahi yara
yerinde kolonize olurlar. Erken şant enfeksiyonlarında distal ucun barsakları
erozyona uğratması ile gram negatif etkenlerin ön plana çıktığı görülmektedir.
B- Şant Enfeksiyonlarında Patogenez ve Patoloji
Şant katetrinin infekte olmasından başlıca şu üç temel mekanizma
sorumludur;
1)Kolonizasyon; Etkenin kateterin yerleştirilmesi sürecinde cerrahi yara
yerinde kolonize olması primer sorumlu faktördür. infeksiyon etkenleri sıklıkla deri
florası elemanları özellikle S.epidermiditis’dir.
2)Hematojen yolla mikroorganizmanın şant aparatına yerleşmesi; Özellikle
ventriküloatrial şant şantta ve sıklıkla da toplumdan kazanılmış H.influenza ve
S.pneuomoniae infeksiyonlarında bu mekanizma ön plandadır.
3)Şantın kontamine distal ucundan(barsak ucu)etkenin retrograd olarak
ilerlemesi ile şant infeksiyonu ortaya çıkabilir. Tipik olarak polimikrobiyaldir ve
gram negatif mikroorganizmalar ön plandadır(45.46.48)
20
C- Şant Enfeksiyonlarında Klinik Belirtiler
Pediatrik şant enfeksiyonları ile ilgili klinik bulgu ve belirtiler çok
değişkenlik gösterir. Böyle bir değişkenliğin ortaya çıkmasında hastaların yaşı,
enfeksiyonun
lokalizasyonu
ve
etken
mikroorganizmanın
türü
önemli
faktörlerdendir. (39). Genel olarak şant enfeksiyonlarında ateş en sık görülen belirti
olmakla birlikte huzursuzluk, halsizlik, bulantı, kusma, başağrısı, iştahsızlık,
karınağrısı, konvülziyon, meningismus, letarji, koma, fontanel kabarıklığı, setting
sun fenomeni(batan güneş manzarası) en sık karşılaşılan klinik semptom ve bulguları
oluştumaktadır. (5, 25, 39).
Şantlı hastalarda ateş olursa aksi ispatlanana kadar, özellikle erken
postoperatif dönemde şant enfeksiyonu düşünülmelidir (5, 25, 39). Şant enfeksiyonu
bulguları fizik muayene ile araştırılmalıdır. Şuur düzeyinde gerileme ile gelen şantlı
hastalarda şant disfonksiyonunun yanı sıra şant enfeksiyonu da düşünülmelidir.
Meningeal irritasyon bulgularının olmaması şant enfeksiyonunu ekarte ettirmezken,
meningeal irritasyon bulguları ortaya çıktığında enfeksiyon ciddi boyutlara
ulaşmıştır. Bununla birlikte enfeksiyonda tanısal yöntemlerde yalancı negatif
sonuçlar da alınabilir (39).
Tablo 3: Şant enfeksiyonlarında klinik semptom ve bulgular
Semptomlar
Huzursuzluk, Halsizlik
Baş ağrısı
İştahsızlık
Karın ağrısı
Bulantı, Kusma
Bulgular
Ateş
Konvülziyon
Meningismus
Letarji
Koma
Fontanel kabarıklığı
Settingsun fenomeni
D- Şant Enfeksiyonlarında Laboratuvar ve Tanı
Şant enfeksiyonlarının tanısında ilk adım olarak özellikle çocuklarda viral
hastalıklar, tonsillit, farenjit, üriner siistem enfeksiyonları, pnomoni, otitis media ve
gastrointestinal infeksiyonlar gibi olası infeksiyonlar değerlendirilmelidir. İnfeksiyon
yeri kateterin distali ile sınırlı değilse rezervuardan alınan BOS kültürü %95
olasılıkla pozitif sonuç vermektedir. Lomber ponksiyon ile elde edilen BOS kültürü
ancak %25 olasılıkla pozitif sonuç vermekte olup herniasyon riski taşır(46,47) BOS
21
örneğinde gram boyama mutlaka yapılmalıdır. Kontaminasyonda spesifite ve
duyarlılık azalır. S.aureus’lu olgularının %82’si, gram negatif mikroorganizmaların
%91’i gram boyamada görülebilmektedir. Mikroorganizma görülmezse kültür
sonucu beklenilmelidir (33). Şant enfeksiyonları için BOS’da milimetreküpte
100’den fazla beyaz küre görülmesi anlamlıdır (1). Bakteriyel enfeksiyonlarda
BOS’da glukoz düşerken, protein artışı görülür, ancak diagnostik değildir. BOS
kültürünün sensitivitesi ve diagnostik değeri daha yüksektir (5, 25,31).
Kateter uçlarının kültürü yararlı olabilir. Bunun için kateter kontamine
edilmeden çıkartılıp kültür için gönderilmelidir. Kanda beyaz küre sayısının yüksek
olması enfeksiyonu düşündürebilir (5)
E- Şant Enfeksiyonlarında Tedavi
Şant enfeksiyonlarının tedavisi oldukça güç, ekonomik maliyeti yüksek ve
yöntemleri tartışmalıdır. Tedavide şant parçalarının çıkartılıp eksternal ventriküler
drenaj uygulanması, uygun antibiyotik tedavisi sonrası yeniden şant takılması
seçeneklerden birini oluşturur. Farklı çalışmalarda şant parçaları çıkartıldıktan sonra
aralıklı ponksiyonlarla BOS drenajı sağlanması ve uygun antibiyotik tedavisi sonrası
yeniden şant takılması veya yalnızca antibiyotik tedavisi verilmesi gibi şant
enfeksiyonu tedavi seçenekleri de rapor edilmektedir. Şant elemanlarının
çıkarılmadığı olgularda ise kateterler çevresinde enfeksiyon ajanının oluşturabileceği
biyotabakanın antibiyotiklere karşı fiziksel direnç meydana getirebilmesi sebebiyle
şant enfeksiyonunun tedavisinde başarı oranının düşebileceği bildirilmektedir (2, 31).
Yapılan çalışmalar sonucu en yüksek başarı ve en düşük mortalite oranına
sahip tedavi şekli şu aşamaları içermektedir;
1)İnfekte şantın uzaklaştırılması
2)Eksternal ventriküler drenajın sağlanması
3)Etkili sistemik antibiotik verlmesi
4)Eksternal ventriküler drenaj ile birlikte etkili intraventriküler antibiotik
verilmesi
5)Ventriküler infeksiyon klinik olarak iyileştikten 3 ile 5 gün sonra eksternal
ventriküler drenajın çıkarılıp intraventriküler antibiotiğin kesilmesi
22
6)Yeni bir şantın tercihen uzaklaştırılan infekte şanttan farklı bir yere
yerleştirilmesi
7)İnfekte şant uzaklaştırıldıktan sonra sonra sistemik antibiotik tedavisinin 37 gün sürdürülmesi
Şant rezervuarından elde edilen BOS’un gram boyaması ile incelenmesi,
ampirik antibiotik tedavisi için önemlidir. Kültür sonucu geldiğinde tedavi tekrar
değerlendirilmelidir.
23
GEREÇ VE YÖNTEM
Bu çalışmada Aralık 2001 –Ağustos 2008 tarihleri arasında hidrosefali
sebebiyle
ventriküloperitoneal
şant
takılmış
ve
operasyon
sonrası
şant
enfeksiyonu gelişmiş çocuklardan, Sağlık Bakanlığı İstanbul Şişli Eğitim ve
Araştırma Hastanesi Çocuk Enfeksiyon Kliniğinde takip ve tedavileri yapılan 40
hastanın geriye dönük olarak değerlendirilmesi yapılmıştır.
Hidrosefali tanısı ebeveynlerden alınan anamnez, fizik muayene, nörolojik
muayene bulguları ile ultrasonografi (USG) ve bilgisayarlı tomografi (BT) gibi
radyolojik yöntemlerin birlikteliğiyle konulmuştur. (43). Olgular, hidrosefali
etiyolojilerine göre; konjenital malformasyon, enfeksiyonlar, hemoraji, araknoid
kist ve sınıflandırılamayanlar alt başlıklarında ele alınmıştır(1,3, 43).
Şant uygulan olgularda şant enfeksiyon tanısı; öykü, fizik muayene
bulguları(ateş, başağrısı, bulantı, kusma, nöbet, mental durum değişikleri, yara
yerinde akıntı, ense sertliği, Kernig ve Brudzinsky bulguları) ve intraventriküler
elde olunan BOS bulguları(basınç, görünüm, hücre sayısı ve tipi, Pandy
reaksiyonu, protein ve glukoz seviyeleri), BOS’un Gram boyası, BOS kültür ile
konulmuştur(1,2,5).
Beyin omurilik sıvısı kültürü sonucu üreyen mikroorganizmaların
antibiyotik duyarlılıklarına bakılmıştır. Şant enfeksiyonu gelişme süresine göre
olgular operasyondan sonra 0-3 ay, 3-6 ay ve 6 ay sonrası dönemler olarak üç
farklı gruba ayrılmıştır (1,3). Olguların hastanede yatış süreleri 30 günden az ve
30 günden fazla olmak üzere iki alt başlıkta incelenmiş ve hastanede kalış süresi
ile şant enfeksiyonları klinik ve laboratuvar bulguları arasında ilişki ele
alınmıştır.
24
İstatiksel Değerlendirme
Bu çalışmada istatiksel analizler NCSS 2007 paket programı ile
yapılmıştır. Verilerin değerlendirilmesinde tanımlayıcı istatiksel metodların
(sıklık
dağılımları,
ortalama,
standart
sapma)yanı
sıra
ikili
grupların
karşılaştırılmasında Mann-Whitney-U testi, nitel verilerin karşılaştırılmasında Ki
Kare
testi
kullanılmıştır.
Sonuçlar
değerlendirilmiştir.
25
anlamlılık
p<0,05
düzeyinde
BULGULAR
Sağlık Bakanlığı İstanbul Şişli Etfal Eğitim ve Araştırma Hastanesi Çocuk
Enfeksiyon Kliniğine Aralık 2001- Ağustos 2008 tarihleri arasında yaşları 1-84 ay
arasında değişen ve ventriküloperitoneal şant enfeksiyonu tanısı ile yatırılan 40 hasta
çalışmaya alınmıştır.
Olgularımız cinsiyetlerine ve yaş gruplarına göre değerlendirilmiştir.
İncelemeye aldığımız 40 olgunun 22’si (%55) kız, 18’i (%45) erkekti. (Tablo 4).
Tüm olgularımızın yaş gruplarına göre dağılımları ise kızlarda 12,72 ±22,27,
erkeklerde 12,36±16,70’idi.(Tablo 4).
Tablo 4. Ventriküloperitoneal şant enfeksiyonlu olguların yaş ve
cinsiyetlerine göre dağılımları
Yaş (Tüm Grup)
Yaş (Kız)
Yaş (Erkek)
Cinsiyet
12,53±19,15
12,72±22,27
12,36±16,70
Sayı
%
18
45
22
55
Erkek
Kız
Hidrosefalinin oluşumuna göre olgular incelendiğinde 40 olgunun 24’ünde
(%60) konjenital malformasyonlar, beşinde (%12,5) enfeksiyonlar, dördünde
hemoraji (%10) ve birinde araknoid kist (%2,5) görülmüştür(Tablo 5). Geri kalan altı
olgu ise (%15) sınıflandırılamayanlar (idiyopatik) grubuna dahil edilmiştir.
Konjenital malformasyon grubundaki olguların %91,6’sında meningomyelosel,
%8,3’ünde Dandy-Walker malformasyonu saptanmıştır. Enfeksiyon sebebiyle
hidrosefali gelişen beş hastanın üçünde tüberküloz menenjit sonrasında, iki hastada
pnömokok menenjit sonrasında hidrosefali gelişmiştir.
26
Tablo 5. Hidrosefali olgularının etiyolojilerine göre dağılımları
Hidrosefali
etyolojisi
Antenatal
dönemde
Sayı
5
24
4
1
6
Enfeksiyonlar
Konjenital malformasyon
Hemoroji
Araknoid kistler
Sınıflandırılamayanlar
hidrosefali
saptanma
%
12,5
60
10
2,5
15
zamanına
baktığımızda
minimum bir ay ile maksimum sekiz ay dolayında (ortalama 6,06 ay) olmak üzere,
son trimestirde saptandığı görülmüştür.
Şant enfeksiyonu gelişen olgularımızın, şant operasyonundan ne kadar zaman
sonra şant enfeksiyonu geliştiği incelendiğinde; hastalarda 10-300 günler arasında
enfeksiyon geliştiği saptanmıştır. Ortalama 77,53 gün yani postoperatif üç ay içinde
saptandığı gözlenmiştir. İlk 90 günde 40 hasta içinde 28 hastada ( %70 ), 90-180
gün arası 40 hasta içinde yedi hastada (%17,5), 180 gün sonrası 40 hastanın beşinde (
%12,5 ) şant enfeksiyonu geliştiği görülmüştür.
Şant enfeksiyonu gelişen hastalarda prematür doğum öyküsü araştırıldığında,
40 hastanın dördünde (%10) prematürite olduğu saptanmıştır(Tablo 6).
Tablo 6. Ventriküloperitoneal şant enfeksiyonlu hastalarda prematür
doğum öyküsü
Prematür
öykü
Yok
Var
Sayı
%
36
4
90
10
Şant enfeksiyonu görülen hastaların şant enfeksiyon tipleri (ŞET) Proksimal,
distal ve yavaş seyirli klinik olarak üçe ayrı grupta incelenmiştir. ŞET Proksimal için
40 hastanın 31’inde menenjit, 40 hastanın dokuzunda
(%22,5 ) ventrikülit
saptanmıştır. Hastaların hiçbirinde subdural ampiyem gelişmemiştir. ŞET Distal için
40 hastadan 13 hastada (%32,5 ) bakteriyemi, 40 hastadan iki hastada( %5 ) peritonit
27
gelişmiş olup, hastaların hiçbirinde plörezi gelişmemiştir. ŞET Yavaş seyirli klinikte
40 hastadan 17 hastada (%42,5 ) beyin cerrahisi tarafından şant disfonksiyonu
olduğu belirtilmiştir. 40 hastadan sadece bir (% 2,5) hastada şant trasesi boyunca
sıvı sızması saptanmıştır(Tablo 7).
Tablo 7. Ventriküloperitoneal şant enfeksiyonlu olgularda Şant
enfeksiyon tipi
SET Proksimal
Ventrikülit
Menenjit
Asemptomatik
Bakteriyemi
Peritonit
Aseptomatik
SET
Yavaş
Şant disfonksiyonu
seyirli klinik
Şant boyunca sıvı sızması
SET Distal
Sayı
9
%
22,5
31
25
13
2
22
17
1
77,5
62,5
32,5
5
55
42,5
2,5
Şant enfeksiyonu ile hastaneye başvuran hastaların klinik belirti ve
bulgularına bakıldığında; 40 hastanın 38’inde (%95) ateş, ikisinde (%5) karın ağrısı,
dört hastada (%10) baş ağrısı, 12 hastada (%30) beslenme yetersizliği, dört hastada
(%10) bulantı, 33 hastada (%82,5) kusma, 19 hastada (%47,5) konvulziyon, 22
hastada (%55 ) mental durum değişikliği, sekiz hastada (%20) yara yerinde akıntı,
iki hastada (%5) şant trasesi boyunca kızarıklık ve
ense sertliği, Kerning, Burdzinski, 33 hastada
saptandığı Tablo 8 ‘de gösterilmiştir.
28
ısı artışı, üç hastada ( %7,5 )
(%82,5) baş çevresinde büyüme
Tablo 8. Ventriküloperitoneal şant enfeksiyonlu olgularda klinik
semptom ve bulguları
Ateş
Karın ağrısı
Başağrısı
Bulantı
Kusma
Nöbet
Mental
Yara yerinde akıntı
Deri altı eritem
Ense sertliği
Kerning
Burdzinski
Baş çevresinde büyüme
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Sayı
%
2
38
38
2
36
4
36
4
7
33
21
19
18
22
32
8
38
2
37
3
37
3
37
3
7
5
95
95
5
90
10
90
10
17,5
82,5
52,5
47,5
45
55
80
20
95
5
92,5
7,5
92,5
7,5
92,5
7,5
17,5
33
82,5
Şant enfeksiyonu ile hastaneye yatırılan hastaların BOS bulguları
değerlendirildiğinde BOS’ta protein 14-2947 mg/dl(507,47± 675mg/dl ), BOS
glukoz 2-72 mg/dl (27,7 ±20,8mg/dl), BOS lökosit sayısı 5-1000 /mm3 ( 504,15±
411,3/mm3), BOS ‘ta lenfosit 0-100
(41,1±37,3), BOS’ta nötrofil 0-100
(58,9±37,3), BOS/kan glukoz oranı 0,01-0,72 ( 0,25±0,19) olarak saptanmıştır.
Ayrıca kan glukozu 68-193mg/dl(110±163mg/dl) , kan lökosit miktarı 477033000/mm3 (17233 ± 7789 /mm3),CRP 0-300 mg/lt (98,9±81,3mg/lt) ve
sedimantasyon 10-104 /saat ( 41,59±30,7) olarak saptanmıştır.(Tablo 9 )
29
Tablo 9. Ventriküloperitoneal şant enfeksiyonlu hastalarda laboratuvar
bulguları
N
Min.
Max.
Ort.
SS
40
1
127
42,35
30,85
HS Saptanma zamanı
33
1
8
6,06
1,80
Enfeksiyon zamanı
40
10
300
77,53
80,19
Protein
40
14
2947
507,47
675,59
Glikoz
40
2
72
27,70
20,81
LDH
12
29
1000
196,83
261,46
Hücre(Lökosit)
39
5
1000
504,15
411,31
Cl
38
92
134
112,53
7,79
Kan glikozu
40
68
1125
135,70
163,50
Lökosit
40
4770
33000
17233,80
7789,60
CRP
40
0
300
98,90
81,39
Sedimantasyon
22
10
104
41,59
30,71
TİT Dansite
38
1000
1022
1008,89
6,43
BOS Lenfosit
40
0
100
41,10
37,32
BOS PNL
40
0
100
58,90
37,32
BOS/Kan glukoz
40
0,01
0,72
0,25
0,19
Şant enfeksiyonu sebebiyle hastaneye yatırılan hastaların BOS örneklemesi
ve kültür incelemesi yapılmıştır. 40 hastadan beşinde (%12,5) BOS kültüründe
üreme olmamıştır. 40 hastadan 17 ‘sinde ( %42,5) miks üreme, 12 ‘sinde (%30 )
S.epidermitis ve S.aureus üredi. İki hastada ( %5 ) brucella, üç hastada ( % 7,5 )
Pseudomonas aeruginosa, bir
hastada (%2,5) Candida albicans üremesi
saptanmıştır.17 miks üremenin 10’unda stafilokok enfeksiyonu, dört hastada
Pseudomonas aeruginosa, iki hastada vankomisin dirençli enterokok, üç hastada
vankomisin duyarlı enterokok, üç hastada E.coli, üç hastada Candida albicans, bir
hastada klebsiella, iki hastada Stenotrophomonas maltophillia, bir
hastada
acinetobacterium, bir hastada Burkholderia glodioli, bir hastada pnömokok üremesi
saptanmıştır (Tablo 10).
30
Tablo 10. VPŞ enfeksiyonunda BOS ‘ta üreyen mikroorganizmalar
Enfeksiyon Bakterileri
45
40
35
30
25
20 %
15
10
5
0
Yok
Stofilokokler
Miks üreme
Candida
Brusella
Pseudomonas
Ventriküloperitoneal şant enfeksiyonu sebebiyle başvuran ve Gram pozitif
mikroorganizmaların üretildiği 27 hastanın antibiyotik duyarlılığı incelendiğinde;
24 hastada (% 88,8 ) penisilin direnci, 23 hastada (%85,1) ampisilin direnci, 17
hastada (%62,9) eritromisin direnci, 17 hastada oksasilin direnci (%63), 11 hastada
(%40,7) tetrasiklin direnci, 11 hastada (%40,7) kloramfenikol direnci, 13 hastada
(%48,1) gentamisin direnci, sekiz hastada (%29,6 ) levofloksasin direnci, sekiz
hastada (%29,6) teikoplanin direnci, beş hastada (%18,5) rifampisin direnci, üç
hastada (%11) vankomisin direnci, bir hastada (% 3,8) linezolid direnci saptanmıştır
(Tablo11).
31
Tablo
11.
Ventriküloperitoneal
şant
enfeksiyonunda
BOS
örneklemesinde Gram (+) mikroorganizmaların antibiyotik duyarlılığı
Sayı
Seftriakson
Oksasilin
Ampisilin
Eritromisin
Tetrasiklin
Kloramfenikol
Gentamisin
Levofloksasin
Vankomisin
Teikoplanin
Rifampin
Linezolid
%
5
35
10
17
4
23
10
17
16
11
16
11
14
13
20
7
24
3
19
8
22
5
26
1
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
Yok
Var
12,5
87,5
37
63
14,8
85,2
37
63
59,3
40,7
59,3
40,7
51,9
48,1
74,1
25,9
88,9
11,1
70,4
29,6
81,5
18,5
96,2
3,8
Üreme (-)
27
67,5
Üreme (+)
13
32,5
Kan kültüründe üreme
Şant enfeksiyonu gelişen Gram negatif mikroorganizmaların kültür
antibiyogramlarına bakıldığında üreyen 10 mikroorganizmanın dokuzunda (%90)
ampisilin, amoksisilin-klavunilik asit ve sefoksitin direnci, altı hastada (%60)
sefotaksim ve seftriakson direnci, üç hastada (%60)sefepime ve aztreonam direnci,
iki hastada (%20)seftazidim ve siprofloksasin direnci, sekiz hastada (%80) TMPSMT direnci, bir hastada (%10) gentamisin ve amikasin direnci saptandı. Bütün
mikroorganizmalar meropeneme hassas saptanmıştır. İmipeneme ise sadece bir
hastada (%10) az hassasiyet saptanmıştır. Kültürde pseudomonas üremesi olan bütün
mikroorganizmalar da piperasilin-tazobaktam ve sefaperazon-sulbaktama hassasiyet
saptanmıştır (Tablo 12).
32
Tablo
12.
Ventriküloperitoneal
şant
enfeksiyonunda
BOS
örneklemesinde Gram(-) mikroorganizmaların antibiyotik duyarlılıkları
Yok
Var
Yok
Amoksisilin-klavunilat
Var
Yok
Sefoxitine
Var
Yok
Sefotaksim
Var
Yok
Seftazidim
Var
Yok
Seftriakson
Var
Yok
Sefepime
Var
Yok
Gentamisin
Var
Yok
Amikasin
Var
Yok
Siprofloksasin
Var
Yok
Nitrofurantoin
Var
Yok
TMP-SMZ
Var
Yok
Piperasin-Tazobaktam
Var
Yok
Sefaperazon-Sulbaktam
Var
Ampisilin
Sayı
%
1
9
1
9
1
9
3
6
8
2
4
6
6
3
8
1
8
1
8
2
5
4
1
9
5
0
5
0
10
90
10
90
10
90
30
60
80
20
40
60
60
30
80
10
80
10
80
20
50
40
10
90
100
0
100
0
Şant enfeksiyonu sebebiyle tedavi edilen hastaların mortalite oranlarına
baktığımızda 40 hastanın beşinde (%12,5) eksitus saptanmıştır. Eksitus saptanan iki
hastamızda serebral herniasyon, iki hastamızda şanta bağlı barsak perforasyonu, bir
hastamızda vankomisin dirençli Enterokok ve Candida albicans üremesi
saptanmıştır.
Şant
enfeksiyonu
gelişen
hastalarımızın
tedavi
protokolleri
değerlendirildiğinde 40 hastamızdan 16 hastamızın şantı çıkarılmış ve eksternal
ventriküler drenaja alınmıştır, 11 hastamıza intratekal tedavi uygulanmıştır.
İntratekal tedavi alan hastalardan birine vankomisin, yedi hastaya targocid ve 3
hastaya amikasin tedavisi uygulanmıştır. Hastalarımıza hastaneye yattıkları ilk gün
15 mg/doz dört dozda vankomisin ve 100mg/kg/gün dozunda seftriakson tedavisi
33
başlanmıştır.Üç hastada vankomisin’e karşı allerjik reaksiyon geliştiğinden
tedavilerine intratekal targocid olarak devam edilmiştir. Hastalarda ürüyen
mikroorganizmaların antibiyotik duyarlılıklarına göre tedavileri değiştirilmiştir.
Şant enfeksiyonlu hastaların hastanede yatış sürelerine bakıldığında 30
günden az hastanede kalan hasta sayısı 19( %47,5 ) , 30 günden fazla hastanede
kalan hasta sayısı 21( % 52,5 ) olarak saptanmıştır (Tablo 13 ).
Tablo
13:
Ventriküloperitoneal
şant
enfeksiyonlu
olgularımızın
hastanede yatış süreleri
Gün
Hastanede Yatış <30
Süresi
>30
Sayı
%
19
47,5
21
52,5
Hastaların hastaneye yatış süreleri; Yaş, cinsiyet, BOSkültüründe üreyen
mikroorganizmalar, hidrosefali etyolojisi, BOS bulguları, kan kültürü ve enfeksiyon
tipine göre karşılaştırıldığında; 30 gün altında hastanede kalan hastaların yaş
ortalaması (16,97±23,75 ay), 30 gün üzerinede kalanlarda yaş ortalaması
(8,5±13,1ay) olarakbulunmuştur. 30 gün üzerinde yaş ortalaması daha küçük olup
istatiksel
olarak anlamlı
bulunmamıştır ( p:0,165) .Hastaların cinsiyetine
baktığımızda 30 gün altında hastanede yatan olguların % 57, 9’u erkek, %42,1’i kız
olduğu görülmüştür. 30 gün
%66,7 kız olarak
üzerinde hastanede yatan olguların %33,3 erkek,
saptanmıştır.30 gün üzerinde hastanede kalan hastalarımızdan
kızların sayısı erkeklere göre daha fazlaydı ama istatiksel olarak anlamlı
bulunmamıştır ( p:0,119).Enfeksiyon bakterilerine göre hastanede kalış süreleri
karşılaştırıldığında BOS’ta polimikroorganizma saptanan hastaların hastanede yatış
süreleri çoğunlukla 30 günden fazla olarak saptanmıştır ( %52,4 ) fakat istatiksel
olarak anlamlı bulunmamıştır (p:0,259) . Hidrosefali etyolojisine göre değerlendirme
yapıldığında meningomyelosel tanısı olan hastaların hastanede yatış süreleri daha
fazla bulunmuştur ancak sonuçlar istatiksel olarak anlamlı bulunmamıştır(p:
0,778).Hastanede yatış süreleri BOS bulguları ile birlikte değerlendirildiğinde
hastanede 30 günden fazla kalan hastaların BOS lökosit sayısında % 61,8 PNL
34
hakimiyeti saptanmış olup sonuçlar istatiksel olarak anlamlı bulunmamıştır (p:
0,605). Hastaların BOS/ kan glukoz değerlerine bakıldığında 30 gün altında
hastanede yatan hastalarda bu oran (0,36±0,18) ,30 gün üzerinde yatan hastalarda ise
bu oran ( 0,15± 0,12) olarak bulunmuştur. Sonuçta 30 günden fazla hastanede yatan
hastaların BOS glukoz değerleri istatiksel olarak anlamlı
düşük bulunmuştur
(p:0,0001) (Tablo 14 ). Hastanede kalış süresi 30 günden az olanların %78,9 ‘unda
kan kültüründe üreme saptanmamıştır. Hastanede kalış süresi 30 günden fazla
olanların %57,1 ‘inde, hastanede kalış süresi 30 günden az olanların büyük
çoğunluğunda kan kültürlerinde üreme saptanmamış olup, her iki gruptada hastanede
yatış süreleri ile kan kültürü sonuçları arasında istatiksel olarak anlamlı ilşki
bulunmamıştır (p:0,141 ) (Tablo 15).
Tablo 14. BOS bulgularının hastanede yatış sürelerine etkileri
<30 Gün
>30 Gün
t
p
Yaş (ay)
16,97±23,75
8,5±13,1
1,42
0,165
BOS Lenfosit
44,37±39,09
38,14±36,36
0,52
0,605
BOS PNL
55,63±39,09
61,86±36,36
-0,52
0,605
0,36±0,18
0,15±0,12
4,44
0,0001
BOS/Kan Glukoz
35
Tablo 15. Hastanede yatış sürelerini etkileyen faktörler
Cinsiyet
Enfeksiyon
Bakterileri
Hidrosefali etyolojisi
kan kültüründe
üreme
Pandy
SET Proksimal
SET Distal
SET Yavaş
Seyirli Klinik
Erkek
Kız
Üreme yok
Stafilokoklar
Miks üreme
Candida
Brucella
Pseudomonas
Enfeksiyonlar
Konjenital malformasyon
Hemoroji
Araknoid kistler
Sınıflandırılamayanlar
Üreme (-)
Üreme (+)
Negatif
(+)
(++)
(+++)
(++++)
Ventrikülit
Menenjit
Yok
Bakteriyemi
Peritonit
Yok
Şant disfonksiyonu
Şant boyunca sıvı sızması
36
<30 Gün
11 57,9%
8 42,1%
4 21,1%
6 31,6%
6 31,6%
0
0,0%
2 10,5%
1
5,3%
3 15,8%
10 52,6%
2 10,5%
1
5,3%
3 15,8%
15 78,9%
4 21,1%
4 21,1%
3 15,8%
4 21,1%
7 36,8%
1
5,3%
5 26,3%
14 73,7%
14 73,7%
4 21,1%
1
5,3%
11 57,9%
8 42,1%
0
0,0%
>30 Gün
7 33,3%
14 66,7%
1
4,8%
6 28,6%
11 52,4%
1
4,8%
0
0,0%
2
9,5%
2
9,5%
14 66,7%
2
9,5%
0
0,0%
3 14,3%
12 57,1%
9 42,9%
1
4,8%
1
4,8%
6 28,6%
7 33,3%
6 28,6%
4 19,0%
17 81,0%
11 52,4%
9 42,9%
1
4,8%
11 52,4%
9 42,9%
1
4,8%
χ²:2,43
p=0,119
χ²:6,52
p=0,259
χ²:1,77
p=0,778
χ²:2,16
p=0,141
χ²:6,68
p=0,153
χ²:0,302
p=0,583
χ²:2,18
p=0,335
χ²:0,961
p=0,618
TARTIŞMA
Günümüzde hidrosefali tedavisinde en etkin tedavi yöntemi olmamakla
birlikte intraventriküler BOS birikiminin neden olduğu intrakranial basıncı düşürmek
amacıyla, BOS’un başka bir vücut boşluğuna drenajını sağlayan şant sistemleri halen
yaygın olarak kullanılmaktadır(1.3.41). Bu sistemler tedavi maliyetleri yüksek ve
tedavisi güç olan komplikasyonları da beraberlerinde getirmektedirler. Özellikle
pediatrik yaş grubundaki hidrosefali hastalarının tedavisinde kullanılan VPŞ
sistemlerine bağlı komplikasyonlar operasyonu takip eden ilk bir kaç ayda en yüksek
düzeye ulaşmaktadır. Pediatrik dönemindeki şant komplikasyonlarının yaklaşık
%50’sini şant tıkanmaları oluştururken, ikinci sırayı şant enfeksiyonları almaktadır
(2, 5). Subdural kanama ve effüzyon, aşırı drenaj sendromu, slit ventrikül sendromu,
şant migrasyonu, şant kopması, şant kırılması, psödokist, intestinal perforasyon,
pnömosefalus gibi komplikasyonlar daha nadir olarak görülmektedirler (2, 5).
VPŞ takılması sonrası gelişen komplikasyonlar temelde operasyon öncesi,
operasyon sırasında ve sonrasındaki teknik detaylardan köken almaktadırlar (41).
Literatürde pediatrik yaş grubundaki hidrosefali olgularının cinsiyete göre
dağılımları %55-60 erkek, %40-45 kız olarak bildirilmektedir (26, 27-30). Choux ve
arkadaşlarının (26) 600 olgudan oluşan çalışmalarında olguların cinsiyete göre
dağılımları 345 erkek ve 255 kız, Güzelbağ ve arkadaşlarının (29) 306 olguluk
çalışmasında 165 erkek, 141 kız, Kontny ve arkadaşlarının (27) çalışmasındaki
olguların 145’i erkek, 109’u kız, Casey ve arkadaşlarının (30) çalışmasındaki
olguların 90’ı erkek, 65’i kız, Vanaclocha ve arkadaşlarının (31) çalışmasındaki
olguların 20’si erkek, 12’si kız, Davis ve arkadaşlarının (32) çalışmasında olguların
678’i erkek, 515’i kız, Kulkarni ve arkadaşlarının (28) çalışmasında olguların % 54’ü
erkekti olarak bildirilmektedir.
Bizim
olgularımızı
1-84
ay
yaş
aralığında
hidrosefali
sebebiyle
ventriküloperitoneal şant takılan ve enfeksiyon gelişen hastalar oluşturmaktaydı.
2001-2008 tarihleri arasında takip edilen 40 olgunun 18’i (%45) erkek, 22’si (%55)
kız idi. Olgularımızın cinsiyetlerine göre dağılımı literatür ile uyumlu değildi.
37
Literatürde pediatrik dönemindeki hidrosefali olgularının etyolojilerine göre
dağılımlarında OHKD sebebiyle gelişen hidrosefali olguları ilk sırayı almaktadır
(27.29.36). Güzelbağ ve arkadaşlarının (29) serilerinde 306 olgunun 109’u, Kulkarni
ve arkadaşlarının (28) serilerinde olguların %21,7’si, Bierbrauer ve arkadaşlarının
(36) serilerindeki olguların %28’i, Kontny ve arkadaşlarının (27) 350 olguluk
serilerinde 133 olgu OHKD’ne bağlı hidrosefalisi olan olgulardan oluşmaktaydı.
Bizim 40 olgudan oluşan serimizde ise; 20 (%50) olguda OHKD sebebiyle
hidrosefali gelişmişti. Olgularımızın hidrosefali etyolojilerine göre dağılımları
literatür ile uyumlu olup, etyolojik nedenler içerisinde OHKD’leri ilk sırayı
almaktaydı.
Literatürde özellikle yaşamın ilk bir yılında şant takılan olgularda şant
enfeksiyonlarının görülme oranları daha ileri yaştaki olgulara oranla daha yüksek
olarak bildirilmektedir (2. 23. 24.25.28.31). Pople ve arkadaşlarının (24) yaptığı 296
olguluk retrospektif çalışmada altı aydan küçük infantlarda şant enfeksiyonu oranı
%15.7 iken, daha büyük yaştaki çocuklarda ise bu oran %5.6 olarak bildirilmektedir.
Güzelbağ ve arkadaşlarının (29) çalışmasında bir yaş altında şant takılan olgularda
şant enfeksiyonu oranı %16 olarak bildirilmektedir. Kulkarni ve arkadaşları (28)
çalışmalarında şant enfeksiyonu için şant takılma yaşının küçük olmasını risk faktörü
olarak bildirmektedirler. Bizim çalışmamızda ise şant enfeksiyonu sebebiyle
çalışmaya dahil edilen olgulardan 17’si (%42,5) 0-1 yaş aralığında geri kalan 23 olgu
ise(%57,5) 1-7 yaş arasındaydı. Olguların yaş gruplarına göre şant enfeksiyonu
görülme oranlarımız literatürle paralellik göstermemekte idi.
Literatürde OHKD’ne eşlik eden hidrosefali olgularına takılan VPŞ’larda şant
enfeksiyonu oranı yüksek olarak bildirilmektedir (23.27.28.29.31). Kontny ve
arkadaşlarının (27) çalışmasında OHKD’ne bağlı olarak gelişen hidrosefali
hastalarında şant enfeksiyonu oranı %10,5 olup, aynı çalışmada diğer etyolojik
nedenlerle şant takılan olgulardaki şant enfeksiyonu oranlarından daha yüksek olarak
bulunmuştur. Tuli ve arkadaşlarının (39) çalışmasında 73 OHKD’li olgunun 11’inde
(%5.06) şant enfeksiyonu gelişmiş ve OHKD’li olgularda morbidite ve mortalitenin
nedeni olarak şant enfeksiyonlarını bildirmektedirler. Bizim çalışmamızda da
38
OHKD’ne eşlik eden hidrosefali sebebiyle şant takılan ve enfeksiyon gelişenolgu
sayısı 20 olup ventriküloperitoneal şant enfeksiyonu sebebiyle takip ve tedavi edilen
hastalarımızın %50 ‘sini oluşturmaktaydı. OHKD’ne bağlı olarak hidrosefali gelişen
olgularda şant enfeksiyonu oranlarımızın yüksekliği literatürle uyumlu bulunmuştur.
Şant operasyonlarını takip eden ilk iki ayda şant enfeksiyonu riskinin daha
yüksek olduğu literatürde bildirilmektedir (5, 23, 26,28,31). Choux (26) ve Kulkarni
(28) çalışmalarında şant enfeksiyonlarının büyük çoğunluğunun operasyonu takip
eden ilk üç ayda ortaya çıktığını bildirmektedirler. Choux ve arkadaşları (26)
çalışmalarında şant enfeksiyonlarının %57’sini şant takılmasını takip eden ilk bir
ayda, %85’ini ilk dört ayda ve %15’ini dördüncü aydan sonra gördüklerini
bildirmektedirler. Casey ve arkadaşları (30) olgularındaki şant enfeksiyonlarının
%92’sinin şant takılmasını takip eden ilk üç ayda olduğunu bildirmektedirler.
Kulkarni ve arkadaşlarının (28) çalışmasında şant enfeksiyonu gelişen olgularda
reoperasyon zamanı 4-177 gün arasında olup, ortalama değer 36 gün olarak
bildirilmektedir.
Bizim çalışmamızda ventriküloperitoneal şant enfeksiyonu sebebiyle takip
ettiğimiz hastalarda enfeksiyon bulgularına en erken postoperatif 10.günde en geç
postoperatif 300.günde rastlanmakta olup ortalama değer 77,53 ve standart sapma
80,19 saptanmış olup şant enfeksiyonlarının postoperatif gelişme periyodu literatür
ile uyumlu olarak bulunmuştur.
Literatürde postoperatif erken dönemde şant enfeksiyonlarından sorumlu
mikroorganizmalar deri florasında bulunan stafilokoklar olarak bildirilmektedir (23,
24,26-28,31,37,41).
Choux
ve
arkadaşlarının
(26)
çalışmasında
şant
enfeksiyonlarında S.epidermidis %44, S.aureus %23, daha az olarak da
Enterobacter, S.hemoliticus, Acinobacter, P.aeruginosa ve C.albicans enfeksiyon
etkeni olarak bildirilmektedir. Kulkarni ve arkadaşlarının (28) serilerinde ise kültürde
üretilen
mikroorganizmaların
48,4’ü
S.aureus,
%38,7’si
koagülaz
negatif
stafilokoklar olarak bildirilmektedir. Pople ve arkadaşları (24) çalışmalarında
operasyon sırasındaki kontaminasyonlarda en sık koagülaz negatif stafilokokların
39
enfeksiyon etkeni olduğunu bildirmektedirler. Kontny ve arkadaşlarının (27)
çalışmasında da izole edilen 28 mikroorganizmanın 16’sını S.epidermidis
oluşturmaktadır. Vanaclocha ve arkadaşlarıda (31) şant enfeksiyonunda izole ettikleri
mikroorganizmaların %71,8’ini koagülaz negatif stafilokokların oluşturduğunu
bildirmektedirler.
Bizim çalışmamızda da postoperatif dönemde gelişen 40 şant enfeksiyonunun
35’ünde kültürde mikroorganizma üretildi, beşinde ise üreme olmadı. Kültürde
üremesi
olan
35
olgumuzun
12’sinde
(%30)
enfeksiyondan
sorumlu
mikroorganizmalar S.epidermidis ve S.aureus, koagülaz negatif stafilokok’lardı,
bununla birlikte kültürde üremesi olan olguların 17’sini mikroorganizmalar arasında
yine koagülaz negatif stafilokokların çoğunluğu oluşturduğu miks üremenin izlendiği
olgular oluşturmaktaydı. Geri kalan 11 olgunun ikisinde (%5) Brucella, üçünde
(%7,5) C.albicans, birinde ise (%2,5)etken mikroorganizma P.aeroginosa idi.
Çalışmamızdaki şant enfeksiyonu etkeni olan mikroorganizmalar literatürle
karşılaştırıldığında literatürle uyumlu olarak bulunmuştur.
Literatürde Gram pozitif üremenin gözlendiği VPŞ enfeksiyonu olgularının
antibiyotik dirençliliğine bakıldığında Fong ve ark.(50) Stafilakok enfeksiyonunda
efektif
tedavi seçeneğini
kloksasilin olarak saptamışlardır. Pfaus ve ark.(52)
stafilokok ventrikülitli olguların intraventriküler vankomisinin en etkili ilaç olduğunu
yazmışlardır. Cunha ve ark.(51) da en etkili tedavinin vankomisin olduğunu
savunmuşlardır. Jourdan ve ark ise şant enfeksiyonu gelişen olgularda en etkin
tedavinin Teikoplanin olduğunu söylemişlerdir. Bizim çalışmamızda ise Gram pozitif
mikroorganizmalarda tedavi seçeneği olarak en etkili antibiyotik ajanlar rifampisin,
linezolid ve vankomisin olarak saptanmıştır.
Literatürde Gram negatif üremenin gözlendiği VPŞ enfeksiyonlu olglarının
antibiyotik dirençliliğine bakıldığında Latif ve ark.(53 )27çocukta seftriaksonun
BOS’a geçişini incelemişlerdir. Hem external ventrikülotomi drenajı hemde VPŞ’a
bağlı gelişen menenjitlerde seftriaksonun BOS‘a geçisinin iyi olduğu ve tedavideki
yeri vurgulanmıştır. Segal-Maurer ve ark. (54) seftazidim dirençli klebsiella’ya bağlı
40
VPŞ enfeksiyonlu olguda meropenem, imipenem ‘e duyarlılık saptanmıştır. Lu ve
ark (55) hastane kökenli Gram negatif enfeksiyonlara karşı üçüncü kuşak
sefalosporinlere direnç geliştiği vurgulanmaktadır. Barsic ve ark.(56) Gram negatif
mikroorganizmalarda en etkin tedavinin siprofloksasin olduğu saptanmıştır. Bizim
çalışmamızda Gram negatif mikroorganizmaların antibiyotik dirençliliğine göre en
etkili antibiyotik meropenem olarak saptanmıştır. Pseudomonas için ise piperazintazobactam ve sefoperazon-sulbaktam en etkili olarak bulunmuştur.
Literatürde ventriküloperitoneal şant enfeksiyonlu olgularda prematüritenin
önemli bir risk faktörü olduğu yönünde yayınlar mevcuttur. Matthew J.McGirt ve
arkadaşlarının
yapmış
olduğu
820
hastadan
oluşan
seride
92
tane
ventriküloperitoneal şant enfeksiyonlu hastadan 10’u prematür olup istatiksel olarak
prematüritenin şant enfeksiyonlarında önemli bir risk faktorü olduğunu ortaya
koymuşlardır.(42) Benzer şekilde Pople IK ve arkadaşları (24) yapmış oldukları
çalışmada preterm infantlarda şant enfeksiyon riskini %33,3 term bebeklerde ise bu
riski %25,8 olarak bildirmektedir. Aynı çalışmada preterm bebeklerde artmış riskte
epidermisin daha ince ve daha az koruyucu özellikte olması en önemli faktör olarak
gösterilmektedir. Ayrıca rezistan cilt florasının artmış insidansı, daha yüksek
bakteriyel adezyon kuvvet, azalmış neonatal immunglobulinler, ve kompleman
aktivasyonu riski artıran diğer faktörler olarak gösterilmektedir. Bu faktörlere ek
olarak aynı çalışmada zayıf beslenme durumu, eşlik eden diğer medikal problemler
ve teknik olarak şant yerleştirilmesinin bu olgularda daha güç olması, pretem
bebeklerin term bebeklere nazaran hastanede kalış sürelerinin daha uzun olması da
önemli risk faktörleri olarak gösterilmektedir.(42.43) Pretermler için şant
enfeksiyonlarında önemli bir risk faktörü olduğunu göstermektedir. Ayrıca ChengChou Lan ve arkadaşları(66), Kulkarni AV ve arkadaşları (28) yapmış oldukları şant
infeksiyonlarında risk faktörleri çalışmalarında istatiksel olarak prematüritenin
önemli bir risk faktorü olduğu sonucuna ulaşmışlardır.
41
Bizim çalışmamızda şant enfeksiyonu sebebiyle takip ettiğimiz 1-84 ay yaş
aralığındaki 40 olgunun dördü preterm olup oran %10 olarak saptanmıştır ve
literatürle uyumlu bulunmuştur.
Şant
enfeksiyonlarında
hastaların
klinik
bulguları
hastanın
yaşına,
mikroorganizmanın virulansına ve şantın tipine göre değişir. Ateş, irritabilite ve şant
disfonkiyonu
en
sık
karşılaşılan
bulgulardır.
Literatürde
Odio
C.
ve
arkadaşlarının(44) yapmış olduğu çalışmada olguların %48 ‘inde ateş, %69’unda
başağrısı ve %76’sında cilt enfeksiyon bulgusu saptanmamıştır. Ancak ateşin
olmaması
şant
enfeksiyonunu
dışlamamaktadır.
Turgut
ve
arkadaşlarının
(57)olgularında ise ateş, kusma, nöbet ve başağrısının şant enfeksiyonlarında en sık
karşılaşılan semptomlar olduğu belirtilmektedir. Büyük çocuklar nonspesifik
abdominal yakınmalar, duygusal değişiklikler, yeme ve oyuna ilgide azalma gibi
belirtiler gösterebilirken yenidoğan döneminde şant enfeksiyonu irritabilite ve
beslenmede azalma ile gösterebilir. Wang ve arkadaşları(58) ateş ve şuur
bulanıklığının erişkinlerde, abdominal semptomlarınve şuur bulanıklığının ise daha
çok çocuk yaş grubunda izlendiğini belirtmişlerdir.
Bizim çalışmamızda ise şant enfeksiyonu sebebiyle takip edilen yaşları 1-84
ay aralığında değişen 40 olguda ateş %95 sıklıkla en sık karşılasılan klinik belirti
olup bu belirtiyi %82,5 oranla kusma ve %55 oranla şuur bulanıklığı gibi mental
durum değişikliklerinin takip ettiği görülmüştür. Çalışmamızdaki şant enfeksiyonu
klinik belirti bulguları literatür bulgularıyla uyumlu bulunmuştur.
42
SONUÇLAR
1- Çalışma grubu oluşturulan vakalar arasında hidrosefali etyolojisinde birinci sırayı
başta meningomyeloselin geldiği OHKD’leri gibi konjenital malformasyonların
oluşturduğu gözlenmiştir.
2- Çocukluk yaş grubunda görülen VPŞ komplikasyonlarının büyük çoğunluğunu
şant enfeksiyonu ve şant tıkanmalarının oluşturduğu tespit edilmiştir.
3- Postoperatif
erken
dönemde
şant
enfeksiyonlarından
en
sık
sorumlu
mikroorganizmalar cilt florasında bulunan stafilokoklardır.
4- Olguların yaşları küçüldükçe VPŞ’a bağlı enfeksiyon oranlarında artış
görülmüştür.
5- Özelllikle meningomyelosel gibi OHKD’li konjenital malformasyonlu olgularda
şant enfeksiyonu gelişme oranın fazla olduğu saptanmıştır.
6- VPŞ uygulanmasından sonraki ilk bir yıllık dönemde şant enfeksiyonları en fazla
ilk üç ay içerisinde görülmüştür.
7- Prematürite ve uzun süre hastanade kalışın şant enfeksiyonları için önemli bir risk
faktörü olduğu görülmüştür.
8- Şant enfeksiyonlarında klinik hastanın yaşına, mikroorganizmanın virulansına ve
şantın tipine göre değişir. Ateş, irritabilite ve şant disfonksiyonu en sık karşılaşılan
bulgular olduğu görülmüştür.
9- Sonuç olarak; Hidrosefali tedavisinde uygulanan ventriküloperitoneal şant (VPŞ)
operasyonlarından sonra gelişen şant komplikasyonları, günümüzde preoperatif,
intraoperatif ve postoperatif tekniklerdeki gelişmelere karşın önemli bir sorun olarak
devam etmektedir. Çocukluk döneminde en sık karşılaşılan VPŞ komplikasyonları
şant enfeksiyonları ve şant tıkanmalarıdır. Bu komplikasyonlar olgular için morbidite
ve mortalite artışının yanı sıra, yüksek ekonomik maliyetleri ile de sorun
oluşturmaktadır. Ayrıca hidrosefali oluşturan etyolojik nedenlerin ve olguların şant
takılma yaşlarının önemli faktörler olduğu, gelişebilecek şant komplikasyonlarının
erken tanısında postoperatif ilk iki aylık dönemde olguların yakın takiplerinin
yapılması gerektiği görülmüş olup hidrosefali sebebiyle şant operasyonu uygulanan
hastalarda şant enfeksiyonu riski alınacak preoperatif, intraoperatif ve postoperatif
önlemlerle en aza indirilebilir.
43
10- VPŞ enfeksiyonlu BOS’ta Gram pozitif mikroorganizmaların ürediği durumda en
etkili tedavi vankomisin olduğu görülmüştür .
11- VPŞ enfeksiyonlu BOS’ta Gram negatif mikroorganizmaların ürediği durumda en
etkili tedavi meropenem olduğu görülmüştür.
44
KAYNAKLAR
1.
Jason IL, Walter DJ. History of hydrocephalus and treatments.
Neurosurg Focus 2001;11,1-5.
2.
Drake JM, Sainte Rose C. The Shunt Book. Cambridge, MA: Blackwell
Science,1995.
3.
McCullough DC. History of the treatment of hydrocephalus. In:
Concepts in Neurosurgery. Hydrocephalus (ed) R.Michael Scott 1990;3
(2), 1-10.
4.
Piatt JH. Hydrocephalus Treatment. In: Wilkins RH Rengachary S
(eds), Neurosurgery. Baltimore, Mc Graw-Hill Company, 1996; 363343.
5.
Detwiler PW,
Porter RW and Rekate LH. Hydrocephalus-clinical
features and management. İn: Choux M, Di Rocco C, Hockley AD
(eds). Pediatric Neurosurgery (1st ed) 1999; 12,253-71.
6.
Jason IL, Walter DJ. History of hydrocephalus and treatments.
Neurosurg Focus 2001;11,1-5.
7.
Medikal Embriyoloji 7.baskı T.W.Sadler 1996; 358-396.
8.
Arıncı Kaplan Anatomi cilt 2 1995; 338-400.
9.
Albert L,Rhoton Jr. Microsurgical anatomy of the lateral ventricles. In:
Wilkins RH Rengachary S (eds): Neurosurgery. Baltimore, Mc GrawHill Company, 1996;144,1419-34.
10.
Sklar F. Physiology of the cerebrospinal fluid compartment. In: Wilkins
RH Rengachary S (eds), Neurosurgery. Baltimore, Mc Graw-Hill
Company, 1996;3617-23.
11.
Sato O, Oı S, Yamada S. Hydrocephalus-experimental considerations
and clinical analyses. In: Choux M, Di Rocco C, Hockley AD (eds),
Pediatric Neurosurgery (1st ed) 1999;11,237-71.
12.
Milhorat TH. Hydrocephalus: Pathophysiology and Clinical Features,
İn: Wilkins RH Rengachary S (eds), Neurosurgery. Baltimore, Mc
Graw-Hill Company, 1996;3625-31.
45
13.
Rekate LH. Treatment of hydrocephalus. Principles and Practice of
Pediatric Neurosurgery. In: Albright L, Pollack I, Adelson D.
1999;3,47-74.
14.
Del Bigio RM, McAllister JP. Hydrocephalus-pathology. In: Choux M,
Di Rocco C, Hockley AD (eds),Pediatric Neurosurgery (1st ed)
1999;10,217-36.
15.
Rekate HD, Olivero W. Current Concepts of CSF production and
absorption. Concepts in Neurosurgery. Hydrocephalus (ed) R.Michael
Scott 1990:3(2),11-22.
16.
Kirkpatrick M, Engleman H, Minns RA. Symptoms and signs of
progressive hydrocephalus. Arch Dis Child 1989;64,124-8.
17.
Camfield PR, Camfield CS, Allen AC, et al. Progressive hydrocephalus
in infants with birth weights less than 1500g. Arch Neurol 1981;38,6535.
18.
Mercuri E, Faundez JC, Cowan F, Dubowitz L. Acetazolamide without
frusemide in the treatment of posthaemorrhagic hydrocephalus. Acta
Pediatr 1994;83,1319-21.
19.
Gilmore HE. Medical treatment of hydrocephalus. Concepts in
Neurosurgery. Hydrocephalus (ed) R.Michael Scott. 1990:3(4),37-46.
20.
Kaufman BA, McLone DG. Infections of cerebrospinal fluid shunts. In:
Scheld WM, Whitley RJ, Durack DT, ed. Infections of the central
nervous system. New York: Raven press,1991;561-85.
21.
McComb JG. Techniques for CSF diversion. Concepts in Neurosurgery.
Hydrocephalus (ed) R.Michael Scott. 1990;3(5),47-65.
22.
Hanekom WA. Yagev R. Cerebrospinal fluid snunt infections. Adv.
Pediatr Infect Dis 1996;11,29-54.
23.
Mutluer S. Bacterial infections of the central nervous system. İn: Choux
M, Di Rocco C, Hockley AD (eds)Pediatric Neurosurgery (1st ed)
1999;31,617-636.
24.
Pople IK, Bayston R, Hayward RD. Infection of cerebrospinal fluid
shunts in infants: a study of etiological factors. J Neurosurg 1992;77,2936
46
25.
Klein DM. Shunt infections. Concepts in Neurosurgery. Hydrocephalus
(ed) R.Michael Scott.1990;3(8),87-97.
26.
Choux M, Genitori L, Long D, et al. Shunt implantation: reducing the
incidence of shunt infection. J Neurosurg 1992;77,875-80.
27.
Kontny U, Höfling B, Gutjahr P, et. Al. CSF Shunt Infections in
Children. Infection 1993; 21,89-92.
28.
Kulkarni AV, Drake JM, Lamberti-Pasculli M. Cerebrospinal fluid
shunt infection: a prospective study of risk factors. J Neurosurg
2001;94,195-201.
29.
Güzelbağ E, Erşahin Y, Mutluer S. Cerebrospinal fluid shunt
complications. The Turkish Journal of Pediatrics 1997;39,363-71.
30.
Casey ATH, Kimmings EJ, Kleinlugtebeld AD, et. Al. The long-term
Outlook
for
Hydrocephalus
in
Childhood.
Pediatr
Neurosurg
1997;27,63-70.
31.
Vanaclocha V, Saiz-Sapena N, Leiva J. Shunt malfunction in relation to
shunt infection. Acta Neurochir 1996;138,829-34.
32.
Davis SE, Levy ML, McComb JG, et. Al. Does age or other factors
influence the incidence of ventriculoperitoneal shunt infections?
Pediatric Neurosurgery 1999;30,253-7.
33.
Bayston R, Leung TSM, Wilkins BM et al. Bacteriological examination
of removed cerebrospinal fluid shunts. J Clin Pathol 1983;36,987-90.
34.
Levitsky D, Mack LA, Nyberg DA. Fetal aquaductal stenosis diagnosed
sonographically: how grave is the prognosis? AJR 1995;164,721-30.
35.
Rekate HL, McCormick J, Yamada K. An analysis of the need for
shunting after brain tumor surgery. Concepts Pediatr Neurosurg
1991;11,39-46.
36.
Bierbrauer KS, Storrs BB, McLone DG, et. Al. A prospective,
randomized study of shunt function and infections as a function of
shunt placement. Pediatr Neurosurg 1990-91;16,287-91.
37.
Weprin BE, Swift DM. Complications of ventricular shunts. Lippincott
Williams&Wilkins 2002;7(3),224-42.
47
38.
Zemack G, Romner B. Seven years of clinical experience with the
programmable Codman Hakim valve: a retrospective study of 583
patients. J Neurosurg 2000;92,941-8.
39.
Tuli S, Drake J, Lamberti-Pasculli M. Long-term outcome of
hydrocephalus management in myelomeningoceles. Childs Nerv Syst.
2003;19(5-6),286-91.
40.
Boelens JJ, Tan W, Dankert J, et. Al. Antibacterial activity of
antibiotic-soaked
hydrocephalus
polyvinylpyrrolidone-grafted
shunts.
Journal
silicon
of Antimicrobial
elastomer
Chemotherapy
2000;45,221-4.
41.
Scott RM. Preventing and treating shunt complications. Concepts in
Neurosurgery. Hydrocephalus (ed) R.Michael Scott. 1990;3(11),115-21
42.
Mc Girt MJ, Zaas A,Fuchs HE, George TM, et al. Risk factors for
pediatric ventriculoperitoneal shunt infection and predictors of
infectious pathogens. Clin Infect Dis,2003;36,858-62.
43.
Nelson Textbook Of Pediatrics 17th edition,Behrman,Kliegman,Jenson.
44.
Odio c,McCracken GH, Nelson JD, CSF shunt infections in pediatrics:
a seven year experienceAm J Dis Child 1984;138,1103-1108.
45.
Turgut H. Santral Sinir Sistemi Şant Enfeksiyonları Klinik 2001
Adana:75.
46.
Jacquelyn G.Black Microbiology. Principles and Explorations 5th
ed.681-682,540-541.
47.
Baron ES, Peterson LR, Finegold SM, Bailey and Scott’s Diagnostic
Microbiology. St Louis: CV Mosby,1994;56,447-507,214-17.
48.
Allan RT, W.Michael S.Acute Meningitis; In Mandell GL, Bernett JE,
Dolin R,eds. Principles and Practise of Infectious Diseases 5th ed.New
York 2000;959-71.
49.
Allan RT, Brian W,W.Michael S.Brain Abscess. İn Mandell GL,
Bernett JE, Dolin R,eds. Principles and practise of infectious
Diseases.5th ed.New York 2000;1016-74.
50.
Fong IW. Staphylococcal central nervous system infections treated with
Cloxacillin. J Antimicrob Chemother.1983Dec; 12,607-612.
48
51.
CunhaBA, RistucciaAM. Clinicalusefulnes of vancomycin. Clin.
Pharm.1983;2,417-24.
52.
Pfausler B,Haring HP, Kampfl A,Wissel J,Schober M,Schmutzhard
E.CSF pharmacocinetics of intraventricular vancomycin in patients with
staf. ventriculitis associated with external Csf drainage. Clin. Inf. Dis.
1997;25,733-5.
53.
Latıf R,Dajanı AS, Ceftriaxone Difussion into cerebrospinal fluid of
children
with
menengitis.
Antimicrobial
agents
and
chemotherapy.1983;46-48.
54.
Segal-Maurer S,Mariona N,Qavi A,Urban C.Succesful treatment of
ceftazidime resistant K.pneumoniae ventriculitis with İV meropenem
and intraventricular polymyxin B:case report and rewiev. Clin. Infect.
Dis.1999;63,108-12.
55.
Lu CH, Chang WN, Chuang YC, Chang HW. Gram negative bacillary
meningitis
in
adult
post
neurosurgical
patients.
Surg.
Neurol.1999;52,438-43.
56.
Barsic B,Himbele J,Beus I,Schonwald S,Marton E,Lisic M.Entry of
ciprofloxacin into CSF during bacterial, viral andtubercoulous
menengitis. Neurol. Croat.1991;40,111-6.
57.
Turgut M,Alabaz D,erbey F,et al Cerebrospinal fluid shunt infections in
children Pediatr Neurosurg 2005;41,131-136.
58.
Wang KC, Lee HJ, Sung JN, Cho KB. Cerebrospinal fluıd shunt
infection in children; efficiency of management, rate of persistent shunt
colonization, and significance of’off-antibiotics’trial. Child Nerv Syst
1999;15,38-43.
59.
Agün B,Aktaş EG, Kaplan M,Arıcı L,Ventriküloperitoneal şant
komplikasyonları Fırat Üniversitesi Sağ. Bil. Dergisi2008; 22(2) ,69-72.
60.
Boran
BO,
Kızılçay
G,Bozbuğa
M,Ventriculoperitoneal
Shunt
Dysfunction. Türk Nöroşirürji Dergisi 2005, Cilt: 15 Sayı:2 (148-151).
61.
Hector EJ, Bradley Aggressive Management of Shunt İnfection;
Combined İntravenos and İntraventriculer Antibiotic Therapy for
Twelve or Less days. Pediatr Neurosurg 2008;44,(104-111).
49
62.
Kai Arnell, Per Enblad, Wester Tomas, Sjölın J.Treatment of CSF
Shunt İnfections in Children Using Systemic and İntraventricular
antibiyotic Therapy in Combination with externalization of the
ventricular catheter: efficacy in 34 consecutively treated infections. J
Neurosurg (3 Suppl Pediatrics 107) 2007;(213-219).
63.
John R,Kestle W,Hugh J,Garton L,William E,James M Drake, Abhaya
V,Kulkarnı V,Cochrane D,Walker L,Management of shunt infections: a
multicenter pilot study: J. neurosurg (3 Suppl Pediatrics )2006;105
,(177-181 ).
64.
Matthew J. McGirt, Aimee Zass, Herbert E,Timothy M,Keith K,Sexton
D. Risk factor for pediatric ventrikuloperitoneal shunt infection and
predictor of infectious pathologens. Clinical İnfectious Diseases
2003;36,858-862).
65.
Rachel T Schereffler, Andrew J.Schereffler, Robert R.Wittler. Treatment
of CSF infections: a decision analysis. Pediatr İnfect. Dis. 2002;21.632636.
66.
Cheng –Chou Lan, Tai-Tong Wong, Shu-Jen Chen, Muh-Lii Liang,
Ren-Bin Tang. Early diagnosis of ventriculoperitoneal shunt infections
and malfunctions in children with hydrocephalus. J Microbiol İmmunol
İnfect 2003;36,47-50.
67.
Stephen J. Haines, Shunt infection. J.Neurosurg(1 Suppl Pediatrics )
2007,106,13-14.
68.
Vinchon M,Dhellemmes P. Cerebrospinal fluid shunt infection: risk
factors and long –term follow –up. Childs Nerv Syst 2006; 22,692-697.
50