T.C. SAĞLIK BAKANLIĞI KARTAL KOŞUYOLU
YÜKSEK İHTİSAS EĞİTİM VE ARAŞTIRMA HASTANESİ
KOŞUYOLU KALP DAMAR CERRAHİSİ KLİNİĞİ
ATRİYAL FİBRİLASYONUN
ROMATİZMAL MİTRAL KAPAK
HASTALIĞINDA RADYOFREKANS
ABLASYON KATETERİ
KULLANILARAK CERRAHİ
TEDAVİSİ
DR. BÜLENT MERT
UZMANLIK TEZİ
İSTANBUL / 2006
1
İÇİNDEKİLER
ÖZET
4
ABSTRACT
7
GİRİŞ
10
GENEL BİLGİLER
12
1.
12
Tarihsel Gelişim
1.1. Aritmilerin cerrahi tedavisi
12
1.2. Atriyal fibrilasyonun cerrahi tedavisi
13
2.
15
Atriyal fibrilasyon ve cerrahi tedavi yöntemleri
2.1. Atriyal fibrilasyonun tanım ve sınıflaması
15
2.2. Atriyal fibrilasyonun epidemiyolojisi ve nedenleri
16
2.3. Atriyal fibrilasyonun patofizyolojisi
17
2.4. Atriyal fibrilasyon mekanizmaları ve cerrahi teknik ile ilişkisi
19
2.5.
22
Atriyal fibrilasyonun cerrahi dışı tedavisi
2.5.1. Farmakolojik tedavi
23
2.5.2. Elektriksel kardiyoversiyon
22
2.5.3. Pacemaker tedavisi ve kateter ablasyonu
24
2.6. Cerrahi tedavi teknikleri ve değişik enerji kaynakları ile ablasyon
24
2.6.1. COX MAZE III prosedürü ve modifikasyonları
24
2.6.2. Mikrodalga ablasyon
27
2.6.3. Kriyoablasyon
28
2.6.4. Lazer ablasyon
29
2.6.5. Ultrason ablasyon
29
2.7.
30
Radyofrekans ablasyon
2
MATERYAL VE METOD
35
1. Amaç
35
2. Hasta Seçimi ve Endikasyonlar
35
3. Unipolar ablasyon uygulaması
37
4. Bipolar ablasyon uygulaması
38
5. Postoperatif takip
40
6. İstatistiki Karşılaştırmalar
42
SONUÇLAR
43
TARTIŞMA
48
KAYNAKLAR
51
ŞEKİLLER
64
3
ÖZET
Atriyal fibrilasyon (AF) günümüzde en sık rastlanan uzun süreli bir aritmidir.
Atriyal fibrilasyon tüm nedenlere bağlı mortaliteyi ve kardiyovasküler hastalığa bağlı
mortalite ve morbiditeyi (ani ölüm, kalp yetmezliği, tromboembolik komplikasyonlar,
hastanede yatış süresinde uzama, tedavi maliyetinde artış, yaşam kalitesinde azalma)
önemli ölçüde arttırmaktadır. Diğer kardiyovasküler rahatsızlıklar giderildikten sonra
bile AF ölüm açısından önemli bir risk faktörüdür. Büyük bir kısmı organik kalp
hastalığıyla (koroner arter hastalığı, kalp kapak hastalığı, konjestif kalp yetmezliği ve
hipertansiyon) ilişkili iken yaklaşık % 31’inde altta yatan bir kalp hastalığı yoktur. Dr
Cox ve arkadaşları tarafından geliştirilen ve sol atriyal izolasyon prensibine dayanan
COX- MAZE III prosedürü altın standart olmuştur. Bu yöntemin yüksek başarısına
rağmen tecrübe gerektirmesi, invaziv olması, uzun sürmesi nedeniyle aynı prensiple
daha pratik yöntemler kullanılması amaçlanmış ve değişik enerji kaynakları kullanılarak
tedavi
yöntemleri
geliştirilmiştir.
Bu
amaçla
kriyoablasyon,
mikrodalga,
elektrokoterizasyon, ultrason, lazer ve radyofrekans ablasyon ile çalışmalar yapılmıştır.
Bu enerji kaynakları arasından en sık kullanılanlar uygulama kolaylığı ve geniş bilgi
birikimi nedeniyle kriyoablasyon ve radyofrekans ablasyondur.
Bu çalışmanın amacı kronik atriyal fibrilasyonu olan, açık kalp cerrahisine aday,
romatizmal mitral kapak hastalarında intraoperatif olarak radyofrekans ablasyon ile sinüs
ritmini tesis etmek ve böylece atriyal fibrilasyonun olası mortalite ve morbiditesini en
aza indirmek, hastaların yaşam kalitesini arttırmak ve tedavi maliyetini azaltmak,
4
kulandığımız radyofrekans ablasyon kateterlerinin etkinliğini ve güvenilirliğini
denetleyerek klinikte yaygın kullanımını sağlamaktır.
Çalışmamıza romatizmal mitral kapak hastalığı olan ve bu amaçla açık kalp
ameliyatı uygulanacak atriyal fibrilasyon ritminde olan 25 hasta dahil edildi. Ablasyon
işlemi standart kardiyopulmoner bypass altında, kros klemp sonrası primer cerrahi
girişimden (rekonstriksiyon, replasman vs.) önce cerrahi Maze prosedürü prensipleri
esas alınarak uygulandı. Onbir hastaya bipolar, 14 hastaya monopolar ablasyon
uygulandı. Kardiyopulmoner bypass (KPB) çıkışında 21 hasta normal sinüs ritmine
dönmüşken, 2 hasta AF’de, 1 hasta atriyal fibroflatter ritminde, 1 hasta nodal ritimde idi.
Taburcu olurken 16 hasta (% 64) sinüs ritminde, 8 hasta (% 32) AF’de ve 1 hasta da (%
4) nodal ritimdeydi. Post operatif 3. ayda yapılan kontrolde toplam 19 hasta (% 76)
normal sinüs ritmine dönmüştü 4 hasta (% 16) halen AF’de, 1 hasta (% 4) fibroflatter
ritminde 1 hasta da (% 4) nodal ritimde idi. Erken dönemde mortalite ve morbidite
gözlenmedi. Bir hastaya postoperatif 8. ayda kalıcı pacemaker implantasyonu uygulandı..
Sonuç olarak erken dönemde atriyal fibrilasyonun
radyofrekans ablasyon
yöntemiyle tedavisinde elde edilen başarı yüzdesi tatmin edici düzeydeydi. Bu yöntem,
uygun hasta profili seçildiğinde ve titiz bir uygulamayla hastalar bir protokole göre takip
edildiğinde başarılı, güvenle uygulanabilen ve uzun dönemde hasta yaşam kalitesini
arttıran, tedavi maliyetini azaltan etkili ve kolay uygulanabilir bir prosedürdür.
5
ABSTRACT
Atrial fibrillation (AF) is a long lasting arryhthmia and is the most
frequently encountered arryhthmia nowadays. Atrial fibrillation significantly
increases both total mortality rates and mortality and morbidity related to
cardiovascular
disease
(sudden
death,
heart
failure,
thromboembolic
complications, prolonged duration of hospital stay, increased cost, decreased
quality of life). Even after all cardiovascular pathologies have been cured, AF still
remains as a significant risk factor of mortality. Although in most of patients AF
is related to an organic heart disease such as coronary artery disease, heart valve
disease, congestive heart failure and hypertension, in about 31% of cases no
underlying heart disease is present. COX- MAZE III procedure, created by Dr
Cox et al., is based on the principle of left atrial isolation and has become the gold
standart for surgical treatment of AF. Although this procedure has a high rate of
success, it is highly invasive, requires experience and duration of procedure is
quite long. For these reasons, new more practical procedures using the same
principle but different sources of energy have been developed. Studies including
cryoablation,
microwave,
electrocauterization,
ultrasound,
laser
and
radiofrequency ablation have been performed. Among these energy sources,
radiofrequency ablation and cryoablation have been used most frequently due to
the ease of use and a broad spectrum of knowledge on these sources.
6
The chief aim of this study is to restore sinus rhythm by use of
radiofrequency ablation intraperatively in patients with rheumatic mitral valve
disease who undergo open heart surgery and has chronic atrial fibrillation. Also
we aimed to reduce the mortality and morbidity related to AF, to increase the
quality of life and to decrease cost of medical treatment by achievement of sinus
rhythm. We tried to achieve more common use of radiofrequency ablation
catheters by thorough testing of efficacy and safety of them.
Our study included 25 patients with rheumatic mitral valve disease who
underwent open heart surgery and had chronic atrial fibrillation. The ablation
procedure was performed with standart cardiopulmonary bypass after aortic cross
clamping and before the main surgical intervention (valve reconstruction or
replacement). The ablation procedure was based on the same principles as surgical
Maze procedure. Bipolar ablation was performed in 11 patients whereas
monopolar ablation was performed in 14. Upon cessation of cardiopulmonary
bypass normal sinus rhythm was restored in 21 patients whereas AF was
persisting in 2 patients. One patient had atrial fibroflutter and one had nodal
rhythm. On discharge, 16 patients (64 %) had sinus rhythm, 8 (32 %) had atrial
fibrillation and 1 (4 %) had nodal rhythm. On postoperative third month 19
patients (76 %) were in normal sinus rhythm. Atrial fibrillation was present in 4
patients (16 %), atrial fibroflutter was present in one (4 %) and nodal rhythm was
present in one (4%). We didn’t observe any early morbidity and mortality.
Permanent pacemaker implantation was performed in one patient in postoperative
8th month.
7
We had satisfactory early results with radiofrequency ablation for
treatment of atrial fibrillation. This procedure is a successful, safe, easily
performed and effective method which increases quality of life and reduces costs
of treatment. It is important to choose patients suitable for this treatment and
follow a standart protocol carefully.
8
GİRİŞ
Atriyal fibrilasyon (AF) toplumda sık rastlanan, uzun süreli bir ritim
bozukluğudur. İlk olarak 1909 yılında Lewis tarafından tanımlanmıştır (1). Genel
popülasyonda görülme sıklığı % 0.4 ila % 2 iken bu oran 60 yaş üstünde % 10’a
ulaşmaktadır. Mitral kapak için ameliyat edilecek hastalarda bu oran % 30 ila %
84 arasında, koroner kalp hastalığı nedeniyle opere edilecek olgularda ise % 5
olarak bildirilmiştir (2). Kalıcı AF görülen kişilerin büyük bir çoğunluğunda altta
yatan bir kardiyovasküler hastalık olmasına rağmen, yaklaşık % 31’inde bu durum
görülmemektedir (3). Kalıcı AF tüm nedenlere bağlı mortalitenin ve
kardiyovasküler
hastalığa
bağlı
mortalitenin
ikiye
katlanması
ile
ilişkilendirilmiştir (3). Diğer kardiyovasküler rahatsızlıklar giderildikten sonra
bile AF ölüm açısından önemli bir risk faktörü oluşturmaktadır (4). İnme riskini 5
ila 7 kat arttırmaktadır ve bütün inmelerin % 15’inden sorumlu tutulmaktadır.
Ayrıca sağlık harcamalarında önemli bir maliyet artışı getirmektedir (5). Atriyal
fibrilasyon bu
derece yaygın olmasına rağmen uzun süre medikal tedavi
denenmiş fakat bunda istenen başarı düzeyine ulaşılamamıştır; bazı yayınlarda %
50 ila % 84 başarısızlık oranı bildirilmiştir (6). Birçok AF hastası sistemik emboli,
hemodinamik dengesizlik, çarpıntı ve baygınlık hissi gibi akut fiziksel
rahatsızlıkların yanı sıra antiaritmik ve antikoagülan tedaviye bağlı diğer birçok
yan etkiye maruz kalmaktadırlar. Bu nedenle AF’yi düzeltmek için düşük riskli,
minimal düzeyde invaziv ve maliyeti düşük yöntemlerin geliştirilmesi büyük
önem taşımaktadır. Bu amaçla değişik cerrahi teknikler (sol atriyal izolasyon
prosedürü, His düğümünün kateter ablasyonu, koridor prosedürü, pulmoner
9
düğme izolasyonu, atriyal kompartman operasyonu vb.) geliştirilmiştir (7). Son
olarak James Cox ve arkadaşları (8) tarafından geliştirilen ve daha sonra iki kez
modifiye edilen ‘‘MAZE III Prosedürü’’ % 100’e yakın başarı oranı ile bu konuda
altın standart olmuştur. Atriyal fibrilasyonun tedavisinde amaç sadece ritmin
sinüse döndürülmesi değildir. Atriyo-ventriküler senkronizasyonun ve atriyal
transport fonksiyonunun yeniden sağlanması da en az onun kadar önemlidir.
MAZE III Prosedürü’nün bu konudaki başarısının yüksek olmasına rağmen her iki
atriyumda muhtelif kesiler yapılarak yeniden dikilmesi (cut and sew) prensibine
dayanan bu işlem çok zaman alması, komplikasyon riskinin yüksek olması, çok
deneyim gerektirmesi ve oldukça komplike bir girişim olması
yaygın
nedenleriyle
kullanım alanı bulamamıştır. Bu nedenle kesip dikme işlemi sonucu
oluşturulan
lezyonların (skar) değişik enerji
kaynakları kullanılarak
oluşturulmasına çalışılmıştır. Bu amaçla radyofrekans (RF), mikrodalga, lazer,
bipolar koter, kriyoablasyon vb. yöntemler denenmiştir. Günümüzde en yaygın
olarak radyofrekans ve kriyoablasyon kullanılmaktadır.
10
GENEL BİLGİLER
1.
TARİHSEL GELİŞİM
1.1. Aritmilerin cerrahi tedavisi
Aritmilerin tedavisi için ablasyon tedavisi kavramı, mekanizması ne olursa
olsun tüm aritmilerin, kalp içinde başlaması ve yayılması için anatomik bir
substrata bağımlı olduğu hipotezine dayanır. Klasik örnek, Wolf-Parkinson-White
sendromudur. Bu aritmi mekanizmasının ilerleyen cerrahi tekniklerle birlikte
tanınması, 1968’de Sealy tarafından yapılan ilk cerrahi ablasyon prosedürünün
uygulanmasına yol açmıştır (9). 1982’de Scheinman ve arkadaşları (10) ve
Gallagher ve arkadaşları (11) transvenöz elektrod kateterlerinden geçen yüksek
enerjili direkt akım şoklarının, atriyal fibrilasyonu olan hastalarda, tam kalp bloku
ve
iyi
kontrol
edilemeyen
ventriküler
yanıt
hızları
oluşturabileceğini
bildirmişlerdir. Son 20 yıl içinde kardiyak aritmilerin cerrahi tedavisinde önemli
gelişmeler kaydedilmiştir. 1980 yılından 1990’lı yılların ortalarına kadar cerrahi,
supraventriküler aritmilerin ve özellikle de WPW sendromunun tedavisinde ön
plana çıkmış, ancak daha sonra yerini perkütan tekniklere bırakmıştır. Aritmilerin
tedavisinde sadece farmakolojik ajanların yetersizliği, önemli yan etkilerinin
ortaya çıkması ve buna paralel olarak elektrofizyoloji alanındaki ilerlemeler bu
gelişmenin önemli nedenleri olarak kabul edilebilir. Elektrofizyoloji alanındaki
ilerlemeler sayesinde bir çok aritminin mekanizması daha iyi anlaşılmış, özellikle
operasyon sırasında kullanılan geliştirilmiş haritalama sistemleri cerrahi
sonuçların iyileştirilmesine önemli katkıda bulunmuştur. Bu bağlamda AF’nin
temel
mekanizmasında
yatan
fokal
11
tetikleme
ve
makro
re-entery
mekanizmalarının ortaya çıkarılması ile AF’nin cerrahi tedavisinde yeni
yaklaşımlar ortaya çıkmıştır. Günümüzde genel kabul edilen görüş, bir aritminin
cerrahi tedavisi için 4 önemli endikasyon olduğu şeklindedir.
1. Aritminin medikal tedaviye yanıtsız olması
2. Aritminin hastanın yaşam kalitesini ciddi şekilde düşürmesi, hayati tehlike
oluşturması
3. Ek kardiyak cerrahi girişimle beraber, ( örn. mitral kapak veya koroner bypass operasyonu ) eş zamanlı olarak aritmiye müdahale edilmesi
4. Daha önce denenmiş olan perkütan tekniklerin başarısız olması.
1.2
Atriyal fibrilasyonun cerrahi tedavisi
İlk olarak 1980 yılında Cox ve arkadaşları ‘sol atriyal izolasyon prosedürü’
nü tarif etmişlerdir (12). Bu prosedürde AF sol atriyum içerisine hapsedilirken,
kalbin diğer bölümleri sinüs ritmini sürdürmektedirler (şekil 1). Bu prosedür ile
kalıcı pacemaker ihtiyacı olmadan düzenli bir ventriküler ritm sağlanmış, aynı
zamanda kardiyak hemodinaminin de düzeldiği gözlenmiştir. Sol atriyum izole
olmuştur ve sol ventrikül ile senkron çalışmamaktadır. Buna rağmen sol ventrikül
sağdan gelen düzenli kardiyak debiye hemen adapte olur ve akımı buna senkron
bir şekilde olur. Kalp ritminin daha düzenli olması ve hemodinamide iyileşme
sağlanmasına rağmen, sol atriyum halen fibrile olduğu için sistemik emboli riski
devam etmektedir. 1982 yılında Scheinman (10) ‘his düğümünün kateter ile
ablasyonu’ yöntemini başlattı. Bu yöntemde supraventriküler aritmi atriyumlara
hapsedilmekte, ventriküler ritim kalıcı pacemaker ile sağlanmaktadır (şekil 2).
Kalp hızı kontrol altına alındığı bu yöntemde atriyoventriküler senkronizasyon
kaybına bağlı hemodinamik bozukluk ve sistemik emboli riski devam etmektedir.
12
1985 yılında Guiraudon (13), AF cerrahi tedavisinde kalıcı pacemaker
gerektirmeyen ‘koridor prosedürü’nü geliştirmiştir. Bu prosedürde, atriyal septum
içerisinde sino-atriyal düğümü ve atriyo-ventriküler düğümü de bulunduran bir
bant, yani koridor oluşturularak sino-atriyal düğümün ventrikülleri uyarmasına
izin verilir (şekil 3). Bu prosedürde kalp kontrol altına alınsa da hemodinamik
düzelme sağlanmamakta ve sistemik emboli riski devam etmektedir. Yapılan tüm
bu çalışmalar AF’nin günümüz tedavi prosedürlerine ışık tutmuş ve gelişen
teknolojinin de yardımıyla cerrahi tedavide bir çok yeni yöntem geliştirilmiştir.
13
2.
Atriyal fibrilasyon ve cerrahi tedavi yöntemleri
2.1.
Atriyal fibrilasyon tanım ve sınıflaması
Atriyal fibrilasyon atriyumların normal sinüs ritminin kaybolmasına yol
açacak şekilde hızlı ve düzensiz aktivasyonudur. AF’de, atriyum duvarı kendi
içinde bölgesel değişimle birlikte ortalama 400-600 kez kasılır ve ventrikül hızı
atriyal
aktiviteyle
olan
etkileşimiyle
ve
atriyoventriküler
nodun
filtre
fonksiyonuna göre 100 ila 160 atım/dakika arasında değişir. Elektrokardiyografik
olarak, değişik yükseklik ve morfolojide, küçük ve düzensiz ‘f’ dalgaları ve
düzensiz QRS kompleksiyle karakterizedir. Klinik görünümlerini sınıflamada;
akut, paroksismal, intermitan, kalıcı ve sürekli gibi sıfatlar kullanılmış fakat bu
tanımlamaların
birbiriyle
çelişen
belirsiz
ifadeler
olması
çalışmaların
karşılaştırılmasını ve tedavinin değerlendirilmesini zorlaştırmıştır. Bu yüzden
American College of Cardiology / American Heart Association / European
Society of Cardiology topluluklarının ortak girişimi AF sınıflandırması için açık
kesin bir terminoloji önermiştir (14). Sınıflama AF’nin ilk tespit atağı ile
başlamaktadır. Eğer bir hasta iki veya daha fazla atağa sahipse, AF rekürren
(tekrarlayan) olarak kabul edilmektedir. Rekürren AF; paroksismal, persistan
(inatçı) ve permanent (kalıcı) olarak tanımlanmaktadır. Paroksismal AF yedi gün
veya daha kısa sürmektedir ve kendiliğinden ortadan kalkmaktadır. Persistan AF
kendiliğinden ortadan kalkmamaktadır ve normal sinüs ritmini yeniden
kazanabilmek için elektrik veya farmakolojik kardiyoversiyon gerektirmektedir.
Permanent AF ise, kardiyoversiyondan sonra bile sinüs ritminin sağlanamadığı
veya hastanın ve doktorun sinüs ritmini geri kazanmak için daha fazla çaba
göstermeye karar aldıkları bir rahatsızlıktır.
14
2.2. Atriyal fibrilasyonun epidemiyolojisi ve nedenleri
Atriyal fibrilasyon, en sık görülen sürekli kardiyak ritim bozukluğudur ve yaşlı
nüfusun artması ile birlikte sıklığı artmaktadır, (4). Framingham çalışmasında, 22
yaşın üzerindeki kişilerde, AF insidansı %2 olarak saptanmıştır. Genel
popülasyonda görülme sıklığı %0.4 ila %2 iken bu oran 60 yaş üstünde %10’a
ulaşmaktadır. Atriyal fibrilasyon, hem kardiyak, hem de nonkardiyak hastalıkta
oluşabilir veya herhangi bir hastalık olmaksızın görülebilir. Gelişmiş ülkelerde,
hipertansif kalp hastalığı, AF’si olan hastalarda altta yatan en sık hastalıktır ( bazı
çalışmalarda, vakaların %50’sinden sorumludur) (18). Kapak hastalığı, atriyal
fibrilasyonun önemli bir nedenidir çünkü kronik AF’lu hastalarda bunun varlığı,
tromboemboli riskini önemli derecede arttırmaktadır. Mitral stenozu ve atriyal
fibrilasyonu olan hastaların %20 kadarında, embolik olaylar gelişir ve bunlar en
sık olarak ( vakaların %60-75’inde) serebral dolaşımı etkiler. Mitral stenozu olan
hastalar arasında, felç ve tromboemboli riski, atriyal fibrilasyonlularda sinüs
ritminde olanlara göre 3-7 kat fazladır. Atriyal fibrilasyon en sık romatizmal kalp
hastalığı ile birliktedir. Romatizmal kalp hastalığı olan 1100 hastada yapılan
çalışmada en yüksek atriyal fibrilasyon sıklığı (%70) mitral stenozu, mitral
yetmezliği, ve triküspit yetmezliğinde görülmüş ve izole mitral stenozu olanların
%29’unda, izole mitral yetmezliği olanların %16’sında ve her ikisinin birlikte
olduğu hastaların %52’sinde tespit edilmiştir (19). Mitral kapak hastalığı ile
kronik AF’nin birlikte olduğu durumlarda, sadece kapağa yönelik cerrahi girişim
sonrası, olguların %80’inden fazlasında AF’nin sebat ettiği görülmüştür (20).
Melo tarafından yapılan bir çalışmada ise ameliyat sonrası spontan sinüs ritmine
dönüş %8 olarak bildirilmiştir (21).
15
Koroner kalp hastalığı olanlarda, kalp yetmezliği veya hipertansiyon gibi
komplike edici faktörler olmadığında, AF gelişme riski oldukça düşüktür. Akut
miyokard infarktüsü olan hastalarda AF genellikle ilk 24 saat içinde oluşur ve
önceden AF hikayesi yoksa kendi kendini sınırlar. Geçici AF’nin nedenleri
arasında; kalp cerrahisi, tiroid hastalığı, alkol, kardiyomiyopati, ailesel nedenler,
KOAH, elektrolit dengesizliği sayılabilir. Bazen de AF için; EKG, fizik muayene,
telekardiyografi ve ekokardiyografide tespit edilen yapısal bir kalp hastalığı
yoktur. Bu durumda AF, ‘lone’(yalnız) olarak adlandırılır. Lone AF görülme
sıklığı yaklaşık %2 ile %31 arasındadır (22). Lone AF sebebinin atriyumlar
içerisinde bulunan fibrotik alanlar, kalbin otonomik sinirsel uyarılara aşırı
duyarlılığı veya lokal atriyal miyokardit olabileceği öne sürülmüştür (23). Atriyal
fibrilasyon mortalite ve morbiditeyi önemli oranda arttırmanın yanı sıra hastaların
yaşam kalitesini önemli ölçüde bozmakta ve sosyoekonomik olarak önemli bir
yük getirmektedir. Dolaşım sistemi ile ilgili hastaneye yatışların yaklaşık %10
aritmi nedeniyledir ve bunun büyük kısmını AF ve atriyal flatter oluşturmaktadır
(24). AHA verilerine göre ABD’de yıllık ortalama 3.6 milyar dolar AF tedavisi
için kullanılmaktadır (25).
2.3.
Atriyal fibrilasyonun patofizyolojisi
Atriyal fibrilasyonun klinik belirtileri, atriyal sistolik fonksiyonun kaybına
ve düzensiz ventriküler yanıta bağlıdır. Atriyal sistolik fonksiyon kaybı, kalbin
hemodinamik fonksiyonunda bozukluğa yol açar ve normal kişilerde kalbin atım
hacminde %10 azalmaya neden olur (yüksek ventriküler hızlarda daha da fazla
azalır). Artan yaş ile sol ventrikül sistolik ve diyastolik fonksiyonunda azalma
meydana geldiğinden atım hacmindeki azalma %30 veya daha fazladır. Bunun
16
yanı sıra düzensiz ventrikül hızları ventrikülün suboptimal şekilde dolmasına
neden olur ve kalp debisinin daha da azalmasına neden olur. İyi kontrol
edilemeyen ventrikül hızları ile birlikte olan AF’nin kardiyoversiyonu, genellikle
sol ventrikülün ejeksiyon fraksiyonunu ve egzersiz kapasitesini düzeltir fakat bu
düzelme prosedür sonrası yavaş yavaş olur. Atriyal sistolik fonksiyon kaybı, sol
atriyum içinde staza neden olur ve intra-atriyal trombüs oluşumuna ve bunun
neticesinde felç ve tromboemboli riskinde artışa neden olur. Sol atriyum içinde
staz oluşması, hiperkoagülasyon durumunu gösteren ve pıhtılaşma faktörleri ile
endotel ve trombosit fonksiyonunu içeren hemostatik bozukluklarla ilişkili
bulunmuştur (15). Atriyal fibrilasyonu olan hastalarda, atriyal natriüretik peptit
düzeyleri de yüksektir ve bu durum, hemokonsantrasyon ve trombüs oluşumu
riskinde artışa katkıda bulunabilir (16). Atriyal fibrilasyon, hastaların yaklaşık
%20-50’sinde kalp yetmezliği ile ilişkilidir. AF, atriyal transport kaybı yoluyla
kalp yetmezliğine yol açabilir. Sol ventrikül hipertrofisinde olduğu gibi, diyastolik
disfonksiyon varsa, atriyal ‘kick’ kaybı ile birlikte AF gelişmesi, kalp
yetmezliğine yol açabilir. Mitral stenozlu hastalarda AF, hem atriyal kontraksiyon
kaybı, hem de diyastolik dolma süresinde kısalma ile kalp yetmezliğine katkıda
bulunur. Kontrol edilemeyen yüksek kalp hızları da, uzun sürdüğünde,
miyokardiyumda, ilerleyici sol ventrikül dilatasyonuna ve sol ventrikül sistolik
fonksiyonunda azalmaya yol açabilen ultrastrüktürel ve mikroskopik değişiklikler
oluşturur; buna taşikardinin indüklediği kardiyomiyopati denir (17). Kronik kalp
yetmezliği olan ve sinüs ritminde olan bir hastada, intrakardiyak basınçların
yükselmesi, atriyal gerilme ve dilatasyona yol açar, AF gelişmesine ve
tekrarlamasına zemin hazırlar.
17
2.4. Atriyal fibrilasyon mekanizmaları ve cerrahi teknik ile ilişkisi
Atriyal fibrilasyon patogenezi tam olarak anlaşılamamış bir aritmidir (26).
Ektopik fokusun tekli dolaşım yeniden girişi ‘reentry’ ve çoklu dolaşım yeniden
girişi rahatsızlığın başlamasında ve devam etmesinde rol oynamaktadır (27). Son
zamanlarda karşı çıkılsa da çoklu dolaşım yeniden girişi 50 yıl boyunca AF’nin
dominant kavramsal modeli olmuştur. Bilgisayar simulasyonu kullanarak Moe ve
ark (28) AF sırasında çoklu gezinen dalgaların (multiple wandering wavelets)
bulunduğunu ortaya koyan bir model geliştirdiler. Atriyal fibrilasyon, “elektriksel
remodeling” ismi verilen bir süreç yoluyla kendi kendisini sürdürür. Hayvan
modellerinde ve klinik deneylerde gösterilmiş olduğu gibi, atriyal fibrilasyon,
‘atriyal fibrilasyonun atriyal fibrilasyonu doğurduğu’ bir dizi elektrofizyolojik
değişikliklere neden olur. Atriyal fibrilasyon periyotlarına yanıt olarak, atriyal
refrakter süre kısalır (daha uzun sikluslarda orantılı olarak daha fazla etki görülür).
Tek ekstra uyarı ile atriyal fibrilasyonun yeniden başlatılması kolaylaşır.
Tekrarlayan ataklar, aritmi kalıcı olana kadar her atağın daha uzun sürmesi ile
sonuçlanır. Sinüs düğümü fonksiyonu da baskılanır. Bütün bu değişiklikler, sinüs
ritminin yerine konmasından sonra zaman içinde geri dönüşür. Cox Maze
prosedürü, bu dalgaları içeren reentrant ‘yeniden girişli’ dolaşımları kesmek üzere
tasarlanmıştır. Allessie (29), AF’nin atriyumda aritminin ‘ehlilleştirilmesi’ ile
sonuçlanan bir elektrofizyolojik ve yapısal değişiklik döngüsü başlattığını
gözlemleyerek AF’nin anlaşılmasını bir sonraki aşamaya taşımıştır. Yani AF,
AF’nin devam ettirilmesini sağlayan elektriksel bir yeniden modellemeye neden
18
olmaktadır (29). Bu nedenle, AF’nin süresinin tedavinin seçimini ve başarısını
etkilemesi muhtemeldir.
AF’nin bir substrat ve tetikleyici gerektirdiği yönünde genel bir uzlaşma
vardır (30). Substrat atriyal bir anomalidir (genellikle inflamasyon veya fibrozis)
ve AF’nin gelişimini destekleyen atriyal elektriksel fonksiyon bozukluğuna yol
açar (27). Tetikleyiciler arasında atriyal ektopik fokus, atriyum duvar
tansiyonunda değişiklikler ve otonom tonusda değişiklikler bulunmaktadır.
Substratın ve tetikleyicinin değişiklik göstermesine rağmen, deneysel ve klinik
kanıtlar pulmoner venlerin ve sol atriyumun AF’yi başlatmadaki ve devam
ettirmedeki önemini işaret etmektedir (31-32).
Haissaguerre (33) paroksismal AF’nin vakaların %94’ünde pulmoner
venlerdeki ektopik atımlardan kaynaklandığını ortaya koymuştur. Bu, pulmoner
ven endotelyumundan sol atriyum endokardına doğru anatomik geçişle ilişkili
olabilir. Bu noktada farklı elektrik (iyonik farklılıklar) özelliklerine sahip iki
doku kesişmektedir ve bu da AF’nin gelişimine katkıda bulunabilir(33-34). Bu
gözlem paroksismal AF görülen hastalarda pulmoner venlerin önemini gözler
önüne sermesine rağmen, yine de aynı gözlem kalıcı ve sürekli AF’ye
uygulanamaz.
Kalıcı
ve
sürekli
AF’ye
gelince,
doğrudan
kanıtlar
bulunmamaktadır ancak klinik tecrübeler patogenezlerinde ve devam etmelerinde
posterior sol atriyumun ve muhtemelen de pulmoner venlerin rol oynadığını
göstermektedir. Harada (35) kalıcı AF görülen 10 hastada intraoperatif atriyal
aktivasyonu mapping (haritalama) ile gösterdi ve çoğu hastada sol atriyumun
elektriksel olarak aktivatör bir rol oynadığını gösterdi. Bununla birlikte, bu
hastalar ayrıca patolojik sağ atriyuma sahip olma eğiliminde idiler (36). Sürekli
19
AF ve mitral kapak hastalığı görülen hastaları tedavi eden Sueda (37-38); AF’yi
yaklaşık olarak %78 oranında düzelten yeni bir sol atriyal prosedür geliştirdiler.
Bu prosedür, dört pulmoner ven ağzını çevrelemeyi (izole etmeyi), sol atriyum
apendiksini kesmeyi ve oluşturulan lezyonu mitral kapak anulusuna doğru
ilerletmeyi içermektedir (Şekil 4).
20
2.5.
Atriyal Fibrilasyonun Cerrahi Dışı Tedavisi
2.5.1 Farmakolojik Tedavi
Atriyal fibrilasyonun farmakolojik tedavisinde üç ana hedef belirlenmiştir.
İlk amaç normal sinüs ritminin tesisi (kardiyoversiyon) ve bunun sürdürülmesidir.
Bu amaçla birçok famakolojik ajan (sınıf Ia ve sınıf Ic antiaritmik ilaçlar, digitalis,
verapamil, diltiazem, beta-bloker, sotalol, amiodaron) kullanılmış fakat pek azı
etkili bulunmuştur. Sınıf Ia antiaritmik ilaçlar (kinidin, disopiramid, prokainamid)
akut atriyal fibrilasyonun kardiyoversiyonunda etkili bulunmuştur. Sınıf Ic
antiaritmik ilaçlar (flekainid, propafenon) paroksizmal ve yeni başlangıçlı atriyal
fibrilasyonda etkilidir, kronik atriyal fibrilasyonda ise yapısal kalp hastalığı
olmayan hastalarda kardiyoversiyon amacıyla tercih edilebilir. Digoksin, betabloker ve kalsiyum kanal blokerleri ise kalp hızının kontrolü amacıyla tercih edilir.
Amiodaron ve sotalol ise son zamanlarda özellikle postoperatif atriyal
fibrilasyonun tedavisinde tercih edilmektedir. Farmakolojik kardiyoversiyonun
başarısını
etkileyen faktörler; altta yatan etyolojinin düzeltilmesi ve atriyal
fibrilasyonun süresidir. Atriyal fibrilasyon süresi kısa olan hastalarda (3 aydan
kısa), kardiyoversiyondan sonra sinüs ritminde kalma olasılığı, 12 aydan daha
uzun süreli AF’na göre iki kat daha fazladır (39). İki yıldan daha uzun süreli kalıcı
AF’nun çok azı sinüs ritmine döner. Genellikle paroksismal AF’de ve yeni
başlangıçlı AF’de etkilidir. İkinci amaç ise ventrikül hızının kontrolüdür.
Ventrikül yanıtını düzenleyerek hemodinamik düzelme sağlamak ve taşikardinin
indüklediği kardiyomiyopatiyi önlemektir. Bu amaçda çoğu kez başarı elde edilir
fakat atriyumlar halen fibrilasyondadır ve ventrikül doluşuna ve kardiyak debiye
katkısı yoktur ayrıca tromboemboli riski devam etmektedir. Son olarak
21
tromboembolinin önlenmesi amaçlanmaktadır. Bu amaçla antikoagülan tedavi
ömür boyu kullanılmalıdır.
Farmakolojik tedavideki düşük başarı düzeyi, tedavinin uzun sürmesi,
kullanılan ilaçların yan etkileri, hasta uyumsuzluğu ve artan tedavi maliyeti
nedeniyle yeni tedavi stratejilerinin geliştirilmesi bir ihtiyaç olmuştur.
2.5.2. Elektriksel Kardiyoversiyon
Elektriksel kardiyoversiyon, atriyal fibrilasyonu olan hastalarda, atriyal
miyokardiyumu repolarize ederek ve böylece organize iletiyi yerine koyarak sinüs
ritmini geri getirir. Başlangıçta asistolik bir periyottan sonra, sinoatriyal düğüm,
kardiyak bir pace-maker olarak rolünü devam ettirir. Eksternal elektriksel
kardiyoversiyon, sinüs ritmini tesis etmek açısından etkilidir, ama etkinliği %2090 arasında değişir (başarı oranı altta yatan etyolojiye göre). İnternal
kardiyoversiyon hem farmakolojik hem de eksternal kardiyoversiyonun başarısız
olduğu hastalarda denebilir. İnternal kardiyoversiyonun düşük ve yüksek enerjili
iki
formu vardır. Yüksek enerjili kardiyoversiyonda, sağ atriyal kavite içine
yerleştirilen kateter elektrod ile sırtta bulunan dağıtıcı elektrod arasına 200300J’lük bir şok verilir (40). Düşük enerjili kardiyoversiyonda ise, sağ atriyum
veya
koroner sinüse ve pulmoner artere yerleştirilen kateter elektrodlar ile
uygulanır (41). Bu iki yaklaşım, özellikle obez hastalarda, akciğer hastalığı
olanlarda ve standart transtorasik yaklaşımın başarısız olduğu hastalarda yararlıdır.
22
2.5.3. Pacemaker Tedavisi ve Kateter Ablasyonu
Atriyal fibrilasyonu olan hastalarda, pacemaker tedavisinin geleneksel
endikasyonları, bradikardi-taşikardi sendromu ile birlikte sinüs düğümü
disfonksiyonu ve AV tam bloktur. AV iletinin kalıcı bir pacemaker yoluyla
kateter ablasyonu, AF’li hastalarda, ventriküler hız kontrolünü sağlamak için etkili
ve yüksek düzeyde güvenilir bir yöntemdir. Fakat antikoagülan tedavi gereksinimi
devam etmektedir ve hemodinamik düzelmeye katkısı yoktur (42). Kateter
ablasyonu kullarak AF’nin ortadan kaldırılması zor bir stratejidir ve oldukça
deneyim gerektirmektedir.
2.6.
Cerrahi Tedavi Teknikleri ve Değişik Enerji Kaynakları ile Ablasyon
2.6.1. COX MAZE III Prosedürü ve Modifikasyonları
Cox maze III ameliyatı AF’nin tedavisinde altın standarttır. Cox ve ark.(43
44)
AF’nin patofizyolojisi ile ilgili deneysel ve klinik kanıtlara dayanan bir
prosedür
tasarlamışlardır.
Temel
prensip
fibrositlerin
elektrik
akımını
iletmediğidir. Sonuçları geliştirmek ve ameliyatı basitleştirmek üzere prosedürü
iki kez modifiye etmişlerdir ve ortaya Cox Maze III yöntemi çıkmıştır (45). Cox
Maze III ameliyatında, insizyonlar ve kriyolezyonlar, AF’nin çoklu reentrant
dolaşımlarını kesmek üzere stratejik şekilde gerçekleştirilir (Şekil 5 A, B).
Standart kardiyopulmoner bypass başladıktan sonra çalışan kalpte ilk olarak sağ
insizyonlar yapılır. Önce sağ atriyal apendiks ampüte edilir. Sağ atriyotomi,
apendiks anterior yüzünden inferior vena kavaya doğru atriyum ortasına dek,
posterior yüzünde ise triküspit kapağa dek ilerletilir. Diğer taraftan, yine sağ
atriyumda süperior vena kava ile inferior vena kava arasında krista terminalisin
23
arkasından giden, düz ikinci bir insizyon yapılır. Bu insizyonun tam ortasından
başlayan ilave bir insizyon triküspit kapak anülüsüne doğru yönlendirilir ve
anülüse kadar olan mesafe kriyoablasyon ile tamamlanır. Kardiyopleji ile
kardiyak arrest sağlandıktan sonra mitral kapak ameliyatlarında olduğu gibi sağ
pulmoner venlerin hemen önünden (Waterson Oluğu) sol atriyotomi yapılır. Sol
atriyotomi alt ve üst pulmoner venlere uzatıldıktan sonra venlerin sol tarafı da
kriyoablasyon yapılarak dört pulmoner venin birlikte etrafında dairesel ileti bloğu
oluşturulmuş olur. Buradan bu çember kriyoablasyon ile mitral kapak anülüsüne
birleştirilir. Ardından sol atriyum apendiksi ampüte edilir ve apendiks ile dairesel
atriyotomi arasındaki atriyum dokusuna kriyoablasyon uygulanır. Daha sonra
süperior ile inferior vena kava arasının tam ortasından, atriyal septumda, fossa
ovalise kadar bir insizyon yapılır. Buradan da triküspit kapak anülüsüne kadar
kriyoablasyon uygulanır. Tüm sol atriyal insizyonlar içeriden tek kat devamlı
dikiş ile kapatılır. Sol tarafın havası tahliye edildikten sonra aort klempi kaldırılır
ve kalp reperfüze olurken sağ atriyotomi kapatılır. Kalp ritmi geri döndükten
sonra kardiyopulmoner bypassa son verilir. Sağ ve sol insizyonlar en yaygın
reentrant dolaşımları keser ve sinüs uyarısını sinoatriyal noddan atriyoventriküler
noda belirli bir yol boyunca yönlendirir. Bu ana geçiş yolunun dışındaki “çoklu
çıkmaz sokaklar” tüm atriyal miyokardiyumunun elektriksel aktivasyonuna izin
verir. Cox Maze III, pulmoner damarları çevrelemeyi ve izole etmeyi ve sol
atriyal apendiksi kesmeyi içermektedir. Bu özellikler, AF’yi düzeltmek için diğer
araştırmacılar tarafından tasarlanan çoğu ameliyatta kullanılmaktadır. Bir çok
merkezde (37,38,46,47), Cox Maze III ameliyatındaki insizyonların ve
kriyolezyonların bazılarını içeren prosedürler uygulanmış ve rapor edilmiştir.
24
Bunlar parsiyel Maze prosedürleri olarak sınıflandırılır. Bu prosedürler, pulmoner
venlerin izolasyonu veya sol atriyal apendiksin eksizyonu da dahil olmak üzere
sol atriyum üzerine yoğunlaşmıştır (Şekil 6). Genellikle koroner sinüs, atrial
flutter riskini arttırmasına rağmen göz ardı edilmiştir (48). Kress ve ark. (49)
AF’nin intraoperatif ablasyonu için bir sol atriyal izolasyon paterni ortaya
koymuşlardır. Bu lezyon paterni sol ve sağ pulmoner venleri çiftler halinde izole
etmeyi, izole edilen bu bölümler arasında bağlantı oluşturmayı ve buradan da sol
atriyal apendikse doğru lezyon oluşturmayı
endokardiyal
hem
de
epikardiyal
olarak
içermektedir. Bu prosedür hem
uygulanabilir.
Genellikle
bu
basitleştirilmiş lezyonların oluşturulması için alternatif enerji kaynakları kullanılır.
Bu nedenle parsiyel Maze prosedürleri daha az zaman almaktadır (46, 50).
Cox ve ark. (44) , her türden Cox-Maze prosedürünü içeren en büyük hasta
serisini rapor etmiştir. Toplam 346 hastada operatif mortalite %2 idi. AF
hastaların %99’unda tedavi edilmiştir ve hastaların sadece %2’si uzun vadeli postoperatif antiaritmik ilaç tedavisine ihtiyaç duymuştur. AF’nin başarılı bir şekilde
düzeltilmesini mitral kapak hastalığının varlığı, sol atriyal büyüklük ve AF türü
(paroksismal / persistan) etkilememiştir. Geçici postoperatif AF yaygındı ve
hastaların %38’inde görüldü. Bu sorun, peroperatif dönemdeki kısa atriyal
refrakter döneme atfedildi ve uzun vadeli sonuçları ortadan kaldırmadı (56).
Hastaların %15’inde cerrahi operasyon sonrası pacemaker ihtiyacı duyuldu. Sağ
atriyal transport fonksiyonu hastaların %98’inde görüldü ve sol atriyal transport
fonksiyonunun görülme oranı da %93’tü (44). İnme yaygın değildi (57,58).
Diğer merkezler de Cox Maze III prosedürü ile ilgili sonuçlar yayınlamıştır
(59, 60). Genel olarak, etkinlikleri Cox Maze ve ark. tarafından rapor edilenlerden
25
daha düşük olmuştur. Cleveland Kliniği’nde ve Mayo Klinik’te AF’yi iyileştirme
oranı %90 civarında rapor edilmiştir (59,61). Ek organik kalp hastalığının varlığı
Cox ve arkadaşlarının çalışmalarında Cox Maze III prosedürünün etkinliğini
ortadan kaldırmamasına rağmen, diğer araştırmacılar düşük oranda başarı rapor
etmişlerdir. Çoğu seride, mitral kapak cerrahisinin Cox Maze III ile kombine
edilmesi hastaların % 75- 82’sinde AF’yi tedavi etmiştir (62,63,64,65). Kamata ve
arkadaşları (64,66) atriyal fibrilasyon dalgasındaki oynama genişliğinin (amplitüd)
ve sol atriyum çapının bu hastalarda yürütülen Cox Maze prosedüründen sonraki
sinüs ritmi tesisinin bağımsız prediktörleri olduğunu bulmuşlardır. Neden diğer
araştırmacıların sonuçlarının Cox ve arkadaşlarınınkinden düşük olduğu
belirsizdir.
Çeşitli gruplar parsiyel Maze prosedürlerinin sonuçlarını yayınlamışlardır
(36,37,46,47). Bu araştırmacılar hastaların %80’inde sinüs ritmini tesis etmişlerdir
(46,50). İnsizyon ve kriyolezyon paternindeki küçük varyasyonlar sonucu
etkilememiştir. Parsiyel maze prosedürleri sol atriyum kaynaklı AF’yi ortadan
kaldırabilmesine rağmen, sağ atriyum kaynaklı atriyal flatter riski halen devam
etmektedir (67,68,69). Bu prosedürlerden sonra atriyal flatterin ortaya çıkma
olasılığı %5-10’dur ve bunun kateter ile ablasyonu kolaydır.
2.6.2. Mikrodalga ablasyon
Termal zarar ve sonrasındaki skar formasyonu yolu ile iletim bloklarından
oluşan hatlar yaratmak için mikrodalga enerjisinden yararlanılmaktadır. Yüksek
frekanslı elektromanyetik (mikrodalga) enerji dokudaki su moleküllerinin
osilasyonuna neden olur ve elekromanyetik enerji kinetik enerjiye (ısı) dönüştürür.
26
Dokuda hasar oluşturma mekanizması radyofrekansta olduğu gibi ısı temellidir
(51). Mikrodalga ısıtma radyofrekansla ısıtmaya göre daha avantajlıdır çünkü
ısıtılan dokunun derinliği ve hacmi çok daha fazladır ve bu da transmural
lezyonlar için daha yüksek oluşum ihtimali anlamına gelir. Mikrodalga ısıtma
endokardiyal yüzeylerde yanıklar oluşturmaz ve bu da tromboembolizm riskini
azaltabilir (52). Mikrodalga sondalar koruyuculudur ve bu özellik epikardiyal
ablasyon sırasında önem arz etmektedir. Günümüzde mikrodalga tabanlı AF
ablasyonu için 2-, 4-, ve 10 cm’lik sondalar bulunmaktadır (53). Mikrodalga
enerjisi ile yaratılan lezyon tipleri radyofrekans ile yaratılanlar ile benzerdir ve
genellikle pulmoner damar izolasyonunu içerir. Mikrodalga ablasyonu yapılan
hastaların %80’inde sinüs ritmi tesis edilmiştir (53). Dünya çapında, bu türden
500’den fazla prosedür gerçekleştirilmiştir ve bunların yaklaşık %30‘u “off
pump”dır. Mikrodalga kateterin AF’nin intraoperatif
zamanlarda
kullanılmaya
başlaması
nedeniyle,
tedavisinde ancak son
uzun
vadeli
sonuçlar
bulunmamaktadır.
2.6.3. Kriyoablasyon
Kriyoablasyon, aritmi cerrahisinde yerleşik yöntemlerden birisidir ve Cox
Maze III prosedürünün önemli bileşenlerinden birisini oluşturur (43, 45). Diazot
monoksit tabanlı bir kriyosondanın atrial dokuya -60 derece 2 dakika süreyle
uygulanması transmural lezyon üretir ve bu da görsel olarak teyit edilebilir. Doku
bütünlüğü korunur ve böylece geride düz endokardiyal bir yüzey bırakır.
Uyguladıkları parsiyel Maze prosedüründe Sueda ve ark. (37, 38) lezyon
setini tamamlamak için kriyo-lezyonlar kullanmışlardır ve % 78 oranında başarı
27
bildirmişlerdir. Diğer araştırmacılar AF’yi tedavi etmek üzere pulmoner ven
izolasyonundan oluşan sınırlı sol atriyal kriyoablasyon uygulamışlardır ve %70
başarı elde etmişlerdir (70). Cox ve ark. (34,45) son zamanlarda yayınladıkları bir
raporda, Cox Maze III standart lezyon setinin kriyoproblar kullanılarak yeniden
üretildiği minimal invaziv bir yönteme yer vermişlerdir. Bu prosedür zorlayıcı ve
teknik açıdan zordur. En belirgin dezavantajları çok büyük donanım
gerektirmeleri, epikardiyal yüzeylere uygulanmasının zor olması ve uygulama
süresinin çok uzun olmasıdır. Bu probların zorluklarından birisi de sertliğidir;
bunula birlikte, gelecekte geliştirilecek esnek problar ve farklı şekillerdeki problar
bu sınırlamayı ortadan kaldıracaktır.
2.6.4. Lazer ablasyon
Lazer enerjisi yüksek enerjili optik dalgalardan oluşur. Dokular üzerindeki
etkisi direkt ısınma ile şok dalgalarının sebep olduğu hızlı hücresel patlamaların
oluşturduğu mekanik hasarın bir bileşimidir. Lazer tekniği ile keskin ve dar
ablasyon hatları oluşturulabilmektedir. Çünkü lazer ışınları dokuya direkt olarak
penetre olur ve ışının sınırları dahilindeki dokuyu ısıtırken lezyon minimal lateral
yayılım gösterir (54). Bu enerji kaynağının çok kuvvetli olması nedeniyle klinik
olarak çok yaygın kullanılmamaktadır.
2.6.5. Ultrason ablasyon
Titreşimsel bir enerji türüdür. Hücre zarlarını parçalar, fiziksel özelliklerini
değiştirir veya termal ısınmaya neden olur. Kardiyak jeneratörlerde, kullanılan
frekans aralığında oluşturduğu doku hasarı termal ısınma sonucudur. Oluşan
28
lezyonların sınırları belirli ve teorik olarak radyofrekans ile oluşanlardan daha
geniştir. Transdüserin kırılgan olması ve 100 dereceyi aşan sıcaklıklarda zarar
görebilmesi bir dezavantajıdır. Nekrotik doku varlığında ultrason emilim katsayısı
değişeceğinden lezyonun genişlik ve derinliği değişecektir (55).
2.7.
RADYOFREKANS ABLASYON
Radyofrekans, frekansı radyo bandında yer alan ve alterne eden elektrik
akımıdır. Radyofrekans yönteminde radyo bandında yer alan; 350kHz’den 1
MHz’e kadar alterne edilen ve dokuda ısı artışı meydana getiren radyofrekans
enerjisi kullanılır. Elektrik akımı kateter ucundaki verici kutup ile hastanın sırtına
yerleştirilmiş veya bipolar sistemde yine kateter üzerinde yer alan diğer alıcı
kutup arasında hareket eder. Geçen enerjinin büyük bölümü kateter ile
miyokardiyal dokunun temasta bulunduğu yüzeye iletildiğinden vücudun diğer
bölümleri etkilenmez. Bu etkileşim sonucu dokularda titreşim ısı enerjisine
dönüşür ve koagulasyon nekrozu oluşur (72). Yapılan çalışmalarda dokuyu 70 ila
80 derecede yaklaşık 1 dakika ısıtmanın 3 ila 6 mm derinlikte lezyon oluşturduğu
gözlenmiştir ki bu da bir transmural geçiş bloğu hattı oluşturmak için yeterlidir
(71). Radyofrekans ablasyon uygulaması için bir enerji jeneratörü ve probu olan
çeşitli sistemler geliştirilmiştir. Radyofrekans ablasyon 1980’lerin ortalarından bu
yana perkütan kateter aracılığıyla özellikle supraventriküler taşikardilerin
tedavisinde kullanılmaktadır. Ucu serum irrigasyonlu radyofrekans ablasyonu ilk
olarak 1988 yılında Wittkampf ve arkadaşları (73) tarafından kullanılmıştır. Bu
kateterin kronik AF’de intraoperatif olarak kullanımı ilk olarak 1995 yılında Sie
ve arkadaşları (74), daha sonra ise Melo ve arkadaşları (75) tarafından
29
gerçekleştirilmiştir. Monopolar sistemlerde, hasta deriye yerleştirilen (genellikle
sırt bölgesine) elektrik yüksüz bir elektrod ile topraklanır ve akım radyofrekanslı
kateterin ucundan akar ve dokuya temas noktasında ısıtır. Lokal olarak 100
derecenin üzerinde sıcaklıklar ortaya çıkarabilir ve bu da doku buharlaşmasına ve
yüzeyel yanmalara neden olabilir. Dokunun diğer kısımları temas bölgesi
ısındıktan sonra ısının diğer bölgelere aktarılmasıyla ısınır. Bu mekanizma lezyon
derinliğini sınırlayabilir, transmural lezyon oluşturmak için
aşırı
enerji
uygulamasına gerek duyulabilir. Serum soğutmalı sistemler ise yüzeyel
yanmaların etkisini azaltırken lezyon derinliğini arttırabilir. Değişik ablasyon
kateterlerinin etkinliğini araştıran Nagakawa ve arkadaşları (80), kuru ve serum
irrigasyonlu kateterleri karşılaştırdılar ve sonuç olarak kuru sistemde istenen
lezyon derinliğine ulaşmak için verilen enerji düzeyinde dokuda karbonizasyon
oluştuğunu, karbonize yüzeyin ısıyı diğer katmanlara iletmede dirençli olduğunu
ve bunun neticesinde tam kat lezyon oluşturmanın güç olduğunu ayrıca bu
karbonize yüzeyin tromboemboli için odak oluşturduğunu ve en geniş ve en derin
lezyonların serum irrigasyonlu kateter ile gerçekleştiğini gözlemlediler. Son
zamanlarda geliştirilen bipolar sistemde kontrollü ve kesin transmural lezyon
oluşturularak bu dezavantaj ortadan kaldırılır.
Cerrahi uygulamalar için çeşitli kateter tipleri geliştirilmiştir. Bunlar
arasında, esnek problar, rijit problar, kalem benzeri problar (serum ilaveli) ve
bipolar klemp gibi problardır. Problar endokardiyal veya epikardiyal uygulanabilir.
Her iki teknik de sürekli ve transmural lezyon oluşturabilir (71, 76). Epikardiyal
uygulama çalışan kalpte de yapılabilmektedir (77).
30
Radyofrekans ablasyon amacıyla çeşitli lezyon tipleri oluşturulmuştur (62,
71, 78). Bu lezyon tiplerinin tamamı pulmoner venlerin tamamen veya tama yakın
izolasyonunu, sol atriyum apendiksinin eksizyonunu veya dışlanmasını içerir.
Ayrıca sol pulmoner venler ile sol atriyum apendiksi arasında ve yine sol
pulmoner venler ile mitral kapak anulusu arasında lezyon oluşturarak iletinin
engellenmesini içerir. Sağ atriyal uygulamalar ise Cox Maze III prosedürüne
benzer şekilde yapılır (78,79) (Şekil 7). Sol atriyal uygulama ortalama 10-20
dakika sürmektedir. Bu süre Cox Maze III prosedürünü gerçekleştirmek için
gerekli 1 saatlik süreden oldukça kısadır (62, 71, 77, 81, 85). Bu lezyon tiplerinin
çeşitli olmasına rağmen AF’nin tedavi oranı %70 ila %80 arasında bildirilmiştir
(71,78, 81, 82, 83, 84). Tedavi edilen hastaların çoğu organik kalp hastalığına
sahipti ve ek olarak mitral kapak ameliyatı geçirmişlerdir. Bu hastalarda elde
edilen başarı hemen hemen Cox Maze prosedürüne yakındır ve sağ atriyumun
prosedüre dahil edilip edilmemesinden bağımsızdır (44, 59, 60). Peroperatif AF
yaygındır ve vakaların yaklaşık üçte ikisinde görülür (71, 84, 85). Hastaların
%30-40’nın AF ile hastaneden ayrılmasına rağmen, bir çoğu takip eden 3 ay
içinde sinüs ritmine dönmektedir. Bu nedenle AF ile taburcu, prosedürdeki
başarısızlığın endikasyonu değildir. Bazı araştırmacılar atriyal büyüklüğün
başarıyı etkilediğini bildirmelerine rağmen, bu bulgu diğer araştırmacılar
tarafından teyit edilmemiştir (62, 78). Atriyal transport fonksiyonu, sinüs ritmine
dönen hastaların %80-100’ünde görülmektedir (86, 87). Elde edilen bu başarı
radyofrekans ablasyona olan ilgiyi arttırmaktadır ancak oluşturulan lezyon tipi ve
prosedürün sadece sol atriyumu içermesi konusunda halen tartışmalar devam
31
etmektedir. Uygulamalar arttıkça ve bu konuda yeni veriler yayınlandıkça
prosedür daha yaygın hale gelecektir.
32
MATERYAL ve METOD
1.
Amaç
Bu çalışmamızda amacımız; kronik atriyal fibrilasyonu olan ve açık kalp
ameliyatına
aday
hastalarda,
intraoperatif
olarak
radyofrekans
ablasyon
uygulayarak, hastaları atriyal fibrilasyonun komplikasyonlarından korumak ve
aynı zamanda radyofrekans enerjisinin bu konudaki etkinliğini ve güvenilirliğini
denetleyerek tekniğin klinik uygulamalarda yaygın olarak kullanımını sağlamaktı.
2.
Hasta Seçimi ve Endikasyonlar
Hasta seçim kriterleri; kalıcı atriyal fibrilasyonu olması (en az 6 aydır AF
mevcudiyeti) ve romatizmal mitral kapak hastalığı nedeniyle ameliyat
endikasyonu bulunması idi. Bunun yanısıra endokarditi olan, öncesinde bilinen
hasta sinüs sendromuna sahip, sol atriyum duvarında kalsifikasyon olan, kardiyak
fonksiyonları uygun olmayan (EF <%25), bipolar uygulama için engel
oluşturabilecek reoperasyon ve ileri adhezyon olan hastalar çalışma dışında
bırakıldı. Atriyum çaplarının ileri derecede büyümesi ( sol atriyum > 7.2 cm); hem
atriyum duvarının ince olması hem de sinüs ritmine dönme olasılığının az olması
nedeniyle diğer bir kısıtlayıcı faktördü.
33
Tablo-1. Hastaların preoperatif demografik ve ekokardiyografik verileri.
Preoperatif değişken
Erkek : Kadın
7:18 (% 28 / % 72)
Ortalama yaş (yıl)
46.2 ± 10.6 (20-67)
Ortalama fonksiyonel kapasite (NYHA Sınıfı)
3.4 ± 0.64 (2-4)
Ortalama AF süresi (yıl)
3.7 ± 2.01 (1-8)
Hipertansiyon
6 (% 24)
Kronik obstrüktif akciğer hastalığı
4 (% 16)
Geçirilmiş mitral rekonstrüksiyon operasyonu
3 (% 12)
Situs İnversus Totalis
1 (% 4)
Şikayeti
Çarpıntı
14 ( %56)
Nefes darlığı
11 (% 44)
Ejeksiyon Fraksiyonu (%)
59.3 ± 8.4 (30-70)
Mitral kapak lezyonu
Mitral darlığı
13 (% 52)
Mitral yetmezliği
1 (% 4)
Miks hastalık
11 (%44)
Sol ventrikül diyastol sonu çapı (cm)
5.3 ± 0.7 (4.2-6.7)
Sol ventrikül sistol sonu çapı (cm)
3.5 ± 0.7 (2.3-5)
Mitral kapak alanı (cm2)
1.1 ± 0.1 (0.7-1.5)
Sol atriyum çapı (cm)
5.7 ± 0.9 (4.1-7.2)
Pulmoner arter basıncı (mmHg)
54.5 ± 12.2 (30-80)
34
Çalışmamızda 18 bayan ve 7’si erkek, toplam 25 hastaya radyofrekans ablasyon
yapıldı. Olguların tamamı kardiyoloji ve kalp-damar cerrahisi ortak konseyi kararına
göre operasyonuna karar verilmiş hastalardı. Çalışmaya alınan hastaların preoperatif
demografik verileri Tablo 1’de özetlenmiştir.
Hastaların tamamında romatizmal mitral kapak hastalığı mevcuttu. Üç hastaya
daha önce açık mitral komussürotomi ameliyatı uygulanmıştı. Operasyonlarda 19
hastaya mital kapak replasmanı, 6 hastaya mitral kapak rekonstrüksiyon teknikleri
uygulandı. Ek prosedür olarak 10 hastaya triküspit kapak rekonstriksiyon teknikleri
uygulanırken bir hastaya aort kapak replasmanı, bir hastaya aortik rekonstriksiyon
yapıldı. Dört hastada sol atriyal trombüs mevcuttu. Hastaların tamamında kalıcı atriyal
fibrilasyon mevcuttu.
Onbir hastaya bipolar, 14 hastaya ise unipolar radyofrekans
ablasyon yapıldı. Hastaların 20 tanesine sadece sol atriyal ablasyon uygulanırken 5
hastaya hem sol hem de sağ atriyal prosedür uygulandı.
5. Unipolar ablasyon uygulaması
Median sternotomiyi takiben, standart kardiyopulmoner bypass tesis edildi. Kross
klemp sonrası sol atriyotomi yapıldı. Endokardiyal ablasyon uygulamak için serum
irrigasyonlu Cardioblate ® Surgical Ablation Pen (Medtronic model 60813) kullanıldı.
Ortalama 10-15 saniye süreyle 25-30 Watt radyofrekans enerjisi kullanıldı (Şekil 8). Sol
atriyumda trombüs bulunan vakalarda trombektomi yapıldı. İlk önce sağ pulmoner
venler yarımay şeklinde lezyon oluşturarak her iki uçtan sol atriyotomi insizyonuyla
birleşecek şekilde izole edildi. (Şekil 9). Daha sonra sol pulmoner venler elips şeklinde
lezyon oluşturarak izole edildi. İzole edilen bu iki adacık düz bir hat ile birleştirildi
(Şekil 9). Daha sonra sol atriyum apendiksine ve mitral kapak posterior anulusuna sol
ven pulmoner adacığından düz bir hatla lezyon oluşturularak prosedür tamamlandı (Şekil
9). Daha sonra sol atriyal apendiksine internal ligasyon yapıldı. Ablasyon işleminden
35
önce dikiş materyali termal hasar görebileceği için işlem tamamlandıktan sonra mitral
kapakla ilgili prosedüre geçildi. Ablasyon öncesi çevre dokuların termal hasara
uğramaması için sol atriyum arka duvarı ile posterior perikard arasına kuru gazlı bez
kondu. Kaşektik hastalar ve sol atriyum duvarı ileri derecede ince olan hastalara
prosedür uygulanmadı.
Sağ atriyal uygulamada ise (Şekil 10 A) sağ atriyotomiyi takiben insizyonun her iki
ucundan vena kava inferior ve vena kava superiora doğru lezyon oluşturuldu. Daha sonra
sağ atriyum apendiksinden septal liflete doğru lezyon oluşturuldu. Posterior lifletten sağ
atriyum tavanına insizyonla birleşecek şekilde lezyon oluşturuldu (Şekil 10 B). Sağ
atriyotomi alt ucundan, fossa ovalisden geçecek şekilde koroner sinüs ostiumuna doğru
lezyon oluşturuldu, buradan da posterior liflete ve vena cava inferiora birer lezyon
oluşturularak ablasyon işlemi tamamlandı (Şekil 10 C). Apendiks ligatüre edildi ve
triküspid kapakla ilgili cerrahi prosedüre geçildi.
Kros klemp sonrası her hastaya 600-800mg/gün yükleme dozunda amiodaron
infüzyonu başlandı. Her hastaya geçici epikardiyal pacemaker teli yerleştirildi.
Dekanülasyonu takiben AF’ye giren hastalara internal elektromekanik kardiyoversiyon
uygulandı.
4. Bipolar ablasyon uygulaması
Bipolar uygulama için serum irrigasyonlu Cardioblate® BP2 Surgical Ablation
Device (medtronic model 60831) kullanıldı. Median sternotomiyi takiben standart
kardiyopulmoner bypass tesis edildi yapıldı, sol atriyum değerlendi. Trombüs bulunan
vakalarda
önce trombektomi yapıldı. Sol pulmoner venler eksplore edildi ve
36
serbestleştirildi, epikardiyal olarak bipolar ablasyon uygulanarak her iki pulmoner ven
ada şeklinde izole edildi (Şekil 11 A). Daha sonra sol atriyum apendiksine epikardiyal
ablasyon uygulanarak lezyon oluşturuldu. Bipolar kateterin bir ayağı epikardiyal
yüzeyde diğeri sol atriyum endokardiyal yüzünde olacak şekilde her iki sağ pulmoner
venlerin etrafında lezyon oluşturarak sol atriyotomi insizyonuyla birleştirildi (Şekil 11
B). Ablasyon işlemi tamamlandıktan sonra sol atriyal internal ligasyon yapıldı. Daha
sonra mitral kapakla ilgili prosedür tamamlandı. Kros klemp sonrası her hastaya 600800mg/gün yükleme dozunda amiodaron infüzyonu başlandı. Her hastaya geçici
epikardiyal pacemaker teli yerleştirildi. Dekanülasyonu takiben AF’ye giren hastalara
internal elektromekanik kardiyoversiyon uygulandı.
Tablo 2. Operatif veriler
Uygulanan Prosedür
Mitral kapak replasmanı
19 (% 76)
Mitral rekonstrüksiyon
6 (% 24)
Ek Prosedür
Aort kapak replasmanı
1 (% 4)
Aort kapak rekonstrüksiyon
1 (% 4)
37
Trikuspid kapak rekonstrüksiyonu
10 (% 40)
Sol atriyum trombektomi
4 (% 16)
Ablasyon
Bipolar (yalnız sol atriyal prosedür)
11 (% 44)
Unipolar
14 (% 56)
Yalnız sol atriyum
9 (% 64.2)
Sol/ Sağ atriyum
5 (% 35.8)
.
____________
AKK (dak)
75.2 ± 20.1 (38-110)
TPZ (dak)
101 ± 24.8 (62-150)
Hipotermi (C°)
29.6 ± 1.2 (27-32)
KPB çıkışı ritm
Sinüs
21 ( % 84)
AF
2 (% 8 )
Nodal
1 (% 4)
Fibroflutter
1 (% 4)
KPB çıkışı inotrop
5.
5 (% 20)
Postoperatif takip
Hasta yoğun bakım ünitesinde tam monitorize olarak izlendi. Ritim takibi 12
derivasyonlu
elektrokardiyografi ile yapıldı. Her hastaya postoperatif amiodaron
infüzyonu başlandı ve yoğun bakım ünitesinde hastalar ritim açısından tekrar
değerlendirildi. Bradikardi gelişen iki hastada amiodaron infüzyonu sonlandırıldı ve
geçici pacemaker desteği sağlandı. Elektrokardiyografide PR mesafesi uzayan hastalarda
38
amiodaron infüzyon dozu azaltıldı ve daha sık takip yapıldı. Postoperatif sinüs ritminde
olan ve yoğun bakımda AF ritmine dönen hastalara sedatize edilerek elektromekanik
kardiyoversiyon uygulandı. Hemodinamik problemi olmayan hastalar servis izlemine
alındı. Hastalar antikogulan ve antiaritmik tedavisi planlanarak taburcu edildi.
Antiaritmik olarak amiodaron tedavisinin en az üç ay süreyle kullanlması önerildi.
Taburcu sonrası ilk hafta ve ilk ay elektrokardiyografi ile takip edildi. Post operatif 3.
ayda ekokardiyografi ve elektrokardiyografi takipleri yapıldı.
Tablo 3. Postoperatif veriler
Yoğun bakımda kalma süresi (gün)
3.2 ±1.4 (1-7)
Hastanede kalma süresi (gün)
7.3±2.6 (4-15)
Drenaj miktarı (ml)
584±259
EKOKARDİYOGRAFİ
Ejeksiyon Fraksiyonu (%)
54.5 ± 10.1 (30-70)
Mitral kapak
Mak gradiyent (mmHg)
13.28±7.6 (0-34)
Mean gradiyent (mmHg )
5.32±2.9 (0-12)
Sol ventrikül diyastol sonu çapı (cm)
5.24± 0.7 (4-7.1)
Sol ventrikül sistol sonu çapı (cm)
3.63 ±0.5 (2.4-4.4)
Sol atriyum çapı (cm)
5.01 ±0.7 (3.9-6.5)
Pulmoner arter basıncı (mmHg)
38.8 ±11.3 (28-60)
39
6.
İstatistik Karşılaştırmalar
İstatistik analizler SPSS “13.0 for Windows®” programı (SPSS Inc., Chicago, III)
kullanılarak gerçekleştirildi. Devamlı değişkenler için ortalama ± standart sapma,
kategorik değişkenler için yüzdesel rakamlar verildi. Kategorik değişkenler arasındaki
farklar χ2 ve Fisher Exact testi ile; devamlı değişkenler arasındaki testler one-way
Anova testi ile değerlendirildi. Paired t test, sol atriyum çaplarındaki pre- ve postoperatif
değişiklikler için kullanıldı. P değeri < 0.05 ise anlamlı kabul edildi.
40
SONUÇLAR
Onbir
hastaya
bipolar,
14
hastaya
monopolar
ablasyon
uygulandı.
Kardiyopulmoner bypass (KPB) çıkışında 21 hasta normal sinüs ritmine dönmüşken, 2
hasta AF’de, 1 hasta atriyal fibroflatter ritminde, 1 hasta nodal ritimde idi. Yoğun bakım
izleminde
hastalar
tam
monitorize
edildi
ve
ritm
takibi
12
derivasyonlu
elektrokardiyografi (EKG) ile yapıldı. Postoperatif yoğun bakım takibinde KPB çıkışı
sinüs ritminde olan 21 hastadan 9 hasta AF’ye girdi. Bu hastalardan 5’ine
elektromekanik kardiyoversiyon uygulandı ve 4 hasta tekrar sinüs ritmine dönerken 1
hastada başarılı olunamadı. Dört hastaya farmakolojik kardiyoversiyon denendi fakat
başarılı olunamadı. Taburcu olurken 16 hasta (% 64) sinüs ritminde, 8 hasta (% 32)
AF’de ve 1 hasta da (% 4) nodal ritimdeydi. Kardiyoversiyon denenen ve başarılı
olunamayan hastanın postoperatif 3. aydaki kontrolünde normal sinüs ritmine döndüğü
gözlendi. Farmakolojik kardiyoversiyon denenen dört hastadan ikisi postoperatif üçüncü
aydaki
kontrolde
normal
sinüs
ritminde
idi.
Sonuç
olarak
elektromekanik
kardiyoversiyon uygulanan beş hastanın tamamı, farmakolojik kardiyoversiyon denenen
4 hastanın 2’si postoperatif 3. ayda sinüs ritminde idi. Postoperatif 3. ayda EKG ve
ekokardiyografi takibi yapıldı. Üçüncü ayda yapılan kontrolde toplam 19 hasta (% 76)
normal sinüs ritmine dönmüştü. 4 hasta (% 16) halen AF’de, 1 hasta (% 4) fibroflutter
ritminde, 1 hasta da (% 4) nodal ritimde idi. Yapılan istatiski değerlendirmede
postoperatif 3. aydaki ritim ile sol atriyum çapı, mitral kapak patolojisi, unipolar ve
bipolar uygulama, sağ atriyal uygulama karşılaştırıldı (Tablo 1, 2, 3, 4). Sonuçlar
arasındaki farklar istatistiki olarak anlamlı değildi. Sol atriyum çapı 5 cm’nin altında
olan hastalarda sinüs ritmine dönüş 5 cm’nin üzerinde olanlara göre daha fazla idi, fakat
41
toplam hasta sayısının yetersizliği nedeniyle sonuç istatistiki olarak anlamlı bulunmadı.
Hem sağ hem de sol atriyal uygulama yapılan hastalarda yalnızca sol atriyal uygulama
yapılanlara göre daha fazla sinüs ritmi elde edildi fakat hasta sayısı yetersiz olduğu için
istatistiki olarak anlamlı sonuç elde edilemedi. Preoperatif ve postoperatif diğer verilerle
yapılan değerlendirmede sinüs ritmine dönme oranına etkili faktör bulunamadı. Erken
dönemde bipolar ve monopolar uygulamaya bağlı komplikasyon görülmedi. Mortalite ve
morbidite izlenmedi. Kalıcı pacemaker ihtiyacı toplam bir hastada görüldü (%4). Bir
hastada postoperatif atrial fibroflatter gelişti (%4). Bu hastaya sadece sol atriyal prosedür
uygulanmıştı. AF ritminde taburcu edilen bu hasta postoperatif 8. ayda presenkopa yol
açan ve multiple pause atakları olan yavaş geçişli fibroflatter ritminde başvurdu ve
Holter tetkiki sonucunda kalıcı pacemaker implantasyonu uygulandı. Geç dönemde
meydana gelen bu komplikasyon bu prosedürün uygulandığı diğer kliniklerde görülen
kalıcı pacemaker gereksinim oranına yakındı. Atriyal fibrilasyonla taburcu edilen bir
hastada post operatif 2. ayda serebrovasküler olay gelişti ve bu hasta sağ hemiparezi ile
takip edilmektedir. Sosyokültürel düzeyi düşük olan bu hastada serebrovasküler olayın
muhtemel nedeni antikoagülan kullanımındaki düzensizliktir. Postoperatif sinüs ritminde
takip edilen bir hasta postoperatif 3. ayda mitral mekanik kapakta ileri dehissens ve
mitral yetmezliği nedeniyle reoperasyona alındı. Bu operasyon sonrası kalıcı tam blok
gelişerek kalıcı pacemaker implantasyonu uygulandı. Bu hastada kalıcı pacemaker
gereksinimin nedeni uygulanan prosedüre bağlı değildir. Reoperasyonda yapışıklıklar
nedeniyle mitral kapağa transeptal olarak yaklaşılmak zorunda kalınmıştır ve kalıcı blok
gelişmesinin
muhtemel
nedeni
atriyal
septuma
yapılan
insizyondur.
Mitral
rekonstriksiyon yapılan ve sinüs ritminde takip edilen bir hasta postoperatif 4. ayda
mitral yetmezliği ve akciğer ödemi ile reoperasyon planlanarak interne edildi. Hasta
42
yoğun bakım izleminde serebrovasküler olay geçirerek reoperasyona alınmadan
kaybedildi.
Romatizmal mitral kapak hastalığı olan hastalarda mitral kapak cerrahisi ile
eşzamanlı yapılan radyofrekans ablasyon yöntemi ile elde edilen kardiyoversiyon oranı
erken postoperatif dönemde tatmin edici düzeyde bulundu. Bu yöntem, uygun hasta
profili seçildiğinde ve titiz bir uygulamayla hastalar bir protokole göre takip edildiğinde
özellikle mitral kapak tamir operasyonları ile birlikte uygulandığında başarılı, Cox Maze
III prosedürüne göre komplikasyon oranı düşük, tedavi maliyetini azaltan, etkili ve kolay
uygulanabilir bir yöntemdir.
43
Tablo 1. Mitral kapak hastalığı ile postoperatif III. aydaki ritmin
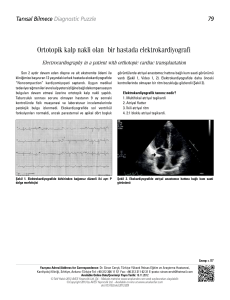
karşılaştırılması
TOPLAM
3. ay sonunda ritim
MİTRAL
KAPAK
md
my
PATOLOJİSİ
miks
TOPLAM
NSR
AFR
FiBROFLATTER
9
3
1
13
1
0
0
1
9
2
0
11
19
5
1
25
P=0.843
Tablo 2.Unipolar ve bipolar uygulama ile postoperatif III. aydaki ritmin
karşılaştırılması
3. ay sonunda ritim
AFR
FiBROFLATTER
12
2
0
14
7
3
1
11
19
5
1
25
NSR
UNİPOLAR-BİPOLAR
unipolar
bipolar
TOPLAM
TOPLAM
P=0.335
44
Tablo 3. Sağ atriyal uygulama ile postoperatif III. aydaki ritmin
karşılaştırılması
TOPLAM
3.ay sonunda ritim
NSR
AFR
FiBROFLATTER
14
5
1
20
5
0
0
5
19
5
1
25
YAPILMADI
SAĞ ATRİYAL
ABLASYON
YAPILDI
TOPLAM
P=0.373
Tablo 4. Sol atriyum çapı ile postoperatif III. aydaki ritmin karşılaştırılması
3. ay sonunda ritim
SOL
ATRİYUM
ÇAPI
TOPLAM
TOPLAM
NSR
AFR
FiBROFLATTER
>5cm
9
4
0
13
<5cm
10
1
1
12
19
5
1
25
P=0.244
45
TARTIŞMA
Atriyal fibrilasyon mortalite ve morbiditeyi önemli oranda arttırmanın yanı
sıra hastaların yaşam kalitesini önemli ölçüde bozmakta ve sosyoekonomik olarak
önemli bir yük getirmektedir. Dolaşım sistemi ile ilgili hastaneye yatışların
yaklaşık %10 aritmi nedeniyledir ve bunun büyük kısmını AF ve atriyal flatter
oluşturmaktadır (24).
Mitral kapak hastalığı nedeniyle ameliyat olan hastaların büyük kısmı
atriyal fibrilasyon ritmindedir. İntermitan veya bir yıldan kısa süreli AF’u
hastalarda mitral kapak ameliyatı sonrası ritim genellikle sinüse dönmektedir fakat
kronik atriyal fibrilasyonda bu oran oldukça düşüktür (19, 20). Mitral kapak
hastalığı ile kronik AF’nin birlikte olduğu durumlarda, sadece kapağa yönelik
cerrahi girişim sonrası, olguların %80’inden fazlasında AF’nin sebat ettiği
görülmüştür (20). Melo tarafından yapılan bir çalışmada ise ameliyat sonrası
spontan sinüs ritmine dönüş %8 olarak bildirilmiştir (21).
Cox Maze Prosedürü yapısal kalp hastalığı ve atriyal fibrilasyonu olan
hastalarda sinüs ritminin tesisinde oldukça efektif ve yaygın kabul görmüş bir
yöntemdir (8). Toplam 346 hastayı içeren ve tüm olguları kapsayan Cox (44)
tarafından yayınlanan en büyük seride operatif mortalite %2 idi. AF hastaların
%99’unda tedavi edilmiştir ve hastaların sadece %2’si uzun vadeli post-operatif
antiaritmik ilaç tedavisine ihtiyaç duymuştur. Geçici postoperatif AF hastaların
%38’inde görüldü. Bu sorun, peroperatif dönemdeki kısa atriyal refrakter döneme
atfedildi ve uzun vadeli sonuçları etkilemedi (56). Hastaların %15’inde operasyon
sonrası kalıcı pacemaker ihtiyacı duyuldu. Sağ atriyal transport fonksiyonu
46
hastaların %98’inde görüldü ve sol atriyal transport fonksiyonunun görülme oranı
da %93’tü (44).
Diğer merkezlerin Cox Maze III prosedürü ile ilgili sonuçları (59, 60) Cox
Maze ve ark. tarafından rapor edilenlerden daha düşük olmuştur. Cleveland
Kliniği’nde ve Mayo Klinik’te AF’yi iyileştirme oranı %90 civarında rapor
edilmiştir (59,61). Ek organik kalp hastalığının varlığı Cox ve arkadaşlarının
çalışmalarında Cox Maze III prosedürünün etkinliğini ortadan kaldırmamasına
rağmen, diğer araştırmacılar düşük oranda başarı rapor etmişlerdir. Çoğu seride,
mitral kapak cerrahisinin Cox Maze III ile kombine edilmesi hastaların % 7582’sinde AF’yi tedavi etmiştir (62,63,64,65). Kamata ve arkadaşları (64,66)
atriyal fibrilasyon dalgasındaki oynama genişliğinin (amplitüd) ve sol atriyum
çapının bu hastalarda yürütülen Cox Maze prosedüründen sonraki sinüs ritmi
tesisinin
bağımsız
prediktörleri
araştırmacıların sonuçlarının
olduğunu
bulmuşlardır.
Neden
diğer
Cox ve arkadaşlarınınkinden düşük olduğu
belirsizdir.
Cox
ve
arkadaşları
maze
prosedürünü
çoğunlukla
lone
uygulamışlardır, fakat diğer araştırmacılar maze prosedürünü ilaç
AF’de
tedavisine
dirençli ve açık kalp cerrahisi gerektiren ek kardiyak patolojisi olan hastalarda
tercih etmektedirler. Bununla birlikte bu yöntemin oldukça komplike olması,
uygulamanın uzun sürmesi, uygulamanın tecrübe gerektirmesi bu konuda calışan
araştırmacıları daha basit ve minimal invaziv yöntemler konusunda arayışa
itmiştir. Parsiyel maze prosedürleri olarak adlandırılan bu yöntemlerde birçok
lezyon setleri oluşturulmuştur (36,37,46,47). Çeşitli gruplar parsiyel Maze
prosedürlerinin sonuçlarını yayınlamışlardır (36,37,46,47). Bu araştırmacılar
47
hastaların %80’inde sinüs ritmini tesis etmişlerdir (46,50). İnsizyon ve
kriyolezyon paternindeki küçük varyasyonlar sonucu etkilememiştir. Parsiyel
maze prosedürleri sol atriyum kaynaklı AF’yi ortadan kaldırabilmesine rağmen,
sağ atriyum kaynaklı atriyal flatter riski halen devam etmektedir (67,68,69). Bu
prosedürlerden sonra atriyal flatterin ortaya çıkma olasılığı %5-10’dur ve bunun
kateter ile ablasyonu kolaydır. Bu yöntemler Cox maze prosedürüne göre daha az
invazivdir.
Haissaguerre ve ark.(33) paroksismal AF’nin vakaların %94’ünde
pulmoner venlerdeki ektopik atımlardan kaynaklandığını ortaya koyduğu çalışma
ve sol atriyuma yönelik bu işlemlerin başarılı olması aynı lezyon setlerinin farklı
enerji
kaynakları
kullanılarak
elde
edilebileceği
fikrini
doğurmuştur.
Radyofrekans ablasyon 1980’lerin ortalarından bu yana perkütan kateter
aracılığıyla özellikle supraventriküler taşikardilerin tedavisinde kullanılmaktadır.
Ucu serum irrigasyonlu radyofrekans ablasyonu ilk olarak 1988 yılında
Wittkampf ve arkadaşları (73) tarafından kullanılmıştır. Bu kateterin kronik
AF’de intraoperatif olarak kullanımı ilk olarak 1995 yılında Sie ve arkadaşları
(74), daha sonra ise Melo ve arkadaşları (75) tarafından gerçekleştirilmiştir.
Radyofrekans ablasyon amacıyla çeşitli lezyon tipleri oluşturulmuştur (62, 71, 78).
Bu lezyon tiplerinin tamamı pulmoner venlerin tamamen veya tama yakın
izolasyonunu, sol atriyum apendiksinin eksizyonunu veya dışlanmasını içerir.
Ayrıca sol pulmoner venler ile sol atriyum apendiksi arasında ve yine sol
pulmoner venler ile mitral kapak anulusu arasında lezyon oluşturarak iletinin
engellenmesini içerir. Sağ atriyal uygulamalar ise Cox Maze III prosedürüne
benzer şekilde yapılır (78,79) (Şekil 7). Sol atriyal uygulama ortalama 10-20
48
dakika sürmektedir. Bu süre Cox Maze III prosedürünü gerçekleştirmek için
gerekli 1 saatlik süreden oldukça kısadır (62, 71, 77, 81, 85). Bu lezyon tiplerinin
çeşitli olmasına rağmen AF’nin tedavi oranı %70 ile %80 arasında bildirilmiştir
(71,78, 81, 82, 83, 84). Bu yeni teknikler AF’yi efektif bir şekilde tedavi etmenin
yanı sıra. kardiyopulmoner bypass süresi kısalttığından ve komplikasyon görülme
sıklığı azalttığından oldukça düşük morbidite ve mortaliteye sahiptir. Bu
prosedürlerin en önemli başarısı Cox maze prosedüründeki gibi tam lezyon seti
oluşturmadan, kısmi lezyon oluşturularak AF’nin başarılı bir şekilde tedavi
edilebileceğini göstermeleridir. Tedavi edilen hastaların çoğu organik kalp
hastalığına sahipti ve ek olarak mitral kapak ameliyatı geçirmişlerdir. Bu
hastalarda elde edilen başarı hemen hemen Cox Maze prosedürüne yakındır ve sağ
atriyumun prosedüre dahil edilip edilmemesinden bağımsızdır (44, 59, 60).
Peroperatif AF yaygındır ve vakaların yaklaşık üçte ikisinde görülür (71, 84, 85).
Hastaların %30-40’nın AF ile hastaneden ayrılmasına rağmen, bir çoğu takip eden
3 ay içinde sinüs ritmine dönmektedir. Bu nedenle AF ile taburcu, prosedürdeki
başarısızlığın göstergesi değildir. Ablasyon sonrası elektromekanik veya
farmakolojik kardiyoversiyon önem taşımaktadır, sinüs ritmi tesis edildikten sonra
farmakolojik
olarak
desteklenmeli
ve
hastanın
sinüs
ritminde
kalması
sağlanmalıdır. Amiodaron ve sotalol tedavisi postoperatif artiyal fibrilasyonun
profilaksisinde tercih edilmektedir. Mitral kapak replasmanı gereken hastalarda
maze prosedürünün uygulanması halen tartışmalı bir konudur çünkü mekanik
kapak replasmanı yapılan hastalarda sinüs ritmi tesis edilse dahi antikoagülan
tedavi ihtiyacı ömür boyu devam etmektedir. Fakat
mitral rekonstrüksiyon
yapılan hastalarda sinüs ritminin tesisi antikoagülan tedavi gereksinimini ortadan
49
kaldıracağından
maze
önerilmektedir.
Bununla
prosedürünün
birlikte
bu
AF’nin
hasta
gurubuna
antikoagülan
uygulanması
tedaviye
rağmen
tromboemboli riskini arttırdığını düşünen cerrahlar ise maze prosedürünün rutin
uygulanmasını savunmaktadırlar. Bu konuda daha fazla randomize çalışmaya
ihtiyaç duyulmaktadır.
Epikardiyal ve bipolar ablasyon prosedürü endokardiyal yaklaşıma göre
daha yeni bir uygulamadır ve literatürde şu ana kadar bildirilen komplikasyonlar
endokardiyal uygulamalardan oluşmuştur. Kullanılan prob ne olursa olsun,
özellikle sol atriyal ablasyon esnasında; özofagus, sirkumfleks koroner arter ve sol
ana bronş
yaralanmaları veya sol atriyum perforasyonuna bağlı kanamalar
gelişebilir. Endokardiyal uygulamada karşılaşılan en fatal komplikasyon özofagus
yaralanmasıdır (88). Sağ ve sol pulmoner ven ağızlarının iki ayrı ada halinde
çevrelenmesi ve bu ikisinin birleştirilmesi esnasında sol atriyum arka duvarına
yakın komşuluğundan dolayı özofagus hasar görebilir. Sol atriyum ile özofagus
arasında bazen hiç bağ dokusu bulunmayabilir (özellikle kaşektik hastalarda). Bu
yüzden, işlem esnasında eğer varsa TEE probu ve nazogastrik sonda çıkarılmalıdır.
Oblik sinüse gazlı bez yerleştirilmesi de hasar oluşma olasılığını en aza
indirecektir. Ayrıca sol atriyal dairelerin kesişmemesine özen gösterilmelidir
çünki aynı dokuya ikinci kez enerji uygulamak perforasyon riskini arttırmaktadır
(89). Doll ve Mohr (88 ), 387 hastaya radyofrekans ablasyon uygulamışlar ve dört
hastada ( %1 ) özofagus perforasyonu geliştiğini bildirmişlerdir.
Sol atriyal endokardiyal uygulamada pulmoner adacıklar mitral kapak
anulusu ile birleştirilirken, anatomik varyasyona göre, termal hasara maruz
kalabilir. Bu etkiyi en aza indirmek için işlem esnasında retrograd soğuk
50
kardiyopleji verilmesi önerilmektedir (90). Sirkumfleks arter yaralanmasına
kriyoablasyon ile kombine Maze operasyonu sırasında da rastlanılmıştır (91).
Endokardiyal radyofrekans uygulamada karşılaşılan diğer komplikasyon ise,
sol atriyum arka duvarına yakın komşuluğundan dolayı sol ana bronş
yaralanmasıdır. Bu yüzen ablasyon işlemine başlamadan önce elle palpasyon
yapılmalı ve sol ana bronşa ait çıkıntı hissedilerek ablasyon buna göre
şekillenmelidir (92). Ablasyon işlemi sol atriyum apendiksinin internal
ligasyonundan sonra yapıldığında, dikiş materyeli hasar görebilir ve buna bağlı
kanama görülebilir (93). Bu yüzden ablasyon işlemi her zaman diğer tüm cerrahi
işlemlerden (kapak replasmanı, rekonstrüksiyon..) önce yapılmalıdır. Atriyum
çapları ileri genişlemiş ve duvar yapısı ince olan hastalarda ablasyon süresi kısa
tutulmalı ve uygulanan enerji miktarı az olmalıdır. Pulmoner ven stenozuna
perkütan uygulamalarda rastlanmakla birlikte, pulmoner ostiumlara en az 3-4 mm
uzaklıkta yapılacak uygulamanın güvenli olacağı bildirilmiştir (94).
Diğer bir komplikasyon ise kalıcı pacemaker gereksinimi duyulan ritim ( nodal
ritim, a-v tam blok..) bozukluğudur. Mohr ve arkadaşlarının (90) 243 hastada
yaptıkları uygulamada 23 (%9.8) hastaya pacemaker takılmıştır. Maze III
prosedürü uygulanan hastalarda ise bu oran %2-24 olarak bildirilmiştir (8, 94).
Öncesinde hasta sinüs sendromu olduğu bilinen hastalara bu prosedür
uygulanmamalıdır.
Bazı araştırmacılar atriyal büyüklüğün başarıyı etkilediğini bildirmelerine
rağmen, bu bulgu diğer araştırmacılar tarafından teyit edilmemiştir (62, 78). Sol
atriyum çaplarının ileri derecede büyümesi, atriyum duvarının incelmesi, fibrozis
ve kalsifikasyon rüptür riski nedeniyle tercih edilmemektedir. Atriyal transport
51
fonksiyonu, sinüs ritmine dönen hastaların %80-100’ünde görülmektedir (86, 87).
Elde edilen bu başarı radyofrekans ablasyona olan ilgiyi arttırmaktadır ancak
oluşturulan lezyon tipi ve prosedürün sadece sol atriyumu içermesi konusunda
halen tartışmalar devam etmektedir.
Yakın gelecekte AF için cerrahi uygulamanın yaygın şekilde kullanımını ve
enerji kaynaklarında, lezyon setlerinde ve cerrahi yöntemlerde iyileşmeyi
göreceğiz. Radyofrekans ve mikrodalga enerjilerinin uygulanması için basit ve
daha hızlı teknikler halen gelişim halindedir. Lazer ve ultrason da lezyon
yaratmak için alternatif enerji kaynakları olabilir. AF’nin minimal invaziv, offpump ablasyonu ufukta görünmektedir. Cox sağ torakotomi yoluyla bir kriyomaze prosedürünün gerçekleşebileceğini göstermiştir (87). Sol atriyum apendiksi
stapler kullanılarak eksize ve eksklude edilebilir (95). Yakın gelecekte, AF’nin
torakoskopik stapler ve geliştirilecek kateterler ile off-pump epikardiyal
ablasyonu mümkün olacaktır.
52
ŞEKİLLER
ŞEKİL 1: SOL ATRİYAL İZOLASYON PROSEDÜRÜ
53
ŞEKİL 2: HİS DÜĞÜMÜ ABLASYON
ŞEKİL 3 : KORİDOR PROSEDÜRÜ
54
ŞEKİL 4: Sueda prosedüründeki sol atriyal insizyon paterni. Pulmoner venlere
dairesel bir şekilde insizyon yapılır ve sol atriyum apendiksine ve mitral
anulusuna doğru birleştirici insizyon yapılır.
55
ŞEKİL 5: COX MAZE III PROSEDÜRÜ
A)
B)
56
ŞEKİL 6: MİNİ-MAZE PROSEDÜRÜ
ŞEKİL 7: RADYOFREKANS ABLASYONDA LEZYON SETLERİ
57
ŞEKİL 8: ORTALAMA LEZYON DERİNLİĞİ VE ABLASYON ZAMANI
Ortalama lezyon derinliği ve ablasyon zamanı
*95%güvenilirlik
Ortalama derinlik(mm)
8
7
--- 30 watts 5cc/dak
6 --- 25 watts 5cc/dak
5 --- 20watts 5cc/dak
4
3
2
1
0
0
5
10
15
20
25
30
35
40
(zaman (sn/1cm²)
ŞEKİL 9: UNİPOLAR ABLASYON SOL ATRİYAL UYGULAMA
mitral kapak ve anulus
kırmızı: cerrahi insizyon hattı
mavi: radyofrekans ablasyon hattı
58
ŞEKİL 10 : UNİPOLAR RF SAĞ ATRİYAL UYGULAMA ŞEMASI
kırmızı: cerrahi insizyon hattı
mavi: radyofrekans ablasyon hattı
A)
vcs
vcı
B)
triküspid kapak
59
C)
koroner sinüs
ŞEKİL 11. BİPOLAR RF ABLASYON UYGULAMA ŞEMASI
A)
60
B)
61
KAYNAKLAR
1.
Silverman ME. From rebellious palpitations to the discovery of auricular
fibrillation: contributions of Mackenzie, Lewis and Eindhoven. Am
J
Cardiol 1994;73:384-9.
2.
Martin A, Schwartz MJ, Kronmal RA, Kosinski AS. Prevalence and
significance of atrial fibrillation in coronary
artery disease (CASS
Registry) . Am J Cardiol 1988;61:7147-71.
3.
Kannel WB, Abbott RD, Savage DD, McNamara PM. Epidemiologic
features of chronic atrial fibrillation: the Framingham study. N Engl J Med
1982; 306:1018-22
4.
Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Lewy
D . Impact of atrial fibrillation on the risk of death: the Framingham Heart
Study. Final results. Circulation 1991;84:527-39.
5.
. Ezekowitz M.D and Netrebko P.I. Anticoagulation in management of
atrial fbrillation. Current Opinion in Cardiology 2003;18:26-31
6.
Lundstrom T. and Ryden L. Chronic atrial fibrillation. Long-term results of
direct current conversion. Acta Medica Scandinavica 1988;223:53-9.
7.
Graffigna A, Pagani F, Minzioni G , Salerno J, Vigano M. Left atrial
isolation associated with mitral valve operations. Ann Thorac Surg.
1992;54:1093-1097; discussion 1098.
8.
Cox JL , Schuessler RB, Lappas DG, Boieneau JP. An 8 ½ -year clinical
experience with surgery for atrial fibrillation . Ann Surg. 1996; 224:267273;discussion 273-275.
62
9.
Sealy WC, Hattler BG jr, Blumenshein SD, Cobb FR. Surgical treatment of
Wolf-Parkinson-White syndrome. Ann Thorac Surg 1969;81-11.
10.
Scheinman MM, Morady F, Hess DS, Gonzales R. Catheter-induced
ablation
of
the
atrioventricular
junction
to
control
refractory
supraventricular arrhythmias. JAMA 1982;248:851-5.
11.
Gallagher JJ, Svenson RH, Kasell JH, et al. Catheter technique for closedchest ablation of the atrioventricular conduction system. N engl J Med
1982;306:194-200.
12.
Williams JM, Ungerleider RM, Lofland GK, Cox JL. Left atrial isolation:
new technique for the treatment of supraventricular arrhythmias. J Thorac
Cardiovasc Surg. 1980;80:373-380.
13.
Guiraudon GM, Campell CS, Jones DL, et al. Combined sino-atrial node
atrio-ventricular node isolation: A surgical alternative to His Bundle
ablation in patients with atrial fibrillation. (Abs.) Circulation 1985;72:III220.
14.
Fuster V, Ryden LE, Asinger RW, et al. ACC/AHA/ESC guidelines for the
management of the patients with atrial fibrillation. Eur Heart J
2001;22:1985-923.
15.
Lip GYH. Does atrial fibrillation confer a hypercoagulable state? Lancet
1995;346:1313-4.
16.
Peterson P, Kastrup J, Wilhelmsen R, Schutten HJ. Atrial natriuretic peptide
in atrial fibrillation before and after electrical cardioversion therapy. Eur
Heart J 1988;9:639-41.
63
17.
Shinbane JS, Wood MA, Jensen DN, Ellenbogen KA, Sheinman MM,
Tachycardia-induced cardiomyopathy: a rewiev of animal models and
clinical studies. J Am Coll Cardiol 1997;29:709-15.
18.
Pasty BM, Manolio TA, Kuller LH, et al. Incidence of the risk factors for
the atrial fibrillation in older adults. Circulation 1997;96:2555-61.
19.
Diker E, Aydogdu S, Ozdemir M, et al. Prevalence and predictors of the
atrial fibrillation in rheumatic heart disease. Am J Cardiol 1996;77:96-8.
20.
Handa N, Schaff HV, Morris JJ, Anderson BJ, et al. Outcome of mitral
valve repair and the Cox Maze procedure for mitral regurgitation and
associated atrial fibrillation. J Thorac Cardiovasc Surg 1999;118;628-635.
21.
Melo J, Adrago P, Neves J, et al. Surgery for atrial fibrillation using
radiofrequency catheter ablation: assessment of results at one year. Eur J
Cardio-thorac Surg 1999;155:851-855.
22.
Brand FN, Abbott RD, Kannel WB, Wolf PA. Characteristics and prognosis
of lone atrial fibrillation: 30-year follow-upin the Framingham study. J Am
Med Assoc. 1985;254:3449-53.
23.
Frustaci A, Chimenti C, Belloci F, Morgante E, Russo MA, Maseri A.
Histological substrate of atrial biopsies in patients with lone atrial
fibrillation. Circulation 1997;96:1180-1184.
24.
Bialy D, Lehmann MH, Schumacher DN, Steinman RT, Meissner MD.
Hospitalization for arrhythmias in the United States: Importance of Atrial
Fibrillation. JACC 1992;19:716-724.
25.
American Heart Association policy document on the atial fibrillation.1988.
http:www.americanheart.org/arrhythmia/patient/about-atria.html.
64
26.
Chen PS, Athill CA, Wu TJ, Ikeda T, Ong JJ, Karagueuzian HS.
Mechanisms of atrial fibrillation and flutter and implication for management.
Am J Cardiol 1999;84:125R-30R.
27.
Nattel S. New ideas about atrial fibrillation 50 years on. Nature
2002;415:219-26.
28.
Moe GK. On the multiple wavelet hypothesis of atrial fibrillation. Arch Int
Pharmacodyn 1962;140:183-8.
29.
Allessie MA. Atrial electrophysiologic remodeling: another vicious circle? J
Cardiovasc Electrophysiol 1998;9:1378-93.
30.
Falk RH. Atrial fibrillation. N Engl J Med 2001;344:1067-78.
31.
Epstein AE, Kay GN. Finding our way through the maze. J Cardiovasc
Electrophysiol 1999;10:1575-7.
32.
Roithinger FX, Steiner PR, Goseki Y, Sparks PB, Lesh MD.
Electrophysiologic effects of selective right versus left atrial linear lesions in
a canine model of chronic atrial fibrillation. Cardiovasc Electrophysiol
1999;10:1564-74.
33.
Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial
fibrillation by ectopic beats originating in the pulmonary veins. N Engl J
Med 1998;339:659-66.
34.
Nathan H, Eliakim M. The junction between the left atrium and the
pulmonary veins. An anatomic study of human hearts. Circulation
1966;34:412-22.
65
35.
Harada A, Sasaki K, Fukushima T, et al. Atrial activation during chronic
atrial fibrillation in patients with isolated mitral valve disease. Ann Thorac
Surg 1996;61:104-12.
36.
Nitta T, Imura H, Bessho R, Hosaka H, Yamauchi S, Tanaka S. Wavelength
and conduction inhomogeneity in each atrium in patients with isolated
mitral valve disease and atrial fibrillation. J Cardiovasc Electrophysiol
1999;10:521-8.
37.
Sueda T, Nagata H, Orihashi K, et al. Efficacy of a simple left atrial
procedure for chronic atrial fibrillation in mitral valve operations. Ann
Thorac Surg 1997;63:1070-5.
38.
Sueda T, Nagata H, Shikata H, et al. Simple left atrial procedure for chronic
atrial fibrillation associated with mitral valve disease. Ann Thorac Surg
1996;62:1796-800.
39.
Dittrich HC, Erickson JS, Schneiderman T, Blacky AR, Savides T, Nicod
PH. Echocardiographic and clinical predictors for outcome of elective
cardioversion of atrial fibrillation. Am J Cardiol 1989;63:193-7.
40.
Levy S, Lauribe P, Dolla E, et al. A randomized comparison of external and
internal
cardioversion
of
chronic
atrial
fibrillation.
Circulation
1992;86:1415-20.
41.
Lau CP, Log NS. A comparison of transvenous atrial defibrillation of acute
and chronic atrial fibrillation and the effect of intravenous sotalol on human
atrial defibrillation threshold. PACE 1997;20:2442-52.
42.
Brignole M, Menozzi C, Gianfrancho L, et al. Assessment
atrioventricular
junction
ablation
66
and
VVIR
pacemaker
of
versus
pharmacological treatment in patients with heart failure and chronic atrial
fibrillation. Circulation 1998;98:953-60.
43.
Cox JL, Schuessler RB, D’Agostino HJ Jr, et al. The surgical treatment of
atrial fibrillation. III. Development of a definitive surgical procedure. J
Thorac Cardiovasc Surg 1991;101:569-83.
44.
Cox JL, Ad N, Palazzo T, et al. Currrent status of the Maze procedure for
the treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg
2000;12:15-9.
45.
Cox JL, Schuessler RB, Boineau JP. The development
of
the Maze
procedure for treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg
2000;12:2-14.
46.
Takami Y, Yasuura K, Takagi Y, at al. Partial maze procedure is effective
treatment for chronic atrial fibrillation associated with valve disease. J Card
Surg 1999;14.103-8.
47.
Bauer EP, Szalay ZA, Brandt RR, at al. Predictors for atrial transport
function after Mini-Maze operation. Ann Thorac Surg 2001;72:1251-5.
48.
Cox JL,Ad N.The importance of cryoablation of the coronary sinus during
the Maze procedure.Semin Thorac Cardiovasc Surg 2000;12:20-4.
49.
Kress DC, Krum D, Chekanov V, at al. Validation of a left atrial lesion
pattern for intraoperative ablation of atrial fibrillation. Ann Thorac Surg
2002;73:1160-8.
50.
Szalay ZA, Skwara W, Pitschner HF, Faude I, Klovekorn WP, Bauer EP.
Midterm results after the Mini-Maze procedure. Eur J Cardiothorac Surg
1999;16:306-11.
67
51.
Wonnell TL, Stauffer PR, Langberg JJ.Evaluation of microwave and radio
frequency
catheter
ablation
in
a
myocardium-equivalent
phantom
model.IEEE Trans Biomed Eng 1992;39:1086-95.
52.
Spitzer SG, Richter P, Knaut M, Schuler S. Treatment of atrial fibrillation in
open heart surgery-the potential role of microwave energy. Thorac
Cardiovasc Surg 1999;47(Suppl 3):374-8.
53.
Knaut M, Spitzer SG, Karolyi L, at al. Intraoperative microwave ablation
for curative treatment of atrial fibrillation in open heart surgery-the MICROSTAF and MICRO-PASS pilot trial. MICROwave Application in Surgical
treatment Atrial Fibrillation in Bypass-Surgery. Thorac Cardiovasc Surg
1999;47(Suppl 3):379-84.
54.
Dorschler K, Muller G. The role of laser in cardiac surgery. Thorac
Cardiovasc Surg.1999;47:385-387.
55.
Viola N, Williams MR, Oz MC, Ad N. The technology in use for the
surgical ablation of atrial fibrillation. Semin Thorac Cardiovasc Surg.
2002;14:198-205.
56.
Cox JL, Schuessler RB, Boineau JP. The development of the Maze
procedure for atrial flutter and atrial fibrillation. Adv Card Surg 1995;6:1-67.
57.
Cox JL, Ad N, Palazzo T. Impact of the maze procedure on the stroke rate in
patients with atrial fibrillation. J Thorac Cardiovasc Surg 1999;118:833-40.
58.
Ad N, Cox JL. Stroke prevention as an indication for the Maze procedure in
the treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg
2000;12:56-62.
68
59.
McCarthy PM, Gillinov AM, Castle L, Chung M, Cosgrove D 3rd. The
Cox-Maze procedure: the Cleveland Clinic experience. Semin Thorac
Cardiovasc Surg 2000;12:25-9.
60.
Arcidi JM Jr, Doty DB, Millar RC.The Maze procedure:the LDS Hospital
experience. Semin Thorac Cardiovasc Surg 2000;12:38-43.
61.
McCarthy PM, Castle LW, Maloney JD, et al.Initial experience with the
maze procedure for atrial fibrillation. J Thorac Cardiovasc Surg 1993;107787.
62.
Chen MC, Chang JP, Guo GB, Chang HW. Atrial size reduction as a
predictor of the success of radiofrequency maze procedure for chronic atrial
fibrillation in patients undergoing concomitant valvular surgery. J
Cardiovasc Electrophysiol 2001;12:867-74.
63.
Raanani E, Albage A, David TE, Yau TM, Armstrong S. The efficacy of the
Cox/maze procedure combined with mitral valve surgery: a matched control
study. Eur J Cardiothorac Surg 2001;19:438-42.
64.
Kamata J, Kawazoe K, Izumoto H, et al. Predictors of sinus rhythm
restoration after Cox maze procedure concomitant with other cardiac
operations. Ann Thorac Surg 1997;64:394-8.
65.
Izumoto H, Kawazoe K, Kitahara H, Kamata J. Operative results after the
Cox/maze procedure combined with a mitral valve operation. Ann Thorac
Surg 1998;66:800-4.
66.
Ueshima K, Hashimoto K, Chiba M, et al. What are the predictors of
restoration of sinus rhythm after combined treatment with surgical repair for
69
organic heart disease and the Maze procedure for atrial fibrillation? J
Cardiovasc Surg (Torino) 1999;40:793-6.
67.
Mohr FW, Fabricus AM, Falk V, et al. Curative treatment of atrial
fibrillation with intraoperative radiofrequency ablation: short-term and
midterm results. J Thorac Cardiovasc Surg 2002;123:919-27.
68.
Usui A, Inden Y, Mizutani S, Takagi Y, Akita T, Ueda Y. Repetetive atrial
flutter as a complication of the left-sided simple maze procedure. Ann
Thorac Surg 2002;73:1457-9.
69.
Deneke T, Khargi K, Grewe PH, et al. Left atrial versus bi-atrial Maze
operation using
intraoperatively cooled-tip radiofrequency ablation in
patients undergoing open-heart surgery: safety and efficacy. J Am Coll
Cardiol 2002;39:1644-50.
70.
Gaita F, Gallotti R, Calo L, et al. Limited posterior left atrial cryoablation in
patients with chronic atrial fibrillation undergoing valvular heart surgery. J
Am Coll Cardiol 2000;36:159-66.
71.
Williams MR, Stewart JR, Bolling SF, et al. Surgical treatment of atrial
fibrillation using radiofrequency energy. Ann Thorac Surg 2001;71:1939-44.
72.
Haissaguerre M, Jais P, Shah DC, et al. Right and left atrial radiofrequency
catheter
therapy
of
paroxysmal
atrial
fibrillation.
J
Cardiovasc
Electrophysiol. 1996;7:1132-1144.
73.
Wittkampf FH, Hauer RN, Robles de Medina EO. Radiofrequency ablation
with a coolet porous electrode catheter. J Am Coll Cardiol 1988;11:17.
70
74.
Sie HT, Ramdal Misier R, Beukema WP. Radiofrequency ablation of atrial
fibrillation in patients undergoing mitral valve surgery: first experience.
Circulation 1996;94:1-675.
75.
Melo J, Adragao P, Neves J, et al. Surgery for atrial fibrillation using
radiofrequency catheter ablation: assessment of results at one year. Eur J
Cardio-thorac Surg 1999;155:851-855.
76.
Shimoike E, Kaji Y, Ueda N, Maruyama T, Kanaya S, Niho Y. In vivo and
in vitro study of radiofrequency application with a new long linear probe:
implication
for
the
maze
operation.
J
Thorac
Cardiovasc
Surg
2000;120:164-72.
77.
Gaita F, Riccardi R, Calo L, et al. Atrial mapping and radiofrequency
catheter
ablation
Electrophysiological
in
patients
findings
with
and
idiopathic
ablation
atrial
fibrillation.
results.
Circulation
1998;97:2136-45.
78.
Sie HT, Beukema WP, Misier AR, et al. Radiofrequency modified maze in
patients with atrial fibrillation undergoing concomitant cardiac surgery. J
Thorac Cardiovasc Surg 2001;122:249-56.
79.
Chen MC, Guo GB, Chang JP, Yeh KH, Fu M. Radiofrequency and
cryablation of atrial fibrillation in patients undergoing valvular operations.
Ann Thorac Surg 1998;65:1666-72.
80.
Nakagawa H, Yamanashi WS, Pitha JV, et al. Comparasion of in vivo tissue
temperature profile and lesion geometry for radiofrequency ablation with a
saline-irrigated electrode versus temperature control in a canine thigh
muscle preparation. Circulation. 1995;91:2264-2273.
71
81.
Hindricks G, Mhor FW, Autschbach R, Kottkamp H. Antiarrhythmic
surgery for treatment of atrial fibrillation-new concepts. Thorac Cardiovasc
Surg 1999;47(Suppl 3):365-9.
82.
Sie HT, Beukema WP, Ramdat Misier AR, Elvan A, Ennema JJ, Wellens
HJ. The radiofrequency modified maze procedure. A less invasive surgical
approach to atrial fibrillation during open-heart surgery. Eur Cardiothorac
Surg 2001;19:443-7.
83.
Nitta T, Lee R, Schuessler RB, Boineau JP, Cox JL. Radial approach: a new
consept in surgical treatment for atrial fibrillation I. Consept, anatomic and
physiologic basis and
development of a procedure. Ann Thorac Surg
1999;67:27-35
84.
Pasic M, Bergs P, Muller P, et al. İntraoperative radiofrequency maze
ablation for atrial fibrillation: the Berlin modification. Ann Thorac Surg
2001;72:1484-91.
85.
Benussi S, Pappone C, Nascimbebe S, et al. A simple way to treat chronic
atrial fibrillation during mitral valve surgery: the epicardial radiofrequency
approac. Eur J Cardiothorac Surg 2000;17:524-9.
86.
Gillinov AM, Petterson G, Rice TW. Esophageal injury during
radiofrequency ablation for atrial fibrillation. J Thorac Cardiovasc Surg
2001;122:1239-40.
87.
Cox JL. The minimally invasive Maze-III procedure. Oper Tech Thorac
Cardiovasc Surg 2000;5:79-92.
72
88.
Doll N, Borger MA, Fabricus A, et al. Esophageal perforation during left
atrial radiofrequency ablation: Is the risk too high? J Thorac Cardiovasc
Surg. 2003;125:836-842.
89.
Patwardhan AM. Esophageal injury during radiofrequency ablation for atrial
fibrillation: Inherent safety of radiofrequency bipolar coagulation. J Thorac
Cardiovasc Surg.2001;122:1241-1242.
90.
Mohr FW, Fabricus AM, Falk V, et al. Curative treatmaent of atrial
fibrillation with intraoperative radiofrequency ablation: short-term
and
midterm results. J Thorac Cardiovasc Surg. 2002;123:919-927.
91.
Sueda T, Shikata H, Mitsui N, Nagata H, Matsuura Y. Myocardial infarction
after a maze procedure for idiopathic atrial fibrillation. J Thorac Cardiovasc
Surg.1996;112:549-550.
92.
Benussi S, Nascimbene S, Calvi S, Alfieri O. A tailored anatomical
approach to prevent complications during left atrial ablation. Ann Thorac
Surg. 2003;75:1979-1981.
93.
Guden M, Akpınar B, Sanisoglu I, Sagbas E, Bayindir O. Intraoperative
saline-irrigated radiofrequency modified
maze procedure for atrial
fibrillation. Ann Thorac Surg. 2002;74:1301-1306.
94.
Arcidi JM, Millar RC. Evolution of the Maze III procedure: are
modifications necessary? Thorac Cardiovasc Surg.1999;47:362-364.
95.
Landymore R, Kinley CE. Staple closure of left atrial appendage. Can J
Surg 1984;27:144-5.
73
74