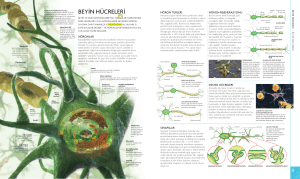
Nöron sitolojisi
nöronal proteinlerin sentez ve
trafiği (gidiş ve geliş)
Sinir sistem hücreleri-konu başlıkları
Nöron ve Glianın paylaştıkları Yapısal ve
Moleküler Özellikler
Hücre iskeleti hücrenin şeklini belirler
Protein partikül ve organeller akson ve
dendrit boyunca aktif şekilde transport
edilir
Diğer sekretuar hücrelerde olduğu gibi
Proteinler Nöronlarda sentezlenmektedir
Membran yüzeyi ve Ekstrasellüler maddeler
hücre içinde yeniden geriye kazanılır
Nöron ve Glia hücreleri genel olarak hücrede
birçok özellikleri paylaşırlar,
sinir sistemi bu hücrelerle bir araya toplanmıştır.
Nöronlar spesifik olarak uzak yerlerde
bulunan diğer hücreler arasında iletişimi
sağlamakla görevlilerdir.
Nöronlar iki özellikleri sayesinde bu
yeteneğe gösterebilirler:
a) bu hücreler yüksek derecede morfolojik
ve fonsiyonel asimetriye sahipler,
bu şekilde nöronlar bir uçtaki alıcı dendritleri
vardır ve diğerinin aksonuna iletirler. Bu tip
düzenlenme tek yöndeki nöronal iletinin
temelini oluşturur.
b)İkinci olarak nöronlar hem elektriksel
hem kimyasal uyarılabilmekteler.
Hücre membranında iyon kanalları ve
reseptörler şeklinde özelleşmiş proteinler
bulunmakta,
Spesifik inorganik iyonların akışını
kolaylaştırabilmekte bu sebeple yükün
tekrar dağılımı ve elektriksel akım yaratarak
membran boyunca voltajı değiştirir.
Yükdeki bu değişiklikler akson boyunca
aksiyon potansiyel formunda depolarizasyon
dalgası oluşturur, nöronda bir sinyalin
seyahat etmesi için olağan yoldur.
Nöronların sitolojisi
Nöronlar epitheliyal hücrelerin taşıdığı ana
özellikleri taşımasına rağmen diğer
organları oluşturan hücrelerden birçok
bakımdan farklıdır.
Oldukca polarizedirler
Elekrik sinyallerini iletecek şekilde
hücre organize olmuştur.
Plazmalemma oldukca hidrofobiktir
Sitozol, sitozol iskeleti matriksi ve
membranlı organellerden
oluşmaktadır.
Glia daha az uyarılabilmekte, fakat
membranlarında iyon alımını kolaylaştıran
transportır proteinleri vardır,
Bu transportır proteinler ekstrasellüler
aralıktan nörotransmiter moleküllerin
uzaklaştırılmasını sağlayarak nöronal
fonksiyonun düzenlenmesi sağlanmış olur.
Nöronların moleküler düzeyde de görülen sitolojik
farklılıktan dolayı yaklaşık 100 farklı tipi
bulunmaktadır.
Nöronlar genlerin aynı komplementi
kalıtılabilmesine rağmen herbiri sınırlı bir set
eksprese eder,
Böylece enzimler, yapısal proteinler, membran
bileşenleri ve sekretuar ürünleri gibi belli
molekülleri üretmektedirler.
Bu ekspresyonun büyük bir kısmında hücrenin
gelişimsel tarihçesine bağlı olmaktadır.
Nöron ve glia birçok yapısal ve
moleküler özellikleri paylaşmaktadırlar
Nöron ve glia embriyonik sinir sisteminin ortak
nöroepitelyal hücrelerinden gelişmektedir.
Dolayısıyla birçok yapısal ve moleküler özellikleri
paylaşmaktadırlar.
Bu hücreler bütün biyolojik membran
yapılarındaki gibi asimetrik çift katlı ve
suda-eriyebilen maddelere karşı impermeabl
özellikte hidrofobik bir bariyer özelliğinde
hücre membranı veya plazmalemma ile
kuşatılmıştır.
Sitoplazma sitozol ve membranöz yapıda
organellerden oluşmaktadır.
Bir Nöronun yapısı
Spinal bir motor nöronun
hücre gövdesi ve nukleusu
çift-katlı nukleer membranı
ile kuşatılmıştır.
İki membran tabakası
arasındaki boşluk
endoplazmik retikulumun
lümeniyle devamlılık
gösterir.
Dendritler nöronun kaidesi
yönünden, akson ise tepe
kısmından ortaya
çıkmaktadır.
Sitozol sitoplazmanın aköz kısmını oluşturur.
Bu kısımda az sayıda protein solüsyonda serbest halde olup
metabolik reaksiyonları kataliz eden bazı enzimlerin
haricinde çoğu protein fonksiyonel kompleksler için
organize edilmişlerdir.
Son proteomik çalışmaları bu komplekslerin hçbirinin
diğerine kovalent şekilde bağlanmadığ birçok ayrı
proteinden oluşmaktadırlar.
N-metil-D-aspartat tip glutamat reseptörünün sitoplazmik
kuyruğu merkezi sinir sisteminde eksitatuar sinaptik
transmisyonu düzenlemektedir, 100 den fazla iskelet
proteini ve protein-düzenleyici enzimden oluşan büyük bir
komplekse sıkıca bağlıdır.
mRNA’nın translasyon işleminin gerçekleştiği
ribozomlar farklı protein altbirimlerinden
meydana gelmiştir.
Proteozomlar, Nöron ve glianın sitozolü
boyunca ubikitinle işaretlenmiş proteinleri
degrade eden büyük multienzim
organelleridir.
Sitoplazmanın ikinci ana bileşeni olan
membranöz yapıda organelleri olan
mitokondri ve peroksizomları içine alan
tübül, vesikül ve vakuoler aparey şeklinde
adlandırılan sisternayı da kapsamaktadır.
Mitokondriler başlıca hücresel enerji molekülü
olan ATP’nin transfer edildiği veya harcanıp
sentezlendiği organeldir.
Peroksizomlar güçlü okside edici ajan hidrojen
peroksitin birikiminin engellenmesini sağlar.
Vakuoler yapıdaki apareyler kaba yüzlü
endoplazmik retikulum, düz yüzlü endoplazmik
retikulum, golgi kompleksi, sekretuar vesiküller,
endozomlar, lizozomlar ve çeşitli
kompartmanların karşılıklı etkileştikleri transport
vesiküllerini kapsarlar.
Lümenleri hücrenin dış kısmına karşı gelmekte,
sonuçta bu organellerin lipid çift tabakasının iç
kısmı plazmalemmanın dış yaprağına karşı
gelmektedir.
Bu sistemin başlıca alt komponentleri
anatomik olarak devamlılık göstermez,
fakat membranöz ve lumenal materyal
transport vesiküllerle bir kompartmandan
diğerine hareket edebilmektedir.
Örn protein ve fosfolipidler kaba yüzlü
endoplazmik retikulumda sentez edilirler
ve düz yüzlü endoplazmik retikuluma ve
golgi kompleksine ve sekretuar vesiküle
taşınırlar.
Nöron yapısındaki organeller
Elektron mikrografıyla
nöron sitoplazmasının
farklı bölgeleri
Daha sonra vesikül membran plazmalemma ile
kaynaşır.
Bu işlem eksositoz olarak adlandırılır.
Tersine plazmalemmal membran endositik
vesikül formunda hücreye alınır (endositoz).
Membranla birleşen içeriğinde reseptör gibi
spesifik proteinler ya vesiküllerle
plazmalemmaya geri döner veya
endozomlara ve oradan da olgun
lizozomlarda degradasyona uğrarlar.
Kaba yüzlü endoplazmik retikulumun özelleşmiş
kısmı nükleer kılıfı oluşturmaktadır.
Küresel şekilde yassılaşmış sisterna kromozomal
DNA’yı histon, transkripsiyon faktörleri,
polimerazlar ve izomeraz gibi proteinleri
kuşatmaktadır.
Nükleer zar nükleer porlarla kesintiye
uğramaktadır, iç ve dış membranın birleştiği bu
kısımlar hidrofilik kanal biçimindedir, protein ve
RNA’nın sitoplazmaya ve nükleer sitoplazmaya
geçişi sağlanır.
Çok büyük moleküller nükleer porlardan
geçemezler,
ancak özel nükleer lokalizasyon sinyalleri
olan proteinler (arjinin ve lizin gibi
aminoasitlerden oluşmuşlardır) tarafından
tanınırlar ki bu proteinler :
nükleer import reseptörleri
Nükleoporinler şeklinde isimlendirilirler.
Hücre gövdesinin sitoplazması fonksiyonel farklılık
olmadan dendritik ağaca uzanmaktadır
Genelde hücre gövdesinin sitoplazması
dendritlerde de mevcuttur,
Fakat kaba yüzlü endoplazmik retikulum, golgi
kompleksi ve lizozomlar hücre gövdesinden
uzaklaştıkça azalma gösterir.
Dendritlerdeki düz yüzlü endoplazmik retikulum
spine şeklinde adlandırılan ince çıkıntıların
kaidesinde göze çarpmaktadır.
Eksitatuar sinapsların alıcı kısmıdır.
Dendritik spine’da poliribozom konsantrasyonu
protein sentezine hizmet ettiğini düşündürmektedir.
Golgi ve endoplazmik retikulum membranları
hücre gövdesinden dendritlere uzanmaktadır.
Hücre iskeleti hücrenin biçimini belirler
Hücre iskeleti hücrenin biçiminden ve
organellerin sitoplazma içinde
asimetrik dağılımından sorumludur.
Hücre iskeleti;
1-Mikrotübül
2-Nörofilament
3-Mikrofilament
Bu filamentler ve ilişkili proteinler
hücredeki total proteinin yaklaşık dörtte
birinden sorumludur.
Mikrotübüller nöron sonuna kadar
uzanan uzun yapı iskelesi biçimindedirler,
hücrenin biçim ve gelişiminde anahtar role
sahipler.
Tek bir mikrotübül 0.1 mm uzunluğunda,
Mikrotübülün uzunluğunca yerleşmiş
çok sayıda alfa ve beta tubulin
monomer çiftlerinin oluşturduğu
protofilamentlerden oluşmuşlardır.
Mikrotübüller pozitif ucundaki GTP-bağlı tubulin
dimerlerinin eklenmesiyle büyürler,
Polimerizasyondan kısa süre sonra GTP hidroliz
olarak GDP oluşur.
Mikrotübül büyümesi durduğunda, pozitif ucu
GDP-bağlı tubulin monomeriyle kapatılır.
GDP-bağlı tubulin polimer için düşük afiniteli
olduğundan mikrotübülün diğer proteinlerle
ilişkisini stabilize edemediğinden katastrofik,
yıkıcı depolimerizasyona yolaçar.
Mikrotübüller bölünen hücrelerde polimerizasyon
ve depolimerizasyon açısından hızlı siklüse
uğrarlar.
tubulin polimerlerinin bütünlüğü ve
yönlendirilmiş polimerizasyonu
mikrotübülle-ilişkili proteinler (MAPs)
aracılığı ile stabil hale getirilmektedir.
MAPs dendritlerde vardır, fakat aksonlarda
yoktur.
Halbuki tau ve MAP3 aksonda bulunmaktadır.
Alzheimer ve diğer bazı nörodejeneratif
hastalıklarda, tau proteini modifiye olmuş ve
karakteritik nörofibriler tangle şeklinde
isimlendirilen anormal yapıda polimerize
olmuştur.
Tubulinler bir multigen ailesi
tarafından kodlanmaktadır.
En az 6 gen alfa ve beta altbirimlerini
kodlar.
Farklı gen ekspresyonları ve posttranskripsiyonel modifikasyonlarla
beyinde 20’den fazla tubulin
izoformları vardır.
Nörofilamentler 10 nm çapında hücre
iskeletinin kemikleridirler.
Aksonun en çok bulunan fibriler bileşenidir,
Ortalama bir aksonda mikrotübülden daha
fazla 3 ila 10 kez daha fazla nörofilament
bulunur.
Saç, tırnak gibi sitokeratinli epitel
hücreleriyle ilişkilidirler,
Astrositlerde fibriler asidik protein, kasda ise
desmin gibi sitokeratinli epitel hücreleriyle
ilişkilidirler
Nörofilamentler, mikrotübüllerin aksine stabil
yapıda ve hücrede neredeyse tamamen
polimerizedir.
3-7 nm çapındaki mikrofilamentler iskelet yapıda
fiberlerin üç ana yapısı içinde en ince olanıdır.
Kasın ince filamentleri gibi mikrofilamentler
polimerize globular aktin monomerlerinin iki
zincirinden oluşurlar.
Herbiri ATP veya ADP taşıyan çift-zincirli heliks
yapıdadır.
Aktin hücrenin başlıca komponenti ve doğada en
çok bulunan hayvansal proteindir.
Aktinin α-aktin türü iskelet kasında bulunmakta,
Nöral aktin omurgalılarda beta ve gama türlerine
göre daha fazladır,
Herbiri farklı bir gen tarafından kodlanır.
Mikrotübül ve nörofilamentlerden farklı olarak
aktin filamentleri kısadır.
Aktin filamentleri, hücre periferinde konsantre
halde plazmalemmanın hemen altında Kortikal
plazmada, spektrin-fodrin,ankirin,talinve aktinin
gibi birçok aktin-bağlayan proteinlerle bulunur.
Bu matriks gelişme sırasında, hücre yüzeyinin
mikro-domenlerinin oluşumunda, pre- ve
postsinaptik morfolojilerde , hücrenin dinamik
fonksiyonunda önemli rolü vardır.
Mikrotübüller gibi mikrofilamentler de
polimerizasyon ve depolimerizasyona uğrar
Mikrotübül ve mikrofilamentler sinaptik bağlantı
ve etkinliğinde başlıca faktör olduğu ve bu
yüzden uzun-dönem hafıza ve öğrenmede
önemli oldukları düşünülmektedir.
Fibriler yapının atlası
A.Mikrotübüller heliks
yapısında 13 protofilamentten
oluşmuş en geniş fibriler
yapıya sahiptir. Herbir
protofilament alfa ve beta
altbirimlerden meydana
gelmiştir.
B.Nörofilamentler ince sarmal
yapıda heterodimerik
monomerlerden oluşmuş.İki
protofilament bir
protofibrilden oluşur, üç
protofibril birbirleri etrafında
dönerek nörofilamentin
10nm’lik formunu oluşturur.
C.Mikrofilamentler polimerize
olmuş iki globular zincirden
oluşmuş en küçük çapa sahip
fibrildir.6 farklı aktin
memelilerde vardır, globular
monomerler asimetrik
oldukları için polardırlar.
Nöron membran ve sekretuar proteinlerin
dağılımı aksonal transport tarafından
kontrolu
Nöronlardaki sekretuar işlemler diğer
hücrelerdekine benzemesine rağmen sinir
hücresinin polaritesinden dolayı oldukça farklılıklar
göstermektedir.
Nöron gövdesinin sinir sonlarından çok uzakta
olması nedeniyle yeni oluşan membran ve
golgideki sekretuar protein özel taşıma sistemi
gerektirmektedir.
Örneğin bir motor nöronda insan ayak kasının
inerve edilebilmesinde hücre gövdesiden sinir
terminaline olan mesafe hücre gövde büyüklüğünü
10.000 kez aşmaktadır.
Membran ve sekretuar ürünler hücre
gövdesinden akson ucuna aktif
olarak taşınmakta olup vesikül,
partikül ve büyük makromoleküllerin
uzun mesafeyi aşmasında pasif
difüzyon oldukça yavaş kalır.
Nöronda membran trafiği
1948’de ilk defa Paul Weiss tarafından
siyatik siniri bağladığında sinirde bağlanan
yerin proksimal yönünde zamanla
aksoplazmanın biriktiğini gözlemledi
Hücre gövdesinden terminale doğru
aksoplazmanın hareketi aksoplazmik akış
adını alır,
Weiss akışın biri hızlı diğeri yavaş olmak
üzere iki ayrı mekanizma tanımlamıştır.
Membranöz organeller sıcak-kanlı
hayvanlarda, bir günde 40mm’den
hızla transport şekli olan hızlı aksonal
transport ile
hücre gövdesine doğru retrograde ve
terminale doğru hareket anterograde
yönelme adını alır.
Buna zıt, sitozolik ve hücre iskelet
proteinleri sadece yavaş aksonal
transport olan daha yavaş transport
ile taşınırlar.
Aksonal transport
Hızlı ileriye (forward moving) transport ile membranöz
organellerin taşınması
Büyük membranöz organeller hızlı
transportla aksona doğru taşınmaktadırlar.
Bu organeller Sinaptik vesikül
prekürsörlerini içermektedir,
Bunlar RNA’ları taşıyan protein partikülleri
gibi düz yüzlü endoplazmik retikulum
elementleri, mitokondri, büyük yoğunçekirdek vesikülleridir.
Aksonlardaki hızlı ileriye doğru transport duran ve
giden tarzda (saltatory) aksonun ana aksisi
doğrultusunda mikrotübüllerin lineer hareketiyle
sağlanır.
Dorsal kök gangliyon hücrelerinde ilk yapılan
deneyler anterograde hızlı transportun kritik olarak
ATP’ye bağlı olduğunu göstermiştir (işaretli
aminoasit injekte edildiğinde).
Mikrotübül fikri belli alkaloidlerin mikrotübülleri
harapladığı, mitozu blokladığı bulgusundan ortaya
çıkmıştır ki, bu şekilde hızlı transport interfere olur.
Motor molekülleri için ileriye doğru hareketi alfa ve
beta subunitlerinden oluşan kinesinin sağladığı
düşünülmektedir.
Türler arasında farklılık gösteren kinesin
mikrotübüller boyunca çok az mesafeye sahip
hareket etmekte olan membranlı organeller
arasında çapraz köprüler oluşturmaktadır.
Yıllar önce elektron mikroskobu çalışmaları
mikrotübül ve vesikül molekülleri arasındaki
çapraz köprülerin partiküllerin hareketinde önemli
rol oynadığını göstermiştir.
Nöron dışındaki diğer hücrelerde bu hareket
aktin ve dyneine bağlıdır.
Yavaş aksonal transport
Sitoplazma iskelet elementleri ve
sitoplazmik çözülebilir proteinler
aksona doğru yavaş aksoplazmik
akışla gerçekleşir.
Bu iskeleti oluşturan fibriller element
proteinleri bu yolla taşınır.
Yavaş transport sadece anterograd
yönde gerçekleşir ve farklı hızda farklı
proteinleri taşımak için en az iki
kinetik komponent içermektedir.
Daha yavaş olan komponentinin hareketi günde
0.2-2.5mm olarak gerçekleşir,
iskeletin fibriler elemenlerinden oluşan proteinleri
taşır.
Bunlar nörofilamentlerin altbirimleri ve alfa ve
beta-tubulin altbirimleridir.
Nörofilament monomerleri veya kısa polimerler
(protein köprüleriyle çapraz bağlandıkları için)
mikrotübüllerle pasif olarak birlikte hareket eder.
Yavaş aksonal transportun diğer komponentinde
ise transport iki kez daha yavaş gerçekleşir.
Diğer protein ve çeşitteki enzimler gibi Klatrin,
aktin ve aktin-bağlayan proteinleri taşırlar.
Hızlı geriye transport
Parçalanacak, restore edilecek veya yeniden
kullanılacak materyal hızlı transportla sinir
uçlarından nöron hücresinin gövdesine
doğru olmaktadır.
Bu materyaller lizozom sisteminin parçası
olan büyük membrana bağlı organeller
içinden paketlenir.
İleriye doğru transportta olduğu gibi
hareket mikrotübüller boyunca olmaktadır.
Hızlı geriye doğru transport için motor
molekülü mikrotübülle ilişkili ATPaz (MAP1C) olan dyneindir.
Hızlı geriye transport-2
Genellikle geriye doğru fonksiyonu daha çok çöp
temizlemek için görünse de, sinir uçlarından
nöron gövdesine doğru materyalin klinik önemi
de bulunmaktadır.
Nöronların büyümesini sağlayan sinir
büyüme faktörü bu yolla olmaktadır. Geriye
doğru transportun hücre gövdesini
bilgilendirdiğine (makromoleküllerin
sentezi) dair çok bilgi bulunmaktadır.
Aksondan taşınan her şey hücre için faydalı
değildir. Bazı nörotrofik virüsler ve toksinlerde bu
yolla merkezi sinir sistemine ulaşır.
Bu herpes simpleks, polio virus ve tetanus toksini
için de ispatlanmıştır.
Endoplazmik retikulumda protein sentezi
Serbest ve membrana
bağlı polizomlar mRNA’yı
protein kodlanması için
farklı yollara gönderirler.
Nukleusda transkribe
edilen mRNA nükleer
porlardan geçerek
sitoplazmada polizomları
oluşturur.
Sekretuar ve membran
proteinleri kaba yüzlü
endoplazmik retikulum
membranına
transportlanır.
Proteinler diğer sekretuar hücrelerdeki gibi
nöronlarda sentezlenmektedirler
Sekretuar ve membran proteinleri
endoplazmik retikulumda sentez edilmekte
ve modifiye edilmektedirler.
Sekretuar ve membran proteinlerinin
mRNA’ları kaba yüzlü endoplazmik
retikulum memranıyla bağlantılı olarak
polipeptid zincirlerine çevrilirler.
Protein sentez yeri ribozomlar olduğu için
endoplazmik retikulumun sitozolik
yüzeyine eklenmesi transferi mümkün
kılar.
Polipeptid zincirinin tamamının retikulum
lümenine transferi sekretuar bir proteinin
üretimini sağlar.
Bunun önemli örneği nöroaktif
peptidlerdir.
Transfer tamamlanamaz ise integral
membran proteini oluşumu ile sonuçlanır.
Polipeptid zincir sentez sırasında membranı
birçok kereler geçtiği için membranda-uzanmış
konfigürasyonları proteinin primer aminoasit
dizisine bağlıdır.
Bunun önemli örnekleri ise nörotransmiter
reseptör ve iyon kanallarıdır.
Bazı proteinler transport edildiği endoplazmik
retikulumda kalır,
Diğerleri vakuoler apareylerin kompartmanlarına
veya plazmalemmaya geçer veya ekstrasellüler
aralığa sekrete edilir.
Sitozol içinde redükleyici çevrede
gerçekleşemeyen serbest sülfidril yan
zincirlerinin oksidasyonunun neden olduğu
molekül içi disülfid köprüsünün oluşumu önemli
bir modifikasyondur.
Disülfid köprüsü proteinlerin tersiyer
yapılarının oluşumunda çok önemlidir.
Proteinler sitozolik enzimlerle ya sentez
sırasında (kotranslasyonel modifikasyon)
veya daha sonra ( post-translasyonel
modifikasyon) modifiye edilirler.
N-açilasyonun bir örneği büyümekte olan
polipeptid zincirine N-terminal ucuna bir
açil grubunun transferidir.
Sekretuar proteinler golgi kompleksinde
modifiye edilmektedirler
Proteinler endoplazmik retikulumdan
transport vesikülleri içinde golgi
kompleksine taşınır,
Golgi kompleksinde modifiye edilip
sinaptik terminallere ve plazmalemmanın
diğer kısımlarına hareket ederler.
Vesiküller Endoplazmik retikulumdan golgi
kompleksinin cis kısmına (golginin nukleusa bakan
yüzü) ulaşırlar, membranları golgi membranıyla
birleşir ve içerikleri golgi kompleksine geçer.
Buradan golginin bir seri enzimatik reaksiyona
uğrayacakları trans tarafına geçerler.
Protein modifikasyonlarının bazıları endoplazmik
retikulumda başlar.
Bu modifikasyonlar N-linked ve O-linked
oligosakkaridlerin eklenmesi, glikozilasyon,
fosforilasyon ve sülfatlanmadır.
Hem çözünebilen hem de membrana-bağlı
proteinler trans-golgiden farklı moleküler
kompozisyonlara ve yollara hareket ederler.
Trans-golgiden transport edilen proteinler
sekretuar ürünler olup plazmalemmanın yeni
sentezlenen bileşenleri (devamlı şekilde sekrete
edildiklerinden constitutive devamlı
sekresyondurlar), endozomlardır.
Yüzey membran ve ekstarsellüler maddeler
hücrede yeniden kazanılmaktadır
Vesiküler trafik hücre yüzeyine doğru plazmalemmadan
internal organellere doğru endositik trafik ile
dengelenmektedir.
Endositik trafiğin önemli bir fraksiyonu klatrinlekaplanmış vesiküllerle gerçekleştirilir.
Klatrin kılıf seçici olarak transmembran reseptörlerle
interaksiyon kurar,
Bu şekilde ekstrasellüler moleküllerin hücreye alınması
sağlanır.
Klatrinle-düzenlenen hücre içine alım reseptörle-düzenlenen
endositoz adını alır.
Kutu 4-1 anormal protein bikimi birçok
nörolojik bozuklukların özelliğidir
Tau bir mikrotübül-bağlayıcı proteinidir ve
normal şartlarda sinir hücresinde
mevcuttur.
Alzheimer hastalığında ekstrasellüler
aralıkda olduğu gibi nöron ve gliada ışık
mikroskobuyla görünebilen anormal tau
agragatları bulunmaktadır.
Fazla miktarda fosforillenmiş tau molekülü
uzunca bir şekilde düzenlenmiş, ince
polimerler biri diğerinin etrafında dönerek
çiftleşmiş helikal formda filamentleri
oluşturmuştur.
Nörofibriler tangle şeklinde isimlendirilen polimer demetleri
hücre gövdesi, dendrit ve aksonlarda birikmektedir.
Kutu 4-1--2
Normal nöronlarda tau ya mikrotübüle bağlıdır
veya sitozolde serbest halde bulunur.
Tangıllarda, mikrotübüllere bağlanma yoktur
fakat yüksek derecede çözünmez özelliktedir.
Kısmen tangıl şekli vardır, çünkü tau proteolitik
olarak degrade edilmez.
Birikimler tubulin polimerizasyonunu
bozar, bu şekilde aksonal transporta engel
olmaktadır.
Sonuçta nöron şekli korunamaz.
Kutu 4-1--3
Birikimler hareket bozukluğu olan
progresif supranükleer palsili hastaların
nöronlarında, fronto-temporal demanslı
hastaların frontal ve temporal lobları
etkileyen bir grup nörodejeneratif
bozuklukda görülmektedir.
fronto-temporal demansların ailesel
formlarında tau geninde mutasyonlara
neden olmaktadır.
Kutu 4-1--4
Anormal agregatlar glial hücrelerde
de bulunur.
Progresif supranükleer palsi, kortikobazogangliyonik dejenerasyon ve
fronto-temporal demanslarda hem
astrosit hem de oligodendrositlerde
de anormal agregat yapısı
görülmektedir.
Kutu 4-1--5
Alzheimer hastalığında, β-amiloid
peptidin ekstrasellüler aralıkda
biriktiği görülür.
Çok geniş integral membran proteini
olan Amiloid prekürsör proteininin
küçük bir proteolitik ürünü olarak
normal şartlarda hücreiçi
membranlarla ilişkili proteolitik
enzimlerle işlem görmektedir.
Kutu 4-1--6
β -sekretaz enzimini gerektiren proteolitik
yolak β-amiloidi oluşturur.
Bilinmeyen sebeplerle, Alzheimer hastalığında
amiloid prekürsördeki anormal miktarları β sekretaz enzimiyle işlem görmektedir.
Erken-başlangıçlı ailesel Alzheimer hastalığı olan
bazı hastalarda ya amiloid prekürsör geninde
ya da membran proteinleri presenilin 1 ve
2’yi kodlayan genlerde mutasyonlar
meydana gelir.
Parkinson hastalığında nöronun hücre
gövdesinde α-synucleinin anormal
agregatları birikir.
Kutu 4-1--7
Tau gibi α-synuclein hücrenin normal çözünebilen
bir bileşenidir.
Fakat Parkinson hastalığında çözünmez hale
gelir ve Lewy cisimcikleri şeklinde spherik
çözünmeyen inklüzyonlar oluşturur.
Bu inklüzyonlar ayrıca ubikitinde
içermektedir.
Ubikitin proteinlerin proteozomal yıkılımı
için gereklidir.
Kutu 4-1--8
Bu anormal protein birikimleri nöron
ve glianın fizyolojisini etkiler mi
Diğer taraftan bu birikimler
proteinlerin değişikliğe uğramış posttranslasyonel işlenmesine cevap
olarak meydana gelebilir ve anormal
proteinleri izole etmekte görev yapıp
normal hücre aktivitelerine izin verir.
Kutu 4-1--9
Birikimler membran trafiği gibi
aksonal ve dendritik transportu
bozabilir.
Alzheimer ve Parkinson hastalıklarında
nöron içinde anormal protein agregatları
Kutu 4-2 Aksonal transportta nöroanatomik
izlemenin kullanılması
Nöroanatomistler spesifik sinir hücre
gövdelerinin akson ve terminallerini boya
mikroinjeksiyonu ile lokalize ederler
radyoaktif işaretli aminoasitlerin
verilmesinden hemen sonra spesifik
proteinleri otoradyografik olarak izlerler,
fluoresan proteinlerin ekspresyonu,
glukoz, amino şekerler, glikoprotein gibi
işaretli şekerler veya spesifik transmiter
maddeler verilerek izlenebilmektedirler.
Kutu 4-2--2
Benzer şekilde proteinler, partiküller veya boyalar
endositozla sinir terminalinden kendiliğinden
alınır ve hücre gövdesine transport edilerek hücre
gövdesinin tanınmasında kullanılır.
Bu tip çalışmalarda Horse Radish Peroksidaz
en yaygın kullanılan enzimdir.
Çünkü bu enzim kendiğinden retrograde
transporta uğrar ve oluşan reaksiyon ürünü
histokimyasal olarak görüntülenir.
Kutu 4-3 Miyelin proteininde meydana gelen
hatalar sinir sinyallerini iletimini bozar
Sinir impulsunun miyelinli aksonlarda normal
iletisi olduğu için miyelin kılıfın hatalı miyelinin
yalıtımsal
özelliğinden dolayı motor ve sensör
fonksiyonda ciddi bozulmalara neden olur.
Miyelini etkileyen birçok hastalıkdaki
demiyelinizan hastalıkların hayvan modellerinde
genetik bir temeli olduğu gösterilmiştir.
Ürperen (shiverer) mutant fare de titremeler ve
sıklıkla kasılmalar olmakta ve genç dönemde
kaybedilmektedir.
Kutu 4-3--2
Bu farelerde santral sinir sisteminin
akson miyelinizasyonu büyük ölçüde
hasarlıdır ve miyelinizasyon anormal
şekildedir.
Bu hastalığa neden olan mutasyon
farede 18. kromozomda yerleşmiş
miyelin basic proteinini kodlayan
genin 5 veya 6 ekzonunun
delesyonudur.
Kutu 4-3--3
Mutasyon resesifdir, her iki parentten defektif
geni aldığında hastalık ortaya çıkmaktadır.
Her iki defektif geni kalıtımla almış olan Shiverer
faresi normal farede bulunan miyelin basic
proteininin %10’ununu taşımaktadır.
Shiverer mutantın fertilize olmuş yumurtasına
mutantı kurtarmak amacıyla yabani tip genin
injekte edildiğinde transgenik fare yabani tip geni
eksprese eder fakat MBP’lerin normal miktarının
ancak %20’sini üretebilir.
Kutu 4-3--4
Transgenik fareler bazı zamanlarda titremeleri
olmasına rağmen konvülsiyonları yoktur ve
normal yaşam süresine sahiptirler.
Santral ve periferik sinir sistemi miyelinleilişkili glikoproteini (MAG) taşımaktadırlar.
MAG immünglobulin süperailesine ait bir
glikoproteindir.
Antijenlerin major hücre histokompatibilite
kompleksi, T-hücre yüzey antijeni ve nöral
hücre adezyon molekülü gibi hücre-hücre
tanınmasında ilişkili olduğu
düşünülmektedir.
Kutu 4-3--5
MAG Shwann hücrelerinde miyelin üretimi
sırasında erken eksprese edilir ve olgun
(kompakt) miyelinin bir bileşeni olur.
Erken ekspresyonda, subsellüler lokasyonu
ve diğer yüzey tanıma proteinlerine yapısal
benzerliği olması önemli bir adezyon
molekülü olduğunu düşündürmektedir.
Santral aksonlarda miyelinde proteinin yarısından
çoğunu proteolipid proteini (PLP) oluşturur,
membran boyunca uzanmış 5 domenden
oluşmuştur.
Kutu 4-3--6
Proteolipidler lipoproteinlerden
farklıdırlar, suda çözünmezler, ancak
organik çözücüde çözünürler.
İnsanda PLP’deki birçok mutasyon
Jimpy fare örneğindeki olduğu gibi
diğer memelilerde de bilinmektedir.
Bir örneği insanda X’e bağlı
heterojen Pelizaeus-Merzbacher
hastalığıdır.
Kutu 4-3--7
Neredeyse tüm PLP mutasyonları
molekülün membran boyunca uzanan
domeninde meydana gelir.
Mutant hayvanlar azalmış miktarda PLP
yani hipomiyelinizasyon ve dejenerasyon,
oligodendrosit ölümü görülür.
Bu gözlemler PLP’nin miyelin
kompaktlaşmasıyla ilgili olduğunu
düşündürür.
Kutu 4-3--8
Olgun periferal miyelinin başlıca proteinin
miyelin protein zero (MPZ veya Po)
Schwann hücrelerinin plazmalemmasında
uzanır.
MAG gibi basic hücreiçi domeni vardır ve
immünglobulin süperailesinin bir üyesidir.
Genetik olarak oluşturulmuş farede Po
Fonksiyonu zayıf motor koordinasyonu,
titreme ve bazen ortaya çıkan kasılmaları
elimine etmektedir.
Kutu 4-3--9
Trembler fare mutantlarındaki
gözlemlerde periferal miyelin proteini
22 (PMP 22) nin tanınmasına yol
açmıştır.
PMP 22 mutasyonları
17.kromozomda gen duplikasyonuyla
herediter periferal nöropatilerden biri
olan Charcot-Marie-Tooth
hastalığına yolaçar.
Charcot-Marie-Tooth hastalığında periferal
miyelin protein 22’nin artmış üretiminden
dolayı miyelinizasyon bozulması
Glial hücrelerin Nöral Fonksiyon
üzerine çeşitli rolleri vardır
Glia Aksonların yalıtım kılıfını
şekillendirir
Oligodendrosit ve Schwann hücrelerinin
başlıca fonksiyonu;
Elektrik sinyalinin akson boyunca hızlı bir
şekilde iletimine olanak tanıyan yalıtımı
sağlayıcı materyali sağlamaktır.
Bu hücreler akson boyunca birçok
kez konsentrik şekilde sarılarak ince
miyelin kılıfı oluştururlar.
Merkezi sinir sisteminin miyelini
oligodendrositler tarafından yapılır
Schwann hücrelerince yapılan periferik
sinir sistemininkine benzer fakat identik
değildirler.
Glianın heriki tipi aksonun sadece
segmentlerinde miyelin oluşturur.
Aksiyon potansiyelinin ilerlemesini
kolaylaştırmak için bu sebepten dolayı
akson miyelinle devamlı şekilde
sargılanmamıştır.
Bir Schwann hücresi bir aksonun bir
segmenti için tek miyelin kılıf
oluşturmaktadır
Halbuki bir oligodendrosit 30 akson
kadar çok segment için miyelin kılıfı
oluşturur.
Santral ve periferik nöronlar için
aksonları Miyelini yalıtımcı görevi yapar
C.Bir periferal sinir lifinin bir Schwann hücresiyle
birkaç evrede myelinlenmesi.
Evre 1:Schwann hücresi aksonu çepeçevre
kuşatır.Evre 2: plazma membranının dış yönü diğer
bölgeyle sıkıca birleşir, bu birleşme myelin membran
oluşumunun ilk oluşumunu gösterir.
Evre 3:myelinin birkaç tabakası Schwann hücre
sitoplazmasının akson çevresinde sürekli şekilde
dönüşüyle oluşmaktadır.
Evre 4: Schwann hücre sitoplazmasının çoğunun en
içteki döngünün sıkışarak dışarı çıkmasıyla olgun
myelin oluşur.
A.merkezi sinir sistemindeki
aksonlar oligodendrositler
tarafından birkaç tabaka halinde
sarmalanırlar. Herbir
oligodendrosit birçok miyelini
yaparlar.
B.elektron mikrografında farenin
siyatik sinirindeki bir aksondan
çapraz kesitte iç mesakson
olarak adlandırılan yapıda
miyelin kılıfın orijini
görülmektedir. Dış mesaksonda
devamlılık gösteren Schwann
hücresinde yüzey membranından
kılıf oluşmaktadır. Schwann
hücre sitoplazması hala
çevrelemektedir, sonunda dışta
sıkışır ve miyelin tabakalar
kompakt hale gelir.
Bir aksondaki miyelin tabaka sayısı
akson çapına orantılı olarak daha
geniş aksonlarda daha ince kılıf
bulunmaktadır.
Çapı çok daha küçük olan aksonlar
miyelinli değildir, bu aksonlar
çaplarınınn küçüklüğü ve miyelin
yalıtımı olmadığından miyelinli
olanlara göre aksiyon potansiyelini
çok daha yavaş iletirler.
Kılıfın lamellar yapı ve biyokimyasal
kompozisyonu miyelinin nasıl glial plazma
membranından oluştuğunun sonucudur.
Periferik sinir sisteminin gelişiminde,
miyelinizasyon olmadan önce akson
Schwann hücreleri tarafından oluşturulan
bir kanal, oluk içinde uzanmaktadır.
Schwann hücreleri akson boyunca
düzenli aralıklarla dizilerek
miyelinlenmiş akson segmentlerini
oluşturmaktadır.
Herbir Schwann hücresinin dış
membranı mesakson olarak
isimlendirilen çift membran yapısı
şeklini oluşturarak aksonu çepeçevre
kuşatarak akson etrafında konsentrik
tabakalar spiraller oluşturur ve
devam eder.
Akson kılıflandıkça Schwann hücre
sitoplazması sıkıştırılır ve kompakt
lamellar yapıyı meydana getirir.
Miyelin kılıfın düzenli şekilde boşluklu
segmentleri miyelinlenmemiş boşluklarla
ayrılır, Ranvier düğümleri olarak
isimlendirilerler,
Aksonun plazma membranı yaklaşık 1µm
aralıklarla ekstrasellüler aralığa maruz
kalır.
Bu düzenlenme sinir impulslarının iletimini
insanda 100m/s’ ye kadar arttırır,
Sinyal bir düğümden diğerine atladığı için
bu mekanizma saltatuar ileti olarak
adlandırılır.
Akson myelin kılfının Ranvier düğümü olarak
adlandırılan düzenli boşlukları vardır
A. Elektron mikrografı periferik
sinir sisteminde ve spinal korddan
aksonların düğüm bölgelerini
göstermektedir. Düğümlerde
myelin katmanın olmadığı
görülüyor.
B. Ranvier düğümünün heriki tarafındaki
bölgelerde akson ve miyelinleme yapan
hücre arasında stabilleştirilmesi sağlamak
için ilişkinin zengin olduğu görülüyor.
Aksonda K+ ve Na+ kanallarının
lokalizasyonunu kısıtlamak için
düğümlerin yerinin değişmemesi de
sağlanmış olur. Potasyuma geçirgen
kanallar ve Caspr2 adezyon proteini
jukstaparanod bölgede konsantre
olmuştur. Paranod bölgesi Caspr2,
contactin ve neurofascin gibi adezyon
proteinlerince zengindir.
Membran-hücre iskeleti bağlayıcı ankyrin
G ve hücre adezyon molekülleri NrCAM
ve NF186 düğümlerde konsantredir.
Düğümler düşük eşik değerine sahip
olduklarından kolaylıkla uyarılırlar.
Düğümdeki akson membranında Na+
kanal yoğunluğu membranın miyelin
kılıflı bölgelerine göre yaklaşık 50 kez
daha büyük aksiyon potansiyeli
oluşturur.
Düğümler arası bölgelerdeki bazı
hücre adezyon molekülleri miyelin
sınırının stabil tutulmasını sağlar.
İnsan femoral siniri primer sensör aksonu
yaklaşık 0,5m uzunlukta ve düğümler arası
mesafe 1-1,5mm,
Böylece dorsal kök gangliyonun hücre gövdesi ve
uyluk kası arasında bir afferent lif boyunca
yaklaşık 300-500 Ranvier düğümü
bulunmaktadır.
Herbir düğümler arası segment tek Schwann
hücresi tarafından oluşturulduğu için herbir
periferik sensör aksonunda 500 Schwann hücresi
kadar çok hücre miyelinizasyona katılmaktadır.
Miyelinin bileşimi plazmalemmanınkine
benzer şekilde yüksek konsantrasyonda
kolesterol ve fosfolipid bulunduran %70
lipid ve %30 proteinden oluşan lipid çift
tabakaya proteinlerin serpiştirilmesiyle
oluşmuştur.
Merkezi sinir sistem miyelininde başlıca iki
protein bulunmaktadır:
a) Miyelin basic protein
b) Proteolipid protein
Miyelin basic protein kompakt halde
sitoplazmik yüzeyde yerleşmiş pozitif
olarak yüklü küçük bir proteindir.
Proteolipid protein ise hidrofobik
integral membran proteinidir.
Bu iki proteinin kılıfın yapısal
stabilitesini sağlamakla görevli
oldukları zannedilmektedir.
Ayrıca multipl skleroz gibi
demiyelinizan hastalıklarda immün
sisteme karşı önemli otoantijenler
oldukları gösterilmiştir.
Guillian-Barre sendromu gibi
demiyelinizan periferal nöropatide bu
proteinlere karşı otoimmün
reaksiyonlar meydana gelmektedir.
Astrositler sinaptik sinyali
desteklemektedir
Astrositler beyinde bütün bölgelerde yıldız
biçimli gliadırlar.
Beyin hücrelerinin yaklaşık yarısını
oluştururlar.
Nöronları beslemede ve ekstrasellüler
aralıktaki iyon ve nörotransmiterlerin
konsantrasyonlarının düzenlenmesinde
önemli rolleri vardır.
Astrosit ve nöronlar sinaptik sinyalin
modüle edilmesinde birbirleriyle ilişki
içindedirler, fakat tam olarak hala
anlaşılamamıştır.
Astrosit prosesi sinapsla yakından ilişkilidir
astrosit prosesi presinaptik
ve postsinaptik elemanlarla
yakından ilişki içindedir.
presinaptik nörondan
serbestlenen Glutamat
sadece postsinaptik
nörondaki reseptörleri
aktive etmez ayrıca
astrositlerde AMPA
reseptörlerini de aktive
eder.
Astrositler yüksek afiniteli
transportır proteinleriyle
sinaptik boşluktan
glutamatı uzaklaştırır.
Astrositler beyinde nörotransmiter
konsantrasyonunu da düzenlemektedirler.
Örnek olarak, astrosit plazma
membranında yerleşmiş yüksek-afiniteli
transpoterlar sinaptik boşluktan
nörotransmiter glutamatı hızlı bir şekilde
temizlerler.
Glutamat glial hücreye girdiğinde glutamin
sentaz enzimiyle glutamine çevrilir.
Glutamin daha sonra nöronlara transfer edilir,
glutamatın ara prekürsörü olarak hizmet eder.
Alınma mekanizmalarıyla karışma olduğunda
ekstrasellüler glutamatın yüksek
konsantrasyonlara çıkmasına neden olur,
Bu durumda eksitotoksisite olarak adlandırılan
bir olaya ve nöronun ölümüne yolaçar.
Astrositler dopamin, norepinefrin, epinefrin ve
serotonin de degrade edebilmektedir.
Astrositler nöronlarınkine benzer
şekilde nörotransmiter reseptörlere
sahipler ve nöronlar tarafından
serbestlenen K+ ile depolarize
edildikleri için nöronlar aktive
olduklarında duyarlı hale gelirler.
Örneğin serebellumda Bergman glia
glutamat reseptörlerini eksprese
etmektedir.
Böylece, serebellar sinapsta
serbestlenen glutamat sadece
postsinaptik nöronda serebellar
sinapsı etkilemekle kalmaz ayrıca
sinaps yakınındaki astrositleri de
etkiler.
Glial reseptörlere bu ligandların
bağlanması serbest hücreiçi Ca+2
konsantrasyonunu arttırır;
Bunun da önemli sonuçları vardır.
Bir astrositin komşu astrositlerle gap
junctionlar vasıtasıyla ilişkiye geçer
ve böylece birçok hücre arasında
küçük moleküllerin ve iyonların
transferine olanak sağlanmış olur.
Bir astrosit içinde sebest Ca+2 daki
artış komşu astrositlerde Ca+2
konsantrasyonunu arttırmaktadır.
Astrosit networku yoluyla Ca+2
iyonunun bu yayılımı yüzlerce
mikrometreyi aşmaktadır.
Olasıdır ki, bu Ca+2 dalgası
nütrientlerin serbestlenmesini
tetikleyerek nöronal aktiviteyi
düzenler ve kan akımını regüle eder.
Astrositlerde Ca+2 artışı sinaptik
fonksiyonu arttıran sinyal
sekresyonuna neden olur.
Fakat bu sinyallerin spesifik moleküler
komponentleri anlaşılamamış.
Astrositler sinapsların gelişiminde de
önemlidirler.
Nöronun yüzeyini sinaps oluşumu için hazırlarlar,
yeni oluşan sinapsları stabilize ederler.
Örneğin, astrositler trombospondin adı verilen
maddeleri sekrete ederek yeni sinaps oluşumunu
teşvik ederler.
Aksonal hasarla oluşan kromatolizis gibi patolojik
durumlarda, astrositler ve presinaptik terminaller
geçici olarak hasarlanmış postsinaptik hücre
gövdelerini içlerine alırlar.
Astrositler nöron ve oligodendrositlerin
gelişim ve hayatta kalmasını teşvik eden
nörotrofik ve gliotrofik faktörleri
serbestlerler.
Ayrıca diğer hücreleri oksidatif stresin
etkilerinden korurlar.
örneğin, astrositlerde glutatyon
peroksidaz hipoksi, inflamasyon ve nöral
dejenerasyon sırasında açığa çıkan toksik
serbest oksijen radikallerini detoksifiye
eder.
Sonuç olarak, astrositler küçük
arterioller ve kapillerle kılıflanır, bu
şekilde beynin her tarafında astrosit
proses sonları ve endotel hücreleri
çevresindeki bazal lamina arasında
temas oluşumunu sağlar.
Koroid pleksus ve ependimal hücreler
serebrospinal sıvıyı üretmektedir
Ependima ve koroid pleksus hücreleri
olgunlaşmamış nöroepitelden oluşmaktadırlar.
Siliyer yapıda küboidal hücrelerin tek tabakası
olan ependima beyin ventriküllerinde
uzanmaktadır, ventriküler sistem boyunca
serebrospinal sıvının hareketine yardımcı olur.
Ependima lateral ve dördüncü ventriküllerin bazı
bölgelerinde ventriküllere doğru çıkıntı yapan
ince kan damarlarını örten koroid pleksus
hücreleriyle devamlılık gösterir.
Bu koroid pleksus epitel hücreleri kandan
plazmayı filtre eder ve serebrospinal sıvı olarak
bu ultrafiltratı sekrete eder.
Beyindeki Mikroglia kemik
iliğinden oluşmaktadır
Nöron, astrosit ve oligodendrositlerden farklı
olarak mikroglia nöroektodermel kökene
ait
değildir.
Gelişmenin erken döneminde sinir sistemine
girer, yaşam boyunca beyinde tüm bölgelerde
kalır.
Büyük ihtimalle santral sinir sisteminde dışarıdan
yabancı istilacılara karşı immünolojik olarak
hayatta kalmada harekete hazır şekilde önemli
rolleri olmasına rağmen Fonksiyonları tam olarak
anlaşılamamış.
Santral sinir sistemindeki hücrelerin tümü içinde
microglia inflamasyon sırasında lenfositlere
antijen sunan ve işleyen sitokin, kemokin sekrete
eden en iyi hücre tipidir.
Böylece lenfosit, nötrofil ve monositleri santral
sinir sistemine getirmede hizmet etmektedir,
İnfeksiyon, strok ve immün-olarak düzenlenen
demyelinizan hastalıklarda önemli immünolojik
aktiviteleri bulunmaktadır.
Mikroglia ayrıca makrofajlara dönüşmekte ve
strokdan veya diğer dejeneratif nöronal
bozukluklardan sonraki hücresel kalıntıları
temizlemektedir.
Nöronun kısımları
Nöron gövdesi
Dendritler
Aksonlar
Terminaller
Membranlı organeller
Mitokondri
Peroksizom
Endoplazmik retikulum
Golgi cisimciği
Lizozom
Transport ve secretuar vezikül
Nöron içi membran sistemi
1-Nukleustan plazma membranına
kadar uzanan membran
2-Mitokondri
3-Peroksizom
Bu üç membran sistemi nöronun farklı
kompartmanlarında bulunmakta, farklı
proteinlerlerden oluşmakta ve farklı
görevler yapmaktadırlar.
Protein sentezi aşamaları
1-amino asitlerin aktivasyonu
2-başlama (initiation)
3-uzama (elongation )
4-sonlanma ve salınma (termination
and release)
5- katlanma ve translasyon sonrası
işlemler ( folding and
posttranslational processing)
1-Hücre membran sistemiyle
ilişkili olarak sentezlenen
proteinler
2-Sitozolde sentezlenen
proteinler ve orada kalanlar
2-Sitozolde sentezlenen fakat
daha sonra nukleus, mitokondri
ve peroksizoma katılan proteinler
Sitozolik Proteinler
Sitoplazmanın iskelet yapısını oluşturan
fibriler
elementler
(nörofilamentler,tubulinler,aktinler)
Birçok metabolik reaksiyonu katalizleyen
enzimler. Bu enzimlerden bazıları nörona
spesifiktir.
(Spinal motor nöronlarında
asetilkolini
katalizleyen kolin asetiltransferaz)
Sitozolik proteinlerin sentezi
1-mRNA sentezi
2-translasyon
3-Modifikasyonlar
a) komodifikayon (N-asetilasyon)
b) posttranslasyonal modifikasyon ( serin,
tirozin, treonin fosforilasyonu; ubikitin)
Sitozolik proteinler Golgi aygıtı ve
endoplazmik retikulumla ilişkili olarak
yapılan proteinlere göre daha az
modifikasyona uğrarlar.
Nöronun hücre gövdesinde sentezlenen
proteinler dendrit ve aksonlara giderler.