Bileşikler Ve Formülleri
Hazırlayanlar:
Mert Türkan 745
Bilgincan Genç 900
Kenan Nemli 247
Doğukan Moğulkoç 1011
Bileşik
• İki ya da daha fazla farklı element atomunun
kendi özelliklerini kaybedip belirli oranlarda bir
araya gelerek kimyasal bağ oluşturması
sonucu meydana gelen yeni ve saf maddelere
bileşik denir. Bu nedenle elementlerin
bileşikleri oluşturması kimyasal değişmedir.
İki ya da daha fazla elementin kendi
özelliklerini kaybederek belirli oranlarda ve
kimyasal tepkimeler sonucu oluşturdukları saf
maddelere bileşik denir.
Bileşiklerin Özellikleri
• 1. Kendilerini oluşturan elementlerin özelliklerini
göstermezler.
2.Bileşiği oluşturan atomlar belirli oranlarda bir
araya gelirler.
3. Bileşikler saf maddelerdir.
4. Aynı dış koşullarda erirken veya kaynarken
sıcaklıkları değişmez.
5. Kimyasal yöntemle oluşurlar.
6. Kimyasal yöntemlerle kendisini oluşturan
maddelere ayrılırlar.
7.Moleküler ve iyonik yapılı bileşikler olmak üzere
ikiye ayrılır.
8.Bileşikler belirli formüllerle gösterilirler.
• Örnekler :
1- • Sodyum elementi sadece sodyum atomlarından
oluşur, gümüş rengindedir ve
(bıçakla kesilebilecek kadar) yumuşaktır.
• Klor elementi sadece klor moleküllerinden oluşur, sarı
– yeşil renkli zehirli bir gazdır.
• Sodyum elementindeki sodyum atomları birbirinden
ayrılır.
• Klor elementindeki klor moleküllerinin atomları
birbirinden ayrılarak sodyum atomlarına yaklaşır kendi
kimliklerini kaybederek ve sodyum klorür bileşiğini
oluştururlar. (TUZ)
• 2- • Hidrojen elementi sadece hidrojen
moleküllerinden oluşur, renksiz, kokusuz, yanıcı
bir gazdır.
• Oksijen elementi sadece oksijen
moleküllerinden oluşur, renksiz, kokusuz, yakıcı
bir gazdır.
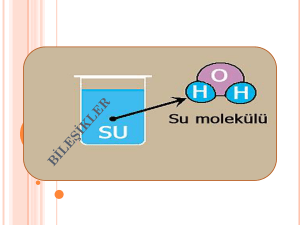
• Oksijen ve hidrojen atomlarından
(elementlerinden) oluşan su, bir bileşiktir ve
kendini oluşturan oksijen ve hidrojen
elementlerinden farklı fiziksel ve kimyasal
özelliklere sahiptir. Su, yanıcı ve yakıcı özellikte
olmayan sıvı halde bir bileşiktir.
Bileşik Formülleri
Bileşik kaç elementten meydana gelmişse
formülde o kadar element sembolü bulunur.
Bir bileşiğin formülünde bu bileşiğin kaç tür
atom içerdiğini ve bu atomların sayılarını
bulabiliriz.
Bazı Formüller
H2O (Su) 2 tane Hidrojen atomu, 1 tane
oksijen atomu vardır.
CO2 (Karbondioksit) 1 tane karbon, 2 tane
oksijen atomu vardır.
C6H12O6 (Şeker) 6 tane karbon, 12 tane
hidrojen, 6 tane oksijen atomu vardır.
Bileşik Çeşitleri
• Bileşikler moleküler yapılı bileşikler ve moleküler
yapılı olmayan bileşikler olarak iki grupta
incelenirler.
a) Moleküler Yapılı Bileşikler :
Bileşikler, farklı cins element atomlarından oluşan
moleküllerden oluşmuşsa böyle bileşiklere
moleküler yapılı bileşikler denir.
• Moleküler yapılı bileşikler moleküllerden oluşur.
• Bileşiklerdeki molekülleri oluşturan atomlar
arasında kovalent bağ bulunur.
s
• Moleküler Yapılı Olmayan Bileşikler :
Bileşikler, moleküllerden oluşmayıp bileşiği
oluşturan farklı cins element atomları bir yığın
oluşturacak şekilde bir araya gelmişse böyle
bileşiklere moleküler yapılı olmayan bileşikler
denir.
• • Moleküler yapılı olmayan bileşiklerdeki
iyonlar düzenli bir yığın oluştururlar.
• Moleküler yapılı olmayan bileşikler sonsuz
örgü tipi bileşiklerdir
• Moleküler yapılı olmayan bileşiklerdeki
iyonlar düzenli bir örgü oluştururlar.
• Moleküler yapılı olmayan bileşikleri
oluşturan zıt yüklü iyonlar arasında iyonik bağ
bulunur. (İyon sayısı yığının büyüklüğüne göre
değişir).
Bileşiğin İsmi
Bileşiğin Formülü
Bileşiği Oluşturan İyonlar
Kalsiyum Oksit
CaO
Ca+2 ve O–2 İyonları
Sodyum İyodür
NaI
Na+1 ve I–1 İyonları
Sodyum Klorür
NaCl
Na+1 ve Cl–1 İyonları
Alüminyum Klorür
AlCl3
Al+3 ve Cl–1 İyonları
Kalsiyum Florür
CaF2
Ca+2 ve F–1 İyonları
Alüminyum Sülfür
Al2S3
Al+3 ve S–2 İyonları
• 1- • Kalsiyum oksit (CaO) bileşiğindeki Ca+2 ve
O–2 iyonları arasında iyonik bağ bulunur.
• Kalsiyum oksit (CaO) bileşiğindeki Ca+2 ve O–
2 iyonları düzenli bir örgü oluştururlar.
• Kalsiyum oksit (CaO) bileşiği, kireç taşında ve
bazı mermer çeşitlerinde bulunur.
• 2- • Sodyum İyodür (NaI) bileşiğindeki Na+1 ve
I–1 iyonları arasında iyonik bağ bulunur.
• Sodyum İyodür (NaI) bileşiğindeki Na+1 ve I–
1 iyonları düzenli bir örgü oluştururlar.
• Sodyum İyodür (NaI) bileşiği, tıp alanındaki
hastalıkların teşhisinde ve bazı hastalıkların
tedavisinde ilaç olarak kullanılır.
Elementler bileşik oluşturduğunda
özelliklerini kaybederler. Örnek Olarak;
• Hidrojen yanıcı, oksijen yakıcı bir maddedir. Su
ise hiç yanmaz ve hiç yakmaz. Aksine su ateşi
söndürür.
Çözeltiler
• Şeker molekül yapılı bir bileşiktir suda
tamamen çözündüğünde pozitif ve negatif
yüklü iyonlar oluşmaz. Bu yüzden şekerli su
elektrik akımını iletmez. Bu tür çözeltilere
ELEKTROLİT OLMAYAN çözelti denir. Elektrolit
olmayan çözeltiler kovalent bağlıdır.
• Suda çözünen madde pozitif ve negatif yüklü
iyonlar oluşturursa bu tür çözeltileri elektrik
akımı iletir, iyonik yapılı bileşiklerin sulu
çözeltileri bu türdendir. Elektrik akımını ileten
çözeltilere elektrolit çözeltiler denir.
Örnek:Tuz
Elektrolit çözeltiler iyonik yapılı çözeltilerdir.
• Tuz, iyonik bağlı, alkol, şeker kovalent bağlı
bileşiklerdendir. Buna göre bir ampülün
yanması için;
1. Tuzlu su
2. Şekerli su
3. Alkollü su
Hangileri kullanılmalıdır ?
Doğru Cevap
• Yalnız 1 olmalı. Çünkü iyonik bağlı tuzda, su
içindeyken + ve – yüklü iyonlar oluşturur. Bu
iyonlar elektriği iletir.
• Bir çözelti hazırlarken çözünen maddenin
çözücü madde içinde daha hızlı çözünebilmesi
için;
• 1. Çözünen maddenin temas yüzeyi
genişledikçe çözünme hızlanır. Çözünen
maddenin tane boyutu küçültülmelidir.
Örnek: İçinde aynı miktar ve sıcaklıkta iki kaba
toz şeker ve küp şeker atılırsa toz şeker daha
çabuk çözünür.
• 2. Çözücü ve çözünen maddenin sıcaklıklarını
arttırmak.
Örnek ; Tatlı şerbeti hazırlanırken su
sıcaklığının artırılması şekerin daha hızlı
çözünmesini sağlar.
Sorularımız
• Derişik bir çözelti seyreltik çözelti haline nasıl
getirilebilir?
CEVAP 1.
• Çözücü madde miktarı arttırılırsa çözelti daha
seyreltik olur.
Sorularımız
• Şekerli su neden elektrik akımını iletemez ?
CEVAP 2.
• Şeker kovalent bağlı bir bileşiktir. Şekerli su
çözeltisinde iyonlar oluşmaz.
Biliyor musunuz ?
• Erime: Katı maddenin sıvı hale gelmesidir.
• Çözünme: Çözünen bir maddenin çözücü
içerisinde moleküllerine ya da iyolarına
ayrılmasıdır.
O HALDE;
Şeker suda erir mi yoksa çözünür mü ?