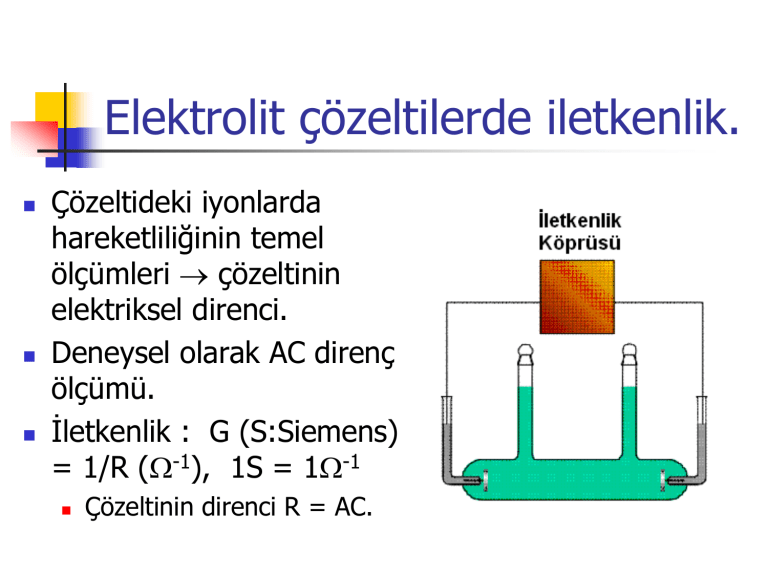
Elektrolit çözeltilerde iletkenlik.
Çözeltideki iyonlarda
hareketliliğinin temel
ölçümleri çözeltinin
elektriksel direnci.
Deneysel olarak AC direnç
ölçümü.
İletkenlik : G (S:Siemens)
= 1/R (-1), 1S = 1-1
Çözeltinin direnci R = AC.
Direnç Ölçümleri
iletkenlik
direnc
Örneğin direnci, kendi uzunluğuna ve
kesit alanına bağlıdır.
A
= çözeltinin öz iletkenliği.
G
l
l
R
A
l
1
RA
= çözeltinin öz direnci.
İletkenliğin birimi = S/m = 1/( m)
S: Siemens
İletkenliğin Ölçümü
Problem – ℓ/A lı hücreye ait bir bilgiyi
gerektiren iletkenliğin ölçümlerini doğrulayın.
Çözüm- Aynı hücre içinde standart bir
çözeltiye göre ilgili çözeltinin direncini
karşılaştırın.
l
RA
*
l
*
R A
Hücre sabiti
Hücre sabiti, C*cell = * R*
* - standart çözeltinin öziletkenliği için
literatur değeri.
R* - standart çözeltinin ölçülmüş direnci.
öziletkenlik - = C*cell /R
Standard çözeltiler - KCl (aq) çeşitli
konsantrasyonlu!
Molar İletkenlik
Molar iletkenlik
M = / c J
Not: c mol/m3 olarak verilmiştir.
Molar iletkenlik – şiddet özelliği
İki durum:
Kuvvetli elektrolitler
Zayıf elektrolitler
Bir çözeltinin iletkenliği mevcut
iyonların sayısına bağlıdır.
Bu yüzden molar iletkenliği m
konsantrasyon denklemi ile işleme
katmak normaldir.
c ilave edilen elektrolitin molar
konsantrasyonudur.
m
SI birimi mol başına siemens
metrekare (Sm2.mol-1) dir.
m
c
İletkenlikle ilgili aşağıdakilerden hangisi
yanlıştır?
a)
b)
c)
d)
e)
Öz iletkenlik ortamda bulunan net iyon sayısıyla
artar ve bu iyonların hidratlanmış (hidrodinamik)
yarı çap artmasıyla azalır..
Kuvvetli elektrolitlerde molar öziletkenlik
derişimin karekökü ile orantılı olarak düşer.
Bir çözeltinin iletkenliği çözeltideki mevcut iyon
sayısıyla tam olarak doğru orantılıdır.
Çözeltide iyonlar arasındaki etkileşimin
artmasıyla çözeltinin iletkenliği düşer.
Zayıf elektrolitlerde iletkenlik çözeltinin derişimi
ile önce şiddetle düşer sonra yavaş yavaş azalır.
İletkenlik ve öziletkenlikle ilgili aşağıdaki
tanımlardan hangisi yanlıştır?
a)
b)
c)
d)
e)
Bir çözeltinin iletkenliği (G) onun direnci (R) ile ters
orantılıdır. R, iyonların hareketini incelemek için deneysel
ölçüm değeridir.
Direnci artıran faktörler; göç eden taneciğin hidratlanmış
yarıçapının büyüklüğü ve çözücünün yüksek viskozitesidir.
İletkenliğe etki eden faktör yüklü taneciğin yarı çapıdır.
Bir çözeltinin iletkenliği kendi özelliklerinin haricinda
elektrotlar arasındaki potansiyel farkı ile artar ve mesafe ile
azalır.
Kuvvetli elektrolit aynı mol sayısındaki zayıf elektrolitten
daha fazla iletkendir.
stAcN A
stAc
A.t
scN A
zscF
zscFA
Aşağıdaki formüllerden
hangisi yanlış olarak ifade
edilmiştir?
: + veya - yüklü iyon sayısı.
:birim yüzeyden birim zamanda geçen
molekül sayısı
: birim yüzey ve birim zamanda göç
eden iyon sayısı.
: birim yüzey ve birim zamanda göç
eden yük miktarı.
: akım miktarı.
Bağımsız göçme kanunu
Kohlrausch kanuna katkı.
Yeteri kadar seyrelme içinde birbirinden
bağımsız olarak hareket eden iyonlar.
o
m
o
o
İyonlar için o değerlerine tablolardan bakınız.
Lityum gibi küçük yarıçaplı iyonların hidrodinamik
yarıçapları büyük olduğundan iletkenlikleri Sodyum ve
Potasyum gibi büyük iyonlara göre daha küçüktür.
Tablo : 298 K’de su içerisindeki limitlenmiş iyonik
iletkenlikler, /(mSm2.mol-1)
H+
34,96
OH-
19.91
Na+
5,01
Cl-
7,63
K+
7,35
Br--
7,81
Zn2+
10,56
SO42-
16,00
Ba2+
12,72
F-
5,54
Cs1+
7,72
NO3-
7,146
Li+1
3,87
(CO32-)2
18,86
CH3CO2-
4.09
Şekil 24.18 Su molekülü
içerisinde H+’nın
hareketini gösteren
düzenlenme
Hidratlanmış H2O molekülleri bir molekülden aldığı Hidrojeni diğerine
aktararak yenilenip dönüşebilir. Proton çok küçük olmasına rağmen çok
yüksek bir molar öz iletkenlik değerine sahiptir.
Su moleküllerinin bir grubu içindeki bağları yeniden düzenleyen bir protonun
etkin bir hareketi vardır. Bununla birlikte gerçek mekanizma hala son derece
karışıktır. Şimdi dikkatimizi yaklaşık üçgen düzlemsel H3O+ iyonuna (6)
kuvvetlice solvatize olmuş üç H2O molekülünü bağlanmasıyla oluşan H9O4+
iyonu üzerinde toplayalım. Atomların bu kümesi kendi kendine
hidratlanmıştır fakat ikincil küredeki hidrojen bağları birincil küredekinden
daha zayıftır. Hızı belirleyen basamağın bu ikincil kürenin daha zayıf olan
hidrojen bağlarından birinin yarılması olduğu düşünülebilir (Şekil 24.18 a).
Kendi yerinden bağ yarıldıktan ve serbest kalan molekül birkaç derece
döndükten sonra H2O....H+....OH2 yapısına (H5O2+ katyonunu oluşturmak
için) bulunan küme içinde bağ açıları ve bağ uzunlukları çok hızlı bir şekilde
ayarlanır (Şekil 24.18 b). Bu düzenlemeden sonra ikincil hidrasyon küresinin
üyelerinden olan bir pozisyonda diğer moleküller gibi bir H9O4+ kümesi
oluşmuştur. Fakat bu pozitif yük önceki yerinin sağında bir moleküle
yerleşmiştir (Şekil-24.18c). Bu modele göre düşük bir aktivasyon enerjisiyle
bir molekül zinciri boyunca komşu moleküller arasında çok hızlı sıçrayan
düzenli bir proton hareketi yoktur. Model basıncın artışıyla hidrojen
bağlarının kırılması ve basıncın yükselmesiyle protonların molar
öziletkenliklerinin artması gözlemiyle uyum içindedir.
Kuvvetli elektrolit durumu
Kohlrausch kanunu
m Kc
o
m
1
2
om = sonsuz seyreltik bir çözeltide elektrolitin molar
iletkenliği konsantrasyonla doğrusal olarak azalarak değişir.
Tamamen iyonlaşmasının bir sonucu olarak çözeltideki
iyonların konsantrasyonu ilave edilen kuvvetli elektrolitin
konsantrasyonunun katlarına orantılıdır.
K = molar iletkenlik eğimi – elektrolit tipine
bağlıdır.
c) Zayıf Elektrolitler
m = mo
HA(aq) + H2O (s) H3O+(aq) + A-(aq)
[H3O+] = c,
[A-] = .c
[HA]=(1-).c
a H 3O .a A
c
.c
Ka
aHA
(1 ) c (1 )
2 2
2
Ka = Çözeltideki ayrışma (veya asitlik denge sabiti)
reaksiyonu için denge sabiti.
.c
Ka
(1 )
2
1/ 2
Ka
4c
1
1
2c K a
K a K a c 0
2
1
1
c
Ka
kesir miktarı olan iyonlaşma derecesi gerçek çözelti
içerisinde iyon olarak bulunduğundan dolayı ölçülen
molar iletkenlik m aşağıdaki şekilde verilir.
m = mo
mc
1
1
0
0 2
m m K a ( m )
Bu eşitlik gösterir
ki;1/m cm’e karşı
grafik edilirse c=0 daki
kesişim mo değeri
olacaktır
Sürüklenme hızı
Aşağıdaki sistemi
inceleyin.
+
-
1
-
+
+
- +
+
+
+
+
Uzunluk = l
2
Model yüklü
tanecik
üzerindeki net
potansiyel
/ V
/m
İyonlar üzerindeki kuvvetler
Hızlandırma kuvveti.
Net elektrik alan yüzünden, ε = (2 - 1) / ℓ
F = zjeε
Geç bırakma (geciktirme) kuvveti.
Sürtünme direnci yüzünden, F`= f s
S = Sürüklenme hızı
f = Stokes kanunundan tahmin edilen sürüklenme
faktörü.
Hızlandırma kuvveti=Geç bırakma kuvveti
olduğu zaman, tanecik sabit hızda hareket eder.
Sürüklenme hızı
s
Sürüklenme hızı aşağıdaki gibi yazılır.
z J e f
f
z J e f
6o a J
zJ = iyonun yükü
o = çözücü viskozitesi
e = electronic yük
=1.602 x 10-19 C
aJ = iyonun çözünmüş yarıçapı
Su içinde, aJ = hydrodynamik yarıçap
Alkali metal iyonlarının molar öz iletkenlikleri yarıçap arttıkça Li+
dan Cs+ ya doğru artar. Stokes formülündeki aj yarıçapının iyonun
hidrodinamik yarıçapı (ya da Stokes yarıçapı) olduğunu
anladığımızda büyük yarıçaplı iyonun küçük olandan daha hızlı
hareket ettiği paradoks çözülür.
Şekil 2.3 Akımın hesaplanmasında s+∆t’lik bir mesafe içinde
(yani (s+∆t)*A hacmi içerisindeki) bütün katyonlar A alanı
boyunca geçecekler. Pencerenin diğer bir tarafında aynı hacim
miktarında anyonların benzer şekilde akıma katkıda
bulunmaları söz konusudur.
J (iyon)
stAcN A
scN A
A.t
Yukarıdaki denklemin birim analizi yapılırsa;
İ_tane/(s*m2) =
= (m/s) *s*m2*mol/m3*i_tane/mol* m-2*s-1
= m/s *(mol/m3)*i_tane/mol= İ_tane/(s*m2)
İyon Akışı
Katyonlar için;
J+ = + cJ NA s+
+= Katyonların sayısı
cJ = elektrolit konsantrasyonu
S+ = Katyon sürüklenme hızı.
Anyonlar için;
J- = - cJ NA s
-= Anyonların sayısı
cJ = elektrolit konsantrasyonu
S- = Anyon sürüklenme hızı.
İyon akışı ve yük akışı
Toplam iyon akışı
Jiyon = J+ + J= cJ NA s
Not: = + + Toplam yük akışı
Jyük = Jiyon (z e)
= ( cJ NAs) (z e)
= ( cJ NA) (z e) (u εf) , F= NAe
= ( cJ z u F εf)
İletkenlik eşitliği.
Ohm kanunu
I = Jyük A
F = Faraday sabiti= 96486 C/mol
C: Coulomp
İletkenlik aşağıdaki gibi hareketliliğe
ilişkilidir.
zucFA.
I
l
A.
I
G.
R
l
zucF
İyonik katkılar
Molar iletkenliğin her bir ferdi iyonun
hareketliliği yüzünden oluşacağı kabul
edilebilir.
z u F
z u F
Taşıma sayısı
İyon taşıma sayısıyla gerçekleştirilen
yükün sürüklenmesi.
t
m
t+ = katyonlarla
gerçekleştirilen yükün
sürüklenmesi.
t
m
t- = anyonlarla
gerçekleştirilen yükün
sürüklenmesi.
Taşıma sayısı ve hareketliliği.
Taşıma sayısı iyonik
hareketlilikten
belirlenebilir.
u
t
u u
u
t
u u
u+ = Katyonun
haretliliği.
u
t
u u
0
u- = Anyonun
haretliliği.
v
v
t
0
v v
m
0
t v
0
0
m
Sonuç olarak ölçümünün bağımsiyonların
taşıma sayılarıız yolları olmasına rağmen,
bireysel iyonik öz iletkenlikleri ve iyonik
hareketliliklerini belirleyebiliriz.
TAŞIMA SAYILARININ t z clAF
It
ÖLÇÜLMESİ
NX daha yoğun indikatör çözeltisi ile A
yüzeyine sahip dikey bir tüpün üst kısmında
MX çözeltisi arasında keskin bir sınır vardır.
M iyonlarının hareketliliği N iyonlarınınkinden
daha büyük olmalıdır. Böylece, M iyonları
alttaki çözeltinin (indikatör çözeltisine) içine
difüzlenirse, M iyonlarının çevresindeki N
iyonlarında daha hızlı yukarıya doğru
çekilecek ve sınır yeniden oluşacaktır.
Taşıma sayılarının
ölçümü için hareketli
sınır metodunda, sınırlar
tarafından
hareketlenmiş mesafesi
akımın geçmesi ile
gözlenir. Sınır AB’den
CD’e hareket ediyorsa,
AB ve CD arasındaki
hacimdeki tüm M
iyonların CD boyunca
hareket etmesi gerekir.
Aşağıdaki ifadelerden hangisi yanlıştır?
a)
b)
c)
d)
e)
Gerçek çözeltiler için ölçülen iletkenlik Λm =Λom
olarak verilir.
Λm= Λom Kc1/2 eşitliği, düşük derişimlerde kuvvetli
elektrolitlerin molar öz iletkenliklerinin derişimin
kare kökü ile doğrusal olarak değiştiğini gösterir.
1/ Λm = 1/ Λom + (Λm c) / [ Ka(Λom)2] şeklinde
ifade edilir.
Bir iyonun mobilitesi ve onun molar öz iletkenliği
arasındaki bağıntı λ = zuF olarak gösterilir.
Taşıma sayısı toplam akımın belli bir türdeki
iyonlar tarafından taşıyan kesri olarak tanımlanır.
t±=I± / I şeklinde yazılır. Katyonlar ve anyonların
It
It
Netyük (t 1)
t *
z F
z F
I t
t *
z F
Ag(k)AgCl(k)HCl(m1)HCl(m2)AgCl(k)Ag(k)
Ag(k)AgCl(k)HCl(m1)H2(g)P+(k)H2(g)HCl(m2)AgCl(k)Ag(k)
E = 2t+E
t
İyonlarla Yük Taşıma
Yük taşımayı tahmin etme.
İyonlarla taşınan yükün miktarı.
Her bir iyon hareketinin hızı.
Son bir hıza ulaşan hareketli
iyonlar (sürüklenme hızı)
Kuvveti geciktiren sürtünmeyi
dengeleyen potansiyel farklılığı
yüzünden hızlanma kuvveti.