(FLOWCYTOMETRY) AKAN HÜCRE ÖLÇER’İN SELİM HEMATOLOJİK HASTALIKLARDA KULLANIMI
PROF DR DAVUT ALBAYRAK
SAMSUN MEDİCALPARK HASTANESİ
KONULAR
1.
2.
3.
4.
5.
6.
7.
8.
KOMPANSASYON
AYIKLAMA İŞLEMLERİ (KÜMELER, APOPTOZ)
CANLILIK
CD 34 SAYIMI
ALPS VE T HÜCRE ALT TİPLERİ
PNH
HEREDİTER SFEROSİTOZ
KRONIK GRANULAMATOZ HASTALIK
FLOWCYTOMETRY
• Akan hücre ölçer doğru adlandırma ve ölçülen şeyi doğru anlatıyor. Dedektör (algılayıcı) önünden akan hücrelerin sayı, ışık sacımları ve florokrom ışıkları ölçülüyor.
• Akım/akış sitometri yanlış ve eksik
• Yanlış ‐‐akım: Flowsitometri doppler değil, sıvının akış özelliklerini ölçmüyor. • Flowcytometry , Akan sıvının içindeki bulunan maddelerin dedektör (algılayıcı) önünden geçerken o maddenin özelliklerinin ölçüldüğü cihazlar grubundandır. • HPLC, florometri, flowcytometri bu gruptandır.
AKAN HÜCRE ÖLÇER ŞEMASI
Küme analiz grafik programı
BD: FACSDIVA
bilgisayar
Fotomultiplier
(Fotosel elitrik güç katlayıcısı )
*104
FSC, SSC, FITIC …
Dedektör1
fotocell
ESKİ‐YENİ CİHAZ
• GAZ LAZER X KATI HAL LAZER (SOLID STATE)
• OTOMATIK KALİBRASYON BEATLERİ VE YAZILIK EKLERİ
• OTOMATİK KOMPANSASYON BEATLERİ
• ÇOK SAYIDA LAZER ve florokrom KANAL
TERİMLER
• Floresan madde (florokrom) : Işığı emen ve aynı anda daha düşük dalga boyunda yayan madde Örnek flor, FITIC
• Fosforesans: Işığı emen ve ışık kesildikten sonra daha düşük dalga boyunda yayan madde Örnek fosfor
• Tandem florokrom:Birincisi emen ve ikincisi yayan iki florokrom maddenin kimyasal bağlanması ile oluşan madde: PE‐texas red, PE‐ pf 043, APC_H7
• (Beklemekle ikinci molekül ayrılırsa birincinin yayını olur. Taze şişelerde %5. Hazır karışımlara uygun değil)
EN ÖNEMLİLERİ ÖNCE SÖYLEYELİM:
BAŞKAN VAKTİN BİTTİ DİYEBİLİR
• Akan hücre ölçümlerini değerlendirmeden önce aynı örnekten alınmış yaymaya mikroskopta bak. • Hangi hücreleri kapılaman (sınırlarını çizip yeni bir grafikte bakman) ve analiz etmen gerektiğine karar ver. • Mikroskopta gördüğün hedef hücrelerin akan hücre ölçerdeki yerleşimleri için akıl yürüt ve • kapı almaya doğru yerden başla.
ANALİZE BAŞLARKEN ACELE ETME: ÖNCE İŞLEM İLİŞKİLİ BOZUKLUKLARI DÜZELT
• Akan hücre analizi tek hücrelerin analizidir. Tek olmayanları (küme yapmışlar, başka hücre yapışmışlar vs), teklerden ayır, at.
• Tek hücreler üzerine başka parçacık, hücre ve hücre parçası yapışmış olmamalı
• Tüpte sıvının bittiği nokta hava kabarcıkları parçacık algısı sebebiyle hatalıdır. Bozuk veriyi (ssc x time) değişimi grafiğinde keserek ayır (gate)
• İstediğin hücre grubuna bütün parçacıklardan nasıl ayırabileceğini düşün (discriminatör ne?)
• Kompansasyonun hatalı olduğu florokromlarda elle düzeltme yap
HATA ÜRETEN VERİLERİN AYIKLANMASI
Hata üreten veriler özgül olmayan bağlanmalarla ortaya çıkan veriler ve grafikte görüntü kalabalığı yaparak istediğimiz verileri fark etmemizi zorlaştıran verilerdir.
Bu verilerin örnekleri şunlardır:
1. Debriz, patlamış hücrelerin artıkları
2. Patlamamış kırmızı kan hücreleri
3. Ölü hücreler
4. Hasar görmüş hücreler
5. Fc reseptöre işaretli antikor bağlanması
6. Apoptoz halindeki hücreler
7. Küme yapmış hücreler ve trombositler
8. Pıhtı üzerine yapışmış hücreler
9. Yıkama, sürükleme sıvılarındaki parçacıklar
10. Hücre işlenirken kullanılan maddeler ile gelen parçacıklar.
11. LAİP antikorları ile boyanabilen yanıltıcı hücreler
ANALİZ MANTIĞINI DOĞRU ANLA
• 1‐HÜCRELERDE ANTİJENİN VARLIĞI, MİKTARI, ÜRETİLEN ANTİKORUN BAĞLANMA GÜCÜ
– Negatif kontrol hücreden 0,5 log fazla MFI
• 2‐Aranılan hücrenin karışım içinden seçilmesi ve ayıklanması: – Lösemi tipleme, MRD, lenfosit tipleme, tam kan sayımı
– Sıralı kapılama
– İkili (çoklu) bayes tipi analiz (istatistiksel analiz)
Işık saçılması
B lenfosit
CD 19 FITIC
Saçılma yön değiştirme
FSC
Absorption
Mavi Lazer ışığı
Düşük dalga ışığa çevirme
ssc
(Fluorescence)
Parçacığa çarpın işığın saçılma, hapsedilme ve floresans
özellikleri
11
4
FSC SSC
• FSC ileriye hafif saçılmayı anlatmaktadır. 20 C lik saçılmalar seçilir. HÜCRE BOYUTU
• SSC 90 C lik saçılmayı anlatır. HÜCRE İÇİ TANECİKLER
IŞIK SAÇIMININ İKİ TÜRÜ İLE HİSTOGRAM
Daha büyük
Y Axis
Apoptozdaki
hücreler
90 derece yana ışık saçımı(SSC) Daha büyük hücreler
Daha tanecikli
Ölü hücreler
X Axis
20 derece Öne doğru ışık saçımı (FSC)
Canlı hücreler
CD45 SSC DE HÜCRELERİN YERLEŞİMİ
GRAFİK FSC x SSC
FSC BÜYÜKLÜK İLE İLİŞKİLİDİR
SSC HÜCRE PLAZMASINDAKİ PARÇACIKLAR VE ÇEKİRDEK
KIVRIMLARI İLE İLİŞKİLİDİR
Kümelenmiş, sınır taşan granülositler
İKİSİ HÜCRE TİPLERİNİ AYIRABİLİR
Granulocytes
SSC
KIRMIZI KAN
HÜCRELERİ,
HÜCRE ARTIKLARI,
ÖLÜ HÜCRELER,
TROMBOSİTLER
SSC
Lymphocytes
Monocytes
FSC
FSC
2 Parameter Histogram
Single Positive PI Population
Double Positive Population
PE FL
Negative Population
FITC FL
Single Positive FITC Population
SINIR ALTI VE SINIR AŞANLARIN HARİÇTE BIRAKILMASI
Kümelenmiş, bağlanmış hücreler
Parçalanmış KKH, trombosit
dengeleme
AZ
ÇOK
DENGELENMEMİŞ/
DENGELENMİŞ
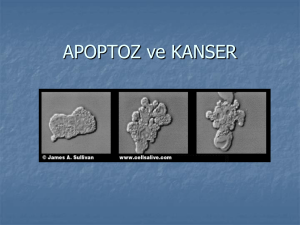
APOPTOSIS
31%
Necrotic
P
R
O
PI
D
I
U
M I
O
D
I
D
E
ölü
33%
Viable
35%
Apoptotic
canlı
ANNEXIN V FITC
Canlı apoptoz
Apoptoz (A)
Marjolein A. van der Pol, Cytometry Part B (Clin. Cytometry) 55B:14–21, 2003.
APOPTOZ :DONDURMA ERİTME ETKİSİ SYTO‐
7AAD
G J Schuurhuis. Large populations of non‐clonogenic early apoptotic CD34‐positive cells are present in frozen‐thawed peripheral blood stem cell transplants.Bone Marrow Transplantation (2001) 27, 487‐498.
ITP,
preb‐B lenfosit olgunlaşması
Alps, 3+,tcr ab+, 4‐8‐ lenfosit
Cd3,4,8 ili alps
• >%2.5
Blasttan metamypolosite cdler
Myeloid farklılaşma
45 x ssc
13 x11b
Bernard soulier
CD 15,33,24,16,14+FLAER PANELİ İLE GRANÜLOSİT VE MONOSİT PNH KLONU
fluorescein-labeled proaerolysin
Aerolysin: hücre zarında delik açıcı dış toksin protein,kompleman hücum kompleksi
benzeri, üreten:Aeromonas hydrophila, Gram-negatif bakteri, ishal ve derin yara
enfeksiyonları.
CD 34
ANNE KANINDA FETAL ALYUVAR
http://www.clinchem.org/content/46/8
/1221/F2.large.jpg
HB F
Dihydrorhodamine123 ile KGH tanısı
http://www.cytometry.org/newsletters/eICCS‐2‐1/article6.php
dihydrorhodamine123 (DHR123) (Molecular Probes, Eugene,) phorbol 12‐myristate 13‐acetate (PMA) (Sigma‐Aldrich, St Louis, MO).
KROMOZOM ANALİZİNDE AKAN HÜCRE ÖLÇER
chromosome 1
chromosome 2
porcine
Propididium iyodür ile DNA index
•
•
•
•
•
•
•
•
•
•
•
•
PI: BD Pharmingen
Cat #550825;
Sigma‐Aldrich
Cat #P4170
DRAQ5: Affymetrix/eBiosciences
Cat #65‐0880
DAPI: BioLegend
Cat #422801;
Sigma‐Aldrich
Cat #32670
Hoechst 33342: LifeTech/Molecular Probes
Cat #H1399;
Bead
Specificity
Soluble
Cytokine
IL-2
Örnek Hazırlama CBA
Bead +
Cytokine
PE
Deteksyon
Ürünü
IL-4
IL-5
Yıkama
IFN
TNF
Capture Beads
Sitokin Capture Bead
AKIŞ HÜCRESİ KİRLERİ
• SAÇLAR, KÜÇÜK PARÇALAR
• TUZ KRİSTALLERİ
• PRETEİN ÇÖKELTİLER
• Bead LER
• BOYA ÇÖKÜNTÜLERİ
DOKU FLOW
Akan hücre incelemesi sadece kan ve sıvı ortamdaki hücreleri içine almaz. Süspansiyon haline getirilebilen dokular da incelenir.
Doku biyopsisi incelenecekse:
A‐1 gr doku ıslak gazlı bezle sarılır. Islak kurutma kağıtlı petri kutusu ile akan hücre incelemesi için taşınır.
B‐Doku mekanik parçalama
C‐Süspansiyon haline getirilir,
D‐ süzülür. 40 micron
KAN ÖRNEĞİ ALIMI
•
•
•
•
EDTA YA DA heparin (10 u/ml).
Citrate kullanma, asidik, düşük ph florasanı bozar
İnce iğne ile kan alma, hücreleri patlatır
ETDA lı tüpte kanı 10 defa alt üst et. Fibrin hücrelere yapışır; hücreleri kümelendirir; hücreleri hapseder
• Örnek kontrolü aynı saatte, aynı şartlarda al,
• Ayrı zamanlı ise tarih saat yaz
Saklama şartları
• Hedef antijenlerinin ifade edildiği şartlar önemli
• Uyarım ve ısı istirahat antijenlerinin seviyesini değiştirir. • İstirahat antijenleri ile ilgili isen buzlu ortamda sakla 4 C
• Uyarım ile artan antijenler ile ilgili isen uyarım aracına ve uyarılma süresine dikkat et.
HÜCRE ORANLARINI DEĞİŞTİREN HASTALIK VE TEDAVİLERİ DİKKATE AL
• Kemik iliğinde hücre yapımı bazı hastalıklarda haberci moleküllerin etkisi ile artar. • Sistemli yangı tepkimesi, G‐CSF tedavisi ve kortizon tedavisi, granülositik seriyi artırır. idiopatik trombositopenik purpura, herpes
grubu virus enfeksiyonları, infeksiyoz
lenfositoz, lenfositleri artırır.
• Pre B lenfositler ALL lenfoblastlarından ayırt edilmelidir. İTP, viral enfeksiyonlar gibi
FİKOL HİPAK 1088
• Eski, kolay ve hücre serileri ile çalışmalarına uygun
• Kırmızı kan hücrelerini ve fibrinli parçaları iyi ayırır. İyi
• Parçalıların oranı değişir, hücrelerin bir kısımı
kırmızı kan hücreleri grubunda kalır. Kötü
• Özgül olmayan bağlanma artar. Engellemek için ortama Ig koymak gerekir.
• İmmunoloji araştırmalarına uygun
TAM KAN PARÇALAMA
•
•
•
•
•
•
•
Kan hastalıkları ile uğraşanlar teşhis amaçlı çalışırlar
Oranların bozulmaması önemli
Bütün gruplar değerlendirilir
Çabuk sonuç alma önemli
Tam kan (KKH) parçalama kullanılır. (lökosit sayımı gibi) En çok tam kan parçalama + yıkama kullanılır.
Yıkamadan okutmada artefaktların sayılan alana düşme ihtimali yüksek.
• Düşük CD 34 olan örneklerde yeterli CD 34 raporlama hatasının en önemli sebebi
• Sisto 16 ekleme hataları azaltır. KIRMIZI KAN HÜCRELERİNİ UZAKLAŞTIRMA
• Antikor inkübasyonu 30 dak (genel antikor bağlanma süresi)
• Birincil antikor ile ölümünü sağlamaya çalış.
• İkincil antikor kullanıyorsan yıkama sonrası kullan.
– İşaretli birincil antikor yoksa, Eritrosit subgrup gibi
• Lisis (KKH parçalama) solusyonu: PBS +saponin 10 mg/ml + 0.1% sodium azide
• 0.025 ml kan + 0.05 ml saponinli PBS == karıştır+ 5 sn
bekle + 0.45 ml PBS+karıştır+ eritrosit parçalanmasını gözle+ 1‐2 dak bekle+ okut+ 5dakdan fazla bekleme
• BD için bdlyse sol kullan. Prospektüse uy.
CİHAZ İLİŞKİLİ SIK HATALAR
• AKIŞ HÜCRESİ KİRLENMESİ: hipo yıkama, proteolitik yıkama
• SÖNME ZAMANI AYARI BOZULMASI: servis
– İki lazer arası uyarım sönme için yeterli zaman
• DENGELEME AYARI HATALARI: dengeleme (kompansasyon) çalışması LENFOSİT HÜCRE ÖLÇER TİPLEME
CD 3
CD 19
B hücre olgunlaşma oran
• immature (CD10+,CD19+,CD20+,CD27–,CD38+); naïve (CD10–,CD19+,CD20+,CD27–,CD38–); memory (CD10–,CD19+,CD20+,CD27+,CD38–); and plasma cells (CD10–,CD19+,CD20–
,CD27++,CD38++)
• in the peripheral blood of 106 healthy volunteers were used to generate the following reference ranges: immature (3‐11 cells/µL); naïve (60‐130 cells/µL); and memory (26‐65 cells/µL); and plasma cells (1‐3 cells/µL).
Caraux A, et al. Circulating human B and plasma cells. Age‐associated changes in counts and detailed characterization of circulating normal CD138– and CD138+ plasma cells. Haematologica 95:1016, 2010.