T.C.
MİLLÎ EĞİTİM BAKANLIĞI
MEGEP
(MESLEKİ EĞİTİM VE ÖĞRETİM SİSTEMİNİN
GÜÇLENDİRİLMESİ PROJESİ)
KİMYA TEKNOLOJİSİ
KİMYASAL DEĞİŞİMLER 1
ANKARA 2007
Milli Eğitim Bakanlığı tarafından geliştirilen modüller;
•
Talim ve Terbiye Kurulu Başkanlığının 02.06.2006 tarih ve 269 sayılı Kararı ile
onaylanan, Mesleki ve Teknik Eğitim Okul ve Kurumlarında kademeli olarak
yaygınlaştırılan 42 alan ve 192 dala ait çerçeve öğretim programlarında
amaçlanan mesleki yeterlikleri kazandırmaya yönelik geliştirilmiş öğretim
materyalleridir (Ders Notlarıdır).
•
Modüller, bireylere mesleki yeterlik kazandırmak ve bireysel öğrenmeye
rehberlik etmek amacıyla öğrenme materyali olarak hazırlanmış, denenmek ve
geliştirilmek üzere Mesleki ve Teknik Eğitim Okul ve Kurumlarında
uygulanmaya başlanmıştır.
•
Modüller teknolojik gelişmelere paralel olarak, amaçlanan yeterliği
kazandırmak koşulu ile eğitim öğretim sırasında geliştirilebilir ve yapılması
önerilen değişiklikler Bakanlıkta ilgili birime bildirilir.
•
Örgün ve yaygın eğitim kurumları, işletmeler ve kendi kendine mesleki yeterlik
kazanmak isteyen bireyler modüllere internet üzerinden ulaşılabilirler.
•
Basılmış modüller, eğitim kurumlarında öğrencilere ücretsiz olarak dağıtılır.
•
Modüller hiçbir şekilde ticari amaçla kullanılamaz ve ücret karşılığında
satılamaz.
İÇİNDEKİLER
AÇIKLAMALAR .................................................................................................... ii
GİRİŞ....................................................................................................................... 1
ÖĞRENME FAALİYETİ 1...................................................................................... 3
1. ELEMENT VE BİLEŞİKLERİN KARŞILAŞTIRILMASI .................................. 3
UYGULAMA FAALİYETİ ................................................................................. 6
ÖLÇME VE DEĞERLENDİRME...................................................................... 10
PERFORMANS DEĞERLENDİRME ............................................................... 12
ÖĞRENME FAALİYETİ 2.................................................................................... 13
2. KİMYASAL HESAPLAMALAR ...................................................................... 13
2.1. Kimyasal Tepkimelerin Denkleştirilmesi ..................................................... 13
2.2. Mol Kavramı ............................................................................................... 15
2.2.1. Mol....................................................................................................... 15
2.2.2 Mol ve Tanecik Sayısı............................................................................ 15
2.2.3. Mol Atom ............................................................................................. 17
2.2.4. Atom Kütlesi ........................................................................................ 19
2.2.5 Mol Kütlesi............................................................................................ 21
2.2.6. Mol - Hacim İlişkisi ............................................................................. 24
2.3. Stokiyometrik Hesaplamalar ........................................................................ 29
2.4. Artan Maddesi Olan Tepkimeler .................................................................. 31
2.5. Saf Olmayan Maddelerin Kullanıldığı Tepkimeler ....................................... 31
2.6. Kimyasal Reaksiyonlarda Karışım Problemleri ............................................ 33
UYGULAMA FAALİYETİ ............................................................................... 35
ÖLÇME VE DEĞERLENDİRME...................................................................... 37
PERFORMANS DEĞERLENDİRME ............................................................... 39
MODÜL DEĞERLENDİRME ............................................................................... 40
CEVAP ANAHTARLARI ..................................................................................... 42
KAYNAKÇA......................................................................................................... 44
i
AÇIKLAMALAR
AÇIKLAMALAR
KOD
524KI0014
ALAN
Kimya Teknolojisi
DAL/MESLEK
MODÜLÜN ADI
Alan Ortak Alan
Kimyasal Değişimler 1
Element ve bileşiklerin karşılaştırılmasını, kimyasal
tepkimelerin denkleştirilmesini ve kimyasal tepkimelerde
hesaplamaları ile ilgili temel bilgi ve becerilerin
kazandırıldığı öğrenim materyalidir.
MODÜLÜN TANIMI
SÜRE
40/32
ÖN KOŞUL
Fiziksel Değişimler 1 modülünü başarmış olmak
YETERLİK
Kimyasal değişimleri incelemek.
Genel Amaç
Gerekli ortam sağlandığında, kurallara uygun olarak
kimyasal değişimleri inceleyebileceksiniz.
Amaçlar
1. Kurallara uygun olarak elementlerden bileşik elde
MODÜLÜN AMACI
edebileceksiniz.
2. Kurallara uygun olarak kimyasal değişim
hesaplamaları yapabileceksiniz.
EĞİTİM
ÖĞRETİM
ORTAMLARI
VE
DONANIMLARI
ÖLÇME VE
DEĞERLENDİRME
Ortam
Atölye, sınıf, laboratuvar, kütüphane, internet ortamı ( bilgi
teknolojileri ortamı ), ev vb. kendi kendine ve grupla
çalışabileceğiniz tüm ortamlar.
Donanım
Mıknatıs, deney tüpü, bek, porselen kapsül, çeker ocak,
terazi, maşa, saat camı, pens.
Modülde yer alan her öğrenme faaliyetinden sonra
verilen ölçme araçları ile kendinizi değerlendireceksiniz.
Modül sonunda bilgi ve beceriyi belirlemek
amacıyla, öğretmeniniz tarafından hazırlanacak ölçme
aracıyla değerlendirileceksiniz.
ii
GİRİŞ
GİRİŞ
Sevgili Öğrenciler,
Bu modülü eğer başarılı bir şekilde bitirirseniz, element ve bileşikleri
karşılaştırabilecek, kimyasal tepkimeleri denkleştirebilecek ve kimyasal tepkimelerde
hesaplamalar yapabileceksiniz.
Unutmayalım ki her güzel eser; planlı, sabırlı, titiz ve düzenli çalışmaların neticesinde
ortaya çıkmaktadır.
Siz sevgili öğrenciler, çalışmalarınızda bu kurallara uyarsanız; başarılı olmamanız için
hiçbir neden yoktur.
.
1
2
ÖĞRENME FAALİYETİ 1
AMAÇ
ÖĞRENME FAALİYETİ 1
Uygun ortam sağlandığında, kuralına uygun olarak, elementlerden bileşik elde
edebilecek, element ve bileşik arasındaki farkları karşılaştırabileceksiniz.
ARAŞTIRMA
Ø
Saf olduğu belirtilen bir maddenin element ya da bileşik olduğunu nasıl
anlarsınız? Açıklayınız
Ø
Çevrenizde gördüğünüz element ve bileşikleri tablo haline getiriniz.
Ø
Bakır içeren bileşikleri ve bunların kullanım alanlarını araştırınız.
1. ELEMENT VE BİLEŞİKLERİN
KARŞILAŞTIRILMASI
Fiziksel Değişimler 1 modülünde; çeşitli yöntemlerle kendisinden daha basit
maddelere ayrılamayan saf maddelere element, kendisinden daha basit maddelere ayrılabilen
saf maddelere bileşik dendiğini, öğrendiniz.
Kimya açısından element ve bileşik kavramlarının bilinmesi önemlidir. Bu nedenle
element ve bileşiklerin karşılaştırılması gerekir. Element ve bileşikler arasındaki farklar
tabloda verilmiştir:
ELEMENT
BİLEŞİK
En küçük yapı taşları atomdur
En küçük yapı taşları moleküldür.
Kimyasal ve fiziksel yollarla daha basit
maddelere ayrıştırılamaz.
Kimyasal yollarla bileşenlerine
ayrıştırılabilir.
Elementler sembollerle gösterilir.
Bileşikler formüllerle gösterilir.
Aynı cins atomlardan oluşur.
Aynı veya farklı cins atomlardan oluşur.
Tablo 1.1: Element ve bileşiklerin karşılaştırılması
Element ve bileşiklerin en temel özelliklerini karşılaştırdıktan sonra birkaç element ve
bileşiği aşağıdaki gibi görünüşlerini de karşılaştırabiliriz.
3
İyot
Bakır
Demir
Kükürt
Çinko
Alüminyum
Resim 1.1: Çeşitli elementler
Günlük yaşamımızda değişik elementlerden oluşmuş maddeleri kullanmaktayız. Her
gün içtiğimiz suda oksijen ve hidrojen, soluduğumuz havada oksijen, azot, hidrojen bulunur.
Demir elementini kükürt elementi ile karıştırıp ısıttığımızda ele geçen bileşik demir’in
ve kükürt’ün özelliğini göstermez. Yeni oluşan demir ( II ) sülfür bileşiğinin özelliğini
gösterir. Reaksiyon denklemini yazarsak;
Demir + Kükürt → Demir ( II ) Sülfür
Demir
Kükürt
Demir Sülfür
Elementlerden bileşik elde edilmesini bakır ve iyot reaksiyonu üzerinden
tekrar incelersek;
Bakır + İyot → Bakır ( II ) iyodür
4
Bakır
İyot
Bakır ( II ) İyodür
Aşağıda çeşitli bileşik resimleri verilmiştir.
Bakır II sülfat
Kurşun IV oksit
Potasyum kromat
Nikel nitrat
Resim 1.2: Çeşitli bileşikler
5
Mangan sülfat
Demir II klorür
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
İşlem basamakları
Ø
Ø
Öneriler
2,5 gram demir tozunu tartınız.
Ø
Ø
Temiz bir spatül kullanınız.
Kimyasal maddeler ile
çalışırken dikkatli olunuz.
Ø
Madde miktarını dikkatli
tartınız
Tartım sonunda teraziyi
temizleyiniz.
1,5 gram kükürt tozu tartınız.
Ø
Ø
Demir tozu ve kükürt tozunu temiz bir
kâğıt üzerinde karıştırınız.
Ø
Ø
6
Düzgün ve temiz bir kâğıt
kullanınız.
Maddeleri spatül ile
karıştırınız.
Ø
Karışıma mıknatıs yaklaştırınız.
Ø
Karışımdaki değişikliği gözlemleyiniz.
Ø
Mıknatıstaki demir tozları ile kükürdü
tekrar karıştırınız.
Ø
Ø
Mıknatısı temiz bir kağıt ile
sarınız
Ø
Mıknatısta demir tozu
kalmamasına dikkat ediniz.
Ø
Deney tüpündeki maddeleri
bir baget ile karıştırınız.
Tüpe aktarırken dikkatli
olunuz. Etrafa dökülürse
temizleyiniz.
Karışımı deney tüpüne alınız.
Ø
7
Ø
Karışımı düşük alevde ,çeker ocakta
ısıtınız.
8
Ø
Deney tüpünde korlaşma
olursa bir süre alevden
uzaklaştırınız.
Ø
Dikkatli ısıtma yapınız.
Ø
Yanıklara karşı önlem alınız.
Ø
Tüpün ağzını duvara doğru
tutunuz. Bu şekilde
ısıtmalarda sıçrama olabilir.
Ø
Ø
Deney tüpünü kırarak içindeki kütleyi
porselen kapsüle alınız.
Ø
Kırma işlemini dikkatli
yapınız.
Ø
Isıtma işleminden sonra
mıknatıs yaklaştırılırsa ne
oluyor? İyi gözlem yapınız
Mıknatısın sarılı olduğu
kâğıtta demir tozları var mı?
İnceleyiniz.
Kütleye mıknatıs yaklaştırarak
gözlemleyiniz.
Ø
Ø
Malzemeleri temizleyiniz.
Ø
Ø
Sonuçları rapor ediniz.
Ø
9
Malzemeleri dikkatli
temizleyiniz
Malzemeleri ve raporu
öğretmeninize veriniz.
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
1.
Aşağıdakilerden hangisi aynı cins tanecik içermez?
A) Su
B) Hava
C) Yemek tuzu
D) Kükürt
2.
Elementler sembollerle, bileşikler formüllerle gösterilir. Bu bilgiyi kullanarak;
I. Yemek tuzu
II. Naftalin
III. Demir tozu
Hangisinin formülle gösterileceğini belirtiniz?
A) Yalnız I
B) I ve II
C) II ve III
D) I ve III
3.
Aşağıdakilerden hangisi kimyasal değişmedir?
A)Kağıdın yırtılması
B) Demirin paslanması
C) Camın kırılması
D) Gümüşten yüzük yapılması
4.
Aşağıdakilerden hangileri elementleri, bileşiklerden ayıran özelliktir?
I: Sembollerle gösterilirler.
II: Erime ve kaynama noktaları sabittir.
III: Yoğunlukları sabittir.
A)Yalnız I
B) Yalnız III
C) I ve II
D) II ve III
I: Belirli erime ve kaynama noktaları vardır.
II: Kimyasal yöntemlerle bileşenlerine ayrılır.
III: Sembollerle gösterilir.
IV: Yoğunlukları sabittir.
Yukarıdaki özelliklerden hangisi veya hangileri element ve bileşiklerin ortak
özelliğidir?
A)Yalnız I
B) I ve III
C) I, II ve III
D) I ve IV
5.
10
Aşağıdaki boşlukları doğru sözcüklerle doldurunuz.
6. Kağıdın yanması………………..bir olaydır
7. Camın kırılması…………………bir olaydır.
.
8.. Bir bileşiğin bütün özelliklerini gösteren en küçük parçasına ………….denir.
9.. ……………………kimyasal yollarla bileşenlerine ayrıştırılabilir.
10. Elementlerin en küçük yapı taşları………….dur.
11. İki veya daha fazla saf maddenin bir araya gelip kimyasal olarak birleşmesiyle meydana
gelen yeni maddeye………………..denir.
11
PERFORMANS DEĞERLENDİRME
PERFORMANS DEĞERLENDİRME
Bakır ve kükürt elementlerini kullanarak bileşik oluşturunuz. Aşağıda hazırlanan
değerlendirme ölçeğine göre yaptığınız çalışmayı değerlendiriniz. Gerçekleşme düzeyine
göre evet-hayır seçeneklerinden uygun olan kutucuğa işaretleyerek belirtiniz.
Değerlendirme Ölçütleri
1
Laboratuvar önlüğünü giyip gerekli güvenlik önlemlerini aldınız
mı?
2
Ortamın temizliğini kontrol ettiniz mi?
3
3 gram bakır tozu aldınız mı ?
4
1,5 gram kükürt tozu aldınız mı ?
5
Karışıma mıknatıs yaklaştırdınız mı?
6
Karışımı gözlemlediniz mi?
7
Karışımı deney tüpüne aldınız mı?
8
Karışımı düşük alevde çeker ocakta ısıttınız mı?
9
Kütleye mıknatıs yaklaştırıp gözlemlediniz mi?
10
Malzemeleri temizlediniz mi?
11
Sonuçları rapor ettiniz mi?
Evet
Hayır
DEĞERLENDİRME
Bu faaliyetteki “Hayır” cevaplarınızı yeniden gözden geçiriniz. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz.
12
ÖĞRENME FAALİYETİ 2
ÖĞRENME FAALİYETİ 2
AMAÇ
Uygun ortam sağlandığında kurallara uygun olarak kimyasal tepkimelerini
denkleştirebileceksiniz ve hesaplamalarını yapabileceksiniz.
ARAŞTIRMA
Ø
Kimyasal denklemdeki ok işareti ne anlama gelir? Araştırınız.
Ø
Kimyasal reaksiyonlar belirli şartlarda gerçekleşir sözünden ne anlıyorsunuz?
Araştırınız.
Ø
Sütten yoğurt elde edilmesi nasıl bir olaydır? Araştırınız.
Ø
Kimyasal olay nedir? Araştırınız.
2. KİMYASAL HESAPLAMALAR
Kimyasal tepkimelerden yararlanarak, denklemdeki maddelerin kütlesi, hacmi, mol ve
tanecik sayısı gibi nicelikleri hesaplanabilir. Kimyasal bir tepkimede nicelikler arasındaki
ilişkiye stokiyometri, hesaplamalara da stokiyometrik hesaplamalar denir.
Kimyasal hesaplamalarda kütlenin korunumu yasası esas alınır. Kütlenin korunumu
yasası, kimyasal bir reaksiyona giren maddelerin kütleleri toplamının, reaksiyon sonucu
oluşan maddelerin kütleleri toplamına eşit olmasını ifade eder.
Kimyasal hesaplamaları doğru yapabilmek için, öncelikle tepkimeyi doğru yazıp
denkleştirmek gerekir.
2.1. Kimyasal Tepkimelerin Denkleştirilmesi
Kimyasal reaksiyonlarda kütlenin korunumu ilkesi geçerlidir, reaksiyona katılan ve
reaksiyonda oluşan maddelerin en küçük yapı taşları olan atomların sayılarının tepkimenin
her iki tarafında eşit olması gerekir. Atom sayılarının tepkimenin her iki tarafında eşit
olmasını sağlayan işleme denklem denkleştirmesi denir.
Denklemler denkleştirilirken genellikle aşağıdaki işlem sırası izlenmelidir
Ø
Önce metal atom sayıları denkleştirilir.
Ø
Varsa oksijen ve hidrojenin dışındaki ametalin atom sayıları denkleştirilir.
Ø
Hidrojen atom sayısı denkleştirilir
Ø
Oksijen atom sayısı denkleştirilir.
13
Örnek:
Ca3N2 + H2O → Ca(OH)2 + NH3 tepkimesini denkleştirelim.
-
Birinci tarafta 3 tane Ca atomu vardır, ikinci tarafta ise 1 tane Ca atomu vardır.
Denkleştirmek için Ca(OH)2 önüne 3 katsayısı yazılır.
Ca3N2 + H2O →3Ca(OH)2 + NH3
Birinci tarafta 2 tane N atomu vardır, ikinci tarafta 1 tane N atomu vardır.
Denkleştirmek için NH3’ün önüne 2 katsayısı yazılır.
Ca3N2 + H2O →3Ca(OH)2 +2NH3
-
Sağ tarafta hidrojenin 12 atom sayısı vardır.ikinci tarafta da 12 tane atom hidrojen
olmalıdır. Bu yüzden H2O’nun katsayısı 6 olorak yazılır.
Ca3N2 +6H2O →3Ca(OH)2 +2NH3
-
Birinci tarafta 6 tane oksijen atomu vardır, ikinci tarafta da 6 tane oksijen atomu
vardır. Dolayısıyla denklem denkleşmiş oldu
Örnek:
Al2O3 + HCl → AlCl3 + H2O tepkimesini denkleştirelim.
-
Birinci tarafta 2 tane Al atomu vardır,ikinci tarafta 1 tane Al atomu vardır.
Denkleştirmek için AlCl3’ün önüne 2 katsayısı yazılır.
Al2O3 + HCl →2 AlCl3 + H2O
- İkinci tarafta 6 tane Cl atomu vardır, birinci tarafta 1 tane Cl atomu
vardır.Denkleştirmek için birinci taraftaki HCl’nin önüne 6 katsayısı yazılır.
Al2O3 +6 HCl →2 AlCl3 + H2O
- Birinci tarafta 6 tane H atomu vardır, ikinci tarafta 2 tane H atomu vardır.
Denkleştirmek için H2O’nun önüne 3 katsayısı yazılır.
Al2O3 +6 HCl →2 AlCl3 +3 H2O
- Oksijenin atom sayıları her iki tarafta da eşit olduğuna göre denklem denkleşmiştir.
14
2.2. Mol Kavramı
2.2.1. Mol
Mol kelimesi Latincede büyük yığın anlamındadır. Mol kavramı çok büyük sayıları
ifade etmekte kullanılan trilyon, katrilyon gibi ama onlardan çok daha büyük bir miktar
birimidir.
Nasıl ki tek tek sayılar yerine düzine ifadesini kullanmak, sayım işleminde kolaylık
sağlıyorsa kimyada da atomların sayımı için mol ifadesi birim olarak kolaylık sağlar. Mol
kavramı bilimsel olarak karbon 12C izotopunun atomları ile tanımlanmış olsa da her tür
kimyasal için geçerli bir kavramdır.
2.2.2 Mol ve Tanecik Sayısı
1 mol denildiği zaman 602.000.000.000.000.000.000.000. veya daha kısa olarak
6,02x1023 sayısı ile ifade edilir. Bu sayıya Avogadro sayısı adı verilir ve NA ile gösterilir.
Mol, herhangi bir maddenin Avogadro sayısı (6,02x1023 ) kadar tanecik (atom,
molekül, formül birim, iyon ) içeren miktarına denir.
Resim 2.1 : Atom
Bu kavramı gözümüzde canlandıralım;
İki ayrı atom yerine kuş tüyü ile çelik bilye düşünelim 6,02.1023 tane kuştüyünü
toplayıp bir yığın yapalım.
Ayrı bir yerde de yine 6,02.1023 tane çelik bilyeyi toplayıp yığalım.
Her iki tarafta da eşit sayıda kuş tüyü ve bilye bulunacaktır. Yani 1 mol kuş
tüyü ve 1 mol bilye elde etmiş oluruz.
Her iki yığın ayrı ayrı tartıldığında aralarında büyük bir ağırlık farkı olduğu görülür.
Çünkü bir tek bilye, bir tek kuş tüyünden çok daha ağır olduğundan bilye yığını, kuş tüyü
yığınından çok daha ağır olacaktır.
Kuş tüyü yığını 1 moldür (6,02x1023 adet)
Çelik bilye yığını da 1 moldür (6,02x1023 adet)
15
1 mol kuş tüyü= (6,02.1023 tane)
1 mol çelik bilye= (6,02.1023 tane)
Mol belirtilirken molün ait olduğu nesne mutlaka belirtilmelidir. Aşağıda bu ifadeye
ait örnekler verilmiştir;
6,02.1023 tane kuş tüyü = 1mol kuş tüyü
6,02.1023 tane çelik bilye= 1 mol çelik bilye
6,02.1023 tane elma=1 mol elma
6,02.1023 tane Hidrojen atomu = 1mol hidrojen atomu
6,02.1023 tane Azot molekülü= 1 mol azot molekülü
6,02.1023 tane Gümüş molekülü =1 mol gümüş iyonu
6,02.1023 tane BaCl2 molekülü =1 mol BaCl2 molekülü
N tane tanecik içeren bir madde örneğinin mol olarak eş değeri (n), tanecik
sayısının(N), Avogadro Sayısına (NA ) bölünmesiyle bulunur.
Formül ile ifade edecek olursak;
Tanecik sayısı
Mol = ———————— şeklinde ifade edebiliriz.
Avogadro sayısı
N(Tane)
n = ————————
NA (Tane/Mol)
şeklinde ifade edebiliriz.
Resim 2. 2: Atom
16
Örnek : 3 mol sodyum atomunda kaç tane sodyum atomu vardır?
Çözüm :
n : 3 mol
I. Yol
NA : 6,02.1023
1 mol Na atomu
6,02x1023 tane Na atomu içerirse
N:?
3 mol Na atomu
X
————————————――——————————
3x 6,02x1023
X = ——————— = 18,06 x1023 tane Na atomu
1
Problemi formülle çözersek;
N
n = N/NA
3= ———— = 3. 6,02.1023 = 18,06 .1023 tane Na atomu
II. Yol
6,02.1023
Örnek :
3,01.1022 tane Mg atomu kaç moldür?
Çözüm : N=3,01.1022
NA =6,02.1023
n= ?
n= N/NA
n = 3,01.1022 /6,02.1023
n = 0,05 mol
2.2.3. Mol Atom
Bir bileşiğin formülü bileşiğin bir molekülünü veya bir molünü belirtmek için
kullanılabilir. Bir bileşiğin bileşik formülü hangi cins element atomlarından oluştuğunu ve o
atomların bileşikteki sayısını belirtir.
Bir molekül Na2CO3
}
2 tane Na atomu
1 tane C atomu
3 tane O atomu
Mol cinsinden ifade edilen bileşiğin bileşik formülünden de bileşikteki atomların mol
sayıları da anlaşılır.
Bir mol Na2CO3
}
2 mol Na atomu
1 mol C atomu
3 mol O atomu
17
Resim 2.3: Dört farklı atomdan oluşmuş tek molekül
Örnek : 0,2 mol Al2O3 bileşiğindeki Al ve O atomlarının sayılarını bulunuz.
Çözüm : 1 mol Al2O3 ‘te 2 mol Al ve 3 mol O atomu vardır.
n = 0,4 mol
NA = 6,02.1023
N=?
1 mol Al2O3
2 mol Al varsa
0,2 molde
X
————————————―————
X = 0,2.2 = 0,4 mol AI vardır.
n = N/NA
NAlüminyum
0,4 = —————
→ 0,4.6,02.1023 = 2,4 .1023 tane Al atomu
23
6,02.10
Şimdi 0,2 mol Al2O3 de O atomunun molünü ve kaç tane O atomu olduğunu bulalım;
1 mol AI2O3 te
3 mol O varsa
0,2 molde
X
————————————―————
X= 0,2.3 = 0,6 mol O atomu vardır
n = N/NA
NOksijen
0,6 = —————
6,02.1023
→
0,6 x 6,02x1023 = 3,6 x1023 tane O atomu vardır
Oksijen atomu sayısı oran-orantı metodundan da bulunabilir;
1 mol O atomu
6,02.1023 tane O atomu içerirse
0,6 mol O atomu
X
————————————――——————————
0,6.6,02x1023
X = ——————— = 3,6.1023 tane O atomu
18
1
Oksijen atomu sayısı oran-orantı metodundan da bulunabilir;
1 mol O atomu
6,02x1023 tane O atomu içerirse
0,6 mol O atomu
X
————————————――——————————
0,6.6,02.1023
X = ——————— = 3,6.1023 tane O atomu
1
2.2.4. Atom Kütlesi
1 mol 12C iztopu yani 6,02x1023 tane 12C iztopu tartıldığında 12 gram gelmiştir. Tek
bir C izotopu ise 1,9926.1023 gramdır.
12
1,9926.1023 gram . 6,02.1023 = 12 gramdır.
Resim 2.4 : 1 mol 12 gram 12C izotopu
12
C izotopunun atom kütlesi 12 kabul edilmiş ve bunun 1/12sine 1 atomik kütle birimi
(akb) denmiştir. Örneğin hidrojen atomunun kütlesi 1,67x10-24 gramdır. Fakat bu kadar
küçük sayıyla hesaplama yapmak pratik değildir. Bu nedenle atomların kütleleri belirtilirken
birim olarak gram değil, atomik kütle birimi (akb) kullanılır.
Atomik kütle birimi de çok küçük bir birim olduğundan maddelerin kütleleri ile
ilgilenirken tek bir atomun yada molekülün kütlesi yerine 6,02x1023 taneciğin (1 mol
taneciğin) kütlesini kullanmak daha uygundur.
Tek bir atomun kütlesi . NA = 1 mol atomun kütlesi
19
Bir elementin 1 mol atomunun gram cinsinden kütlesi ile o elementin ortalama atom
kütlesi aynı sayı ile ifade edilir. Örneğin; 1 mol magnezyum atomunun kütlesi 24,3 gr, bir
magnezyumun ortalama atom kütlesi ise 24,3 akb’dir. Bu 24,3 sayısına magnezyum
elementinin atom kütlesi veya atom ağırlığı denir. Resim 2.5 deki her biri 1 mol atom içeren
elementlerin hepsi aynı mantıkla tartılmıştır. Buradaki element numunelerinin her birinde o
elementin bir mol atomu bulunmaktadır.
Sağ üstten itibaren;
32 g kükürt (açık renk)
12 g karbon (koyu renk)
201 g civa(sağ alttaki sıvı )
207 g kurşun (küp)
64 g bakır (granül
Resim 2 . 5 : Çeşitli elementlerin 1’er molü
Resim 2. 5’deki atom yığınlarının her birinde aynı sayıda (6,02.1023 tane ) atom
bulunur fakat her yığının kütlesi farklıdır; çünkü atomların kütleleri farklıdır.
a)
Üstteki terazinin her iki
kefesindeki
örneklerin
kütleleri
eşittir; fakat sağdaki atomlar daha
hafif olduğu için sağ kefede daha çok
sayıda atom vardır.
b) Alttaki terazinin kefelerinde eşit
sayıda atom vardır; fakat, sağdaki
atomlar hafif olduğu için soldaki
kefedeki örneğin kütlesi daha
büyüktür.
Resim 2.6: Farklı atomların kütle ve atom sayıları arasındaki ilişki
Periyodik cetvelde birimsiz olarak verilen atom kütleleri üç değişik şekilde
yorumlanabilir. Örneğin; alüminyum elementi için verilen 27,0 sayısı;
Ø
Ø
Ø
Alüminyumun ortalama atom kütlesinin 27,0 akb
Bir mol alüminyum atomunun kütlesinin 27,0 gram
Alüminyum elementinin atom ağırlığının 27,0 gr/mol olduğunu gösterir.
20
2.2.5 Mol Kütlesi
Bir maddenin 1 molünün gram cinsinden kütlesine, o maddenin mol kütlesi denir ve
M ile gösterilir. Mol kütlesinin birimi gr/mol’dür. Bir elementin bir atomunun gram olarak
kütlesi (gerçek kütlesi),
Gerçek atom kütlesi
Mol Kütlesi (MA)
Avogadro sayısı (NA)
=
Formülüyle bulunur. Örneğin; 6,02.1023 tane demir (Fe) atomunun kütlesi 56 gramdır.
Bir tek demir atomunun kütlesi ise;
56
6,02.1023
= 9,3.10-23 g. dır
Molekül yapılı bir element veya bileşiğinin 1 molünün gram olarak kütlesi de mol
kütlesi olarak tanımlanır. Kimyasal hesaplamalarda temel birim; atom için atom kütlesi,
moleküller için molekül kütlesi ve formül birimi için formül kütlesi olarak alınır. Örneğin;
O2 molekülünün kütlesi 16.2=32 gramdır. Tek bir oksijen atomunun kütlesi ise oksijen
molekülünün kütlesinin Avogadro sayısına bölümüyle bulunur.
32
6,02.1023
= 5,316.10-23 g.dır
Resim 2 . 7: 1 mol bileşik
21
Bir bileşiğin mol kütlesi, o bileşiği oluşturan atomların mol kütleleri toplamına eşittir.
Örneğin; Fe:56, S:32, O:16 olduğuna göre Fe2(SO4)3’ ın mol kütlesi;
2 mol Fe atomu = 2.56 = 112 g
3 mol S atomu = 3.32 = 96 g
12 mol O atomu = 12.16 = 192 g
Fe2(SO4)3
Fe2(SO4)3 = 400 g / mol dür.
Benzer olarak MgCl2 ve (NH4)3 PO4 bileşiklerinin mol kütlelerini bulalım;
Mg:24, Cl:35,5 N:14, H:1, P:31, O:16
1x24 = 24
2x35,5 = + 71
95 g
MgCl2
İfadeyi yan yana da yazıp sonucu bulabiliriz;
MgCl2 : (1x24) + (2x35,5) = 95 g
Örnek :
3.14 = 42
12.1 = 12
1.31 = 31
4.16 =+64 .
149 g
(NH4)3 PO4
veya
(NH4)3PO4 = (3x14) + (12x1) + (1x31) + (4x16) = 149 g olarak bulunur.
Bir maddenin belirli bir kütlesinin kaç mol olduğu ,
n (mol) =
Verilen kütle
Mol kütlesi
bağıntısı ile bulunur.
Verilen kütleyi m gram, mol kütlesini MA gram / mol ve mol sayısını da n mol olarak
ifade edersek;
n (mol) =
m (g)
MA (g / mol)
22
yazılabilir.
Resim 2 . 8: Bir molekül örneği
Örnek: 37 g Ca (OH)2 kaç moldür? (Ca:40, O:16, H:1)
Çözüm :
Öncelikle verilen bileşiğin bir molünün kütlesi bulunur.
MCa(OH)2 = (1.40) + (2.16) + (2.1) = 74 g / mol
Problemi formül ile çözersek
II. yol
I.yol
1 mol
X
MA= 74 g / mol
m= 37 g
n= ?
x=
37
74
74 g
37 g
n=
m
MA
n=
37
74
n=0,5 mol
= 0,5 mol
Örnek: 8 g NaOH kaç moldür?( Na:23 O:16 H:1 )
Çözüm:
MNaOH= 23 + 16 + 1 = 40 g
m= 8 g
n= ?
I.Yol
1 mol
40 g
X mol
8g
————————————
8
X= ——— =0,2 mol
40
II.Yol
m
8
n= ——— = ——— = 0,2 mol
MA
40
Örnek: 25 g Cu SO4. 5 H2O kaç moldür ?
Çözüm:
MCu SO4. 5 H2O = ( 1. 64 ) + ( 1.32) +( 4.16 ) +5.(( 2.1 )+( 1.16 )) = 250 g
23
MA = 250 g/mol
m=25 g
n= ?
I. Yol
II. Yol
1 mol
250 g
X mol
25 g
————————————
25
X= ———— = 0,1 mol
250
m
25
n= ——— = ——— = 0,1 mol
MA
250
2.2.6. Mol - Hacim İlişkisi
Bir maddenin bir molünün hacmine molar hacim denir. Katıların ve sıvıların molar
hacimleri maddeden maddeye değişir. Ancak bütün gazların molar hacimleri aynı sıcaklık ve
basınç koşullarında aynıdır.
Herhangi bir gazın 0o C sıcaklık ve 1 atmosfer basınç altında bir molünün hacmi 22,4
litredir.
0o C ve 1 atm’ye standart koşullar veya normal koşullar olarak adlandırılır. O halde
normal şartlar altında (NŞA olarak gösterilir.) 1 mol gaz 22,4 litredir.
1 mol gaz = 22,4 litre (NŞA)
1 mol H2
= 6,02.1023 tane H2 molekülü = 2gH2
= 22,4 litre (NŞA)
23
1 mol CO2 = 6,02.10 tane CO2 molekülü = 44 g CO2 = 22,4 litre (NŞA)
1 mol N2
= 6,02.1023 tane N2 molekülü
= 28gN2
=22,4 litre (NŞA)
Resim 2 . 9: Aynı koşullarda klor ve hidrojen gazı
24
Örnek : 2 mol N2 gazı (NŞA )‘da kaç litredir?
Çözüm :
1 mol N2
22,4 L. Hacim kaplarsa
2 mol N2
X
————————————————
X = 2.22,4 = 44,8 litre hacim kaplar
Örnek : 5,6 litre CO2 gazı NŞA’ da kaç gramdır ? (C: 12, O: 16 )
Çözüm :
MCO2 = (1.12 ) + ( 2.16 ) = 44 g
1 mol
22,4 L NŞA da
X
5,6 L
——————————————
5,6
X = ———— = 0,25 mol CO2
22,4
n = 0,25 mol
M = 44 g
m=?
m
n = ———
MA
→
m
0,25 = ——— = 0,25.44 = 11 g
44
Örnek : 1,204.1024 tane H2 molekülü NŞA da kaç litredir ?
Çözüm :
1 mol 6,02.1023 tane tanecik içerir.
NŞA’ da 1 mol gaz 22,4 litre hacim kapladığına göre Avogadro sayısı kadar tanecik NŞA’
da 22,4 litre hacim kaplar.
6,02.1023
22,4 litre
1,204.1024
X
1,204.1024.22,4
—————————————— = ———————— = 44,8 litre
6,02.1023
Örnek: Aşağıdaki soruları 6 gram Etan gazı (C2H6) için yanıtlayınız.(C:12 H:1)
a)
b)
c)
d)
e)
f)
Kaç tane molekül içerir?
Kaç mol karbon atomu içerir?
Kaç tane karbon atomu içerir?
Kaç gram karbon içerir?
Kaç mol hidrojen atomu içerir?
Kaç tane hidrojen atomu içerir?
25
g)
h)
i)
j)
Kaç gram hidrojen içerir?
Kaç mol atom içerir?
Kaç tane atom içerir?
NŞA hacmi kaç litredir?
Resim 2.10 : Etan gibi helyuma da kimliği soruluyor
Çözüm :
C2H6’ nın 1 molü
MA=MC2H6 = (2x12) + (6x1) =30 gram
1 mol
30 g ise
X
6g
———————————
X.30 = 1.6
6
X= ——— = 0,2 mol ( diğer şıklar 0,2 mole
30
göre çözülecektir).
a) 1 mol
6,02 .1023 ise
0,2
X
———————————
X = 0,2.6,02.1023 =1,204.1023 tane molekül vardır.
b) 1 mol C2H6 da
2 mol C varsa
0,2 mol C2H6
X
—————————————————
X = 0,2.2 =0,4 mol C atomu
26
1 mol
2.6,02 .1023 tane C atomu
0,2 mol C de
X
————————————————————
X = 0,2.1,204.1023 =2,4.1023 tane C atomu
d)
1 mol C
2.12 g
0,2 mol C
X
———————————
X = 0,2.24 = 4,8 g C
c)
e)
1 mol C2H6 da
6 mol H varsa
0,2 mol C2H6 da
X
—————————————————
X = 0,2.6= 1,2 mol H atomu vardır
f)
1 mol
6.6,02.1023 tane
0,2 mol H de
X
————————————————————
X = 0,2.36,12.1023 = 7,224.1023 tane H atomu vardır.
g)
1 mol H
6.1 g
0,2 mol H
X
———————————
X = 0,2.6.1 = 1,2 g H
h) 1 mol C2H6 ,2 mol C ve 6 mol H olmak üzere toplam 8 mol atom içerir.
1 mol C2H6 da
8 mol toplam atom
0,2 mol C2H6 da
X
—————————————————
X = 0,2.8 = 1,6 mol atom
ı)
1 mol
8.6,02 x 1023 tane atom
0,2 mol H de
X
————————————————————
X = 0,2.8.6,02.1023 = 9,6.1023 tane atom içerir.
j)
1 mol C2H6
22,4 litre ise (NŞA)
0,2 C2H6
X
————————————————————
X = 0,2.22,4 = 4,48 litre
Örnek: 0,04 mol X(NO3)2 maddesinin kütlesi 7, 2 gram geldiğine göre
a)X’in atom kütlesi nedir ?
b) X’in bir atomunun kütlesi nedir ?( N : 14 O : 16 )
27
Çözüm :
n = 0,04 mol
m = 7,2 g
MX(NO3)2 =?
m
n = ————
MX(NO3)2
molekülün mol ağırlığı 180 gdır.
X(NO3)2 = X+ 2.N + 6.O =180
= X + 2.14 + 6.16 =180
= X + 124 =180 →
b)
7,2
0,04 = ——— →
MX(NO3)2
=
MX(NO3)2 = 7,2/0,04
= 180 g
X=180-124=56 g
X(NO3)2 de 1 mol X vardır.
Gerçek atom kütlesi
Mol kütlesi
Avogadro sayısı
=
Gerçek atom kütlesi
56
=
6,02.10
23
= 93x10-23 gram
Örnek: 3 gram Al2Y3 bileşiğinde 1,92 gram Y vardır. Y’ nin mol kütlesini hesaplayınız.
(Al=27)
Çözüm :
3 gram Al2Y3 te 3-1,92=1,08 g Al vardır.
n=
m
M
=
1,08
27
=
0,04 mol Al
İçinde 0,04 mol Al bulunan Al2Y3’ ün mol sayısı;
2 mol AI içeren Al2Y3
1mol ise
0,04 mol Al2Y3
X
———————————————
2.X = 0,04 x 1 → X = 0,02 mol Al2Y3
1 mol Al2Y3 bileşiğinin mol kütlesini bulalım;
28
0,02 mol Al2Y3
3 g ise
1 mol Al2Y3
x gdir
———————————————
3.1
X = ———— = 150 g dır.
0,02
Al2Y3 = 150 g / mol
→
150 = 2.27 + 3.Y →
150 = 54 + 3.Y
150 - 54
Y = ————— = 32 g / mol
3
Veya daha kısa bir yolla;
2 x 27 = 54 gr Al 3Y ile birleşmiş.
1,08 g Al ile
1,92 g 3Y birleşirse
54 g Al ile
X g 3Y birleşir.
———————————————
54.1,92
X = ———— = 96 g 3Y birleşir.
1,08
96
3Y= 96 g ise →
Y= ———— = 32 g olarak bulunur.
3
2.3. Stokiyometrik Hesaplamalar
Örnek:
25 g CaCO3 katısı bir miktar HCl çözeltisi ile;
CaCO3 + HCl → CaCl2 + H2O + CO2 denklemine göre tepkimeye giriyor. Tepkime
sonunda; (Ca:40 , O:16 , C:12)
a- Kaç mol CaCl2 katısı oluşur?
b- N.Ş.A’da kaç lt CO2 gazı oluşur?
29
Çözüm:
a- CaCl2 ‘nin mol sayısı istendiğinden tepkimenin alt kısmına yazılır.
CaCO3 + 2HCl → CaCl2 + H2O + CO2
100 g
1 mol CaCl2
25 g
X mol
────────────────────────
25
X = ───── = 0,25 mol CaCl2 oluşur.
100
b- Doğru orantı ile CO2’nin N.Ş.A’daki hacmi hesaplanır.
100 g CaCO3 ile
22,4 L CO2 oluşur.
25 g
X L
────────────────────────
25.22,4
X= ────── = 5,6 L CO2 oluşur.
100
Örnek:
X(OH)2 + 2HCl → XCl2 + 2H2O
Tepkimesine göre 0,5 mol HCl harcandığında 52 g XCl2 bileşiği oluşuyor. Buna göre
X elementinin atom kütlesi kaçtır? (Cl:35,5)
Çözüm:
X(OH)2 + 2HCl → XCl2 + 2H2O
2 mol
ag
0,5 mol
52 g
───────────────
2.52
a = ───── = 208 g XCl2 oluşur.
0,5
X+2.Cl = 208
X + 2.35,5 = 208
X + 71 = 208
X = 208- 71 = 137 g/mol
30
2.4. Artan Maddesi Olan Tepkimeler
Bazı tepkimelerde, tepkimeye giren maddelerden biri tam olarak harcandığı halde,
diğer madde artabilir. Bu durumda tepkime, maddelerden en az bir tanesi bitinceye kadar
devam eder. Problem tepkimede biten maddeye göre çözülür.
Örnek:5,6 gram CO gazı ile 4,8 gram O2 gazının reaksiyonundan hangisinin kaç gramı
reaksiyona girmeden kalır?(CO:28 gr/mol, O:16 gr/mol)
Çözüm:
2CO (g) + O2(g) → 2CO2(g)
2.28 gr 2.16 gr
56 gram CO gazı
32 gram O2 gazı ile tepkimeye girerse
5,6 gram CO gazı
x gram O2 gazı ile tepkimeye girer.
x= 3,2gram
4,8 – 3,2 = 1,6 gr O2 gazı artar.
UYARI: O2 gazı üzerinden reaksiyona girecek CO gazı miktarı hesaplanmış olsaydı 4,8 g O2
gazına karşılık 8,4 g CO gazı gerektiği görülecekti. Başlangıçta 5,6 g CO gazı olduğuna göre
artan gaz O2 gazıdır.
Örnek:
Başlangıç miktarları eşit olan 64 gram H2 ve O2 gazları karışımı tepkimeye giriyor. Tepkime
tamamlandığında artan gaz ve oluşan H2O kaç gramdır? (H:1 , O:16)
Çözüm
Başlangıç miktarları 64 g ve eşit olduğuna göre 32 g H2 ve 32 g O2 vardır. Orantı kurarsak
2H2 + O2 → 2H2O
4g
32
36
X
32
Y
────────────
X= 4 g H2 harcanır, 28 g H2 artar; 36 g H2O oluşur.
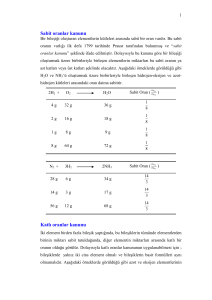
2.5. Saf Olmayan Maddelerin Kullanıldığı Tepkimeler
Kimyasal tepkimelerde kullanılan maddelerden bazıları saf olmayabilir. Bu tür madde
içeren problemleri çözerken, maddenin saf olan miktarının bulunması gerekir. Çünkü
tepkime denklemlerinde daima saf olan madde miktarları gösterilir.
31
Örnek:
Isı
2KClO3(k) → 2KCl(k) + 3O2(g) tepkimesine göre, %50 saflıktaki 24,4 g KClO3’ın
ısıtılmasından, N.Ş.A’ da kaç litre O2 gazı elde edilir? (KClO3:122 gr/mol)
Çözüm:
100 gr maddenin
50 gr KClO3 safsa
24,4 gr maddenin
X
────────────────────────
24,4.50
X = ──────── = 12,2 gram (saf madde)
100
2KClO3 (k) → 2KCl + 3O2(g)
2.122 gr KClO3
3.22,4 L O2
12,2 gr KClO3
X
────────────────────
12,2.3.22,4
X = ───────── = 3,36 L O2 elde edilir.
2.122
Örnek:
Saf olmayan 6 g Mg tozu üzerine H2SO4 çözeltisi eklendiğinde N.Ş.A’da 2,24 L H2
gazı oluşuyor. Buna göre Mg’nin saflık yüzdesi kaçtır? (Mg:24)
Çözüm:
Mg(k) + H2SO4(suda) → MgSO4(k) H2(g)
24 g
22,4
X
2,24
───────────────────────
24.2,24
X = ───── = 2,4 g Mg
22,4
32
Buna göre başlangıçta verilen Mg katısının 2,4 gramı saf olduğuna göre 100 gramının
6g
2,4 g safsa
100 g
X
───────────────
100.2,4
X = ───── = 40 g saftır. Saflık oranı ise %40’tır
6
2.6. Kimyasal Reaksiyonlarda Karışım Problemleri
Karışım başka bir madde ile tepkimeye sokulduğunda, karışımı oluşturan maddelerden
yalnız bir tanesi tepkimeye giriyorsa, buna ait tepkime denklemi yazılarak ilgili maddenin
miktarı hesaplanır. Eğer tepkimeye girmeyen maddenin miktarı soruluyorsa, karışımın
toplam miktarından bulunan değer çıkarılır.
Örnek:
4 gram Mg ve Ag karışımı HCl ile tepkimeye sokulunca, normal koşullarda 1,12 L H2
gazı açığa çıkıyor. Karışımdaki Ag’ün kütlece yüzdesi nedir?(Karışımdaki elementlerden
yalnız Mg, HCl ile tepkime verir) (Mg:24).
Çözüm:
Mg + 2HCl → MgCl2 + H2(g)
Tepkimeye göre H2 gazı 1 moldür bu yüzden 22,4 L hacim kaplar. Mg’da 1 moldür, bu
yüzden 24 gramdır.
1 mol Mg
N.Ş.A’da 22,4 L H2 gazı oluşturursa
X mol Mg
1,12 L H2 gazı oluşturur.
──────────────────────────
1.1,12
X = ────── = 0,05 mol Mg
22,4
33
1 mol Mg
0,05 mol Mg
24 g ise
X
──────────────────────────
24.0,05
X = ────── = 1,2 g Mg
1
4 g karışım – 1,2 g Mg = 2,8 gr Ag vardır.
4 g karışımda
2,8 g Ag varsa
100 g karışımda
X
───────────────────────
100.2,8
X = ────── = %70 Ag vardır.
4
34
UYGULAMA FAALİYETİ
UYGULAMA FAALİYETİ
Ø
Ø
Ø
Ø
İşlem Basamakları
3-4 cm Mg şeridini kesiniz.
Ø
Öneriler
İş önlüğünüzü giyiniz.
Ø
Çalışma masanızı düzenleyiniz.
Ø
Mg şeridini tartmadan önce eğer
oksit tabakası varsa seyreltik HCl
asidine daldırarak oksit tabakasını
temizleyiniz.
Ø
Madde miktarını dikkatli tartınız.
Ø
Saat camının darasını bir yere not
ediniz.
Ø
Yakma işlemini mutlaka pota pensi
kullanarak yapınız.
Yanma sonucu oluşan MgO’i saat
camının üzerinde toplayınız.
Kesilen Mg şeridini tartınız.
Saat camının darasını alınız.
Mg şeridini yakınız.
Ø
35
Ø
Ø
Ø
Elde edilen külü saat camının
üzerinde tartınız.
Tepkimeleri denkleştirip,
hesaplamaları yapınız.
Sonuçları rapor ediniz.
Ø
Hassas teraziyi dikkatli kullanınız.
Ø
İşiniz bittikten sonra hassas teraziyi
temizleyiniz.
Ø
Hesaplamaları dikkatlice yapınız.
Ø
Rapor hazırlamak çok önemlidir,
tüm verilerinizi içeren bir rapor
yazınız.
36
ÖLÇME VE DEĞERLENDİRME
ÖLÇME VE DEĞERLENDİRME
1.
2HNO3 + 3X → 3S + 2NO + 4H2O denkleşmiş tepkimesinde, X ile gösterilen
madde aşağıdakilerden hangisidir?
A) N2
B) H2S
C) NO
D) NO2
2.
CO(g) + 1/2O2(g) → CO2(g) tepkimesine göre, 56 g CO ile 40 g O2 gazları tepkimeye
girdiğinde aşağıdakilerden hangisi doğru olur?
A) 1 mol CO2 oluşur.
B) O2’nin tamamı harcanır.
C) CO’in tamamı harcanır.
D) 10 g oksijen artar.
3.
I. Mol sayısı korunur.
I. Kütle korunur.
III. Atom sayısı ve cinsi korunur.
Bir kimyasal tepkime için yukarıdakilerden hangilerinin doğruluğu kesindir?
A) Yalnız I
B) Yalnız III
C) II ve III
D) I ve II
4.
C6H12O6 + O2 → CO2 + H2O tepkimesi en küçük kat sayılarla denkleştirildiğinde
O2’nin n kat sayısı kaç olur?
A) 18
B) 12
C) 8
D) 6
5.
10 g CaCO3 katısı bir miktar HCl çözeltisi ile CaCO3 + HCl " CaCl2 + H2O + CO2
denklemine göre tepkimeye giriyor. Tepkime sonunda kaç mol CaCl2 katısı oluşur?
(CaCO3: 100 )
A) 0,5 mol
B) b- 0,1 mol
C) 0,3 mol
D) d- 0,75 mol
80 g KClO3 ısıtıldığında N.Ş A’da 16,8 lt O2 gazı oluşmaktadır. Kullanılan KClO3’ın
saflık yüzdesi kaçtır? (K:39, Cl;35,5 , O;16 )
A) 50
B) 76,56
C) 91,87
D) 75
6.
37
7.
Aşağıdaki kimyasal denklemleri denkleştiriniz.
A) Mg3N2 + H2O → Mg(OH)2 + NH3
B) CaO + H3PO4 → Ca3(PO4)2 + H2O
C) C2H5OH + O2 → CO2 + H2O
8.
0,05 mol Demirde kaç tane atom bulunur? (Fe : 56 )
A) 6,02x1022
B) 3,01x1022
C) 1,2x1023
D) 6,02x1023
9.
9,6 g CH4 gazı NKA’ da kaç litre hacim kaplar? (C: 12 H: 1 )
A) 13,4
B) b- 22,4
C) 9,6
D) d- 16
10.
XOH bileşiğinin 11,2 gramında 3,2 gram Oksijen bulunduğuna göre x’in atom kütlesi
kaçtır? (O : 16 H : 1 )
A) 7
B) 19
C) 23
D) 39
38
PERFORMANS DEĞERLENDİRME
PERFORMANS DEĞERLENDİRME
Mg şeriti yakarak bileşik oluşturunuz. Aşağıda hazırlanan değerlendirme ölçeğine göre
yaptığınız çalışmayı değerlendiriniz. Gerçekleşme düzeyine göre evet-hayır seçeneklerinden
uygun olan kutucuğA işaretleyerek belirtiniz.
Değerlendirme Ölçütleri
1
2
3
4
5
6
7
8
9
Evet
Hayır
Laboratuvar önlüğünü giyip gerekli güvenlik önlemlerini aldınız
mı?
Ortamın temizliğini kontrol ettiniz mi?
Mg şeridini kestiniz mi?
Kesilen Mg şeridini tartınız mı?
Saat camının darasını aldınız mı?
Mg şeridini yaktınız mı?
Elde edilen külü saat camının üzerinde tartınız mı?
Tepkimeyi denkleştirip hesaplamaları yaptınız mı?
Sonuçları rapor ettiniz mi?
Kullanılan Malzemeler
1- Magnezyum şerit
2- Pens
3- Bunzen beki
4- Saat camı
5- Hassas terazi
DEĞERLENDİRME
Bu faaliyetteki “Hayır” cevaplarınızı yeniden gözden geçiriniz. Kendinizi yeterli
görüyorsanız diğer öğrenme faaliyetine geçiniz.
39
MODÜL DEĞERLENDİRME
MODÜL DEĞERLENDİRME
1.
I. Özkütleler (yoğunluklar)
II. Erime noktaları
III. Kimyasal özellikler
Demir ile kükürt elementleri birleşerek demir sülfür bileşiği oluştururken
yukarıdakilerden hangisi ya da hangileri değişir?
A) Yalnız I
B) Yalnız I ile II
C) Yalnız III
D) I, II ve III
2.
Oda koşullarında tüm elementler için aşağıdakilerden hangisi doğrudur?
A) Katı ya da sıvı halde bulunurlar.
B) Elektrik akımını iletirler
C) Atomlardan oluşurlar
D) Moleküllerden oluşurlar.
3.
Aşağıdakilerden hangisi bileşiklerle elementlerin ortak özelliği değildir?
A) Belirli erime noktalarının olması
B)Farklı maddelere ayrılabilmeleri
C) Belirli özkütlelerinin olması
D) Kendilerine özgü çözünürlüklerinin olması
4.
2,8 g X elementi, oksijenle birleşerek 9,2 g X2O4 bileşiği oluşturuyor.Buna göre X’in
atom kütlesi kaçtır? (O: 16 g/mol)
A) 12
B) 23
C) 14
D) 28
5.
16 g hidrojen ile 16 g oksijen tepkimeye sokuluyor. Hangi maddeden kaç gram artar?
(H:1, O:16 g/mol)
A) 14 g H2
B) 8 g O2
C) 2 g H2
D) 12 g O2
6.
Bir kimyasal tepkimede kütle değişmez,
A) Doğru B) Yanlış
40
7.
Tepkime sırasında atomların sayısı değişir.
A) Doğru B) Yanlış
8.
Aşağıda verilen denklemleri altı çizilen maddenin katsayısı 1 olacak şekilde
denkleştiriniz
A) C3H8 + O2 → CO2 + H2O
B) Al + H2SO4 → Al2(SO4)3 + H2
C) MnO2 + HCl → MnCl2 + Cl2 + H2O
D) Mg3N2 + H2O → NH3 + Mg(OH)2
41
CEVAP ANAHTARLARI
CEVAP ANAHTARLARI
ÖĞRENME FAALİYETİ 1 CEVAP ANAHTARI
1
2
3
4
5
6
7
8
9
10
11
B
B
B
A
D
Kimyasal
Fiziksel
Molekül
Bileşikler
Atom
Bileşik
ÖĞRENME FAALİYETİ 2 CEVAP ANAHTARI
1
2
3
4
5
6
B
C
C
D
B
B
a- Mg3N2 + 6H2O →3Mg(OH)2 +2NH3
7
b- 3CaO + 2H3PO4 → Ca3(PO4)2 + 3H2O
c- C2H5OH +3O2 → 2CO2 + 3H2O
8
9
10
B
A
D
42
MODÜL DEĞERLENDİRME CEVAP ANAHTARI
1
2
3
4
5
6
7
D
C
B
C
A
A
B
a-C3H8 + 5O2 → 3CO2
+ 4H2O
b-2Al + 3H2SO4 → Al2(SO4)3 + 3H2
8.
c-MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
d-Mg3N2 + 6H2O → 2NH3 + 3Mg(OH)2
M
43
KAYNAKÇA
KAYNAKÇA
Ø
ÇELİK Necdet, Ali Rıza ERDEM, Varol GÜRLER, Hasan KARABÜRK,
Ayhan NAZLI, Uğur Hulisi PATLI, Kimya I Sürat Yayınları.
Ø
Demir Mustafa, Anorganik Kimya–1, MEB Yayınları
Ø
KIZILDAĞ Güler, M.Faruk DURSUN, Lise 2 Kimya, MEB, 2001.
Ø
YILMAZ Fahrettin, Serhat yayınları, Lise 2 Kimya.
Ø
ARIK Ahmet, Rahim Polat, Nasuh Ülker, Kimya 1, Oran Yayıncılık İzmir
2002.
Ø
KARACA Faruk, Lise 2, Paşa Yayıncılık Ankara, 2003.
Ø
www.kimyaokulu.com
Ø
www.theoderegray.com
44