Hasan Kılıç*
Fen Bilimleri, Ortaokullarda Fen Bilgisi dersi, Liselerde ise Fizik, Kimya, Biyoloji
ve Sağlık Bilgisi isimleri ile okutulmaktadır.
Bunlarda lise ve dengi okullarda okutulan
kimya dersi kendi içinde beş anabilim dalına
ayrılır. Bunlar; Fizikokimya, Analitik kimya,
Anorganik kimya, Organik kimya ve Biyokimya’dır.
Bu çalışmanın konusunu oluşturan Fizikokimya veya bir diğer adı ile fiziksel kimya
adından da anlaşıldığı gibi fiziksel yöntemlerin kimyaya uygulanması sonucunda ortaya
çıkmıştır.
Fizikokimya Nedir
Fizikokimya; organik veya inorganik
(organik olmayan) karakterli kimyasal sistemlerin özelliklerini ve davranışlarını fiziksel yöntem ve teorilerle irdeleyerek kimyasal
kanun ve yöntemlerin geliştirildiği önemli bir
kimya anabilim dalıdır. Fizikokimya, maddeler arasındaki kimyasal reaksiyonlar sonucunda ortaya çıkan fiziksel olayları, davranışları
fiziksel yöntemlerle inceleyerek, bu olaylar
veya davranışlarla ilgili olarak konulmuş ilahi
kanunları bulup ortaya çıkaran bir madde bilimidir. Elde ettiği bu fizikokimyasal kanunlara dayanarak aynı türden diğer maddelerin,
örn., yeni sentezlenmiş bileşiklerin davranışlarının açıklanmasını, yorumlanmasını yapar
[1,2]. Mikhail Lomonosov 1752 yılında fizikokimya terimini icat etmiştir ve verdiği konferansta fizikokimya’yı, “fizikokimya, fiziksel
deney koşulları altında yürüyen bir reaksiyon
ortamında meydana gelen olayların sebebini
açıklayan bir bilimdir” şeklinde tarif etmiştir
[3].
Bir fizikokimyacı yaptığı bir deneysel
çalışmada sistemin ölçülebilen bir fiziksel
büyüklüğündeki değişimi izler. Bu gözlemden elde ettiği bulgu ya da bulgular ile ilgili
maddenin yapısı arasında akıl yürüterek ilişki
kurar ve söz konusu maddenin karakterizasyonunu yapar, davranış özelliklerini belirler.
Bir fizikokimyasal çalışma aşağıda verilen basit bir örnekle daha iyi şöyle izah edilebilir:
Hepimiz biliriz kışın yollar buz tutmasın diye
yollara tuz serpilir. Peki tuz serpince ne olur
da yol buz tutmaz? İşte bu sorunun cevabını
fizikokimya bu konuda daha önceden yaptığı
deneysel çalışmalardan elde ettiği sonuçlardan bilmektedir. Bu konuda fizikokimyanın
ileri sürdüğü kanun veya diğer bir deyişle,
fizikokimyanın varlığını bulduğu ilahi kanun
der ki; “safsızlıklar donma noktasında daima
bir düşmeye ve kaynama noktasında da bir
yükselmeye sebep olurlar”. Görüldüğü gibi
bu kanuna göre yola tuz serpilince yol, suyun
donma noktası olan 0 0C de donmayacak, 0
0
C nin altındaki, örn., -2 0C veya -3 0C gibi
daha düşük bir sıcaklıkta donacaktır. Bu da
yolda kayma ya da buzlanma tehlikesini bir
miktar geciktirecek ve sonuç olarak yol daha
güvenli olacaktır. Şimdi yukarıdaki “tuz serpince ne olurda yol buz tutmaz, burada nasıl
bir mekanizma işler de yol buz tutmaz?” sorusuna fizikokimyanın basit açıklaması şöyledir: Saf su molekülleri normalde 0 0C de
(*) Doç.Dr., Marmara Üniversitesi, Fen Edebiyat Fakültesi, Kimya Bölümü, Fizikokimya Anabilim Dalı Öğretim Üyesi, hkilic@marmara.
edu.tr
1
YENİ TÜRKİYE 88/2016
21. yy.’da Nanoteknoloji
Uygulamalarında
Fizikokimya’nın Yeri
YENİ TÜRKİYE 88/2016
2
donar. Saf su demek; aralarında sudan başka
yabancı hiçbir molekül veya madde olmayan
su demektir, hepsi birbirinin aynısıdır. O halde hepsi aynı fiziksel özelliklere, buradaki
hali ile aynı bir donma noktasına sahiptirler.
Fakat ortama tuz serpilince, tuz suyun içinde çözünür ve çözünmüş tuz molekülleri yar
yar su moleküllerinin arasına sızar ve böylece
birbirine tutunmuş su moleküllerinin birbiri
ile temasını keser. Su molekülleri arasındaki
temas bu şekilde kesilince suyun donması artık gecikir, çünkü bir su molekülü donmasını
yanındakine iletemez olur. İşte bu gecikmelerin toplamı da bize suyun donma noktasında fark edilebilir bir düşme olarak yansır.
Tuz serpince donma noktası düşmesi ile ilgili
fizikokimyanın daha kapsamlı açıklaması
ise; “suyun mol kesrindeki azalma sebebi ile
donma noktası düşer” şeklinde olup, burada
bununla ilgili detayları vermeye gerek görülmemiştir. Burada yeri geldiği için bu konu ile
ilgili olmuş bir olayı nakletmek te yararlı olacaktır. İkinci dünya savaşı sırasında Hitlerin
orduları bir kış mevsiminde Moskova kapılarına dayanmıştır. Ancak hesap etmedikleri bir
olay olmuş, tankların yakıt depoları donmuş,
dolayısı ile açık hedef haline gelmişlerdir. Hitler, “bana bilim adamlarını toplayın” şeklinde
bir emir vermiş ve tüm bilim adamlarını bir
çadırda toplamıştır. Hitler bilim adamlarına
“24 saat içinde donmayan motor bulunacak
aksi halde hepinizin başını keserim” demiştir. Gerçekten 24 saat içinde zırhlı araçların
motorlarının donma sorunu yakıta antifiriz konulması ile çözülmüştür [4]. Antifiriz
maddesi, etilen glikol olup yakıta katıldığında yakıtın saflığı bozulmaktadır. Yukarıda da
belirtildiği gibi saflığın bozulması da yakıtın
donma noktasında bir düşmeye sebep olmuştur. Böylece etilen glikol ilk kez araçlarda kullanılmıştır. Daha önceki dönemde ise etilen
glikol, dinamitin donma noktasını düşürdüğü
ve böylece de dinamitin daha güvenli saklanmasına amacı için kullanılmakta idi.
Çoğumuz mutlaka duymuşuzdur veya
okumuşuzdur günümüzde çok sık bir şekil-
de hidrojen enerjisinden bahsedilir. Fakat bir
türlü hidrojen enerjisine geçilememektedir.
Nedir bu enerji, nasıl bir enerjidir ve neden
hidrojen enerjisine geçilemiyor da insanlık
bunu kullanamıyor? Bu soruları fizikokimya
penceresinden cevaplamadan önce aşağıdaki
bilgilerin verilmesi gerekmektedir. 2 Hidrojen atomu (veya 1 Hidrojen molekülü) + 1
Oksijen atomu, birbiri ile reaksiyona girdiğinde aralarında aşağıda verilen reaksiyona
göre
H2(gaz) + ½ O2(gaz) → H2O(buhar) + 69000 kalori
veya tam olarak fizikokimyasal kurala göre
yazılırsa,
H2(gaz) + ½ O2(gaz) → H2O(buhar) ΔH= - 69000 kalori
çok istekle, diğer bir ifade ile şiddetle
vuku bulan bir reaksiyon gerçekleşir ve ürün
olarak su meydana gelir. Verilen reaksiyondan
da görüldüğü gibi büyük bir enerji açığa çıkmıştır. ΔH = - olması demek bu reaksiyonun
ekzotermik olduğunu, dolayısı ile dışarıya
69000 kalorilik enerji verildiğini göstermektedir. Dikkat edilirse 18 gram su oluşmasına
karşılık büyük bir enerji açığa çıkmaktadır.
Bu sebeple hidrojen ile oksijen arasındaki reaksiyon patlama ile meydana gelir. Bu reaksiyon bir yanma reaksiyonudur. Hidrojen son
derece yanıcı bir gaz ve bilindiği gibi oksijen
de son derece yanmayı şiddetlendiren bir
gazdır. Bu nedenledir ki bir yangın yerinde ilk
müdahale ateşin hava ile temasını kesmektir.
Bu iki maddenin şiddetli reaksiyonundan
açığa çıkan suya bakınız ki reaksiyona girenlerden tamamen farklı bir kimyasal özelliğe
sahiptir. Su da, ne yanmadan ve ne de yakmadan eser kalmamıştır, tam tersine bir söndürücü ortaya çıkmıştır. Bu da yaratanın ilahi
gücünü göstermesi açısından çok önemli bir
reaksiyondur. İnsanlık tarih boyunca hiçbir
zaman denizdeki suyun yandığını görmemiştir ve sonsuza dek de görmeyecektir. Burada
şu hatırlatmanın yapılmasında fayda vardır:
Deniz tabanından yanıcı bir başka gaz, örneğin doğal gaz su yüzeyine çıkar ve bu gaz
ateşlenirse yanar. Bu yanma farklı bir yanma
Hidrojen % 100 verimle yanabilen ve
yanma ürünü de su olan, dolayısı ile çevreye
olumsuz bir etkisi olmayan çevre dostu bir
yakıttır. Mümkün olsa arabalarda petrol yerine hidrojen gazı kullanılsa egzozdan dışarı su
buharı atılacaktır. Buna benzer olarak; uzay
mekiklerinin fırlatılışı esnasında mekik tam
kalkarken ortam birden toz duman olur, bulut gibi bir ortam oluşur. İşte bu ortam su buharıdır, çünkü mekik tam kalkarken hidrojen
– oksijen arasındaki reaksiyon başlatılmış ve
oluşan su, buhar halinde ortaya çıkmıştır. Bu
sırada muazzam bir enerji açığa çıkmış ve bu
enerji mekiği rampadan kaldırabilmiştir. Oluşan bu suyun tekrar hidrojen ve oksijene dönüşebilmesi için o açığa çıkan enerjinin suya
aynen geri verilmesi gereklidir. Bu örnekten
suyun hidrojen ve oksijene parçalanması için
ne kadar büyük bir enerjinin verilmesi gerektiği daha açık bir şekilde görülmektedir.
Dünyamızın ¾ ünün su olduğu düşünüldüğünde ve egzozdan da çevreye hiçbir zararı olmayan su atıldığı göz önüne alındığında
gerçekten okyanusların, denizlerin, derelerin,
göllerin muazzam birer enerji kaynağı olduğu
görülebilir. Günümüzde suyun elektrolizini
ekonomik ölçekte gerçekleştirebilmek için
bilim insanları yoğun bir şekilde çalışmakta,
değişik katalizör malzemeleri geliştirmekte
ve bunlarla denemeler yapmaktadırlar. Fakat
maalesef bu konuda henüz önemli bir ilerleme olduğu söylenemez. Bilim insanlarının
yıllardır bu alanda yaptıkları bunca çalışmaya
rağmen suyun elektrolizinde önemli derecede ekonomik bir şekilde elektroliz yapacak
elektrotların bulunamamasına bir de ters
taraftan bakılırsa sanırım burada ilahi bir
sır olduğu görülebilir. Farz edelim ki suyun
elektrolizi de diğer pek çok kimyasal maddeler gibi ekonomik bir şekilde gerçekleşebilir
olsaydı yeryüzünde yaşam ne olurdu acaba?
Eğer okyanustaki, denizdeki, deredeki, göldeki ve akarsulardaki su kolayca hidrojen ve
oksijenine parçalanabilir olsaydı o zaman yeryüzünde patlamalardan dolayı yaşanamazdı.
Bundan da kötüsü, bazı devletler okyanusları, deniz, dere, göl ve akarsuları sahiplenir ve
böylece yeryüzünde kargaşa hakim olurdu.
Hatta bu kavgalar köylere kadar inebilirdi. O
halde suyun elektrolizinin ekonomik olmamasının sebebi bir tesadüf değil tam aksine
ilahi bir sır olmalıdır. Yüce yaratan suda tam
bu noktaya öyle bir kilit vurmuştur ki sanırım
insanlık sonsuza kadar da bu kilidi çözemeyecektir. Bu sonuç da göstermektedir ki, fizikokimya ve diğer tüm bilim kolları yukarıda
en başta da belirtildiği gibi sadece yaratıcının
koyduğu kanunları ve bu kanunlarla ilgili matematiksel ifadeleri bulurlar, ortaya çıkarırlar,
kendileri kanun koyamazlar.
Bilindiği gibi içinde bulunduğumuz
dünyamızda maddeler katı, sıvı ve gaz olmak
üzere en fazla üç faz halinde bulunabilirler.
İyi ki bu şekilde bulunurlar. Aksi takdirde
3
YENİ TÜRKİYE 88/2016
olup, burada anlatılan hidrojenin yanması ile
bir ilgisi yoktur. Deniz, dere, göl veya herhangi bir akarsuyun yandığının görülmemesi;
hidrojenin tam bir şekilde yandığını, geride
hiç hidrojen kalmadığını, hidrojenin % 100
verimle yanarak suya dönüştüğünü gösterir. Fizikokimyanın bir alt dalı olan kimyasal
termodinamik suyun oluşum reaksiyonunu
ve mevcut suyun da tekrar oluşturanlarına
(H2 ve O2) parçalanması reaksiyonunu incelemiştir. Kimyasal termodinamiğin vardığı
sonuç çok sade bir şekilde şöyledir: Suyun
oluşumunda hidrojen ve oksijenin birbiri ile
reaksiyona girme istekleri ne kadar yüksekse,
ters reaksiyonun yani elimizdeki mevcut suyun hidrojen ve oksijenine parçalanması reaksiyonu da aynı nispette zordur. O halde 18
gram suyu hidrojen ve oksijenine parçalamak
için 69000 kalori verilmesi gerekiyor. Görüldüğü gibi ters reaksiyon ekonomik değildir.
İşte bu nedenledir ki yukarıda verilen reaksiyonda tek yönlü bir ok, ileri yönde bir ok
kullanılmıştır. Reaksiyon kendiliğinden geri
dönmemektedir. Neden hidrojen enerjisini
kullanamıyoruz sorusunun cevabı artık belli
olmuştur. Şöyle ki; suyun oluşturanlarına parçalanması ekonomik değildir.
maddenin örn., suyun buhar fazı olmasaydı
yükseklere su nasıl çıkarılabilirdi. Suyun buhar fazı sayesinde Himalaya’ların tepesine su
doğal olarak bulutlar vasıtası ile çıkabilmektedir.
YENİ TÜRKİYE 88/2016
4
Madde moleküllerinin en serbest bir
şekilde hareket ettiği faz gaz fazıdır. Gaz fazında moleküller arası ilişkiler, etkileşimler
minimum bir seviyededir. Bu yüzden fizikokimya, fizikokimya yasalarını hazırlarken
önce gaz fazında incelemelerini yapar, teorilerini veya denklemlerini buradaki gözlemlerine göre oluşturur, sonra buradan elde ettiği
bilgiler ışığında sıvı ve katı fazlarla ilgili olayları değerlendirmeye, yorumlamaya çalışır.
Gazdan sıvı ve katıya geçtikçe madde molekülleri arasındaki etkileşimler artacağından
söz konusu maddenin birçok fiziksel özelliğinde önemli değişikler olur. Bu değişiklere
dayanarak söz konusu maddenin daha yakından tanınması sağlanır, karakterizasyonu
yapılır. Fizikokimyacı gerektiğinde bu incelemelerinde yeni yöntemler geliştirir. O halde
fizikokimyanın amacı, maddenin ölçülebilen
tüm özelliklerini ölçebilmek için fiziksel teori
ve yöntemlerden faydalanarak yeni teori ve
yöntemler geliştirmek, yeni deneylerin prosedürlerini hazırlamak, yeni cihaz gerekiyorsa
bunu tasarlamaktır denilebilir.
Kimyanın önemli bir ana bilim dalı
olan modern fizikokimya 1860 ile 1880 yılları
arasındaki kimyasal termodinamik, elektrolit
çözeltileri, kimyasal kinetik ve diğer bazı konularla ortaya çıkmıştır. Fakat zaman içinde
gelişerek pek çok önemli alt dalları ortaya
çıkmıştır. Kimyasal denge konusunda uzun
zamandan beri yapılan çalışmalar bu alt dalın en doğru biçimde ancak termodinamik
ile açıklanabileceğini göstermiştir. Bu yüzden
kimyasal denge ile ilgili ilk termodinamik çalışma birbirinden bağımsız olmak üzere Amerikalı matematiksel fizikçi Josiah Williard
Gibbs (1839-1903) ve Hollandalı kimyacı
Jacobus Henricus van’t Hoff (1852-1911) tarafından 1874-1878 yılları arasında yapılmıştır [5]. Bu gelişmeler sonrasında önemli bir
kilometre taşı Josiah Willard Gibbs’in 1876
yılında yayınlanan “Heterojen Maddelerin
Dengesi Üzerine” isimli makalesi olmuştur.
Bu makale Gibbs enerjisi, kimyasal potansiyel ve Gibbs’in fazlar kuralı gibi fizikokimyanın birtakım köşe taşlarını ortaya çıkarmıştır
[6]. İlk bilimsel fizikokimya dergisi bir Alman
dergi olup Zeitschrift für Physikalische Chemie ismi ile 1887 yılında Wilhelm Ostwald,
Jacobus Henricus van’t Hoff ve Svante
August Arrhenius tarafından kurulmuştur.
Rus-Alman fizikokimyacı Friedrich Wilhelm
Ostwald (1853-1932) zayıf elektrolitlerin
molar iletkenliği ile ilgili Arrhenius kuramını nicel olarak 1888 yılında açıklamıştır. Bu
bilim adamları 19. yüzyılın sonları ve 20. yüzyılın başlarında fizikokimyanın önderleri idi.
Bu üç bilim adamı 1901-1909 yılları arasında
Nobel kimya ödülü ile ödüllendirilmişlerdir.
Devam eden dönemde istatistiksel mekaniğin kimyasal sistemlere, kolloidlere ve yüzey kimyasına uygulamasında gelişmeler olmuştur. Bu gelişmelerde Irving Langmuir’in
önemli katkıları olmuştur. Diğer önemli bir
basamak 1930 lardan itibaren kuantum mekaniğinin kuantum kimyası içinde gelişmesi
idi. Burada Linus Pauling önemli liderlerden
biridir. Teorik gelişmeler, infrared spektroskopi ve mikrodalga spektroskopi gibi farklı
formlarda spektroskopik yöntemler kullanarak deneysel gelişmelerle baş başa ilerledi.
Elektron spin rezonans spektroskopi (ESR)
ve nükleer magnetik rezonans spektroskopi
(NMR) muhtemelen 20. yüzyılın en önemli
gelişmesidir. Fizikokimya da diğer iki önemli
keşifte radyoaktivitenin ve ağır atomların sahip olduğu enerjinin keşfedilmeleridir. Özellikle 2. Dünya savaşından önce ve 2. Dünya
savaşı sırasındaki isotop ayırmadaki gelişmeler bu alanın çok kısa zamanda büyük ilerleme kazanmasına yol açmıştır [7].
Doğada maddeler ile ilgili olarak gözlenen olaylar ilk zamanlarda filozoflar tarafından yorumlanmaktaydı. Kimya ilmini bu filozoflardan ilk kurtaran ve kimyasal elementin
modern anlamını ilme sokan İngiliz bilim
Fizikokimya anabilim dalının da zamanla daha da gelişmesi sebebi ile bu anabilim dalı da pek çok alt dallara ayrılmıştır.
Bu alt dallardan bazıları aşağıda sekiz sınıf
içinde verilmiştir. Bu alt dallar aynı zamanda
tüm dünyada kimya mühendisliğinin de doğmasına sebep olmuştur [1,5].
1) Gazlar, Sıvılar, Gerçek çözeltiler,
Heterojen sistemlerde kimyasal denge (J.
Williard Gibbs’in fazlar kuralı, 1875-1876),
Katılar (kristalografi, katıların yapısının aydınlatılması, X ışını yöntemleri), Yüzey kimyası ve kolloidal çözeltiler, Adsorpsiyon - desorpsiyon, Elektrokimya (elektrolit çözeltiler,
elektrokimyasal sistemlerin termodinamiği,
korozyon).
2) Homojen sistemlerde kimyasal denge, Kimyasal kinetik (kimyasal reaksiyonların
hızları, hız kanunları ve mekanizmaları), Kataliz, Fotokataliz, Fotokimya.
3) Kimyasal termodinamik (çözeltilerin termodinamiği, serbest entalpi fonksiyonu = Gibbs serbest enerjisi, kimyasal potansiyel), Termokimya (kalorimetri).
4) Kuantum kimyası (Klasik mekanik
ve Kuantum mekaniği arasındaki farklar, Kuantum mekaniğinin prensipleri, de Broglie ve
Schrödinger denklemleri, Kuantum teorisinin postulaları (doğru kabul edilen varsayımları), Atomların elektronik halleri, Schrödinger denkleminin Hidrojen atomuna ve diğer
atomlara uygulanması, Çok atomlu moleküllerin elektronik yapıları, Atom ve moleküllerin ötelenme, dönme ve titreşim hareketleri)
[2,5,8].
5) Çekirdek kimyası (nükleer kimya)
[8,9]).
6) Polimer kimyası, Polimer oluşumunun reaksiyon kinetikleri
7) Optik spektroskopi, fotokimya ve
yüzey kimyası, Katı, sıvı ve polimerlerin yapısını inceleme metotları, magnetik alan ve
magnetik dipoller, elektronik ve magnetik
dipoller, elektron spin rezonans spektroskopisi (ESR); manyetik alanda elektron spinini (dönmesini) inceler. Buna göre bir moleküldeki paramagnetik türleri, yani magnetik
alandan etkilenen serbest radikal gibi türleri belirlemede kullanılır. nükleer magnetik
rezonans spektroskopisi (NMR); manyetik
alanda atomun çekirdeğinin spinini (dönmesini) inceler. Maddenin gaz ve sıvı halinde
kullanılabilir. Çalışılan moleküldeki H veya
karbon, C çekirdekleri bu yöntem ile sayılabilir. Fourier transform infrared spektroskopisi (FTIR); molekülün titreşim hareketlerine
bağlı olarak spektrumlar alır. Ultraviole-görünür bölge spektroskopisi (UV-Vis), mikrodalga spektroskopisi; molekülün dönmesi ile
ilgili durumu inceler. Mikrodalga spektroskopisinden yararlanarak bir molekülün atomları arasındaki uzaklık hesaplanabilir. Raman
spektroskopisi (RS); bu yöntem FTIR spektrumları gibi molekül yapısı hakkında önemli
bilgiler verir. Elektron spektroskopisi (ES);
yüzey çalışmalarında kullanılır. Kütle spektrografisi yöntemi; Bu yöntemle atom tartıları çok duyarlı bir şekilde tayin edilebilir, bu
yüzden bir elementin izotoplarının kütlesi bu
yöntemle yüksek doğrulukla ölçebilir. Nötron aktivasyon analizi; çekirdek özelliklerine
dayanan bir yöntemdir. Örnek madde nötron bombardımanına tabi tutulur ve böylece
radyoizotopu hazırlanır. Her radyoizotopun
kendine has bir yarılanma süresi olduğunda
ortamda kaç tür madde bulunduğu tayin edilebilir. Taramalı elektron mikroskobu (SEM);
5
YENİ TÜRKİYE 88/2016
adamı Robert Boyle (1626-1691) olmuştur.
R. Boyle ilk kimyacıdır. Zaman ilerledikçe
bu alanda da ilerlemeler olmuş, 17. yy dan
20. yy lın başına kadar maddelerin birbirleri
ile ilişkileri konusunda bilgilerimizde önemli
gelişmeler olmuştur. Bu ilerlemeler sırasında
yapılan gözlemlerin, yorumların, sonuçların
değerlendirilmesine matematiğin de girmesi
ile kimya, fizik ve biyoloji gibi temel bilimler ortaya çıkmıştır. Kimya biliminin ilerleyen
yıllarda hızla gelişmesi sebebi ile fizikokimya,
analitik kimya, inorganik kimya (organik olmayan kimya), organik kimya ve biyokimya
beş anabilim dalına ayrılmıştır [5].
katı yüzeyi taramalarında kullanılır. Atomik
kuvvet mikroskobu (AFM); hem iletken ve
hem de yalıtkan yüzeylerdeki atomların tek
tek ayrılmasını sağlarlar.
8) Maddenin makroskopik ve moleküler teorilerinin uzlaşması: Moleküler haller
için olasılık dağılımı, İstatistik termodinamik.
Bu alt dalların içerikleri konusunda
aşağıda kısa kısa bilgiler verilmiştir.
Kristalografi; katı maddeler içinde
atomların nasıl dizildikleri, bağ yapıları, atomların kristal örgüsü ve bu özelliklerin katının
fiziksel ve kimyasal özellikleri üzerine etkilerini inceler. Kristalografi, X ışınlarının keşfinden sonra gelişmeye başlamıştır. İngiliz fizikçiler Sir William Henry Bragg (1862-1942) ve
oğlu Sir Lawrance Bragg (1890-1978) X ışınlarını kristal yapı analizinde kullanarak katıların incelenmesinde bir devrim yapmıştır.
YENİ TÜRKİYE 88/2016
6
Yüzey kimyası ve kolloidal çözeltiler;
iki faz arasındaki düzleme yüzey veya arayüz
denir. Sıvı-gaz, sıvı-sıvı v.b. gibi tüm ikili arayüzlerdeki fiziksel ve kimyasal olaylar normal
çözelti içindeki durumlarına göre farklılıklar
gösterir. Bu nedenle buna benzer bazı özel
koşullardaki atom, molekül veya iyonlara kolloidal tanecikler denir. Bu taneciklerin içinde
dağıldıkları faz ile oluşturdukları arayüzde
kolloitlerin özellikleri değişir. Bu yüzden yüzey kimyası ve kolloitler çoğu zaman birlikte
incelenirler.
Adsorpsiyon – desorpsiyon; atom iyon
ya da moleküllerin bir katı yüzeyinde tutunmasına adsorpsiyon ve tutunan taneciğin yüzeyden tekrar geri ayrılmasına da desorpsiyon
denir. Endüstride, tıpta ve diğer kimya tabanlı pek çok alanda önemli uygulamaları vardır.
Bir ortamda iki ayrı tür madde olduğunu düşünelim ve bu söz konusu ortam çözeltisinin
miktarı da bir kimyasal işlem yapılamayacak
kadar az olsun. Böyle bir durumda uygun bir
adsorban (adsorplayıcı) kullanarak ortamdan
uzaklaştırılması istenilen madde ortamdan
çıkartılabilir. Böylece bir çeşit saflaştırma yapılmış olur.
Elektrokimya; Bir şekilde bir madenden veya yapılmış bir çalışmadan elimizde
Au+Cu (altın+bakır) karışımı bir malzeme
olsun. Bu malzeme içindeki altını, bakıra
dokunmadan saf bir şekilde almak istiyoruz.
Bunu başarabilmek için seçilecek en iyi yöntem bir elektroliz işlemi olup, elektrokimyanın alanına girer. Söz konusu malzemenin uygun bir elektroliz çözeltisi hazırlanır ve uygun
bir şekilde elektroliz devresi kurulduğunda
altın, bakıra dokunmadan çalışılan elektrot
üzerinde çöktürülerek ortamdan uzaklaştırılır. Başka bir ifade bakırdan ayrılabilir. Her
elementin kendine has elektrokimyasal bir
çökme potansiyeli vardır. Bu yüzden altın ve
bakırın çöktürme potansiyelleri birbirinden
farklıdır. Elektroliz işlemi altının çöktürülme
potansiyelinde gerçekleştirildiğinde altın çökerken bakır olaya karışmaz ve altın % 100 e
varan yüksek bir saflıkta elde edilebilir. Söz
konusu altın – bakır çözeltisindeki altını alternatif olarak analitik kimya yöntemi ile de
ayırmak mümkündür. Fakat bu yöntemde
ortama uygun üçüncü bir çöktürücü madde
(reaktif) ilave edilmelidir. Örn., bu reaktif altını çöktürür fakat mutlaka bakırdan da çöktürür. Dolayısı ile elektrokimyasal yöntemdeki gibi yüksek saflıkta altın elde edilemez.
Kimyasal denge; ileri ve geri yöndeki
reaksiyonların hız sabitlerinin eşit olduğu
durumda kimyasal denge kurulur. Denge
halindeki ileri hız sabitinin, geri hız sabitine
oranından ilgili reaksiyonun kimyasal denge
sabiti bulunur. Bu sabit sayesinde söz konusu
madde ile ilgili olarak önemli başka detaylara
ulaşılabilir.
Kimyasal kinetik; bir reaksiyonun dengeye gelmeden önceki koşullarını inceler.
Reaksiyon başladıktan itibaren denge konumuna ulaşıncaya kadar geçen süre içinde
reaksiyonun hangi hızla ilerlediğini inceler.
Yaptığı hesaplamalarla reaksiyonun istemli
mi, istemsiz mi olduğunu, ne kadar sürede
Kataliz, bir kimyasal reaksiyonun hızlandırılması işlemine kataliz, bu iş için kullanılan maddelere de katalizör denir. Bir
kimyasal reaksiyonun hızı bir ışık etkisi ile
hızlandırılıyorsa buna da fotokataliz denir.
Günümüzde ne yapılırsa yapılsın üreticinin
ilk gözden geçirdiği konu olayın maliyetidir.
Yüksek maliyetli ürünlerin pazar şansı daha
azdır. Bu yüzden pek çok işkolu üretimleri
esnasında katalizör kullanarak çalıştıkları reaksiyonun daha çabuk, daha verimli olması
yoluna giderler. Bu da başta elektrik ve malzeme sarfiyatında önemli tasarruflara sebep
olur. Örn. sıvı yağların katılaştırılmasında
platin elementi (Pt) çok iyi bir katalizördür.
Pt, hidrojen gazını (H2), anında H, H şeklinde hidrojen atomlarına ayırır ve bu hidrojen
atomları sıvı yağ içinde bağlanacakları yerlere
anında bağlanarak reaksiyonu çok kısa sürede bitirirler, böylece elektrik enerjisi tasarrufu sağlarlar. Bu nedenle katalizörler, sanayicilerin en çok ilgilendiği konular arasındadır.
Fotokimya; ışığın neden olduğu kimyasal reaksiyonlara fotokimya, ışık kimyası
denir. Büyük bir bahçede örn. elma yetiştirdiğimizi düşünelim. Bahçede dikili elma
ağaçlarının hepsi aynı cinsten olsa bile toplanan elmaların her birinin tat ve aromaları nın
farklı olduğu görülür. Güneş ışığını uygun bir
şekilde alan elmalar daha tatlı olacaktır, çünkü bu tür elmalar içinde vuku bulan fotokimyasal reaksiyonlar tam olarak gerçekleşmiştir.
Burada yeri gelmişken fotokimya ile
ilgili bir anımı anlatmak istiyorum. Bir deneysel çalışmam sırasında laboratuvarda bir kumarin bileşiğinin asitlik sabitlerinin tayini ile
ilgili bir çalışma yapıyordum. Bu amaçla her
10 dakikada bir bu bileşiğin absorbansı aletle tarafımdan ölçülüyordu. Dört saatlik bir
çalışmaya rağmen alet içinde bekleyen maddede herhangi bir değişiklik olmayınca toparlanmaya karar vermişken, masanın üzerinde
güneş ışığı altında bekleyen stok çözeltiden
son bir kere daha alıp son bir çalışma yapmak geldi içimden. Hemen böyle yaptım ve
bu defa spektrumda çok önemli bir değişiklik
görülmüştür. Hastanede çekilen röntgen filmi
de bir çeşit spektrumdur. Bu yüzden burada
bahsedilen spektrumda bu şekilde düşünülebilir. Değişiklik gözlenince çalışmalar devam
edilmiş ve tekrar bir dört saat sonunda değişimin sonlandığı bulunmuştur. Yapılan değerlendirmeden, çalışılan maddenin kimyasal
yapısının güneş ışığı etkisi ile bir yerinden
açıldığını ve iki tane bu şekilde açılmış molekülün birbirine bu açılmış yerden bağlanarak
iki moleküllü bir yapı oluşturduğu, kimya tabirine göre dimerleştiği bulunmuştur. Bu tür
dimerleşmelerin özellikle tıpta adrese teslim
ilaç uygulamalarında önemli uygulamaları vardır. Bu çalışmada varılan sonuca göre
söz konusu maddenin özellikle cilt kanseri
tedavisinde faydalı olacağı bulunmuştur. Patent başvurusu tarafımdan yapılmıştır. Ayrıca
asit, baz özellikleri ve güneş ışığı etkisi ile dimerleşmesi iki ayrı makale olarak basılmıştır
[10,11]. Adrese teslim ilaç uygulaması kısaca
şöyledir: Bu madde ile kapsül hazırlanır ve
gerçek kanser ilacı bu kapsül içine yerleştirilerek bir çeşit hap hazırlanır. Doktor hastaya
örn., “ilacı gece saat 12:00 de iç, yârin sabah
8:00 de burada ol” der. Bunun anlamı şudur;
hasta ilacı içtikten 8 saat sonra ilaç kanserli bölgenin kapısına gelmiş ve kapsül içinde
beklemektedir. Saat 8 de hasta ışın tedavisine alınır, öyle ki üzerinde hastalıklı bölgeye
x ışınları v.b. yüksek enerjili ışın gönderilir.
Bu ışının gücü ile kapsül açılır ve ilaç adrese
teslim edilmiş olur. Bu verilen ışın tedavisi ile
sağlıklı hücrelerde zarar görebilir. Bu yüzden
kemoterapi alan hastalarda saç dökülmesi
v.b. yan etkiler ortaya çıkmaktadır.
Termodinamik; fiziksel ve kimyasal
olaylardaki denge koşullarını inceler. Kimyasal tepkimenin yönünün ve denge konumu-
7
YENİ TÜRKİYE 88/2016
bu reaksiyonun bitebileceği gibi konularda
önemli bilgiler sağlar. Örn., gıda kimyasında
gıdanın raf ömrünün hesaplanmasında, bir
ilacın etki süresinin ne zaman biteceği veya
vücuttan atılacağı v.b. gibi çalışmalar bu alt
dal içinde gerçekleştirilir.
nun belirlenmesinde kullanılır. Bir tepkimenin nereye doğru gittiğinin belirlenmesinde
kullanılır. Termokimya, ısı alışverişinden ve
bunların ölçülmesinden, kalorimetrik ölçümlerden bahseder.
8
Kuantum kimyası; atomun yapısının
aydınlatılması çalışmaları fizikokimyanın bir
alt dalı olan Kuantum kimyası içinde ele alınmaktadır. Atomun yapısının aydınlatılması
çalışmaları sırasında kuantum kimyasının ortaya çıkması ve bunun bir sonucu olarak Schrödinger’in geliştirdiği denklemle günümüzdeki kuantum mekaniği veya diğer bir adı ile
dalga mekaniğinin ortaya çıkış sürecinde çok
ilginç gelişmeler yaşanmıştır. Bu gelişmelerin okuyucu tarafından okunmasında önemli
yararlar vardır. Kuantum mekaniği bize atomum içindeki elektronların yerini tam olarak
belirleyemeyeceğimizi söylese de, elektronun
en fazla bulunabileceği bölgeyi tanımlar. Kuantum mekaniğinin doğması, radyoaktivite
ve nükleer enerjinin ortaya çıkışı Fizikokimya
konulu bu çalışmanın sonuna doğru daha ayrıntılı olarak verilmiştir.
Hesapsal kimya; laboratuvarda gerçekleştirilmesi mümkün veya mümkün olmayan
tüm çalışmaların kuantum mekaniği ile hesaplamaları yapılarak söz konusu reaksiyonun mümkün veya değil olma durumlarının
teorik olarak incelendiği fizikokimyanın bir
alt koludur.
YENİ TÜRKİYE 88/2016
İstatistik mekanik ve istatistik termodinamik; maddelerin makroskopik ve mikroskobik özellikleri arasında bağlantılar kuran alt dallardır.
Çekirdek kimyası (nükleer kimya);
Her element atomunun bir çekirdeği vardır.
Çekirdeğin içinde + yüklü proton ve yüksüz
nötronlar bulunur. Çekirdeğin dışındaki bölgedeki elektronların alınıp verilmesi ile normal kimyasal reaksiyonlar olur. Çekirdeğin
içindekilerin karıştığı reaksiyonlara ise nükleer reaksiyonlar denir ve bunlar nükleer kimya
alanına girer. Nükleer çalışmalar her laboratuvarda yapılamaz ancak nükleer santrallar-
da yapılabilir. Bu yüzden çekirdek kimyası;
çekirdeğin içi ile ilgili bilgiler verir. Çekirdek
içinde bulunan elementel tanecikler, çekirdek içi kuvvetler, çekirdeklerin kararlılığı, çekirdek modelleri, radyoaktivite ve radyoaktif
maddelerin yaydığı ışınlar v.b. bilgiler verir
[8]. Radyoaktivite de çekirdek içinde gelişen
olayların bir sonucudur, çekirdek kimyası
içinde bir bölümdür. Bazı çekirdekler nötron
ve poton gibi parçacık ve elektromagnetik
ışıma (radyasyon) yayar. Bu olaya radyoaktivite denir. Radyasyon kimyası; radyasyonların
ilerlerken yolları boyunca meydana getirdikleri değişikleri inceler [8,9].
Polimer kimyası, farkında olmasak bile
doğal veya yapay polimer maddelerle içiçe
yaşamaktayız. Nişasta, selüloz, pamuk, yün,
doğal kauçuk birer polimer maddedir. Dogal
polimerlerin yanı sıra, basit moleküllerden
yola çıkarak sentetik büyük moleküllü polimelerlerin de sentezlenebileceğini ilk defa
1920 yılında Alman kimyacı Hermann Staudinger (1881-1965) göstermiş ve 1953 yılında Nobel Kimya ödülünü almıştır [5].
Fizikokimyasal çalışmalar makroskopik ve mikroskobik yaklaşımlarla ele alınmaktadır. Örn., hacmi, miktarı, basıncı veya
sıcaklığı ölçülebilecek kadar büyük madde
durumlarında deneysel çalışmalar makroskopik yaklaşımlarla değerlendirilir. Bu yüzden
termodinamik, elektrokimya, kimyasal kinetik ve polimer kimyası içindeki çalışmalar
makroskopik türdendir. Oysa, atom, molekül, iyon, elektron gibi çok küçük maddeler
durumunda yapılan çalışmalar mikroskobik
yöntemle ve teorik olarak incelenirler. Bu
yüzden kuantum kimyası, spektroskopi ve istatistiksel termodinamik kapsamında yapılan
çalışmalar mikroskobik türden olup teorik
çalışmalardır.
Yukarıda verilen fizikokimyanın alt
dalların her biri büyük bir alan olup özel uzmanlık gerektirir. Bu da göstermektedir ki fizikokimya kendisine has yöntem ve metotlara sahiptir. Ülkemizde pek çok fizikokimyacı
Ülkemizde olduğu gibi tüm dünyada
binlerce araştırmacı, binlerce konu üzerinde
farklı yöntemler kullanarak tıp, mühendislik,
eğitim, ziraat, veteriner v.b. gibi alanlarda
araştırmalar yaparak değişik amaçlı malzemeler üretmektedirler. Bu araştırmacıların
hepsinin ortak tarafı bilerek veya bilmeyerek
mutlaka bir fizikokimyasal yöntem kullanıyor
olmalarıdır. Bir malzemeci çalışma grubu düşünelim, bir çalışma yapacaklar fakat çalışma
yöntemi ile ilgili tecrübeleri yoktur. Bu durumda diğer ülkelerden söz konusu yöntemle
çalışabilecek bir araştırmacıyı laboratuvarlarına davet ederek çalışmalarını gerçekleştirilebilirler. Günümüzde sahasında uzman pek
çok araştırmacı kendi bilgisini arttırmak için
veya dışarıda yapılacak bir çalışmaya kendi
uzmanlık alanında katkı sağlamak için yurtdışına giderek bilimsel çalışmalara katılmaktadır. Bu şekilde bir çalışmaya katılmam için
Houston Universitesi, Kimya ve Biyokimya
Mühendisliği profesörlerinden Dr. Stanko
Brankovic’den kendi laboratuvarında (Texas,
ABD) çalışmak üzere 2013 yılında davet
edildim. Yüksek lisans tez çalışmam sırasında kullandığım Anodik Sıyırma Voltametri
(ASV) yöntemi ile bu laboratuvarda 2013 ve
2014 yazında çalışarak magnetik kaydedici
kafaların yapımında kullanılacak nanomalzemenin sentezi ve elektriğin kayıpsız bir
şekilde dönüşümünü sağlayacak fonksiyonel
nanomalzeme sentezi çalışmalarına katıldım
[18,19]. Söz konusu çalışmaların makale hazırlık çalışmaları halen devam etmektedir.
Nanoteknolojide Fizikokimyanın Yeri
Burada yeri gelmişken ve fizikokimya
ile özellikle elektrokimya ile çok yakından
ilgili olması sebebi ile nanoteknolojiden bahsetmek isabetli olacaktır. Günümüzde en çok
konuşulan konulardan birisi de nanoteknolojidir. Metrenin milyarda birine nano denir.
O halde nanoteknoloji; metrenin 1/milyar
boyutunda işleyen bir teknoloji demektir.
Bu kadar küçük boyuttaki bir teknoloji olsa
olsa atomik boyutlarda yürüyen bir teknoloji olmalıdır. Neden araştırmacılar bu kadar
zor bir işe giriyorlar, dar bir alanda deney
yapmaya çalışıyorlar gibi haklı bir soru akla
gelebilir. Atomlar nanoboyutlarda bir araya
getirildiklerinde elektrik, manyetik, optik
ve mekanik davranışlarında ilginç özellikler
göstermektedirler. Örn. hepimiz biliriz altının rengi sarıdır. Fakat nanoboyutta bir araya
getirilmiş birkaç altın atomundan oluşan nanomalzemenin rengi ise yeşildir. Bu yüzden
değişik element atomlarının nanoboyutta bir
araya getirilmesi ile ilginç özellikler konusundaki merak, araştırmacıları cezbetmektedir.
Bu yüzden yeni bulunabilecek ilginç özellikler malzeme biliminde çok önemli yeni
gelişmelere, akıllı malzemelerin ortaya çıkmasına sebep olacaktır. Böylece de hayatın
ilgili noktasında önemli yeni bir kolaylık geliştirilmiş olacaktır. Nanomalzemelere örnek
olarak karbon nanotüpler, nanokristaller ve
fulerinler örnek verilebilir. Fakat şu unutulmamalıdır ki, gerçekte en bariz nanoteknolojik ürünler; biz insanlar, hayvanlar ve diğer
bitki örtüsü, kısaca bu gezegende yaratılmış
her varlıktır. Örn. bir insan sidiğini sidik torbasında uzun bir süre tutabildiği halde acaba
elinde kaç dakika tutabilir. Beş dakika bile
tutamaz, eli yanmaya başlar. O halde yaratıcı
9
YENİ TÜRKİYE 88/2016
vardır ve her biri fizikokimya içindeki kendi
uzmanlık alanında araştırmalar yapmaktadır.
Bir fizikokimyacı olarak, organik kimyacılar
tarafından yeni sentezlenmiş, dolayısı ile hiçbir fizikokimyasal özelliği henüz bilinmeyen
bazı orijinal primidin bileşiklerinin fizikokimyasal özellikleri tarafımdan çalışılmıştır. Primidin bileşikleri hayatın sırrını taşıyan DNA
(deoksiribonükleik asit) nın yapısındaki üç
yapıtaşından biridir. Bu çalışmalarda elektrokimyasal [12], potansiyometrik titrasyon
[13] ve UV-görünür bölge spektrofotometri
yöntemleri kullanılarak söz konusu bileşiklerin ilaç olabilmeleri yolunda gerekli asitlik
sabiti, keto ↔ enol tautomerleşmesi ve hidrasyon gibi önemli fizikokimyasal özellikleri
çalışılmış, ilgili reaksiyon mekanizmaları tayin
edilerek literatüre kazandırılmıştır [14-17].
YENİ TÜRKİYE 88/2016
10
burada amaca uygun bir malzeme kullanmış,
öyle bir malzeme ki burada bu malzemenin
atomları bu görevi yerine getirecek şekilde
konuşlandırılmıştır, dizilmiştir. Eğer buradaki malzeme de elimizin içindeki malzemenin
aynısı olsaydı acaba halimiz nice olurdu. Başka bir örnek, toprağa bir tane elma çekirdeği
gömüyoruz, oradan bir elma ağacı büyüyor,
armut ağacı değil. O halde o elmanın çekirdeğinde o elmanın genetik kodu işlenmiş.
İşte bütün bunlar bir nanoteknolojidir ve insanlık var olalı bu teknoloji de vardır. Gören
göz tavuğa baksa yaratıcıyı görür. Tavuk, etraftaki çer çöpü toplar yer ertesi gün sahtesi
yapılamayan, ambalajlanmış bir yumurta sunar sahibine. Yukarıda verilen 1/milyar ölçütü
dikkatle hayal edilirse, sanki nanoteknolojik
bir çalışmada çalışılacak element atomlarının
cımbızla alınarak ilgili yere konulması gibi
bir işlemi gerektirdiği görülebilir. Bu durum
normalde mümkün değildir çünkü bunca
gelişmiş mevcut teknolojiye rağmen malesef
günümüzde atomları henüz göremiyoruz ve
hiçbir zaman da göremeyeceğiz. Fakat böyle
bir işlem, atomların tek tek istediğimiz gibi
yerleştirilmesi işlemi ancak uygun bir elektroliz işlemi ile mümkündür. Bu da göstermektedir ki bu teknolojinin günümüzdeki
tek aleti uygun bir elektrokimyasal yöntem,
kısacası elektrokimyadır. Elektrokimya, fizikokimyanın önemli bir alt dalıdır.
Elektrokimyasal yöntem geçmişten günümüze kadar fizikokimyanın çok önemli bir
kolu olmuştur. Nanoteknolojik dönemde de
bu üstünlüğünün devam edeceği anlaşılmaktadır. Bu dönemde elektrokimyacılar başta,
mikroelektronikçiler,
nanoelektronikçiler,
malzemeciler ve katıhal fizikçileri olmak
üzere fonksiyonel nanomalzeme araştırmalarında önemli katkıları olacaktır. Dolayısı
ile nanoteknoloji fonksiyonel nanomalzeme
kullanılmasını içeren tüm alanlarda önemli
katkılara ve yeniliklere yol açacaktır. Başta
Amerika Birleşik Devletleri, İsrail, Japonya
ve Almanya gibi diğer pek çok ülke bu teknolojiye milyar dolarlar üzerinde muazzam
yatırım yapmıştır ve hala da yapmaktadırlar.
Nanoteknolojiden beklenen; artık yapılacak
ürünler mikro boyutun da ötesinde nanoboyut mertebelerindeki küçük hacimlerde olabilecek ve üstelik eski teknolojiye göre daha
sağlam, daha verimli, daha kullanışlı, daha
hızlı, kısacası daha fonksiyonel olacaktır.
Nanoteknoloji sayesinde kimya ve kimyasal
maddeler daha etkili ve bilinçli kullanılarak
daha verimli, daha güvenilir malzemeler üretilebilecektir. Bu da göstermektedir ki gelecekte nanoteknoloji kimya bilimi ile, özellikle
mevcut fizikokimyasal yöntemlere ilave olarak yeni keşfedilecek yöntemlerle kimyanın
omuzlarında ilgili endüstriyel alanlarda pek
çok yeni önemli gelişmelere yol açacaktır.
Önümüzdeki yüzyıl temelde kimyanın, fizikokimyasal yöntemlerin ve malzeme biliminin yüzyılı olacaktır.
Nanoteknolojik gelişmelere örnek verecek olursak, örn., bu teknoloji ile uzun süre
solmayan boyalar, daha etkili ilaçlar, daha
yüksek kapasiteli ve hızlı bilgisayarlar, daha
fonksiyonel iş elbiseleri, örn., yanmayan, ıslanmayan elbiseler, iş makineleri yapılabilecektir. Geliştirilecek nanorobotlar ile sağlık
ve mühendislikte önemli yenilikler olacaktır.
Daha fonksiyonel dedektörler, biyosensörler
üretilebilecektir. Bu sayılanların pek çoğu
günümüzde gerçekleşmiştir. Bu gelişmelere
ilave olarak, nanoteknolojik gidişat gelecekte
bu teknolojinin iletişim, inşaat, hava, kara ve
deniz ulaşımı, eğitim, deniz dibi araştırmalar,
uzay araştırmaları, depremi önceden tahmin
edebilme araştırmaları gibi hayatın birçok
noktasında daha da önemli uygulamaları olacaktır. Yeni geliştirilecek nanoalgılayıcılar sayesinde deprem araştırmalarında önemli gelişmeler beklenebilir. Enerjinin daha verimli
üretilmesi, iletilmesi ve kullanılması gerçekleşerek elektrik enerjisinin tasarrufunda büyük
katkılar sağlayabilir. Belki çok uçuk bir öngörü olacak fakat şunu belirtmekte yarar vardır;
nanoteknoloji ile geliştirilecek süper hızlı ve
fizikokimyasal yöntemleri içeren daha yeni
teknik programlarla donatılmış süper bilgisa-
yarlar sayesinde gelecekte kimyasal deneyler
hiç deney yapmadan hem de tam nanoteknolojik olarak bilgisayar ortamında gerçekleştirilecektir. Böylece söz konusu reaksiyonun
daha önceden olabilirliği ve elde edilen ürünün fizikokimyasal özellikleri bilgisayar ortamında önceden belirlenecek ve istikbal vaad
eden bir durum halinde gerçek nanoteknolojik çalışmaya geçilecektir. Görüldüğü gibi
böyle bir çalışma var olan doğal kaynakların
heba edilmeden daha yerinde kullanılmasını sağlayacak ve bu şekli ile de daha temiz
çevrenin gelişmesinde yardımcı olacaktır.
Bu yüzden başta Amerika Birleşik Devletleri olmak üzere birçok ülke nanoteknolojik
çalışmalara çoktan başlamışlar hatta nanoteknoloji dersleri okullarda lisans seviyesine
kadar inmiş durumdadır. Daha da ötesi, şu
an Amerika’da liselerde verilen proje ödevlerinde öğrencilerin çoğu nanoteknoloji ile üretilmiş elektronik parçaları bir araya getirerek
başta robot, çeşitli sensörler, uzaktan kumandalı alet vb. teknolojik ürün tasarımı yaparak
birbirleri ile yarışmaktadırlar. Bizim ülkemizde de nanoteknolojik çalışmalar Tübitak,
Aselsan, Gebze Yüksek Teknoloji Üniversitesi (GYTE), Orta Doğu Teknik Üniversitesi
(ODTÜ), Bilkent ve Sabancı Üniversitelerinde yapılmaktadır. Hatta Bilkent Üniversitesi
bünyesinde Devlet Planlama Teşkilatımızın
desteği ile 2006 yılında Ulusal Nanoteknoloji Araştırma Merkezi (UNAM) kurulmuştur.
Yurtdışındaki değerli araştırmacılarımız da
bu merkezdeki araştırmacılarımız ile ortak
çalışmalar yaparak merkezimize araştırma –
geliştirme (AR-GE) desteği vermektedirler.
açıklamak için çeşitli bilimsel modeller ortaya
koymuşlardır [8].
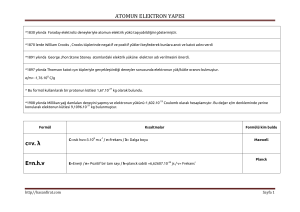
Atom hakkında Democritus, Dalton,
Thomson, Rutherford, Bohr ve De Broglie
görüşlerini ortaya koymuşlar ve günümüzdeki atom modeli ortaya çıkmıştır. Democritus’ a göre; madde parçalara ayrıldığında
en sonunda bölünemeyen bir tanecik kalır
ve bu atomdur. Günümüzde kullanılan atom
modeli Modern Atom Teorisi sonucu ortaya
konmuştur.
b) Dalton Atom Modeli (John Dalton
1766–1844)
İlk atom hipotezi; İlk atom teorisinin
1808 yılında Dalton tarafından ileri sürülmüştür. İlk defa Dalton atomları simgeleyen
yuvarlaklar kullanmışsa da sonraları Berzelius, değişik atomların isimlerinin baş harflerini kullanmıştır. Buna göre atom hakkında
ilk bilimsel görüş 1803 – 1808 yılları arasında
İngiliz bilim adamı John Dalton tarafından
ortaya atılmıştır. Dalton’a göre; 1- Bütün elementler görünmeyen atomlardan oluşmuştur,
atomlar içi dolu küre şeklindedir, 2- Atomlar
bölünmezler, 3- Bir elementin atomları aynı
ve aynı bir kütleye sahiptir. Farklı elementlerin atomları farklıdır. 4- Kimyasal tepkimelerde atomların düzenlenmesi değişir. Yeni
bir atom meydana gelmez ve var olan da yok
olmaz.
11
Thomson Atom Modeli (John Joseph
Thomson 1856–1940)
Atom Modelleri: Atom, Yunancada
bölünemez anlamına gelir. Eski çağlardan
günümüze kadar gözle görülemeyen atom
hakkında çeşitli bilim adamları deneyler yapmışlar, atom hakkında elde ettikleri bilgileri
Şekil 1: Katot ışınları tüpü. Sağa doğru
giden ışınlar – yüklü katot ışınları, sola doğru
giden ışınlar + yüklü kanal ışınları [20]
YENİ TÜRKİYE 88/2016
Atomun Yapısının Aydınlatılması
Çalışmaları ve Kuantum Mekaniğinin
Doğuşu
YENİ TÜRKİYE 88/2016
12
İngiliz fizikçi Sir William Crooke, 1879
da katot ışınları tüpünü (boşalma (deşarz) tüpünü) icat etmiştir. Bu tüp içine çok düşük
basınçta bir gaz konulduğunda ve gazdan da
10000 V düzeyinde elektrik akımı geçirildiğinde gazın cinsine göre bir ışıma gözlenmiştir. Gazın cinsi değiştikçe ışımanın renginin
de değiştiği gözlenmiştir. Örn., azot gazı (N2)
gazı varsa ışımanın rengi pembe, civa (Hg)
buharı varsa ışımanın rengi yeşildir. Bu tüple
yapılan sonraki deneylerde tüp içindeki gazın
basıncı 1/100 mm-Hg nın altına düşürüldüğünde söz konusu gaza özel olarak görülen
ışımaların kaybolduğu gözlenmiştir. Ancak
bu sefer katottan (- elektrot) anot (+ elektrot) a doğru bir ışıma görülmüştür. Bu deney
her seferinde tüpün içine farklı gazlar konulmuş ve düşük basınçta bu deney aynı şekilde
tekrarlanmıştır. Her seferinde de yine sadece
katottan anoda doğru ilerleyen ışıma görülmüştür. Bu yüzden bu ışımaya katot ışınları
denilmiştir. Gazın cinsi değiştiği halde her
seferinde katottan anoda doğru ilerleyen aynı
bir ışının görülmesi, bunun tüm maddelerin
ortak bir özelliği olduğu sonucuna varılmıştır. İlerleyen dönemde J.J. Thomson bu katot
ışınlarının etrafına mıknatıs yerleştirmiş ve
bu defa ışınların mıknatısın pozitif tarafına
doğru büküldüğünü bulmuştur. Buna göre
Thomson bu ışınların – yüklü olduğunu bulmuştur. J.J. Thomson ve daha sonraki araştırmacılar bu – yüklü taneciklerin elektrik
yük / kütle oranını tayin ederek, bunların
Faraday tarafından elektroliz yoluyla elde
edilen elektrik atomları olduğu, elektronlar
olduğu bulunmuştur. Katot ışınları tüpünde
gözlenen olayın açıklaması şudur: Yüksek
gerilimle hızlandırılan elektronlar, ortamdaki
gaz (veya hava) moleküllerine çarparak onlardan da elektron kopararak birlikte elektriğin katottan anoda akmasını sağlarlar. Katot
ışınları tüpü, TV tüpünün atasıdır. Elektronlar – yüklü partiküllerdir. Elektronlara bir
elektrik veya magnetik alan uygulanarak TV
ekranında odaklanması sağlanır ve görüntü
oluştururlar [8,20].
Elektriğin tanecik yapılı olduğu Faraday’ın elektroliz çalışmalarından biliniyordu.
Böylece katot ışınlarının tanecik denilen o en
küçük yapı, elektrik atomu, yani elektronlar
olduğu kesin olarak anlaşılmıştır. Böylece
elektrik atomunun, başka bir ifade ile elektronların gerçek varlığı gazlardan elektrik akımı geçirilmesiyle oluşan katot ışınlarından
ortaya konulmuştur [8].
Pozitif ışınlar (kanal ışınları) ın keşfi:
Katot ışınlarının elektronlar olduğu anlaşılınca Goldstein; madem katot ışınları – yüklü taneciklerdir, o halde atomda + yüklü tanecikler de olmalıdır deyip, + yüklü parçacıkların
varlığını kanal ışınlarını bularak göstermiştir.
Katot ışınları tüpünde anot, katot elektrotları
arasına uygulanan yüksek gerilim sonucunda atomdan elektronlar kopup ayrıldıklarına
göre geride + yüklü iyonlar oluşmalıdır. Bu
+ yüklü iyonlar da elektronun ters yönünde
hareket ederek negatif elektroda (katoda)
doğru gitmelidirler şeklinde düşünmüş ve
deneysel çalışmasını gerçekleştirmiştir. Bu +
yüklü ışımaları daha iyi görebilmek için katot elektrodunun üzerine delikler açmıştır.
Deney başladığında aradığı ışınların bu deliklerden elektrodun arkasındaki karanlık bölgeye kanal şeklinde geçişlerinden Goldstein
bunları tespit etmiş ve bunlara pozitif ışınlar
ya da kanal ışınları demiştir [8,20]. Bu ışınlar
yukarıda Şekil 1 de gösterilmiştir.
J.J. Thomson atom modeli: Maddenin
yapısına dair ilk modern yaklaşım J.J. Thomson’un katot ışınlarından elektronun keşfi ile
başlar. Thomson deneyinde katot için farklı
madde kullandığında ve deney tüpünün farklı gazla doldurulduğunda bile katot ışınlarının aynı davranışta bulunduğunu görmüş,
elektronun maddenin temel bir taneciği olduğunu söylemiştir. Böylece atomun yapısı
hakkında ilk model 1897 yılında Thomson
tarafından ortaya konmuştur. Thomson 1887
yılında elektronu keşfinden sonra kendi atom
modelini ortaya atmıştır [20].
Bu devirde herkes gibi Alman bilim
adamı Röntgen’de katot ışınları tüpü ile çalışmalar yapmıştır. 1896 yılında Röntgen katot
ışınlarının çarptıkları katı yüzeylerde çok girici ve o güne kadar bilinmeyen farklı ışınların
meydana geldiğini gözlemlemiş ve mahiyetini
de bilemeyince bunlara X ışınları demiştir.
Bu konu Moseley’e doktora tezi konusu olarak verilmiştir. Moseley bir deney düzeneği
hazırlamıştır. Bu düzenekte bu X ışınlarının yolu üzerine her seferinde farklı bir element, bir antikatot malzemesi yerleştirmiştir.
Bu deney düzeneği ile Moseley, Röntgen’in
deneysel koşullarını aynen sağlamıştır. Moseley’in deneysel düzeneği aşağıda gösterilmiştir [8]. Moseley, bu antikatot malzemenin
Bragg yöntemine göre röntgen ve emisyon
spektrumlarını incelemiştir.
Şekil 2: X ışınlarının keşfi [8]
Düzenekten de görüldüğü gibi katot
ışınları hızla ilerlerken önlerine konulmuş
antikatot malzemesine, örn. bir bakır engele hızla çarparlar. Başak bir ifade ile büyük
bir hızla ilerleyen elektronlar bu çarpmanın
etkisi ile antikatot malzeme tarafından durdurulurlar, frenlenirler. İşte bu frenleme,
bakırın daha iç tabakalardaki elektronlarının
sökülmesine boşaltılmasına yol açar. Daha iç
tabakalardaki elektronlar yerinden söküldüğünden, açığa çıkan X ışınları da daha yüksek enerjili olmaktadırlar. Moseley, bakır gibi
birçok element çalışmıştır. Her bir elementten elde ettiği X ışını ile, o elementin atom
numarası (pozitif yükü) arasında bir ilişki
olduğunu görmüştür. Bulduğu bu deneysel sonuca göre Moseley elementlerin kimlik numaralarının atom numarası olduğunu
bu sebeple periyodik sistemde elementlerin
atom numaralarına göre sıralanması gerektiğini ortaya atmıştır. Daha da önemli ikinci
bir bulgusu; o zamanlarda örn., oksijenin
doğada 168 O , 178 O , ve 188 O şeklinde olduğu
biliniyordu ve bunların her birinin ayrı birer
element olduğu sanılıyordu. Moseley, bunların ayrı ayrı elementler olmadığını oksijenin
izotopları, (benzeri) olduğunu bulmuştur. Bu
keşfi ile Moseley periyodik sistemi güçlendirmiş ve izotop diye yeni bir kavramı da kimyaya kazandırmıştır. Bu sebepledir ki günümüz
periyodik sisteminde elementler artan atom
numaralarına göre sınıflandırılmışlardır. Yukarıda verilen üç oksijen izotopuna bakıldığında oksijen sembolünün altındaki sayıların
üç sembolde de aynı ve 8 olduğu görülür. İşte
bu alttaki sayılar bir atom için atom numarası
olarak adlandırılır ve ilgili atomun kimlik numarası yerine geçer. Bu sayının 1 değişmesi
demek, örn. 8 yerine 7 olması demek; başka
bir atom, azot atomu (N) demektir. Diğer
taraftan oksijen sembollerinde üstte yazılan
rakamlar ise; söz konusu elementin kütlesi
hakkında bilgi verir [2,5,8].
X ışınlarının keşfinin önemi: 1- en fazla
uygulama bulmuştur. Bunlar ilmi, sınai ve tıbbi olmak üzere üç gruptur. 2- Atomun elekt-
13
YENİ TÜRKİYE 88/2016
Thomson atom modeli; - yüklü elektron ve + yüklü protonların homojen bir şekilde yer aldığı bir küre modelidir, üzümlü
keke benzer. Üzümler elektronları geri kalan
kısım ise + yükleri temsil eder. Thomson’
a göre; atom küre şeklindedir. Atomda (+)
ve (–) yüklü tanecikler elektriksel dengeyi
sağlamak için pozitif yük sayısına eşit sayıda
elektron küre içinde dağılmıştır. Elektronun
küre içindeki dağılımı üzümün kek içindeki
dağılımına benzer. Günümüz atom bilgisine
göre nötron denilen parçacıklardan bahsedilmemesi Thomson modelinin önemli bir
eksikliğidir. Proton ve elektronların atomda
rastgele yerlerde bulunduğu iddiası ise teorinin günümüze göre diğer bir hatalı yönüdür
[5,20].
ron sistemine ait bilgilerimizin önemli bir kısmı X ışınları sayesinde elde edilmiştir. 3- İnci,
elmas v.b. değerli eşyaların gerçek mi, sahte
mi olduğu X ışınları ile belirlenebilmektedir.
Günümüzde havaalanlarına v.b. yerlere girerken bu ışınlarla kontroller sağlanmaktadır, 4gözle görülemeyecek kadar küçük cisimlerin
içini görmeye yararlar, hekimler bunlarla vücudun içini görürler. Hastanelerde çektirilen
Röntgen filmleri bu ışınlarla çekilirler [2,8,9].
X ışınlarının tehlikeleri: Kanın beyaz
hücrelerini (akyuvarlar) öldürürler ve kansızlığa sebep olurlar. Bir çeşit deri kanseri
yaparlar. Bu ışınlarla çalışanlar kurşun eldiven, gözlük, elbise kullanmalıdır ve duvarları
içinde kurşun levhalar olan odalarda çalışmalıdırlar.
14
X ışınlarının keşfedilmesinden sonra
Amerikan patent ofisine başvurulmuştur. Patent ofisi başkanı dünyadaki o günkü bilim
adamlarına birer mektup göndererek onları
önemli bir keşif üzerinde konuşmak üzere
Amerika’ya davet eder. Verdiği kokteylde
dünyadaki en büyük keşfin yapıldığını, bundan daha büyük başka bir keşfin olmayacağını belirterek X ışınlarının keşfini duyurur. Fakat bundan tam iki ay sonra radyoaktivitenin
keşfi, bölünemez denilen atomun bölündüğü
bulunmuştur, keşfedilmiştir [2,8,9].
YENİ TÜRKİYE 88/2016
Rutherford Atom Modeli (Ernest
Rutherford 1871–1937)
Rutherford zamanında J.J. Thomson
atom modeli geçerliydi. Bu modele göre
atom küre şeklindedir ve küre içerisinde proton ve elektronlar bulunur. Acaba bu proton
ve elektronlar atom içinde belirli bir yerde mi
yoksa gelişigüzel mi dağılıyorlardı? Bu sorunun cevabı henüz bilinmiyordu. Rutherford
bu sorunun cevabı ve Thomson atom modelinin doğruluk derecesini anlamak için daha
önceden α ve β ışınları ile yaptığı çalışmalardan kazandığı tecrübelerine dayanarak bir
deney tasarlamıştır. 1909 yılında yaptığı bu
deneyinde ince bir altın levha üzerine rad-
yoaktif bir kaynaktan elde ettiği +2 yüklü
α ışınlarını göndermiş ve bu ışınların saçılmasını incelemiştir. Böylece atomun yapısı
hakkında ilk deneysel bilgi Rutherford’dan
gelmiştir.
Şekil 3. Rutherford’un altın deneyi montajı [21]
Şekilden görüldüğü gibi altın levhayı
C şeklinde çinko sülfür (ZnS) sürülmüş bir
ekran içine yerleştirmiştir. Altın levhayı geçip ekran üzerine düşen α tanecikleri ekrana
sürülen ZnS üzerine çarptıklarında ışıldama
yapmaktadırlar. Böylece metal levhayı geçen α taneciklerini sayma imkanı elde edilmiştir. Rutherford yaptığı bu deneyde altın
levha üzerine gönderilen α taneciklerinin %
99,99 kadarının yollarından sapmadan veya
çok az saparak metal levhadan geçtiklerini,
fakat çok az bir kısmının ise metale çarptıktan sonra 1500 e varan büyük bir açı ile geriye
döndüklerini görmüştür. Gönderilen ışınların
çoğunun geçmesi, atomların içinde büyük
boşluk olduğunu göstermiştir. Geriye sapan
ışınlar ise atomun içinde sapmaya neden
olan büyük bir + yük olduğunu göstermiştir, çünkü gönderilen α ışınları da sonuçta +
yüklüdür. Gönderilen + yüklü ışını, atomun
içindeki + yüklü merkez itmiştir. Rutherford
bu sonuca göre atomun merkezinde + yüklü
bir merkez önermiş ve buna çekirdek demiştir, atomun çekirdeği. Tıpkı biyolojide olduğu gibi. Biyolojide her hücrenin bir çekirdeği
vardır ve hücrenin yönetimi buradan yapılır.
Rutherford, çekirdekteki bu + yükün protonlar olduğunu işaret etmiştir. Bu sonuçlara
göre kendi atom modelini önermiştir [2,8,9].
Rutherford’un atom modeli (1911); 1Atomun merkezinde atomun bütün kütlesi-
Rutherford’un bu önerilerine, madem
elektronlar sürekli dönüyor, enerjisi bitince
çekirdek üzerine düşmelidir diye itirazlar gelir ve Rutherford bu itirazı açıklayamaz. Bu
itirazı hem Rutherford ve hem de Max Planck’ın öğrencisi olan Niels Bohr 1913 te Rutherford atom modelini, Planck’ın kuantum
teorisi ile birleştirerek aşağıda Bohr kuramında verildiği şekilde açıklar [8,9].
Planck’ın kuantum teorisine (1901)
göre enerji tanecikli bir yapıya sahiptir, sürekli değildir. Bu nedenle bir cismin enerji
alış verişi enerji atomları ile yani enerji kuantumları ile olur. Bir enerji kuantumu, E = hν
olup bu en küçük enerji atomudur. Burada
h; Planck sabiti olup değeri 6.63x10-34 Js dir.
Enerjinin en küçük birimine kuantum denir
[2,5,8]. Planck, değişik sıcaklıklara kadar
ısıtılmış katı maddelerin yaydığı radyasyonu
incelemiştir. Bu incelemeleri sırasında ısıtılmış bu tür maddelerin yaydığı radyasyonu
incelerken, söz konusu maddenin atomlarının veya molekülerinin sadece belirli ve kesikli birimlerde enerji yayabileceklerini veya
soğurabileceklerini (içine çekebileceklerini)
keşfetmiştir. Planck, bu teorisi ile demir’in
spektrumlarını çok başarılı bir şekilde şöyle
açıklamıştır: Bir demir parçasını kızgın bir
kor’a atalım ve bir süre sonra oradan çıkaralım. Demir kıpkırmızı görülür. Aynı demiri
bekletmeden hemen aynı kor’a tekrar sokalım. Kor’u daha fazla körükleyip yanmanın
şiddetini arttıralım. Bu şekilde demiri bir
süre bekletelim ve tekrar dışarı çıkaralım. Bu
defa demirin mavi ışık verdiği görülür. Mavi
ışık, kırmızı ışıktan daha yüksek enerjilidir.
O halde mavi ışık, demir elementinin daha
iç tabakalardaki elektronlarının uyarılmasına
karşılıktır. Oysa kırmızı ışık, demirin değerlik
tabakasındaki, yani en dış tabakadaki elektronların uyarılmasına karşılıktır.
Bohr Atom Modeli (Niels David Bohr
1875–1962)
Bohr kuramı 1913: Gezegenler sabit
yörünge üzerinde dönebilirler ve klasik teori
bunlar için geçerlidir, çünkü bunlarda Newton kanununa göre kuvvet çekmesi ağırlıktan
ileri gelir. Bu yüzden klasik teori atomlara
uygulanamaz. Atomlar için belirli yörüngeler
olabilir ve elektronların bu yörüngelerdeki hareketi, bir yörüngeden diğerine ancak
enerji alıp – vererek geçmek şeklinde olabilir. Bu yörüngeler n (baş kuantum sayısı) ile
belirlenebilir. Görüldüğü gibi Bohr kuant
kavramını atomların yapısına uygulayan ilk
bilim adamıdır [2,5]. Bohr’un bu açıklamaları daha açık olarak şöyle izah edilebilir;
Gezegenler gibi büyük kütleli maddelerin
davranışları klasik mekanik ile incelenebilir.
Fakat atom boyutlarındaki küçük cisimlerin
davranışları klasik mekanik ile incelenemez,
başka bir mekanik gereklidir. Bir boğaz köprüsü yapmak için klasik teori, Newton mekaniği geçerlidir, kullanılabilir. Fakat örn., karıncalar ve daha küçük canlıların geçebileceği
bir boğaz köprüsü yapabilmek için Newton
mekaniği kullanılamaz, başka bir mekanik
kullanmak gereklidir.
Bohr teorisinde de, Rutherford teorisinde olduğu gibi elektronlar atomun çekirdeği çevresinde dairesel yörüngeler üzerinde
15
YENİ TÜRKİYE 88/2016
ni içeren + yüklü bir çekirdek ve çekirdeğin
içinde protonlar vardır. Çekirdeğin çevresinde ise çekirdeğin + yüküne eşit sayıda elektronlar vardır. Elektronlar çekirdek etrafında gezegenlerin Güneş etrafında dolandığı
gibi dairesel yörüngelerde sürekli dolanırlar.
2- Elektronlar çekirdek çevresinde belli bir
hızla dolanırlar, öyle ki dönme ile kazanılan
merkezkaç kuvvet, atom çekirdeğinin çekim
gücüne eşit olur ve böylece elektronlar çekirdek üzerine düşmezler. Rutherford, çekirdek
içinde kütlesi protonun kütlesine eşit büyüklükte bir taneciğin daha olması gerektiğini
işaret etmiştir. Nötron 1932 yılında James
Chadwick tarafından keşfedilmiştir ve 1935
yılında da Nobel fizik ödülü ile ödüllendirilmiştir. Bu taneciğin elektriksel bir yükü
yoktur, nötürdür. Bu taneciğe nötron diyoruz
[2,8,9].
hareket ediyordu. Fakat Bohr, ciddi bir başka
koşul getirmekte idi;
1- Hidrojen atomunun tek elektronu
sadece belirli yörüngelerde bulunabilirdi.
Her yörüngenin de belli bir enerjisi vardır.
Yani elektronun enerjisinin kuantlı olduğunu, tanecikli olduğunu, sadece belli enerjileri
alabileceğini öngörüyordu. Başka bir ifade ile
elektronların çekirdekten itibaren her uzaklıkta bulunamadıklarını, ancak belli mesafelerde bulunabileceklerini söylüyordu. Bohr,
elektronlar çekirdek etrafında dairesel yörüngelerde hareket ederler diyordu. Bohr, bu yörüngelere enerji düzeyi veya kabuk demiştir.
2- Uyarılmış bir atomdaki bir elektron
yüksek enerji düzeyinden düşük enerji düzeyine inerken aradaki enerji farkını bir foton,
bir ışık olarak yayar, tersinde ise enerji alır ve
aradaki enerji farkı; ΔE = Eyüksek – Edüşük = hν
(kuant) şeklindedir diyordu.
16
Bohr modeline göre atom; ortada atomun hemen hemen bütün kütlesinin bulunduğu + elektrik yüklü bir çekirdek, bunun
etrafında muhtelif tabakalara sıralanmış
güneş etrafında gezegenlerin hareketi gibi
harekette bulunan ve çekirdeğin + yükünü
nötürleştirecek sayıda – yüklü elektronlardan
oluşmuştur [2,5,8].
YENİ TÜRKİYE 88/2016
Şekil 4: Değişik atomların elektronik yapıları [22]
Bohr atom modeline göre Hidrojen
atomu; Hidrojen’in simgesi 11 H dir. Alttaki 1; bu atomun çekirdeğinde + yüklü bir
protonun varlığını göstermektedir. H atomu
doğal halinde nötür olduğuna göre o halde
çekirdek çevresinde de – yüklü bir elektronu
olmalıdır. Üstteki 1 ise; bu atomun kütlesinin
1 olduğunu göstermektedir. Elektronun kütlesi,
protonun kütlesinin 1/1840 ta biridir, görüldü-
ğü gibi çok küçüktür, bu nedenle de atomun
kütlesinde önemli bir etkisi yoktur. O halde H
atomunda, çekirdekte bir proton ve çekirdek
çevresinde de dönmekte olan 1 elektron vardır. Görüldüğü gibi H atomunda nötron yoktur ve H atomu tıpkı Dünya – Ay ın minyatürü gibidir. Hidrojen’den bir sonraki element
Helyum olup, 24 H
e şeklinde gösterilir. Buna
göre; alttaki 2; Helyum’un çekirdeğinde iki
tane + yüklü proton ve iki tane de yüksüz
nötron olduğunu gösterir. Bir nötronun kütlesi ile bir protonun kütlesi aynı olup 1 e eşittirler. Bu yüzden üstteki 4; iki proton + iki
nötronun kütleleri toplamı olan 4 e eşittir.
Bohr’a göre çekirdeğe en yakın yörüngede bulunan (n = 1) elektron en düşük
enerjilidir. 1913›te Danimarkalı fizikçi Niels
Bohr (1885-1962), H atomunun spektrum
çizgilerini Max Planck’ın kuantum kuramına dayanarak başarılı bir şekilde açıklamıştır.
Buradaki spektrum kelimesi; bir hastanede
çekilmiş bir akciğer filmi kabaca ilgili hastanın akciğerinin bir çeşit spektrumudur, içeride ne var, ne yok göstermektedir. Atomlarında bu şekilde spektrumları alınır. Bohr kendi
kuramında ne söylemişse bunu H atomu ile
yaptığı çalışmadan elde ettiği spektrumların
yorumu ile başarılı bir şekilde ıspat etmiştir.
Bohr modeli H atomunun yanı sıra hidrojene benzer, başka bir ifade ile tek elektronlu
Helyum ve Lityum gibi element atomlarının
spektrum çizgilerini de başarıyla açıklamıştır.
Ancak bu model çok elektronlu atomların
ve iyonların karmaşık spektrum çizgilerini
açıklamakta maalesef yetersiz kalmıştır. Bu
sebeple bu kuram yaklaşık oniki yıl geçerli
kalabilmiştir [2,5].
Modern Atom Teorisine Doğru
İlerleyen yıllarda Sommerfeld ve Wilson, Bohr kuramını daha da genişletmişlerdir. Bohr sadece bir koordinat sistemi düşünmüştür. Atomda üç boyut olduğuna göre
bir elektronun yerini belirlemek için üç koordinat sistemi gereklidir. Bu nedenle enerji
De Broglie teorisi: Fizikçiler şaşırmıştı,
neden Bohr atomunda bir elektron belirli
yörüngelerle kısıtlı idi. Böyle on yıl geçmiş,
kimse bir açıklama getirememişti. 1924 yılında de Broglie bulmacayı çözmüş ve dalgalar
tanecikler (fotonlar) gibi hareket edebilirse,
elektron gibi taneciklerin de dalga özelliğine
sahip olabileceğini ileri sürdü. Yani de Broglie’a göre bir elektron, sürekli bir dalga gibi
hareket edebilir idi. De Broglie, H atomunda
sürekli dalga gibi davranan elektron dalgalarının yörüngesinin atomun çevresine tam olarak uyması gerektiğini önerdi. Aksi takdirde
dalganın kendisini yok edeceğini öne sürdü.
De Broglie teorisi dalganın tanecik gibi ve
taneciklerin de dalga karakteri gösterdikleri
sonucunu sağlamıştır. De Broglie teorisine
göre elektron da foton gibi düşünülebilir.
Elektron mikroskobunun keşfi, de Broglie
teorisinin geçerliliği konusunda inandırıcı bir
kanıttır. Elektron mikroskobu, elektronun
dalga özelliğinin önemli bir uygulamasıdır.
De Broglie’den kısa bir süre sonra J.J. Thomson un oğlu G.P. Thomson elektronun dalga
özelliği gösterdiğini bulmuştur. X ışınlarında
olduğu gibi elektron demetini bir altın tabakası üzerine göndererek röntgen ışınlarında
olduğu gibi iç içe halkalı resimler elde etmiştir [5,20].
Heisenbergin belirsizlik prensibi, 1926;
elektronların dalga hareketinin keşfi ile bir
başka problem doğmuştu. Şimdi bir dalganın
pozisyonu nasıl belirlenecekti? Heisenberg,
elektronun hızı hassas bir şekilde ölçülürse elektronun yeri konusunda bir belirsizlik
olur. Heisenberg, “elektronun yeri hassas
ölçülürse, bu defa elektronun hızındaki belirsizlik artar ve bu sonuç Bohr atom teorisi
ile çelişir, Bohr un düşündüğü ile uyuşmaz,
çünkü Bohr, e belli bir yörünge üzerinde hareket ediyor demiştir. Eğer Bohr’un dediği
doğru olsaydı, elektronun hem pozisyonu ve
hem de hızı tam olarak ölçülebilmeli idi. O
halde elektronun yeri ve hızı aynı anda tam
olarak belirtilemediğine göre Bohr modelinde olduğu gibi belirli yörüngelerden bahsedilemez. Ancak elektronun bulunma olasılığının yüksek olduğu bölgelerden bahsedilebilir.
O halde elektronları çekirdek etrafında belli
yörüngelerde dönen tanecikler olarak değil
de, elektron bulutları olarak düşünmek doğru olur” demiştir [2,5].
Kuantum mekaniği (dalga mekaniği) nin
ortaya çıkması gereği; de Broglie ve Heisenberg in buluşları ile elektronun yerinin tayini gündeme gelmiştir. De Broglie tarafından
elektron gibi dalga özelliği de gösteren taneciklerin hareketini tanımlamada klasik mekanik yetersiz kalmıştır. Kuantum mekaniği
bu sebeple doğmuştur. Kuantum mekaniği;
Planck’ın kuantum enerji paketleri kavramını, de Broglie denklemini ve Heisenberg’in
belirsizlik prensibini esas almıştır [2,5].
17
Klasik mekanik ile kuantum mekaniği
arasındaki farklar;
1- Klasik mekanikteki yörünge kavramının yeri artık kuantum mekaniğinde dalga
fonksiyonu almıştır. Buna göre Bohr modelindeki yörünge yerine atomik orbitallerden
bahsedilir.
2- Klasik mekaniğe göre; madde ve
enerji ayrı ayrı özelliklere sahiptir. Madde kesikli (sürekli değil), enerji ise süreklidir. Bu
yüzden enerji sıfır olamaz. Kuantum mekaniğine göre ise bu farklar ortadan kalkmıştır.
İkisi arasında [2,5];
1. en önemli fark; kuantum mekaniğinde maddenin dalga karaktere, dalganın da
tanecik karaktere sahiptir. Yani tanecik dalga
özelliğine, dalga da taneciklerin bazı özelliklerine sahip olabilir.
2. en önemli fark; Planck’ın kuantum
teorisine göre enerji taneciklidir, kuantlaşmıştır, yani süreksizdir, ancak belli bazı ener-
YENİ TÜRKİYE 88/2016
düzeylerini veya elektron yörüngelerini tam
tayin etmek için sadece baş kuantum sayısı
(n) değil, aynı zamanda l, m ve s gibi üç kuantum sayısının daha gerekli olduğunu ileri
sürmüşlerdir [5].
jileri alabilir, sürekli alamaz. Bu yüzden bir
cismin enerjisi sıfır da olabilir. Kuantum mekaniğine göre bir ışığın ışını, bağımsız enerji
paketçiklerinden, hν oluşmuştur. Bu yüzden
kuantum mekaniğinde sistemin ölçülen bir
büyüklüğü için kuantlıdır demek; sadece belli değerler alabilir demektir. Her ölçülen kuantlı değildir, örn., bir taneciğin uzaydaki yeri
kuantlı değildir. Bir cismin enerji alış verişi
enerji atomları ile yani kuantumlar ile olur.
Bir enerji kuantumu (atomu) E = hν dür.
Işık atomlarına foton (tanecik) denir [2,5,8].
YENİ TÜRKİYE 88/2016
18
Kuantum mekaniğini atoma uygulamak
için Schrödinger kendi adı ile anılan bir dalga fonksiyonu (Schrödinger denklemi) önermiştir. Schrödinger denklemi, çok küçük
taneciklerin üç boyutlu uzaydaki hareketini
tanımlamak üzere önerilmiş bir diferansiyel
denklemdir. Bu denklem kuantum mekaniğinin doğmasına yol açmıştır. Fizik ve kimyada
bir çığır açmıştır. Denklemin önemli tarafı;
parçacık (kütle) ve dalga davranışını birleştirmesidir. Schrödinger denklemi; elektronun
atom içindeki hareketini tanımlar. Denklemin çözümü atomdaki bir elektronun bulunabileceği hacmi belirler. Bu hacme orbital
denir. Başka bir ifade ile, denklemin çözümü sadece elektronun uzayda bulunabilme
olasılığını değil, aynı zamanda enerjisinin de
tayinine yarar. Orbitaller elektronların çekirdek etrafında bulunabilecekleri bölgelerdir.
Elektron tanecik olarak düşünülürse orbital;
atom içinde elektronun bulunma olasılığı en
yüksek olduğu bölgeyi gösterir. Dalga olarak
kabul edildiğinde ise elektronun yük yoğunluğundan söz edilir. Atomdaki her bir elektronun dört kuantum sayısı vardır. Bu dört
kuantum sayısı elektronlar için adres bilgileri
gibidir. Bir atomda dört kuantum sayısı birbirinin aynısı olan iki elektron bulunamaz,
mutlaka biri farklıdır [2,5,8].
Orbitallerin şekilleri: Yukarıdan beri
anlatılanlardan sonra neymiş bu orbitaller,
şekilleri nasıldır diye merak eden okuyucularımızın görmesi için aşağıda sadece p orbitallerinin şekilleri verilmiştir. Bizim için önemli
olan orbitallerin elektron yoğunluğu değil, şekilleri ve birbirine göre nisbi büyüklükleridir.
Kuantum mekaniği ile yapılan hesaplar bize
bütün s orbitallerinin küresel olduklarını,
baş kuantum sayısı (n) arttıkça kürenin büyüklüğünün arttığını göstermektedir. Bunların şekilleri burada verilmemiştir. Aşağıda p
orbitalleri kısaca anlatılmış ve ilgili şekilleri
verilmiştir.
p orbitalleri: kuantum mekaniği hesaplarına göre üç tane 2p orbitali vardır; 2px,
2py, 2pz. Bu üç orbital; şekil, büyüklük ve
enerji açısından tamamen birbirinin aynıdırlar, sadece yönleri farklıdır. Örn., oksijenin
8 elektronu vardır ve bunlar orbitallere şu
şekilde doldurulurlar; 1s2 2p6 veya 1s2 2 p x2 ,
2 p y2 ve 2 p z2 . Görüldüğü gibi üstteki 2 lerin
toplamı 8 dir. Burada oksijenin 2 elektronu s
orbitaline ve diğer 6 elektron da p orbitallerine yerleşmişlerdir.
Burada görülen taralı bölgeler elektronların en fazla bulundukları bölgeleri göstermektedir. Kuantum mekaniği bize böyle
bir resim vermemektedir. Bu şekiller, kuantum mekaniği ile yapılan hesaplamalarından
elde edilen verilerden yola çıkarak fizikokimyacı yorumu ile belirlenebilmektedir.
Kuantum mekaniği işte bu yönü ile bu
alanda bir çığır açmış ve hesapsal kimya denilen fizikokimyanın teorik yeni bir alt dalının
doğmasına yol açmıştır.
Kaynaklar
[1] R.G. Mortimer. Physical Chemistry. Amsterdam, Netherland: Elsevier Academic Press, 2008.
3rd ed.
[2] Fizikokimya, Prof.Dr. Ali Rıza Berkem,
Prof. Dr. Sacide Baykut, Prof. Dr. Mustafa L. Berkem,
İstanbul Üniversitesi Yayınları, ISBN 975-404-204-7,
1993.
[4]
http://www.trcitroen.com/forum/otomobil-bakimi-ve-boya-koruma/708-antifiriz-kullanimi.
html
[5] Fizikokimya, Prof.Dr. Yüksel Sarıkaya, Ankara Üniversitesi, Fen Fakültesi, Gazi Büro Kitabevi,
1997.
[6] Josiah Willard Gibbs, “On the Equilibrium
of Heterogeneous Substances”, Transactions of the
Connecticut Academy of Sciences 1876.
[7] Eric Herbst, “Chemistry of Star-Forming
Regions”, Journal of Physical Chemistry A 109 (2005)
4017-4029.
[8] Dr. Ali Rıza Berkem, “Madde ve Enerji,
Atom Bombası”, İstanbul- Şirketi Mürettibiye Basımevi No. 73, 1946.
[9] Prof.Dr. Ali Rıza Berkem, “Çekirdek Kimyası ve Radyokimya”, İstanbul Üniv. Yayın No: 3631,
ISBN 975-404-207-1, 1992.
[10] H. Kılıç*, “Ultraviolet-visible study on
acid-base equilibria for some 7,8-ethylenedioxy coumarins,” Journal of Molecular Liquids, 187 (2013)
314-319.
[11] H. Kılıç*, “Sunlight-exposure photodimerization behavior of some 7,8-ethylenedioxycoumarins:
Experimental and theoretical evidence of photodimerization,” Journal of Molecular Liquids, 200 (2014)
238-245.
[12] H. Kılıç*, and M.L. Berkem, “Electrochemical Behavior of Some New Pyrimidine Derivatives,”
J. Serbian Chemical Society, 69 (2004) 689-703.
[13] H. Kılıç*, and B. Er, “Potentiometric Investigation of Acid-Base Equilibria of Two New Pyrimidine Derivatives in Various Methanol–Water Media,” J.
Serbian Chemical Society, 71, (2006) 43-54.
[14] H. Kılıç*, “Electronic Absorption Study
on Acid–Base Equilibria for Some Keto and Thioketo
Pyrimidine Derivatives Experimental and Theoretical
Evidence of Enolization and Solute–Solvent Interactions,” Spectrochimica Acta Part A, 67 (2007) 1210–1219.
[15] H. Kılıç,* “Ultraviolet–visible Study of
Tautomeric Behavior of Some Carbonyl and Thiocarbonyl Pyrimidine Derivatives: Experimental Evidence
of Enolization and Thioketonization, ” Spectrochimica
Acta Part A, 71 (2008) 175–185.
[16] H. Kılıç*, “Electronic absorption study on
acid–base equilibria for some pyrimidine derivatives
containing semi- and thiosemicarbazone moiety, ” Spectrochimica Acta Part A, 75 (2010) 728–733.
[17] H. Kılıç*, “Electronic absorption study on
hydration, solvation behavior for some keto and thioketo pyrimidine derivatives,” Spectrochimica Acta Part
A, 104 (2013) 328–336.
[18] [(invited) E. Bulut, D. Wu, H. Kilic, and
S.R. Brankovic, “Reaction Kinetics of Metal Deposition via SLRR of UPD ML Studied By Surface Reflectivity Measurements”, 228th The Electrochemical
Society Meeting, 2015, October 11-15th, Phoenix, AZ.
[19] (invited) E. Bulut, D. Wu, H. Kilic, and
S.R. Brankovic, “SLRR of UPD Monolayers – Fundamental Aspects and Interplay of UPD, Reaction Kinetics, and Nucleation”, 66th International Society of Electrochemistry Annual Meeting, 2015, October 4-9th,
Taipei, Taiwan.
19
[20] Genel Kimya, Prof. Dr. Hikmet Savcı,
Prof. Dr. Musa şahin, Yrd. Doç.Dr. Hale Bayram, Yrd.
Doç.Dr. Ali Rıza Özkaya, Yrd.Doç.Dr. Ümit Salan,
Marmara Üniversitesi Yayın No: 568, 2. Baskı, 1998.
[21]
http://www.fenodevi.com/9sinif-kimya-konulari/rutherford-atom-modeli
[22]http://bilgiyelpazesi.com/egitim_ogretim/
konu_anlatimli_dersler/fen_ve_teknoloji_dersi_konu_
anlatimlar/atom_atomun_yapisi_kisimlari_bolumleri_2.asp
YENİ TÜRKİYE 88/2016
[3] Alexander Vucinich, “Science in Russian
culture”, Stanford University Press 1963 sayfa 388.
ISBN 0-8047-0738-3.