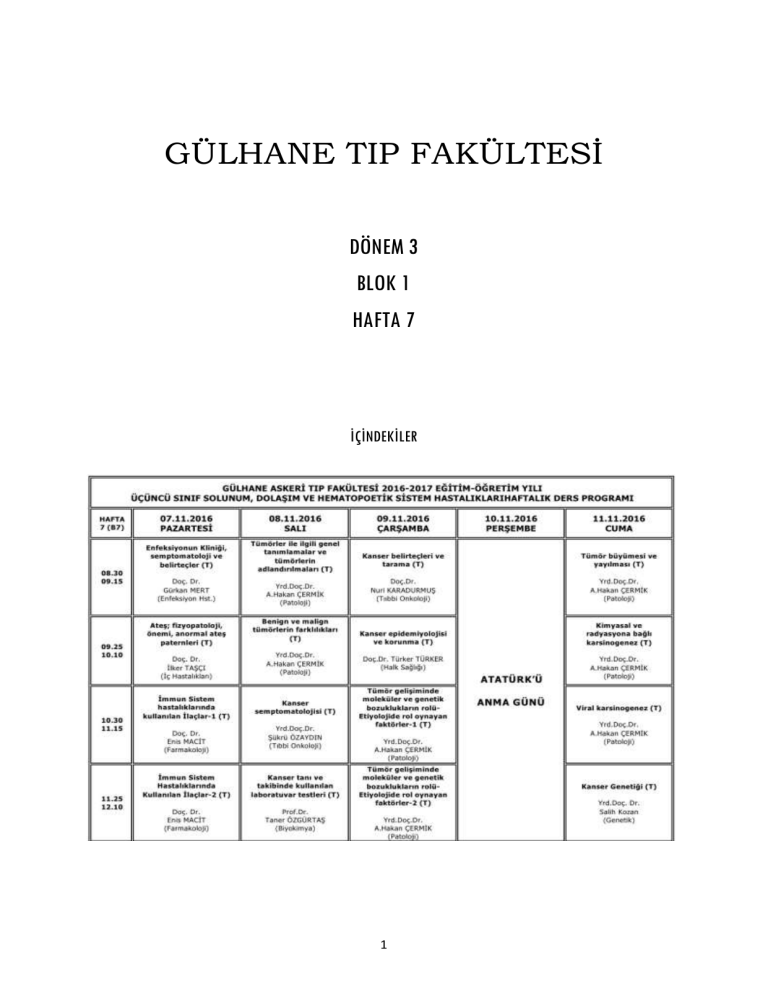
GÜLHANE TIP FAKÜLTESİ
DÖNEM 3
BLOK 1
HAFTA 7
İÇİNDEKİLER
1
ENFEKSİYON HASTALIKLARINDA SEMPATOMATOLOJİ-Prof. Dr. Cumhur Artuk
Tanı
Anamnez --> %70 --> seyahat, ko-morbid hastalık
Fizik muayene --> %20 --> steteskop yeterlidir
Laboratuar--> %10
Enfeksiyon etkenleri -->
.
.
Asellüler
Prion
Virüs
Tek hücreliler
Prokaryot->Bakteri
Ökaryot->Mantarlar, Protozoonlar
Çok hücreliler
Helmintler
Mantarlar(küf)
1013 hücre vardır fakat 1014 mikroorganizma insan üzerinde yaşamaktadır. Bir organ gibi
düşünülmektedir. Sanki insan onların içinde yaşamaktadır. Gereksiz antibiyotik kullanımı gibi floranın
bozulduğu durumlarda diğer sistemlerde örneğin KV sistemde, üriner sistemde patolojik sonuçlar
oluşabilmektedir.
Etken ile karşılaşma sonucunda (ya floradaki patojen hale gelir ya da ekzojen kaynaklı olabilir) şu
durumlar oluşabilir:
Enfeksiyon oluşmaz -> Asemptomatiktir.
Belirtisiz(subklinik) enfeksiyon -> çok hafif olarak bulgular vardır. (Ateş vb.)
Akut semptomatik enfeksiyon -> Gürültülü tablo akut halde oluşur. Ateş, terleme, kilo kaybı...
Kronik enfeksiyon -> Akut olmadan oluşur. İmmün sistemin durumuna göre akut gelişip daha
sonra kronik olabilir.
Latent enfeksiyon -> Bağışıklık sistemi ile baskı altına alınmıştır. İmmün sistem düştüğünde
tekrar aktif hale gelir.
m.o
Prodrom evresi
Sonlanma
Komplikasyon
İyileşme
Kuluçka evresi Klinik bulgular evresi
Ölüm
Tüm sistemlere ait yakınmalar (anamnezde) tek tek sorulmalıdır. Bir yerde olan patoloji(örneğin bir
apse bile) sistemik bulgulara yol açabilir. Sadece hastanın yakındığı sistemlere-dokulara fikse
olmamak gerekir.
Her diş fıçalamadan 20-30 dk. sonrasına kadar vücutta bir bakteriyemi oluşur. İmmün sistemi
baskılanmış olanlarda hastalık oluşturabilirler.
Uç yaşlarda yaşayanlarda enfeksiyon riski daha yüksektir. Bunlarda aynı zamanda ateşte olmayabilir.
Yaşlılarda yakınmalar hafif ve lokalizasyonu kötüdür. Aynı zamanda yaş etkenler hakkında fikir de
verir. En önemlilerinden olarak yaş antibiyotik seçimi ve dozajını etkiler. (Çocuklarda kinolon,
aminoglikozit, yaşlılarda böbreklerde metabolize edilen ilaçlar kullanılır.)
Fizik muayenede ateş, kalp hızı, solunum hızı, kan basıncı, deri muayenesi, lenf nodülleri ve tüm
sistemler muayene edilir. Bunun yanında göz dibi muayenesi de yapılır.
2
Ateş:
36°C nın altı hipotermik kabul edilir. Septik şoka girer. Ciddi vakalarda görülür.
37,5°C (normal)
38,3°C (subfebril ateş denir)
Enfeksiyon hastalıklarında inflamasyon belirti ve bulguları ortaya çıkar. Laboratuar olarak CRP ve ESR
de artış vardır. Döküntüler oluşabilir.
Core ısı aort kanının ısısıdır. Buna en yakın rektal ve timpanik membranın ısısıdır.
İnsan vücut ısısı sirkadiyen ritm ile değişiklik gösterir. En düşük değer sabah 06.00, en yüksek değer
akşam 16.00-00.00. 0,5°C fark vardır.
Endojen pirojenler --> IL-1, IL-6, TNF-α , IFN.
Hipotalamus termostat ayarı ile vücut sıcaklığı en fazla 40°C ulaşabilmektedir. Bunun üzerindeki
sıcaklıklar hipertermi gibi sıcaklık çarpması vb. sebeplerle oluşur.
Nabızda diskordans --> 1°C ateş artışı en az 15-20 vuru nabızı artırmalıdır. Eğer nabız artmıyorsa altta
yatan başka patolojiler düşünülür.
Enfeksiyonun olup ateşin olmadığı durumlar:
İlaç kullanımı --> NSAEİ, Aseteminofen, kortikosteroid
Çok genç ve çok yaşlılarda
Kronik enfeksiyonlarda --> HIV, kronik fungal ve mikobakteriyel enfeksiyonlar
Ateş 3 haftaya kadar sürüyorsa genelde enfeksiyon kaynaklıdır. 3 haftadan fazla sürenlerde ise yine
enfeksiyon olabilirken bunun yanında maligniteler, kollojenazlar da sebep olabilir.
Enfeksiyon hastalıklarında değişik paternlerde döküntüler gözlenir: peteşi-purpura, toksik eritem,
ektima gangrenosum gibi. Bunun yanında patogonomik bulgularda görülür : eritema kronikum
migrans, ektima gangrenozum, sankr vb.
Enfeksiyonlar (toplumdan edinilmiş, nazokomiyal ve immünitesi baskılanmış olanlarda)
1)MSS Enfeksiyonları: Menenjit(ense sertliği, bulanık baş, bilinç değişikliği), ensefalit,
meningoensefalit, beyin apseleri.
Bakteriyel menejit: Olguların 2/3 ünde klasik triad, Kernig ve Brudzinski işaretleri, %50 kranial sinir
tutulumu, nöbet, KİBAS, papilödemi.
Menejit
Ateş
Baş ağrısı
Menejizm --> Baş ağrısı, ense sertliği, bulantı-kusma, fotofobi
Beyin disfonksiyonu
Meninks irritasyon bulguları: ES, Opistotonus, Brudzinski(boyun fleksiyon yapıldığında bacaklardanda
olması), Kernig işaretleri(bacak ekstansiyona getirildiğinde baldır kaslarının ağrıması).
Klasik triad: ateş+ense sertliği+bilinç değişikliği
Aksi kanıtlanana kadar tüm menenjitler bakteriyel olarak düşünülmelidir.
3
2)KVS Enfeksiyonları: İnfektif endokardit, myokardit, perikardit. Aksi kanıtlanana kadar infektif
endokardit olarak kabul edilmelidir.
3)Solunum yolları enfeksiyonları:
Üst solunum yolu enfeksiyonları
.
-Akut viral rinit
.
-Akut larenjit
.
-Akut sinüzit
. -Akut farenjit ve tonsilit
.
-Otitis media
Alt solunum yolu enfeksiyonları
-Akut bronşit
-Bronşiolit
-Kronik bronşitin akut alevlenmesi
-Pnömoni
Pnömoni:
Tipik --> S. pneumoniae, H. influenzae, M. catarrhalis(β-laktam).
Atipik --> M. pneumonaie, C. pneumonae, L. pneumophila(Makrolid veya kinolon).
4)GI Enfeksiyonları:
•
Gastroenterit
•
Enterokolit
•
Dizanteri sendromu
•
Tenezm
•
Sendromlar: Emetik sendrom, İnflamasyonsuz ishal sendromu, İnflamasyonlu ishal sendromu
5)Ürogenital Sistem Enfeksiyonları:
•
Üriner sistem enfeksiyonları: Üst ÜSE = Pyelonefrit, Alt ÜSE = Sistit
•
Komplikasyonlu ÜSE
•
Asemptomatik bakteriüri
•
Tekrarlayıcı ÜSE
6)Lokomotor Sistem Enfeksiyonları: Septik artrit, osteomyelit
Bulgu olarak: inflamasyon bulguları, eklemde hareket kısıklığı, lokalize kemik hassasiyeti olur. Bu
durum monoartiküler-poliartiküler; simetrik-asimetrik; deri döküntülü, gezici-sabit olabilir.
7)Deri ve Yumuşak Doku Hastalıkları: İmpetigo, Sellülit, Ektima, Folikülit, Enfeksiyöz gangrenler.
8)Cinsel Yolla Bulaşan Hastalıklar: Erkekte üretrit, Vajinit, Mükopürülan servisit, Pelvik inflamatuvar
hastalık.
Enfeksiyon hastalıkları acilleri: İnfektif endokardit, Menenjit, Sepsis, Febril nötropenik hasta, Viral
hepatit.
4
ATEŞ: FİZYOPATOLOJİ, ÖNEMİ, ANORMAL ATEŞ PATERNLERİ-Prof. Dr. İlker Taşçı
Oral: ortalama 35,6 – 38,2°C
38-38,3°C üzeri ateştir. 37,2-37,9 --> subfebril.
Aksiller + 0,5°C = Oral
Oral + 0,5°C = Rektal = Timpanik
Hipotermi: <35°C --> aynı zamanda sepsis kriteridir. Periferde nerdeyse kan kalmamıştır. Kanın santral
organlarda göllendiğini gösterir.
Hafif ateş: 37,5 - 38.3°C
Orta derecede ateş: 38,3 – 39,4°C
Yüksek ateş: 39,4 – 41,5°C
Çok yüksek ateş: > 41,5°C
.
Merkezi vücut ısısı: Alt özofagus ve timpanik membrandan ölçülendir. Günlük insan sıcaklığı 0.5°C dir.
Endojen pirojen kaynağında başlıca monositler, nötrofiller ve lenfositler vardır. Projenik sitokinler
mikrobik olmayan; inflamasyon, travma, Ag-Ab kompleksleri, kanser gibi durumlarda da sentezi artar.
Sitokinler fizyolojik şartlarda vücut ısısının düzenlenmesinde rol almazlar. Ekzojen pirojenler, endojen
pirojenler olmadan pek işe yaramazlar.
Vücut sıcaklığı --> vazokonstrüksiyon(titremenin esas sebebi)
.
termogenez --> kas ve yağ dokusunda gerçekleşir. Buna titretici olmayan
.
termogenez denir. Termogenezin diğer bir çeşidi titremedir.
Hipertermi --> Yüksek ısıya maruz kalma veya termoregülasyon merkezinin bozulması sonucu vücut
ısısının artması. Ternostat ayarı(eşik değer) değişmemiştir, sıvı kaybı vardır, cilt kuru ama sıcaktır.
Çeşitleri:
•
Malign hipertermi: anesteziklere bağlı
•
Nöroleptik malign sendromu: nöroleptik kullanımına bağlı
•
Serotonin sendromu: serotoninerjik kullanımı
Hiperpireksi --> Çok yüksek ateş (>41.5°C). SSS kanaması, ilaçlar, bazı enfeksiyonlarda görülür.
Akut: <7 gün (bakteriyel – viral enfeksiyon)
Subakut: 7-14 gün (abse)
Kronik: 14 gün> (romatolojik hastalıklar, kanser, TB, kronik bakteriyel enfeksiyon)
Ateş Paternleri:
1)Sürekli: 38,5°C nin altına – normal aralığa düşmez. 24 saate dalgalanma 1°C den düşüktür.
Pnömoni, bakteriyel menenjit, üriner sistem enfeksiyonu.
2)Remittan(inişli-çıkışlı): 24 saatlik dalgalanmalar 2°C den fazladır. Normal aralığa düşmez. Sitokin
deşarjı olur, geri çekilir. Dalgalanmalar hızlıdır. Enfektif endokardit, sepsis, abselerin kana karışması
sonucu sepsiste gözlenir.
3)İntermittan(aralıklı): 24 saatlik sürenin bazı saatlerinde ateş vardır. Vücut ısısı normale döner. 1-2
gün sürer, normale döner, tekrar olur. Hastanın incelenmesi gerekir. Sıtma, subdiyafragmatik abse,
lenfoma, TB, kala-azar.
5
4)Rekürrens(tekrarlayan): 3-4 gün yüksek seyreder, birden normale döner. Birçok gün sonra tekrar
yükselir. Burada da hasta yatırılır. Lenfoma, borelioz, bruselloz da görülür.
5)Ondülon(dalgalı): Yavaş yavaş yükselir, birkaç gün yüksek kalır ve yavaş yavaş düşer. Bu durum
haftalarca tekrarlar. Bruselloz, Hodgkin ...
Ateş – nabız --> 1°C de en az 10 atım. İlaç ya da enfeksiyon kaynaklı. Bruselloz gibi olabilir. Tifo luların
%30-40 ında görülür.
38,3°C üzerindeki ateşlerde nabız genelde 90 ın üzerindedir.
Viral enfeksiyonlarda ateş olur. 39,5-40°C bakterilerde olurken, viral enfeksiyonlarda 41-41,5°C olur.
İMMÜN SİSTEM HASTALIKLARINDA KULLANILAN İLAÇLAR- Yrd. Doç.Dr. K. Gökhan Ulusoy
A)İmmünsüpresif İlaçlar
İmmünojene(transplante edilecek doku) maruz kalmadan önce kullanılmak. Red reaksiyonları,
otoimmün hastalıklar, psöriyazis ve atopik dermatit vb. hastalıkların tedavisinde kullanılır. 4
çeşittirler.
1)T Hücre Blokerleri: Siklosporin(organ naklinde önemli), takrolimus(daha az yan etki), sirolimus(yeni,
ilk olarak antifungal olarak);everolimus.
a.Siklosporin: Siklolifine bağlanarak kalsinörini inhibe eder. IL-2 gen aktivasyonunu önler. Oral
biyoyararlanımı düşük ve değişkendir(bireylerin karaciğer enzimlerine göre). Bu hastalarda daima ilaç
takibi yapılmalı(10-15 gün). Tedaviye başlamadan önce hedef doz belirlenmeli. İlaç etkileşimlerinden
etkilenir. 3 önemli özelliği vardır:
Treg fonksiyonunu etkilemez
Myelosupresyon yapmaz
Makrofajlara inhibitör etkinliği az olduğundan çoğunlukla prednizon(->KS) ile birlikte kullanılır
Reddin önlenmesi, GHVR, otoimmün hastalıklarda kullanılır. Oftalmik solüsyonları kornea nakillerinde
kullanılır.
Yan etkileri: Nefrotoksisite, HT, karaciğerde disfonksiyon, mental retardasyon(psikoz->KS lerde de
vardır), kanser insidansında artma.
b.Takrolimus: Etki mekanizması siklosporine benzer. İmmünofiline bağlanır. Siklosporinden daha
patenttir(siklosporin 50-500 mg=takrolimus 2-20 mg). Oral ya da IV özellikte. Solid organ(böbrek,
karaciğer) greftlerinde kullanılır. GHVR da da kullanılır. Tedavi cerrahiden önce kullanılmalıdır. Atopik
dermatit ve psöriazis(sistemik yan etkileri az) de topikal kullanılabilir. Toksik etkileri fazladır.
c.Sirolimus: Rapamisin olarak bilinir. Sadece oral, IV yoktur. T hücre proliferasyonunu engeller.
Biyoyararlanımı düşüktür. Organ transplantasyonunda profilaktiktir.
2)Glukokortikoidler: T hücre sitokin salınmasını, B hücrelerden de Ab salınmasını inhibe ederler.
Makrofaj, monosit, PMNL leri inhibe ederler. Lenfosit yıkımını artırırlar. Kompleman sistem
aktivasyonunu engellerler. En çok kullanılan immünosupresandır. Transplant reddinde ve GHVR da
diğer immünsupresanlarda kullanılır. Romatolojik hastalıklarda(RA, lupus), otoimmün hastalıklarda
(ITP) çok kullanılır. Doğal glukokortikoidler kullanılmazlar.
Prednizon ve prednizolon oral, orta ve yüksek dozlarda kullanılır. Metilprednizol un çok yüksek
dozları akut organ reddi süresince i.v. kullanılır.
6
Esas yan etkileri supresyon için gerekli olan yüksek dozlarında yaygındır. Cushing sendromu,
hiperglisemi, sekonder enfeksiyon, osteoporoz, kas güçsüzlüğü, psikolojik-mental.
KS ler çok etkilidir. Yan etkileri fazladır. Tüm immünolojik hastalıklarda kullanılabilir. Lokal
uygulandıklarında çok sıkıntı oluşturmazlar. Mutlaka doz yavaş yavaş artırılıp, yavaş yavaş
azaltılmalıdır. Ani kesilmelerde adrenal bezden aşırı salınımı gerçekleşebilir.
3)Sitotoksik ilaçlar(antiproliferatif): Çok seçici değillerdir. Bu yüzden en çok Kİ hücrelerine zarar
verirler.
Azatioprin --> Siklosporin ve/veya prednizon ile birlikte organ transplant reddi ve ağır RA de
Mikofenolat mefetil --> Siklosporin ve prednizon ile birlikte böbrek transplantları için
Siklofosfamid(en güçlü) --> İmmünolojik böbrek hast, kemik iliği nakli
Metotreksat --> GVHS profilaksisi. RA ( kan, ilaç düzeyi takip edilmeli)
Genelde diğer immünsüpresiflerle kullanılır. Kanser türüne göre değişik kombinasyon uygulanır.
4)Antikor Ajanlar
a.Antitimosit antikorlar:
Lenfosit/timosit Ig ler --> İnsan timik lenfositleri parçalar. T-hücre yanıtını inhibe eder.
Anti-CD3 monoklonal Ab --> Antijene bağlanmayı inhibe eder. T-hücrelerini yok eder.
Anti-Tac, Anti-CD25 monoklonal Ab --> IL-2 reseptorüne bağlanarak aktive olmuş T-hücrelerini inhibe
ederler.
b.Rh(D) Ig: IgG yapısındadır. Rh uyuşmazlığında kullanılır. Fetal kana maruz kalan anneye ilk 72 saat
içinde uygulanmalı.
İmmün supresyonlarda genelde --> siklosporin+prednizon ilk seçenektir.
Stentlerde tıkanıklığı önlemek için --> Sirolimus
B)İmmünstimülan İlaçlar(çok kullanılmazlar)
Genellikle immün yetmezliklerde kullanılır. Hem hümoral hem hücresel immünitede artış sağlanır.
Stimülasyon derecesi genelde azalır. 4 çeşittir:
1.Bakteri Derive Ürünler: BCG M. bovis in attenue türlerinden elde edilir. Makrofajlardan TNF-α
salınımını stimüle eder. Yüzeyel mesane kanserinde kullanımı onaylanmıştır. Hipersensitivite, şok,
ateş, titreme gibi istenmeyen etkileri olabilir.
2.Sentetik İlaçlar: Lenfosit, granulosit ve makrofajların bir takım faktörler tarafından stimülasyonunu
artırır.
3.IV Ig ler: Pasif immunizasyon. Genelde IgG kullanılır. Primer immun yetmezlikli hastalarda
replasman tedavisinde kullanılır
4.Sitokinler:
a)IFN lar: , , tipi vardır. Viral replikasyonu azaltır. İmmün yanıtı module eder. Düşük dozlara NK,
makrofaj ve sitotoksik hücreleri aktive eder.
7
IFN- --> AIDS-ilişkili Kaposi sarkomu, HPV ve HCV -> tek ve etkili tedavi
IFN- --> Multipl sklerozlu hastalarda atak sıklığı ve şiddeti azaltır
IFN- --> Kronik granülomatoz hastalıkların tedavisinde
Ateş, bitkinlik, başağrısı, kas ağrısı, GIS bozuklukları, KV problemler yapabilir.
b)IL-2 kullanımı: TH ve TC proliferasyonunu artırır. Diğer mediyatörlerin seviyesini artırır. Yüksek
oranda toksiktir. Ödem, hipotansiyon ve azalmış organ perfüzyonuyla birlikte görülen kapiller kaçış
sendromu yapabilirler.
c)CSF kullanımı: Özellikle anemi tedavisinde önemlidirler. Burada İmmünstimülan olarak da
kullanılabilirler. Kanser tedavisinde çok etkili değildirler ancak kemoterapi sonrası myeloid
supresyonu geri çevirirler, bazı immün kolonileri aktive ederler. Myeloid olmayan kanser türlerinde
kemoterapi sonrası enfeksiyon riskini azaltırlar. Kemik ağrısı başlıca yan etkidir. Splenomegali, ürik
asit artışı olabilir.
TÜMÖRLER İLE İlGİLİ GENEL TANIMLAMALAR VE ADLANDIRILMALARI-Doç. Dr. A. Hakan Çermik
Amaçsız, konağı kullanan, “kısmen” otonom bir gelişme gösteren, klonal olarak(bir hücreden
çoğalan). Kanser hücreleri büyüme, diferansiasyon, fonksiyon ve organizasyon yönünden diğer
hücrelerden farklıdır.
Diferansiasyon --> geliştiği hücreye benzemesi. Çok benziyorsa iyi, az benziyorsa kötü diferansiye.
Tümörün malign-benign olmasını tayin etmede yeterir olabilecek kriterdir.
Anaplazi --> hiç benzerlik yok
Displazi --> hücresel şekil bozukluğu var. Malign değildir. Geri dönüşümlü(uyarı ortadan kalkar).
Tümörler 2 parçadan oluşur:
Parankim --> Neoplastik hücrelerden oluşur. Benign tümörlerin parankimi normal hücrelere
benzer, kitlesel lezyon halindedir. Malign tümörlerde hücreler farklılaşmış, bozulmuştur.
Stroma --> Neoplastik olmayan hücrelerden oluşur. Tümörün büyümesi için destek bağ
dokusu, kan damarlarından oluşur. Stroma değişkenlik gösterebilir.
.
.
– Desmoplazi -> Fibröz stroma cevabıdır. O dokunun kanser olup-olmadığını anlamak için
kullanılır.
– Skiröz tümör -> Sert
– Medüller -> Yumuşak
Benign tümörler(-oma)
Mezenkimal kökenli: fibroma, kondroma, osteoma
Epitel kökenli:
o
o
o
Papillom -> Siğiller, epidermiste. Papil benzeri yapılar oluştururlar.
Polip -> Mukozal yüzeylerde, mide – bağırsak, aynı zamanda tubuler adenokarsinomlardır.
Kistodenom -> İçi sıvı dolu adenom. Kistin içeriğine göre:
– seröz kist adenom
– müsinöz kist adenom
– papiller kistadenom: seröz papiller ve müsinöz papiller kistadenom (Malign tümörlerde
papiller yapılar stromaya invazyon yapmıştır)
8
Malign tümörler
Mezenkimal kökenli(sarkom): fibrosarkom, liposarkom, leiomiyosarkom.
Epitel kökenli(karsinom):
Mikroskobik yapı --> adenokarsinom, yassı epitel hücreli karsinom.
Köken aldığı organ --> renal hücreli adenokarsinom, akciğerin yassı epitel hücreli karsinomu.
Malign tümörlerin mezenkim veya epitel diferansiasyonunun olmadığı durumlara az
diferansiye/indiferansiye karsinom/sarkom denir. Karsinomların bir kısmı indiferansiye hücrelerden
meydana gelir. Bunların köken aldığı hücreyi bulmak zordur.
Teratoma: her üç germ yaprağını temsil eden, farklı yöne diferansiye olabilen totipotent hücrelerden
gelişir. Tüm organların karışımı görülebilir. En sık overlerde görülür.
-blastoma eki: tümörün embriyolojik kaynaklı olduğunu gösterir. Medülloblastom, retinablastom,
nöroblastom.
Genel kurallara uymayan tümör adlandırılmaları
Malign tümörler: melanom, seminom, mezatelyom, gliom, lenfoma(Hadgkin ve Hadgin dışı da),
lösemi(tümü maligndir).
Benign tümörler:
Koristom --> Doğal lokalizasyonu dışında (ektopik) görülen ve mikroskobik olarak normal olan
yapılardır. Örneğin ince bağırsak mukozasının altında görülen pankreas dokusu.
Hamartom --> Doğal lokalizasyonunda tek bir organı oluşturan doku elemanlarının bir araya gelerek o
organ içinde meydana getirdikleri tümör benzeri yapılar.
Miks tümörler: Birden fazla parankim hücre tipinden oluşan tümörlerdir.
Tükrük bezi -----> Pleomorfik adenom
Malign mikst tümör
.
Meme -----> Fibroadenom
Malign sistosarkoma fillodes
.
Böbrek ----->
Wilms tümörü
BENİGN ve MALİGN TÜMÖRLERİN FARKLILIKLARI-Doç. Dr. A. Hakan Çermik
Benign tümörlerin genel özellikleri --> Lokalizedirler. İyi sınırlı, çevredeki dokuya yapışık değildir.
Yüzeydeki deri ve mukozada ülserasyon meydana getirmezler. Yavaş büyür. Genellikle ağrıya sebep
olmazlar. Çevre dokudan kapsül ile ayrılırlar. Tümör hücreleri iyi diferansiyedir. Mitoz nadirdir, varsa
normal mitozladır. Çevre dokulara invazyon ve infiltrasyon yoktur. Uzak dokulara metastaz olmaz.
Malign tümörlerin genel özellikleri --> Sınırları belirsizdir. Yüzeyindeki deri ve mukozada ülserasyona
sebep olabilir. Hızlı büyüyebilir. Ağrıya yol açabilir. Çevre dokulara invazyon gösterebilir. Metastaz
yapar.
Malign – Benign ayrımında 4 temel kriter vardır.
A)Diferansiasyon ve Anaplazi: Benign tümörler köken aldığı dokuya özgü yapı, normal hücresel ürün
sentezi devam eder(hormon vb). Malign tümörlerde anaplazi vardır(diferansiasyon yokluğu). Yapı ve
fonksiyon kaybı vardır.
İyi diferansiye, orta diferansiye, az derece diferansiye, indiferansiye(atipik mitozlar gözlenir),
anaplastik --> Gittikçe hücrelerin şekli değişir. Normal dokudan uzaklaşır. Çekirdek büyür,
hiperkromafine olur. N/S oranı büyür. Mitotik aktivite artar.
9
İyi diferansiye tümörler; kaynaklanmış olduğu dokuya benzerler. Genel olarak benign tümörler iyi
diferansiye tümörlerdir. Kötü diferansiye tümörler; farklılaşmış hücrelerden oluşur. Bir tümörde
diferansiasyon olmaması veya anaplazi malignitenin işaretidir.
Malign Tümörlerin Anaplazi Kriterleri: Pleomorfizm vardır(monoformik değildir). Nukleusta;
hiperkromatizm vardır ve N/S oranı artmıştır. Çekirdekler iridir. Mitoz oranı yüksektir ve atipik
mitozlar vardır. Tümör dev hücreleri bulunabilir. Özellikle tümör kitlesinin merkezinde iskemik nekroz
vardır. Kromatinler kaba ve nukleus membranında birikme eğilimindedir. Nukleuluslarda
büyümüştür. Mitoz, tümörün malign olduğunu göstermediği gibi neoplastik olduğunu da göstermez.
Atipik mitoz varlığı, malign neoplazilerin tipik özelliğidir. Anaplastik hücrelerin dizilimi belirgin ölçüde
bozulmuştur. Buna polarite kaybı denir. Büyük kitleler oluşturan tümör hücreleri disorganize anarşik
bir dizilim gösterir. Tümör dev hücrelerinin hiperkromatik, büyük nükleusları vardır. Bir veya birden
fazla polimorfik nükleus içerebilir.
Tümör diferansiasyon derecesi aynı zamanda köken aldığı dokunun kantite ve kalitesini belirler.
Köken aldığı dokunun işlevini azaltır ya da artırabilir. Örneğin endokrin bezlerin benign tümörleri ve
iyi diferansiye karsinomları o bezin özgün hormonunun salgılanmasını devam ettirir. Bunun yanında
karaciğer karsinomlarında fetal proteinlerden -fetoprotein salınımı görülebilir. Ayrıca ektopik
hormon salınımıda görülebilir. Örneğin bronkojenik karsinomda ACTH, insülim, glukagon salınımı
olabilir.
B)Tümör Büyüme Hızı: Benign tümörler yavaş büyür, yıllar sürer. Malign tümörler hızlı büyür, yayılır
ve konakçıyı öldürür. Tümörün büyüme hızını proliferatif fazdaki hücrelerin sayısı belirler. Tümörün
doubling hızı burada önemlidir. Bu tümörün 1 cm den 2 cm ye çıkması için geçen süredir. Bu süre
köken aldığı dokuya, kanser türüne göre değişiklik gösterir. Bunun yanında proliferasyon havuzundaki
tümör oranı ve büyüyen lezyondaki hücrelerin dökülme ve kaybedilme oranı da tümör büyümesinde
önemlidir.
Tümör büyümesinin erken fazında büyüme fraksiyonu yüksek, tanı sırasında düşüktür. Tümör
büyüdükçe tümör hücrelerinin replikasyon havuzunu terk etme nedenleri: dökülme, besin yetersizliği,
apopitozis, diferansiasyon, G0 a dönüş.
Maligniteyi belirlemek için mikroskopta görülen alanlarda mitoz sayısı hesaplanır. Aynı zamanda
atipik mitoz varlığıda çok önemlidir.
C)Lokal İnvazyon: Benign tümörler kaynaklandıkları organ ve dokuda sınırlı kalır. Komşu organ ve
dokulara metastaz yapmazlar. Çevre dokudan düzgün bir kapsülle ayrılırlar(kapsül her zaman
olmayabilir). Malign tümörler çevre doku organlara yayılırlar. Çevre dokunun yerini alabilirler ve
yerleştikleri dokuda harabiyet oluştururlar. Kapsülleri yoktur.
İnvazyon
Hiperplazi, hipertrofi de olabilir.
Normal mukoza ------> Metaplazi -----> Displazi -----> Karsinoma in situ ------>Karsinom ------> Metastaz
Barett özofagusta gözlenir.
Squamoz epitel kolumnar
epitele dönüşür.
Kanserin ilerlediğini
göstermez. Geri dönüşlüdür.
Etken kalkınca düzelir. Epitel
hücrelerinde polarite kaybı,
pleomorfizm, hiperkromazi,
N/S artışı, mitoz vardır. Hafiforta-şiddetli olabilir.
10
Displastik hücreler tüm mukozayı
doldurmuştur. Bu hücreler bazal
membranı aşıp invazyon yapması ile
karsinom gelişir. Malign tümöre ait
tüm özellikler vardır. Bazal membran
sağlamdır.
D)Metastaz: Malign-benign tümör ayrımında en önemli kriterdir. Benign tümörler metastaz yapmaz.
Malign tümörler birkaç istisna dışında(SSS tümörleri-glioma-, bazal hücreli karsinom) hepsi metastaz
yapar. İyi diferansiye çok küçük tümörlerde de yaygın metastaz olabilir.
Troid papilom kanseri--> boyun LN prostat kanseri--> vertebralara gibi. Çok agresiv bir tümörde
metastaz görülmeyebilir(glial tümör gibi). Bazı tümörlerin bazı dokulara tropisi vardır.
Metastaz 3 yol ile olabilir; vücut boşlukları ve yüzeylerine ekilme ile yayılım, lenfatik
yayılım(karsinom), hematojen yayılım(sarkom).
Malign invaziv/Benign ekspansif
Bunların yanısıra vücut boşlukları ve yüzeylerine direk yayılımda olabilir: periton, plevra, perikard,
subaraknoid, eklem boşluğu.
Tümörlerin periton boşluğuna açılıp salgı yapmasına psödomiksoma peritonei denir(mukus salgılayan
over veya appendiks karsinomları).
Lenfatik yayılım --> Kanser yayılımının en sık yolu. Lenfatiklerde kollateraller vasıtası ile farklı
yayılımlar olabilir. Örneğin sağ meme tümörü, sol aksiller LN larına yayılım gösterebilir. Occult
mikrometastazlar çok olur. Occult mikrometastaz, LN nda 1-2 tane tümör hücresinin görülmesidir.
Lenfatik yayılımda bazen atlayan metastazlar görülebilir(normal drenajdan farklı olarak). Bu venözlenfatik anastomoz, inflamasyon ve radyasyondan olmaktadır.
Hematojen yayılım --> Sarkomlarda çok görülür ancak karsinomlarda da görülebilir. Venöz tutulum
daha sıktır. Primer tümörün bulunduğu bölgede histolojik olarak küçük damar tutulumunun
görülmesi, olumsuz prognostik faktördür ancak metastaz olmayabilir. Metastaz en az iskelet kası ve
dalakta görülebilir.
KANSER SEMPTOMATOLOJİSİ-Yrd. Doç. Dr. Şükrü Özaydın
Kanser genelde kansere neden olan etkene maruziyetin sonucunda oluşur(sigara gibi). Bu durumda
kanser hücresi immün sistemden kaçar, apopitoza yönlendirilemez, organizma baş edemez hale
gelince kanser oluşur. Kanser etyoloijisi bununla sınırlı değildir. Konjenital mutasyonlarda söz
konusudur(over, meme gibi).
En çok KVS hastalıklarından sonra kanser gelir. Çok etnik
Erkeklerde en çok: akciğer(öldürücülüğü fazla), prostat, mesane, kolon, mide.
Kadınlarda ise: meme(görülmesi fazla ama ölümleri az, bunun sebebi taramadır, erken evrede tespit
edilebiliyor), troid, kolorektal, mide, uterus.
1.Kitle:
Bacakta(asimetrik) şişme-ağrı --> osteosarkom
Dispne, hemoptizi --> akciğer
Batında büyükçe kitle --> uterus
Memede kitle-ülser --> meme kanseri
Kusma, bulantı, baş dönmesi --> beyin
2.Ağrı: Organların parankiminde değilde zarlarında gelişen tümörler ağrı oluşturur. Duvarda gerilim
olunca oluşur. Kemikte de periostta oluşursa gerçekleşir(çünkü sinirler burda bulunmaktadır). Bu
hastalarda şiddetli ağrı oluşur. %20 lik kesimin ağrısı dindirilemez.
3.Kilo kaybı: Son 6 ay içerisinde %10 dan fazla kilo kaybı varsa bu anlamlıdır.
11
4.Ateş: Lösemi ile lenfomalarda(bazen myelomlarda da ) ateş çoğunlukla bulunur. Lenfomada
boyunda kitle, kilo kaybı, gece terlemesi ve ateş genellikle bulunur. 38°C nin üstünde olmalı ve
tümöre spesifik olmalıdır. Başka bir enfeksiyon kaynaklı olmamalı. Karaciğer metastazlarında da ateş
görülebilir.
5.Halsizlik: Tedaviden sonra olabilir(uzun zaman geçmesine rağmen).
6.Cilt değişiklikleri
7.Kanama adına: Mide, kolon kanserlerinde hematemez, mesane kanserlerinde hematüri, akciğer
kanserlerinde hemoptizi görülebilir.
8.Disfaji: Tümörün büyüyüp özofagus un 3 te 2 sini kapatması ile olur.
9.Öksürük
10.Ses kısıklığı
11.Dispne
Kitle
Meme --> 50 yaşından sonra 2 yılda bir mammografi ile yakalanabilir. T1–T2 safhada görülebiliyor.
Kemik --> Genç, ağrısı ve ısı artışı varsa şüphenilmelidir. Simetriği ile kıyaslanmalı.
Testis --> Primeri bilinmeyen metastatik kanser. (simetrisi olan organlarda görmek kolay).
Lenf nodu --> Lenfomada boyundan şişlik olur. Bu şişlikler 1 cm üzerinde ve oval-yuvarlak olmalıdır.
Lenfomada ateş, gece terlemesi ve kilo kaybıda aranır.
Baş, boyun --> Buraya metastaz yapmışda olabilir. Supraklaviküler lenf nodlarının şişmesi %50
oranında kanserdir.
Yumuşak doku --> Çok büyük kitleler oluşturabilir.
Böbrek --> Çok çabuk büyüyen tümörler olabilir.
Cilt --> Melanomlar kitle oluşturur. Cilt kanserlerinde genelde iyileşmeyen yaralar da olur. Bunun
yanında cildin bazal hücreli ve squamoz hücreli kanserlerinde de iyileşmeyen yaralar olur.
Troid --> Nodüller.
Sol supraklaviküler LAP --> Mide, kolon, üriner kanserlerde.
Paraumblikal LN tutlumu --> Sister mary joseph nodulu
Mide kanseri --> Sol aksiller LN tutulumu(İrish nodulu)
Ağrı
Kişiye göre değişir. Tümörlerin sinir invazyonu ile de ortaya çıkabilir. Genelde visseral organların
zarlarının gerimi ile ortaya çıkar. Tedavi amaçlı verilen ilaçlarla da ağrı oluşur(sinir harabiyeti sonucu).
Somatik, visseral ve sempatik kaynaklı olabilir.
Ağrı iki çeşit yol ile oluşabilir:nosiseptik ve nöropatik. Nosiseptik ağrı, somatik ya da visseral kaynaklı
olabilir. Keskin, iyi lokalize olmuş, zonklayıcı ve basınç benzeri olan somatiktir. Sıklıkla cerrahi sonrası
ve kemik metastazı ile gelişir. Visseral ağrılar daha yaygın, ağrılı ve kramp şeklindedir. Bası,
infiltrasyon veya abdominal organ distansiyonu sonucu oluşur. Nöropatik ağrı, tümör ya da ilaç
kaynaklı olabilir. Periferal ve santral sinir sistemi hasarlanması sonucu oluşur. Yanma ve batma
şeklinde olur.
İleri evrede %75-90 oranında görülebilir. %20 ağrı çözülmez.
Bazı merciler ağrıyı 5 vital bulgu içine alırlar. Bunlar ateş, nabız, solunum, tansiyon, ağrı.
Ağrının %70-90 ı kontrol altına alınabilir.
12
Kilo Kaybı
Hastaların %40-60 ında gözlenir. İleri evrede %80 oranında görülür. Bu durumlarda kaşektik bir
durum da olur. Bazen ilk semptom da olabilir. Ölümlerin %20 si kilo kaybından olur. Kanser hastaları
çok iyi beslenmelidir. Ağız olmazsa IV yoldan. En ciddi malnütrisyon kanser hastalarındadır.
Ateş
Lösemi, lenfoma, böbrek kanseri ve karaciğer metastazlarında görülür. PGE2 üretiminde artış
vardır(bunun yanında IL-1;6, TNF-α, IFN-). 40°C üstündedir. Semptom ve bulgular sessizdir(titreme,
taşikardi, hipotansiyon görülmez). Tümör dışı ateş dışlanmalıdır(enfeksiyon olmamalıdır).
Yorgunluk
Tedaviden sonra ortaya çıkabilir. Subjektiftir. Uyku ve dinlenme ile düzelmez. Kanser tedavisi, anemi,
kaşeksi, metabolik bozukluklar(hipokalemi gibi) sebep olabilir. Hastada bitkinlik, kuvvetsizlik,
tükenmişlik, uyuşukluk vb. semptomlar olabilir.
Cilt değişiklikleri
Hiperpigmentasyon
Eritem
İyileşmeyen yara
Sarılık
Kanama
Hemoptizi --> akc
Hematemez --> mide, kolon-genelde solEpiteksis --> nazofarinks kanseri
Melana --> gaytanın simsiyah, kötü kokulu çıkması
Hematüri --> mesane, bazen böbrek
Menore --> menopozdan sonra ise uterus kanseri
Öksürük --> Akc kanseri
Ses kısıklığı --> Tümörün laringeal sinirlere bası yapması sonucu oluşur
Yan ağrısı --> Plevra tutulumlarında olur
Dispne --> Anemi, pnömoni(yaşlı ve sigara içiyorsa ya da akc kanserinde de olabilir), plevral
efüzyonda, sağ akc tümöründe, Vena kava süperior bası sonucu Vena kava süperior sendromunda,
cerrahi sonrası vb. durumlarda oluşur.
Perikardiyal efüzyonda --> çadır kalp görünümü
V.C.S. sendromu --> Sağ akc kanseri v.c.s. a bası yapar. Yüz, üst ekstremite de ödem oluşur.
Disfaji --> Özofagus kanserinin lümenin 2/3 ünden fazlasını kapatması ile olur.
Odinofaji --> Yemek yedikten sonra retrosternal ağrı hissetme.
13
KANSER TANI VE TAKİBİNDE LABORATUAR-Prof. Dr. Taner Özgürtaş
Kanserler:
Bir organa lokalize olarak –> %90-95
Komşu dokulara yayılım –> %70
Uzak dokulara metastaz –> %20-25
İdeal kanser marker ı sadece tümörlü vakalarda yükselmeli ve erken evrede artmalı. Ancak markerlar
non-malign dokularda da sentezlenmeli ve yavaş salınmalıdır. Hiçbir marker ın duyarlılığı yüksek
değildir.
Tümör marker çeşitleri:
Hormonlar –> HCG
Enzimler –> PSA
Proteinler ve Glikoproteinler –> CA 125, CA 15.3, CA 19.9
Onkofetal antijenler –> CEA, AFP
Reseptörler –> ER, PR, EGFR
Genetik değişiklikler –> mutasyonlar, translokasyonlar
Proteomik ve diğer omik değişiklikler
Tarama maksatlı kullanılmaz. Tanı koymada kaçınılır. Monitorizasyon ve hastalığı takip için(tedaviye
yanıt) kullanılabilir.
Tarama, diagnoz, prognoz, tümör evreleme, primer tümör lokalizasyonu sınırlıdır.
Onaylı Tümör Markerları:
.
Serum/Plazma
Prostat kanseri
Meme kanseri
Over kanseri
Kolorektal kanser
Pankreatik kanser
Testiküler kanser
Hepatoselüler kanser
Mezotelyoma
Kanıt derecesi –> I
Uzman görüşü –> A
PSA
CA 15.3/CA 27.29, HER-2/neu
CA 125, HE-4
CEA
CA 19.9
AFP
AFP-L3, DCP
SMRP
En iyi marker
TCN
Tümör markerları kullanılacak pek fazla alternatif
olmadığı için kullanılır.
Tümör kanserinde tümör marker ölçümü zorunludur.
CAE-125 --> tek önerilir serum marker --> over kanserinde
. CAE -->
“
--> kolorektal kanser
.
CA 19-9 --> Prognoz için ; I-A olmasına rağmen prognoz çok hızlı olduğu için kullanılmaz. Yeterli
zaman yoktur. Bulunması prognoza bir katkısı da olmaz.
Karaciğer kanserinde AFP tek serum tümör markerıdır.
Bu markerler doğru ölçülse bile, onları etkileyen çok sayıda faktör vardır(örneğin PSA için tuşe).
14
Tarama amaçlı kullanılmazlar(istekli hastalarda kullanılır). Yüksek riskli bireylerde. Tanı konmuş
hastaların monitörizasyonunda.
PSA: 0-4
2.5 –> Tümör dışlatmaz
8 –> Tümör dedirtmez. Benign prostat hipertrofisi.
KANSER EPİDEMİYOLOJİSİ ve KORUNMA-Doç. Dr. Türker Türker
Vücuttaki normal hücrelerin vücut bütünlüğünde bir görevi varken kanser bu bağlamın dışındadır.
Kendi kafasına göre hareket etmekte, amaçsız şekilde çoğalmaktadır. Çok görüldüğü için çok öldürür.
Kronik bir hastalıktır. En yaygın önlenebilir 2. sıradaki kronik hastalıktır.
Yıllar içinde enfeksiyonlar azaldı, yaşlı nüfus ve kronik hastalıklar arttı. Enfeksiyonlar genel hijyen
koşullarının artması, atıkların uzaklaşması, antibiyotiklerin çıkması, aşılar, suların Cl lanması, barınma
sağlığı artması sonucu azalmıştır. Beklenen yaşam süresi uzadı. Bu yüzden kanser insidansı artış
göstermektedir.
Kronik hastalıkların artması:
1)Yaşam biçimi değişiklikleri –> Sigara, alkol kullanımı, hareketsiz yaşam, hayvansal gıdalarla
beslenme, ayak üstü yeme alışkanlığı.
Soru
olabilir
2)Çevresel etmenler –> Hava kirliliği, kimyasallar, katkı maddeler.
Kronik hastalardan korunma:
1)Hastalık nedenlerinden korunma(primer tedavi-etken vücuda girmeden) –> Sigara içilmemesi,
lifli-posalı gıdalarla beslenmenin artırılması, düzenli fizik egzersiz yapılması.
2)Hastalığın erken dönemde saptanması –> Sekonder koruma.
3)Zamanında ve uygun tedavi yapılması.
4)Tedavi sonu izleme.
Kanserli hastaların sürekli kontrol edilmesi ve ilaçları alması halinde 5 yıllık sağ kalım garantisi verilir.
Elde veriler(analizlerle) kullanılarak 20-30 sene ilerisi için veri oluşturma-grafik hazırlamaya
projeksiyon denir.
Toplam doğurganlık oranı 2,1 dir. Toplam Doğurganlık Hızı (TDH), 18-45 yaş arasındaki bayanların
çocuk sahibi olma oranını yansıtır. Ülkenin yenilenme hızı ile doğrudan ilişkilidir.
Kanser tipi sıklığı : Akciğer
.
Meme
.
Kolon
.
.
Erkek: Akciğer
Prostat
Kolorektum
Mide
Karaciğer
Kadın: Meme
Kolorektum
Akciğer
Serviks
Mide
Enfeksiyon – Kanser –> HPV(serviks kanseri), HBV – HCV(karaciğer kanseri)
Kanserin bilinen risk faktörleri:
Sigara
Diyetle ilgili faktörler
Obezite
Egzersiz
Meslek
Genetik yatkınlık
Enfeksiyon ajanları
Radyasyon
İlaçlar
Sosyoekonomik durum
15
Soru olabilir
Soru
olabilir
Kanser ölümlerinin 1/3 ü 5 risk faktörüne bağlıdır:
Yüksek BKİ
Düşük meyve ve sebze alımı
Fizik aktivite eksikliği
Tütün kullanımı
Alkol kullanımı
Soru olabilir
Primer Korunma (Risk Faktörlerinin Kontrolü)
Kanser eğitimi & mevzuat düzenlenmesi
Tütün – alkol önleme ve bırakma
Diyet: yüksek lifli, düşük yağlı, meyve ve sebzeler
Kilo kontrolü
CYBH önleme ve kontrolü
Güneş ışınlarına /radyasyona maruziyetin takibi
Risk faktörlerinin kontrolü
Soru olabilir
Meme kanseri –> 10 yaşından sonra her yıl mamografi ve klinik meme muayenesi.
Prostat –> 50 yaş üstü, PSA ve rektal tuşe/yılda
Kolorektal kanser –> Gaytada gizli kan testi her yıl
.
Fleksibil sigmoidoskopi 5 yılda bir
.
Çift kontrast baryum grafi 5 yılda bir
.
Kolonoskopi her 10 yılda
Akciğer kanserinde tomografi ile takip –> Takibe devam edilsin mi yoksa radyasyon daha mı kötü
yapar şüphesi vardır. Kontrol için hem iyi hem kötü yanı vardır.
TÜMÖR GELİŞİMİNDE MOLEKÜLER ve GENETİK BOZUKLUKLARIN ROLÜ-Doç. Dr. A. Hakan Çermik
Çeşitli karsinojenik uyarılar sonucu DNA üzerinde şu değişiklikler meydana gelebilir: nokta mutasyonu
translokasyon, amplifikasyon. Bunun sonucunda hücreler transforme olarak kanser hücresine
dönüşürler. Kanser tek bir progenitör (kök) hücreden oluşur. Buna monoklonal çoğalım denir.
Sonuçta kanser dokusu tek tip hücreden oluşur. (Bazen farklı hücre çeşitlerinden de oluşabilir)
4 grup gen vardır ki bunlar hücre büyümesini, hücrenin tüm siklusunu düzenlerler
Proto-onkogen = Dominant kalıtılır. Hücre büyümesini ve diferansiyasyonunu sağlarlar.
Tümör supresör genler = resesif = DNA tamiri ve mitozun durdurulması
Apopitoz regüle eden genler = dominant veya resesif = Hücre ölümünü sağlayan gen
ürünlerinde azalır.
DNA tamirinden sorumlu genler = resesif = Tamir gen ürünlerinde azalma.
Tümör oluşumu esnasında driver (ana) mutasyonun yanında ek mutasyonlar da gerçekleşir. Bu
mutasyonların birikimi sonucu tümör heterojenite kazanır, daha dirençli hale gelmesini sağlar.
Malign tümörler dış uyarana gerek duymazlar. Gelişmeyi inhibe eden uyarılara duyarsızlardır.
Apopitozdan kaçarlar, sınırsız bölünme yetenekleri vardır. Anjiogenezi uyarırlar. İnvazyon ve metastaz
yaparlar. İmmün yanıttan kaçma yetenekleri vardır.
Kanser oluşumunda genetik mutasyonların yanı sıra epigenetik değişikliklerde katkı sağlar. DNA
metilasyonları ve histon modifikasyonu bu süreçte rol oynar.
16
Hipermetilasyon = Tümör supresör genlerin inaktivasyonu
Hipometilasyon = Protoenkogenlerin aktifleşmesi
A)Proto-Onkogenler: Normalde hücrenin büyümesi ve farklılaşmasını düzenleyen proteinleri
kodlayan genlerdir. Mutasyonla onkogen ahline dönüşürler. Onkogenlerin kodladığı proteinlere
onkoprotein denir. Onkogenler 2 şekilde aktivite gösterir.
a) Fonksiyonel bir proteinin sayısal artması(nicel)
.
-Gen düzeyinde kopya sayısında sayısal artış(amplifikasyonu)
.
-Gen ürünü proteinin sayısal artışı (over-ekspresyon)
b) Mutasyon sonucu modifiye protein üretimi(nitel)
.
-Proteinin yeni fonksiyon kazanması
Onkogenler 3 yol ile oluşabilir: nokta mutasyonu(faz değişimi sonucu oluşur), gen amplifikasyonu(mRNA artışı), kromozomal değişiklikler(delesyon, inversiyon).
Onkoproteinler hücre büyümesi–bölünmesinde 5 noktaya etki ederler:
1)Büyüme Faktörleri: Büyüme faktörlerini kodlayan genlerdeki mutasyon sonucu otokrin veya
parokrin etki ile hücrenin büyümesinin uyarılmasıdır. Aynı zamanda bu hücrelerde mutasyon riski de
azalmıştır. Örneğin HGF (Hepatosit growth faktör) overekspresyon sonucu hepasellüler karsinoma
oluşur.
2)Büyüme Faktör Reseptörleri: Normalde ligand ile aktive olan reseptörler; mutasyona uğradığında
uyarı olmadan devamlı olarak mitojenik sinyalleri tetikler.
ERBB1→EGFR kodlar. Mutasyonunda akciğer adenokarsinomu görülür.
ERBB2→HER2 (c-erbB-2) kodlar. Mutasyonunda meme ca oluşur. Mutasyon sonucu sayıları(normalde
20 bin) 1-2 milyonu geçebilir.
EML4-ALK füzyon geni→EML4-ALK protein. Mutasyonunda akciğer adenokarsinomu
Büyüme faktör reseptörleri→antikor verilerek immünflorasan mikroskopta gözlenebilir.
Mikroskobide sentez arttıkça yeşil görünüm oluşur. Daha sonra derecelendirilmeye sokulur.
RET→Nörotrofik faktör reseptörüdür. Mutasyonunda MEN (modüler troid karsinomu en önemlisi) 2A
tümörü oluşur.
3)Sinyal İleti Proteinleri: En sık trozin kinaz reseptör yolağı mutasyona uğrar. RAS en önemli sinyal
iletim proteinlerindendir(%30’unda kanserlerin bu mutasyon vardır)→en sık anormallik RAS’ın
genindedir. Guanezin trifosfat aktivitesi ile baskılanır. GAPS genlerindeki mutasyon RAS’ı daima açık
tutar. GAP, NF-1 geni ile kodlanır. Pankreas-biliyer sistem tümörlerinde %90 oranında karşılaşılır.
RAS yolak esnasında ikiye ayrılır:
RAF ve P13K. B-RAF mutasyonu(RAF geninde mutasyon) en çok malign melanomda görülür.
P13K→PTEN, P12K/AKT yolağını frenler. Mutasyonunda endometrial ca. P13K mutasyonunda enzim
artışı sonucu meme ca oluşur.
JAK/STAT yolağı→(KIT mutasyonunda) myeloproliferatif hastalıktır.
WNT sinyal iletimi→ β-katenin geni tarafından kodlanır. Hepatosellüler karsinom, hepatoblastom
gelişebilir.
17
KRAS, NRAS→nokta mutasyonu ile kolon, akciğer, pankreas tümörleri oluşabilmektedir.
4)Nükleer Regulatör Proteinler: myc proteini esas rol oynar. Aşırı ekspresyonunda neoplastik
transformasyon görülür.
C-MYC→translokasyon sonucu Bukitt lenfoma t(8:14)
N-MYC→amplifikasyon sonucu nöroblastoma
L-MYC→amplifikasyon sonucu akciğer küçük hücreli karsinomu
5)Hücre Siklus Regülatör Proteinler
Siklin ve siklin bağımlı kinazlar→Hücre siklusunu yöneltirler.
-Siklinler; D, E, A, B
-Siklin bağımlı kinaz→CDK4, CDK6, CDK2, CDK1
Siklin D + CDK4 –> en önemlisi
-CDK inhibitörleri→p16, p15, p18, p19, p21(p53), p27, p57
-Hücre siklus kontrol noktası komponentleri→RB (G1->S), p53 (G2->S)
Hücre Siklus İnhibitörleri;
-CIP/KIP ailesi (CDKN1A-D), p21, p27(büyümeyi engeller)
Siklin ve CDK kompleksine bağlanarak hücre siklusunu durdururlar.
-INK4/ARF ailesi (CDKN2A-C)
p16/INK4a, siklin D-CDK4 bağlanarak RB etkisini inhibe ederler
p14/ARF, MDM2 aktivitesini baskılayarak p53 seviyesini arttırır
Hücre siklus kontrol noktası komponentleri:
-RB (tümör supresör protein)→ G1-S geçişini durdurur. Diferansiyosyonda görev alır.
-p53→MDM2 tarafından (-) olarak regüle edilir. p21 üzerinden hücre siklusunu durdurur. Eğer
durduramaz ise apopitozu indükler(ya da DNA onarımını gerçekleştiremez), proapopitotik gen (BAX)
üretimini artırır. G1/S noktası için gerekli G2/M noktası için ana komponenttir.
Siklinlerden→Cyelin D1, Cyelin E mutasyonların sonucu mantle hücreli lenfoma oluşur. T(11,4)
Siklin bağlı kinazlardan→CDK4 mutasyonu sonucu glioblastoma, melenom oluşur.
Önemli Protoonkogen Mutasyonları ve Oluşan Tümörler
Reseptör
HER, ERB2→amplifikasyon sonucu meme ca
. RET→nokta mutasyonu sonucu MEN2a
Sitoplazma
RAS→Nokta mutasyonu sonucu kolon, lösemi ca
Ab1→translokasyon sonucu(t 9:22) KML (Kronik Myeloid Lösemi)
18
Nukleus
c-myc→(t 8:14) Burkitt lenfoma
n-myc→amplifikasyon sonucu nöroblastoma
Kromozamal translokasyonlar sonucu oluşan tümörler slayt: 46
B)Tümör Süpresör Genler (Anti-Onkogenler): Tümör oluşumu için her iki kopyanın da
kayıp(homozigot kayıp) olması gerekir. DNA tamir ve hücre bölünmesini durdurma görevleri vardır.
Tümör süpresör genler ve protein ürünleri:
-Mitojenik sinyal yolu inhibitörleri→
APC→ailesel kolon polipleri ve karsinomu
NF1→nörofibromatozis tip1
NF2→nörofibromatozis tip2
PTCH→medullablastom, benign tümör
PTEN→Bening deri, GIS, SSS tümörleri
SMAD2, SMAD4→juvenil polipozis
-Hücre siklus inhibitörleri→RB(ailesel retinablostama sendromu)
.
CDKN2A(p16, p24) Ailesel melanoma
-Metabolizma artırıcı ve anjiogenezis inhibitörleri→VHL, STK11, SDHB, SDHD (ailesel paraganglioma,
feokrasitoma)
-İnvazyon ve metastaz inhibitörleri→CDH-1 (E-kaderin) (ailesel gastrik kanserler)
-Genom stabilite bozukluğu→TP53
-DNA tamir faktörleri→BRCA-1, BRCA-2→Ailesel meme ve over kanserleri, erkek meme kanseri
.
MLH1, MSH2, MSH6→Herediter nonpalpozis kolon karsinomu.
-Mekanizması bilinmeyen →WT-1, MEN
Retinoblastomada familial form ve sporadik form vardır. Familial(%40) formda bir alelde mutant diğer
alelde sağlam olan Rb genlerinin mutasyon sonucu her iki alelde mutant olmasıdır. Sonuçta
retinoblastoma ortaya çıkar. (Hastalığın ortaya çıkması için her iki alel de mutant olmalıdır. Sporadik
formda sağlam olan her iki alelin, üst üste, ayrı ayrı mutasyonları sonucu her iki alelin de mutant hale
gelmesi ve hastalığın ortaya çıkması söz konusudur. Buna Krausen iki vuruşta onkogenez hipotezi
denir.
Nükleer Transkripsiyon ve Hücre Siklusunu İnhibe Eden Proteinler
1) Rb geni: pRb-P→Serbest E2F transkripsiyon proteinİ → DP grubu proteinler→ Rb, histon
.
.
hipofosforile
deasetilaz enzimi ile
.
trasnkripsiyonu inhibe eder
pRb-P hiperfosforile→Serbest E2F transkripsiyon proteini + DP grubu proteinler→S fazı genlerinin
transkripsiyonun aktivasyonu
Gen delesyonu ile pRb kaybı sonucu, hücre siklusu üzerinde moleküler frenler ortadan kalkar.
Hücreler kontrolsüz olarak S fazına girer. Rb sadece ilk kontrol noktasını (G1→S engeller). p53 ise
siklusun tüm basamaklarını engeller.
19
Rb geninin antiproliferatif etkisinin ortadan kalkmasının nedenleri→
–
–
–
–
Rb→mutasyon sonucu inaktivasyonu
CDK4-siklin D→gen amplifikasyonu sonucu aktivasyon
p16(CDK inhibitörü)→kayıp sonucu inaktivasyon
viral onkoprotein (HPV-EZ) bağlaması sonucu Rb inaktivasyonu
p16, siklin D ya da CDK4’de mutasyon gösteren hücrelerde Rb geni mutasyona uğramasa da
fonksiyonu bozulur.
2) p53 geni ve p53 proteini: İnsanlarda oluşan tümörlerin %50 sinden fazlasında bulunur. Sempatik
hücrelerde p53 geninin her iki alelinde de mutasyona uğraması sonucu oluşur. Hemen hemen her
kanser tipinde görülebilir.
Li-Fraumeni sendromu→kalıtımsal bir mutant alel + ikinci alelde somatik mutasyon sonucu oluşur. 50
yaş öncesinde malign tümör gelişimi normal bireylere göre artmıştır. Multipl (meme, lösemi vb.)
tümörler gözlenebilir.
p53 fonksiyonları→
–
–
–
–
Hücre bölünmesini durdurma→p21(CDK inhibitörü) ile
DNA onarımı→onarım genlerini aktive eder
apoptozis→Box proteinini arttırarak
Tümör anjiogenez inhibisyonu→Trombospendin-1
p53 DNA hasarında tetiklenince, siklus G1 fazında duraklamaya ve DNA’yı tamir eden genleri harekete
geçirerek DNA tamirine yardımcı olur. DNA’sı hasarlanmış ve tamir edilemeyen bir hücre ise p53
tarafından apopitozise yönlendirilir.
p53 homozigot kaybı (her iki alelde de)
HPV-E6 bağlanması, ortadan hızlı kaldırma→DNA hasarı tamir edilemez. Bölünen hücrelerde
mutasyonlar sabitlenir. Sonuçta neoplazmaya doğru dönüşüm başlar.
Sinyal İletimini İnhibe Eden Proteinlerin Hasarında Oluşan Hastalıklar
1) NF-1 geni: NF-1, tümör süpresör geninde mutasyon vardır. Multipl benign nörofibromlar vardır.
Sütlü kahve lekeleri, iris hematomları vardır, fibrosarkom riski artmıştır.
2) APC geni ve APC proteini: APC proteini β katenini tutar. Serbest bırakmaz. Bazen bırakır(APC
mutasyonu, β-katenini devamlı aktif hale getirir) ve hücre bölünme sinyali alır. Her iki alelde genin
mutasyonu sonuca erken yaşlarda kolonda çok sayıda adenomatöz polip oluşur. Bazı polipler
transformasyona uğrar ve kolon kanserine dönebilir. Bunun yanında APC mutasyonu olmadan da
WNT yolağı ile β-katenin nükleusa girer ve hücre bölünmesini uyarır.
C)Apopitozu Regüle Eden Genler:
Mlc-1, Blc2(hemapoietik ve solid tümörlerde fazladır)→ apopitozu inhibe eder
Bak-Bax→apopitozu uyarır→apopitoz ekstrensek(TNF-, Fas-Fasl) ya da intrensek(kanser
hücrelerinde intrensek baskın) yol ile olabilir. İnstrensek yol ile mitokondri sitokrom enzimleri salınır.
Bu proteinlerde kaspaz sistemini aktive eder. p-53 Bax’ı kullanarak apopitozu indükler. (p53, c-myc
mutasyonu sonucu oluşan tümörlerde de apopitozu uyarır)
Blc-2 genindeki mutasyonlar hücrelerin apopitozisini önler. Örneğin lenfositlerde B-lenfosit birikimi
olur. LAP ve kemik iliği infiltrasyonu gerçekleşir. Β hücreli folliküler lenfoma oluşur.
20
D)DNA Tamirinde Sorumlu Genler: DNA tamirinde rol oynayan genler; hMSH-2, BRCA-1, BRCA-2. Bu
genlerin anormallikleri normal hücre bölünmesi sırasında diğer genlerde oluşabilecek mutasyonlara
izin verir(genom instabilitesi). Genom instabilitesi, tipik olarak bu genlerin her iki kopyasının da kaybı
durumunda gelişir.
DNA tamirinin yollarında hasar:
Yanlış eşleşme tamiri→Herediter Non-polipozis kolon kanseri sendromu (HNPCC)
Nükleotid eksizyon tamiri→Kseroderma Pigmentozum
Rekombinasyon tamiri→bloom sendromu, ataksia telenjektozia, Fanconi anemisi, ailesel
meme kanserleri
HNPCC (Lyneg Sendromu): MLH1,MSH2, MSH6, PAS2 genlerinde mutasyon vardır. Sağ kolonda
kanser oluşur. Kanser poliplerinden değil, yeniden başka bir alanda gelişir. Diğer kanser türleri (over,
mide, beyin, ürotelyal) riski artmıştır.
Kseroderma Pigmentozum: UV ışığına hipersensitivite sonucu deri kanserleri gelişimi olur. UV ışığı
sonrası oluşan DNA hasarı tamir edilemez. Bu durum DNA replikasyonunu engeller. Hücre bölünmesi
inhibisyonu sonucu, mutasyon olma riski artırır. Burada ca ler gelişir.
BRCA-1 ve BRCA-2 genleri:
Her iki alelin inaktivasyonu→ailevi meme kanseri olgularının % 80’i
BRCA-1 mutasyonu→meme karsinomu. Overin epitelyal tümörleri için, erkeklerde prostat
yüksek risktir.
BRCA-2 mutasyonu→erkek ve kadın meme karsinomu.
BRCA-1 geni kromozomlardaki çift zincir kırılmalarını onarır. Mutasyonunda kromozom kırılmaları ve
anoploidi olur.
Telomer Etkisi→Hücreler yaşlandıkça telomerler kısalır, bölünmez hale gelir. Telomerler
kromozomların kutuplarında bulunan özel DNA sekanslarıdır. Her bölünme ile kısalırlar. Bir noktadan
sonra fazla kısaldıklarında telomer fonksiyon kaybı olur. p53 kontrol noktası aktive olur (G1-S).
Kromozom uçları degrede olur, bunun yanında füzyon meydana gelir. Hücre siklustan çıkar ve ölüme
gider. Telomerazda, telomer uzunluğunun korunmasını sağlayan bir enzimdir. Telomeraz germ
hücrelerinde, kök hücrelerde düşük düzeyde ve malign hücrelerde %90 oranında görülür. Sınırsız
çoğalma kapasitesi olabilir.
Genel Not:
RAS
RAF
P13K
Akt
mTOR
pTEN
Akt’ ı
inhibe
eder
MAPK
Hücre bölünmesi
Siklin D
Myc
21
TÜMÖR BÜYÜMESİ, İNVAZYON ve METASTAZ MEKANİZMALARI-Doç. Dr. A. Hakan Çermik
Tümörlerin gelişim hızı→tümör hücrelerinin ikilenme zamanına, tümör hücre havuzundaki çoğalan
hücre oranına (büyüme fraksiyonu), büyüyen kitle içinde kaybolan, dökülen hücre oranına bağlıdır.
Tümör hücreleri belirli bir ikilenme zamanı sonra 1 kg ağırlığa ulaşan kanser kitlesinden fazlasını
kaldıramaz. Tümör gelişimi sürerken bir kısım hücreler ölürken diğer bir kısmı farklılaşır.Bir yandan da
transforme hücreler çoğalmaya devam eder.
Tumor-initiating cells (T-irs)→her zaman aktiftirler. Tümörün gelişiminde rol oynamaktadırlar (Kanser
kök hücreleri gibi) aktif olup her zaman bölünme kapasitesine sahiptirler.
Kanser hücreleri anjiogenez desteğinin gelişme amacıyla anjiogenik switch adı verilen, kendine doğru
damarlanmayı artırma işlevini gerçekleştirirler. Damarlanma olmadıkça tümör gelişimi, karsinoma in
situ halinde kalır. Bu işlemi de bazı mediatörler gerçekleştirir.
Neovaskülarizasyon tümör büyümesinde→besi ve oksijen gereksinimini sağlar. Bunun yanında yeni
oluşan endotel hücreleri polipeptid büyüme faktörleri salgılar ve bu faktörler komşu tümör
hücrelerinin büyümesini uyarır.
Tümör hücrelerinde damarlara: VEGF(en önemlisi), b-F8F
Damardan tümör hücrelerine: ILGF, PDGF
Dc nova damar oluşumu→vaskülogenezis
Vaskülogenezise ek olarak var olan kapillerin dallanması ile → anjiogenezis denir.
Kanser damarlanmasında stabilizasyon yoktur, lokalizasyona uygun olmayan ve anormal yapı ve
fonksiyona (arteriyol, kapiller, venül sıralaması olmayan) sahiptir.
Kanser damarlanması →sürekli büyüme halindedir, kıvrımlıdır, düzensizdir, geçirgendir. Aynı
zamanda perfüzyon bozukluğu vardır, geçirgenliğinden metastaza uygundur.
Anjiogenik Büyüme Faktörleri→Fibroblast growth faktör(aFGF, bFGF)
. *HIF-1, RAS, myc, MAPK
Vasküler endotelyal growth faktör/vasküler permeabilite faktör
. anjiogenik büyüme faktörleri
Hipoksi de anjiogenezi indükleyebilir
üzerinden etkir.
Anjiogenez İnhibitörleri→Angiostatin, endostatin, metalloproteinaz inhibitörleri, trombospondin(TSP1, p53 üzerinden), tumstatin, vaskülostatin.
Anjiogenik faktörler tümör hücresi veya tümörü infiltre eden inflamatuar hücreler tarafından yapılır.
Bazı anjiogenez inhibitörleri tümör hücresinden bazıları ise tümör hücreleri tarafından uyarılırlar.
Tümör hücresi tarafından uyarılanlar; anjiostatin(plazminojen tarafından salınır), endostatin ve
tumstatin(kollajen tarafından salınır) dir. Bu mediyatörler metastazı engeller.
Anjiogenik switch→anjiogenezi aktive eden faktörlerin artması, anjiogenezi inhibe eden moleküllerin
azalması anlamına gelmektedir.
Normalde: hipoksi→apopitozis→trombospondin-1 in sentezi artar →HIF-1 ve VEGF düşer
p53
geni mutasyonunda:hipoksi→apopitozis→trombospendin-1’in düzeyidüşer→HIF-1veVEGF artar.
Anjiogenez invazyon ve metastaz için şarttır(Tümörde).
22
Tümörde anjiogenez sonucu düzensiz bir kan akımı oluşur. Bunun yanında hücreler arası sıvının
basıncı artmıştır. Bu nedenle O2 ve besi maddelerinin tümöre ulaşımında güçlük vardır.
Anjiogenez inhibitörleri sonucu (endostatin gibi) primer tümörün gerilemesine yol açarken, tedavinin
kalkması ile zaman içinde primer tümörde rekürrens gözlenir. Tümörün tekrar oraya çıkması inhibe
olan damar bölgesinin dışında yeni bir bölgeden damarlanmanın sağlanması ile olur.
VEGF’nin bir izoformuna karşı geliştirilen bir monoclonal antikor ilacı olan Avastin, ilk antianjiogenetik
ilaçtır.
Bir tümörün invazyon ve metastazı bazı basamaklarla olur. Bu basamaklardan birinde olacak olan
aksamada tümör hücresi yaşamını yitirebilir.Tümörlerden hergün çok kez hücrelerin dolaşıma geçtiği
fakat bunlardan sadece birkaç metastaz ortaya çıkabilmektedir. Tümör içindeki hücreler metastatik
potansiyel yönünden heterojendir. Sadece belli bazı subklonlar bu basamakları geçebilecek doğru gen
ürünlerine sahiptir.
Genel olarak metastaz: İlk olarak bazal membran aşılmalıdır. İnterstisyel bağ dokuya geçip,
ilerlemelidir. Vasküler yapılara penetre olmalıdır. Tümör embolisi olup damar duvarına yapışmalıdır.
Ekstravaze olmalıdır. Uzak bölgede büyümeye devam etmelidir.
Kana geçen kanser hücreleri agregatlar halinde ilerlerler. Bu sayede immüniteden korumuş olurlar.
Kana geçen kanser hücrelerini ilk olarak NK hücreleri karşılar.
İnvazyon ve Metastaz Kaskadı 2’ye ayrılır;
1)Ekstrasellüler Matriks İnvazyonu
a.Tümör hücrelerinin birbirinden ayrılması: E-kadherin, kateninler gibi hücrelerin bazolateral
kısımlarındaki bağlantıların gevşemesi-ayrılması sonucu gerçekleşir. E-kadherin hücreler arasında
bulunurken, kateninler kadherinlerin hücre iskeletine bağlanmasını sağlarlar. Bazı tümörlerde
E-kadherin ekspresyonları azalır ve bu sayede hücreler kolayca birbirinden ayrılabilirler. Bazı
tümörlerde de katenin geni mutasyonlu olmakta, E-Kadeninler fonksiyon görememekte ve bu sayede
hücreler birbirinden kolayca ayrılabilmektedir.
b.Tümör hücrelerinin matriks komponentlerine yapışmaları: Kanser hücrelerinde ekspose edilen
laminin, fibronektin ve integrin reseptörleri ile matriks proteinlerine bağlanır. Karsinomlarda reseptör
sayısı artar ve reseptörler hücre membranının her tarafına dağılmıştır. Karsinom hücreleri fazla
miktarda ve köken aldıkları normal dokularda bulunmayan integrinleri yapabilirler. (Örn; avβ3
integrin kanserin oluşturduğu damarlarda varken, normal damarlarda yoktur. Bu reseptörlere karşı
karşı geliştirilmiş monoklonal antikor→ Vilaxin)
c.Ekstrasellüler matriksin parçalanması: Bu işlemi proteazlar ile gerçekleştirir.
Serin proteinaz: plazminojen aktivatörü
Sistein proteinaz: katepsin D (meme kanserinde)
Matriks metalloproteinazlar(bazı kanserlerde bu kollajenazlar artmıştır): tip 4
kollajenazlar→MMP9 ve 2
Konakçıdaki stromal fibroblast veya infiltre makrofajlar indüklenerek de gerçekleştirilebilir.
Matriks yıkılması ile → invazyon için pasaj açılır. Büyümeyi destekleyici faktörler (PDGF, TGFB ve
FGF) ortaya çıkar. Anjiogenez uyarılır ve kemotaktik aktivite sağlanır.
23
b-
MMP9 ve MMP2→tip 4 kollajeni parçalarlar.
MMP2→laminin5’i parçalar. Kanser hücrelerinde motilite sağlayan faktörler açığa çıkarır.
d.Tümör hücrelerinin göçü: Otokrin motilite faktörü etkili olmaktadır. (Lokomasyon)
2)Vasküler yayılım ve tümör hücrelerinin yeni odaklara yerleşimi
Organ tropizmi nedenleri→Tümör hücrelerinin ligandlarına uygun hedeflenen organın endotel
hücrelerinde bulunan adezyon molekülleri ekprese edebilirler. Bunun yanında bazı hedef organlar
tümör hücrelerini çeken maddeler salgılayabilir. Ayrıca hedef doku, tümör tomurcuklarının gelişmesi
için elverişli olmayabilir.
Karsinom→lenfatik
Sarkom→hematojen
yayılım
gösterir
Skip metastaz→komşu anatomik lenf düğümüne değil başka bir lenf düğümüne yapılan metastaz.
Doku MMP inhibitörleri→TIMP
Motilite faktörleri→Timosin β15→kanserde up-regüle olur.
Hepatosit Growth Faktör
Matriks komponentlerinn yıkım ürünleri →tümör hücrelerinin çoğalmasını indükler anjiojeniktir.
Kemotaktiktir.
Sirkülasyondaki tümör hücreleri agregatlar oluşturma eğilimindedir. Bu homotipik (tümör-tümör)
veya heterotipik (tümör kan hücresi özellikle trombosit) şeklinde.
Bu agregatların oluşması hem tümör hücre sağ kalımını hem de bir dokuya tutunabilme yeteneklerini
arttırır. Bu agregatlar adhezyon molekülleri ile endotele yapışır, daha sonra preteolitik enzimlerle
bazal membranı aşıp ekstravaze olurlar.
CD44 –> Normalde T lenfositlerin lenfoid dokularda selektif yerlere migrasyonu için yol göstericidir.
Bazı kanserlerde (kolon, prostat, larinks, serviks ve endometrial) ekspresyonu artarak metastaz
kolaylaşır.
Prostatik adenokarsinom
Bronkojenik karsinom
Meme kanseri
Nöroblastoma
–>kemik
–>adrenal gland ve beyin
–>KC, kemik ve over
–>KC, kemik
Her kanser doğal drenaj
yolu ile kanser yapmaz.
Metastaz multifaktoriyel bi olaydır(Sadece metastaz geni değil adezyon molekül ekspresyonu,
kollajenaz yapımı vb faktörler de etkilidir). NM23 geninin mutasyondan sorumlu olabileceği
düşünülüyor.
NM23
PTEN
KAL-1
KiSS-1
Metastazı suprese etkisinin
olduğu düşünülmektedir.
24
KİMYASAL MADDELER ve RADYASYONA BAĞLI KARSİNOGENEZ-Doç. Dr. A. Hakan Çermik
A)Kimyasal Maddelere Bağlı Karsinogenez: Başlatıcı ve devam ettirici olmak üzere iki çeşittirler.
Başlatıcılar her zaman kanser oluşturmazlar, mutasyon olup öyle kalabilir. Promoterlar başlatıcı
olmadan tümör yapamazlar. Başlatıcılar da tümör oluşumu için tek başına yeterli değildirler.
Başlatıcılar hücrelerden elektron koparırlar. Kalıcı DNA hasarı oluştururlar. Bu değişiklik tümör
oluşturabilmesi için mutant DNA’nın replike olması gerekmektedir. Polisiklik hidrokarbonlar bu etkiye
sahip maddelerdir.
İlerleticiler ile oluşmuş hücresel değişiklikler direkt olarak DNA’yı etkilemez ve geri dönüşlüdür.
Proliferasyon ve klonal ekspansiyon yapıcıdır. Östrojen ve sakkarin promoter etkilidir.
Başlatıcı etkenler hücrelerdeki DNA, RNA, protein gibi yapılarla etkileşime girebilen ileri derecede
reaktif elektrofilik yapıdadırlar. Bunlar kc de sitokrom p450 enzimlerince metobolize olurlar. Bu
enzimleri kodlayan genlerdeki polimorfizm karsinogeneze yatkınlığı belirler. Bu enzimlerin fazla
çalışması sonucu polisiklik aromatik hidrokarbonların metobolitleri artacağında kansere yakalanma
olasılığı artar. Bunun yanında Glutatyon-S-transferaz enzimi de bu bileşikleri metabolize eder. Sonuç
olarak bir kimyasal maddenin karsinojenik potansiyeli, elektrofilik türevinin reaktivitesi ve metabolik
aktivasyon ve inaktivasyon reaksiyonlarının dengesine bağlı olarak değişmektedir.
Her karsinojen bazı genlerle daha çok mutasyon oluşturmaktadır. Örn: Aflotoksin B1 p53 geninde
mutasyona sebebiyet vermektedir. Sonuçta hepatosellüler karsinom oluşur.
Hepatosellüler karsinomda –> Bazı bölgelerde –> Aflotoksin B1 maruziyeti sonucu p53 geninde
mutasyon oluşur –> tümünde
Bazı bölgelerde ise –> HBV + HCV enfeksiyonu sonucu kanser gelişir. p53 mutasyonu daha azdır.
Karaciğerde kimyasal maddelerin çoğu reaktif elektrofillerine aktive edilir. Ancak karaciğer hücreleri
prolifere olamadıkları için ( Rb –> G1-S, p53 –> tümünde) kanser oluşmamaktadır.
Başlatıcılar –> Mutasyon (ras,p53) –> Devam ettiriciler –> Proliferasyon
(preneoplastik)
(forbol esterleri,
Klonal gelişme
hormonlar,
Malign neoplazma
fenoller, ilaçlar.)
Tümör progresyonu
Direkt –> Kendileri direkt olarak karsinojen
İndirekt –> Vücutta metabolitleri karsinojen etkili.
Bazı antikanser ilaçlar(siklofosfamid, klorambusil, nitrozüreler vb.) da başlatıcı ajan olabilir. Lösemi ve
lenfomaya sebep olabilirler.
Hayvan yağlarında mangalda, tütsülenmiş et ve balık, sigara metabolik aktivasyonu gereken
prokarsinojenlerdir(yani başlatıcı).
Aflatoksin de metabolik aktivasyonu gereken prokarsinojendir. Bayatlamış tahıllarda üreyen
aspergillus flavus mantarı bu maddeyi üretir. Bu madde aynı zamanda kırmızı biberde de bulunmakta
ve hepatosellüler kanser riskini artırmaktadır.
Promotorlar –> Sigara dumanı, viral enfeksiyonlar, hormonlar, safra tuzları, alkol, fenoller, forbol
esterleri, ilaçlar(fenol babital).
Arsenik
Etilen Oksit –> Lösemi
Vinil Klorid –> Karaciğer anjiosarkomu
Sakkarin –> Mesane
–> Hemanjiosarkom
25
Asbestozis –> Mezotelyoma
Benzen
–> Hodking Hastalığı, Aplastik Anemi, Lösemi
Kadmium –> Prostat
B)Radyasyona Bağlı Karsinogenez: Dokudaki e– uzaklaştırabilecek enerjiye sahip olan radyasyona
iyonizan radyasyon denir. α, β, γ, X ışınları ve nötron partikülleri bu gruptadır.
Direkt Hasar: İyonize radyasyon DNA moleküllerinin bağlarını bozar, tek veya çift zincir kırıkları
oluşturur. En hassas baz timidindir. Hücre ölür veya kanser görülür.
İndirekt hasar: Serbest oksijen radikalleri vasıtasıyla hasar oluşur. UV-B kanserojen etkilir. Enzim
inaktivasyonuna ve mutasyonlara sebep olur. Ayrıca hücresel immüniteyi baskılar. Melanom, bazal
hücreli karsinom, yassı epitel hücreli karsinom ve solar keratöz gelişebilir. Ksederma pigmentozumlu
hastalarda UV maruziyeti sonucu deri kanseri riski artar.
İyonize edici radyasyonda AML, KML(öncelikle lösemi) oluşumuna yol açar. Baş-boyun bölgesinde
kanser tedavisi amacıyla yapılan ışınlamada tiroid papiller karsinomu ve tükrük bezi mukoepidermoid
karsinomu olasılığı çok yüksek.
VİRAL ve BAKTERİYEL KARSİNOGENEZ-Doç. Dr. A. Hakan Çermik
A)DNA Onkojenik Virüsler:
Merkel hücreli polyoma virüs, merkel hücreli karsinoma oluşmasında etkendir.
1)HPV → HPV 1-2-4-7 : Benign skuamoz papillom(siğil)
HPV 6-11 : Düşük maligniteli genital siğiller(düşük riskliler)
HPV 16-18 : Yüksek riskli türler, invaziv skuamoz hücreli kanserler
(31 de) (ağır displazi, karsinoma in situ gibi)
Yüksek riskli grup –> serviksin skuamoz hücreli karsinomları,
anogenital bölgenin skuamoz hücreli karsinomları,
oral ve laringeal skuamoz hücreli karsinomlar.
HPV enfeksiyonu başlatıcı olarak görev alır. Sigara, diğer mikrobik enfeksiyonlar, ek somatik
mutasyonlar vb. ilerletici faktörlerle malign transformasyon gerçekleşir. Patolojisinde viral
onkoproteinler olan E6 ve E7’nin p53 ve Rb’e bağlanması vardır.
Dipnot: E6 p53’ü baskılayarak apoptozisi ve DNA tamirini engeller.
E7 Rb proteinlerinin aktiflenmesini engelleyerek büyümenin duraklamasına müsaade etmez.
p53 –> p21 –> siklin D / CDK4 –> pRb – E2F -----> büyümede duraklama
2)EBV –> Herpes virüs ailesindendir. B hücrelerine afinitesi vardır. Nazofarenks mukozası epiteline
affinite gösterir. CD21 ile hücre içine girer. Genomda t(8;14) ile Burkitt lenfomaya sebep olur.
Nazofarenks kanseri, immunoblastik B hücreli lenfoma, infeksiyoz mononükleozis, klasik Hodgkin
lenfomaya sebep olabilir.
Virüsa ait –> LMP-1 –> blc-2, CD40R ; EBMA-2 –> siklin D moleküllerine bağlanarak MYC
translokasyonu (myc geni aktive hale gelir) oluştururlar. T(8;14) olması ve ek mutasyonlarla
neoplastik bir klonun ortaya çıkmasına sebep olur. Buna Burkitt lenfoma denir. Bu aşamalar
esnasında bir kısım poliklonal olarak çoğalmış B hücreleri EBV’ye spesifik sitotoksik T hücreleri ile
öldürülür.
Afrika tipi BL –> %90’ında EBV DNA (+)
Her iki hasta grubunda da viral kapsid antijenlerine
Sporadik (Afrika dışı) BL –> %15-20 EBV DNA (+)
karşı yüksek serum antikor titreleri (+)‘tir.
26
3)HBV –> Hepatosellüler karsinomdan sorumludur. Karsinom, inflamasyon ile oluşmakta.
Hepatositler içine giren virüsü yok etmek için üretilen ROS’lar zaman içinde genomik hasar meydana
getirirler. HBV –> HBx
Sinyal yolaklarını tetiklerler
.
HCV –> kor protein
HCV daha antijeniktir fakat HBV daha çok görüldüğü için buna bağlı tümörlerde daha sıktır. Genomik
mutasyon sonucu IGF II ve IGFIR gibi protoonkogenler aktive olur(Bunun yanında p53 inaktive olur).
4) (KSHV, HHV-8) Kaposi Sarkomu Herpes Virüsü –> AIDS’te HHV- 8 kaposi sarkomuna neden olur.
B)RNA Onkojenik Virüsler
HTLV-1 –> T hücre lenfoması oluşturur. CD4+ T hücrelerine afinitesi vardır. Uzun süre latent
kalabilir. Lösemi enfekte bireylerin %3’ünde gelişir. İmmün cevap yanıtında azalma sonucu ölüm
gerçekleşebilir. Öncelikle poliklonal T hücre proliferasyonu görülürken ek mutasyonlarla monoklonal
T hücre lenfoması gelişir.
Tax proteini –> T hücrelerin poliklonal proliferasyon ve diferasyonunda işlev gören bazı genlerin
transkripsiyonunda görev alır. Viral bir moleküldür. Viral genomdan sentezlenen tax, CREB2’e
bağlanarak işlev görür.
Uzun latent dönem sonrası ek mutasyonlar DNA tamirinde bozulmaya yol açarlar. Genom instabilitesi
doğar.
Tax proteini başta çok üretilirken zamanla azalır. Bu sayede tax spesifik TC hücrelerden kaçma
sağlanır.
C)Onkojenik Bakteriler
Helicobakter pilori –> Midenin B hücreli lenfomalarına sebep olabilir.
Kronik gastrit –> B hücre proliferasyonu –> t(11;18) translokasyonu –> MALToma
.
gibi genetik anomaliler
Mide adenokarsinomuna sebep olabilirler.
Kronik gastrit –> atrofi –> intestinal metaplazi –> displazi –> intestinal tip mide adenokarsinomu
CagA geni ile konakçı hücrenin sinyal sistemini uyarır. T hücrelerine bağlı poliklonal B hücre uyarımı
olur. NF – kB transkripsiyon faktörü aracılılığıyla monoklonal MALToma açığa çıkar. Antibiyotik
tedavisi sonrası, lenfomada gerileme olur. İleri evrede ek mutasyonlarla midede yayılım gösterebilir.
KANSER GENETİĞİ-Yrd. Doç. Dr. Salih Kozan
Kanser multifaktoryel bir hastalıktır(Genetik + çevresel). İnsan yaşamının uzaması (antibiyotiklerin
keşfi en önemli adım olmuştur) kanser insidansını artırmıştır.
Kanser çevresel etmenlerin insan genomu üzerindeki etkilerinin birikmesidir. Genom bu durumu bir
yere kadar koruyabilmektedir.
Kanser hücrelerinin farklılaşma, çoğalma ve hayatta kalma mekanizmaları bozulmuştur. Genetik
değişiklikler sonucu somatik fonksiyon bozukluğu vardır.
Onkogenler –> Embriyonik hayatta akriftirler. Hücre bölünmesinin gerçekleşmesini sağlarlar.
.
Epigenetik değişikliklerle açılabilirler.
27
Tümör süpröser genler sistemi kontrol ederler. İki alelin kaybı sonuu kasner oluşumu gözlenir.
Mutasyonları sonucu genomik stabilite sağlanamaz.
Dna tamir genleri başta ya da sonda olur. Sondakilerde meydana gelen mutasyonlar daha kötü
sonuçlanır ve tümör çok daha malign çoğalır. Fakat bu tarz tümörler terapiye daha duyarlıdır.
Retinablastoma: Rb-1 geni mutasyonu sonucu oluşur(G1-S fazında etkili TSG’dir). Mutasyon
konjenital ya da sonradan olabilir. Konjenital olan daha erken yaşlarda ortaya çıkar. Bilateral olabilir.
Lİ-Fraumeni: p53 geninde mutasyon vardır. Germline olarak aktarılabilir. Yumuşak doku tümörü,
lösemi, beyin tümörleri, meme ca ve adenokortikal tümörler ortaya çıkabilir.
Dipnot: p53’ün bir alelinin mutant aktarılması sonucu genomun stabilitesini düşürür. Bir tane p53
koruyuculuğu daha azdır. Erken yaşlarda kanser gelişimi daha sıktır. Ailesel (meme ca gibi)
kanserlerde durum çoğunlukla böyledir.
NF-1: Periferik sinir sistemini tutar. Nörofibromalar oluşur. Hücrenin esas enerji yolağı olan mTOR
yolağının sürekli aktiflenmesi patolojiyi oluşturur. NF-1 geninde mutasyon sonucu, hücreye gelen
sinyal az olsa bile hücre sürekli bölünme eğilimindedir. NF-1 proteinin görevi RAS-GDP’nin RASGTP’ye dönüşümünü engellemektir. Mutasyon sonucu hücre sürekli enerji üretir ve bunu bölünme
için kullanır. Rapomisin ilacı mTOR yolağını inhibe ederek hücrenin apopitoza girmesini sağlar.
BRCA1 ve BRCA2 Mutasyonları: Meme kanserlerinin %9’unda görülür. Birinci derece akrabasında 40
yaşından önce meme ca görülmesi bu genlerde mutasyon olma riskini artırır. Bilateral olması da
mutasyon olasılığını artırır. Hem over hem meme ca varsa BRCA-1 mutasyonu, erkek meme
kanserinde BRCA-2 mutasyonu olma olasılığı yüksektir. 70 yaşın üzerinde %80 görülür. DNA tamir
mekanizmlarındaki bozukluk sonucu ortaya çıkar. Şiddetliyse, 40 yaşın altında ailede varsa, bilateralse
aile ağacı çıkarılmalıdır.
Familial Poipozis Koli: APC geni mutasyon vardır. Normalde APC--katenim bir kompleks içindedir ve
uyarı gelmediyse bu kompleks yıkılır, atılır. Büyüme sinyali geldiği zaman, (wnt--katenin yolağı
üzerinden) kompleks kontrollü şekilde parçalanır. Açığa çıkan -kateninler bir trasnkripsiyon
faktörüne bağlanır ve hücre bölünür. Epigenetik ve mutasyonlar sonucu -kateninler gidip
protoonkogenleri, onkogen haline geçmesine sebep olur.
Normal epitel -----> Displastik epitel --------> Adenom -----> Karsinom -------> Metastik kanser
ADC
K-RAS
p53
Metalloproteinazlar kazanır.
.
Bu da mutasyonla olur.
Herediter Non-Polipozis Kolon Kanseri: DNA tamir genlerinde hasar vardır. Erken yaşta malign
tümörlere sebep olabilir. Kanser değildir ama kansere açıktır. MLH-1, MSH2 ve 6 mutasyonları
saptanmıştır.
DNA tamir genlerindeki hasar sonucu ortaya çıkan hastalıklar: Ksederma pigmentosum, Ataksia
Telenjektazi, Fankon Anemisi, Bloom Sendromu
Sporadik Tümörler –> Ailesel olmayan tümörlere denir.
p53, Rb1 –> Multipl myelomda mutasyonu vardır(3’te 1’inde söz konusu).
pTEN –> Akt inhibitörüdür
g;22 translokasyonu –> KML de Flederfiya sendromunda görülür.
28
Sitogenetik bozukluklar –> 5q_ gibi
Gen ampflikasyonları (myc geni –> nöroblastoma, meme)
Translokasyon Sonucu Oluşan Onkogenler: 9 ve 22’den bir parça kopup bir füzyon kromozomu
(karşılıklı translokasyon vardır) oluşması söz konusudur. BRC – AB4 genleri bir araya gelir. Bu kişilerde
beyaz hücre sayısı 100.000 üzerindedir. Splenomegali vardır. Bcr-AbI füzyonu KML dışındaki
tümörlerde çok kötü bir prognoza yol açar.
Bcr-AbI gen kompleksine tutunmuş kanser proteini ATP’nin bu gen kompleksine bağlanmasını sağlar.
Bu durumda KML’ye yol açar. İmatinip ilacı da ATP’nin bu gen kompleksine bağlanmasını bloke eder.
Bu sayede KML önlenmiş olur. ( KML= Kronik Myeloid Lösemi)
KML’de tek başına bcl-abI geni vardır. Başka bir mutasyon söz konusu değildir.
.
Bu füzyon aslında AML de daha çok ortaya çıkar.
t(15;17) translokasyonu sonucu AML (Akut Myeloid Lösemi tip 3) M3 hastalığı ortaya çıkar. PML-RAR
alfa mutasyonu da vardır. Tedavisinde A vitamini verlir.
t(15;21) translokasyonu sonucu ALL(?) açığa çıkar.
t(9;22) translokasyonu saptanan hastada KML mi yoksa AML mi olduğu immunoloji raporu
beklenmeden A vitamini ( retinoik asit ) başlanmalıdır.
c-Myc –> Burkitt lendoma t:(8;14)
n-Myc –> Nöroblastoma(amplifikasyonla)
siklinD/CDK4 –> Rb fosforilleyerek hücrenin G1 kontrol noktasından ilerlemesini sağlar.
KANSER BELİRTEÇLERİ VE TARAMA DERSİ NOTU BULUNMAMAKTADIR
29












