Bakteri Enfeksiyonlarının Patogenezi
Enfeksiyon hastalığı oluşması için,
patojen bakterinin konak ile temasa geçmesi, konak
hücrelerine tutunması, kolonize olması, hücre ve dokuların içine girmesi ve sonunda hasar oluşturması
gereklidir. Bakteri bu kademeleri geçerken konak bağışık yanıtından kurtulmalıdır. Bakterinin konak
hücre yüzeyine tutunma işlemine aderans denir. Patojen bakterinin konak dokusunda çoğalması
enfeksiyon olarak ifade edilir. Normal flora üyesi olan bakteriler için bu deyim yerine kolonizasyon
deyimi kullanılır. Konak dokusuna tutunan ve enfeksiyon oluşturan bakterinin içeri girmesine
invazyon denilir. Bakterinin enfeksiyon oluşturma kabiliyetine patojenite ve enfeksiyon oluşturan
bakteriye patojen adı verilir. Aynı tür içindeki suşlar arasındaki patojen olanı belirtmek için virulan
kelimesi kullanılır. Konakta oluşan enfeksiyon, klinik belirtiler ile seyrederse enfeksiyon hastalığı
gelişmiştir. Bazı bakteriler her zaman patojen olduğu halde bazıları konak bağışıklık sisteminin hasara
uğraması veya yabancı cisim varlığı gibi kolaylaştırıcı faktörler olduğu zaman enfeksiyon oluştururlar.
Bu tür patojenlere fırsatçı patojen denir. Bakteriler enfeksiyon hastalıklarını toksin dediğimiz
maddeleri salgılayarak oluşturabilir. Toksin salgılayan bakterilere toksijenik bakteriler denir.
Enfeksiyon
Bakteri organizmaya girdikten sonra genellikle epitel hücrelerine tutunur. Daha sonra çoğalır. Bu
aşamada bakteri virulans faktörleri hastalık oluşturma mekanizmasını belirler. Bazı bakteriler içeri
girer, lenfatik sistem yoluyla kana karışır, kanda geçici veya kalıcı bakteriyemiye neden olur.
Bakteriyemi sayesinde doku ve organa ulaşarak oralarda da çoğalır. Bazı bakteriler ise konakta
tutunma işlemini başardıktan sonra orada kolonize olurlar. Daha sonra toksin dediğimiz zehrini
salgılayarak hastalık oluştururlar.
İlk grup için Haemophilus influenzae tip b enfeksiyonunu örnek olarak verebiliriz. H.influenzae tip
b, sağlıklı insanların sadece %1-2’sinin normal floralarında bulunur. Konak tarafından alındıktan sonra
kolonize olur ve translokasyon ile epitel hücrelerini geçerek kan dolaşımına katılmaktadır. Kapsül,
doğal fagositoz ve kompleman etkisinden bakteriyi korumaktadır. Bakteri, kapsüle karşı gelişmiş
antikoru olmayan bireylerde, epiglottit, menenjit ve pnömoniye neden olur. Bir başka örnek olarak
Vibrio cholerae verilebilir. Polar flagellası sayesinde barsak yüzeyinde mukus tabakasını geçer ve pilileri
ile epitel yüzeyine tutunur. Burada çoğalarak toksin salgılar ve hastalığa neden olur. Kana karışmaz.
Toksin etkisi ile lümene su ve tuz atılımı sonucunda elektrolit bozukluğu ortaya çıkar.
Enfeksiyonun Bulaşması
Bakteriler çevremizde toprak, su, çürüyen sebze ve meyvelerde, çiftliklerde ve doğal yaşam
ortamlarında yaşayan hayvanlarda bulunmaktadır. Bakteriler çeşitli yollar ile insanlara bulaşarak
enfeksiyon oluşturur.
İnsanlarda sık olarak enfeksiyon hastalığına neden olan Salmonella ve Camylobacter, hayvanlarda
hastalık yapmadan bulunabilirler. İnsanlara hayvansal gıdalar ile bulaşırlar. Hayvanlarda hafif şiddette
enfeksiyon hastalığına yol açan bazı bakteriler insanlara bulaştıkları zaman çok daha şiddetli
enfeksiyon hastalığına neden olabilirler. Örneğin Yersinia pestis, kemirici ve bunların pirelerinde
bulunur, insanlarda şiddetli hastalık yapar. Toprakta bulunan Bacillus anthracis hayvanları enfekte
eder, hayvanlardan insanlara bulaşarak enfeksiyon hastalığına neden olur. Toprakta bulunan
Clostridium türleri gıdaları kontamine edebilir, bütünlüğü bozulmuş deri ve yumuşak dokuda
enfeksiyon meydana getirirler. Gastroenterit, botulizm, yara enfeksiyonu ve tetanoza neden olurlar.
Hastalığın kliniği bulaşma yolunu da gösterir. Örneğin Vibrio cholerae su ile bulaşır ve şiddetli
ishale neden olur. İshal ile ortama atılan bakteri su kaynağına ulaşır ise başka kimselerin de
hastalanmasına neden olur. Benzer olarak E.coli taşıyan atık sular ile yiyeceklerin kontamine olması
sonucu ishal oluşur. Mycobacterium tuberculosis solunum sisteminde enfeksiyona neden olup damlacık
yoluyla başka insanlara bulaşır.
Birçok hastalık insanlar arasında eller ile bulaşır. El yıkama hastane enfeksiyonlarının geçişini
engellemede en önemli yollardan birisidir. Bakterilerin insan vücuduna başlıca giriş yolları; deri ve
mukozalar, solunum sistemi, gastrointestinal sistem ve genitoüriner sistemdir. Bunların dışında kan,
vertikal ve prenatal yol ile bulaşma olabilir.
Koch Postülası
Klinik örnekten izole edilen bakterinin klinik tablodan sorumlu olup olmadığı hep sorgulanmıştır. Bu
soruya cevap olarak 1884 yılında Robert Koch kendi adıyla anılan postülasını ortaya atmıştır.
1.-Aynı hastalığa sahip bireylerde aynı mikroorganizma bulunmalı ve mikroorganizma dağılımı ile
lezyonlar uyumlu olmalıdır.
2.-Mikroorganizma in-vitro ortamda saf olarak üretilmelidir.
3.-Elde edilen saf kültür deney hayvanlarına verildiği zaman tipik hastalık oluşturmalıdır.
4.-Deney hayvanlarındaki lezyonlardan alınan örneklerden in-vitro olarak aynı mikroorganizma
üretilmelidir.
Ancak pratikte bazı bakteriler Koch postülasını karşılamaktan uzak kaldığı gözlenmiştir. Örneğin
sifiliz etkeni Treponema pallidum ve lepra etkeni Mycobacterium leprae in-vitro olarak üretilememiştir.
Bir başka örnek gonore etkeni Neisseria gonorrhoeae olup sadece insanlara patojendir. Hayvan modeli
yoktur. Diğer taraftan bazı bakteriler için deneysel hayvan modeli yerine in-vitro yöntemler
geliştirilmiştir. Moleküler tanı yöntemlerinin ilerlemesi ile bu yöntemler patojen ve patojen olmayan
mikroorganizmaların ayırımında kullanılmaya başlanmıştır. Böylece virulans genlerinin moleküler
yöntemler ile saptanması başarılmıştır. Örneğin difteri hastalığı etkeni olan Corynebacterium
diphtheriae klinik örnekten izole edildiği zaman toksin salgıladığını göstermek için hayvan deneyi yerine
in-vitro yöntemler tercih edilmiştir. Aynı durum E.coli için de geçerlidir. Virulans genlerinin moleküler
yöntemler ile saptanması giderek artmaktadır. O zaman ikinci bir Koch postülası gündeme gelmiştir.
Moleküler Koch Postülası
1.-Araştırılan özellik patojen suş ile ilgili olmalı.
2.-Araştırılan gen ile şüphe edilen virulans arasında doğru bir ilişki olmalıdır.
3.-Olmayan veya mutasyona uğratılan gen doğal gen ile yer değiştirdiği zaman virulans kazanılmalıdır.
Yukarıdaki ilkelere rağmen sorunlar devam etmektedir. Çünkü gerek Koch gerekse Moleküler Koch
postülalarının uygulanabilmesi için etken bakterinin üretilmesi gereklidir. Konak dokularında veya
sıvılarında etken olduğundan şüphe edilen mikroorganizmaya ait genetik materyallerin bulunması yeni
bir kavramın daha ortaya atılmasına neden olmuştur. Bu konuda yapılan çalışmalar sonucu moleküler
tanı rehberi geliştirilmiş ve uygulamaya konulmuştur.
Moleküler Tanı Rehberi
1.-Aranan NA dizisi enfeksiyon etkenini temsil etmeli.
2.-NA dizisi sağlıklı kontrollerde olmamalı veya kopya sayısı az olmalı.
3.-Hastalığın iyileşmesi ile kopya sayısı azalmalı.
4.-Sağlıklı kimselerde NA dizisi saptandığı zaman ilerde bu kişilerde de hastalık saptanmalıdır.
Klinikten izole edilen bakteriler için patojen, nonpatojen, fırsatçı patojen gibi tanımları yapmak her
zaman mümkün değildir. Mycobacterium tuberculosis ve Yersinia pestis gibi bakteriler ne zaman izole
edilseler patojen olarak tanımlanmaktadırlar. Fakat hem normal flora elemanı olan hem de hastalık
etkeni olan bakteriler için bir tanımlama yapmak zor görünmektedir. Bunun için insan barsak florası
elemanı olan E.coli örnek olarak verilebilir. E.coli aynı zamanda üriner sistem enfeksiyonlarına, seyahat
ishali ve diğer hastalıklara neden olmaktadır. Hastalığa neden olan E.coli ile normal flora elemanını
ayırmak mümkün değildir. Pseudomonas aerigunosa ve Stenotrophonomas maltophilia gibi bazı
bakteriler ise bağışıklık sistemi baskılanmış kimselerde hastalık oluşturur. Böyle bakterilere fırsatçı
diğer bir ifade ile oportunistik patojen denilir.
Bakterilerin Genetik Özellikleri
Bakteriler haploid olup genetik etkileşim ve değişim kapasiteleri sınırlıdır. Kromozomal genler sıkıca
korunmaktadır. Bunun sonucu olarak bakteriyal enfeksiyonlar klonal özellik taşımaktadır. Konuya örnek
vermek istersek, hemen aklımıza Neisseria meningitidis gelir. Dünyada birçok bölgede görülen
epidemik menenjit, N.meningitidis serogrup A tarafından oluşturulmaktadır.Başka bir örnek
H.influenzae olabilir. Bu bakterinin çok sayıda klonal tipi olmasına karşın saptanan enfeksiyonların
büyük çoğunluğundan H.influenzae tip b sorumludur.
Bakterilerde genetik bilgi aktarımını fajlar ve kromozom dışı hareketli genetik elemanlar olan
plazmid ve transpozonlar sağlar. Birçok bakteriyal virulans faktörünü kodlayan gen plazmid veya faj
üzerinde taşınır. Bu genetik elemanların tür içindeki suşlar arasında ve nadiren de olsa türler hatta
cinsler arasında transferi sonucunda virulans faktörleri aktarılabilir. Bazen bir başka kromozom dışı
genetik eleman olan transpozonlar olaya karışır.
Aynı kromozom üzerinde yer alan sayıda patojenite ile ilgili genlerin bulunduğu bölgelere
patojenite adaları denilir. Bir veya daha fazla virulans genini taşıyan patojenite adaları büyük olup
patojenik olmayan suşlarda bulunmazlar. Patojenite adaları genellikle hareketli genetik elemanların
genomu ve tRNA genleri ile beraber bulunur.
Tablo 1.-Bakterilerin hareketli genetik elemanları tarafından kodlanan virulans faktörleri
Bakteri
Virulans Faktörü
Plazmid
Esherichia coli
LT ve ST toksin
Esherichia coli
Hemolizin
Clostridium tetani
Tetanospazmin
Bacillus antracis
EF, LF, PA
Faj
Clostridium botulinum
Botulinum toksini
Corynebacterium diphtheriae
Difteri toksini
Streptococcus pyogenes
Eritrojenik toksin
Vibrio cholerae
Kolera toksini
LT, Isıya duyarlı toksin; ST, ısıya dirençli toksin; EF, Ödem faktörü; LF,
Öldürücü faktör; PA, Koruyucu antijen
Bakteriyal Virulans Faktörlerin Düzenlenmesi
Patojen bakteri saprofit veya serbest yaşama uyum sağlamıştır. İnsan vücudunda veya dış
ortamda yaşayabilir. Metabolizmasını bulunduğu ortama göre ayarlar. Kompleks sinyal iletim sistemi
ile virulans genlerini kontrol eder. Bu sinyaller arasında ısı, demir miktarı, pH, iyonlar (Ca2+ gibi),
çoğalma fazı, osmolalite ve beslenme faktörleri sayılabilir.
Corynebacterium diphtheriae difteri hastalığına neden olur. Hastalığın oluşmasında difteri toksini
temel rol oynar. Toksin geni faj tarafından taşınır. Sadece faj ile enfekte olan bakteriler toksin genine
sahip olur ve toksin salgılarlar. Toksin sadece düşük demir içeren ortamda salgılanır.
Bordetella pertussis virulans genleri bakteri 37 oC‘de çoğaldığı zaman aktiftir. Çoğalma, ısı 37
o
C’nin altında olduğu zaman, magnezyum sülfat veya nikotinik asit ortamda fazla miktarda olduğu
zaman baskılanır.
Vibrio cholerae virulans faktörleri birçok faktör tarafından kontrol edilir. Kolera toksini salınımı pH
6.0’da pH 8’e göre; 30 oC’de 37 oC ‘ye göre fazladır. Virulans faktörleri açısından osmolalite, pH, ısı ve
amino asit kompozisyonu önemlidir.
Yersinia plazmidleri tarafından kodlanan Yops, antifagositik proteinlerdir. Bu proteinler en fazla 37
o
C’de ve kalsiyum yokluğunda sentezlenir. Bakteri kalsiyum varlığında 37 oC’de ürediği zaman dahi 25
o
C’de ürediğinden daha fazla antifagositik protein salgılar. Bakteri hayvan veya insan vücudunda
proteini sentezleyerek fagositozdan kurtulurken kemirici piresinde buna ihtiyaç duymaz.
Bazı bakterilerin hareketleri ortamın ısısına bağlıdır. Bakterinin virulansında hareket özelliği önemli
değil ise bu özelliği kaybedebilir. Örneğin Yersinia enterocolitica ve Listeria monocytogenes 25 oC’de
hareketli ama 37 oC ‘de hareketsiz veya çok az hareketlidir.
Virulans Değişiklikleri
Genetik olarak bakteride oluşan kromozomal veya kromozom dışı değişikliklerle virulans
değişebilir. Mutasyon veya rekombinasyon sonucu bakteride virulansını artıran genlerin oluşması bu
yönde etkilidir. Ayrıca virulans genleri dışarıdan aktarılabilir. Buna örnek olarak toksijenite kazandıran
fajlar veya direnç kazandıran plazmidleri verebiliriz. Çevre faktörlerinin etkileriyle de virulans artabilir.
Çeşitli yollarla bakterinin virulansı azalabilir. Virulansın azalması, genetik olarak mutasyon veya
kromozom dışı elemanların kaybolması ile olabilir. Organizmadan yeni ayrılan bakterinin virulansı
yüksek iken uygunsuz besiyerlerine aktarılma sonucu virulans azalabilir. İlk izolasyonda M şeklinde
olan bakteri kolonisi, daha sonra S koloniye ve son olarak R koloniye dönebilir. Virulansın azalmasına
atenüasyon denir. In-vitro yapılan kültürler veya duyarsız hayvanlarda yapılan seri pasajlarla
bakterilerin virulansı azaltılabilir. Ayrıca çeşitli fiziksel ve kimyasal yöntemler kullanılarak bakterilerin
virulansı azaltılabilir.
Bakteri Virulans Faktörleri
Bakteriyal virulans faktörlerini kolonizasyon, konak bağışık yanıtından kurtulma ve hasar oluşturma
için gerekli faktörler olarak üç başlık altında inceleyebiliriz.
1.Kolonizasyon
Bakterinin hastalık oluşturabilmesi için önce konakta kolonize olması gereklidir. Konak hücresine
tutunmalı ve çoğalmalıdır. Bunun istisnaları da vardır. Bazen bakterinin konak dışında oluşturduğu
toksinin alınması ile hastalık oluşabilir. Ama bu olayı enfeksiyon olarak tanımlamak pek doğru değildir.
1.A.Konak Hücre ile Temas
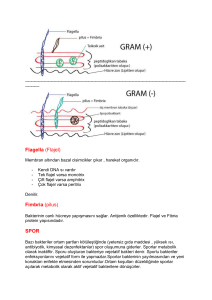
Bakterinin konak hücreye tutunmasına aderans denilir. Barsak ve mesanenin mukozal yüzeyinde
devamlı bir yıkama vardır. Bu sayede kolonizasyon engellenmektedir. Hareketli bakteri mukozal yüzeye
doğru hareket ederek mukoza ile temas eder ve kolonize olabilir. Bu nedenle barsaklarda ve mesanede
kolonize olan bakterilerin büyük bir çoğunluğu hareketli bakterilerdir. Buna örnek olarak Vibrio
cholerae hareketsiz mutantlarının hareketli doğal tiplere göre daha az virulan olmasını gösterebiliriz.
Spiroketler çok ince olup endoflagellaları vardır. Bu sayede mukozaları ve hasarlı deriyi kolaylıkla
geçebilirler ve organizmaya girerler.
Helicobacter pylori flagellası sayesinde mukus içinde mukoza epitel hücrelerine doğru hareket
eder.
1.B.Tutunma ve Uzaklaştırılmaya Direnç
Bakteri deri ve mukoza ile temasa geçtiği zaman o bölgeden uzaklaşmasını sağlayacak birçok
fiziksel faktörle karşılaşır. Öksürük, burun akıntısı, kusma, ishal, idrar, tükürük gibi fiziksel yollar ile
bakteri uzaklaştırılır. Bakteri fiziksel olarak uzaklaştırılmaya pili, hücre adezin proteinleri, kapsül yapıları
ve biyofilm oluşturarak karşı koyar.
1.B.1.Pili
Pili, konak hücrede bulunan reseptörlere tutunmayı sağlar. Sonlandığı yapışkan kısım konak hücre
yüzeyinde bulunan glikoprotein veya glikolipid reseptörlere uygunluk göstermektedir. Bakteri konak
hücreye tutunduğu zaman, pili depolimerize olarak bakterinin konak hücreye yapışmasını
sağlamaktadır.
N.gonorrhoeae kolumnar epitel ile kaplı mukozaları enfekte eder. Pili ilk tutunmayı sağladıktan
sonra kaybolur. N.gonorrhoeae yeni pili sentezler, bu pililerde yapışkan uç daha farklı olup sperm,
boğaz, genitoüriner sistem, rektum, konjunktiva gibi birçok mükoz membran epitel hücrelerine
tutunmayı sağlar. Bakteri sentezlediği Opa gibi diğer adezinler ile tutunmasını kuvvetlendirir.
N.meningitidis pilileri ile nazofarenks mukozasında bulunan epitel hücrelere tutunur ve kolonize olur.
Daha sonra buradan kana karışıp ve menenkslere ulaşarak sepsis ve menenjite neden olmaktadır.
Üropatojenik E.coli suşları, bakterinin üriner sistem epitel dokusuna tutunmasını sağlayacak pililere
sahip olduğu için idrarın yıkayıcı etkisine direnir. Bu bakteriler pili dışında adezinlere de sahiptir.
V.cholerae pilileri ile barsak mukozasına tutunur ve ishalin uzaklaştırıcı etkisine dayanır. Pseudomonas
aeruginosa pilileri sayesinde yarada ve akciğerlerde kolonize olur.
1.B.2.Adezinler
Bakterilerin yüzeyinde bulunan ve konak hücredeki özgül reseptörlere bağlanarak bakterilerin
tutunmasını sağlayan proteinlere adezin denilir. Adezinler ile tutunan bakteri fiziksel uzaklaştırılmaya
direnç gösterir. Streptococcus pyogenes çeşitli adezinlere sahiptir. Bunlar arasında bulunan protein F
birçok epitel yüzeyinde yaygın olarak bulunan fibronektine bağlanmaktadır. Lipoteikoik asit
fibronektine bağlanan bir diğer adezinidir. S.pyogenes’de bulunan M proteini de adezin fonksiyonuna
sahiptir. T.pallidum uçlarında adezin proteinler içerir ve bu sayede fibronektine bağlanırlar. Borrelia
burgdorferi kendisinin çeşitli hücrelere yapışmasını sağlayacak olan ve uçlarda bulunan adezinlere
sahiptir. Bordetella pertussis filamentöz hemaglütinin, pertussis toksin ve pertaktin gibi çeşitli
adezinlere sahiptir. N.gonorrhoeae Opa veya protein II olarak isimlendirilen adezinlere sahiptir.
Bakteride bulunan çeşitli Opa proteinleri sayesinde birçok tip konakçı hücresine bağlanabilir.
Streptococcus pneumoniae yüzeylerinde çeşitli choline-binding protein taşırlar. Bu proteiner
nazofarenks, akciğer ve epitel hücrelerinde bulunan kolin moleküllerine bakterinin bağlanmasını
sağlarlar. Bağlanma, tutunma kadar bakterinin kan ve BOS’a geçişi için de önemlidir.
1.B.3.Kapsül
Bakterilerin bir kısmı polisakkarit kapsüle veya glikokalikse sahip olup konak hücrede biyofilm
oluştururlar. Streptococcus mutans diş yüzeyinde bulunan glikozu dekstrana çeviren glukoziltransferaz
enzimine sahiptir. Dekstran ise glikokaliks yapısında bulunur. Bakterinin diş yüzeyine yapışmasını
sağlar. Böylece Streptococcus mutans, diğer bakteriler ve artıklar plak şeklinde oluşum meydana
getirirler.
1.B.4.Biyofilm
Biyofilm katı bir yüzeye veya birbirine tutunmuş olan bakteri topluluklarından oluşur. Bakteriler,
ekzopolisakkarit bir matrikse gömülüdür. Biyofilm, katı yüzeylerde yapışkan bir örtü oluşturur. Doğada
yaygın olarak bulunur. Biyofilm tek bir türden oluşabileceği gibi birden fazla türden de oluşabilir.
Mayalar da oluşan biyofilm içinde yer alabilir. Biyofilm oluşumu, insanda oluşan enfeksiyonun
devamlılığı ve tedavide karşılaşılan zorluklar açısından önemlidir. Staphylococcus aureus ve
Staphylococcus epidermidis, kateter ve lens gibi yabancı cisim varlığında biyofilm oluştururlar. Kistik
fibrozisli hastalarda, Pseudomonas aeruginosa aynı şekilde enfeksiyon oluşturur. Biyofilm oluşturan
bakteriler, konak bağışıklık sisteminden ve antibiyotiklerden korunurlar.
1.C.Konak Hücrenin İçine Girme
Bakterinin konak hücreye girmesine invazyon denir. Salmonella epitel hücreleri arasındaki
birleşim yerlerinden dokuya girerler. Yersinia türleri, Neisseria gonorrhoeae, Chlamydia trachomatis
gibi bazı bakteriler ise doğrudan epitel hücrelerine yapışarak hücre içine girmektedir. Bakteri hücre
içine girdiği zaman hücre membranından oluşan vakuol içinde olabilir veya vakuol membranının
erimesi sonucu sitoplazma içinde bulunabilir. Birçok enfeksiyonda bakteri virulans faktörleri, konak
hücresi üzerine etki göstererek bakteriyi içine almasını sağlayacak çıkıntılar oluşmasına neden olurlar.
Bazı bakteriler çeşitli proteinler oluşturur ki bunlara invazin denilir. İnvazinler konak hücre
fagositoz sistemini uyararak bakterinin hücre içine alınmasını sağlarlar.
Shigella ve enteroinvaziv E.coli invazinleri sayesinde kolona yerleşirler. Bu tür bakterilerde tip III
sekresyon sistemi vardır. Tip III sekresyon sistemi ile bakteri sitoplazmik membranından konak
hücre sitoplazmik membranına kanal benzeri porlar oluşur. Bu porlar sayesinde bakteriye ait
proteinlerin bakteri sitoplazmasından konak hücre sitoplazmasına doğrudan ulaşması sağlanır. Bakteri
kolon epiteli ile temasa geçtiği zaman tip III sekresyon sistemi sayesinde aktin sistemini polimerize ve
depolimerize edebilir. Bu değişim bakterinin, fagositik hücrede yalancı ayak şeklinde çıkıntılar
oluşturmasına neden olur ve bakteri fagosite edilerek vakuol içinde tutulur. Bundan sonra bakteriye
düşen görev vakuol membranını parçalayarak sitoplazmaya ulaşmaktır.
Shigella hücre içine girdiği zaman fagositik vezikülden kurtulur ve sitoplazmada çoğalır. Aktin
polimerizasyonu Shigella bakterisini hücre içinde ileriye doğru iterek diğer komşu hücrelere iletir.
Listeria monocytogenes sahip olduğu internalin olarak tanımlanan proteinler sayesinde konak
hücreye tutunur. Bakteri konak hücreyi uyararak konak hücrenin filopod olarak tanımlanan çıkıntılar
oluşturmasına neden olur. Bu çıkıntılar sayesinde hücre içine alınan bakteri aktin kökenli hareket
mekanizmasıyla komşu hücrelere ve dışarı doğru hareket eder. Legionella pneumophila makrofaja
tutunduğu zaman uzun ve ince psödopod oluşumuna neden olur. Bakteriyi saran halka vezikül
oluşturur. Vezikül oluşmasına rağmen fagolizozom oluşumu inhibe olduğu için bakteri vezikül içinde
çoğalır.
Streptococcus pneumoniae invazini olan fosforokolin bakterinin konak hücreye girmesi ve
fagositoza dirençli olmasını sağlar. Özellikle bakterinin kan ve menenkslere ulaşmasında önemlidir.
Streptococcus pyogenes F ve M proteinleri bakterinin konak hücreye girmesini ve derin dokulara
yayılmasını sağlarlar. Borrelia burgdorferi ve Treponema pallidum gibi spiroketler invazin proteinleri ve
hareketli olma özellikleri sayesinde konak hücrelere girerler. Bakteri konak hücreye tutunur ve bu
esnada invazinleri ile konak hücreyi uyararak enzim salgılamasını sağlar. Bu enzimler spiroketin burgu
hareketi ile konak hücreye girmesine yardımcı olan sindirim enzimleridir.
Toksin yapımı ve diğer virulans faktörleri invazyondan bağımsızdırlar. Örneğin Corynebacterium
diphtheriae toksin salgılamasa dahi nazofarenks epitelini tutunur ve semptomatik boğaz ağrısına neden
olur.
1.D.Beslenme
Patojenik bakteriler besin ihtiyaçlarını karşılarken nonpatojenik bakteriler ve konakçı hücreleri ile
yarış içindedirler. Bakteriler açısından en önemli besin maddelerinden birisi demirdir. Demir, sahip
olduğu geniş oksidasyon-redüksiyon potansiyeli sayesinde metabolik birçok olayda önemli rol
oynamaktadır. Bakteriler üreme ortamlarında 0.4-4 mol/L oranında demir olmasını isterler. Hayvan ve
insanlarda fazla miktarda demir vardır ancak bu demir hemoglobin, myoglobin gibi hücre içindedir. Bu
durum bakteriler için uygun değildir. Serbest demir ferrik formda (Fe3+) olup, primer olarak yüksek
oranda çözülmez hidroksil, karbonat, fosfat şeklinde bulunur. Serbest demir iyonu konsantrasyonu
kan, lenf, ekstrasellüler doku ve eksternal sekresyonda son derece düşük olup 1018mol/L Fe3+
düzeyindedir. Serbest iyonik demir, konak hücrede bulunan demir-bağlayan ve taşıyan proteinlere
bağlı olarak bulunur. Bu proteinler kan ve lenf için transferin, ekstrasellüler sekresyon için
laktoferrindir. Transferrin ve laktoferrin Fe3+için yüksek düzeyde afiniteye sahiptir. Normal demir
metabolizmasında kısmen doymuş halde bulunurlar. Bu nedenle normal koşullarda konak demir
metabolizması, bakteri için yeterli demiri sunmaz.
Bakteriler kendilerine yeterli miktarda demir temin etmek için çeşitli yöntemler geliştirmişlerdir.
Bakterilerin çoğunluğu, düşük afiniteli demir asimilasyon sistemlerine sahip olup bu sistemler
sayesinde demirin polimerik formlarını kullanabilirler. Diğer bakteriler ise, yüksek afiniteli demir
asimilasyon sistemine sahiptirler. Bu sistem siderofor olarak isimlendirilen düşük molekül ağırlıklı
taşıyıcı proteinlere sahiptir. Sideroforlar ferrik demire özgül olup bakteri hücresinin demir ihtiyacını
karşılarlar. Siderofor üretimi ortamda bulunan demir konsantrasyonuna genetik bir cevap şeklinde
gelişir. Sideroforun görevi ortamdaki demiri yakalamaktır. Siderofor demiri bağladığı zaman bakteri
membranında bulunan kendisine özgül reseptörleri sayesinde demiri hücre içine sokar. Membranda
bulunan demir reseptörleri düşük demir konsantrasyonunda sentezlenir. Bazı bakteriler kendi
sideroforlarının yanında başka bakterilere ait sideroforlar için de reseptör içerirler. Yine bir grup bakteri
insan transferrin, laktoferrin, ferritin ve hemini demir kaynağı olarak kullanabilirler. Neisseria
gonorrhoeae, Neisseria meningitidis ve Haemophilus influenzae transferrin ve laktoferrini; Y.pestis ise
transferrin ve hemini demir kaynağı olarak kullanır. Hücre içinde çoğalabilen Listeria, Salmonella,
Legionella pneumophila ve diğer bakteriler hücre içindeki demir havuzundan ihtiyaçlarını temin ederler.
Borrelia burgdorferi ise kofaktör olarak demir yerine manganezi kullanır. Bazı bakterilerin
ortamdaki demir konsantrasyonu azaldığı zaman toksin salgılayarak konak hücrelerinin ölümüne ve
demirin açığa çıkmasına neden olurlar.
2.Konak Bağışık Yanıtından Kurtulma
2.A.Doğal Bağışıklıktan Kurtulma
Doğal bağışık yanıtta meydana gelen fagositoz, bakteride bulunan ama memeli hücresinde
olmayan yapıların fagositer hücreler tarafından algılanmasıyla gelişir. Bakteri üzerindeki bu yapıların
algılanması aynı zamanda makrofajlardan sitokin salgılanmasına neden olur. Salgılanan sitokinler ve
bakterinin kendisi, kompleman sistemini aktive eder. Doğal bağışıklıktan kurtulma dendiği zaman
fagositozdan ve komplemanın litik etkisinden korunma anlaşılır.
2.A.1.Kapsül Yapısı
Streptococcus pneumoniae, Haemophilus influenzae, Neisseria meningitidis, Bacillus anthracis ve
Bordetella pertussis gibi bakteriler kapsülleri sayesinde doğal fagositozdan kurtularak enfeksiyon
hastalıklarına neden olurlar. Kapsülün etkileri aşağıda belirtilmiştir.
C3 konvertazın oluşumunu engellerler.
Sialik asitten zengin kapsüller kompleman düzenleyici protein olan protein H’yi bağlar.
C3b’yi kapatarak opsonizasyonu engeller.
Bakterideki patojenite ile ilgili yapıları kapatarak doğal fagositozu engeller.
Bağışıklık sistemi kapsüle karşı antikorlar sentezleyerek bakteriyi etkisiz hale getirir.
2.A.2.Fagozom Oluşumunun Engellenmesi
Patojen Yersinia, tip III sekresyon sistemi sayesinde aktin filamentlerini depolimerize ederek
fagositozdan kurtulur. Staphylococcus aureus koagülaz oluşturarak kendisine fagositoza karşı direnç
sağlar.
2.A.3.Fagozomdan Kaçış
Shigella flexneri ve bazı Rickettsia türleri fagozom ile lizozom birleşmeden önce fagozomdan
kaçarlar.
2.A.4.Fagozom-Lizozom Birleşmesinin Engellenmesi
Neisseria gonorrhoeae por proteinleri sayesinde fagozom ile lizozom birleşmesini engeller.
Chlamydia, Mycobacterium ve Legionella pneumophila lizozomu fagozoma taşıyan veziküler taşıma
mekanizmasını bozarlar.
2.A.5.Fagozom Asidifikasyonunun Engellenmesi
Streptococcus pyogenes M proteini bakteriye fagositik ölüme karşı direnç sağlar. Mycobacterium
ve Legionella pneumophila fagozomun asidifikasyonunu engellerler. Lizozomal enzimler etkilerini asit
pH’da çok daha iyi gösterebildikleri için, bu enzimlerin etkileri engellenmiş olur.
2.A.6.Fagozomun Maturasyonunun Engellenmesi
Mycobacterium tuberculosis’in hücre duvar lipidleri fagozomun maturasyonunu engeller.
2.A.7.Fagositik Ölüme Direnç
Legionella pneumophila ve Mycobacterium türleri toksik oksijen bileşiklerinin oluşmasını
engelleyerek vakuol içinde yaşamlarını sürdürürler. Salmonella gibi bazı bakteriler oksijenin toksik
formlarına ve defensin olarak tanımlanan bakteri öldüren peptidlere karşı daha dirençlidir. Salmonella
acid tolerance response (ATR) genine sahip olup bakteri bu sayede fagozomun ve midenin asit
pH’sından kurtulur.
2.A.8.Kompleman Aktivasyonunun Engellenmesi
Streptococcus pyogenes C5a’yı parçalayan proteaz oluşturur. Yersinia proteinleri ise C3b ve C5a’yı
yıkarlar. Streptococcus pyogenes M proteini kompleman düzenleyici protein olan protein H’yi bağlar.
Haemophilus influenzae, Bordetella pertussis ve Neisseria gonorrhoeae, LPS yapısının O antijenlerine
siyalik asit bağlayarak C3 konvertaz oluşumunu engellemektedir.
2.A.9.Nötrofillerden Korunma
Staphylococcus aureus altın sarısı, Grup B Streptococcus portakal rengini veren karatenoid
pigmente sahip olup bu sayede nötrofillerin mayınlarından korunurlar. Staphylococcus aureus ve
Streptococcus pyogenes lökosidin olarak isimlendirilen ekzotoksinleri sayesinde fagositer hücreleri
öldürürler. Enzimleri sayesinde fagosit veya lizozom membranında hasar oluştururlar ve kendi
enzimleri ile fagositer hücrenin ölümüne neden olurlar.
2.A.10.MAC Etkisini Ortadan Kaldırma
Salmonella gibi bakteriler LPS tabakasında bulunan O-polisakkarit zincirlerini uzatarak MAC’ı dış
membrandan uzaklaştırmaktadırlar.
2.A.11.Makrofaj Apoptozisine Neden Olma
Salmonella ve Shigella gibi bakteriler ise makrofaj apoptozisine neden olurlar.
2.B.Adaptif Bağışıklıktan Kurtulma
Organizma tarafından enfeksiyon etkenlerine karşı oluşturulan en önemli savunma silahlarından
birisi antikorlardır. Antikor Fab kısmı ile antijene yapışır. Bunlara epitop denir. Antijene Fab kısmı ile
yapışmış olan antikorlar Fc kısımları ile üzerlerinde Fc reseptörü bulunan hücrelere yapışırlar. Bu
yapışma opsonizasyon veya antijenin erimesi ile sonuçlanır. IgG ve IgE tipi antikorlar opsonin olarak
görev alırlar ve opsonizasyona neden olurlar. Yine IgG, IgM ve IgA sınıfı antikorlar bakterinin yüzeyine
bağlanarak konak hücreye tutunmasını önlerler. IgG ve IgM klasik yoldan komplemanı aktive ederler.
IgM ve IgA bakterilerinin kümeleşmesine neden olarak daha kolay fagosite edilmelerini sağlarlar.
2.B.1.Antijenik Değişiklik
Neisseria gonorrhoeae, pililerin adezin uçlarında devamlı değişiklik yaparak konak antikorlarından
kurtulur. Salmonella, K ve H antijenlerinde değişiklik yaparak, daha önceki antijenik yapıya karşı
oluşmuş olan antikorlardan kurtulur.
2.B.2.Antijenik Benzerlik
Neisseria meningitidis siyalik asit, Streptococcus pyogenes ise hyalüronik asit içeren kapsüle
sahiptir. Bu yapılar konak dokusunda bulunanlar ile benzerlik gösterir. Bu nedenle kapsüle karşı
antikorların oluşmasını engelleyerek konak savunmasından kaçarlar. Diğer bazı bakterilerin de
yüzeylerini fibronektin, laktoferrin ve transferrin gibi konak proteinleri ile kapladığı görülmektedir.
2.B.3.Antikora Tersten Bağlanma
Staphylococcus aureus protein A ve Streptococcus pyogenes protein G oluşturur. Bu proteinler
konak antikorlarının Fab kısmı yerine Fc kısmına bağlanırlar. Böylece bakteri antikorla kaplanmasına
rağmen opsonizasyon gerçekleşmez.
2.B.4.Ortama Salınan Benzer Antijen Oluşturma
Streptococcus pyogenes, IgG ve IgM antikorlarını bağlayan M-like protein oluşturur. Neisseria
gonorrhoeae Rmp (protein III) olarak tanımlanan proteini ile diğer yüzey proteini ve LOS’a karşı
oluşan antikorlardan korunur.
2.B.5.İmmunglobilinleri Parçalayan Proteaz Oluşturma
Haemophilus influenzae, Streptococcus pneumoniae, Helicobacter pylori, Shigella flexneri,
Neisseria meningitidis, Neisseria gonorrhoeae ve enteropatojenik E.coli immünglobülin proteaz
salgılayarak sekresyonda bulunan IgA’ları parçalarlar.
3.Konak Hasarı
Bakterilerin konakta hasar oluşturma mekanizmalarının
yapıları ile konakta hasar oluşturdukları görülmektedir.
temeline baktığımız zaman iki farklı
3.A.Endotoksinler
Endotoksin bakteri hücre duvar yapısını oluşturan moleküllerdir. Gram-negatif bakteride LPS,
Gram-pozitif bakteride peptidoglikan ve lipoteikoik asit endotoksinleri oluşturmaktadır.
Enfeksiyon etkeni konağa girdiği zaman konak onu yabancı olarak algılar. Patojenin tanınması
enfeksiyon etkeninde olan ama konakta olmayan moleküller ile olur. Yani konak daha önce
karşılaşmadığı yabancı cismi tanımakta ve ona karşı cevap oluşturmaktadır. Bu yanıta doğal bağışık
yanıt denir. Konak bağışık sisteminin daha önce hiç karşılaşmadığı halde tanıdığı bu moleküllere,
patojenite ile ilişkili moleküler dizilim denilmektedir. Bunlar peptidoglikan monomerleri, teikoik
asit, LPS, mikolik asit ve mannoz gibi yapılardır ki işte bunlar endotoksinlerdir. Konak hücrelerinde bu
molekülleri tanıyan ve patojen tanıyan reseptörler veya PRR olarak isimlendirilen özel reseptörler
vardır. Gram-negatif bakteri hücre duvarının dış membranından ayrılan LPS ilk olarak kanda bulunan
LPS-bağlayan proteinlere bağlanarak kompleks oluşturur. Bu kompleks makrofajlar üzerinde
bulunan CD14 moleküllerine bağlanır. LPS doğrudan TLR-4’e de bağlanabilir. LPS bağlayan proteinin
CD14 ile temas etmesi sonucu TLR-4, LPS’e cevap verir. Gram-pozitif bakteri peptidoglikan
monomerleri ve lipoteikoik asit hücre duvar komponentleri makrofaj yüzeyinde bulunan TLR-2 ve TLR4 gibi reseptörlere bağlanır. TLR gibi PRR ile bağlanma sonucu makrofaj proenflamatuar sitokin
olarak isimlendirilen sitokinleri salgılar. Sitokinler hücre içi düzenleyici proteinler olup sentez edildiği
hücreyi veya bir diğer hücreyi etkilemektedirler. Sitokinler enflamasyona neden olurlar. Bakteri aynı
zamanda kompleman yolağını aktive eder. Kompleman yolağı ise pıhtılaşma sistemi üzerine etki eder.
LPS, peptidoglikan veya lipoteikoik asit nötrofiller üzerinde bulunan PRR olan TLR’lere bağlandığı
zaman, nötrofiller içinde taşınan proteaz ve toksik oksijen radikalleri dışarıya boşalır. Bu hücre dışı
ölümü IL-8 gibi kemokinler uyarır.
LPS ve sitokinler NO sentezini artırırlar. Bazı Gram-negatif bakterilerde LPS dışında veya LPS ile
beraber lipoproteinler ve bazılarında ise LPS yerine LOS enflamasyonda rol oynarlar. Bunlara örnek
olarak Mycobacterium tuberculosis ve Mycobacterium leprae gibi patojen bakterilerden ortama mikolik
asit ve peptidoglikan açığa çıkar. Mikolik asit ve peptidoglikan molekülleri makrofajlarda bulunan
PRR’lere bağlanarak sitokin salgılanmasına neden olurlar ve enflamasyonu başlatırlar. Mycobacterium
tuberculosis enfeksiyonunda ortaya çıkan enflamasyondan sorumlu olan sitokinlerden en önemlisi TNFα’dır.
Şimdi enflamasyon cevabının oluşmasını basamaklar halinde inceleyelim. Bakteri insan vücuduna
girdiği zaman bölgedeki makrofajlar tarafından genel anlamda yabancı olarak tanınır. Bu tanıma
sonucunda IL-1, IL-6, IL-8, IL-12, ve TNF-α salgılanır. IL-1 ateş ve damar epitelinde adezyon
moleküllerinin ekpresyonuna neden olurken IL-6 karaciğerde akut faz reaktanlarının sentezlenmesine
yol açar. TNF-α ise damar geçirgenliğinin artmasına neden olur ve IL-1 gibi damar endotelinde
adezyon moleküllerin ekspresyonuna yol açar. IL-8 bölgeye enflamatuar hücrelerin kemotaksisine yol
açar ve IL-12 ise NK hücrelerin aktivasyonuna neden olur. Bakterinin kendisi, immün kompleksler ve
IL-6 uyarımı sonucu karaciğerde sentezlenen lektinler kompleman sistemi uyarır. Uyarım sonucu C3a
ve C5a, IL-8 tarafından yapılan kemotaksis görevine yardım ederler. İmmün kompleksler , C3a ve C5a
mast hücreleri ve bazofillerden vazoaktif aminlerin salınımına neden olur. Kemotaktik maddeler
tarafından bölgeye çağrılan nötrofiller bakterilerin patojenite ile ilişkili moleküler dizilimleri ile
birleşerek fagositoza ve içeriklerini dışarı boşaltmalarına bunun sonucu olarak endotel hasarına neden
olurlar. Endotel hasarı bradikinin sistemini ve fibrin sistemini aktive eder. Kompleman sistemi ve
vazoaktif aminlerin etkisiyle vazodilatasyon, damar geçirgenliğinde artma meydana gelir. Uzamış
vazodilatasyon ve kapiller geçirgenliğin bozulması sonucu plazma enfeksiyon bölgesine geçer,
vasküler direnç düşer.Dolaşımdaki kan volümü azalır. Bunun sonucunda hipotansiyon, organ ve
dokuların kanlanmasında azalması ortaya çıkar. Karaciğer fonksiyonları bozulur ve kan şekeri düşer.
Aynı şekilde böbrek ve GİS hasarı ortaya çıkar. Koagülasyon yolağının aktivasyonun sonucu kan
damarlarında pıhtılaşma meydana gelir. Kan ve oksijen hayati organlara ulaşamaz. Pıhtılaşma
faktörlerinin tükenmesi sonucu yaygın kanamalar görülür. Pıhtılaşma sistemindeki iki kademeli tabloya
yaygın damar içi koagülasyon veya DIC denir.
Akciğer alveollerinde bulunan kapiller damarlarda ortaya çıkan geçirgenlik artışı sonucu pulmoner
ödem ve gaz değişiminde azalma meydana gelir. Akciğerlerde oluşan klinik tabloya akut solunum
yetmezliği sendromu veya ARDS denilir.
Hipotansiyon, hipovolemi, perfüzyon azalması, ARDS birlikte asidoz ve kalp kan atım volümü
azalması ortaya çıkar. Sitokin uyarımı sonucu kalp kaslarının aşırı NO üretimi kalp yetmezliğine neden
olur.
İşte küçük bir sivilce ile septik şokun oluşma mekanizması budur. Bu iki klinik tablo arasındaki fark
ortamdaki antijen ve sentezlenen sitokin miktarıdır. Bu miktarlar az olursa küçük bir enflamasyon,
yüksek miktarda ise şok ortaya çıkar.
3.B.Ekzotoksinler
Toksin Yunanca toxikon kelimesinden gelmekte olup zehir anlamı taşımaktadır. Bakteriler duvar
yapılarından başka, çeşitli toksinler oluşturarak konağa zarar verirler.
Toksin sentezi genellikle plazmid veya faj tarafından aktarılan genetik bilgiler ile sağlanır. Toksin
sentezinin kontrolü kromozomal veya plazmid kaynaklı olabilir. Toksin sentezini kontrol eden genler
çevresel uyarılar ile aktive olurlar. Corynebacterium diphtheriae’de toksin sentezleyen genler faj
tarafından bakteriye aktarılırken kontrol geni DtxR kromozomda bulunmaktadır. Staphylococcus aureus
enterotoksinin yapısal genleri kromozomal veya plazmid kaynaklı olabilir ama kontrol genleri plazmid
kaynaklıdır.
Gram-pozitif bakteriler sentezledikleri toksinlerini doğrudan dış ortama salarlar. Gram-negatif
bakteriler ise toksinlerini beş değişik sekresyon mekanizmasından birisini kullanarak hücre dışına
ulaştırmaktadırlar. Bunlar bir tablo halinde sunulmuştur. Tabloda yer alan ekzotoksinlerin dışında
elastaz, fosfolipaz gibi membran hasarı yapan toksinlerin birçoğu tip II sekresyon sistemi ile salınırlar.
Tablo 2.-Ekzotoksinlerin Salınım Mekanizmaları
Bakteri
Toksin veya Protein
Esherichia coli
Hemolizin
Pasteurella haemolytica
Lökosidin
Bordetella pertussis
Adenilaz Siklaz
Vibrio cholerae
Kolera Toksin
Pseudomonas aeruginosa
Ekzotoksin A
Yersinia
Yop E, H, J
Pseudomonas aeruginosa
Ekzoenzim s
Enteropatojenik E.Coli
Tir
Bordetella pertussis
Boğmaca Toksini
Helicobacter pylori
Cag A
Serratia marcescens
Hemolizin
Helicobacter pylori
VOT
Bordetella pertussis
BrkA
Sekresyon
Tip I
Tip I
Tip I
Tip II
Tip II
Tip III
Tip III
Tip III
Tip IV
Tip IV
Tip V
Tip V
Tip V
Bakteri ekzotoksinleri Tip I, II ve III olmak üzere üç başlık altında incelenebilir.
3.B.1.Tip I Ekzotoksinler (Pirojenik Ekzotoksinler)
Tip I ekzotoksinler süper antijenlerdir. Normal bir antijene baktığımız zaman konak hücre APC
tarafından alınır, epitoplarına ayrılır ve MHC-II ile bağlanır. İşlenmiş antijen APC yüzeyinde MHC-II ile
beraber sunulur. Bu şekilde T4 lenfositler tarafından tanınır. Süper antijenler ise dışarıda bulunan
MHC-II molekülüne doğrudan bağlanarak T4 lenfositler ile etkileşime girmektedir. Çok fazla sayıda T4
lenfositin aktivasyonu sonucunda ciddi miktarda IL-2 salgılanır. Salınan IL-2 kana karışarak ateş,
bulantı, kusma, ishal ve halsizlik gibi semptomlara neden olur. Diğer taraftan IL-2 bazı sitokinlerinin
salgılanmasına neden olur. Bu sitokinler arasında TNF-α, IL-1, IL-8 ve PAF sayılabilir. Tüm bunlar
endotel hasarına, akut solunum yetmezliği sendromuna, DIC, şok ve organ yetmezliği gibi daha önce
gördüğümüz septik şok tablosuna neden olur. Bazı Staphylococcus aureus suşları toksik şok sendromu
toksin-1 üretirler. Bu toksin toksik şok sendromuna neden olur. Şiddetli sitokin üretimi ateş, döküntü
ve sonunda şok gelişimine neden olur.
Streptococcus pyogenes’in bazı suşları tarafından pirojenik ekzotoksin üretilmektedir. Pirojenik
ekzotoksin, süper antijen etkisiyle toksik şok sendromu benzeri klinik tabloya neden olmaktadır.
Staphylococcus aureus suşları enterotoksin salgılayabilir. Enterotoksin süper antijen olarak
davranmaktadır. Fazla miktarda IL-2 salınması sonucunda ateş, bulantı, kusma ve ishal ortaya
çıkmaktadır. Kusma, toksinin vagus sinirini uyarımı sonucu ortaya çıkabilir.
3.B.2.A-B Modeli Toksinler
Bakteri ekzotoksini dediğimiz zaman esas anlaşılan toksin grubu bu grup olup tip III toksin olarak
da bilinmektedirler. Bu toksinler için A-B modeli toksin nitelendirmesi yapılmaktadır. Toksinlerin A ve
B olmak üzere iki kısımdan oluşmaları nedeniyle böyle bir tanımlama yapılmıştır. B kısmı toksinin etki
ettiği hücrede bulunan uygun reseptöre bağlanma görevini yürütmektedir. Bağlanma olduğu zaman ya
A ve B kısmı birlikte endositoz yoluyla hücre içine girmekte ve burada A kısmı ayrılarak sitoplazmaya
geçmekte veya bağlanma sonrası sadece A kısmı konak hücresine girerek sitoplazmaya geçmektedir.
A-B modeli toksinlerde aktif olan A kısmı etkisini farklı şekillerde göstermektedir.
Geçmişte B kısmının sadece bağlanmadan sorumlu olduğu ve inaktif olduğu düşünülmüştür. Ancak
günümüzde boğmaca toksini, kolera toksini, ısıya-duyarlı enterotoksin ve E.coli alfa-hemolizini B
birimlerinin reseptörlerine bağlandığı zaman biyolojik etki ortaya çıkardıkları gösterilmiştir.
Bakteri toksinlerin bir kısmının ise A-B modeline uymadığı, sadece aktif A kısımlarının olduğu
görülmüştür. Bu toksinlerin, bakterilerin tip III sekresyon sistemleri sayesinde doğrudan konak
hücrenin içine doğru verildiği gösterilmiştir. Pseudomonas aeruginosa ve Yersinia türleri tarafından
salgılanan bazı toksinler bu grup toksinlere örnek olarak verilebilir.
Bacillus anthracis şarbon toksini salgılamaktadır. Aktif olan A kısmı Lethal Faktör (LF) ve Ödem
Faktörü (EF), B kısmı ise Koruyucu Antijen (PA) içermektedir. LF ve PA birlikte metalloproteinaz etki
göstermekte ve mitojen ile aktif olan protein kinazın kesilmesine neden olmaktadır. Oluşan kompleks
aynı zamanda makrofajlardan proenflamatuar sitokinlerin salınımına yol açmaktadır. EF ise PA ile
birlikte adenilaz siklazın artmasını sağlar. LF ve EF konak doğal bağışıklık sistemini baskılamaktadır.
Bordetella pertussis toksini guanin nükleotid bağlayan G proteinlerini ADP-ribozilasyonu yaparak
etkisiz hale getirir. Düzenlemenin ortadan kalkması sonucu siklik adenozin monofosfat (cAMP) seviyesi
artar. Bu artış solunum sekresyonu ve mukus miktarında artmaya neden olur. B.pertussis
patogenezinde yer alan ikinci toksin olan adenilaz siklaz/hemolizin hücre içindeki ATP’yi cAMP’ye
çevirir. Toksin lökositlerin kemotaksis, fagositoz ve öldürme yeteneğini inhibe eder. Bir diğer Bordetella
toksini olan trakeal toksin peptidoglikan parçası olup IL-1 salınımına ve bunun sonucunda ateşin ortaya
çıkmasına neden olur. Trakeal toksinin başka bir etkisi ise silya fonksiyonlarının bozulmasıdır.
Corynebacterium diphtheriae tarafından salgılanan difteri toksini, konak hücrede bulunan HB-EGF
reseptörlerine bağlanarak EF-2 üzerine etki eder ve protein sentezini bozar. Klinik tablodan toksinin
yanında bakteriye ait diğer virulans faktörleri de sorumludur. Pseudomonas aeruginosa tarafından
sentezlenen Ekzotoksin-A toksini aynı mekanizma ile hücrede protein sentezini durdurur. Fakat
reseptörleri farklı olduğu için difteri klinik tablosunu oluşturamaz.
Clostridium botulinum botulinum toksini salgılar. Botulinum toksininin yedi farklı serotip vardır.
Toksinlerin hedefi SNARE proteinleri olan synaptobrevin, SNAP-25 ve syntaxin olup nörötransmiter
taşıyan veziküllerin sinapslara füzyonu engellenir. Asetilkolin salınımının engellenmesi sonucu yumuşak
paraliziler görülür. Clostridium tetani metalloproteinaz aktivitesine sahip olan tetanoz toksini salgılar.
Bu toksine tetanospazmin denir. Toksin alındıktan sonra GD1b gangliozid reseptöre bağlanır ve
retrograd yolla alfa motor nöronlara gelir. Toksin inhibitör γ-aminobütürik asit nöronlarına gelir.
Burada nörötransmiter taşıyan veziküllerin sinapslara füzyonu engellenir. İlginç olan, bu engelleme
SNARE proteini olan synaptobrevin üzerinden yapılmasıdır. İnhibitör nörotransmiterlerin engellenmesi
sonucu asetilkolin salınımı durdurulamaz ve sert paraliziler meydana gelir. Metalloproteinaz
inhibitörlerinin verilmesinin tedavide yeri olabilir. Clostridium botulinum ve Clostridium tetani hedef
olarak SNARE proteinlerinden synaptobrevini kesmelerine rağmen etkileri farklı olmaktadır. Bunun
nedeni hedef olan hücrelerin farklı olmasıdır. Yüksek miktarda tetanoz toksini lokal verildiği zaman
yumuşak paraliziler oluşması bu tezi desteklemektedir.
Tablo 3.-A-B Modeli Toksinlerde Aktif Kısım Fonksiyonları
Bakteri
Toksin
cAMP Üzerine Etkili Toksinler
Bordetella türleri
Adenilat Siklaz Toksin
Bacillus anthracis
EF+PA
Pseudomonas aeruginosa
ExoY
Vibrio cholerae
Kolera Toksini
Esherichia coli
Isıya-Duyarlı Toksin
ADP-Ribozilasyonu Yapan Toksinler
Corynebacterium diphtheriae
Difteri Toksin
Pseudomonas aeruginosa
Ekzotoksin A
Bordetella pertussis
Boğmaca Toksini
Clostridium botulinum
C2 Toksin
Clostridium botulinum
C3 ADP-ribozil transferaz
Rho Proteinleri Üzerine Etkili Olan Toksinler
Escherichia coli
CNF1, CNF2
Bordetella pertussis
Dermonekrolitik Toksin
Clostridium difficile
Toksin A ve B
Metalloproteaz Toksinler
Enterotoksijenik Bacillus fragilis
Bacillus fragilis enterotoksin
Clostridium botulinum
Botulinum Nötotoksini
Clostridium tetani
Tetanoz Nörotoksini
Bacillus anthracis
LF+PA
RNA Üzerine Etkili Toksinler
Shigella dysenteriae
Shiga Toksin
Escherichia coli
Shiga Benzeri Toksin
Vibrio cholerae tarafından salgılanan kolera toksini Gs olarak ifade edilen proteinin ADPribozilasyonuna neden olarak etki eder. Bu işlem sonucu cAMP oluşur. Fazla miktarda cAMP barsak
lümeninde bulunan epitel hücrelerinden sodyum geri emilimini engellemekte ve fazla miktarda klor
atılımına neden olmaktadır.
Escherichia coli ısıya duyarlı toksin salgılar. Isıya duyarlı toksin LT-I ve LT-II olarak ayrılır. LT-I
kolera toksini ile aynı etki mekanizmasına sahiptir.
Escherichia coli ısıya dayanıklı olan ve ST ile gösterilen ikinci bir toksin daha oluşturur. ST endojen
guanilat siklazı aktive ederek cGMP artışına ve ishale neden olur. Memeli hormonu olan guanilin ile ST
benzer yapı gösterdiği için ST guanilin reseptörüne bağlanır. Toksin etkisiyle cGMP artışı protein G
fosforilasyonuna ve klor atılımına neden olur.
C.difficile toksin A ve toksin B olmak üzere iki toksin oluşturur. Toksin A bir enterotoksin olup aynı
zamanda nötrofiller üzerine kemotaktik etkiye sahiptir . Toksin A, sitokin salınımına ve barsak hücreleri
arasındaki birleşmenin gevşemesine neden olur. Barsaklarda hücreler arası sıkı bağlanmanın
gevşemesi ile lümene barsak içeriği kaçar, ishal ortaya çıkar. Toksin B ise bir sitotoksin olup aktin
depolimerizayonuna neden olur.
3.B.3.Tip II Toksinler
Birçok bakteri membran hasarı oluşturan toksin salgılar. Membran hasarı oluşturan toksinler
Tip II toksin olarak bilinir. Tip II toksinler etkilerine göre 3 başlık altında incelenebilir.
A.-Membran fosfolipidini hidrolize eden toksinler :
Bu toksinlere örnek olarak fosfolipaz C, fosfolipaz D, spingomyelinaz aktivitesi gösteren toksinler
verilebilir.
B.-Deterjan benzeri etki ile membranın erimesine neden olan toksinler:
Staphylococcus aureus θ toksin örnek olarak verilebilir.
C.-Kanal veya por oluşturan toksinler :
Tip II toksinlerin en büyük grubunu oluşturur. Por oluşturan toksinlerin bir grubu kolesterol bağımlı
sitolizinlerdir. Kolesterol bağımlı sitolizinler Clostridium, Listeria, Streptococcus, Bacillus ve
Arcanobacterium gibi Gram-pozitif bakteriler tarafından salgılanır. Escherichia, Enterobacter, Proteus
ve Bordetella gibi Gram-negatif bakteriler tarafından salgılanan por oluşturan toksinler RTX yani
salınmaya hazır toksin yapısındadır. Örnek olarak hemolizin ve lökosidin verilebilir. Por oluşturan
toksinleri aşağıdaki fonksiyonları yerine getirirler.
a.-Konak hücre besinlerin dışarıya çıkması ve hücrenin ölümü.
b.-Tip III sekresyon sistemi içinde görev alma.
c.-Vakuol membranının hasarı ve bakterinin sitoplazmaya kaçması.
d.-Hücre membranın içten hasarı ve bakterinin dışarıya kaçması.
Tip II toksinlerden bazıları aşağıda sunulmaktadır.
H. pylori musinaz ve fosfolipaz oluşturarak mide mukozasında hasara neden olur. S.pneumoniae
pnömolizin
oluşturur ve konak hücre kolesterolüne bağlanır. Silyalı epitel hücreleri, akciğer dokusu
ve damar epitel hücrelerinde hasara neden olur. S.pyogenes eritrosit membranına litik etkili olan
hemolizin, proteinleri parçalayan proteaz, DNA’yı parçalayan DNAz ve fibrin üzerine eritici olan
streptokinaz salgılar. Lökosit ve lizozom mebranlarını etkileyen lokosidin salgılarlar.
S.aureus lökositleri eriten lökosidin salgılar. Streptokinaz ile aynı fonksiyona sahip stafilokinaz, kan
plazmasını pıhtılaştıran koagülaz, memeli hayvanların dokularını birbirine bağlayan ve bağ dokusunun
esasında bulunan hyalüronik asidi parçalayan Duran-Reynals faktörü olan hyalüronidaz salgılar.
C.perfiringens lesitini yıkan lesitinaz, bağ dokusunu yıkan kollagenaz ve bağ dokusundaki hyalüronik
asidi parçalayan hyalüronidaz salgılar. P.aeruginosa doku hasarına neden olan alkalen proteaz,
lökositlerin membranlarında hasar oluşturan sitotoksin, akciğerdeki elastini parçalayan elastaz
sentezler. Bazı bakterilerde bulunan IgA proteaz, IgA1’ i parçalar. Buna örnek olarak N.gonorrhoeae,
S.pneumoniae, N.meningitidis, H.influenzae verilebilir.
Tablo 4.-Tip III Ekzotoksin ve Endotoksin farkları
EKZOTOKSİN
ENDOTOKSİN
Gram-pozitif ve Gram-negatif
Gram-pozitif ve Gram-negatif
bakteriler tarafından salgılanır.
bakterilerin parçalanması sonucu
oluşur.
Yaşayan hücreler tarafından
Bakteri ölümü veya çoğalmasında
sentezlenir.
ortaya çıkar. Hücre duvarı parçasıdır.
Polipeptid yapısındadır.
Peptidoglikan, muramik asit ve LPS.
Isıtmakla toksisitesi kaybolur.
Isıtmaya dayanıklıdır.
Antijeniktir. Anti toksik antikorlar
Zayıf antijeniktir.
oluşturur ve bu antikorlar toksini
nötralize eder.
Genellikle ısı, formalin vb. yöntemler
Toksoid hale dönmez.
ile toksoid hale döndürülerek aşı
olarak kullanılır.
Deney hayvanlarına son derece
Deney hayvanlarına orta derecede
toksiktir.
toksiktir.
Özgül reseptörlere bağlanır.
Özgül reseptörü yoktur.
Genellikle ateş oluşturmaz.
IL-1 ve diğer mediatörlerin salınımına
bağlı olarak ateş oluşturur.
Genellikle ekstrakromozomal genler
Kromozomal genler tarafından
tarafından kontrol edilir.
kontrol edilir.