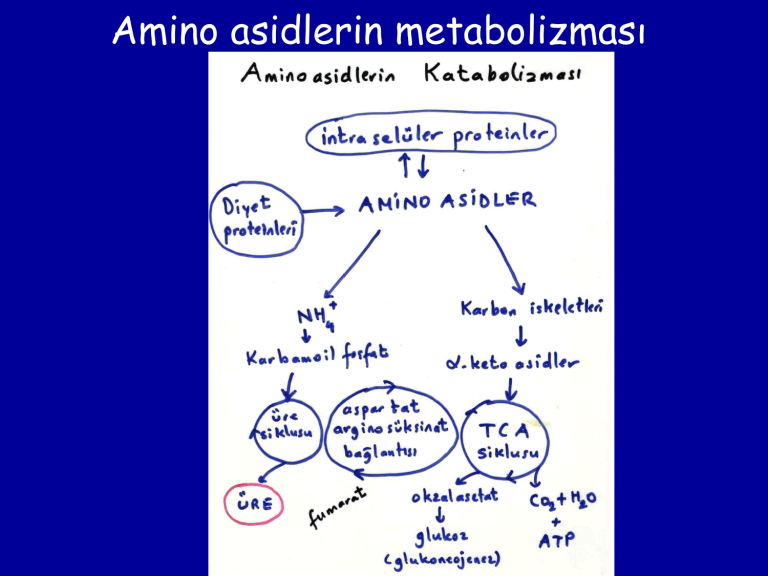
Amino asidlerin metabolizması
Transaminasyon
Piruvik asid
CH3
Alanin
CH3
C=O
CH-NH2
COOH
COOH
NH2
CH2CH
Fenilalanin
O
CH2C
COOH
transaminaz
(kofaktör B6 vit=
piridoksal fosfat)
COOH
Fenilpiruvik asid
Transaminasyon
COOH
COOH
CH2
+
Piridoksal
fosfat
Piridoksamin
fosfat
COOH
CH2
COOH
CH2
CH2
CH-NH2
C=O
COOH
COOH
glutamat okzalasetat
transaminaz (GOT) =
aspartat transaminaz (AST)
Aspartik asid 2-Oksoglutarik asid
CH2
+
CH2
C=O
CH-NH2
COOH
COOH
Okzalasetik asid
Glutamik asid
sülfit oksidaz
SO32- + O2 + H2O
SO42- + H2O2
İdrarda SO42- iyonu halinde atılır
Zehirsizleştirmede rol oynar
Bazı bileşiklerin suda, kanda çözünen
bileşikler haline gelmesini sağlar.
C- terminal (uç)
N-terminal (uç)
Glutationun organizmadaki
işlevleri
1- Doğal bir hücre içi antioksidanıdır. Hücre
içi oksido-redüksiyon reaksiyonlarına
katılır.
2-Ksenobiyotikleri vücuttan atılacak hale
getirir (sistein sağlayarak).
3-Bazı enzimlerin aktivasyonunda rol oynar.
4-Amino asidlerin hücre içine taşınmasında
rol oynar (-glutamil siklusu).
•
G-SH + Kse
G-S-Kse
Glutation-S-transferaz
• Glutation katepsinler ve Fibrini stabilize
eden faktör gibi –SH içeren enzimler için
aktivatördür.
• -glutamil siklusu ile amino asidlerin
hücrelerin içine taşınmasında rolü vardır.
• Karnosin N-(-alanil) histidin
• Anserin N-(-alanil) 3-metilhistidin
Peptid yapısındaki hormonlar
• Oksitosin ve vazopressin, 9 amino asid
(hipofiz arka lob)
• Adrenokortikortikotropik hormon
(ACTH), 39 amino asid (hipofiz ön lob)
• İnsulin, 51 amino asid (pankreas)
• Glukagon, 29 amino asid (pankreas)
• Tirokalsitonin, 32 amino asid (tiroid)
Proteinlerin yapısı
•
•
•
•
Birincil yapı
İkincil yapı
Üçüncül yapı
Dördüncül yapı
Linus Pauling 1901-1994
1954 Nobel Kimya; 1962 Nobel Barış
• 1930 ve 1940’lı yıllarda Linus Pauling ve
Robert Corey polipeptid zincirinin
yapısını X ışınları ile tayin etmişlerdir.
İkincil Yapı
• α – Helezon
konformasyonu (molekül
içi hidrojen bağları), 3.6
kalıntıda bir α–heliks
oluşur.
β – Konformasyon (kırmalı tabaka
yapısı, moleküllerarası hidrojen bağları)
Bu bağlarda oluşan üçüncül yapı
sonucunda
• Globuler (yumak şeklinde) protein
• Fibriler (lifsel) protein meydana gelir.
Fibriler (lifsel) proteinler
• a) İkincil yapıları -helezon tarzında olan polipeptid zinciri
aynı şekilde ikincil yapısı oluşmuş bir başka polipeptid
zinciriyle yeni bağlar oluşması sonucunda birleşir, bu suretle
fibriler (lifsel) proteinler meydana gelir. (Miyozin,
fibrinojen, α-keratin)
• b) İkincil yapısı -konformasyon tarzında olan bir çift
polipeptid zinciri, ikincil yapısı konformasyon tarzında olan
başka bir çift polipeptid zinciri arasında meydana gelen
bağlar sonucunda birleşir ve fibriler proteinler oluşur. (βkeratin, ipek fibroini)
• Fibriler proteinler, üçüncül yapılarındaki güçlü disfülür (-SS-) bağları nedeniyle dış etkenlere ve proteinleri hidroliz
eden enzimlere karşı çok dayanıklıdırlar ve suda
çözünmezler. Fibriler proteinler, dokuların yapısını oluşturur.
Dördüncül yapı
• Üçüncül yapıları bulunan proteinlerin,
protomer denilen alt birimlerinin hidrojen
bağları, van der Waals çekmeleri, iyon
bağları ile polimerize olmalarıyla dördüncül
yapı oluşur.
Skleroproteinler
Skorbüt
Sıcak su ile jelatin oluşur
Ehlers-Danlos
Sendromu
Kollajen moleküllerinde amino asid dizisinin tekrarlayan
tripeptid şeklindedir. Bu tekrarlayan tripeptid,
(GlisinXProlin) veya (GlisinXHidroksiprolin) şeklinde
gösterilebilir ki burada X, herhangi bir amino asid olabilir.
Kollajen, bulunduğu dokulara dayanıklılık verir, doku şeklini
korur ve dokuya gerilme direnci sağlar.
Kollajen, kanın pıhtılaşmasında etkilidir; kan pıhtısı ile
etkileşerek yara deliğini kapatır,
Deriden elde edilmiş kollajen liflerinin
elektron mikroskoobunda görüntüleri
Elastin bulunduğu dokulara (damar, deri,
akciğerler) esneklik sağlar.
Elastinin esnekliği çapraz dezmosin bağları
ve amorf yapısından kaynaklanır. Dört lizin
molekülü bir araya gelince ortaya dezmosin
çapraz bağı gelir.
Yün keratininde disülfür bağı az, kolayca eğilebilir, bükülebilir.
Boynuz, saç, tırnakta disülfür bağı çok bu nedenle çok serttirler.
Saç lifi sıcakta gerildiğinde -heliks hidrojen bağı kopar ve -kırmalı
tabaka yapısına döner ve saçın boyu uzar.
Bir saç telinde ortalama 20 000
polipeptid zinciri bulunur.
Bazı Önemli
Proteinler
•
•
•
•
•
Kan serumu ve kan plazması proteinleri:
Kan
Kan serumu
Kan + antikoagülan
Kan plazması
Kanda total protein %6-8 g’dır.
Serumda %3-4 g serum albumin, %2-3 g
serum globulinler, plazmada ise bunlara
ilaveten fibrinojen vardır.
Fibrinojen
•
•
•
•
•
Glikoprotein yapısındadır.
Mol.ağ. 341.000.
Kan plazmasında %0.4 g.
Karaciğerde sentezlenir.
Ağır karaciğer hastalıklarında kanda
azalır, bazı infeksiyonlarda artar.
Fibrini stabilize eden faktör (Faktör XIII)
Kan pıhtılaşması
tromboplastin
1.
Protrombin
F III
Trombin
Diğer faktörler
F IIa
F II
trombin
2. Fibrinojen
Fibrin
(monomer)
Fibrin
(agregat)
FI
FSF
trombin
Ca2+
Aktif FSF
Ca2+
F XIII
F IV
Fibrin
(polimer, gerçek pıhtı)
Kan pıhtılaşması
İntrensek yol
XII
Ekstrensek yol
XIIa
XI
XIa
doku faktörü
IXa
IX
X
VII
VIIa
Xa
antitrombin
Va
V
II
IIa
I
Ia
fibrinojen çözünür fibrin
XIII
XIIIa
çözünmez fibrin
PIHTI
K vitamininin pıhtılaşmadaki rolü
• Preprotrombin
(Glutamik asid)
Protrombin
(4-karboksi glutamik asid)
• Faktör VII, IX ve X’un biosentezi için K vitamini
gerekli.
• K vitamini antagonisti heparin ve dikumarol
(çürümüş tatlı yoncada bulunmuştur) tromboza
engel olmak için tedavide kullanılırlar.
• K vitamini eksikliğinde kanın pıhtılaşma zamanı
uzar, organizmanın kanamalara eğilimi artar.
Buna sebep kandaki protrombin eksikliğidir.
HEMOFİLİ
•Hemofili A. Kral sülalesi hastalığı.
Faktör VIII (% 85)
•Hemofili B: Faktör IX (%15)
Hemofiliyle ilgili yazılı ilk kaynaklar, MS II yy
Yahudilerin Talmud adlı kitabında yer alan el
yazmalarına dayanır. 12. yüzyılda yaşamış olan
Endülüs’lü bilim adamı Ebu-l Kasım el Zehravi’nin
eserlerinde hemofiliden bahsedilmektedir.
Hemofilinin toplum tarafından tanınması,
1800’lerde hastalığın İngiltere kraliçesi
Victoria’dan kendisinden sonra gelen nesillere ve
onun neslinden olan diğer kraliyet ailelerine
(İspanya, İtalya, Rusya) geçmesine dayanmaktadır
Serum albumin
• Serum albumin: Kan serumunda %3-4 g
serum albumin bulunur.
• Mol. ağ. 69.000.
• Özellikle karaciğerde sentezlenir.
• Elektroforezde (kan serumu) albuminden
daha ileride göç eden bir fraksiyon
vardır, buna prealbumin denir.
Globulin
Kan serumunda %2-3 g
serum globulin bulunur.
Globulinlerin -, -, olmak üzere alt sınıfları
vardır
Molekül ağırlıkları
160.000 ile 1.000.000
arasında değişir.
Globulinler RES
hücrelerinde ve
özellikle karaciğerde
sentezlenir.
• Molekül ağırlıkları: Çok farklı
• Denatürasyonları: Isı, UV ve X-ışınları, asid,
alkali, organik çözücüler ile denatüre olurlar.
2., 3., ve varsa 4. yapıları bozulur.
• Amfolit özellikleri
• Elektroforezi
Protein elektroforezi
Çöktürülmeleri
• Proteinler; ısı, çeşitli tuzlar (amonyum
sülfat, magnezyum sülfat, sodyum
sülfat), organik çözücüler, ısı, asid ve
bazlarla çöktürülebilir,
• Tuzlar dışındakilerle yapılan çöktürme
proteinleri denatüre eder ve proteinler
bir daha doğal şekillerine dönemez.
• Tuzlarla yapılan çöktürme proteinleri
denatüre etmez, yani koruyucu
çöktürmedir.
Dializ