208
Sitomegalovirüs Enfeksiyonları:
Etken ve Epidemiyoloji
Cytomegalovirus Infections: The Agent and Epidemiology
Emin Sami Arısoy
Kocaeli Üniversitesi Tıp Fakültesi, Çocuk Sağlığı ve Hastalıkları Anabilim Dalı, Çocuk Enfeksiyon Hastalıkları
Bilim Dalı, Kocaeli, Türkiye
Geliş Tarihi: 21.02.2011
Kabul Tarihi: 23.03.2011
Yazışma Adresi
Correspondence Address
Dr. Emin Sami Arısoy
Kocaeli Üniversitesi Tıp
Fakültesi, Çocuk Sağlığı ve
Hastalıkları Anabilim Dalı,
Çocuk Enfeksiyon
Hastalıkları Bilim Dalı,
Kocaeli, Türkiye
Tel.: +90 262 303 72 13
E-posta:
[email protected]
Özet
Summary
Sitomegalovirüs (SMV) her yerde bulunan bir etkendir; dünyanın her yerinde, bütün toplumsal, iktisadi ve ekinsel katmanlardan, bütün yaşlardaki insanlarda enfeksiyona yol
açar. Çoğu SMV enfeksiyonunun belirtisiz olması ya da hafif
hastalığa yol açmasına karşın, virüs yenidoğanlar ve bağışıksal sorunlu çocuklarda ağır hastalığa neden olabilir.
Yenidoğanların yaklaşık %1’i doğuştan SMV enfeksiyonlu
olarak dünyaya gelir. Bu bebeklerin çoğunda belirti yoktur,
ancak doğuştan enfeksiyonlu yenidoğanların %5-%15’i
doğumda belirtilidir. Bebekler, doğumda annenin rahim ağzı
ve vajen salgıları, doğumdan sonra da anne sütü aracılığıyla
SMV enfeksiyonu alabilir. Erkendoğan bebekler virüsü anne
sütünden edinmek açısından en yüksek risk altındadır.
Çocuklar virüsü küçük çocuklukta ve okul öncesi dönemde,
özellikle günlük çocuk bakımı kurumlarında da edinebilir.
SMV aile bireyleri arasında bulaştırılabilir; kaynak olgular
büyük çoğunlukla küçük çocuklardır. SMV’nin cinsel yolla
bulaşımı da iyi tanımlanmıştır. Kan ürünleri ve organ aktarımı, hastanelerdeki SMV enfeksiyonu kaynaklarıdır. Öte
yandan, hastanelerde SMV’nin bireyler arasında bulaşımı
tanımlanmamıştır. (J Pediatr Inf 2011; 5 (Suppl 1): 208-12)
Anahtar kelimeler: Sitomegalovirüs, bulaşım, epidemiyoloji
Cytomegalovirus (CMV) is a ubiquitous virus that commonly
infects persons of all ages from all parts of the world and from
all socioeconomic and cultural backgrounds. Although most
CMV infections are asymptomatic or cause mild disease, the
virus can cause serious disease in newborns and
immunocompromised children. Approximately 1 percent of
newborns are born congenitally infected with CMV. Most of
these babies are asymptomatic, but 5 to 15 percent of
congenitally infected newborns will have symptoms at birth.
Infants may be perinatally infected with CMV via contact with
maternal cervicovaginal secretions during delivery or from
breast milk ingestion after delivery. Preterm infants appear to
be at greatest risk of acquiring the virus from breast milk.
Children may also acquire the virus during the toddler years
or preschool years, especially in group daycare settings.
CMV can be transmitted among family members; young
children most frequently are the index cases. The sexual
transmission of CMV also is well documented. Blood products
and organ transplantation are sources of CMV infection in
hospitals. However, the nosocomial transmission of CMV
from person to person has not been documented.
(J Pediatr Inf 2011; 5 (Suppl 1): 208-12)
Key words: Cytomegalovirus, transmission, epidemiology
“Ülkesini, yüksek istiklâlini korumasını bilen Türk milleti,
dilini de yabancı diller boyunduruğundan kurtarmalıdır.”
Mustafa Kemal Atatürk
2 Eylül 1930
yaygınlığından ötürü, bir hastalık sürecinde yer alıp
almadığı, sağaltım gerekip gerekmediği konularında
karar vermek kimi zaman güç olabilir. Böylesi durumlarda, SMV ve görülüm özelliklerine (epidemiyoloji)
ilişkin bilgiler karar için yardımcı olacaktır (2).
Sitomegalovirüs (SMV), her yerde bulunan bir
virüstür; bütün yaş, soy, toplumsal konum, kültür ve
coğrafyalardan insanlarda enfeksiyon yapar.
Enfeksiyonları çoğu kez belirtisizdir ya da hafif bir
hastalık ortaya çıkar. Ancak SMV, özellikle yenidoğanlar ve bağışıksal sorunlu (immün-kompromize)
bireylerde ağır hastalığa yol açabilir (1,2). SMV’nin,
Sitomegalovirüs
SMV, Epstein-Barr virüsü (EBV), herpes simpleks
virüsleri (HSV) 1 ve 2, varisella-zoster virüsü (VZV),
insan (human) herpesvirüsleri (HHV) 6, 7 ve 8 ile birlikte, herpesvirüs ailesinin bir üyesidir. Bu virüsler
J Pediatr Inf 2011; 5 (Suppl 1): 208-12
benzer özellikler taşır; genom çizgisel, çift sarmal DNA yapısındadır, kapsit ikoza-hedral bakışım (simetri) gösterir ve dışta bir
virüs zarfı bulunur (2). Herpesvirüs ailesinin diğer virüslerinde
olduğu gibi, SMV’nin de enfeksiyon ertesinde konakta gizli olarak kalıcılaşma (latensi) ve yeniden etkinleşme (re-aktivasyon)
özellikleri vardır. Böylece SMV yineleyen enfeksiyonlara yol açabilir.
SMV, HHV-6A, HHV-6B ve HHV-7 virüslerini de kapsayan
beta-herpesvirüs alt-ailesinin bir üyesidir. Doku kültüründe,
özgüllük gösteren bir görünüm (sito-patik etki) sergiler. SMV
yavaş çoğalır, hücre kültüründe enfeksiyonlu hücrelerde virüsün
ortaya çıkışı genellikle 24 saati bulur, sito-patik etkiyse birçok gün
ya da hafta sonra görünür duruma gelir. SMV’nin farklı sero-tipleri
yoktur, DNA incelemeleriyle belirlenebilen farklı kökenleri (strain)
vardır; bu özellik geno-tip sınıflaması olanağı sağlar.
SMV büyük ve karmaşık bir virüstür, 200-300 nm (nanometre: mili-metrenin milyonda biri; 10-9 metre) çapındadır; 162
kapsomerli ikoza-hedral bir kapsit ve içinde çizgisel, çift sarmal
bir DNA’dan oluşur. Kapsit, çoğunluğu virüsün şifrelediği proteinlerden oluşan bir ‘kılıf’yapı (tegument) tarafından sarmalanmıştır. SMV en dışta da konak hücresi endoplazmik retikülumu
ve Golgi yapısından köken alan, iki lipit tabakalı bir zar zarfıyla
çevrilidir. Zarf ayrıca virüsün şifrelediği 20’den çok gliko-protein
kapsar (4). İnsan SMV genomu, yaklaşık 235.000 baz çifti ve
166 protein şifreleyen genlerden oluşur. Yinelenen uç ve iç baz
çifti dizileri genomu uzun ve kısa iki özgül parçaya böler.
Genomun bu iki parçası arasındaki birleşim yeri çok değişken
bir bölgedir, alan çalışmalarında SMV kökenlerinin ayırımı için
kullanılır (4).
Sitomegalovirüs enfeksiyonu
SMV enfeksiyonu, hücre düzeyinde virüs zarfı ve konak hücresi zarının birleşmesiyle başlar, virüs genomunun çekirdeğe
serbestleşmesiyle sürer. Virüs zarfındaki gB ve gH glikoproteinleri, konak hücresi yüzeyindeki heparan sülfatla etkileşir;
SMV’nin tutunması ve zarfın hücre zarıyla birleşmesine aracılık
eder. Bu gliko-proteinler, etkisiz kılıcı (nötralizan) antikorlar için
de temel hedeftir (3).
SMV proteinlerinin yapımı, genlerin sıralı okunup çevrilmesiyle başlar. Hücreye girişi izleyen dakikalar içinde erken (alfa)
proteinler ortaya çıkar ve çoğalma sürecini başlatır. Ardından
ortaya çıkan (beta) proteinler virüs DNA’sının çoğalımını düzenler. Çoğalım döngüsünün geç (gama) evresinde yapısal proteinler üretilir ve virion (nükleo-kapsit) kurulur. Virüs DNA’sının
çoğalımı, protein yapımı, zarfsız virüs yapısının (virion) kurulması çekirdek içinde gerçekleşir; “baykuş gözü” olarak tanımlanan,
özgül sayılabilecek çekirdek içi içerti (inklüzyon), nükleokapsitlerin birikiminden oluşur.
Virüsün zarflanması çok adımlı bir işlemdir; çekirdek zarından tomurcuklanmayla başlar, sito-plazmada endozom zarlarının edinilmesiyle sürer. Virüs, hücre dışına çıkmak üzere, Golgi
yapısı aracılığıyla hücre yüzeyine taşınır. SMV enfeksiyonuna
uğramış hücrelerde görülen, virüse özgül sayılabilen sitoplazma içertisi, Golgi yapısında, nükleo-kapsitler ve virion ya da
DNA içermeyen zarflanmış kılıf yapıların birikimini yansıtır (4).
İnsanda SMV enfeksiyonu, virüs ile konak arasındaki
karmaşık bir dengeye göre biçimlenir. Genel sonlanım, belirtisizce oluşmuş, gizli olarak kalıcılaşmış bir enfeksiyondur.
Enfeksiyonun oluşum düzeneği ve virüsün -biyolojik davranışını
Arısoy E.S.
CMV Enfeksiyonları: Etken ve Epidemiyoloji
209
yönlendiren- özgül gen ürünleri arasındaki ilişki tam olarak belirlenememiştir (3). Ancak, SMV genlerince şifrelenen proteinlerin,
konakta hücre etkinleşmesi, akyuvar hareketi, doğuştan ve
edinsel bağışıklık ve yangısal yanıtı, virüsün yayılımı ve kalıcılığı
yönünde etkilemesine ilişkin araştırmalar sürmektedir. SMV
proteinlerinin kabaca yarısının virüs çoğalımında ya da virüsün
yapısal parçaları olarak görev aldığı, kalanların da olasılıkla
konak işlevleriyle etkileştiği düşünülmektedir (3).
Yayılım ve kalıcılık
Sağlıklı konakta SMV’nin olağan giriş yeri üst solunum yolu
ya da cinsel yol mukozasıdır. Virüsün çeşitli organlardaki dokulara yayılımı en çok kan yolundan (viremi) ve akyuvarların enfeksiyonuyla gerçekleşir, yayılımda damar endotel hücreleri de
olası bir rol oynar. SMV, nötrofil kemo-taksisinde tam işlevselliği olan bir alfa-kemokin şifreler; böylece konakta akyuvarlarla
yayılımının yönetimine de katılır (5). SMV’nin şifrelediği başka
kemokinler, kemokin algaçları (reseptör) ve sitokinler de saptanmıştır. Bu aracılar hücre yolculukları, hücre içi işaretleşme ve
konak hücresinin etkinleşmesini düzenleyerek viremi düzeyini
etkiler (5-7).
Farklı hücre çeşitleri enfeksiyona katılsa da, SMV enfeksiyonunda bez doku epitel hücrelerinin tutulumu en belirgindir (3).
SMV hastalığına ilişkin bir kanıt olmayan sağlıklı ve bağışıksal
sorunlu kişilerin otopsilerinde sıklıkla birçok organda (tükürük
bezi, akciğer, böbrek, karaciğer, pankreas, böbreküstü bezi,
bağırsak mukozası) SMV’ye özgül patolojik bulgular saptanır (4).
SMV’nin doğum ve sonrası (peri-natal) ve kan ve organ aktarımıyla bulaşımına ilişkin deneyim, virüs saçılımının, etkenin edinilmesinden 4-6 hafta sonra başladığını göstermektedir. Viremi
sıklıkla bu dönemde belirlenir ve belirtisiz enfeksiyonlu sağlıklı
konakta bile haftalarca sürebilir. İlk enfeksiyondan sonra virüs
idrar, gözyaşı, semen, rahimağzı salgıları ve anne sütü örneklerinin doku kültüründe kolayca üretilir. Virüsün tükürük, idrar ve
cinsel yol salgılarında saçılımı aylarca yıllarca sürebilir (3).
Güçlü bir antikor yanıtı karşısında bile etkin SMV çoğalımı
sürer, ancak çoğalım hücresel bağışıklık yanıtı gelişirken daha
yavaştır. SMV’nin, çoğalım döngüsünün farklı dönemlerinde
konak bağışıklık yanıtıyla etkileşme yeteneği sağlayan çeşitli
genleri vardır. SMV’nin, temel doku uygunluk birleşiği (majör
histo-kompatibilite kompleksi; MHC) I ve II sınıfı proteinleri
‘yanıltan’ ya da yapısını bozan, antijen işlenmesi ya da sunumuyla etkileşen, doğal öldürücü hücre öldürücülüğünü engelleyen özgül işlevleri belirlenmiştir (3). SMV’nin insandaki kalıcılığının, genomunun kemik iliğinde CD34+ kök hücrelerdeki devamlılığına bağlı olduğu düşünülür (4). SMV genomu içeren kemik
iliği CD34+ kök hücreleri, monosit-makrofaj ve dendiritik hücreler olarak olgunlaşır; SMV olasılıkla yangı öncülü (proenflamatuvar) sitokinlerin etkisi altında yeniden etkinleşir.
Bağışıksal yanıt
SMV’nin konak savunmasını ayarlayıcı çeşitli yetileri olsa da,
konağın savunma gücü önemlidir. SMV hastalığının sıklığı ve
ağırlığı bağışıksal (immün) işlevlerin bozulmasına koşutluk gösterir. Kanser ilacı sağaltımı, organ aktarımı ve AİDS nedeniyle
bağışıksal sorunlu olan hastalar, sıklıkla inatçı viremi gösterir,
çeşitli yerlerinden virüs saçar, SMV nedenli çeşitli klinik sorunlara uğrar (3). Enfeksiyonun hafifletilmesinde antikor önemli yer
tutar, ancak bağışıksal sorunlu hastalarda SMV’nin yeniden
etkinleşmesini ya da yeniden enfeksiyonu önleyemez. Organ
210
Arısoy E.S.
CMV Enfeksiyonları: Etken ve Epidemiyoloji
alıcılarındaki enfeksiyonlar, içsel gizli virüsün yeniden etkinleşmesi ya da yeni bir SMV kökeniyle yeniden enfeksiyonla ilişkilidir. Kan ya da kan ürünleriyle edinilen SMV hastalığıysa, neredeyse yalnızca annesinden antikor edinememiş küçük, erkendoğan bebeklerde ortaya çıkar.
SMV enfeksiyonu denetiminde hücresel bağışıklık da önemlidir. AİDS hastaları, anti-timosit globülinlerle sağaltılan organ
alıcıları ve kemik iliği alıcılarında görülen çoğu ağır SMV enfeksiyonları bu bilgiyi doğrulayan gözlemlerdir. AİDS’li hastalarda,
düşük CD4+ lenfosit sayısı (<100 hücre/mm3), SMV hastalığı için
önemli bir risk etmenidir (8).
Doğuştan Enfeksiyonun Oluşum Yolu
Virüsün -virülans- etmenlerinin, doğuştan enfeksiyonun ağırlığını belirleyiciliğine ilişkin bilgiler çok azdır. Fetüs güçsüz bir
konak olarak düşünülür, ancak fetüsteki SMV enfeksiyonlarının
çoğunluğu iyi seyirlidir. Doğumda belirtili olan doğuştan SMV
enfeksiyonlu yenidoğanlar, bağışıksal sorunlu hastalardaki gibi,
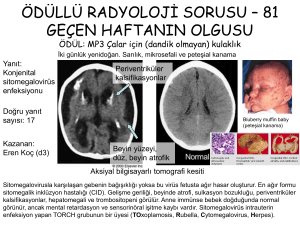
sıklıkla çok dizgeli bir hastalık sergiler (1-3). Mikrosefali, kafa içi
kalsifikasyonlar, BOS proteini artışı, havale ve anormal nörolojik
bulguların da içinde olduğu merkez sinir dizgesi (MSD) bulguları sıktır (9). Otopsi çalışmaları, birçok organda doku zedelenmesini ve enfeksiyonun histo-patolojik kanıtlarını gösterir. Birçok
farklı beyin hücresinde (sinir, glia, epandim, koroit pleksus,
menenks, damar endoteli) sito-patolojik lezyon ve içertiler görülür; tipik olarak, fokal nekroz alanlarıyla yamalı bir tutulum vardır.
Yarım daire kanalları, vestibüler zar, kohlea ve kulağın diğer yapılarında içerti taşıyan epitel hücreleri bulunur. Temporal kemik
bozuklukları eşliğinde kohlea, vestibül, işitme kanalı kusurları
(Mondini displazisi), doğuştan SMV enfeksiyonlu bebeklerdeki
sağırlıkla ilişkilidir. Retinada sitomegalik hücreler ve fokal nekroz
görülebilir. Karaciğer örneklerinin incelenmesi, peri-portal lenfoid
infiltrasyon, safra stazı, safra kanallarında içerti taşıyan hücreler,
dev hücre dönüşümü ve parankim hücrelerinde nekroz gösterebilir. Nekroz ya da yangısal hücre infiltrasyonu olmaksızın, akciğer, böbrek, endokrin organlar, pankreas ve tükürük bezi glandüler epitel hücreleri arasında bolca içerti taşıyan hücre bulunur.
Enfeksiyon hasarına bağlı hücre yıkımı ve damar endotel hücrelerinin enfeksiyonu sonucu damarsal yapı bozukluğu görülür. Bir
hayvan modelinin sonuçları, SMV’nin gelişen beyni, hücrelerin
yıkımlı (litik) enfeksiyonu, nöron göçüyle etkileşim, nöronal kök
hücrelerin kaybı ve damarsal çökkünlük gibi birçok düzenekle
hasara uğrattığını düşündürmüştür (10).
Epidemiyoloji
Görülme sıklığı ve geçiş yolu
SMV enfeksiyonu, gelişmiş ve geri bırakılmış ülkelerde bütün
toplumsal, iktisadi kesimlerde sıktır. Enfeksiyonun görülme sıklığı,
yaş, yaşam koşulları ve toplumsal alışkanlıklara bağlı olarak oldukça değişir. Gelişmemiş ülkelerde, çocukların çoğu virüsü ilk 3
yaşta edinir. Öte yandan, gelişmiş ülkelerde, örneğin ABD ve
Birleşik Krallık’ta, erişkinlerin ancak %60-%80’i virüsle karşılaşmıştır (1). Anne sero-pozitiflik oranları yüksek ve emzirme yaygın
olduğunda, bebeklerin yarıdan çoğu yaşamın ilk yılı içinde virüsü
edinmektedir (2,3). ABD’de bir serolojik görülüm çalışmasında,
SMV görülme sıklığı genelde %59; kadınlarda %64, erkeklerde
%54 olarak bulunmuştur (11). Afrika, Asya ve Latin Amerika’da,
ergenlik öncesinde çocukların çoğunda SMV enfeksiyonu görülür.
J Pediatr Inf 2011; 5 (Suppl 1): 208-12
Anne sütüyle beslenme, çocuk yetiştirme uygulamaları, kalabalık
yaşam, temizlik ve cinsel davranış farklılıkları, SMV sıklığında yaşla
ilişkili değişikliklere yol açan etmenlerdir. Çocuk yuvası benzeri
ortamlar, küçük çocuklarda SMV yayılımını kolaylaştırır. Enfeksiyon,
yuva çocukları ve bakıcılarında sıktır (3). Yuva ve ailelerde yürütülen çalışmalar, küçük çocukların virüsü arkadaş, görevli ve aile
büyüklerine kolayca bulaştırdığını göstermiştir (12).
Ağız yoluyla SMV saçılımı sıktır ve aylarca sürer (1-3). Küçük
çocukların ağızlarını her yer sürme davranışı SMV’nin doğrudan
tükürükle, oyuncak ya da yüzeyler üzerinde, çocuk ve bakıcıların elleriyle bulaşımını kolaylaştırır. SMV’nin cinsel bulaşımı
ergen ve erişkinlerde önemlidir. Erken cinsel yaşam, çok cinsel
eşlilik, cinsel yolla bulaşan diğer hastalıkların varlığı, SMV enfeksiyonunun yüksek görülme sıklığıyla ilişkilidir (1,3,13).
Bir toplulukta SMV’nin sürmesinde dikey bulaşım önemli bir
rol oynar. SMV anneden bebeğine plasenta yolu, doğumda
anne cinsel organlarındaki virüse temas ve anne sütüyle bulaşabilir (2,3). Sero-pozitif annelerin yaklaşık %10’u virüsü doğumda
cinsel yolla saçar ve doğumda SMV ile karşılaşan yenidoğanların yaklaşık yarısı enfeksiyona uğrar (3). SMV sero-pozitif annelerin %30-%70’inin süt kültüründe üretilebilir (14,15). Sütünde
virüs olan annelerin emzirdiği bebeklerin yaklaşık %50’sinin
enfeksiyonu edindiği gösterilmiştir (14). Polimeraz zincir tepkimesi (PZT) çalışmaları, sero-pozitif annelerin %95’inden çoğunun sütünde SMV DNA’sı olduğunu göstermiş ve anne sütünde
virüsün oluşuyla bebeğe geçişi arasındaki ilişkiyi doğrulamıştır
(16,17). Enfeksiyonu yaşamın erken döneminde edinen bebekler virüsü yıllarca saçar; böylece diğer çocuklar ve bakıcıları için
önemli bir SMV kaynağı olur (1-3).
Doğuştan (konjenital) enfeksiyon
SMV, gelişmiş ülkelerdeki en sık doğuştan enfeksiyon nedenidir. Doğuştan SMV enfeksiyonu -dünya ölçeğinde- yaygındır;
canlı doğumların yaklaşık %1’inde (%0.2-%2.5) görülür (2,18).
Oranlar geri bırakılmış ülkelerde ve gelişmiş ülkelerin düşük gelirli katmanlarında yüksektir (3). Doğuştan SMV enfeksiyonu oranları, annenin sero-pozitifliğine koşutluk gösterir; SMV enfeksiyonu görülme sıklığının yüksek olduğu toplumlarda doğuştan SMV
enfeksiyonu oranları da yüksektir. Bu durum, birincil ve yeniden
enfeksiyonun daha büyük görülme sıklığı ya da gebelikte annedeki içsel virüsün yeniden etkinleşmesiyle açıklanabilir (2). Anne
yaşı küçüklüğü, evli olmamak, beyaz ırktan olmamak, doğuştan
SMV enfeksiyonunun yüksek oranlarıyla ilişkilidir (3).
Doğuştan SMV enfeksiyonlu bebeklerin çoğunda doğumda
bir belirti yoktur, %5-%15’iyse belirtilidir (18). Gebelikteki birincil ve yineleyen SMV enfeksiyonları bebekte enfeksiyona yol
açabilir. Ancak, bulaşım oranı birincil enfeksiyonda yineleyen
enfeksiyona göre çok yüksektir (%40 ve <%1) (2). Yine annesindeki birincil enfeksiyondan ötürü doğuştan SMV enfeksiyonlu
olan bebeklerin, doğumda belirtili, daha sonra da kalıcısorunlu
(sekel) olma olasılığı çok daha yüksektir (2). Enfeksiyonlu bebeklerin %10-%20’sinde sinirsel işitme yitimi, göz sorunları, bilişsel
ya da motor işlev bozukluğu vardır.
Doğum ve ertesinde (peri-natal) edinilen enfeksiyon
Bebekler SMV enfeksiyonunu annenin rahim ağzı ve vajen
salgılarıyla karşılaşma sonucu ya da anne sütüyle edinebilir.
Erkendoğan bebekler, virüsü anne sütü aracılığıyla edinmede en
yüksek risk altındadır (2). Almanya’da 151 anne ve 176 erkendoğan bebekleriyle yapılan bir çalışmada, emziren sero-pozitif
J Pediatr Inf 2011; 5 (Suppl 1): 208-12
annelerde SMV’nin yeniden etkinleşme oranı %96, bu annelerden bebeklerine, anne sütünde virüs DNA’sı saptanarak gösterilen virüs bulaşımı da %37 olarak bulunmuştur (18+). Virüs
DNA’sının sütte erken ortaya çıkışı (doğum ertesinde; bulaştırıcılarda ortanca 3,5 gün, bulaştırmayanlarda ortanca 8 gün) ve
virüsün sütte varlığı bulaşım için risk etmenleri olarak belirlenmiştir. Bulaşıma uğrayan 33 bebeğin 16’sında (%50), ortalama
42 günlük bir kuluçka dönemi sonunda belirtili SMV enfeksiyonu
gelişmiş; bebeklerin 4’ünde sepsisi düşündüren belirti ve bulgular ortaya çıkmıştır. Diğer 17 bebekte (%50) herhangi bir belirti
oluşmamıştır. Doğum ve ertesinde yenidoğanlara SMV enfeksiyonu bulaşımında, çok düşük doğum ağırlığı ve virüsün anne
sütünde erken dönemde varlığı, belirtili SMV enfeksiyonu için
risk etmeni olarak görülmektedir (19).
Doğum öncesi, doğum ve doğum sonrası dönemlerde SMV
enfeksiyonunun bulaşmadığı çocuklar, virüsü daha sonra,
küçük çocuklukta ve okul öncesi dönemde, özellikle yuva ve
anaokulu ortamlarında edinebilir. ABD’de günlük çocuk bakımı
kurumlarında, çocuklarda SMV’nin tükürük ve idrarla saçılımı
%10->%80’dir (20,21). Bu yüksek görülme sıklığı, küçük çocukların istenen özeni taşıyamayan temizlenme ve çocuklar ve
bakıcıların özensiz el yıkama uygulamaları eşliğinde virüsün
yatay bulaşımını da artırmaktadır (2).
Bulaşımın diğer değişkenleri
Ergenlik, özellikle gelişmiş ülkelerde, SMV için bir diğer hızla
edinme dönemidir. Cinsel etkinlik, SMV enfeksiyonunu edinmede
bir diğer önemli risk etmeni olabilir. Yaşı küçük annelerin bebeklerinde doğuştan SMV enfeksiyonu ve hastalığı görülebilir (1,2).
SMV aile bireyleri arasında bulaşabilir. Kaynak olgu genellikle evdeki küçük çocuklardır. SMV’nin cinsel bulaşımı da iyi
tanımlanmıştır. Virüs rahim ağzı ve vajen salgıları ve semenle
saçılır. Genç kadınlarda ilk cinsel ilişki ertesinde birincil SMV
enfeksiyonu belgelenmiştir (18).
Hastane enfeksiyonu
Hastane ortamında bireyler arası bulaşım beklenen bir
durum değildir. Hastane çalışanlarında SMV enfeksiyonu riskinin artmadığı gösterilmiştir (21,22). Bu durum, olasılıkla el yıkama ve diğer el temizliği uygulamalarının hastanelerde SMV
bulaşımını azaltmasıyla ilişkilidir. Hastanelerde SMV bulaşımının
önlenmesi için genel önlemler yeterlidir ve SMV enfeksiyonlu
hastaların ayrı tutulması gerekli değildir (2). Gebe ya da gebelik
tasarlayan sağlık çalışanlarının SMV enfeksiyonlu hastaların
bakımından uzak tutulması gerekmez, yalnızca genel önlemlere
uyulması yeterlidir.
Süt bankası uygulaması seyrektir, ancak banka sütü de
yenidoğanlar için bir enfeksiyon kaynağı olabilmektedir.
Hastanede edinilen çoğu SMV enfeksiyonunın kaynağı kan, kan
ürünleri ve organ aktarımıdır. Kan aktarımı sonrası SMV hastalığı yenidoğanlarda, özellikle erkendoğanlarda görülür, ancak
daha büyük çocuklar ve ergenlerde de görülebilir. Sağlıklı bireyde kan aktarımıyla ilişkili SMV enfeksiyonları genellikle belirtisizdir. Öte yandan, bağışıksal sorunlu hastalar, özellikle HİV enfeksiyonu, kanser, kemik iliği ya da organ alıcısı olan hastalar, SMV
ile sıklıkla enfekte olur ve ağır hastalık gelişimi açısından büyük
risk altındadır (1,18).
Kemik iliği alıcılarında, kan ürünleri, özellikle akyuvarlar,
SMV enfeksiyonu ve hastalığının önemli bir nedeni olabilir (1-3).
Kan ürünleriyle SMV edinme riski, sero-pozitif vericilerden seronegatif alıcılara birçok kez aktarım yapıldığında en yüksektir. Bir
Arısoy E.S.
CMV Enfeksiyonları: Etken ve Epidemiyoloji
211
çalışmada, açık kalp cerrahisi uygulanan 93 sero-negatif çocuğun %9.7’sinde serolojik dönüşüm görülmüş; kan aktarımı
sonrası SMV enfeksiyonu riski bir birim (ünite) kan için %2.7
olarak hesaplanmıştır (23). Başka iki çalışmada, sero-negatif
annelerin kan verilen çocuklarında enfeksiyon oranı %13.5 ve
%9.2 olarak bildirilmiştir (24,25). Doğum ağırlığı 1.250 gramın
altındaki yenidoğanlarda, kan verilmesi ya da insan sütü ile SMV
enfeksiyonu ve hastalığı riski doğum ağırlığı daha büyük olan
bebeklere göre artmaktadır (26). Kan ya da kan ürünü verilmesiyle ilişkili SMV enfeksiyonları, yalnızca sero-negatif verici kaynaklı kan ürünü kullanılması ya da kanın akyuvarlardan arındırılmasıyla önlenebilir (1,3). Verici sütüyle beslemenin yarar-zarar
hesabı da ayrıca yapılmalıdır (2).
Mesleksel enfeksiyon
SMV iş nedenli karşılaşmalar sonucunda küçük çocuklardan
edinilebilir. Hemşire, yuva görevlisi, bakıcı ve öğretmenler bu
açıdan daha yüksek risk altındadır. Tersine olarak, ABD ve
Kanada’da çocuk bakımı alanında çalışanlarda sürekli olarak
SMV enfeksiyonu görülme sıklığı yüksektir; her yıl için beklenen
enfeksiyon oranı %2 iken, bu kümede yıllık oran %8-%20’dir
(27,28). SMV’yi edinme riski küçük çocuklarla teması olan
çocuk bakımı çalışanlarında yüksektir (2).
(Bu yazıda, zorunlu olarak kullandığım sitomegalovirüs gibi
etken, ampisilin gibi madde adları yanı sıra, enfeksiyon, kanser,
risk, sero-negatif benzeri yaklaşık 10 tane yabancı kaynaklı sözcüğü kullanmaktan kaçınamadım. Bu nedenle, kongre başkanlığı, oturum başkanlığı, katılımcılar ve yazının okurlarından özür
dilerim. Emin Sami Arısoy)
Kaynaklar
1. Demmler-Harrison, GJ. Cytomegalovirus. Feigin RD, Cherry JD,
Demmler-Harrison GJ, Kaplan SL, ed. Textbook of Pediatric Infectious
Diseases, 6. basım, Philadelphia: Saunders, 2009: 2022-43.
2. Demmler-Harrison, GJ. Cytomegalovirus infection and disease in
newborns, infants, children and adolescents. http://www.uptodate.
com/contents/cytomegalovirus-infection-and-disease-innewborns-infants-children-and-adolescents
(güncelleme:
27.09.2010). Uptodate: Sürüm: 18.3. (Erişim: 13.03.2011)
3. Pass RF. Cytomegalovirus. Long SS, Pickering LK, Prober CG, ed.
Principles and Practice of Pediatric Infectious Diseases, 3. basım,
Churchill Livingstone - Elsevier, 2008; 1029-36.
4. Mocarski ESJ, Shenk T, Pass RF. Cytomegaloviruses. Knipe D,
Howley P, ed. Fields Virology, 5.basım, Philadelphia: Lippincott,
Williams & Wilkins; 2007: 2701-72.
5. Penfold MET, Dairaghi DJ, Duke GM, et al. Cytomegalovirus encodes
a potent alpha chemokine. Proc Natl Acad Sci USA 1999; 96: 9839-44.
6. Billstrom MA. Intracellular signaling by the chemokine receptor
US28 during human cytomegalovirus infection. J Virol 1998; 72:
5535-44.
7. Saederup N, Lin YC, Dairaghi DJ, et al. Cytomegalovirus-encoded
beta chemokine promotes monocyte-associated viremia in the
host. Proc Natl Acad Sci USA 1999; 96: 10881-6.
8. Gallant JE, Moore RD, Richman DD, et al. Incidence and natural
history of cytomegalovirus disease in patients with advanced
human immunodeficiency virus disease treated with zidovudine. J
Infect Dis 1992; 166: 1223-7.
9. Boppana SB, Pass RF, Britt WJ, et al. Symptomatic congenital
cytomegalovirus infection: neonatal morbidity and mortality. Pediatr
Infect Dis J 1992; 11: 93-9.
10. van den Pol AN, Mocarski E, Saederup N, et al. Cytomegalovirus
cell tropism, replication, and gene transfer in brain. J Neurosci
1999; 19: 10948-65.
212
Arısoy E.S.
CMV Enfeksiyonları: Etken ve Epidemiyoloji
11. Staras SAS, Dollard SC, Radford K, et al. Seroprevalence of cytomegalovirus infection in the United Stated, 1988-1994. Clin Infect
Dis 2006; 43: 1143-51.
12. Pass RF, Hutto C, Lyon MD, et al. Increased rate of cytomegalovirus infection among day care center workers. Pediatr Infect Dis J
1990; 9: 465-70.
13. Stanberry LR, Rosenthal SL, Mills L, et al. Longitudinal risk of herpes
simplex virus (HSV) type 1, HSV type 2, and cytomegalovirus infections
among young adolescent girls. Clin Infect Dis 2004; 39: 1433-8.
14. Dworsky M, Yow M, Stagno S, et al. Cytomegalovirus infection of
breast milk and transmission in infancy. Pediatrics 1983; 72: M295-9.
15. Ahlfors K, Ivarsson SA. Cytomegalovirus in breast milk of Swedish
milk donors. Scand J Infect Dis 1985; 17: 11-3.
16. Vochem M, Hamprecht K, Jahn G, et al. Transmission of cytomegalovirus to preterm infants through breast milk. Pediatr Infect Dis
J 1998; 17: 53-8.
17. Jim WT, Shu CH, Chiu NC, et al. Transmission of cytomegalovirus
from mothers to preterm infants by breast milk. Pediatr Infect Dis J
2004; 23: 848-51.
18. Demmler GJ: Infectious Diseases Society of America and Centers for
Disease Control. Summary of a workshop on surveillance for congenital cytomegalovirus disease. Rev Infect Dis 1991; 13: 315-29.
19. Hamprecht, K, Maschmann, J, Vochem, M, et al. Epidemiology of
transmission of cytomegalovirus from mother to preterm infant by
breastfeeding. Lancet 2001; 357: 513-8.
20. Adler, SP. Cytomegalovirus transmission among children in day
care, their mothers and caretakers. Pediatr Infect Dis J 1988; 7:279.
J Pediatr Inf 2011; 5 (Suppl 1): 208-12
21.
22.
23.
24.
25.
26.
27.
28.
Adler, SP. Cytomegalovirus and child day care. Evidence for an
increased infection rate among day-care workers. N Engl J Med
1989; 321: 1290.
Balfour CL, Balfour HH: Cytomegalovirus is not an occupational risk
for nurses in renal transplant and neonatal units. JAMA 1986; 256:
1909-14.
Balcarek KB, Bagley R, Cloud GA, et al. Cytomegalovirus infection
among employees of a children's hospital: no evidence for increased risk associated with patient care. JAMA 1990; 263: 840-4.
Armstrong JA, Tarr GC, Youngblood LA, et al. Cytomegalovirus
infection in children undergoing open heart surgery. Yale J Biol Med
1976; 49: 83-91.
Yeager AS, Grumet FC, Hafleigh EB, et al. Prevention of transfusionacquired cytomegalovirus infections in newborn infants. J Pediatr
1981; 98: 281-7.
Adler SP, Chandrika T, Lawrence L, et al. Cytomegalovirus infections in
neonates due to blood transfusions. Pediatr Infect Dis 1983; 2: 114-8.
Maschmann J, Hamprecht K, Dietz K, et al. Cytomegalovirus infection of extremely low-birth weight infants via breast milk. Clin Infect
Dis 2001; 33: 1998-2003.
Murph JR, Baron JC, Brown K, et al. The occupational risk of cytomegalovirus infection among day care providers. JAMA 1991; 265: 603-8.
Ford-Jones EL, Kitai I, Davis L, et al. Cytomegalovirus infections in
Toronto child-care centers: a prospective study of viral excretion in
children and seroconversion among day-care providers. Pediatr
Infect Dis J 1996; 15: 507-14.