MADDENİN YAPISI VE ÖZELLİKLERİ
8.SINIF
3.ÜNİTE
* PERİYODİK SİSTEM VE ÖZELLİKLERİ *
KONU
NO: 10
Element: Aynı cins atomlardan meydana gelen saf maddelere
element denir. Örnek: Hidrojen, kalsiyum, oksijen, flor, klor ...
Bileşik: İki ya da daha fazla cinsten atomun bir araya gelerek
oluşturdukları saf maddelere bileşik denir.
Örnek: Hidrojen ve oksijen bir araya gelerek suyu oluşturur.
Karışım: Birden fazla maddenin kimyasal özellikleri
değişmeyecek şekilde bir araya gelmesiyle oluşan yapıya
karışım denir. Örnek: Tuzlu su, ayran, salata, çorba, çay ...
Yukarıda da görüldüğü gibi doğada birçok bileşik ve karışım yer
almaktadır. Fakat elementler doğada sınırlı sayıda bulunurlar.
Bugün itibariyle doğada bilinen 118 element yer almaktadır. Her
geçen gün bu sayı yapılan araştırmalarla ve bulunacak yeni tür
elementlerle değişecektir. Elementleri çeşitli bilim adamları yüz
yıllardan bu yana yaptıkları çalışmalarla gruplamaya çalışmışlardır.
Şimdi sizlerle beraber tarihte elementlerle ilgili yapılan bu
çalışmaları kısaca görelim.
PERİYODİK SİSTEMİN TARİHÇESİ
Aynı cins (tür) atomdan meydana gelen elementler, tarihsel süreçte
zamanla keşfedilmiştir. Elementlerin keşfedildiği tarihin net
bilinmemesiyle birlikte 1800'lü yılların sonuna doğru 60-65 tane
elementin bulunduğu bilinmektedir. Günümüzde doğada bulunan
element sayısının 90 civarında olduğu bilinmektedir. Laboratuar
ortamında üretilen yapay elementlerle birlikte toplam element
sayısı, 118’dir. Elementlerin incelenmesinde ve hatta
keşfedilmesinde kolaylık olması açısından tarih boyunca elementler
hep gruplandırılmaya çalışılmıştır.
Elementleri özelliklerine göre gruplandırma ilk çağlardan beri yapıla
gelen bir çalışmadır. İlk çağlarda doğada toprak, su, hava ve ateş
olarak dört temel elementin olduğu iddia ediliyordu. Zamanla
bunların element olmadığı anlaşıldı. 1800’lü yıllarda kimi zaman
elementlerin fiziki özellikleri, kimi zaman kimyasal özellikleri göz
önüne alınarak bilinen elementler gruplandırılmıştır. Bu
gruplandırmalarla birlikte birçok element tablosu ortaya çıkmıştır.
Bilim adamları tarafından elementlerin sınıflandırılması için yapılan
tablolarda, bazı özelliklerin periyodik olarak tekrar etmesi sebebiyle
bu tablolara periyodik sistem (periyodik tablo ya da periyodik
cetvel) denir. Tarih boyunca periyodik sistemlerle ilgili araştırma
yapan bilim adamları ve yaptıkları çalışmalar aşağıda verilmiştir.
www.fensepeti.com
Belirli bir hacmi ve kütlesi olan her şeye madde denir. Maddenin en
küçük yapı birimi de atomdur. Atomlar o kadar küçük parçalardır ki
bir toplu iğnenin ucuna bin tane atom sığabilir. Bunun yanında her
madde atomlardan meydana gelmiştir. İçerdikleri atom
yapılarından yola çıkarak karışım, bileşik ve elementler şu şekilde
açıklanabilir:
::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
PERİYODİK SİSTEM
::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
Bu konu anlatımı seti Metin GÖKTÜRK tarafından hazırlanmıştır. Konu anlatım seti ve diğer setler için www.fensepeti.com sitesini ziyaret edebilirsiniz. 2017 ©
Johann Döbereiner (1780 – 1849)
Elementlerin sınıflandırılmasıyla ilgili ilk çalışmayı
1829 yılında Döbereiner yapmıştır. Döbereiner,
lityum, sodyum ve potasyum gibi elementlere
benzer özellik gösterdikleri için aynı grupta yer
vermiş ve elementleri üçerli gruplar halinde
göstermiştir.
Alexandre Beguyer de Chancourtois (1820 – 1886)
Benzer özellik gösteren bazı element ve iyonları
dikey sıralarda olacak şekilde sarmal olarak
sıralamıştır.
John Newlands (1837 – 1898)
Elementleri atom ağırlıklarına göre sıralamış ve
oluşturduğu tabloyu müzik notalarına benzetmiştir.
Ayrıca Newlands, ilk 8 elementten sonra benzer
fiziksel ve kimyasal özelliklerin tekrar ettiğini fark
etmiştir.
Henry Moseley (1817 - 1915)
1913 yılında elementleri, element atomlarının atom
numarasına (proton sayılarına) göre düzenlemiştir.
Gilen Siborg (1912 - 1999)
Periyodik sistemin en altında yer alan iki sıra
hâlindeki elementleri düzenleyerek periyodik
sisteme son şeklini vermiştir.
Dimitri İ. Mendeleyev (1834–1907) ve Lothar Meyer (1830 –1895)
Birbirlerinden habersiz, aynı dönemde elementleri
sınıflandırmış ve aynı sıralamayı bulmuşlardır.
Ancak Meyer elementleri benzer fiziksel
özelliklerine göre sıralarken, Mendeleyev bu
sıralamada atom ağırlığını kullanmıştır. Ayrıca
Mendeleyev oluşturduğu çizelgede elementlerin
düzenli olarak tekrarlanan özellikler gösterdiğini
fark etmiştir. Mendeleyev’in yaptığı sıralama
günümüz
de
kullanılan
elementlerin
sınıflandırılmasına yakın bir sıralamadır.
1A 2A
1.Periyot
3A 4A 5A 6A 7A 8A
1A
2.Periyot
3.Periyot
B GRUPLARI
4.Periyot
5.Periyot
6.Periyot
7.Periyot
Lantanitler
Aktinitler
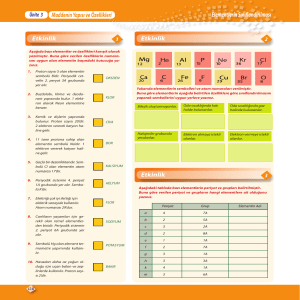
Periyodik tabloda yatay sıralara periyot, dikey (düşey) sütunlara
ise grup adı verilir. Ayrıca periyodik tabloda 7 periyot, 18 grup
vardır. Bu gruplardan 8 tanesi A grubu, 10 tanesi de B grubudur.
Bu yıl sadece A grubu işlenecek olup B grubuna girilmeyecektir. A
grubu sütunları 1A, 2A, 3A, 4A, 5A, 6A, 7A ve 8A olarak
adlandırılır. Bu gruplardan bazılarının özel adları vardır ve bunlar
aşağıda verilmiştir.
1A - Alkali Metaller
2A - Toprak Alkali Metaller
7A - Halojenler
8A - Soy gazlar (Asal Gazlar)
:::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
Periyodik tabloda elementler yan yana artan atom numaralarına
(proton sayılarına) göre dizilirken, alt alta ise benzer özelliklerine
göre dizilmişlerdir.
www.fensepeti.com
PERİYODİK TOBLO VE ÖZELLİKLERİ
Doğada canlı ve cansız varlıklar bir arada yaşarlar. Canlıların en
küçük yapı birimine hücre denirken cansız varlıkların en küçük yapı
birimine atom denir. Atomun yapısını 7. sınıfta "Maddenin Yapısı
ve Özellikleri" ünitesinde görmüştük.
Atom, merkezinde proton ve nötron, yörüngelerinde
(katmanlarında) ise serbest halde dolaşan elektronlardan
meydana gelir. Bir elementin atom numarası aynı zamanda
elektron sayısına eşit olduğundan, elektron sayılarından yola
çıkarak atomun yani elementin periyodik tablodaki yeri
belirlenebilir. Yer belirleme işlemi aşağıdaki şekilde yapılır.
Periyodik tabloda bulunan periyotlar atomun yörüngesini temsil
etmektedir.
Periyodik tabloda 1. periyotta 2, 2. periyotta 8, 3. periyotta 8 ve
4. periyotta da 18 element bulunmaktadır. Bu da atomların
çekirdeğinin etrafında yer alan katmanlardaki elektron sayılarını
ifade etmektedir. Örneğin 1. periyotta 2 elementin olması
atomların 1. katmanında en fazla 2 elektronun yer alacağını
göstermektedir. Bu durumda kısaca aşağıdaki formül kullanılır.
Formüldeki parantezler katmanları, sayılar elektronları ifade
etmektedir.
2) 8) 8) 18) ...
Atomun katman sayısı, periyot numarasını verirken son
katmanda bulunan elektron sayısı da atomun grup numarasını
verir.
:::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
Atom Numarası ile Yer Bulma
Örnek: Atom numarası 1 olan Hidrojen (H) elementi periyodik
tabloda 1. periyotta ve 1A grubunda yer alır. H elementinin atom
modeli incelenecek olursa;
H atomu modeli
H atomu kısa gösterimi
1)
Yukarıda görüldüğü gibi H atomu 1 katmana sahiptir ve bu da
onun 1. periyotta olduğunu gösterir. Tek (Son) katmanındaki
elektron sayısının 1 olması da 1A grubunda yer aldığını gösterir.
Be atomu modeli
Be atomu kısa gösterimi
2) 2)
Yukarıda verilen Berilyum (Be) elementinin atomu 2 katmana
sahip olduğundan 2. periyottadır. Ayrıca Be elementinin son
katmanında 2 elektron bulunduğundan Be elementi 2A grubunda
yer alır.
8. Sınıfta periyodik tablonun genellikle ilk 20 elementi
üzerinden işlemler verilir. Bu durumda ilk 20 elementi ezbere
bilmek problemleri çözme açısından yararınıza olacaktır...
Element
Atom Gösterimi
Periyodik Tablodaki Yeri
1H
1)
1. Periyot 1A Grubu
2He
2)
1. Periyot 8A Grubu
3Li
2) 1)
2. Periyot 1A Grubu
4Be
2) 2)
2. Periyot 2A Grubu
5B
2) 3)
2. Periyot 3A Grubu
6C
2) 4)
2. Periyot 4A Grubu
7N
2) 5)
2. Periyot 5A Grubu
8O
2) 6)
2. Periyot 6A Grubu
9F
2) 7)
2. Periyot 7A Grubu
10Ne
2) 8)
2. Periyot 8A Grubu
11Na
2) 8) 1)
3. Periyot 1A Grubu
12Mg
2) 8) 2)
3. Periyot 2A Grubu
13Al
2) 8) 3)
3. Periyot 3A Grubu
14Si
2) 8) 4)
3. Periyot 4A Grubu
15P
2) 8) 5)
3. Periyot 5A Grubu
16S
2) 8) 6)
3. Periyot 6A Grubu
17Cl
2) 8) 7)
3. Periyot 7A Grubu
18Ar
2) 8) 8)
3. Periyot 8A Grubu
19K
2) 8) 8) 1)
4. Periyot 1A Grubu
20Ca
2) 8) 8) 2)
4. Periyot 2A Grubu