BİYOTEKNOLOJİK
ÜRÜNLER VE
BİYOBENZERLER
Prof. Dr. Atila Karaalp
Marmara Üniversitesi Tıp Fakültesi
Tıbbi Farmakoloji Anabilim Dalı
Diyabet Hemşireleri Akademisi 22 Ekim 2016 Girne, Kıbrıs
Özet
• Biyoteknolojik ürünler:
–
–
–
–
–
Tanım
Pazar payı
Özellikleri
Üretim süreçleri
Sorunlar
• Biyobenzerler
– Biyoeşdeğerlik
çalışmaları
– Ruhsatlandırma süreci
– Farmakovijilans
– Dünyada durum
– Türkiye’deki biyobenzer
ürünler
- Yapılması gerekenler / Yapılabilecekler
Giriş
• DNA’nın 1953’teki keşfinden 20 yıl sonra ilk kez
rekombinant DNA teknolojisi denemeleri
yapılmıştır (1973 Cohen ve Boyer).
• Bu gelişme sonucunda 1982’de ilk rekombinant
insan insülini ruhsatlandırılıp kullanıma girmiştir.
• Bundan sonraki 25-30 yılda geliştirilen onlarca
biyofarmasötik ürün günümüzde kullanılmaktadır.
• Önümüzdeki yıllarda da halen geliştirilmekte olan
yüzlerce biyofarmasötik, 200’den fazla
endikasyonda kullanıma girmesi tahmin
edilmektedir.
EGA-FAQ on Biosimilar Medicines. July 2011. http://www.egagenerics.com/images/factsheet/EGA_factsheet_07.pdf
Biyofarmasötikler
• Halen pazarlanmış olan biyofarmasötik
ajanların yıllık 169 milyar USD’dan fazla pazarı
bulunmaktadır.
• Buna göre biyofarmasötikler, tüm
farmasötiklere göre iki kat daha hızlı
büyümektedir.
• 2010 yılında Avrupa’da en çok satan 10 ilaçtan
6’sı biyofarmasötik (monoklonal antikor)
ürünlerdir.
Kategorilere göre dünya
biyofarmasötik satışları
Ref. Biosimilars Advisory Service , Global Pipelines, Regulatory Pathways, and Key Stakeholder Perspectives of Biosimilars March 2013
Biyofarmasötikler
• Biyofarmasötik pazarında 2020 yılına kadar
mevcut birçok biyolojik ilacın patent süresi
dolmuş olacak.
• Bu durum da biyofarmasötiklerin jeneriklerinin
üretimi konusunu ön plana çıkarmıştır.
• Tüm dünyada 200 kadar yeni biyobenzer ürün
geliştirme projesi sürmektedir.
• Projelerin büyük çoğunluğu preklinik fazdadır,
yaklaşık beşte biri Faz III çalışmalarını yürütmekte
ya da ruhsat onayını beklemektedir.
Biyolojik Tıbbi Ürün
(biyofarmasötik)
• Etken maddesi niteliğinin ve kalitesinin
belirlenmesi için imalat süreci ve kontrolü ile
birlikte fizikokimsayal biyolojik testler
kombinasyonu gerektiren ve biyolojik bir
kaynaktan imal edilmiş ya da ekstre edilmiş
üründür.
TİTCK (İEGM) - BİYOBENZER TIBBİ ÜRÜNLERE İLİŞKİN KILAVUZ. 2008
Biyolojik Tıbbi Ürün (biyofarmasötik)
• Bu ürünler;
– İmmünolojik ürünler,
– Kan ürünleri,
– Rekombinant DNA teknolojisi prokaryotik ve ökaryotik
hücrelerde, transforme memeli hücreleri de dahil
olmak üzere biyolojik olarak aktif proteinleri kodlayan
genlerin kontrollü ekspresyonu, hibridoma ve
monoklonal antikor yöntemleri ile elde edilen ürünler,
– İleri tıbbi tedavi ürünleri,
– Etkin maddenin doğrudan kendisinden türetilmediği
reaktifler; kültür ortamı, dana fetüs serumu, katkı
maddeleri, kromatografi vb.
İEGM - BİYOBENZER TIBBİ ÜRÜNLERE İLİŞKİN KILAVUZ
Biyofarmasötikler
•
•
•
•
•
•
•
•
İnsulin
GH (büyüme hormonu)
Eritropoetin
Beta interferon (immunmodülatör)
Monoklonal antikorlar
Pıhtılaşma faktörleri (VIII, IX)
Çeşitli enzimler
Aşılar
Biyofarmasötikler
büyük bir meydan okuma
Biyofarmasötikler ile konvansiyoneller arasındaki farklar
Tek bir canlı serisinden,
Özdeş kopyasını yapmak
olanaksız!!!
İlişkili moleküllerin karışımından
oluştuğu için olanaksız
Öngürülebilir süreç,
Özdeş kopyası yapılabilir
Kolaylıkla tanımlanabilir
Daha dayanıklı
Hassas (kolaylıkla bozulabilir)
Yüksek olasılık
(Çok) düşük olasılık
Özellikler
Jenerik vs. Biyobenzer
Biyolojik/Biyoteknolojik
Kimyasal İlaçlar
Boyut
Küçük
Büyük
Yapı
Basit
Kompleks
Stabilite
Biyobenzer/kopya
Karalı üretilebilir.
Modifikasyon
İyi tanımlanmış
Çok seçenekli
Öngürülebilir süreç,
En az
6 aylık
etkinlik,
Özdeş
kopyası
yapılabilir
Tek bir canlı serisinden,
ÖzdeşBiyoeşdeğerlik
kopyasını yapmak
çalışması yeterlidir.
olanaksız.
Üretim
Tanımlama
Stabilite
İmmünojenisite
güvenlilik,
immunojenisite
çalışması
gereklidir.
Kolaylıkla
tanımlanabilir
Yeterli çalışma yoksa
«kopya» olarak anılır.
Dayanıklı
(Çok) düşük olasılık
Jeneriği üretilebilir.
Kararsız
İlişkili moleküllerin
karışımından oluştuğu için
Farmakokinetik öz.
olanaksız
Açısından %80-120
Benzerlik
yeterlidir.
Hassas
(kolaylıkla
bozulabilir)
Yüksek olasılık
Biyolojik bir ürünün yapısı
Biyolojik ürünün üretimi son derece
karmaşık ve çok adımlı bir süreçtir
DNA dizisi
Protein üretimi
Klonlama
Saflaştırma
Kültivasyon
Formülasyon
Biyolojik ürünler
• Genellikle bir biyolojik sistem veya canlı
kullanılarak üretilirler.
• Molekül büyüklüğü konvansiyonel ilaçlardan
oldukça büyüktür (100-1000 kat).
• Heterojen ve karmaşık moleküllerdir, çevrilme
sonrası üç boyutlu yapılara evrilirler ve bu yapı
ilacın etkisini (farmakodinami) ve dayanıklılığını
(stabilite) belirler.
• Üretim süreci ürünü etkiler, süreç üründür
(process is product).
Biyolojik ürünler
• Kalite standartları çok yüksek olmak zorundadır.
• Çok fazla sayıda kalite kontrol basamağı içerir.
• Üretim sırasında ortaya çıkabilecek yan ürünler çok
zararlı olabilir.
• Küçük bir molekül için 100 den az kalite testi
gerekirken, bir biyolojik üretim sürecinde 2000'den
fazla test gerektirir.
• Ürünler çok sıkı GMP kuralları altında üretilmelidir.
• Parenteral formülasyon için gerekli işlemler yapılır.
• Deneyimli kritik insan gücü gerekir
Biyolojik ürünlerin üstünlükleri
• Biyolojik olmaları (sentetik olmamaları)
• Çok düşük dozlarda büyük biyolojik aktiviteye
sahip olmaları
• Yüksek selektivite hatta spesifisite göstermeleri
• Hedeflendirilebilmeleri
• Suda çözünür olmaları
Biyolojik ürünlerin problemleri
•
•
•
•
•
•
•
•
Yapılarının büyük olması
Yapılarının karmaşık olması
Üretimlerinin son derece karmaşık olması
Safsızlaştırma sorunları
Stabilite sorunları (kolay bozulma)
İmmünojenisite
Formülasyon zorluğu
Uygulama yollarının sınırlı olması (sadece
parenteral)
İmmünojenisite
İmmünojenisite
• Büyük moleküllü ve biyolojik bir ajanın vücuda
enjekte edilmesi bağışıklık sistemini uyarır.
• Uyarılmış bağışıklık sistemi cilt döküntülerinden
başlayıp, ölümcül kemik iliği süpresyonu ya da
anafilaksi gibi ciddi klinik sonuçlar oluşturabilir.
• Ayrıca oluşan antikorlar da ilacın etkinliğini sona
erdirir.
• Dolayısıyla hastalar o ilaç sınıfına karşı direnç
geliştirebilirler.
İmmünojenisite
• Tüm rekombinant protein ilaçlar hastanın
immün sistemi tarafından yabancı olarak
tanınma potansiyeline sahiptir.
• Bunun dışında immünojenisiteyi tetikleyen
birçok başka faktör de vardır:
– İstenmeyen eksojen protein
- Virüsler
– İstenmeyen eksojen DNA varlığı - Safsızlıklar
– Endotoksinler
- Agregatlar
Biyolojik ürünlerin üretim sürecinin çeşitli
yönleri immünojenisiteyi etkileyebilir
Üretim
sürecinin
kontrolü
Ürün
stabilitesinin
takibi
Formülasyon
bileşeni seçimi
İmmünojenisite
İmmünojenisite
İmmünojenisiteye katkıda bulunan faktörler:
• Protein dizisi (insan dışı dizi varyasyonları örn. bakteriyel diziler
immünojenisiteyi arttırmaktadır)
• Molekül ağırlığı (büyük moleküllerde küçüklere göre daha fazla)
• Glikozilasyon derecesi (translasyon sonrası değişiklikler ürünün
yabancı olarak tanınmasına neden olabilir)
• Çözünürlük ve agregasyon (agregatlar yabancı antijenler olarak
tanınabilir)
• Safsızlık düzeyi (istenmeyen proteinler, DNA, virüsler, endotoksinler,
metaller, antibiyotikler ve büyüme faktörleri)
• Formülasyon ve saklama (formülasyondaki yardımcı maddeler ve
uygun saklanmayan ürünlerde oluşabilecek bozunma)
İmmünojenisite
• İmmünojenisite mekanizmaları tamamen
anlaşılabilmiş değildir.
• Antikor oluşumu insidansı aşırı derecede seyrek ila
tedavi edilen hastaların büyük çoğunluğu arasında
değişebilmektedir.
• İmmünojenisite tüm popülasyonlarda veya tüm
endikasyonlar ile görülmeyebilir.
• Analiz araçları immünojenisitenin tam olarak
öngörülmesine izin vermez (unpredictable).
İmmünojenisite
• İmmünojenisitede en yaygın etki, etkinliğin
değişmesidir.
–İlaç aktivitesi kaybı çoğunlukla kalıcı nötralize edici antikor
düzeyleri ile meydana gelmektedir.
–Aynı sınıftaki tüm ürünlerin etkinliğini azaltabilir; alternatif
tedavi yoksa, ciddidir.
• Antikorun endojen bir proteinin aktivitesini nötralize
etmesi ya da endojen bir yapıya reaksiyon oluşturması
halinde, ciddi yan etkiler meydana gelebilir.
İmmünojenisite
• Antikor assayleri standartlaştırılmamıştır.
• İmmünojenisite mekanizmalarının tam olarak
anlaşılmadığından, bir immünojenik yanıtın
nasıl klinik sonuçlar doğuracağını öngörmek
genellikle olanaksızdır.
• İmmün sistem güncel analiz araçlarından çok
daha duyarlıdır (bekle ve gör).
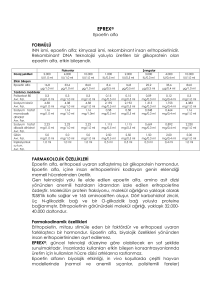
İnsan eritropoietin olayı
İnsan eritropoietin olayı
• Rekombinant insan
epoietini alan hastalar
arasında eritropoetinantikor pozitif saf kırmızı
hücre aplazisi (PRCA)
olgularında artış.
• ABD dışında dağıtılan
önceden doldurulmuş
Eprex® enjektörlerinde
insan serum albümini (HSA)
yerine polisorbat 80
kullanılmaya başlanması ile
aynı döneme denk geldiği
anlaşılmıştır.
İnsan eritropoietin olayı
Eritropoietin-antikor pozitif saf kırmızı hücre aplazisi (PRCA)
olgusu sayısı
80
70
Subkutan formülasyonun
çekilmesi
Eprex®’ten HSA
sabitleyicisinin çıkartılması
60
50
40
30
20
10
0
Pre1998
1998
1999
2000
ABD dışında EPO alfa (Eprex)
2001
Yıl
2002
2003
2004
Toplam antikor-pozitif PRCA
2005
Eşdeğer (jenerik) ilaç
• Eşdeğer ilaçlar, referans ilaçlarla aynı özelliklere sahip olduğu,
dolayısıyla, hasta üzerinde aynı tedaviyi sağladığı bilimsel
çalışmalarla kanıtlanan ve referans ilaçların koruma süreleri
bittikten sonra satışa sunulan ürünlerdir.
• Eşdeğer ilacın 4 temel özelliği; etkin, kaliteli güvenilir ve
ekonomik olmasıdır.
• Bir eşdeğer ilaç, referansıyla aynı etkinlik, kalite ve
güvenilirlikte olmak zorundadır.
Biyoyararlanım
Biyoeşdeğerlik
Türkiye’de % 85-125
aralığında kabul edilir
Biyoeşdeğerlik popülasyonu vs
Hasta popülasyonu
BE çalışma popülasyonu Hasta popülasyonu
Sağlıklı gönüllü
Hasta (organ disfonksiyonu)
Kısıtlı sayı (20-30)
Milyonlarca
Organlar sağlam
Organ fonksiyonları değişebilir
Sıklıkla erkek gönüllüler
Tek doz
Test öncesi kan düzeyi = 0
Tek ilaç
Cmax-Tmax farklılıklarına rağmen EAA
aynı kalabilir
Her iki cinsiyet
Kronik tedavi
İlaç kanda hep var
Polifarmasi
Cmax-Tmax farklılıkları etki-toksisite
farklılıklarına yol açabilir
Biyobenzer (biosimilar)
• Biyobenzer (biosimilar) ürünler, bir sağlık otoritesi
tarafından daha önce ruhsatlandırılmış bir biyofarmasötik
ürün ile ileri derecede benzerlik taşıyan biyolojik ilaçlardır.
• Biyofarmasötikler canlı organizmalardan üretildikleri için
farklılık göstermeleri kaçınılmazdır.
• Bu değişkenlik, başka faktörlerle örneğin, üretim
süreçlerinin geliştirilmesi veya değiştirilmesi aşamalarında
da ortaya çıkabilmektedir.
• Ayrıca her bir üretim serisi içinde olabileceği gibi seriden
seriye de değişebilir.
• Dolayısıyla farklı üreticilerin ürünleri arasında birçok
farklılığın olma olasılığı daha yüksektir.
Biyobenzer (biosimilar)
• Dolayısıyla, gerek referans, gerek biyobenzer
ürünlerdeki değişkenlikler tipik olarak klasik
jenerik ilaçlarda gözlenenlerden çok daha fazladır.
• İşte bu ürün özellikleri nedeniyle biyobenzerlerin
geliştirilmesi, üretimi ve ruhsatlandırması özel
kurallara bağlanmıştır.
• Bu ilaçların ruhsatlandırılmaları ile ilgili kurallar
Uluslararası Harmonizasyon Konferansı’nda (ICH)
geliştirilmiştir ve başta FDA ve EMA olmak üzere
birçok sağlık otoritelerince mevzuatlara
yansıtılmış ya da yansıtılmaktadır.
Farklı üretim süreçleri farklı ürünler üretmektedir
•
Biyobenzerler öncü biyolojiklere göre farklı üretim süreçleri ile üretilmektedir.
DNA dizisi
Protein üretimi
Klonlama
Saflaştırma
Kültivasyon
Formülasyon
Adapted from 24Kuhlmann et al. Nephrol Dial Transplant 2006:21(Suppl 5);v4–v8 and 40Trouvin. Presentation “Biological
Biotech products Overview on regulatory aspects” 2008; Available at: http://www.leem-recherche.org/wpcontent/uploads/2008/09/jh-trouvin-01-quality-approach_bio.pdf
Biyo benzer???
• Biyolojikler karmaşık moleküllerdir ve birebir
kopyaları yapılamaz.
• Dolayısıyla biyobenzerler (rekombinant
proteinler) jenerik değildir.
• Her ne kadar eşdeğer (jenerik) ilaçlar gibi
değerlendirilmeseler de konvansiyonel ilaçlar için
geçerli olan «farklı moleküllerin farklı ilaçlar
olması durumu» büyük moleküllü biyolojik
ürünler için çok daha fazla gerekli olmalıdır.
Biyobenzer ürün
«Biyojik ürünlerin özdeş kopyaları üretilemez, ancak
biyobenzerleri üretilebilir.»
AB Biyobenzer ürün tanımı:
«Orijinal biyolojik ürünle kalite, etkililik ve güvenlilik açısından
karşılaştırılabilir olduğunu klinik ve klinik-dışı çalışmalarla
kanıtlaması gereken üründür.»
| 43
Biyobenzerler
• AB’deki biyobenzerler için ruhsatlandırma gereklilikleri
bunların jenerik olmadığını ve biyolojiklerin birebir
kopyalarının yapılamayacağını yansıtmaktadır.
• Birebir aynı fizikokimyasal özellikler ve aynı farmakokinetik
profilleri göstermesi gereken jeneriklerin aksine,
biyobenzerler için gereklilikler çok daha kapsamlıdır.
• Biyobenzerler için ruhsatlandırma gereklilikleri tam kimya,
üretim ve kontrol (CMC) karakterizasyonunu, klinik öncesi
verileri, farmakokinetik verileri ve en az bir klinik çalışmayı
içermektedir (yeterli mi?).
• Biyobenzerler öncü bir biyolojik ile benzerliğe dayalı olarak
onaylandığından, bu öncü biyolojik (referans ürün) ile
kıyaslanabilirliği gösterilmelidir (yeterli mi?).
Farklı üretim süreçleri farklı ürünler
üretmektedir
• Farklı üreticilerin eritropoetin örneği
İzoelektrik odaklanma
Katod
Anod
Örnek
E IA IB IIA IIB IIIA IIIB IV
V VII VIII
E
E
VI
Kaynak: Schellekens. Nephrol Dial Transplant 2005:20(Suppl 4);iv31–iv36
Biyobenzerler
• Sınırlı klinik programda sık gözlenmeyen
advers olaylar ve immünojenisite sorunları
lansmandan önce saptanamaz.
• Dolayısıyla, tüm biyobenzerlerin lansman
sonrasında sürekli olarak güvenilirlik ve
immünojenisite verilerinin toplanması için bir
risk-yönetim planı (farmakovijilans) sağlaması
gerekmektedir.
Biyobenzerlerin farmakovijilansıyla ilgili
dünyada durum
12%
Biyobenzerlerin farmakovijilansı konusunda mevzuata sahip olan ülkeler. *Şubat 2013 itibariyle
Not: FDA’’nın mevcut taslak rehberinde, immünojenisiteyle alakalı bir pazarlama-sonrası çalışma ihtimalinden söz edilmektedir. Buna
ilaveten, "PAZARLAMA-SONRASI GÜVENLİLİK İZLEMİNDE DİKKAT EDİLECEK HUSUSLAR“ ’a ayrılmış bir bölüm bulunmaktadır.
EMA’ya sunulan biyobenzer başvuruları
Ticari isim
Jenerik isim
Ticari isim sahibi
Referans
ürün
Karar
Karar tarihi
Omnitrope®
Somatropin
Sandoz
Genotropin®
Ruhsatlandırıldı
12 Nisan 2006
Valtropin®
Somatropin
BioPartners
Humatrope®
Ruhsatlandırıldı
24 Nisan 2006
Alpheon®
İnterferon alfa-2a
BioPartners
Roferon-A®
Reddedildi
28 Haziran 2006
Binocrit®
Epoetin alfa Hexal
Abseamed®
Epoetin alfa
Sandoz
Hexal
Medice
Eprex®
Ruhsatlandırıldı
28 Ağustos 2007
Retacrit®
Silapo®
Epoetin zeta
Hospira
Stada
Eprex®
Ruhsatlandırıldı
18 Aralık 2007
Insulin Rapid Marvel
Çözünür insülin
Marvel
Humulin®
Çekildi
16 Ocak 2008
Insulin Long Marvel
İzofan insülin
Marvel
Humulin®
Çekildi
16 Ocak 2008
Insulin 30170 Mix Marvel
Bifazik insülin
Marvel
Humulin®
Çekildi
16 Ocak 2008
Tevagrastim®
Ratiograstim®
Filgrastim ratiopharm
Biograstim®
Filgrastim
Teva
Ratiopharm
Ratiopharm
CT Arzneimittle
Neupogen®
Ruhsatlandırıldı
18 Eylül 2008
Zarzio®
Filgrastim Hexal®
Filgrastim
Sandoz
Hexal
Neupogen®
Ruhsatlandırıldı
6 Şubat 2009
Nivestiml®
Filgrastim
Hospira
Neupogen®
Ruhsatlandırıldı
10 Haziran 2010
Epostima
Epoetin zeta
Reliance
GeneMedix Plc
Eprex®
Çekildi
15 Mart 2011
Mounho et al. Biyobenzerlerin Ruhsatlandırılması için Global Ruhsatlandırma Standartları. Gıda ve İlaç48
Yasası Dergisi 2010;65:819–837
ahttp://www.ema.europa.eu/docs/en_GB/document_library/Medicine_QA/2011/04/WC500105306.pdf
Son güncelleme: Mayıs 2011; EMA websitesi: http://www.ema.europa.eu/ema/index.jsp?curl=/pages/home/Home_Page.jsp&jsenabled=true
TİTCK (İEGM) biyobenzer başvuruları
Farmakovijilans açısından
yaşanabilecek önemli zorluk
Güvenlilik endişesi:
İmmünojenisite
Güvenliliğin izlenmesi
(farmakovijilans)
Güvenlilik sorunlarına
tepki verilmesi
Belirli bir biyobenzer ürünün
ve imalatçının
geriye doğru izinin sürülmesi
!
Eğer eczanede otomatikman ikame ediliyorlarsa,
biyobenzerlerin izinin sürülmesi güçleşir!!!
*Policy position on naming of biotechnology-derived therapeutic proteins. A joint position statement of the innovative biotechnology and
pharmaceutical industry associations: BIO, EBE, EFPIA, EuropaBio, IFPMA, and PhRMA
http://www.who.int/medicines/services/inn/WHO_INN-Research-basedIndustriesJointPosition.pdf
Sonuç
Özet
• Yakın gelecekte birden çok orijinal biyolojik ilacın patent sürelerinin
bitecek olması hem ilaç sektörünün hem de sağlık otoritelerinin
dikkatini bu alana çekmektedir.
• Ancak biyobenzer ilaç geliştirme ve üretimi oldukça karmaşık süreçler
içermektedir ve son ürün orijinal ilacın birebir kopyası olamaz.
• Biyobenzer ilaçlar için immünojenisite önemli klinik sonuçlar
doğurabilir.
• Biyobenzerler için tüm dünyada ruhsatlandırma süreçlerinin tanımlanması henüz devam etmektedir. Bu alanda öncülüğü EMA yapmaktadır.
• Ruhsatlandırma süreçlerinin yanı sıra biyobenzer ürünler için
farmakovijilans süreçlerinin tanımlanması da büyük önem teşkil
etmektedir.
• İlaç ikamesi ilaç güvenliliği ve izlemi açısından bir sorun olarak karşımıza
çıkabilir.
Yapılması gerekenler / Yapılabilecekler
• Biyobenzer bir ürün kullanımı sırasında hastada
ortaya çıkabilecek her türlü olumsuz durum:
– Fark edilmeli
– Kaydedilmeli
– Bildirilmeli (advers etki bildirim formu)
• Ne gibi olumsuzluklar:
– İmmünojenisite (alerjik reaksiyonlar, etkisizlik)
– Aktivite azalması (Hb-A1c KŞ - stabilite sorunu)
– Diğer (yan etkiler, kilo problemleri, hipoglisemi)
• Nasıl:
– Advers etki bildirim formu
Beşeri Tıbbi Ürünlerin Güvenliğinin İzlenmesi ve
Değerlendirilmesi Hakkında Yönetmelik
• Yönetmelik, 22 Mart 2005 tarih ve 25763 sayılı Resmi Gazete
’de yayınlanarak yürürlüğe girmiştir.
• Sağlık Mesleği Mensuplarının Sorumlulukları (Madde 8):
Hastalarda beşeri tıbbi ürün kullanımına bağlı olarak ortaya
çıkan ürün advers etkilerinin Bakanlığa spontan bildirimi,
advers etkileri gözlemleyen sağlık mesleği mensubunun
mesleki sorumluluğunda olup; bu bildirimler, bu
Yönetmeliğin 9 uncu ve 13 üncü maddelerinde öngörülen
şekilde gerçekleştirilir.
http://www.iegm.gov.tr/Folders/Docs/%C4%B0la%C3%A7%20G%C3%BCvenli%C4%9Fi%20%C4%B0zleme,%20De%C4%9Ferlendirme%20%C5%9Eube%20M%C3%B
Cd%C3%BCrl%C3%BC%C4%9F%C3%BC%20-%20T%C3%9CFAM/G%C3%BClnihal%20Sunum_425dc31.pdf
Marmara Üniversitesi Pendik EAH
Tıbbi Farmakoloji Birimi
• Mart 2011’den beri
• Poliklinik binası, 1. Kat, 9046 numaralı oda (Plastik Cerrahi Polikliniği
yanı)
• İlaç etkileşmeleri
• Gebelikte ve emzirme döneminde ilaç kullanımı
• Polifarmasi (en çok başvuru beklediğimiz ama olmayan)
• Bitkisel ürün kullanımı
• Karaciğer, böbrek yetmezliği, yaşlı, çocuk gibi özel popülasyonlarda
ilaç kullanımı
• Doz ve uygulama yolu belirleme
• Zehir danışma ve klinik toksikoloji
• Akılcı ilaç kullanımı
• Farmakovijilans
• İlaçla ilgili diğer tüm konular
Soru - Tartışma
Prof. Dr. Atila Karaalp
Marmara Üniversitesi Tıp Fak.
Tıbbi Farmakoloji Ab.D.
[email protected]