Uploaded by
burgayunlu
Enzim Biyokimyası: Yapı, İşlev ve Faktörler
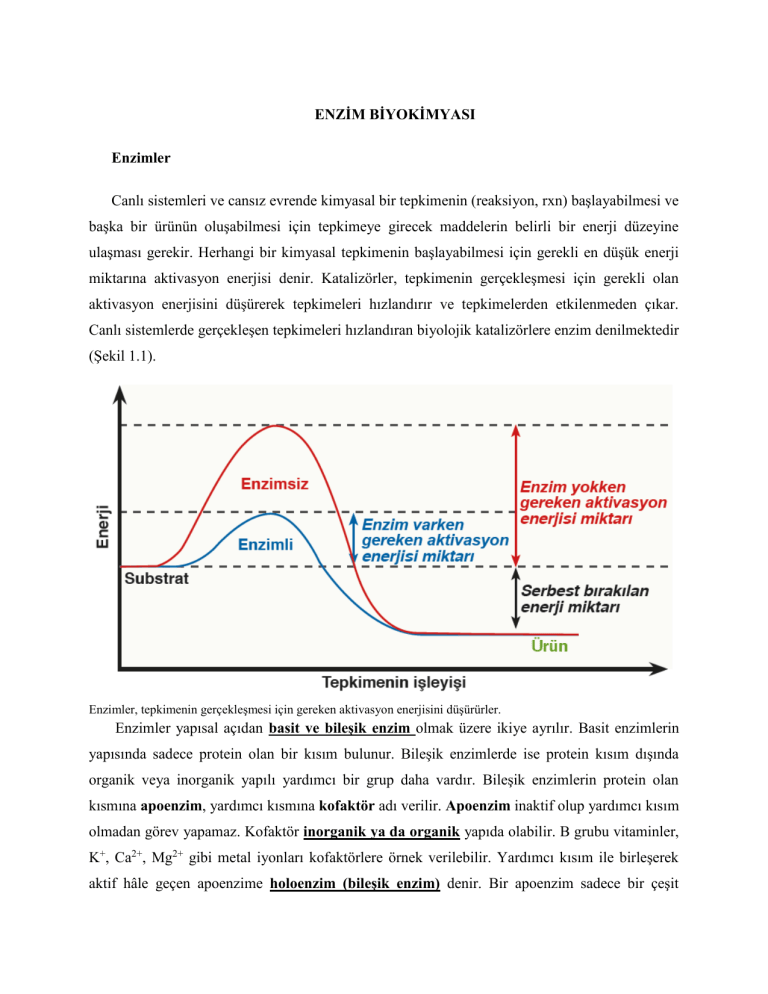
ENZİM BİYOKİMYASI Enzimler Canlı sistemleri ve cansız evrende kimyasal bir tepkimenin (reaksiyon, rxn) başlayabilmesi ve başka bir ürünün oluşabilmesi için tepkimeye girecek maddelerin belirli bir enerji düzeyine ulaşması gerekir. Herhangi bir kimyasal tepkimenin başlayabilmesi için gerekli en düşük enerji miktarına aktivasyon enerjisi denir. Katalizörler, tepkimenin gerçekleşmesi için gerekli olan aktivasyon enerjisini düşürerek tepkimeleri hızlandırır ve tepkimelerden etkilenmeden çıkar. Canlı sistemlerde gerçekleşen tepkimeleri hızlandıran biyolojik katalizörlere enzim denilmektedir (Şekil 1.1). Enzimler, tepkimenin gerçekleşmesi için gereken aktivasyon enerjisini düşürürler. Enzimler yapısal açıdan basit ve bileşik enzim olmak üzere ikiye ayrılır. Basit enzimlerin yapısında sadece protein olan bir kısım bulunur. Bileşik enzimlerde ise protein kısım dışında organik veya inorganik yapılı yardımcı bir grup daha vardır. Bileşik enzimlerin protein olan kısmına apoenzim, yardımcı kısmına kofaktör adı verilir. Apoenzim inaktif olup yardımcı kısım olmadan görev yapamaz. Kofaktör inorganik ya da organik yapıda olabilir. B grubu vitaminler, K+, Ca2+, Mg2+ gibi metal iyonları kofaktörlere örnek verilebilir. Yardımcı kısım ile birleşerek aktif hâle geçen apoenzime holoenzim (bileşik enzim) denir. Bir apoenzim sadece bir çeşit koenzim veya kofaktörle çalışırken bir koenzim veya kofaktör değişik apoenzimlerle çalışabilir. Holoenzimlerde enzimin etki edeceği maddeyi (substrat) tanıyan ve enzimlerdeki substrat özgüllüğünü sağlayan protein yapıdaki apoenzim kısmıdır. Katalitik etkinliği ise apoenzime bağlanan yardımcı kısım olarak koenzim veya kofaktör kısmı substratı ürüne dönüştürerek gerçekleştirir. Enzimler metabolizmada (biyolojik sistemlerde), gerçekleşen kimyasal reaksiyonlarda katalizör fonksiyonu sergileyerek reaksiyon hızını 106 – 1012 kez arttıran protein yapıdaki moleküllerdir. Özetle, katalizör olarak bir enzimin fonksiyonu, aktivasyon enerjisini düşürmek suretiyle bir reaksiyonun hızını artırmaktır. Enzimler reaksiyon ΔG’sini değiştirmeden başlangıç enerjisini düşürerek katalizör görevi üstlenen makromoleküllerdir. Ancak kimyasal dengeyi ve ΔG (Gibbs serbest enerjisi, reaksiyon enerjisinin işe dönüşümü) değiştirmezler. Substratla reaksiyona giren, kendisi parçalanmadan veya değişikliğe uğramadan kimyasal reaksiyonu katalizleyen, büyük oranda protein yapıdaki moleküllerdir. İstisna örnekler, RNA yapısındaki ribozimler, DNA yapısındaki enzimler DNAaz’lar olarak bilinmektedir. Diğer bir deyişle canlı dünyasında reaksiyon katalizörleri olan enzimler, biyokimyasal olayların vücutta yaşam ile uyumlu bir şekilde (fizyolojik pH, 36,5 ˚C ve hücre ve organizmanın homeostazisini sağlayan metabolik aktivite düzeninde) gerçekleşmesini sağlayan kimyasal ajanlardır Sub strat Enzim (Anahtar) Substrat (Kilit) Aktif merkez Enzim-Substrat kompleksi Enzim-Substrat kompleksi Ür ünler E nzim E nzim rün E nzim Ü Organizmadaki biyokimyasal tepkimeleri hızlandıran katalizörlere enzim, enzimlerin etki ettiği maddelere substrat, tepkime sonunda ortaya çıkan maddeye ise ürün adı verilir. Enzim ile substratı arasındaki uyum anahtar-kilit ilişkisine benzer. Enzimler substratlara özgüdür. Her enzim her substrata etki edemez. Enzim substratına bağlanarak enzim-substrat kompleksini oluşturur. Enzimin substratına geçici olarak bağlandığı ve etki ettiği bölgeye aktif merkez denir. Substrat enzim etkisi ile ürüne dönüşür. Enzim, herhangi bir değişikliğe uğramadan üründen ayrılır. Bazı enzimler çift yönlü çalışabilir (tersinir). Örneğin kanda gazların taşınmasından sorumlu olan ve alyuvarlarda bulunan karbonik anhidraz enziminin CO2 taşınırken gerçekleştirdiği tepkimeler tersinirdir. 𝐶𝑂2 + 𝐻2𝑂 ⇔ 𝐻2𝐶𝑂3 Enzimler çok hızlı çalışır. Karaciğer, kas ve bitki hücrelerinde metabolizma sonucunda çok zararlı bir bileşik (Bkz. Oksidatif stres, serbest radikal hasarı) olan hidrojen peroksit (H2O2) oluşur. Bu hücrelerde bulunan katalaz enzimi, her bir saniyede milyonlarca H2O2 molekülünü su ve oksijene parçalayarak zararsız hâle getirir. Katalaz enzimi, antioksidan sistemin süperoksit dismutaz, glutatyon peroksidaz gibi enzim yapısındaki bir bileşenidir. H2O2 detoksifikasyonunu gerçekleştirir. 1 𝐻2𝑂2 + 𝑘𝑎𝑡𝑎𝑙𝑎𝑧 → 𝐻2𝑂 + O2 + katalaz 2 Enzimler hem hücre içinde (intraselüler) hem de hücre dışında (ekstraselüler) çalışabilir. Örneğin besinleri parçalayan sindirim enzimleri, hücre içinde ve hücre dışında çalışabilmektedir. Enzimler, tepkimelerden değişmeden çıkar. Bu yüzden tekrar tekrar kullanılabilir. Zamanla yapısı bozulan enzimler amino asitlerine kadar yıkılır ve yerine yenisi (denova sentez) sentezlenir. Koenzim ve kofaktörler de tekrar tekrar kullanılabilir. Hücrede ilgili proteini kodlayan belirli bir genin kontrolünde sentezlenen enzimlerin miktarı dolayısıyla katalizledikleri tepkimeler ve metabolik reaksiyonlar bütünü denetim altındadır. Enzimler takımlar hâlinde çalışır, bir enzimin etki ettiği tepkimenin ürünü, kendinden sonraki enzimin substratıdır. Nişastayı glikoza kadar parçalayan amilaz ve maltaz enzimleri buna iyi bir örnektir. Takım hâlinde çalışan enzimlerde son ürün miktarı belli bir değere ulaştığında metabolik yolun son ürünü metabolik yolda yer alan bir enzime bağlanarak o enzimin çalışmasını durdurur. Böylece metabolik yol kontrol edilir. Bu olaya feedback (geribesleme) mekanizması denir. Enzimler, genellikle substrat çeşidi ya da tepkime çeşidi isminin sonuna -az eki getirilerek adlandırılır. Maltaz, sükraz, kinaz ve hidrolaz buna örnektir. İsminin sonunda -ojen eki bulunan enzimler ilk salgılandıklarında inaktif (zimojen) durumdadır. Bu enzimler, belirli şartlar altında aktif hâle geçer. Örneğin midede proteinlerin sindirimini gerçekleştiren pepsinojen enzimi ilk salgılandığında inaktiftir (proenzim). Besinlerin mideye ulaşmasıyla birlikte mide parietal hücrelerince salgılanan HCl (hidroklorik asit) sayesinde pepsinojen, belirli peptid dizisinin proteolitik kesimi ile aktif formu olan pepsine dönüşür. Enzimlerin Çalışmasına Etki Eden Faktörler a) Sıcaklık Enzimler, protein yapılı olduğundan yüksek ve düşük sıcaklıktan etkilenir. 0 °C gibi düşük sıcaklıklarda genellikle enzimlerin yapısı bozulmaz. Ancak enzimler etkinlik gösteremez. Gıdaların düşük sıcaklıkta uzun süre bozulmadan saklanabilmesinin sebebi budur. Enzimler, insan vücudunda en iyi 37 °C civarında çalışır. Enzimlerin en iyi çalıştığı sıcaklık değerine optimum (ideal) sıcaklık denir. Her enzimin sıcaklığa karşı belirli bir toleransı vardır. Optimum sıcaklık değeri aşıldığında tepkimenin hızı düşmeye başlar ve genellikle 55 °C’den sonra tamamen durur. Bunun sebebi enzimleri oluşturan proteinlerin yapısının yüksek sıcaklıklarda bozulmasıdır (denatürasyon). Denatürasyon, proteinlerin aktif formlarını oluşturan sekonder ve tersiyer yapılarının kaybolmasına ve primer protein yapısına dönülmesini ifade etmektedir. Organizmada denatüre proteinler, disfonksiyonel olmaları yanı sıra çözünürlüklerini yitirmeleri nedeniyle proteolitik yıkıma yönlendirilir. Sinir sistemindeki enzimlerin fonksiyonları 41°C’den sonra bozulmaya ve denatürasyon sürecine giremesi vd. birtakım patolojik hücresel süreçler nedeniyle (özellikle nöronal matürasyonun tam olarak gerçekleşmediği pediatrik yaş gruplarında) yüksek ateş havale (nöbet) geçirilmesine neden olan etmenlerden biridir. b) pH Her enzimin etkin bir şekilde çalıştığı belirli bir pH aralığı ve maksimum hızda çalıştığı belirli bir pH değeri vardır. Enzimin maksimum hıza ulaştığı pH değerine optimum (ideal) pH denir. Örneğin midede çalışan sindirim enzimleri, asidik; pankreas ve bağırsaktan salınan sindirim enzimleri ise bazik ortamda çalışır. Midede çalışan pepsin enziminin optimum pH değeri 2, bağırsaklarda görev alan tripsin enziminin optimum pH değeri ise 8’dir. Kan ve vücut proteinlerinin optimum pH değeri ise genellikle 7’dir. c) Enzim ve Substrat Miktarı Enzim ve substrat miktarı tepkime hızını etkiler. Enzim ve substrat miktarına bağlı olarak reaksiyon hızı üç farklı şekilde değişebilir. ♦ Enzim ve substrat miktarı sürekli artarsa tepkime hızı sürekli artar. Doğal ortamlarda enzim ve substrat miktarı sınırlı olduğu için bu tür tepkime grafiklerine rastlanmaz. ♦ Enzim miktarı sabit, substrat miktarı sürekli artarsa tepkime hızı belirli bir noktaya kadar artar. Tüm enzimler substratları ile birleştiğinde tepkime hızı sabitlenir. ♦ Enzim miktarı artarken substrat miktarı sabit ise tepkime hızı belirli bir noktaya kadar artar. Ortamda substrat kalmadığında tepkime durur d) Su Ortamdaki su yoğunluğu %15’in altına düştüğünde enzimler aktivite gösteremez. Yoğunluk %15’in üstüne çıktığında enzimler çalışmaya başlar. Su yoğunluğu belirli bir noktaya ulaşıncaya kadar tepkime hızı artar ve belirli bir noktadan sonra sabit kalır. Su yoğunluğu aşırı artarsa tepkime hızı azalır. Düşük su yoğunluğundan dolayı kurutulmuş meyve ve sebzelerde mikroorganizmalar üreyemez. Bu sayede kurutulmuş gıdalar uzun süre bozulmadan saklanabilir. e) Substrat Yüzeyi Enzimler dış yüzeylerinden başlayarak substratlara etki eder. Substrat yüzeyi artırılabiliyorsa tepkime hızı da artar. Besinlerin iyice çiğnendikten sonra yutulması, substrat yüzeyini artırdığından sindirim tepkimelerini hızlandırır. Yağların sindiriminde lipazların etki gösterebilmesi, safra sıvısının lipitlerle etkileşime girerek lipid emülsifikasyonu gerçekleştirmesi, yani lipazların lipid substratlarına hidrolitik etkinliğini sergileyebilecekleri yüzeyi oluştururlar. f) Aktivatörler Enzimin çalışma hızını artıran madde veya faktörlere aktivatör denir. Pepsinojen, mide hücreleri tarafından üretilen inaktif bir enzimdir. Hidroklorik asit (HCl), pepsinojeni aktif pepsin durumuna getiren bir aktivatör maddedir. Bileşik enzimlerin yapısında bulunan kofaktör ya da koenzimler ile su da bir aktivatördür. Isı, ışık, pH değişimleri bir noktaya kadar aktivatör etki gösterir. Örneğin fotosentezde görev alan bazı enzimler, ışık ile aktive olur. Ayrıca metabolizmadaki çoğu enzim aktivitesi allosterik düzenleme ile denetlenmektedir (Bkz. Enzim aktivitesinin allosterik olarak düzenlenmesi). g) Enzim Aktivitesinin Allosterik Olarak Düzenlenmesi Bazı multienzim sistemlerinde, apoenzim yapısı içerisinde allosterik düzenleme bölgesine sahip olan regülatör enzimin, son ürün gerektiğinden fazla olduğunda metabolik yolun son ürünü tarafından spesifik olarak inhibe edilmesine, bu sayede organizmada aşırı metabolit birikiminin önlenmesini sağlayan fizyolojik bir inhibisyondur. Enzim aktivitesinin bu tür düzenlenmesi, allosterik feedback inhibisyon olarak adlandırılır. Aktiviteleri allosterik feedback inhibisyon vasıtasıyla ayarlanan enzimler, katalitik aktif bölgeleri (substrat bağlanma bölgeleri), kofaktör bağlanma bölgeleri ve ayrıca enzim aktivitesini değiştiren metabolik yolaktaki metabolitlerin bağlanmasını sağlayan bir veya daha fazla düzenleyici allosterik bölgeye (R) [enzim aktivitesini arttıran pozitif modülatör (effektör) veya azaltan negatif modülatörü (inhitör)] sahiptirler. h) İnhibitörler Enzimlere bağlanarak veya enzimi kararsız hâle getirerek etkisizleştiren madde veya faktörlere inhibitör denir. İnhibitörler enzimlerin etkinliğini yavaşlatır ya da geri dönüşümsüz olarak durdurur. Siyanür, yılan, böcek ve akrep zehirleri, arsenik, kurşun, cıva gibi elementler, antibiyotikler ve bazı metabolik son ürünler inhibitörlere örnek verilebilir. Yüksek sıcaklık, ışık, pH değişimleri de inhibitör etkisi gösterir. Örneğin ultraviyole ışınlar amilaz enzimini inhibe eder. Reversibl enzim inhibisyonları • Kompetitif (yarışmalı) enzim inhibisyonu • Unkompetitif enzim inhibisyonu • Nonkompetitif (yarışmasız) enzim inhibisyonu İrreversibl enzim inhibisyonları İnhibitör bileşikler, substrat bağlanmamış olan serbest enzime veya enzim substrat kompleksi bağlanabilir. Bu şekilde ES kompleksinin oluşumu ve ürün dönüşümünü bloke ederler. Enzim inhibitörleri ile enzim inhibisyonu reversibl (geri dönüşlü) veya irreversibl (geri döndürülemez) olabilir. Reversibl inhibitörler, enzimlerle kovalent olmayan bağ yaparken, irreversibl inhibitörler kovalent enzimlere bağlanırlar. İnhibitör bileşikler, serbest enzime veya ES kompleksine bağlanabildikleri halde substrat gibi hareket edip ürün oluşturmazlar. Enzim inhibitörleri ile enzim inhibisyonu reversibl (geri dönüşlü) veya irreversibl (geri döndürülemez) olabilir. Reversibl kompetitif inhibitörler, enzim veya ES kompleksiyle kovalent olmayan bağ yaparak tepkime sonucu ürün elde Kompetitif edilmesini enzim önlerler. inhibisyonunda inhibitör madde, enzimin substratına olan ilgisini azaltır; Km değeri büyür. en, irreversibl inhibitörler kovalent enzimlere bağlanırlar. Enzimin Substrat Özgünlüğü Enzimin aktif bölgesi substrat için oldukça özgündür (spesifite). Enzimlerin özgünlüğü: bağ, grup, substrat, optik, geometrik ve kofaktör özgünlüğü olarak 5 başlık altında incelenmektedir. Bağ özgülüğü: Enzimler, substrat moleküllerindeki belirli bağları hedef alarak etki gösterirler. Ör. proteazlar peptid bağlarını, esterazlar ester bağlarını hedef alarak hidroliz rxn katalizini gerçekleştirirler. Optik özgünlük: Fumarat, fumarik asitin trans formuna H2O eklerken, cis izomeri olan maleik asite bu etkiyi yapamaz. Bağıl özgünlük: Bazı enzimler bağlı oldukları gruplara spesifite gösterirler. Ör: Hekzokinaz, çeşitli heksoz şekerlere ATP’den fosfat transfer eder. Mutlak özgünlük: Bazı enzimler yalnız tek bir substratın belirli bölgesine etki ederler. Ör: Glukokinaz ATP’den sadece glukoza fosfat transferini katalizler, diğer şekerleri substrat olarak kullanamaz. Üreaz üreyi, karbonik anhidraz sadece karbonik asiti etkiler. Grup özgünlüğü: Enzim sadece bağ ve konuma değil aynı zamanda bağı çevreleyen kimyasal gruplar ya da atomlara da özgünlük gösterir. Ör. karboksipeptidaz enzimi, polipeptid zincirinin sonundaki serbest karboksil ucuna, aminopeptidaz ise polipeptid zincirinin serbest amino ucuna etki eder. Çifte özgünlük: Enzim iki farklı substrata etki edebilir. Ör. ksantin oksidaz hem hipoksantin hem de ksantine etki eder. (Ürik asit) Hormonlar, belirli hücre tiplerinden salgılanan ve hedef hücreler üzerinde düzenleyici etki gösteren, amino asit, polipeptit, protein ve steroid yapıdaki organik bileşiklerdir. Hormonlar, büyüme, gelişme, üreme ve homeostazisi sağlama gibi görevleri yerine getirdiğinden canlılık için esansiyeldir. Sentez, sekresyon ve hedef hücre üzerine olan etkilerinde çoğunlukla azalma nadiren artış yaşanması metabolik hastalıklara yol açar. Endokrin bezler (gland) tarafından üretilen hormonlar, kan ve vücut sıvılarıyla hedef organlara taşınır. Örneğin insanda hipofiz bezinden salgılanan ve kan yoluyla tüm vücuda dağıtılan büyüme hormonu (GH, protein yapıdaki bir hormondur), vücuttaki hücreleri etkileyerek büyümeyi ve hücre yenilenmesi ile hücrenin bölünmesini uyarır. Az salınması cüceliğe (dwarfizm), fazla salınması ise devliğe (gigantizm) yol açar. Bunun dışında büyüme hormonu kan şekerindeki düşüşe yanıt veren bir hormondur. VİTAMİN BİYOKİMYASI Sağlıklı bir yaşamın sürdürülebilmesi için proteinler, lipitler, karbonhidratlar, inorganik tuzlar, mineraller gibi maddelerin yanı sıra vitaminlere de ihtiyaç duyulur. Vitaminler, genelde insan vücudu tarafından üretilemediğinden besinler yoluyla dışarıdan hazır alınmaları gerekir. Bitkiler ihtiyaç duyduğu vitaminlerin tümünü kendileri üretir. Her vitaminin metabolizmada kendine özgü bir fonksiyonu olduğu için bir vitaminin eksikliği bir başka vitamin ile giderilemez. Vitaminlerin eksikliği durumunda birtakım rahatsızlıklar meydana gelir. Vitaminler vücutta enerji verici olarak kullanılmaz ancak enerji dönüşüm olaylarında ve biyokimyasal tepkimelerde enzimlerin yardımcı grupları olarak görev aldığı için düzenleyici moleküllerdir. Vitaminler basit yapılı olduğundan sindirime uğramaz ve hücre zarından doğrudan geçebilir. Vitaminlerin birçoğu yüksek sıcaklık, ışık, asit-bazdan etkilenir ve oksijen varlığında bozulur. Vitaminler yağda ve suda çözünen vitaminler olmak üzere iki gruba ayrılır. Yağda çözünenler A, D, E ve K; suda çözünenler ise B grubu ve C vitaminleridir. a) Yağda Çözünen Vitaminler Yağda çözünen vitaminler vücutta depolanabildiğinden eksiklikleri geç hissedilir. Yağda çözünen vitaminlerin bağırsaklardan emilebilmesi için yağların sindiriminde ve emiliminde problem olmaması gerekir. A vitamini Suda çözünemeyen A vitamini, benzen, eter, kloroform gibi maddelerde çözünür. Görme, büyüme, üreme, bağışıklık, kan yapı- mı ve embriyo gelişimi için gerekli olan bir vitamindir. A vitamini; hayvansal gıdalardan en çok balık, karaciğer, tereyağı, yumurta sarısı ve yağlı sütte, koyu yeşil-sarı yapraklı sebzelerde, havuçta (Görsel 1.70), patateste ve meyvelerde bol miktarda bulunur. A vitaminin öncüsü olan karotenler ince bağırsaklarda emilir. Karaciğerde dönüştürülerek depolanan A vitamininin eksiklik belirtileri, yetişkinlerde bir yıldan sonra görülmeye başlar. A vitamini eksikliğinde; kemik ve diş gelişiminde problemler, deride kuruma ve pullanma, gece körlüğü, vücut direncinin azalması gibi rahatsızlıklar görülebilir. A vitamininin uzun süre yüksek dozda alınması durumunda vücutta zehirlenme belirtileri görülür. Deri, avuç içi ve ayak tabanları sarı bir renk alır. D vitamini D vitamini, kalsiyum ve fosforun ince bağırsaklarda emilmesini ay- rıca kemik ve dişlerde depolanmasını sağlar. İdrarla kalsiyum ve fosfor atılımını azaltır. D vitamini eksikliğinde çocuklarda uzun ke- miklerde eğriliklerle ortaya çıkan raşitizm, büyüme ve gelişmede gerileme, ilerleyen yaşlarda osteoporoz (kemik erimesi), osteo- malazi (kemik yumuşaması) gibi kemik kayıplarına bağlı oluşan hastalıklar görülür. Raşitizm özellikle süt çocuklarında çok görülen bir hastalıktır.









