Uploaded by
birader007
Bohr Atom Modeli: Açıklama ve Postulatlar

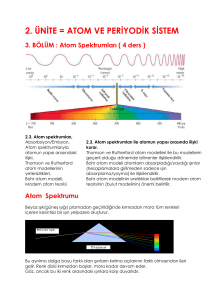
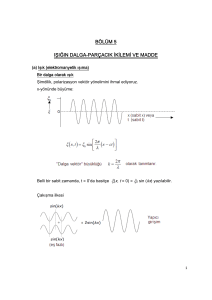
Bohr Atom Modeli Nedir Bohr atom modeli nedir, Bohr atom modeli özellikleri ile ilgili özet konu anlatımı şu şekilde: Niels Henrik Bohr 1911 yılında kendinden önceki Rutherford Atom Modelinden yararlanarak yeni bir atom modeli fikrini öne sürdü. Bohr Atom Modeli Bohr atom modeli öncesi diğer atom modellerinde, atomun çekirdeğinde, (+) yüklü proton ve yüksüz nötronların bulunduğu, çekirdeğin etrafında dairesel yörüngelerde elektronların dolaştığı ifade edildi. Bu elektronların çekirdek etrafında nasıl bir yörüngede dolaştığı, hız ve momentumlarının ne olduğu ile ilgili bir netice ortaya konmadı. Bohr ise atom teorisinde elektronların hareketini bu noktadan inceledi. Bohr kuramının varsayımları 1913 yılında Niels Bohr, hidrojen atomunun spektrum çizgilerini ve Planck’ın kuantum kuramını kullanarak Bohr kuramını ileri sürdü. Bu bilgiler ışığında Bohr varsayımları (postulatları) şöyle özetlenebilir: 1. Bir atomdaki elektronlar çekirdekten belli uzaklıktaki yörüngelerde hareket eder ve bu yörüngelerdeki açısal momentumu h/2pi’nin tam katlarıdır. Her kararlı hâlin sabit bir enerjisi vardır. 2. Herhangi bir kararlı enerji seviyesinde elektron dairesel bir yörüngede hareket eder. Bu yörüngelere enerji düzeyleri veya kabukları denir. 3. Elektron kararlı hâllerden birinde bulunurken atom ışık (radyasyon) yayınlamaz. Ancak, yüksek enerji düzeyinden daha düşük enerji düzeyine geçtiğinde, seviyeler arasındaki enerji farkına eşit bir ışık kuantı yayınlar. Burada E = Eson-Eilk bağıntısı geçerlidir. 4. Elektron hareketinin mümkün olduğu kararlı seviyeler, K, L, M, N, O gibi harflerle veya en düşük enerji düzeyi 1 olmak üzere, her enerji düzeyi + bir tam sayı ile belirlenir ve genel olarak “n” İle gösterilir, (n: 1,2,3 …) Uyarılmış atom Bohr atom modeline göre, çekirdeğe en yakın enerji seviyesine dairesel hareket yapan elektron kararlıdır, ışık yaymaz. Elektrona yeterli enerji verilirse elektron bulunduğu enerji seviyesinden daha yüksek enerji seviyesine sıçrar. Atom bu durumda kararsızdır. Kararlı hale gelmek için elektron tekrar eski enerji seviyesine dönerken almış olduğu enerji seviyesine eşit enerjide bir Foton (ışın taneciği / dalgası) fırlatır. Atom bu şekilde ışıma yapar. Bohr Atom Modelindeki eksiklikler Elektronlar çok hızlı olduğu için sadece klasik fizik değil, rölativite de göz önüne alınarak düşünülmeliydi. Bohr Atom Modeli, sadece tek elektronlu atomların (hidrojen) spektrumlarını açıklayabilir. Çok elektronlu atomların spektrumlarını açıklayamaz. Bohr Atom Modelinde dalga-parçacık ikiliği (De Broglie Hipotezi) göz önüne alınmamıştır. Heisenberg belirsizlik ilkesine göre atomdaki elektronun yeri ve hızı kesin olarak ölçülemez. Bundan dolayı “yörünge” kavramı yanlıştır. Bohr Atom Modeli Teorisi hakkında aktaracaklarımız bu şekilde. Bohr Varsayımları, Bohr Teorileri, Bohr Postülaları 2010-01-06 22:47:00 Bohr postülaları, kendisinden daha önce öne sürülmüş atom modellerinin (thomson atom modeli, rotherford atom modeli) yanlış ve eksiklerini tamamlamak üzere 4 ana başlıkta toparlanabilecek postülalar geliştirmiştir. Bu ayrıntılı incelenmesi konuyu en sadece şekliyle yazacak olursak; 1- Atomlarda elektronlar çekirdek etrafında dairesel yörüngede hareket ederler. Elektron ve çekirdek arasındaki kuvvet coulomb kuvvetidir. 2- Elektronlar açısal momentumu h (h/2pi) 'in tam katlarıyla verilen kararlı yörüngelerde hareket ederler. Açısal momentum kuantizedir. (Klasik fizikte açısal momentum süreklidir) 3- Elektron izinli yörüngelerde hareket ederken elektromanyetik ışıma yapmazlar. 4- Eğer elektron başlangıçta toplam enerjisi Ei olan bir enerji seviyesinden Es olan bir seviyeye sıçrama yaparsa, elektromanyetik ışıma yapar. Yayınlanan elektromanyetik dalganın frekansi enerji düzeyleri arasındaki farkın h planck sabitine bölümüyle bulunur. f = (Ei-Es) / h Niels Hendrik Bohr 1919 yılında kendinden önceki Rutherford Atom Modeli atom modellerinden yaralanarak yeni bir atom modeli fikrini öne sürdü. Kaynak: Bohr Atom Modeli https://www.msxlabs.org/forum/fizik/254957-bohr-atommodeli.html#ixzz4cPquiLSd Çekirdeğe en yakın enerji seviyesine dairesel hareket yapan elektron kararlıdır, ışık yaymaz. Elektron'a yeterli enerji verilirse elektron bulunduğu enerji seviyesinden daha yüksek enerji seviyesine sıçrar. Atom bu durumda kararsızdır. Kararlı hale gelmek için elektron tekrar eski enerji seviyesine dönerken almış olduğu enerji seviyesini eşit enerjide bir Foton (ışın taneciği) fırlatır. Atom bu şekilde ışıma yapar. Bohr Atom Teorisi Buraya kadar anlatılan atom modellerinde, atomun çekirdeğinde, (+) yüklü proton ve yüksüz nötronların bulunduğu, çekirdeğin etrafında dairesel yörüngelerde elektronların dolaştığı ifade edildi. Bu elektronların çekirdek etrafında nasıl bir yörüngede dolaştığı, hız ve momentumlarının ne olduğu ile ilgili bir netice ortaya konmadı. Bohr ise atom teorisinde elektronların hareketini bu noktadan inceledi. 1913 yılında Neils Bohr, hidrojen atomunun spektrum çizgilerini ve Planck'ın kuvantum kuramını kullanarak Bohr kuramını ileri sürdü. Bu bilgiler ışığında Bohr postulatları şöyle özetlenebilir. 1. Bir atomdaki elektronlar çekirdekten belli uzaklıktaki yörüngelerde hareket eder ve bu yörüngelerdeki açısal momentumu h/2π'nin tam katlarıdır. Her kararlı hâlin sabit bir enerjisi vardır. 2. Her hangi bir kararlı enerji seviyesinde elektron dairesel bir yörüngede (orbitalde) hareket eder. Bu yörüngelere enerji düzeyleri veya kabukları denir. 3. Elektron kararlı hâllerden birinde bulunurken atom ışık (radyasyon) yayınlamaz. Ancak, yüksek enerji düzeyinden daha düşük enerji düzeyine geçtiğinde, seviyeler arasındaki enerji farkına eşit bir ışık kuantı yayınlar. Burada E = Eson-Eilk bağıntısı geçerlidir. 4. Elektron hareketinin mümkün olduğu kararlı seviyeler, K, L, M, N, O gibi harflerle veya en düşük enerji düzeyi 1 olmak üzere, her enerji düzeyi pozitif bir tam sayı ile belirlenir ve genel olarak "n" İle gösterilir, (n: 1,2,3 ....) Bugünkü bilgilerimize göre; Bohr kuramının, elektronların dairesel yörüngelerde hareket ettikleri, ifadesi yanlıştır. Kaynak: Bohr Atom Modeli https://www.msxlabs.org/forum/fizik/254957-bohr-atommodeli.html#ixzz4cPqoPJdg Bohr Atom Modeli (1913) Atomik yapı problemi ilgisini çekmiş olan Niels Bohr (1885-1962), yaratıcı cesaretli bir adım attı: klasik fiziğin bazı kurallarını bıraktı ve onun yerine atomik yapı problemine Max Planck’ın ve Albert Einstein’in kuantum kuramını uyguladı. Dikkate değerdir ki o zamanlar bilinen kuantum kuramının birkaç özelliği problemi çözebilirdi-klasik fizikle çelişki konusuna aldırış edilmediği sürece. Bohr, basitçe, çekirdek etrafındaki yörüngelerdeki elektronların ışık yaymadıklarını ve atomların yaydığı ışığın bir başka fiziksel yapının sonucu olduğunu varsaydı. Bohr, Planck’ın enerjinin kuantlaşması fikrinin, elektronlar için ancak belli yörüngelerin mümkün olduğu anlamına geldiğini gösterdi. Atomların kararlılığını açıklamak için Bohr, yörüngedeki elektronun onun altına düşemeyeceği en düşük enerjili yörünge (daha doğrusu enerji düzeyi) konusunda bir önermede bulundu. Bir elektron daha yüksek bir yörüngeden, daha alçağına düşerken, böylece enerji kaybederken, bu elektronu taşıyan atom ışık yayar, bu da kaybedilen enerjiyi taşır. Yalnızca belli elektron yörüngelerine izin verildiği için, elektronların yörüngeler arasında yalnız belli sıçramalar olabilir ve sonuç olarak, yayılan ışığın enerjisi kuantlaşır. Işığın enerjisi rengi ile bağlantılı olduğu için atomlar tarafından ancak belli renklerde ışık yayılabilir. Bu şekilde Bohr’un kuramsal atom modeli, gizemli spektrum (tayf) çizgilerinin varlığını açıklamaktadır. Her farklı atomun tek ve belli renklerde ışık yaydığını ifade eden deneysel olarak gözlemlenmiş gerçek, atomların kuantumlu yapısını açığa çıkarmıştır. Bohr’un atomunun enerji düzeylerini imgelemenin bir yolu, harp gibi, yaylı bir müzik enstrümanı düşünmektir. Çalındığı zaman her yaydan belli bir titreşim veya ses çıkar. Benzer şekilde bir elektron, atomdaki yörüngelerde atlarken, belli bir titreşimi veya rengi olan ışık yayılması olur. Bu da kesintili ışık tayfının kaynağıdır. Bohr yeni fikirlerini, tek bir protonla onun çevresinde yörüngede tek bir elektronu olan en basit atoma, hidrojene uyguladı. Böyle basit bir atom incelemenin avantajı, elektronun izin verilen yörüngelerinin kesin olarak hesaplanabilir olması ve bu nedenle de hidrojenden çıkan ışık tayfının belirlenebilmesidir. Hidrojen atomuna uygulandığı kadarıyla Bohr kuramının temel fikirleri şöyledir: 1. Elektron, protonun çevresinde Coulomb çekim kuvvetinin etkisi altında dairesel bir yörüngede hareket eder. 2. Atomda yalnızca belirli yörüngeler kararlıdır. Bu kararlı yörüngeler, elektronun(dolaysıyla atomun) ışıma yapmadığı yörüngelerdir (Enerji sabit ya da kararlı olduğundan elektronun hareketini tanımlamak için klasik mekanik kullanılabilir). 3. Işık yaymayan atom, yani en düşük enerjili atom için temel durumdaki atom nitelemesi yapılır. Enerji almış bir atoma ise uyarılmış atom denir. Uyarılmış atomlar, temel duruma geçerken ışık yayınlar. Bu sıçramalı, ani geçiş, klasik olarak gösterilemez ya da ele alınamaz. Bu sıçramalı geçişte fotonun frekansı, elektronun yörüngesel hareketinin frekansından bağımsızdır. 4. Elektron yörüngesinin izin verilen büyüklüğü, elektronun yörüngesel açısal momentumuna dayanan ek bir kuantum koşulu ile belirlenir. Başka anlatımla elektron n=1, 2, 3, 4... gibi özel tamsayılarla gösterilen baş kuant sayılı enerji düzeylerinde bulunabilir. Bohr’un kendi teorik atom modeline dayanan hidrojen ışık tayfı ile ilgili hesapları, deneysel olarak gözlemlenmiş olan tayfa yeterince uygun sonuç verdi. Kuram ile deney arasında böyle uyum rasgele olamazdı. Bu durum, Bohr’un kuantum teorisinden aldığı fikirler bileşiminin doğru çıktığı anlamına geliyordu-bilimsel imgelem atomların kuantum yapısına ilk başarılı adımını atmıştı, insan zihninin yeni bir ortamı, bu durumda maddenin atomik yapısını kavrama konusundaki eski kapasitesi yine güçlü şekilde desteklenmişti. Çizgi spektrumunun kuramsal olarak çıkarılması başlı başına dikkate değer bir bir başarı olmasına karşın, Bohr'un anıtsal başarısı çok daha derin ve geniştir. Bu nitelik, Bohr'un 1913'teki üç kısımdan oluşan makalesinde dile getirilmiştir. Bohr: 1. Hidrojenin yayma spektrumuna göre soğurma spektrumunda görülen sınırlı sayıdaki çizgileri açıkladı; 2. Atomlardan yayılan x-ışınlarını açıkladı; 3. Elektronun kabuk modeline göre atomların kimyasal özelliklerin açıkladı; 4. Atomların moleküller oluşturmak üzere nasıl bir araya geldiklerini açıkladı. Kuramsal fizikçiler Bohr’un fikirlerini aldılar ve daha karmaşık atomlara uyguladılar. Ancak, her büyük bilimsel ilerleme gibi, Bohr’un modeli pek çok yeni soruya-daha önce sorulamayan sorulara- yol açtı. Bir elektron ne zaman yörüngesini değiştirip atomdan ışık yayılmasına yol açar? Yayılan ışık hangi doğrultuda ilerler ve neden? Bu sorular Einstein’ı zorladı. Klasik fiziğe göre, hareketin yasaları atom gibi bir fiziksel sistemin gelecekteki davranışını kesin olarak belirler. Fakat ışık yayan atomlar ani ve önceden belirlenmemiş şekilde hareket ediyor görünüyorlardı. Atomlar sıçrıyor. Fakat neden ve hangi yönde? Einstein, aynı aniliğin radyoaktivitenin de özelliği olduğunu kavradı. Başlangıçta fizikçiler, atomların davranışını klasik elektromanyetizm teorisi çerçevesine uydurmaya çalıştılar ve ışık kuantumunu kullanmadan kuantum sıçramaları bilmecesini yanıtlamak için umutsuz girişimlerde bulundular. Her atomun bir çekirdeği ve elektronları olduğu anlaşılmıştı. Thomson, atomik hacmin pozitif elektrik yüküyle dolu olduğunu elektronların da bu pozitif yüklü ortamda gömülü, hareket edemez durumda bulunduğunu tasarlamıştı. Rutherford'un modelindeki elektronlar ise durgun olamaz. Bu elektronlar, kütlenin ve pozitif yükün yoğunlaştığı çekirdek tarafından çekilir. Buna göre elektronları çeken elektrostatik kuvvete karşı onları yerinde tutacak hiçbir kuvvet yoktur. Klasik fizik (o zamana dek bilinen fizik yasalarına) göre elektronlar ivmelendirilmiş elektrikle yüklü parçacıklar olarak ışıma yaparak saniyenin yüz milyonda biri kadar bir sürede (yol bu kadar) spiral bir hareketle çekirdek üzerine düşmelidir. Doğrudan denendiği başka olgularda başarılı olan elektromanyetik kuram, bu öngörüde başarılı olamadı. Çünkü çekirdekli atomunu yaşadığı bir gerçekti. Bu çelişki şu anlama geliyor: Makroskopik dünyada geçerli olan fizik yasaları, atomal boyutta, yani mikroskopik dünyada geçerli olmamaktadır. İncelenen olayın ölçeği küçüldükçe klasik fiziğin geçerliliği de azalıyor ve atom anlaşılmak istenirse kesinlikle dalgaların parçacık gibi, parçacıkların da dalgalar gibi davrandığını dikkate almalıyız. Günlük yaşantımızdan edinilen kavramlarla kuantum kuramının kavramları arasında hiç bir bağlantı yok ne yazık ki! Işığı ve elektronu, "hem dalga, hem parçacık" gibi, yani bu ikili tabiatta kavramaktan başka bir seçeneğimizin olmadığını anımsatmalıyım. Yine ileri gittik galiba. Daha ileri gideceğiz de gitmeden önce Bohr' un 1913'te ortaya koyduğu kuramın temellerini ve kendisini bir araştıralım. Niels Bohr, zamanındaki çağdaş bulguları birleştiren bir kuram üretti. Onun önünde biriken denel sonuçlar ve kendi buluşları şöylece özetlenebilir: 1. Rutherford'un 1911'de varlığını kanıtladığı çok yoğun, çok küçük hacimde istiflenmiş, pozitif yüklü atom çekirdeği; bu çekirdek çevresinde dolanan elektronlar. 2. Gaz halindeki atomların verdiği çizgisel tayf (spektrum) ve tayf çizgileriyle ilgili yasalar. Tayf çizgilerini başarıyla açıkladı. 3. Her elementin, insanlardaki parmak izi gibi, kendine özgü x-ışınları tayfı vermesi. Bohr, xışınlarını da başarıyla açıkladı. 4. Bütün bunları birbirine bağlamayı olanaklı kılan, Planck'ın 1900'de açıkladığı kuantum kuramı. Elektronun kabuk modeline göre, atomların kimyasal özelliklerini ve atomların nasıl molekül oluşturduklarını açıkladı. Size Bohr' un daha 1913'te atomla ilgili neler dediğini anlatacağım. Ama şunu belirteyim ki Bohr, yaklaşık 40 yıl yeni fiziğin, yani kuantum kuramının 1920'lerdeki aşamasının, Einstein'e karşı bilimsel itirazların en büyük adıdır. Negatif yüklü, pek küçük kütleli elektronlar, pozitif yüklü olan ve neredeyse atomun kütlesinin tümünü taşıyan pozitif çekirdeğin çekimiyle neden çekirdek üzerine düşmüyor? Elektronlar her, enerjiyi değil de belli enerjileri alabildiği için. Daha 1885'te J.Johann Balmer (1825-1898), hidrojen spektrumunun görünür bölgesini incelemiş ve her çizginin belli bir dalga boyuna karşılık geldiğini denel olarak göstermişti. İşte bu spektrum çizgilerinin aynı zamanda hidrojen atomu içindeki ayrı enerji düzeylerini de gösterdiğini Bohr gördü. Bohr, hidrojen atomunda her enerji düzeyinin belirli ve sabit bir enerjisi olduğunu anladı. Atom içindeki elektron işte bu belirli enerjileri alabiliyor, ama bunlar arasındaki herhangi bir enerji değerini alamıyordu. Işığın 'atomu' yani ışığın kuantumu fotondu. Bir madde, bir iki, üç, dört, vs. foton alabilir ya da salabilirdi. Ama söz gelişi bir buçuk, iki buçuk foton alıp veremezdi. Beyaz ışık, farklı dalga boyundaki ışınlar içerir. Newton, ışığa bakmaya başladığında ilk bulduğu şey beyaz ışığın renklerin karışımı olduğuydu. Beyaz ışık, bir cam prizmadan geçirildiğinde kırmızı ışık en az, mor ışık en çok kırılır. Kırmızıdan mora doğru, arada turuncu, sarı, yeşil, mavi ve menekşe renkle yer alır. Kırmızı ışığın dalga boyu, mor ışığınkinden daha uzundur. Aslında görünen ışık uzun bir eşelin (skalanın) yalnızca küçük bir parçasıdır; tıpkı işitebileceğimizden daha yüksek ve daha alçak notalar içeren müzik skalası gibi. Işık skalası, frekans adı verilen sayılarla düzenlenir. Sayılar büyüdükçe ışık kırmızıdan maviye, mora ve mor ötesine geçer. Morötesi ışığı göremeyiz ama bu, fotoğraf filmlerini etkiler. Bu hala ışıktır, ama sadece sayı farklıdır. Eğer sayıyı artırmayı düşünürsek x-ışınlarına, gama ışınlarına ve ötesine erişiriz. Eğer öteki yönde değiştirirsek, maviden kırmızıya, kızılötesi(ısı) dalgalarına sonra televizyon ve radyo dalgalarına varırız. Newton, ışığın taneciklerden oluştuğunu düşünmüş ve bunlara " cisimcik" (korpüskül) adını vermişti. Bunda haklıydı (ama bu sonuca vardıran akıl yürütmesinde hatalıydı). Işığın taneciklerden oluştuğunu biliyoruz; çünkü üzerine ışık düştüğünde tıkırdayan, çok duyarlı bir alet kullanır ve görürüz ki ışık zayıfladığında her tıkırtının sesi hâlâ aynı şiddetle çıkmakta, yalnız aralıkları uzamaktadır. Demek ki ışık yağmur damlalarına benzer-her bir küçük ışık topağına bir foton denir- ve ışığın hepsi aynı renkteyse "yağmur damlalarının" hepsi aynı boydadır. 1924'te Niels Bohr, Hendrik Kramers ve John Slater, atom düzeyinde enerji ve momentumun korunumu yasalarını terk etme pahasına bu yaklaşımı savunan bir yazı yazdılar- bu devrimci bir öneriydi. Çünkü bu yasalar en iyi test edilmiş fizik yasalar arasında bunuyorlardı. Bu önerinin yapıldığı zamanda, korunum (sakınım) yasalarını tek tek atomik süreçler için geçerli olduğunu gösteren hiçbir doğrudan deneysel kanı olmamıştı. Ancak bu kısa sürede gerçekleşti. Arthur H. Compton ve A. W. Simon elektronlardan tek tek fotonlar, ışık parçacıkları saçılmasını sağladılar. Tek tek elektronların izlerini görüntüleyen bir cihaz olan Wilson bulut bölmesi kullanarak, yüksek hassaslık derecesi ile tek tek atomik süreçler için korunum yasalarını doğruladılar. Fizikçilerin çoğu için 1925'te yapılan bu deneyler, Einstein’ın 1905 yılındaki ışık kuantumu önerisini destekledi. Rutherford ve Compton’unkiler gibi çok sayıda yeni deneyle atomun yapısı açığa çıkarılmıştı. Bu deneyler, teorik fizikçileri yeni ve bilinmeyen bir dünyaya geçmeye zorladı; alışılmış olar klasik fiziğin yasaları artık işlemiyor görünüyordu. Atomda insan zihni yeni bir mesajı almıştı-atomik mikro dünyanın yapısında yeni bir fizik açığa çıktı. Yüzyıllarca deney ve fiziksel teorilerle desteklenen determinizmin dünya görüşü yıkılmak üzereydi. Bohr, Compton ve Simon’un deneylerinin sonuçlarının, hem korunum yasalarını doğruluğu, hem de ışık kuantumu veya fotonun varlığı anlamına geldiğini kabul etti. Temmuz 1925'te şu sonucu özetledi: “Klasik elektrodinamik teorinin gerekli genelleşmesinin, doğanın tanımını bu güne kadar üzerine kurulmuş olduğu kavramlarda köklü bir devrimi gerektirdiği gerçeğine hazır olunmalıdır.” Kuantum kuramının geliştiği o heyecanlı günlerde bir meslektaşı " Rutherford dostum, bugünlerde fizik nasıl?" diye sormuş, Rutherford da şöyle yanıtlamış: "Fizik hakkında söylenecek bir tek şey var; kuramcıların ayakları yere basmıyor, onları aşağı indirmek gene bize düşüyor." Nobel Ödüllü kuramsal fizikçi Steven Weinberg bu satırları aktardıktan sonra şunları yazıyor: "Bir kuramcı olarak, benim bu tür kuram karşıtı duyguları üzüntüyle karşılamam doğaldır. Fakat gerçekte kuramcılar ve deneyciler birbirleriyle genellikle iyi geçinirler ve biri olmadan diğeri olamaz. Rutherford'un tutumu herhalde şu nedene dayanıyor: Rutherford en büyük çalışmasını, çekirdek hakkında öylesine az şey bilindiği dönemde yapmıştı ki, özenle hazırlanmış matematiksel bir kurama yer yoktu; gereken kuram neyse, onu Rutherford'un kendisi de sağlayabilirdi." Kuşkusuz burada nezaket ve denge söz konusu. Yine de gerçek şu: Rutherford devrime hazır değildi; ama Bohr bu devrime hazırdı. Modern atom kuramının ayrıntılarında Bohr'un izleri yok gibi görünür. Oysa o ünlü Solvay Konferansları başladıktan sonra, özellikle 1927'dekiyle birlikte Bohr-Einstein tartışması bilim tarihinin çok önemli ve canlılığını koruyan sayfalarıdır. Kaynak: Bohr Atom Modeli https://www.msxlabs.org/forum/fizik/254957-bohr-atommodeli.html#ixzz4cPrGdvFC Rutherford atom modeli , α- parçacığı saçılması olayını başarılı ile açıklamasına rağmen iki ana güçlükle karşılaştı. Bunlar: a) Modelde, elektronlar için çekirdek tarafından periyodik bir hareket olarak kabul edildiği için, böyle bir hareket harmonik hareketten beklenen sürekli enerji dağılımı vermeliydi. Halbuki atomların saldığı ışıma kesikli spektrum vermektedir. b) Rutherford atom modeli, atomların kararlılığını da açıklayamadı: dairesel veya eliptik bir yörüngede dolanan bir elektron ivmeli hareket yapmaktadır. İvmeli hareket yapan bir q elektrik yükü, elektromagnetik teoriye göre, birim zamanda ε= 2/3*q² a² /c³ büyüklüğünde enerji yayar. Bu enerji, hem a ivmesinin ve hem de q yükünün karesiyle orantılıdır. Bir başka deyimle ivmenin yönüne ve yükün işaretiyle bağlı değildir. Yine, hidrojen çekirdeği etrafında r yarıçaplı bir yörüngede bir v hızıyla dolanan bir elektronun merkezcil ivmesi a = v²/r dir. Merkezcil kuvvet, Coulomb çekimine eşitlenerek a = e²/(mr²) bulunur. Buna göre, ivmeli hareket yapan elektronun birim zamanda yaydığı enerji ε = (2/3 )*(e²/c³)*(e²/mr²)² olur. Böylece elektronun sahip olduğu Eκ= e²/(2r) kinetik enerjisinin tamamını kaybederek, spiral bir şekilde çekirdeğe düşmesi için geçen zaman; t = Eκ/ε 'dir. Rutherford Modeli'nden iki yıl sonra, 1913 yılında, Niels Bohr; klasik fizikten kesin çizgilerle ayrılan bir seri postulat ortaya atarak kendi adı ile anılan atom modelini geliştirdi. Bu model, ışığın spektral yapısını ve atomların kararlılığını büyük bir başarı ile açıkladı. Bohr Atom Modeli 1908 yılında Geiger ve Marsden tarafından gerçekleştirilen α- parçacığı saçılması deneyleri, elektronların artı yükün sürekli bir dağılımı içinde gömülü olduğunu kabul eden Thomson’ un atom modeli ile açıklanamadı. Bunun üzerine, Rutherford; atomun artı yükünün ve zorunlu olarak kütlesinin hemen hemen tamamının atomun boyutu ile karşılaştığında çok küçük bir bölge içinde toplandığını kabul eden yeni bir atom modeli geliştirildi. Bu modele göre, atomlar çekirdeği oluşturan artı yük tarafından 1/r² ile orantılı bir kuvvetle çekilmektedir. Bohr Postulatları ve Bohr Atom Modeli 1- Bir atom sadece belirli enerji durumlarında bulunabilir. Böyle bir atomda elektronlar, açısal momentumu h/2π nin tam katları olarak sınırlanmış yörüngelerde ederler. Yani, r yarıçaplı bir yörüngede v hızı ile dolanan bir elektronun açısal momentumu L= m v r = nh/2π , (n tam sayı) Formül 1 dir. ilave olarak, bu yörüngelerdeki elektronlar, ivmeli hareket yapıyor olmalarına rağmen, klasik elektromagnetik teorinin söylediğinin aksine, ışıma yapmaz. 2- Bohr atomundaki bir elektron E enerjili bir yörüngeden daha düşük bir Ε′ enerjili yörüngeye atlar ve bu sırada enerjinin tek bir kuantumu büyüklüğünde ışıma yapar. Işımanın enerjisi veya enerjideki değişme, yani, Eson (E) –Εilk (E′) enerji farkı γ = Ε-Ε′ Formül 2 frekanslı bir ışıma olarak ortaya çıkar. Eğer Ε′ enerjili bir yörünge elektronu γ frekanslı bir ışığı yutarsa E enerjili yörüngeye çıkar. Bu postulatlar, hidrojen atomu gibi tek elektronlu atomlar, bir kere iyonlaşmış helyum, v.s., de; dairesel yörünge kabulü altında çok basit sonuçları verir. Yörüngelerin eliptik seçilmesi, sonuçları zenginleştirir. Çekirdeğin yükü Ze ve elektronun yükü de –e olduğuna göre, çekirdeğin kütlesi sonsuz kabul edilerek; Coulomb kuvveti merkezcil kuvveti doğuracak şekilde Ze²/r² = mv²/r Formül 3 yazılabilir. Formül 1 eşitliğinden elde edilen r = nh/2πmv Formül 4 Formül 3 eşitliğinde yerine yazılarak, elektronun hızı V = (2πZe²)/(nh) Formül 5 bulunur. Formül 4, Formül 5'de yerine yazarak da, yörüngenin yarıçapı, r = (1/4π²)*(n²h²/Ze²m) Formül 6 elde edilir. Durgun çekirdek ve bu çekirdeğin etrafındaki r yarıçaplı yörüngede v hızı ile dolanan elektronun oluşturduğu sistemin toplam enerjisi E = (1/2mv²)-(Ze²/r) Formül 7 dir. Bohr atom modelinin başarısı, onun hidrojene benzer (tek yüklü) atomlara uygulanabilmesindedir. Büyük başarısına rağmen, Bohr Modeli atomların ne zaman elektron salacağı konusunda bir şey söylenemez. Bohr Atom Modeli'nden Çıkan Sonuçlar: 1- Klasik fizik sonuçları, kuantum mekaniğinden elde dilen sonuçların sınır hali olarak elde edilmelidir. Buna “uygunluk ilkesi” (Correspondence principle) denir. Klasik fizik ise, dairesel bir yörüngede dolanan elektronun hızı v olduğunda, dolanımın frekansının γκ1 = v/2πr olduğunu söylemektedir. Uygunluk ilkesi göre, kuantum fiziğine dayalı olarak elde edilmiş olan ifade, klasik fiziğe dayalı olarak elde edilen sonucu sınır halde vermelidir. Gerçekten de n>>1 için, bu yaklaşmanın sağlandığı görülmektedir. Bu n+1 → n geçişi, büyük n ler sınırında bile klasik olarak geçerli değildir. Dairesel yörüngeler için, n+2 → n geçişi, kuantum mekaniği tarafından da yasaklanmaktadır. 2- Açısal momentumun kuantumlanması, daha başka durumlarda ortaya çıkarır. Açısal momentumun kuantumlanmasının eliptik yörüngelere uygulanması, hidrojene benzer atomların spektrumlarını daha tam verir. Bu durum deneysel olarak da doğrulanmaktadır. Kaynak: Bohr Atom Modeli https://www.msxlabs.org/forum/fizik/254957-bohr-atommodeli.html#ixzz4cPrTdYt0