T. C.
EGE ÜNİVERSİTESİ
SAĞLIK BİLİMLERİ ENSTİTÜSÜ
ACC MUTANT TELOMERİK TEKRARLARLA TRANSFORME
KLUVEROMYCES LACTIS HÜCRELERİNDE
TELOMER DEVAMLILIĞININ MEKANİZMASI
Farmasötik Biyoteknoloji Anabilim Dalı Programı
Yüksek Lisans Tezi
Bilge DEBELEÇ BÜTÜNER
DANIŞMAN
Prof.Dr. Zeki TOPÇU
İZMİR
2007
i
ii
ÖNSÖZ
Günümüzde insan sağlığını tehdit eden önemli hastalıklardan biri olan kanserin
mekanizmasının anlaşılmasına ilişkin çalışmalar, ilaç hedeflerinin belirlenmesi
açısından önemli bir araştırma alanıdır. Telomerler ve insan hastalıkları arasındaki
bağlantının anlaşılması da bu açıdan önemlidir. Projemizin de, telomer ve telomerazı
hedef alan ilaç geliştirme çalışmaları açısından yol gösterici olacağı düşüncesindeyiz.
Bu çalışma esnasındaki katkılarından dolayı proje yöneticisi ve tez danışmanım
Prof. Dr. Zeki Topçu’ya teşekkür ederim.
Tez çalışmam esnasında laboratuarda birlikte çalıştığım arkadaşlarım Arş.Gör.
Nuriye Serra İstanbullu ve Arş.Gör. Özlem Küçükoğlu’na, tezin yazılma sürecinde
hayatımı kolaylaştırmak adına gösterdikleri çabaları için Arş. Gör. Şüra Baykan
Erel’e ve Arş. Gör. Ayşe Nur Yurtman’a, yaşamımın her alanındaki desteklerinden
dolayı eşim İsmail Bütüner’e ve ailem Hanife-Erdoğan Debeleç’e çok teşekkür
ederim.
iii
İÇİNDEKİLER
1. Bölüm I .................................................................................................................... 1
1.1. Giriş .................................................................................................................. 1
1.2. Genel Bilgiler ................................................................................................... 3
1.2.1. Telomer-Telomeraz Kompleksi................................................................ 3
1.2.1.1. Telomer ............................................................................................. 3
1.2.1.1.1. Telomerik DNA ........................................................................ 4
1.2.1.1.2. Telomerik Proteinler ................................................................. 7
1.2.1.1.2.1. Çift Zincirli Telomerik DNA Bağlanma Proteinleri......... 8
1.2.1.1.2.2. Tek Zincirli Telomerik DNA Bağlanma Proteinleri......... 8
1.2.1.2. Doğrusal Kromozom Uçlarının Replikasyon Problemi .................... 9
1.2.1.3. Telomeraz Ribonükleoprotein Kompleksi........................................ 9
1.2.2. Telomerlerde Meydana Gelen İşlemler .................................................. 12
1.2.2.1. Telomerik Tekrarların Replikasyonu.............................................. 12
1.2.2.2. Telomerik Tekrarların Uzatılması................................................... 13
1.2.2.3. Telomer Uzunluğunun Düzenlenmesi ............................................ 13
1.2.2.4. Telomerlerdeki Rekombinasyonel Olayların Düzenlenmesi .......... 15
1.2.3. Genetik Rekombinasyon......................................................................... 15
1.2.4. Kluveromyces lactis ................................................................................ 16
1.2.5. Telomerazdan Bağımsız Telomer Devamlılığı....................................... 17
1.2.5.1. Mayada Rekombinasyonel Telomer Devamlılığı ........................... 18
1.2.5.1.1. Telomeraz Aktivitesine Sahip Olmayan Mutant Maya
Hücreleri................................................................................. 18
1.2.5.1.2. Rekombinasyonel Telomer Uzaması Modelleri...................... 20
iv
1.2.5.2. Memeli Hücrelerinde Telomerazdan Bağımsız Telomer
Devamlılığı .................................................................................... 21
1.2.6. Alternatif Telomer Uzaması ve Kanser .................................................. 23
2. Bölüm II Gereç ve Yöntem .................................................................................... 26
2.1. Kullanılan Kimyasal Maddeler ...................................................................... 26
2.2. Kullanılan Cihaz ve Aletler............................................................................ 27
2.3. Kullanılan Besiyeri ve Çözeltiler ................................................................... 28
2.4. Laboratuar Çalışmaları ................................................................................... 30
2.4.1. Çalışma Düzeneği................................................................................... 30
2.4.2. Maya Kökenleri ...................................................................................... 31
2.4.3. Mutant Telomerik Tekrar Taşıyan K. lactis Hücrelerinin
Oluşturulması ve Transformasyonu ...................................................... 31
2.4.4. Fenotipik Değerlendirme ........................................................................ 34
2.4.5. K. lactis Genomik DNA İzolasyonu....................................................... 36
2.4.6. Telomerik DNA Analizleri ..................................................................... 36
2.4.7. Southern Blot.......................................................................................... 38
2.4.8. K. lactis Transformantlarının -His ve -Ura Besiyerlerinde Analizleri.... 38
3. Bölüm III Bulgular................................................................................................. 39
4. Bölüm IV Tartışma ................................................................................................ 52
5. Bölüm V Sonuç ve Öneriler................................................................................... 58
6. Bölüm VI Özet ve Abstract.................................................................................... 60
7. Bölüm VII Kaynaklar............................................................................................. 62
v
TABLO DİZİNİ
Tablo 1: Çeşitli türlerde telomerik tekrar dizileri..................................................... 5
Tablo 2: Doğal, Acc ve Bcl mutant telomerik tekrar dizileri ................................. 32
Tablo 3: Fenotip özellikleri takip edilen ve DNA izolasyonu yapılan
koloni sayıları........................................................................................... 39
Tablo 4: Transformantların zamana göre fenotip değişimleri ................................ 40
Tablo 5: WA2, A2,A4,B3 transformantları için hafif ve şiddetli senes
fenotipi gösteren koloni sayıları............................................................... 42
Tablo 6: Acc ve Bcl transformantları için hafif ve şiddetli senes fenotipi
gösteren koloni sayıları ............................................................................ 43
Tablo 7: Mutant telomerik tekrarların rekombinasyonel dağılım özellikleri ......... 50
Tablo 8: His+ ve Ura+ transformant sayıları.......................................................... 51
ŞEKİL DİZİNİ
Şekil 1:
Çalışmanın temel basamakları ................................................................. 31
Şekil 2:
Mutant Telomerik Tekrar Taşıyan K. lactis Hücrelerinin
Oluşturulması ve Transformasyonu ......................................................... 33
Şekil 3:
K. lactis transformantlarının fenotiplerinin tipik skorları ....................... 35
Şekil 4:
WA2, A2,A4,B3 Transformantlarının zamana göre fenotip
değişimleri................................................................................................ 40
Şekil 5:
Acc ve Bcl transformantlarının zamana göre fenotip değişimleri ........... 41
Şekil 6:
Acc ve Bcl transformantlarının senes fenotip gösterme yüzdeleri........... 43
Şekil 7:
Acc ve Bcl transformantlarının jel fotoğrafları........................................ 44
Şekil 8:
32
P işaretli KLl-25 telomerik oligo probu ile gerçekleştirilen
hibridizasyon işleminin ardından elde edilen fotoğraflar......................... 47
vi
ACC MUTANT TELOMERİK TEKRARLARLA TRANSFORME
KLUVEROMYCES LACTIS HÜCRELERİNDE
TELOMER DEVAMLILIĞININ MEKANİZMASI
Uzm. Ecz. Bilge DEBELEÇ BÜTÜNER
Yüksek Lisans Tezi, Farmasötik Biyoteknoloji Anabilim Dalı
Tez Yöneticisi: Prof. Dr. Zeki TOPÇU
Ocak 2007, 71 sayfa
Telomerler ökaryotik kromozom uçlarında bulunan, DNA ve proteinden oluşan
yapılardır. Kanser ve insan eşey hücreleri de dahil olmak üzere ölümsüz ökaryotik
hücrelerde telomer devamlılığı telomeraz enzimi ile sağlanır. Ancak telomer
boylarının devamlılığının sağlanmasında telomeraz enzimi dışında “Alternatif
Telomer Uzaması” olarak adlandırılan başka mekanizmaların da var olduğu
düşünülmekte, ancak bu mekanizmalar hakkında çok az şey bilinmektedir.
Çalışmamız, insan telomerik yapılarına benzerliği ile bilinen Kluyveromyces lactis
modeliyle telomerazdan bağımsız telomer devamlılığını ve bunun farmasötik
önemini araştırmayı amaçlamıştır. Telomer, telomeraz ve bu enzimin etkileşimde
bulunduğu telomerik proteinler, umut verici antikarsinojenik ilaç hedefleri olarak
değerlendirildiğinden, sonuçlarımız, alternatif telomer uzaması mekanizmalarının,
antikanser tedavi stratejilerinin hedefi olarak kullanılması konusunda yeni tartışmalar
açacaktır.
Anahtar sözcükler: Telomer, rekombinasyon, alternatif telomer uzaması,
antikanser ilaç hedefi.
E-posta: [email protected]
vii
THE TELOMERE LENGTHENING MECHANISM IN
KLUVEROMYCES LACTIS ORGANISM TRANSFORMED WITH
ACC MUTANT TELOMERIC REPEATS
Uzm. Ecz. Bilge DEBELEÇ BÜTÜNER
M.Sc Thesis in Dept. Of Pharmaceutical Biotechnology
Supervisor: Prof. Dr. Zeki TOPÇU
January 2007, 71 pages
Telomeres are the DNA-protein complexes found at the ends of eukaryotic
chromosomes. Most immortal cells, including cancer cells and human germinal cells
maintain the telomeric length by the enzyme, telomerase. However, the telomeric
length maintenance is also thought to be carried out by the pathways called
“Alternative Lengthening of Telomeres /ALT” other than telomerase but little is
known about the mechanism of these alternative pathways. This thesis aimed to
study telomerase-independent telomere maintenance pathway and its pharmaceutical
significance using the yeast Kluyveromyces lactis, as a model organism, with
considerable similarity to human telomeres. Because of the telomere, telomerase and
a number of telomerase-interacting proteins are currently considered as the potential
targets of anticancer drugs, our results will trigger new discussions in relation to
employment of these alternative telomere maintenence mechanisms as the targets of
anti-cancer therapy strategies.
Keywords:
Telomere,
recombination,
telomeres, anticancer drug target.
E-mail: [email protected]
viii
Alternative
lengthening
of
BÖLÜM I
1.1. GİRİŞ
Telomer doğrusal kromozomların ucunda yer alan yapısal bir bileşendir. Gen
ekspresyonunun düzenlenmesinde, rekombinasyonda, mayoz ve mitoz bölünme gibi
kromozom fonksiyonlarında önemli yere sahiptir. Kromozom uçlarının bozulmadan
kalmasını sağlayarak kromozoma kararlılık vermektedir. Telomeraz adlı enzim,
telomerin kısalmasını önlemek için, yapısındaki RNA kalıbını kullanarak
sentezlediği telomerik tekrar dizilerini kromozomun ucuna ilave etmektedir. Ancak
ökaryotlarda, somatik hücrelerin çoğunda telomeraz aktif değildir. Bu nedenle her
hücre bölünmesinde kromozom uçları kısalır. Birçok hücre bölünmesinden sonra da
kromozomlar kritik derecede kısalır ve hücre daha fazla bölünme kapasitesini yitirir
(25).
Telomeraz aktivitesine sahip olmayan bazı ökaryotik hücreler (bazı kanser
hücreleri de dahil olmak üzere) Alternatif Telomer Uzaması (Alternative
Lengthening of Telomeres /ALT) yoluyla da telomer devamlılığını sağlayabilirler.
Bunun için telomer füzyonu ya da rekombinasyon mekanizmalarından biri
kullanılabilir. Saccharomyces cerevisiae ve Kluveromyces lactis başta olmak üzere
mayalar rekombinasyonu kullanırlar. Telomeraz aktivitesi bulunmayan mutant maya
hücreleri, ardışık hücre bölünmeleri sonucu kötüleşen büyüme fenotipleri
göstermekte, hücrelerin çoğu ölmekte, az sayıdaki iyileşen hücreler de uzamış
telomerler bulundurmaktadır (49,51).
ix
Telomerler ve insan hastalıkları arasındaki bağlantının anlaşılması için, telomer
fonksiyon kaybının hücre büyümesini bloke etmek amacıyla
ve hücrelerin bu
sorunun üstesinden gelmek amacıyla kullandıkları mekanizmaların anlaşılması
gerekmektedir. Rekombinasyonel telomer uzaması, insan kanser olgularının
%10’unda
telomer
devamlılığı
mekanizması
olarak
görülmektedir.
Maya
hücrelerinde olduğu gibi memeli hücrelerinde de görülen telomerazdan bağımsız
telomer devamlılığı mekanizmalarının aydınlatılması, antikanser tedavide bu
mekanizmanın hedeflenmesi açısından aydınlatıcı olacaktır (49).
Bu çalışmada araştırmayı amaçladığımız nokta, tek bir mutant telomerik
tekrarın telomeraz aktivitesine sahip olmayan mutant bir K. lactis’te rekombinasyon
yoluyla telomer uzamasına neden olup olamayacağıdır. Hızlı ve önemli derecede
telomer uzamasına neden olduğu bilinen Acc mutant telomerik tekrarından elde
edilen sonuçlar, mutasyonel olarak etkisiz olduğu bilinen Bcl telomerik tekrarı ile
karşılaştırılmıştır.
1.2. GENEL BİLGİLER
1.2.1. Telomer-Telomeraz Kompleksi
Telomerlerle ilgili ilk araştımalar 1930’larda Barbara McClintock ve Hermann
Muller tarafından gerçekleştirilmiş ve bu iki araştımacı, farklı organizmalarla
birbirlerinden ayrı olarak yaptıkları çalışmalarda, kromozom uçlarında kararlılığı
x
sağlayan özel bir bileşen olduğunu belirlemişlerdir. Daha sonra 1978 yılında
Elizabeth Blackburn, Tetrahymena telomerlerindeki TTGGGG tekrar dizilerini
saptamıştır. Bu çalışmadan itibaren birçok organizmanın telomerik tekrar dizileri
tanımlanmış, telomer yapısının aydınlatılması ile ilgili çok yol katedilmiştir (6,25).
1.2.1.1. Telomer
Telomer doğrusal kromozomların ucunda yer alan yapısal bir bileşendir.
Kromozomun üst düzey organizasyonunda ve hücre proliferasyonunda fonksiyon
gösterir. Kromozom uçlarını bir başlık gibi (“capping”) koruyan telomerik kompleks,
fonksiyonel telomeraz ile kombinasyon halinde, telomerin, rekombinasyona yatkın
çift zincir kırıklarından ayırt edilmesine olanak veren özgün bir yapıya sahiptir. Bu
özgün yapı, telomerik DNA’nın histon yapısında olmayan proteinlerle kompleks
halde oluşturduğu “T-loop” yapısıdır (4,8,9). Kromozom uçlarının bozulmadan
kalmasını sağlayarak kromozoma kararlılık vermektedir (51,76).
Kromozom kararlılığı için telomerlerin diğer kromozom uçları ile füzyondan
kaçınması gerekirken, DNA çift zincir kırıklarının başarılı şekilde onarılması için,
kırık uçların tekrar birleştirilmeleri gerekmektedir. Telomerler ve DNA çift zincir
kırıkları arasındaki bu farka rağmen, telomer fonksiyonu ve DNA onarımı için ortak
olarak ihtiyaç duyulan birçok proteinden dolayı (Bazı DNA onarım proteinleri
telomerazın telomerler üzerindeki aktivitesini kontrol etmektedir.) hücre döngüsü
esnasında, kromozom uçlarının geçici olarak DNA çift zincir kırıklarına benzeme
olasılığı akla gelmektedir. DNA onarım proteinlerinin onarımdaki rolü DNA çift
zincirlerinin
birleştirilmesiyken,
telomerlerde
etmektedir (6,15,29,41).
xi
telomeraz
aktivitesini
kontrol
1.2.1.1.1. Telomerik DNA
Telomerik dizi ilk olarak Tetrahymena’da tanımlanmıştır (11). İki tip telomer
dizisi bulunmuştur. Birinci tip, telomerik DNA dizileri olarak adlandırılır. Telomeraz
tarafından tayin edilen 5-26 bç uzunluğundaki nükleotit dizisinin, arka arkaya
tekrarlanmasıyla oluşur. Telomerik DNA tipik olarak G-kümelerince zengin bir
zincir ve buna komplementer sitozince zengin bir zincir içerir. Kromozom ucuna
doğru 5’-3’ yönünde uzanır ve bir 3’ uç çıkıntısı oluşturur (3).
Telomerler, tek hücreli organizmalardan daha yüksek yapılı bitki ve hayvanlara
kadar, türler arası farklılıklarla beraber, yapı ve fonksiyon bakımından önemli
derecede benzerlik göstermektedir. Birçok türdeki telomerik tekrar dizisi aynı ya da
benzerdir (86). Örneğin omurgalıların çoğu TTAGGG tekrarına sahiptir. Tablo 1’de
farklı organizmaların telomerik tekrar dizilerinden örnekler verilmiştir (3).
Tablo 1: Çeşitli türlerde telomerik tekrar dizileri: Telomerik tekrar dizileri
kromozomun 3’ ucunda 5’-3’ yönünde gösterilmektedir.
xii
Grup
Memeliler
Küfler
Protozoa
Bitki
Alg
Maya
Organizma
Homo sapiens
Physarum polycephalum
Tetrahymena
Oxytricha
Arabidopsis
Chlamydomonas
Schizosaccharomyces pombe
Telomerik Tekrar dizisi
AGGGTT
AGGGTT
GGGGTT
GGGGTTTT
AGGGTTT
AGGGTTTT
(A)G2-5TTAC
Saccharomyces cerevisiae
G1-3T
Evrim boyunca telomerik dizilerin neden bu kadar az değişiklik gösterdiğine
ilişkin açıklamalardan biri, telomerik DNA’nın birçok protein için özgül bağlanma
bölgeleri olarak görev yapmasıdır. Ayrıca telomeraz RNA kalıbının, enzimin aktif
bölgesine katkıda bulunması gibi, telomerazın fonksiyonunu kısıtlayan faktörlerin
de, telomerik dizinin evrimleşmesine engel olduğu düşünülmektedir (51,86).
Telomerler, mutlaka aynı tekrar dizisinden meydana gelmeyebilirler.
Saccharomyces cerevisiae (T(G)2-3(TG)1-6) ve Schizosaccharomyces pombe gibi bazı
organizmalar, telomerazlarının kalıtsal olarak çeşitli tekrar dizilerini sentezleme
eğiliminde olmasından dolayı çeşitli tekrar dizilerinden oluşmuş telomerlere
sahiptirler. İnsanların da aralarında bulunduğu bazı diğer türlerde ise çeşitli tekrar
dizileri yalnızca telomerlerin iç kısımlarında bulunmaktadır. Bu farklı tekrar dizileri,
telomeraz yerine DNA polimerazın replike ettiği telomer kısımlarındaki rasgele
mutasyonlar sonucu oluşmaktadır (51,60,64).
Kromozom ucunda telomerik DNA’nın ortalama miktarı organizmalar arasında
ve aynı organizmanın farklı hücreleri arasında farklılık göstermektedir. Örneğin
farenin her telomeri 150 kb uzunluğunda iken, Oxytricha 20 bp’lik telomerik diziye
sahiptir (25,86).
Kromozom uçlarını bir başlık gibi koruyan “capping” fonksiyonunun
mekanizması ya telomerlerin ucundaki tek zincirli bölgede özelleşmiş DNA yapısı
xiii
ile (G-kuartet) ya da telomerik proteinler ile gerçekleşir (26). Guanince zengin
ardışık tekrarlı telomerik dizilerin organizmalarda yaygın olarak korunmuş olması,
telomerlerin özgün yapıları için belirli DNA dizilerine ihtiyaç duyduklarını
düşündürmektedir. Dört zincirli olan en stabil DNA yapısı G-kuartet olarak
adlandırılmaktadır (7). Guanince zengin yapının telomer fonksiyonundaki rolü iki tip
yapı ile açıklanabilir. Birinci tip yapıda, 12-16 nükleotit uzunluğundaki guanince
zengin oligonükleotit dizileri, molekül içi ikincil bağlar oluşturarak kendi üzerine
katlanmaktadır. İkinci yapıda, guanince zengin, en az 4 kısa guanin kümesi içeren,
daha uzun oligonükleotitler yine kendi üstüne katlanarak daha yoğun bir şekil
meydana getirmekte ve lineer kromozom ucunu koruyan yoğun bir yapı
oluşturmaktadır (5).
İkinci grup telomerik DNA, telomer-bağlantılı diziler ya da subtelomerik
dizilerdir ve hem telomerin içinde hem de bitişiğinde bulunurlar. Türlere bağlı olarak
yapı ve fonksiyon bakımından farklılıklar gösterirler. Aynı türde kromozom
uçlarında benzer subtelomerik diziler bulunabildiği gibi, türün bazı kromozomlarında
bulunup bazılarında bulunmaması da mümkündür. S. cerevisiae’de subtelomerik X
ve Y’ elementleri saptanmıştır. Biri veya her ikisi birden telomerlerin çoğunda ya da
tamamında bulunmaktadır (86). Fonksiyonları ve kromozom kararlılığındaki rolleri
tam olarak bilinmemekle beraber, bu diziler telomerin fonksiyonunu artırabilirler.
Örneğin S. cerevisiae’deki subtelomerik Y’ elementi, telomeraz fonksiyonunun
kaybolması veya telomer replikasyonunun bozulması durumunda amplifiye
edilmektedir.
Hücrenin
telomer
fonksiyonu
ve
hayatta
kalma
yeteneğini
sürdürmesinde rol oynamaktadır (5,45,51).
Telomerler kimyasal ve protein problarla etkileşime geçmeye dirençli
korunmalı bir yapıya sahiptir. Telomer pozisyonunun etkisine (Telomer Position
xiv
Effect/ TPE) bağlı olarak, telomerler yakınındaki genin transkripsiyonunu
baskılamaktadırlar (28).
1.2.1.1.2. Telomerik Proteinler
Telomerler kromozom ucunun korunması işlevlerini telomer-telomeraz
kompleksi içinde yer alan telomerik bağlanma proteinleri ile birlikte gerçekleştirirler.
Telomerik bağlanma proteinleri, telomeraz aktivitesini düzenleyerek ya da telomerik
tekrar dizilerinin hasara uğratılmasına karşı kromozom ucunu koruyarak telomer
devamlılığını etkilemektedir (18,60). Telomerik DNA’nın kromozom ucunda DNA
kaybını önlemesindeki kritik fonksiyonu, koruyucu “capping” işlemine katılan birçok
özgül protein için bağlanma bölgesi olarak görev yapmasından kaynaklanır.
“capping” çok sayıda proteinin, diziye özgül olarak telomerik DNA’ya
bağlanmasıyla gerçekleşen kompleks bir işlemdir, 4 yolla gerçekleştirilir: (i)
Telomerik ucun DNA hasarı onarım mekanizmalarını harekete geçirmesini
engelleyerek, (ii) Uç-uca kromozom birleşmesini engelleyerek, (iii) Telomerik
bölgeler arasında homolog rekombinasyonu engelleyerek, (iv) Telomer uzunluğunu
düzenleyerek. Telomerik bağlanma proteinleri, telomerlerin ucunda, uçların çift
zincir kırıklarından ayırt edilmesini sağlayan “T-loop” yapısının oluşumuna
katılırlar. Bu yapı, telomerlerin 3’ uçlarını degradasyondan korur ve telomerazın
telomer üzerindeki aktivitesini sınırlar (15,35).
Tek ve çift zincir bağlanma proteinleri, telomeraz ve telomeraza bağlı
proteinler, çift zincir kırığı onarımı proteinleri gibi telomer fonksiyonuna katılan tüm
bu protein bileşenlerin, telomerik bölgede gerektiği zaman uygun şekilde fonksiyon
gösterebilmeleri için, telomerik bölgedeki bulunuşları düzenlenmekte, proteinlerin
tamamı aynı anda telomerik bölgede bulunmamaktadır (65).
xv
S. cerevisiae kromozomunun telomerik DNA’sı nükleozomal olmayan farklı
bir kromatin yapısındadır. Bu yapıya telozom denir. Mayalara göre telomerleri daha
uzun olan memelilerde ise telomerik DNA’nın büyük kısmı nükleozom olarak
paketlenmiş halde, uç kısımlarındaki telomerik DNA ise maya telozomuna benzer
yapıdadır (20,86).
1.2.1.1.2.1. Çift Zincirli Telomerik DNA Bağlanma Proteinleri
Tomurcuklanan ve bölünen mayalar ile memeli hücrelerinde tanımlanan
birçok telomerik çift zincirli DNA bağlanma proteini yanında Kluveromyces lactis’te
Rap1p ve Taz1p ile insan telomer bağlanma proteini TRF1 ve TRF2’nin (Telomeric
Repeat-binding Factor) fonksiyonel altbirimleri de tanımlanmıştır. Rap1p ve TRF1
dizi homolojisi içermemekle beraber telomerlerde bazı ortak fonksiyonlara
sahiptirler (9,37,43). Mayada, transkripsiyonu düzenleyen Rap1p proteinin telomerik
DNA’ya bağlanması için telomerik tekrar bölgesinde 40 bç’lik bir konsensüs diziye
gereksinimi vardır (5). Ancak sadece telomerik DNA’yla değil, subtelomerik
kromatin yapısıyla bağlantılı olduğuna ilişkin de veri mevcuttur (20).
1.2.1.1.2.2. Tek Zincirli Telomerik DNA Bağlanma Proteinleri
İncelenmiş tüm organizmalarda, telomerik DNA’nın 3’ ucu tek zincirli diziden
oluşmaktadır. Bu tek zincirli bölgenin, telomeraz-substrat tanıması için gerekli
olduğu düşünülmektedir. Ekzonükleazlar tarafından yıkıma duyarlı olan ve hücre
tarafından hasarlı DNA olarak da algılanabilecek telomerik tek zincirli bölge,
kromozom uçlarının füzyonuna da neden olabilir. Bu sorunu bertaraf etmek için 3’
telomerik DNA uçları telomer-telomeraz kompleksi içinde gizlenmiş şekilde
bulunmaktadır. Telomerik tek zincir bağlanma proteinleri, diziye özgül olarak tek
xvi
zincirli telomerik DNA’ya bağlanarak kompleks oluşturmaktadırlar. Bu kompleks
telomeraz tarafından dizinin gereğinden fazla uzatılmasını da engellemektedir.
Mayada Est1p, Est2p, Est3p, Cdc13 tek zincirli telomerik bağlanma proteinleri
tanımlanmıştır (9,51,60).
1.2.1.2. Doğrusal Kromozom Uçlarının Replikasyon Problemi
Prokaryotik organizmalarda halkasal olan kromozom yapısı ökaryotlarda
doğrusaldır. Replikasyon esnasında kromozom “uçlarında” özel bir sorunla
karşılaşılır. Kesintisiz zincirdeki sentez normal olarak kromozom ucuna kadar devam
ederken, kesintili zincirde RNA primeri uzaklaştığında sorun ortaya çıkar. Normal
olarak 3’-OH grubuna nükleotit ilavesi yapılarak primerin uzaklaşması sonucu
oluşan boşluklar doldurulmalıdır. RNA primeri kromozomun orta bölümlerindeki
replikasyon çatallarından uzaklaştığında oluşan boşluk, DNA Polimeraz tarafından
doldurulmaktadır. Ancak kromozomun ucunda 3’-OH grubunu sağlayacak bir kalıp
zincir yoktur. Sonuç olarak her sentezin sonunda kromozom, RNA primerinin boyu
kadar kısalacaktır. Bu önemli problemi çözmek amacıyla bazı organizmalar evrim
sürecinin erken döneminde moleküler bir çözüm geliştirmişlerdir (6,15,25,29,51).
1.2.1.3. Telomeraz Ribonükleoprotein Kompleksi
Telomer bütünlüğünü sağlamadaki anahtar özellik, telomerik DNA’nın,
kromozom uçlarının korunabileceği kritik uzunlukta tutulabilmesidir (75). Bunun
için telomeraz enzimi, telomerin kısalmasını önlemek için, yapısındaki RNA
kalıbını kullanarak sentezlediği telomerik tekrar dizilerini kromozomun ucuna ilave
etmektedir. Telomeraz ilk olarak Tetrahymena’da tanımlanmış ve 5’-CAACCCCAA
-3’ dizisinden oluşan 159 nükleotitlik RNA bileşenini kullanarak bu organizmanın
xvii
telomerik tekrar dizisi olan (TTGGGG)n’nin ardışık tekrarlarını oluşturmak üzere,
nükleotitleri polimerize ettiği gösterilmiştir (3). Telomeraz, telomerin yalnızca
guanince zengin zincirini sentezler. Komplementer zincirin tamamlanması, primazpolimeraz kompleksi tarafından kontrol edilerek, yarı-korumalı DNA replikasyonu
mekanizması ile gerçekleştirilir. Enzim tekrar dizisinin birçok kopyasını kesintili
zincirin 3’ ucuna 5’-3’ sentez yönünde ilave eder. Kalıp olarak kullanılan bu uzantıya
komplementer primer eklenmesi ve polimeraz tarafından zincir uzamasının
tamamlanmasıyla replikasyon döngüsü sonucu genetik materyal kaybı engellenmiş
olur (4,6,25,44).
Telomeraz, ribonükleoprotein yapısında ve bünyesinde katalitik aktivitesi için
gerekli bir RNA bileşeni (TER) ile protein bileşeni (TERT) bulunduran bir revers
transkriptazdır. Her replikasyon sonrası telomerin kısalmasını önlemek için telomerik
tekrar dizilerini kromozomun ucuna ilave etmektedir. TERT, RNA’yı kalıp olarak
kullanarak DNA dizisi sentezleyen revers transkriptaz özelliğindeki bileşendir.
Enzimin aktivitesi için gerekli diğer bileşen RNA (memelilerde TR ve mayalarda
TLC1 olarak adlandırılır) ise kopyalanacak telomerik DNA tekrarları için kalıp
olarak kullanılan kısa bir RNA dizisidir (10,51,60).
Mayalarda telomeraz enzim kompleksi iki aktif bölge ve iki TER molekülü
içeren dimerik bir yapıdır. Telomeraz RNA kalıbı 16 nükleotitten oluşmaktadır ve
TER molekülünün uzunluğu çoğunlukla 1 kb civarındadır (15,51). İnsan telomeraz
enzim kompleksi, 451 nükleotitlik RNA bileşeni içerir (19).
Telomeraz diğer polimerazlara benzer şekilde, bir çekirdek enzim yapısı ve
buna bağlı diğer faktörlerin kombinasyonundan oluşan bir holoenzim kompleksi
şeklindedir. TERT dışında bazı telomeraza-bağlı proteinler telomeraz aktivitesi için
anahtar roller üstlenirler. Mayalarda enzimin iki düzenleyici bileşeni Est1p ve Est3p,
xviii
in vivo olarak enzimin telomer replikasyonunu gerçekleştirebilmesi için gereklidir.
Bu proteinlerin yokluğunda, telomerazın telomerik DNA’yı uzatamamasına bağlı
olarak telomerler kısalmaktadır (21,44,60).
Telomerlerle etkileşim içinde olan telomeraz kompleksi çok sayıda bileşen
içermektedir ve bunlardan herhangi biri, telomeraz aktivitesinin düzenlenmesi için
hedef olabilmektedir. Telomerazla bağlantılı altüniteler, enzim aktivitesinin
zamanlamasını ve miktarını ayarlamaktadırlar. Bu mekanizmalardan biri, enzimin
kendi altünitelerinin aktiviteyi pozitif yönde düzenlemesidir. Telomerin dubleks
bölgesine bağlanan proteinler de telomeraz ile fiziksel olarak bağlantıda
olmadıkları halde, enzim aktivitesini düzenleyici rol oynamaktadır. Mayalarda
Rap1p ve insan hücrelerinde TRF1 ve TRF2 proteinleri, guanince zengin
tekrarların sayısını belirleyebilmekte ve telomer yeterli uzunluğa geldiğinde
telomeraz aktivitesini inhibe etmektedirler (43).
Yaşa bağlı olarak, farklı yaştaki insan hücrelerinde ya da hücre bölünmesi
sayısına bağlı olarak, insan fibroblast hücre kültüründe telomer uzunluğu analiz
edildiğinde, yaş ve hücre bölünmesi sayısı arttıkça, telomerik dizinin dereceli olarak
kısaldığı saptanmıştır. Normal memeli somatik hücrelerinin çoğunda telomeraz
aktivitesi ya çok düşük bulunmuş ya da hiç bulunamamıştır. Bu nedenle her hücre
bölünmesinde kromozom uçları kısalır. Birçok hücre bölünmesinden sonra da
kromozomlar kritik derecede kısalır ve hücre daha fazla bölünme kapasitesini yitirir.
Kromozom kısalmasının doğal hücre yaşlanmasının bir parçası olduğu ve biyolojik
saat işlevi gördüğü düşünülmektedir. Ancak memeli eşey hücrelerinde, erken
dönemdeki embriyonik hücrelerde, ölümsüz hücre kültürlerinde ve belirli kanser
hücrelerinde telomeraz aktivitesi saptanmıştır (5,19,35).
1.2.2. Telomerlerde Meydana Gelen İşlemler
Telomerik DNA’nın replikasyonu, bildiğimiz DNA kalıplı DNA replikasyonu
ile tek telomerik DNA zincirinin telomeraz tarafından uzatılması işleminin bir
kombinasyonudur. Telomerik DNA da kromozomal DNA’nın diğer kısımları gibi
kopyalanmaktadır. Daha sonra telomeraz, RNA bileşenini kalıp olarak kullanarak
xix
yeni telomerik tekrar dizilerini sentezlemekte ve kromozom ucuna eklemektedir.
Telomeraz aktivitesine sahip olmayan maya ve insan hücreleri, sınırlı bir süre normal
olarak büyüyebilmekte, telomerleri kısaldıkça dereceli olarak daha çok sayıda hücre
bölünme yeteneğini kaybetmektedir (48).
1.2.2.1. Telomerik Tekrarların Replikasyonu
Lineer DNA uçlarının replikasyonundaki sorun göz önüne alındığında, kromozom
uçlarının replikasyonu, genomun diğer kısımlarınınkinden farklı bir
mekanizmayla gerçekleştirilmektedir. Birinci yaygın çözüm, primaz-polimeraz
kompleksinin, telomeraz tarafından sentezlenen ve kalıp olarak kullanılan
uzantıya, komplementer primer eklemesi ve polimeraz tarafından zincirin
uzatılmasıdır. İkinci mekanizmada yine telomeraz tarafından sentezlenen uzantı
saç tokası (hair pin) şeklinde kıvrılır. Karşı karşıya gelen guanozinler arasında
hidrojen bağları (G ≡G) kurulur. Kromozomun ucunda primerin uzaklaşmasıyla
oluşan boşluğu DNA Polimeraz I’in doldurabilmesi için gerekli olan serbest 3’OH ucu oluşturulmuştur. Bundan sonra saç tokası yapısı kırılır ve sonuçta
replikasyon döngüsü sonucu genetik materyal kaybı olmaz (51,86).
1.2.2.2. Telomerik Tekrarların Uzatılması
Telomeraz, telomer devamlılığı için ökaryotlar arasında yaygın olan bir
mekanizma olsa da tüm ökaryot organizmalarda telomeraz aktivitesi yoktur. Bu
konuda en çok araştırılmış organizma olan Drosophila melanogaster’de telomeraz
bulunmamaktadır. Büyük retroelementlerin kromozom ucuna periyodik olarak
eklenmesiyle telomer devamlılığını sağlamaktadır. Bu tekrar diziler kromozom
ucunu koruyan heterokromatin yapısını oluşturmaktadırlar (15). Lineer DNA
uçlarının uzatılmasını sağlayan bir başka yol da genetik rekombinasyondur
(49,86).
1.2.2.3. Telomer Uzunluğunun Düzenlenmesi
DNA ve buna bağlı proteinlerin oluşturduğu heterokromatin benzeri kompleks bir
yapı olan telomerlerin, kromozom kararlılığını sağlamanın yanında, mayoz ve
mitoz hücre bölünmesinde de bazı fonksiyonlara sahip olduğu düşünülmektedir.
Uzunluklarının ve yapılarının, bu fonksiyonlarını gerçekleştirebilecekleri
uygunlukta olması gerekmektedir. Telomer uzunluğunun düzenlenmesi, telomerik
bölge kısaldığında telomerazın telomerler üzerinde aktivite göstermesine izin
verilmesi ve yeterince uzadığında bu aktivitenin sınırlanmasıyla gerçekleştirilir
(15). Telomer uzunluğuna duyarlı bir sistemin telomerik tekrar sayısını ve
bağlanan proteinleri ölçtüğü ve bu bilgiyi telomerik tekrarları ekleyen (telomeraz)
ya da uzaklaştıran (özel ekzonükleazlar) mekanizmalara aktardığı
düşünülmektadir. Sonuç olarak, çift zincir telomerik DNA bağlanma proteinleri
telomerleri diziye özgül olarak tanımakta ve telomerik DNA-protein kompleksi
farklı proteinlerin etkileşimi sonucu oluşturulmaktadır (21).
Telomeraz aktivitesi olan hücrelerde, telomerik DNA’nın tanımlanmış en uzun ve
en kısa uzunluğuna gelmesini düzenleyen ve uygun uzunlukta kalmasını sağlayan
xx
çeşitli faktörler mevcuttur. Örneğin mayada en kısa sınır telomerik DNA
uzunluğu 300-500 bç iken insanda birkaç kilobaz uzunluğa ulaşabilmektedir.
Ortalama telomer uzunluğu ile hücreler arasındaki telomer uzunluğu çeşitliliği
arasında bir korelasyon bulunmaktadır. Çok uzun telomerler, daha kısa olanlara
göre uzunluk bakımından daha heterojendirler (51).
Telomerik proteinler tarafından telomerlerin uzunluğu negatif yönde kontrol
edilebilmektedir. Rap1p proteini C-terminal kuyruğu aracılığıyla telomerazın
kromozom ucuna erişmesini engelleyerek telomer uzunluğunu negatif yönde
düzenlemektedir. Çift zincirli telomerik DNA bağlanma proteinlerinin
bağlanmasının inhibe edilmesinin, anormal telomer uzamasına neden olduğu
saptanmıştır.
Ancak Rap1p proteini telomerik DNA’ya diziye özgül olarak bağlanmaktadır.
Mayalarda telomerik dizilerdeki çeşitli mutasyonların, telomer uzunluğuna
etkisine ilişkin çalışmalarda, telomer uzunluğu ile Rap1p proteininin ilişkili
olduğu mutant telomerik tekrara bağlanma afinitesindeki kayıp arasında bir
korelasyon saptanmıştır. Ayrıca çift mutasyona (hem telomerik dizide mutasyona,
hem de Rap1p proteininin C-kuyruğunda kısalma meydana getiren mutasyona)
sahip maya hücrelerinde, telomerlerin aşırı uzadığı ve parçalandığı belirlenmiştir
(38,51).
Telomeraz RNA kalıbında mutasyona sahip S. cerevisiae ve K. lactis
mutantlarında, telomer uzunluğunu pozitif yönde etkileyen bazı faktörlerin kalıp
diziye bağımlı olduğu ve telomeraz enzimleri in vitro olarak aktif olduğu halde,
telomerik DNA’nın dereceli olarak kısaldığı görülmüştür (23).
Memeli TRF1 ve TRF2 proteinleri telomer uzamasını negatif yönde kontrol
ederler. Memeli telomerik bağlanma proteini TRF2’nin fonksiyonunun bozulması,
kromozom ucunda guanince zengin 3’ uzantısının kaybına neden olmaktadır (23).
1.2.2.4. Telomerlerdeki Rekombinasyonel Olayların Düzenlenmesi
Aktif telomeraz varlığında, telomerlerde rekombinasyon olayları sık olarak
gerçekleşmez. S. cerevisiae ve K. lactis hücrelerinde telomeraz aktivitesinin
bertaraf edilmesi, hücrelerde büyüme özelliklerinde bozulmalar görülmeden önce,
telomerik ve subtelomerik rekombinasyon olaylarının oranını artırmaktadır. K.
lactis’te telomerik rekombinasyon olayları telomerik bölge uzunluğundaki ani
artışlar şeklinde görülmektedir. Mutant telomeraz RNA kalıbına sahip olan ve
telomerleri normal uzunluktakinden daha kısa halde stabil olan mutant hücreler,
subtelomerik gen konversiyonu oranında artış göstermektedir. Bu veriler, bazı
hücre içi bileşenler tarafından, çift zincir kırıkları gibi algılanan kısalmış
telomerlerin, rekombinojenik olduğu hipotezi ile de örtüşmektedir (52).
Kromozom uçlarında, homolog olmayan uç birleşmesi (NHEJ) sonucu telomer
füzyonları meydana gelmektedir. K. lactis hücrelerinde telomerik tekrarlardaki belirli
mutasyonlar, yüksek sıklıkta telomer füzyonuna neden olurlar. Bu, normal şartlarda
kromozom uçlarını, NHEJ’den koruyan telomerik proteinlerin bağlanma bölgelerinin
bozulmasından kaynaklanmaktadır (51).
xxi
1.2.3. Genetik Rekombinasyon
Mayoz sırasında homolog kromozomlar eşleştiğinde kromozom segmentlerinin
(bölümlerinin) karşılıklı değiş-tokuşu gerçekleşebilir. Yüksek oranda DNA dizi
homolojisi içeren iki kromozom arasında, eşdeğer pozisyonlardaki DNA dizilerinin
karşılıklı yer değiştirmesi şeklindeki bu olaya genel ya da homolog rekombinasyon
denir. Değiş-tokuşun genetik materyal kaybı olmaksızın gerçekleşebilmesi DNA
dizileri arasındaki eşlenikliğe bağlıdır. Genetik rekombinasyon bir dizi enzimatik
işlem sonucu gerçekleşir. Karşılıklı gelen iki homolog dizide;
1. Her bir çiftte aynı pozisyonda endonükleaz aracılığıyla tek zincirde kırık
oluşur.
2. Çift zincirlerde kesim sonucu açıkta olan uçlar yer değiştirir ve diğer
zincirin ipliği ile eşleşir.
3. Boşta olan uçlar ligaz tarafında birleştirilir ve rekombinant çiftler oluşur.
4. Değiş-tokuş sonucu çapraz köprü yapısı ortaya çıkar, çapraz köprünü
pozisyonu dallanma-göçü olarak adlandırılan olayla koromozom boyunca hareket
eder. Bu hareket her bir çift zincirde karşılıklı gelen bazlar arasındaki hidrojen
bağlarının kırılıp yer değiştirerek tekrar oluşmasıyla gerçekleşir. Bu hareket sonucu
her iki homolog üzerindeki heterodubleks DNA uzunluğu artar.
5. Dubleksler ayrıldıktan sonra karakteristik Holliday yapısı ortaya çıkar.
6. Daha
değiş-tokuşa
katılmamış
karşı
homologlardaki
iki
zincir
endonükleazla kırılır ve tekrar birleşme sonucu rekombinant dubleksler oluşur (36).
1.2.4. Kluveromyces lactis
xxii
Mayalar filogenetik sınıflandırmada fungus takımına dahildirler. Tek hücreli
olmaları ve bölünerek ya da tomurcuklanarak çoğalmaları ortak özellikleridir (76).
Maya genetiği çalışmaları telomer araştırmaları için son derece değerlidir.
Çoğu ökaryotta olduğu gibi telomerik DNA’ları guanince zengin kısa ardışık tekrar
dizilerinden meydana gelmektedir. Kluveromyces lactis’in de dahil olduğu
Ascomycetus mayaları, telomerik tekrar dizilerinin çeşitliliği bakımından ökaryotlar
arasında alışılmadık bir durum sergilemektedirler. Ökaryotlarda telomerik tekrar
dizisi, ortalama 5-8 bç iken, mayalar arasında birim tekrar uzunluğu 8-26 bç
arasındadır (49,76).
K. lactis telomeri 25 bp’lik (ACGGATTTGATTAGGTATGTGGTGT)
telomerik tekrar dizisinin 10-20 kopyasından oluşmaktadır. K. lactis subtelomerik
bölgeleri henüz detaylı şekilde aydınlatılamamıştır. 12 kromozomundan 10’una ait
subtelomerik bölgelerin karakterizasyonu gerçekleştirilmiştir (59).
Saccharomyces cerevisiae ve Kluveromyces lactis başta olmak üzere mayalar
alternatif telomer devamlılığı mekanizması olarak rekombinasyonu kullanırlar.
İnsan ALT hücre kültürü telomerleri ile, maya PSS hücrelerindeki telomerlerin
tekrar dizilerinin ardışık yapısı bakımından benzerlik saptanmıştır. Bu nedenle
ALT mekanizmasının aydınlatılması için yapılan çalışmalarda, maya modellerinin
yol gösterici olacağı düşünülmektedir (46). Ayrıca laboratuar koşullarında kolay
üretilebilme özellikleri ve moleküler genetik tekniklerle çalışabilmeye uygun
olmaları da göz önüne alındığında, tek hücreli ökaryotik bir organizma olarak,
rekombinasyonel telomer devamlılığının anlaşılabilmesi için yapılan çalışmalarda
uygun model organizmalardır (76).
K. lactis, telomer çalışmaları için S. cerevisiae’ye göre bazı açılardan
avantajlar göstermektedir. Telomerik tekrar dizilerini aynı zamanda subtelomerik
bölgede de değil, yalnızca telomerlerde bulundurmaları, rekombinasyonla değişen
telomerik yapının analizini kolaylaştırmaktadır (49).
1.2.5. Telomerazdan Bağımsız Telomer Devamlılığı
xxiii
Ökaryotların çoğunda telomerler, telomerazın sentezlediği kısa tekrar dizileri
ile uzatıldığı halde, telomeraz aktivitesine sahip olmayan bazı ökaryotik hücreler
(bazı kanser hücreleri de dahil olmak üzere) Alternatif Telomer Uzaması (Alternative
Lengthening of Telomeres /ALT) yoluyla da telomer devamlılığını sağlamaktadırlar.
Telomeraz aktivitesine sahip olmayan bazı maya ve memeli hücrelerinde
telomerazdan
bağımsız
telomer
devamlılığının
olduğu
gösterilmiştir
(12,18,49,52,73).
ALT mekanizmasının işareti (marker) olarak kullanılması mümkün olan
“Promiyelositik lösemi proteini/PML” tanımlanmıştır (“ALT-associated
Promyelocytic leukemia (PML) Bodies (APBs)”). PML proteini, promiyelositik
lösemide füzyon olaylarına katılması nedeniyle bu şekilde adlandırılmıştır.
ALT’ın karakteristik özelliği olan heterojen yapıdaki uzun telomer dizileriyle
birlikte, ALT mekanizmasının işareti olarak kullanılmaktadır (73).
1.2.5.1. Mayada Rekombinasyonel Telomer Devamlılığı
1.2.5.1.1. Telomeraz Aktivitesine Sahip Olmayan Mutant Maya
Hücreleri
Bu zamana kadar, üç maya türünün (S. cerevisiae, K. lactis ve S. pombe)
telomeraz aktivitesine sahip olmayan mutantları oluşturulmuştur. K. lactis
telomerik tekrarı prob olarak kullanılarak, telomeraz enziminin RNA altünitesini
kodlayan TER1 geni tanımlanmıştır. TER1 geninin bazı bölümlerinin delesyonu
telomer fonksiyonunu iki şekilde değiştirmektedir. İlkinde bazı mutantlar, kısmi
telomeraz aktivitesini sürdürmekte ve telomerlerini normalden daha kısa halde
kararlı tutabilmektedirler. TER1 geninin tamamını kaybeden ikinci grupta ise
dereceli telomer kısalması görülmektedir. Bu grup hücrelerin telomerleri, 100
hücre bölünmesinde orijinal uzunluğunun %10’una ulaşmakta ve gittikçe artan
sayıda hücre, bölünebilme yeteneğini kaybetmektedir (49).
Telomeraz aktivitesi bulunmayan mutant maya hücrelerinde, ardışık hücre
bölünmeleri sonucu dereceli olarak telomer kısalması ve kötüleşen büyüme
fenotipleri (“senescence”) görülmekte, hücrelerin çoğu ölmektedir. “Senescence“
terimi maya ve memeli hücreleri için farklı anlamlarda kullanılmaktadır. Memeli
hücrelerinde “senescence“ telomer kısalması ile başlayan hücre ölümü olmaksızın
meydana gelen bir büyüme problemidir. Maya hücreleri için kullanıldığında ise,
azalan büyüme oranı ve sonucunda telomerlerin kritik kısalığa gelmesine bağlı
olarak gerçekleşen hücre ölümü anlamına gelmektedir. Ancak maksimum hücre
ölümünün ardından, az sayıda, kısmi olarak düzelen büyüme özellikleri gösteren
hücreler (Post-senescence survivors/PSS) görülmektedir. Uzamış telomerler
bulunduran bu hücrelerin analizi sonucu kritik kısalığa gelen telomerlerin
oluşturduğu DNA hasarı sinyalini bertaraf eden iki mekanizma ortaya
xxiv
çıkarılmıştır: Telomer füzyonu ve rekombinasyonel telomer devamlılığı. Uzamış
telomerlerde tekrar başlangıçtaki dereceli telomer kısalması görülmekte ve bu iki
işlem (rekombinasyonel telomer uzaması ve dereceli olarak telomerlerin
kısalması) birbirini takip ederek bir döngü oluşturmaktadır (47,49,51). Ancak PSS
hücrelerinde telomerler dereceli olarak değil tek bir adımda uzatılmakta ve bu
işlem esnasında hücreler, çeşitli homolog rekombinasyon proteinlerinin (RAD
50p, RAD51p ve RAD 52p) fonksiyonuna ihtiyaç duymaktadırlar (77,78).
S. pombe, her iki mekanizmayı da kullandığı halde, S. cerevisiae ve K. lactis
türlerinde telomerazdan bağımsız telomer devamlılığı mekanizması
rekombinasyona dayanmaktadır. Mayada rekombinasyonel telomer devamlılığı
iki şekilde gerçekleşmektedir. Birincisi, diğer dizilerin amplifikasyonuna ilişkin
bir veri olmadığı halde telomerik tekrar bölgelerinin uzamasıdır (Telomer başlıkkorumalı rekombinasyon/ Telomere cap-prevented recombination/CPR). TelomerCPR yolu ile senes fenotipi gösterdikten sonra hayatta kalan hücrelerdeki telomer
uzunluğu, doğal tip maya hücrelerindekinden (250-500 bç) daha fazladır. İkincisi
ise sadece S. cerevisiae’de görülmekte ve telomerik ve subtelomerik bölgeleri
içeren büyük DNA bölümlerinin ardışık amplifikasyonu ile gerçekleşmektedir
(48,78).
Saccharomyces PSS hücrelerinin karakteristik özelliği olan oldukça uzun ve aynı
zamanda uzunluk bakımından heterojen olan telomerlerin bu yapıları, telomeraz
yokluğunda telomer devamlılığını sağlayan ölümsüz insan hücre kültürleri ve
tümör hücrelerindeki telomerlere benzemektedir (78).
1.2.5.1.2. Rekombinasyonel Telomer Uzaması Modelleri
İlk olarak mayalarda keşfedilen rekombinasyonel telomer uzaması, telomeraz
enzimine gerek duymadan telomer devamlılığını sağlayan alternatif bir
mekanizmanın varlığını göstermiştir. S. cerevisiae ve K. lactis organizmalarında
telomeraz yokluğunda kısalan telomerik bölgelerin, rekombinasyon yoluyla
devamlılığı sağlanabilmektedir. Aynı şekilde subtelomerik bölgeler de
yayılmaktadır (48,49).
Telomerik olmayan DNA uçları, homolog olmayan uç birleşmesi ya da
rekombinasyon ile DNA onarım mekanizmalarını harekete geçirmektedir.
Mayalarda bu onarım işlemi tercihen gen konversiyonu ile gerçekleşmektedir.
Telomerik tekrar bölgelerinin çok kısalması ve kromozom ucunu yeterince
koruyamaması gibi telomer fonksiyonunun kaybına neden olan bir durumun,
telomerlerde rekombinasyon olayını tetikleyeceği düşünülmektedir. Telomerik
bölgesi kısalmış kromozom uçları, DNA kırıklarını onaran proteinler tarafından
işlenmekte ve rekombinasyon yoluna götürülmektedir (50,84). Bu da bölünmeye
devam eden hücrelerde rekombinasyonun neden telomer devamlılığını sağlamakta
yeterli olduğunu açıklamaktadır(48,49).
Telomer devamlılığını sağlayan farklı rekombinasyon yolakları (RAD50, RAD51 ,
RAD52) tanımlanmıştır (16,42). Gen konversiyonu RAD52 geni kontrolünde ya
da RAD52’den bağımsız homolog rekombinasyon ile gerçekleşmektedir. K. lactis
hücrelerinde çembersel telomerik DNA’ların tetiklediği telomer uzamasının
RAD52 geni kontrolünde gerçekleştiği saptanmıştır (55,79,87). K. lactis’te
hücrede telomeraz aktivitesi bulunmasına rağmen, ALT benzeri bir telomer
xxv
yapısına yol açan rekombinasyon mekanizmasını kontrol eden STN1 geni
tanımlanmıştır (33).
Telomeraz aktivitesine sahip olmayan ve iki tip telomerik tekrar dizisi
bulunduran mutant K. lactis hücrelerindeki telomer devamlılığı ise, çember
şeklindeki DNA’nın kalıp olarak kullanıldığı gen konversiyonu ile açıklanmakta,
telomerik çemberlerin rekombinasyon olayını tetikleyebileceği düşünülmektedir.
Bu model, ALT hücrelerinin karakteristik özelliği olan uzun bir telomerin tek
adımda oluşturulabilmesiyle ve telomerik bölgelerin heterojen tekrar dizilerinden
oluşmasıyla da örtüşmektedir. Bu hücreler, rekombinasyonel telomer uzaması
gerçekleştikten sonra, iki tip (doğal ve mutant) telomerik tekrar dizisi içeren bir
telomerik yapıya sahip olmaktadırlar(33,49,56). “Roll and Spread Model” olarak
adlandırılan bu mekanizma ile 100-400 nükleotitlik tek veya çift zincirli bir
telomerik DNA çemberinin, rekombinasyonel telomer uzamasına yol açtığı
belirlenmiştir (56,57). Tek zincirli çemberler, sadece guanince zengin telomerik
dizilerden meydana gelmektedir ve “T-loop” oluşumuna benzeyen intratelomerik
zincir invazyonunun tekrar ayrışmasıyla oluştuğu belirlenmiştir. Maya ve insan
hücrelerinde gözlenen hızlı telomer delesyonunun (Rapid Telomere Deletion)
ürünleri oldukları da düşünülmektedir (27,56)
1.2.5.2. Memeli Hücrelerinde Telomerazdan Bağımsız Telomer Devamlılığı
İnsan hücrelerinin çoğunda, telomer devamlılığını sağlayacak bir mekanizmanın
bulunmaması, hücrede replikasyonun durmasına neden olmaktadır (1). Ancak
sınırsız büyüme özelliğine sahip insan hücrelerinin tümünde bazı telomer
devamlılığı mekanizmaları bulunmaktadır. İnsan kanser hücrelerindeki telomer
devamlılığı telomeraz varlığı ile açıklansa da, bazı kanser hücrelerinin ve ölümsüz
hücre hatlarının telomeraz yokluğuna rağmen telomer devamlılığını
sağlayabildikleri görülmüştür. Tümör kökenli hücre hatları ve tümör örneklerinin
%5-10’unda alternatif telomer uzamasının göstergesi olarak, telomeraz
yokluğunda telomer uzaması görülmüştür. Ölümsüz insan fibroblast hücrelerinin
%30’unda telomeraz aktivitesi belirlenememesine rağmen normal insan
hücrelerindeki gibi dereceli telomer kısalması da saptanmamıştır (34,51,58).
İnsan hücrelerindeki alternatif telomer uzamasının mekanizması henüz
bilinmemektedir. Maya ve insan ALT hücre kültürlerinden elde edilen verilerle,
inter-telomerik ve intra-telomerik (T-loop oluşumu) homolog rekombinasyonun
memeli telomerlerinin korunması ve uzamasında rol oynayabileceği (22,32),
mayalardaki CPR mekanizması gibi, telomerler arasında karşılıklı olmayan
rekombinasyonun telomerik uzamayı sağlayabileceği düşünülmektedir
(14,26,51,75,839). Bazı insan hücre kültürlerinde ve ALT hücrelerinde, TER1-∆
mutant K. lactis hücrelerindekine benzer şekilde “Roll and Spread Model”i
destekleyen ekstrakromozomal telomerik çembersel DNA molekülleri
saptanmıştır ve bu da çembersel DNA kalıplı gen konversiyonunu akla
getirmektedir (14,51,57,79).
İnsan ALT hücre kültüründe, yüksek sıklıkta telomerik dizilerin karşılıklı
değişimi ile karakterize bir alternatif telomer uzaması mekanizması saptanmıştır.
Telomerik dizi değişimleri, hücrede telomeraz aktif hale getirildiğinde de devam
etmektedir. Bu değişimler sadece telomerik bölgede gerçekleşmekte, kromatidin
iç bölümlerinde görülen kardeş kromatit dizi değişimleri ile arasında bir
korelasyon bulunmamaktadır (40).
xxvi
1.2.6. Alternatif Telomer Uzaması ve Kanser
Normal somatik hücrelerin aksine, tümör hücreleri telomeraz ya da alternatif bir
mekanizma ile tümör oluşumunun anahtar basamağı olan telomer devamlılığını
sağlayabilmektedir (88). Normal somatik hücreler, “senes” olmadan önce sınırlı
kez bölünebilirler. Ancak tümör gelişimi için, hücrelerin proliferasyon sınırını
aşıp ölümsüz hale gelerek, olağan sınırdan daha fazla kere bölünebilmeleri
gerekmektedir. Ölümsüz hücre hatlarının tamamında telomer devamlılığı
mekanizması bulunduğundan, ölümsüzlük ile telomer devamlılığı bağlantılı
durumlardır (66).
Telomerleri kritik derecede kısalmış bir hücre şu üç sondan biriyle
karşılaşmaktadır: 1) Hücre çoğalmasının durması (“senescence”), 2) Apoptozis, 3)
Hücre çoğalmasının devam etmesi ve hücrede genomik kararsızlık. Normal
somatik hücrelerde dereceli telomer kısalması sonucu gelişen “senescence”
fenotipinin, pre-neoplastik hücrelerin replikasyon potansiyelini sınırlamadan
sorumlu, tümör baskılayıcı bir mekanizma olarak görev yaptığı, böylece hücrede
onkogen bir aktivasyona neden olabilecek mutasyonların devam ettirilmesine
engel olduğu düşünülmektedir (74).
Bazı tümör olgularında, normal bir hücrenin tümör hücresine dönüşmesi
evresinde, hücrede meydana gelen telomer kısalması, uç-uca kromozom
füzyonuna neden olmakta, kromozomun yeniden düzenlenmesi de, tümör
gelişiminin karakteristik özelliği olan genomik kararsızlıkta rol oynamaktadır. Bu
genomik kararsızlık, telomerik dizilerdeki rekombinasyon oranı üzerinde etkili
telomer bağlanma proteinlerinin mutasyonu ya da anormalliklerine bağlı olarak,
telomer uzunluğunda meydana gelen hızlı değişimlerden de kaynaklanmaktadır.
p53’ün fonksiyonunu yerine getiremediği durumlarda da genomik olarak kararsız
hücreler hayatta kalabilmekte ve telomer füzyonu sonucu malign fenotipler için
tehlikeli bir potansiyel oluşturmaktadırlar (30,35,54).
Telomerlerin replikasyon yeteneklerini tekrar kazanmalarının, tümör gelişiminde
kritik bir basamak olduğu düşünülmektedir. Mayalarla yapılan çalışmalar da
tümör gelişiminin erken evrelerinde, telomer uzunluğunun kontrolünün kritik
önemi olduğunu göstermektedir (87).
ALT mekanizması tümör kökenli hücre hatlarında ve primer tümörlerde de
gözlenmiştir. Ancak, %10 oranındaki telomeraz-negatif tümör olgularının
tamamında (Tümör olgularının %90’ında telomeraz aktivitesi saptanmıştır (34),
ALT mekanizmasının karakteristik telomer morfolojisi görülmemektedir. Bu
nedenle telomeraz ve ALT mekanizmalarından bağımsız başka mekanizmaların
da varolma ihtimali göz ardı edilmemelidir (73). Bazı telomeraz-pozitif tümör
olgularında, telomeraz aktivitesi ve ALT mekanizmasının bir arada varolduğuna
işaret eden uzatılmış ve heterojen yapıda telomerler saptanmıştır (73).
Tümör tiplerinin, ALT aktivitesi bakımından gösterdikleri özellikler henüz tam
olarak aydınlatılamamış olsa da, astrositoma ve osteosarkoma olgularında, ALT
mekanizmasının kullanıldığı bilinmektedir (31,67).
Tümörün tipine göre ALT mekanizmasının prognostik önemi de değişmektedir.
İnsan tümör hücrelerindeki ALT mekanizması, normal memeli somatik
hücrelerindeki telomer homeostazının düzenlenemeyen şekli olarak
nitelendirilebilir (53).
xxvii
ALT mekanizmasının moleküler temelinin anlaşılması, tümör tanısı ve tedavisi
için önemlidir (53). Aynı derecede önemli olan bir başka soru ise ALT
mekanizmasının normal somatik hücrelerde nasıl baskılandığıdır. Bu hücrelerde
telomer devamlılığının sağlanamamasından da anlaşılabileceği gibi, normal
hücreler ALT mekanizmasını baskılayabilmektedirler (68).
İnsan kanser olgularının çoğunda telomeraz aktivitesi ile onkojenite arasında
korelasyon bulunmaktadır (43). Ancak insan kanser hücrelerinde telomer
devamlılığı mekanizması olarak ALT, telomerazdan daha az kullanılan bir
mekanizma olmasına rağmen, ALT mekanizmasının anlaşılması kritik öneme
sahiptir (49). Çünkü telomeraz pozitif tümörlerin tedavisi için telomeraz
inhibitörlerinin kullanımı, telomer devamlılığı için ALT’ı kullanan altklonların
ortaya çıkması için seçici bir baskı oluşturmaktadır. Bu yüzden başarılı bir
antikanser tedavi telomeraz ve ALT inhibitörlerinin kombinasyonundan
oluşmalıdır (58,67,68,70).
İnsan ALT hücre kültürü telomerleri ile, maya PSS hücrelerindeki telomerlerin
tekrar dizilerinin ardışık yapısı bakımından benzerlik saptanmıştır. Bu nedenle
ALT mekanizmasının aydınlatılması için yapılan çalışmalarda, maya modellerinin
yol gösterici olacağı düşünülmektedir (46).
BÖLÜM II
GEREÇ VE YÖNTEM
2.1. KULLANILAN KİMYASAL MADDELER
1. Maya ekstresi (Yeast extract)
(AppliChem)
2. NaCl
(AppliChem)
3. Tripton
(Sigma)
4. Pepton
(Merck)
5. Dekstroz
(AppliChem)
6. Agar
(AppliChem)
7. Zimolaz (Zymolase)
(Sigma)
8. Trizma baz
(Sigma)
9. EDTA.2H2O
(AppliChem)
10. NaOH
(Sigma)
11. Triptofan
(Sigma)
xxviii
12. Histidin
(AppliChem)
13. Urasil
(AppliChem)
14. Adenin
(AppliChem)
15. Lösin
(Sigma)
16. Maya Nitrojen Bazı (Yeast Nitrogen Base)(Sigma)
(Amonyum Sülfatlı, Aminoasitsiz)
17. Drop-out Mix
(Sigma)
18. Sorbitol
(AppliChem)
19. β-Merkapto Etanol
(Sigma)
20. Sodyum dodesil sülfat (SDS)
(AppliChem)
21. Potasyum asetat
(AppliChem)
22. Asetik Asit
(Atabay)
23. Etanol
(J. T. Baker)
24. Tris.Cl
(Sigma)
25. Amonyum Asetat
(AppliChem)
26. EcoRI restriksiyon enzimi
(Fermantas)
27. AccI restriksiyon enzimi
(Roche)
28. BclI restriksiyon enzimi
(Fermantas)
29. RNase
(Roche)
30. Agaroz
(Prona)
31. 100 bp, 200 bp, 1000 bp DNA markörleri (Fermantas)
32. Etidyum Bromür
(Sigma)
33. HCl
(Carlo-Erba)
34. Sodyum sitrat
(Sigma)
35. Whatmann filtreleri
(Amersham)
36. Naylon membran
(Amersham)
2.2. KULLANILAN CİHAZ VE ALETLER
1. Mikroskop
(Novex)
2. Elektroforez güç kaynağı
(Thermo)
3. Elektroforez tankı
(Thermo-EC)
4. Görüntüleme sistemi
(Vilber Lourmat)
5. Bilgisayar
(HP)
xxix
6. Ultra santrifüj
(Hettich)
7. Etüv
(Nüve)
8. Otoklav
(Hirayama)
9. Manyetik Karıştırıcı
(Velp)
10. Çalkalayıcılı inkübatör
(Gerhardt)
11. Isı bloku
(Lab-Line)
12. pH metre
(Ino-Lab)
13. Vorteks
(Ika)
14. Hassas terazi
(Sartorious)
15. Mikrodalga fırın
(Ariston)
16. Derin Dondurucu (-80°C)
(Nuaire)
17. Derin Dondurucu (-20°C)
(Beko)
18. Mikropipet
(Thermo)
2.3. KULLANILAN BESİYERİ VE ÇÖZELTİLER (72)
1. Yeast Pepton Dekstroz (YPD):
Maya Ekstresi
10g
Pepton
20g
Dekstroz
20g
Agar
20g
dH2O (distile su) ile 1000 mL’ye tamamlandı.
2. Yeast Pepton Dekstroz Sıvı(YPD sıvı): Maya Ekstresi
10g
Pepton
20g
Dekstroz
20g
dH2O ile 1000 mL’ye tamamlandı.
3. -His ve -Ura Besiyerleri:
Adenin, Lösin ve Urasil stok çözeltileri 100x, Triptofan ve Histidin stok
çözeltileri 500x oranında hazırlandı ve membran filtre ile sterilize edildi.
1)
500 x Trp: 500 mg Trp, 50 mL dH2O
2)
500 x His: 500 mg His, 50 mL dH2O
3)
100 x Ura: 100 mg Ura, 50 mL dH2O
4)
100 x Ade: 100 mg Ade, 50 mL dH2O
5)
100 x Leu: 100 mg Leu, 50 mL dH2O
6)
%20 Dekstroz: 50 gr dekstroz, 250 mL dH2O
xxx
Çözelti A: 6,7 g Yeast Nitrogen Base (Amonyum sülfatlı, aminoasitsiz)
20 g Agar
1 mL 5N NaOH
1 g Drop-out Mix
dH2O ile 1000 mL’ye tamamlanır. (pH: 6,0)
121ºC’de 30' otoklav sterilizasyonuna tabi tutulup soğuyunca çözeltiye 100 mL
%20’lik dekstroz çözeltisi ilave edildi.
-Ura ve -His plakları için Çöz. A üzerine aşağıdaki çözeltiler ilave edildi.
-Ura Plak: 10 mL 100 x Leu
2 mL 500 x Trp
2 mL 500 x His
10 mL 100 x Ade
-His Plak: 10 mL 100 x Leu
2 mL 500 x Trp
10 mL 100 x Ura
10 mL 100 x Ade
xxxi
Son plak konsantrasyonları: Trp:20 mg/L, His:20 mg/L, Ura:20 mg/L, Ade:20 mg/L.
4. SEB:
91,9 g Sorbitol
100 mL 0,5 M EDTA
0,5 mL β-Merkapto etanol
dH2O ile 500 mL’ye tamamlandı.
5. Zimolaz/SEB: 2 mg zimolaz 6 mL SEB içinde çözündürüldü.
6. EDS:
25 mL 0,5 M EDTA (pH :8,0)
2,5 mL %20’lik SDS
6,025 µl 5 M NaOH
Vf : 500 mL
7. 5 M Potasyum Asetat Çözeltisi:
122,75 g potasyum asetat
200 ml dH2O
pH:7,5 dH2O ile 250 mL’ye tamamlandı.
8. TE:
10mM Tris.Cl (pH:8,0)
1 mM EDTA (pH :8,0)
9. 10 M NH4OAc Çözeltisi:
770 g Amonyum asetat
dH2O ile 1000 mL’ye tamamlandı.
10. 0,5 x TBE:
0,045 M Tris-borate
5,4 g Tris-base
0,001 M EDTA
2,75 borik asit
2 mL 0,5 M EDTA
800 mL dH2O, dH2O ile 1000 mL’ye tamamlandı.
11. 0,2 N HCl Çözeltisi: %36,5’lik HCl 1:50 oranında distile su ile seyreltildi.
12. 0,5 N NaOH/ 1,5 M NaCl :
600 mL 5 M NaCl
200 mL 5 N NaOH
1200 mL dH2O
13. 1 M Tris (pH:7,5) / 1,5 M NaCl: 225 mL 5 M NaCl
500 mL 1,5 M Tris (pH:7,5)
dH2O ile 750 mL’ye tamamlandı.
14.20xSSC:
175,3 g NaCl
88,2 g Sodyum sitrat
800 mL dH2O
pH :7,0 dH2O ile 1000 mL’ye tamamlandı.
xxxii
2.4. LABORATUAR ÇALIŞMALARI
2.4.1. Çalışma Düzeneği
Acc ve Bcl telomerik tekrarlarının konstrüksiyonu
ve bunların K. lactis
hücrelerine transformasyonu gerçekleştirilmiştir. K. lactis hücrelerinde TER1’in
kaybından sonra Acc ya da Bcl ile işaretli bir telomer taşıyan TER1-∆ kökenlerinin
fenotipik büyümeleri ışık mikroskobu altında takip edilerek kaydedilmiştir. Fenotipik
değerlendirme sonucu seçilen K. lactis kolonilerinden genomik DNA izolasyonu
yapılmıştır. Genomik DNA’lara EcoRI ve EcoRI+AccI veya EcoRI+BclI ile
restriksiyonel kesim yapılmıştır. Bu restriksiyonel fragmanlar %1’lik agaroz jel
elektroforezi ile ayrıştırılıp etidyum bromür (5 µg/ml) ile boyandıktan sonra
görüntülenmiş ve Southern Blot yöntemi ile naylon membrana transfer edilmiştir.
Membranlar,
32
P işaretli KL1-25 telomerik oligo probu ile hibridizasyona tabi
tutulmak üzere projemizde işbirliği yapılan taraf olarak yer alan Georgia Üniversitesi
Genetik Bölümüne Dr. Michael J. McEachern’in laboratuarına gönderilmiştir. Daha
sonra 6. pasajda seçilerek DNA izolasyonu yapılmış olan koloniler ve bu kolonilerin
1. ve 2. kuşak ebeveynleri, HIS ve URA genlerini taşıyıp taşımadıkları bakımından –
His ve –Ura besiyerlerinde analiz edilmişlerdir. Çalışmanın temel basamaklarını
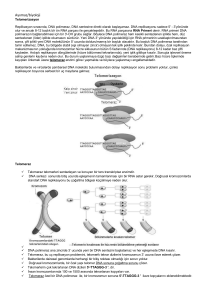
gösteren şema Şekil 1’de verilmiştir.
xxxiii
Şekil 1: Telomerik tekrarların dağılımını belirlemek için Acc tekrarı taşıyan
telomerlere sahip K. lactis suşlarının oluşturulması ve kullanılması: Subtelomerik bölge,
URA3 geni(STU) ve 11,5 bç Acc telomerik tekrarı taşıyan 1,2 kb’lik lineer DNA parçası
kullanılarak Acc telomerik tekrarları ter1-∆ suşuna yerleştirilir
Şekil 1: Çalışmanın temel basamakları
2.4.2. Maya Kökenleri
Kullanılan tüm K. lactis kökenleri 7B520’nin türevleridir (85). TER1 (pJR31)
taşıyan plazmid, HIS3 geni taşıyan pKL316’nın türevidir (71).
2.4.3. Mutant Telomerik Tekrar Taşıyan K. lactis Hücrelerinin
Oluşturulması ve Transformasyonu
Acc ve Bcl mutant telomerik tekrarların oluşturulması ve bunların K. lactis
hücrelerine transformasyonu danışmanım Prof. Dr. Zeki Topçu tarafından,
projemizde işbirliği yapılan taraf olarak yer alan Georgia Üniversitesi Genetik
Bölümünde Dr. Michael J. McEachern’in laboratuarında gerçekleştirilmiştir. HIS3
TER1 plasmidi taşıyan TER1-∆ K. lactis hücreleri ~11,5 telomerik tekrar taşıyan
URA3 ile işaretlenmiş telomerik fragmentlerle transforme edilir. İşlemin deneysel
basamaklari şekil 2’de verilmiştir. Acc transformantları WA2, A2 ve A4, Bcl
transformantı B3 olarak adlandırılmıştır. Acc mutasyonu, Rap1 bağlanma dizisinde
xxxiv
Acc restriksiyonel tanıma bölgesi oluşturan 25 bç’lik telomerik tekrardaki tek baz
değişimidir. Hızlı ve önemli derecede telomer uzamasına neden olduğu
bilinmektedir. Bcl mutasyonunun ise etkisiz olduğu gösterilmiştir (81,82). K. lactis
doğal telomerik tekrarları ile Acc ve Bcl mutant tekrarları tablo 2’de gösterilmiştir.
Tablo 2: Doğal, Acc ve Bcl mutant telomerik tekrar dizileri
Doğal telomerik tekrar
Acc mutant telomerik tekrar
Bcl mutant telomerik tekrar
TTTGATTAGGTATGTGGTGTACGGA
TTTGATTAGGTATGTGGTATACGGA
TTTGATCAGGTATGTGGTGTACGGA
xxxv
Şekil 2: Mutant Telomerik Tekrar Taşıyan K. lactis Hücrelerinin
Oluşturulması ve Transformasyonu
2.4.4. Fenotipik Değerlendirme
xxxvi
Fenotipik değerlendirme TER1’in kaybından sonra Acc ya da Bcl ile işaretli bir
telomer taşıyan TER1-∆ kökenlerinin fenotipik büyümeleri ışık mikroskobu altında
skorlanarak gerçekleştirilmiştir. Bunun için K. lactis hücreleri zengin besiyeri
ortamına (YPD) pasajlanarak 30°C’de 48 saat inkübasyona bırakılmıştır. Büyüme
skorları, 48 saatte bir yapılan pasajlamalar sonucunda kolonilerin ortalama büyüklük
ve görünüşüne göre 4-0 aralığında 0,5’lik değişim gösteren değerlerle verilmiştir. “4”
büyüme skoru doğal tip hücrelerden ayırt edilemeyecek bir büyümeye işaret ederken
“1” skoru küçük, kötü görünümlü kolonileri ve tipik olarak zengin besiyerindeki 6
seri pasajlama sonrasında yüksek hücre ölümünü gösterir (48). Şekil 3 ’de koloni
fenotiplerinin tipik skorları gösterilmiştir.
xxxvii
A
B
C
D
A: Fenotip Değeri 4,
B: Fenotip Değeri 3,
C: Fenotip Değeri 2,
D: Fenotip Değeri <1,
E: Senes fenotipi gösteren
transformantlar arasından tekrar
replikasyon yeteneği kazanarak
referans değerindekine yakın
fenotip
özelliği
gösteren
transformant
E
Şekil 3: K. lactis transformantlarının fenotiplerinin tipik skorları
2.4.5. K. lactis Genomik DNA İzolasyonu (72)
xxxviii
1. Hücreler 1,5 ml YPD içerisinde yaklaşık 12 saat süresince çoğaltılır.
2. 2 dakika santrifüjlenip besiyeri uzaklaştırılır.
3. 180 µl Zimolaz/SEB içerisinde vortekslenir. (2 mg zimolaz/6 ml SEB)
4. 37°C’ de 30 dak inkübe edilir.
5. 13000 rpm’de 5 dak santrifüjlenir, süpernatan uzaklaştırılır.
6. 150 µl EDS içerisinde süspansiyom haline getirilir.
7. 65°C’ de 15 dak inkübe edilir.
8. 15 µl 5M KOAc eklenir, tüp altüst edilerek karıştırılır, buz üzerinde 60 dak
bekletilir.
9. 13000 rpm’de 5 dak santrifüjlenir berrak süpernatan yeni bir tüpe transfer
edilir.
10. 200 µl Et-OH eklenir, 2000 rpm’de 1 dak santrifüjlenir, Et-OH
uzaklaştırılır.
11. Oluşan DNA presipitasyonu 100 µl TE’de çözülür.
12. 34 µl NH4OAc (10 M) eklenir, buz üzerinde 20 dak bekletilir.13000 rpm’de
5 dak santrifüjlenir. (NH4OAc proteinleri çöktürür.)
13. Süpernatan yeni bir tüpe transfer edilir, 150 µl Et-OH eklenerek 2000
rpm’de 1 dak santrifüjlenir.
14. +4°C’ deki %70’lik Et-OH ile yıkanır.
15. Buharlaştırılan tüp içeriği 30 µl TE’de saklanır.
2.4.6. Telomerik DNA Analizleri (72)
Rekombinasyon sonucu mutant telomerik tekrarları kazanmış olan kolonilerin
genomik DNA’larının AccI ya da BclI restriksiyon enzimlerinin özgül tanıma
bölgesini taşıdıkları bilinmektedir. Acc transformantlarının genomik DNA’larının
EcoRI ve EcoRI+AccI ile, Bcl transformantlarının genomik DNA’larının EcoRI ve
EcoRI+BclI ile restriksiyonel analizleri gerçekleştirilmiştir.
Her DNA örneğinin restriksiyonel analizi için uygun olan miktar, A ve B
tüplerinin her birine konmuş (x µl) ve üzerine (12-x) µl dH2O eklenmiştir.
1. EcoRI Reaksiyonu: 1 reaksiyon için tüpe
xxxix
1,5 µl 10 x EcoRI buffer
1 µl EcoRI
0,2 µl RNase
0,3 µl dH2O Æ 3 µl/tüp Æ 37°C’de 2 saat inkübasyon
2. (AccI + EcoRI) Reaksiyonu: 1 reaksiyon için tüpe
a. 1,5 µl 10 x EcoRI buffer
1 µl EcoRI
0,2 µl RNase
0,3 µl dH2O Æ 3 µl/tüp Æ 37°C’de 2 saat inkübasyon
b. 1 µl Buffer A
1 µl AccI
8 µl dH2O Æ 10 µl/tüp Æ 37°C’de 2 saat inkübasyon
3. (BclI + EcoRI) Reaksiyonu: 1 reaksiyon için tüpe
a. 2 µl 10 x EcoRI buffer
1 µl EcoRI
0,2 µl RNase
4,8 µl dH2O Æ 8 µl/tüp Æ 37°C’de 2 saat inkübasyon
b. 1,25 µl 10 x G buffer
1 µl BclI
2,75 µl dH2O Æ 5 µl/tüp Æ 37°C’de 2 saat inkübasyon
Bu restriksiyonel fragmanlar %1’lik agaroz jelde yürütülüp etidyum bromür (5
µg/ml) ile boyandıktan sonra görüntülenmiştir.
2.4.7. Southern Blot
xl
Restriksiyonel kesimin ardından, rekombinasyon aracılığıyla URA3 işaretli
telomerik tekrarları kazanmış kolonilerin belirlenmesi amacıyla, Southern Blot
yöntemi ile DNA fragmanları jelden naylon membrana aşağıdaki şekilde transfer
edilmiştir (17,72).
1) 0,2 N HCl Æ 10 dakika (Depürinasyon)
2) 0,5 N NaOH/ 1,5 M NaCl Æ 1 saat (Denatürasyon)
3) Distile su Æ 1-2 dakika
4) 1 M Tris (pH:7,5) / 1,5 M NaCl Æ 30 dakika (Nötralizasyon)
5) 2 x SSC Æ 5 dakika (Adaptasyon)
6) 10 x SSC/0,5 N NaOH Æ 12-16 saat (Transfer)
Membranlar
32
P işaretli KL1-25 telomerik oligo probu ile hibridizasyona tabi
tutulmak üzere projemizde işbirliği yapılan taraf olarak yer alan Georgia Üniversitesi
Genetik Bölümüne Dr. Michael J. McEachern’in laboratuarına gönderilmiştir.
KL1-25 oligonükleotit probu: ACGGATTTGATTAGGTATGTGGTGT
2.4.8. K. lactis Transformantlarının -His ve -Ura Besiyerlerinde Analizleri
K. lactis transformantlarından 6. pasajda seçilerek DNA izolasyonu yapılmış
olan koloniler ve bu kolonilerin 1. ve 2. kuşak ebeveynleri, HIS ve URA genlerini
taşıyıp taşımadıkları bakımından analiz edilmişlerdir. Bunun için K. lactis hücreleri His (histidin içermeyen) ve –Ura (urasil içermeyen) besiyerlerine pasajlanmış,
30°C’de 48 saat inkübasyonun ardından –His besiyerinde üreyen koloniler HIS
genini taşıdıkları için His+, -Ura besiyerinde üreyen koloniler URA genini taşıdıkları
için Ura+ olarak kaydedilmiştir.
xli
BÖLÜM III
BULGULAR
Fenotip özellikleri takip edilen ve DNA izolasyonu yapılan koloni sayıları
Tablo 3’de görülmektedir.
Tablo 3: Fenotip özellikleri takip edilen ve DNA izolasyonu yapılan koloni sayıları
Transformant
Acc
Bcl
N1
N2
1. Psj 2. Psj 3. Psj 4. Psj 5. Psj 6. Psj 1. Psj 2. Psj 6. Psj
6
2
12
4
24
8
48
16
96
22
185
44
6
2
12
4
27
4
N1: Takip Edilen Koloni Sayısı
N2: DNA İzolasyonu Yapılan Koloni Sayısı
K. lactis kolonilerinin morfolojik fenotip değerlendirmeleri zengin besiyeri
ortamında 48 saatte bir yapılan pasajlamalar sonucunda kolonilerin ortalama
büyüklük ve görünüşüne göre ışık mikroskobu altında skorlanarak yapılmıştır.
Transformantların zamana göre fenotip değişimleri Tablo 4’de görülmektedir. Şekil
4’de ve Şekil 5’te transformantların zamana göre fenotip değişimleri grafik halinde
görülmektedir. Telomeraz RNA genini (TER1) taşıyan plazmid kaybedildiği zaman,
Acc ya da Bcl telomerlerinden birini taşıyan transformantların alt klonlarının seri
pasajlaması sonucunda dereceli telomer kısalması ve replikasyonun durması şeklinde
açıklanabilecek senes fenotipi görülmüştür.
xlii
Tablo 4: Transformantların zamana göre fenotip değişimleri
1. Pasaj 2. Pasaj
Transformant n *Skor n *Skor
2 4
4
3
WA2
2 4
4 3,25
A2
2 4
4 3,75
A4
2 4
4 3,38
B3
n: Koloni sayısı *: 4 üzerinden
1. Pasaj 2. Pasaj
Transformant n *Skor n *Skor
6 4
12 3,33
Acc
2 4
4 3,38
Bcl
n: Koloni sayısı
3. Pasaj
n *Skor
8 2,75
8 3,13
8 3,25
8 3,25
4. Pasaj
n *Skor
16 2,94
16 2,16
16 3,03
16 2,25
5. Pasaj
n *Skor
32 2,5
32 1,61
32 2,53
22
2
6. Pasaj
n *Skor
54 2,24
69 2,12
62 2,19
44 2,17
3. Pasaj
n *Skor
24 3,04
8 3,25
4. Pasaj
n *Skor
48 2,71
16 2,25
5. Pasaj 6. Pasaj
n *Skor n *Skor
96 2,21 185 2,18
22
2
44 2,17
*: 4 üzerinden
Fenotip Değişimi
5
4,5
4
Fenotip Değeri
3,5
3
WA2
A2
2,5
A4
B3
2
1,5
1
0,5
0
1. Pasaj
2. Pasaj
3. Pasaj
4. Pasaj
5. Pasaj
6. Pasaj
Pasaj Numarası
Şekil 4: WA2, A2,A4,B3 Transformantlarının zamana göre fenotip değişimleri
xliii
Fenotip Değişimi
5
4,5
Fenotip Değişimi
4
3,5
3
Acc
2,5
Bcl
2
1,5
1
0,5
0
1. Pasaj
2. Pasaj
3. Pasaj
4. Pasaj
5. Pasaj
6. Pasaj
Pasaj Numarası
Şekil 5: Acc ve Bcl transformantlarının zamana göre fenotip değişimleri
Daha ayrıntılı bir inceleme için senes koloniler hafif ve şiddetli olarak alt gruplara
ayrılmışlardır. Hafif senes koloniler fenotipik skorlama sırasında 2,5 ya da 2,0’ye
ulaşanlar, şiddetli senes koloniler 1,5 ya da 1,0’e ulaşanlardır. Tablo 5, Tablo 6 ve
Şekil 6, her iki transformant için bu senes skorlarına ulaşan koloni sayısını
göstermekte ve Acc’ye göre daha fazla sayıda Bcl transformantının senes fenotipi
gösterdiği görülmektedir. Tablo 5’de görüldüğü gibi 2,5 ve 2,0 skorlarına, WA2
transformantının sırasıyla %85 ve %76’sı, A2 transformantının sırasıyla %97 ve
%91’i, A4 transformantının sırasıyla %87 ve %71’i, B3 transformantının sırasıyla
%95 ve %93’ü ulaşmışlardır. 1,5 ve 1,0 skorlarına, WA2 transformantının
sırasıyla %41 ve %19’u, A2 transformantının sırasıyla %83 ve %52’si, A4
transformantının sırasıyla %37 ve %8’i, B3 transformantının sırasıyla %82 ve
%52si ulaşmışlardır. Acc transformantlarının sırasıyla %90 ve %80’i , Bcl
transformantlarının sırasıyla %95 ve %93’ü hafif senes skorlarına ulaşmışken
şiddetli senes transformantlar gözönüne alındığında oranlar oldukça farklılık
göstermektedir. Acc transformantının sadece %55 ve %28’i sırasıyla 1,5 ve 1,0’e
inerken Bcl’nin %82 ve %52’si aynı fenotipik skorlara inmiştir.
Tablo 5: WA2, A2,A4,B3 transformantları için hafif ve şiddetli
senes fenotipi gösteren koloni sayıları, T: Transformant.
xliv
T
WA2
A2
A4
B3
T
WA2
A2
A4
B3
T
WA2
A2
A4
B3
T
WA2
A2
A4
B3
Takip Edilen
Koloni Sayısı
54
69
62
44
Takip Edilen
Koloni Sayısı
54
69
62
44
Takip Edilen
Koloni Sayısı
54
69
62
44
Takip Edilen
Koloni Sayısı
54
69
62
44
Büyüme Özelliği Oranı
Senes
Nonsenes
46
8
67
2
54
8
42
2
Büyüme Özelliği Oranı
Senes
Nonsenes
41
13
63
6
44
18
41
3
Büyüme Özelliği Oranı
Senes
Nonsenes
22
32
57
12
23
39
36
8
Büyüme Özelliği Oranı
Senes
Nonsenes
10
44
36
33
5
57
23
21
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
85
15
97
3
87
13
95
5
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
76
24
91
9
71
29
93
7
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
41
59
83
17
37
63
82
18
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
19
81
52
48
8
92
52
48
Sınır: 2,5
Sınır: 2,0
Sınır: 1,5
Sınır: 1,0
Tablo 6: Acc ve Bcl transformantları için hafif ve şiddetli senes
fenotipi gösteren koloni sayıları, T: Transformant.
xlv
T
Acc
Bcl
T
Acc
Bcl
T
Acc
Bcl
T
Acc
Bcl
Takip Edilen
Koloni Sayısı
185
44
Takip Edilen
Koloni Sayısı
185
44
Takip Edilen
Koloni Sayısı
185
44
Takip Edilen
Koloni Sayısı
185
44
Büyüme Özelliği Oranı
Senes
Nonsenes
167
18
42
2
Büyüme Özelliği Oranı
Senes
Nonsenes
148
37
41
3
Büyüme Özelliği Oranı
Senes
Nonsenes
102
83
36
8
Büyüme Özelliği Oranı
Senes
Nonsenes
51
134
23
21
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
90
10
95
5
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
80
20
93
7
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
55
45
82
18
Büyüme Özelliği Oranı
Senes(%) Nonsenes(%)
28
72
52
48
Sınır: 2,5
Sınır: 2,0
Sınır: 1,5
Sınır: 1,0
Senes-Nonsenes
100
10
90
5
7
20
18
45
80
70
48
72
Acc Nonsenes
Acc Senes
Bcl Nonsenes
Bcl Senes
60
Koloni Yüzdesi
50
90
40
95
93
80
82
55
30
20
52
28
10
0
2,5
2,0
1,5
1,0
2,5
2,0
1,5
1,0
Fenotipik Sınır
Şekil 6: Acc ve Bcl transformantlarının senes fenotip gösterme
yüzdeleri
xlvi
Seçilen
transformantlardan
DNA
izolasyonları
yapılarak
telomerik
restiksiyonel fragmanların analizi (EcoRI ve EcoRI+AccI ya da EcoRI ve
EcoRI+BclI) gerçekleştirilmiştir. Bu fragmanlarla yapılan %1’lik agaroz jel
elektroforezi sonucu elde edilen jel fotoğrafları Şekil 7’de görülmektedir.
1. ve 2. kuşak altklonlar
M - + - + - +
- +
- + - +
- + - + - + - + M
M - + - + - +
- +
- + - + M
A
Şekil 7: Acc ve Bcl transformantlarının jel fotoğrafları: A: WA2 transformantı,
B: A2 transformantı, C: A4 transformantı (üst sıra), B3 transformantı (alt sıra).
Transformantların 1. ve 2. kuşak altklonları fotoğrafta işaretlenmiştir. Diğer
kuyucuklar 6 seri pasajlama sonrasında gösterdikleri fenotip özelliklerine göre
seçilen altklonların restriksiyonel analizlerini göstermektedir.
xlvii
1. ve 2. kuşak altklonlar
M - + - + - + - +
M - + - + - +
- + - + - + - + - + - + M
- + - + - + - + - + M
B
xlviii
1. ve 2. kuşak altklonlar
M - +
- + - + - +
M - + - +
- + - +
- +
- + - +
- +
- + - + - +
C
xlix
- + M
- + - +M
Restriksiyonel kesim sonucu oluşan DNA fragmanları, Southern Blot yöntemi
ile naylon membrana transfer edilmiştir. Georgia Üniversitesi’nde 32P işaretli KLl-25
telomerik oligo probu ile gerçekleştirilen hibridizasyon işleminin ardından elde
edilen fotoğraflar Şekil 8’de görülmektedir.
1
3
5
7
9
11
13
15
17
19
A
Şekil 8: 32P işaretli KLl-25 telomerik oligo probu ile gerçekleştirilen
hibridizasyon işleminin ardından elde edilen fotoğraflar. A: WA2 transformantı, B:
A2 transformantı, C: A4 transformantı (üst sıra), B3 transformantı (alt sıra). “☻”
işareti mutant telomerik tekrarların yayıldığı altklonları göstermektedir.
l
1
3
5
7
9
11
13
B
li
15
17
19
1
3
5
7
9
11
13
C
lii
15
17
19
Tablo 7’de mutant telomerik tekrarların yayılım gösterdiği altklonlar tablo
halinde özetlenmiş ve analiz edilen 24 altklondan 9 tanesinde (~%38) mutant
telomerik tekrarların yayıldığı belirlenmiştir.
Tablo 7: Mutant telomerik tekrarların rekombinasyonel dağılım özellikleri
T
WA2
A2
A4
TOPLAM
6. PasajdaAnaliz
Edilen Koloni Sayısı
10
11
3
24
MTT
MTT(%)
3
5
1
9
30
45
33
38
T: Transformant
MTT:Mutant Telomerik Tekrarların yayılım gösterdiği altklon sayısı
DNA izolasyonu yapılan K. lactis transformantlarının histidin veya urasil
içermeyen besiyeri ortamına pasajlanmaları sonucu belirlenen His+ ve Ura+
transformant sayıları Tablo 8’de görülmektedir. Beklendiği gibi tüm transformantlar
1. kuşakta her iki geni de taşımaktadırlar. WA2 transformantının 2. kuşakta analiz
edilen 4 altklonundan 2 tanesinin HIS genini kaybettiği, 6. kuşakta analiz edilen 12
koloniden sadece 1 tanesinin HIS geni, 6 tanesini de URA geni taşıdığı
görülmektedir. A2 transformantının 2. kuşakta da HIS ve URA genlerini koruduğu,
ancak 6. kuşakta analiz edilen 12 koloniden hiçbirinin HIS geni taşımadığı, 2
tanesinin URA geni taşıdığı belirlenmiştir. A4 transformantının 2. kuşak
altklonlarının tamamının HIS genini kaybettiği ancak URA genini koruduğu, 6.
kuşakta ise sadece 1 koloninin URA geni taşıdığı görülmektedir.
B3
transformantının 2. kuşak altklonlarının tamamının HIS ve URA genlerini koruduğu,
6 kuşakta ise tamamının her iki geni de kaybettiği görülmektedir.
liii
Tablo 8: His+ ve Ura+ transformant sayıları
Transformant
WA2 (Parental)
WA2 (2. Pasaj)
WA2 (6. Pasaj)
A2 (Parental)
A2 (2. Pasaj)
A2 (6. Pasaj)
A4 (Parental)
A4 (2. Pasaj)
A4 (6. Pasaj)
B3 (Parental)
B3 (2. Pasaj)
B3 (6. Pasaj)
Analiz Edilen
Koloni Sayısı
2
4
12
2
4
12
2
4
3
2
4
4
His+ Sayısı
Ura+ Sayısı
2
2
1
2
4
0
2
0
0
2
4
0
2
4
6
2
4
2
2
4
1
2
4
0
liv
BÖLÜM IV
TARTIŞMA
“Roll and Spread Model” modeli, tek bir telomerik tekrarın, telomeraz
aktivitesine sahip olmayan mutant K. lactis hücrelerinde uzatılmış telomerlere sahip
PSS hücreler oluşturabileceğini öne sürmektedir (56). Çalışmamızda, bu model ile
uyum gösteren sonuçlar ortaya çıkmıştır.
Çalışmamızda deneylerin başarıya ulaşma ölçütleri aşağıdaki gibidir:
•
Transforme olmuş K. lactis hücrelerinin, gerçekleştirilen transformasyonla
seçici besiyerlerinde gösterdikleri büyüme arasındaki tutarlılık.
•
Pasajlanan,
telomeraz
enziminden
yoksun
K.
lactis
hücrelerinin
mikroskobik fenotipleri ile telomer uzunluğu arasındaki korelasyonun tutarlı olması.
•
Telomer
devamlılığının
rekombinasyon
işlemi
ile
gerçekleştiğini
açıklayabilmek için, izleyici gen olarak kullanılan URA3 geninin varlığının seçici
besiyerlerinde pasajlama ile belirlenmesi.
Seri pasajlamalar sonucunda, hücrelerde HIS3TER1 plasmidinin kaybıyla
dereceli telomer kısalması ve bunun fenotipik yansıması olarak kötüleşen koloni
fenotipleri görülmüş, bazı kolonilerde URA3 işaretli mutant telomerik tekrarların
rekombinasyon yoluyla yayılmasının ardından tekrar iyileşen koloni fenotipleri
saptanmıştır (Şekil 4 ve 5).
lv
Şekil 7’de alınan görüntüler, DNA izolasyonlarının başarılı bir şekilde
gerçekleştirildiğini göstermekte ancak alınan DNA bandlarının transformasyonda
kullanılan mutant telomerik fragmanlara ait olup olmadıkları hakkında bir fikir
vermemektedir. DNA bantlarının hangilerinin mutant telomerik tekrarlara ait
olduğunu anlamak amacıyla, Şekil 8’de sonuçları görülen Southern Blot ve KL-125
telomerik oligo probu ile hibridizasyon işlemleri gerçekleştirilmiştir.
KL-125 probu ile alınan membran görüntüleri, telomerik bölgeye ait DNA
bandlarının varlığını göstermesinin yanı sıra diğer bir önemli bulguyu daha
sağlamaktadır. “Gereç ve Yöntem” bölümünde ayrıntılı olarak tanımlandığı gibi
yapılan tek ve çift restriksiyonel enzim analizleri mutant telomerik tekrarların
dağılımlarını göstermektedir. Tablo 7’de rekombinasyonel dağılım verileri analiz
edilen 24 altklondan 9 tanesinde (~%38) mutant telomerik tekrarların yayıldığı
belirlenmiştir. Bu oran Bcl transformantları için yaklaşık %10 dur (80).
Transformantların oluşturulması esnasında orijinal telomerik tekrar üzerindeki farklı
mutasyonlar, telomerik uzama mekanizmasında farklı etkiler yaratabileceğinden telomerik proteinlerin bağlanma bölgelerindeki değişikliklerin olasılıkla farklı
sonuçlar doğurması- mutant telomerik tekrarların yayılım oranı da Acc ve Bcl
transformantları arasında farklılık göstermektedir (50). Bunun dışında telomerik
dizinin boyca önemi de bu iki mutant arasındaki farklı dağılım oranının bir nedeni
olabilir. Sonuç olarak Bcl mutasyonunun fenotip üzerinde etkisiz, Acc mutasyonun
da hızlı ve önemli derecede telomer uzamasına neden olduğu bilindiğinden, Acc
transformantlarında elde ettiğimiz %38’lik mutant telomerik takrar dağılımı
sonucunun, Topcu z ve ark (80) tarafından Bcl transformantlarında saptanan %10’luk
dağılım sonucu ile benzer olması beklenmemektedir.
lvi
Şekil 8’de hibridizasyon fotoğraflarından da anlaşılacağı gibi, rekombinasyon
sonucu farklı kolonilerin telomerleri ya da aynı koloninin farklı telomerleri arasında
telomer uzamasının oranında farklılık olabilir. Bu durum, tek bir mutant telomerik
tekrar diğer telomerler arasında yayılım gösterirken, rekombinasyon işleminin
rasgele gerçekleşiyor olmasının doğal bir sonucudur.
DNA izolasyonu yapılan K. lactis transformantlarının HIS ve URA genlerini
taşıyıp taşımadıklarının saptanması için histidin veya urasil içermeyen besiyeri
ortamına pasajlanmaları sonucu Tablo 8’deki veriler elde edilmiştir. Beklendiği gibi
tüm transformantlar 1. kuşakta her iki geni de taşımaktadırlar. TER1 geni ile aynı
plazmitte yer alan HIS geninin sonraki pasajlamalarda kaybının saptanması o
altklonun TER1 genini de kaybettiğini ve telomeraz aktivitesine sahip olmadığını
göstermektedir. Transforme edilen mutant telomerik tekrarların subtelomerik
bölgesine yerleştirilmiş URA3 geni ise mutant telomerik tekrarların dağılımının
işareti olduğundan, seri pasajlamalar sonucunda URA3 geninin dağılımı DNA
rekombinasyon hızının bir ölçüsüdür. WA2 transformantının 6. kuşakta analiz edilen
12 koloniden sadece 1 tanesinin HIS geni, 6 tanesini de URA geni taşıdığı
görülmektedir. A2 transformantının 6. kuşakta analiz edilen 12 koloniden hiçbirinin
HIS geni taşımadığı, 2 tanesinin URA geni taşıdığı belirlenmiştir. A4
transformantının 6. kuşakta analiz edilen 3 koloniden hiçbirinin HIS geni taşımadığı,
sadece 1 koloninin URA geni taşıdığı görülmektedir.
Kanser prognozunda telomerik uzamanın öneminin fark edilmesiyle birlikte,
antikanser tedavi stratejisinde, telomer ve telomeraz umut vaat edici ilaç hedefleri
olarak gündeme gelmiştir. Bu stratejiler, tümör hücrelerinin büyük çoğunluğunda
belirlenen telomeraz aktivitesi nedeniyle, tümör spesifik immünoterapi, telomeraz
hedefli tümör spesifik gen terapisi, telomerazın RNA bileşenini ya da katalitik alt
lvii
ünitesini hedef alan ilaç molekülleri, telomer-telomeraz kompleksi içinde yer alan
telomerik proteinleri hedefleyen ilaç moleküllerinin tasarım çalışmaları gibi,
çoğunlukla telomerazın aktivitesini inhibe etmeye yöneliktir (61,62,70). Ancak bu
stratejilerin tümör hücrelerinin %10-15’inde görülen ALT mekanizması üzerinde
etkisiz olması, bazı tümörlerin sadece tek mekanizmayı hedefleyen stratejilere direnç
geliştirebilme ihtimalini ve ek tedavi stratejilerinin gerekliliğini ortaya çıkarmaktadır
(61,62,69).
Telomeraz aktivitesi ve ALT mekanizmalarını birlikte kullanan heterojen
tümörlerde telomeraz inhibitörlerinin kullanımının, tedavide yaratabileceği iki
problem dikkat çekmektedir. Birincisi, telomeraz inhibitörü ALT mekanizması
üzerinde etkisiz olacağından tedavi %100 başarılı olmayacaktır. İkincisi ise,
telomeraz aktivitesinin inhibe edilmesinin, ALT mekanizmasını kullanan tümör
hücreleri üzerinde seçici bir avantaj sağlayabileceği teorisidir (58,69). Buna ilişkin
yapılan iki çalışmada DNA hatalı eşleşme onarım (Mismatch Repair) mekanizmasına
sahip olmayan kolon kanseri hücrelerinde telomeraz aktivitesi inhibisyonu
sonucunda ALT mekanizmasının karakteristik telomer yapısına sahip olmayan
telomer uzaması gerçekleştiği ve telomeraz enziminin yeniden aktive olduğu
saptanmıştır. Bunun nedeni, bu hücrelerin ALT mekanizması için gerekli bazı DNA
onarım proteinlerinden yoksun olmalarıyla açıklanmıştır (2). Telomeraz pozitif
ölümsüz insan fibroblast hücreleriyle gerçekleştirilen bir diğer çalışmada da
telomeraz inhibisyonu sonucunda benzer sonuçlar alınmış ayrıca APB’lerin (“ALTassociated Promyelocytic leukemia (PML) Bodies (APBs)”) eksprese edilmediği
saptanmıştır (24). Bazı telomeraz negatif insan tümör hücrelerinde ise, ALT
aktivitesinin uzun ve heterojen telomer yapısı ve APB’ler gibi karakteristik
özelliklerine sahip olmayan telomer uzamasının belirlenmesi, birden fazla ALT
lviii
mekanizmasının
olabileceğini
ve
bilinen
ALT
işaretlerinin
mekanizmanın
tanımlanması için yeterli olmayabileceğini akla getirmektedir (13,39). Daha önce
tanımlanmış olan insan ALT hücrelerindeki telomer yapısı Tip II S. cerevisiae PSS
hücrelerine (yalnızca telomerik tekrar dizilerinden oluşan) benzer yapıda olduğu
halde Marciniak ve ark. tarafından insan ALT hücre hattıyla yapılan bir çalışmada,
Tip I PSS hücrelerinin telomer yapılarına benzer yapıda (telomerik tekrarlara ve
subtelomerik Y’ elemanına sahip olan) telomer dizileri saptanmıştır. Bu hücrelerin,
telomerik rekombinasyona ilişkin işaretler taşıdığı halde APB elemanlarına sahip
olmadığı belirlenmiştir (46).
Başarılı bir telomer hedefli antikanser tedavi için, telomeraz ve ALT
inhibitörlerinin kombine kullanımı en uygun strateji olacaktır. Bu nedenle ALT
mekanizmasındaki moleküler bileşenlerin karekterizasyonu, ilaç hedefi olarak yeni
ALT inhibitörlerinin tanımlanması açısından oldukça önemlidir. Ayrıca her iki
telomer uzaması mekanizmasının da hedefi telomerler olduğundan, iki mekanizmada
da yer alan proteinlerin tanımlanarak ilaç hedefi olarak gündeme gelmesi ve iki
mekanizmanın tek bir molekülle inhibe edilmesi de mümkündür (58,61,68).
Telomeraz inhibitörlerinin uzun süreli kullanımının, kök hücreler, germinal
hücreler, kütanöz hücreler, immün ve hematopoietik sistem hücreleri gibi yüksek
proliferasyon gösteren hücreler üzerinde toksik bir etki oluşturacağı öngörülmektedir
(61). Ancak kanser hücreleri normal hücrelerden daha hızlı çoğaldığı ve bunun
sonucu olarak da daha kısa telomerlere sahip olduğu için, anti-telomeraz stratejinin
öncelikli hedefi olacaktır (62).
Kanser hücrelerinde telomer uzaması mekanizmalarının moleküler temelinin
anlaşılması kadar önemli olan bir nokta ise normal hücrelerde bu mekanizmaların
nasıl baskılandığının anlaşılmasıdır (68). Normal hücrelerin telomer devamlılığını
lix
sağlayamamalarından da anlaşılacağı üzere ALT mekanizmasının somatik hücrelerde
baskılandığı gösterilmiştir (63). Ancak bazı telomeraz-pozitif hücreler de ALT
mekanizmasını baskılayabilmektedirler. ALT hücre hattı ve telomeraz-pozitif hücre
hattının füzyonu sonucunda, telomer devamlılığını sağlayabilen ancak karakteristik
ALT telomerik yapısına sahip olmayan hibritler meydana gelmiştir (63,68).
lx
BÖLÜM V
SONUÇ VE ÖNERİLER
Çalışmamızda “Roll and Spread Model”de de öne sürüldüğü şekilde tek bir
mutant telomerik tekrarın telomeraz aktivitesine sahip olmayan mutant bir K.
lactis’te rekombinasyon yoluyla telomer uzamasına neden olabileceği saptanmıştır.
Telomerler ve insan hastalıkları arasındaki bağlantının anlaşılması için, telomer
fonksiyon kaybının, hücre büyümesini bloke etmek ve hücrelerin bu sorunun
üstesinden
gelebilmek
amacıyla
kullandıkları
mekanizmaların
anlaşılması
gerekmektedir. Tümör hücrelerinin telomerik dizileri koruma yetenekleri, anti-kanser
ilaç geliştirme çalışmaları için önemli bir hedeftir ve insan somatik hücrelerinde
telomerik kısalma tümör-baskılayıcı adaptasyon olarak değerlendirilmelidir.
Başarılı bir telomer hedefli antikanser tedavi için, telomeraz ve ALT
inhibitörlerinin kombine kullanımı en uygun strateji olacaktır. Bu nedenle ALT
mekanizmasındaki moleküler bileşenlerin karekterizasyonu, ilaç hedefi olarak yeni
ALT inhibitörlerinin tanımlanması açısından oldukça önemlidir. Ayrıca her iki
telomer uzaması mekanizmasının da hedefi telomerler olduğundan, iki mekanizmada
da yer alan proteinlerin tanımlanarak ilaç hedefi olarak gündeme gelmesi ve iki
mekanizmanın tek bir molekülle inhibe edilmesi de mümkündür (58,61,68).
Kanser hücrelerinde telomer uzaması mekanizmalarının moleküler temelinin
anlaşılması kadar önemli olan bir nokta ise normal hücrelerde bu mekanizmaların
lxi
nasıl baskılandığının anlaşılmasıdır (68). ALT inhibitörleri geliştirilebilmesi için
baskılanma mekanizmalarının bileşenleri de, yeni hedefler olacaktır.
lxii
BÖLÜM VI
ÖZET
Telomerler ökaryotik kromozom uçlarında bulunan, DNA ve proteinden oluşan
yapılardır. Kanser ve insan eşey hücreleri de dahil olmak üzere ölümsüz ökaryotik
hücrelerde telomer devamlılığı telomeraz enzimi ile sağlanır. Ancak telomer
boylarının devamlılığının sağlanmasında telomeraz enzimi dışında “Alternatif
Telomer Uzaması” olarak adlandırılan başka mekanizmaların da var olduğu
düşünülmekte, ancak bu mekanizmalar hakkında çok az şey bilinmektedir.
Çalışmamız, insan telomerik yapılarına benzerliği ile bilinen Kluyveromyces lactis
modeliyle telomerazdan bağımsız telomer devamlılığını ve bunun farmasötik
önemini araştırmayı amaçlamıştır. Telomer, telomeraz ve bu enzimin etkileşimde
bulunduğu telomerik proteinler, umut verici antikarsinojenik ilaç hedefleri olarak
değerlendirildiğinden, sonuçlarımız, alternatif telomer uzaması mekanizmalarının,
antikanser tedavi stratejilerinin hedefi olarak kullanılması konusunda yeni tartışmalar
açacaktır.
lxiii
ABSTRACT
Telomeres are the DNA-protein complexes found at the ends of eukaryotic
chromosomes. Most immortal cells, including cancer cells and human germinal cells
maintain the telomeric length by the enzyme, telomerase. However, the telomeric
length maintenance is also thought to be carried out by the pathways called
“Alternative Lengthening of Telomeres /ALT” other than telomerase but little is
known about the mechanism of these alternative pathways. This thesis aimed to
study telomerase-independent telomere maintenance pathway and its pharmaceutical
significance using the yeast Kluyveromyces lactis, as a model organism, with
considerable similarity to human telomeres. Because of the telomere, telomerase and
a number of telomerase-interacting proteins are currently considered as the potential
targets of anticancer drugs, our results will trigger new discussions in relation to
employment of these alternative telomere maintenence mechanisms as the targets of
anti-cancer therapy strategies.
lxiv
BÖLÜM VII
KAYNAKLAR
1. Baur, J. A., Y. Zou, ve ark. (2001). "Telomere position effect in human
cells." Science 292(5524): 2075-7.
2. Bechter, O. E., Y. Zou, ve ark. (2004). "Telomeric recombination in
mismatch repair deficient human colon cancer cells after telomerase
inhibition." Cancer Res 64(10): 3444-51.
3. Blackburn, E. H. (1990). "Telomeres and their synthesis." Science 249(4968):
489-90.
4. Blackburn, E. H. (1990). "Telomeres: structure and synthesis." J Biol Chem
265(11): 5919-21.
5. Blackburn, E. H. (1991). "Structure and function of telomeres." Nature
350(6319): 569-73.
6. Blackburn, E. H. (1991). "Telomeres." Trends Biochem Sci 16(10): 378-81.
7. Blackburn, E. H. (1994). "Telomeres: no end in sight." Cell 77(5): 621-3.
8. Blackburn, E. H. (2000). "Telomere states and cell fates." Nature 408(6808):
53-6.
9. Blackburn, E. H. (2001). "Switching and signaling at the telomere." Cell
106(6): 661-73.
10. Blackburn, E. H. (2005). "Telomeres and telomerase: their mechanisms of
action and the effects of altering their functions." FEBS Lett 579(4): 859-62.
lxv
11. Blackburn, E. H. and J. G. Gall (1978). "A tandemly repeated sequence at the
termini of the extrachromosomal ribosomal RNA genes in Tetrahymena." J
Mol Biol 120(1): 33-53.
12. Bryan, T. M., A. Englezou, ve ark. (1995). "Telomere elongation in immortal
human cells without detectable telomerase activity." Embo J 14(17): 4240-8.
13. Cerone, M. A., C. Autexier, ve ark. (2005). "A human cell line that maintains
telomeres in the absence of telomerase and of key markers of ALT."
Oncogene 24(53): 7893-901.
14. Cesare, A. J. and J. D. Griffith (2004). "Telomeric DNA in ALT cells is
characterized by free telomeric circles and heterogeneous t-loops." Mol Cell
Biol 24(22): 9948-57.
15. Chan, S. R. and E. H. Blackburn (2004). "Telomeres and telomerase." Philos
Trans R Soc Lond B Biol Sci 359(1441): 109-21.
16. Chen, Q., A. Ijpma, ve ark. (2001). "Two survivor pathways that allow
growth in the absence of telomerase are generated by distinct telomere
recombination events." Mol Cell Biol 21(5): 1819-27.
17. Church, G. M. and W. Gilbert (1984). "Genomic sequencing." Proc Natl
Acad Sci U S A 81(7): 1991-5.
18. Colgin, L. M. and R. R. Reddel (1999). "Telomere maintenance mechanisms
and cellular immortalization." Curr Opin Genet Dev 9(1): 97-103.
19. Collins, K. and J. R. Mitchell (2002). "Telomerase in the human organism."
Oncogene 21(4): 564-79.
20. de Bruin, D., S. M. Kantrow, ve ark. (2000). "Telomere folding is required
for the stable maintenance of telomere position effects in yeast." Mol Cell
Biol 20(21): 7991-8000.
lxvi
21. Dubrana, K., S. Perrod, ve ark. (2001). "Turning telomeres off and on." Curr
Opin Cell Biol 13(3): 281-9.
22. Dunham, M. A., A. A. Neumann, ve ark. (2000). "Telomere maintenance by
recombination in human cells." Nat Genet 26(4): 447-50.
23. Evans, S. K., A. A. Bertuch, ve ark. (1999). "Telomeres and telomerase: at
the end, it all comes together." Trends Cell Biol 9(8): 329-31.
24. Fasching, C. L., K. Bower, ve ark. (2005). "Telomerase-independent telomere
length maintenance in the absence of alternative lengthening of telomeresassociated promyelocytic leukemia bodies." Cancer Res 65(7): 2722-9.
25. Greider, C. W. and E. H. Blackburn (1996). "Telomeres, telomerase and
cancer." Sci Am 274(2): 92-7.
26. Griffith, J. D., L. Comeau, ve ark. (1999). "Mammalian telomeres end in a
large duplex loop." Cell 97(4): 503-14.
27. Groff-Vindman, C., A. J. Cesare, ve ark. (2005). "Recombination at long
mutant telomeres produces tiny single- and double-stranded telomeric
circles." Mol Cell Biol 25(11): 4406-12.
28. Grunstein, M. (1997). "Molecular model for telomeric heterochromatin in
yeast." Curr Opin Cell Biol 9(3): 383-7.
29. Harley, C. B., A. B. Futcher, ve ark. (1990). "Telomeres shorten during
ageing of human fibroblasts." Nature 345(6274): 458-60.
30. Hastie, N. D., M. Dempster, ve ark. (1990). "Telomere reduction in human
colorectal carcinoma and with ageing." Nature 346(6287): 866-8
31. Henson, J. D., J. A. Hannay, ve ark. (2005). "A robust assay for alternative
lengthening of telomeres in tumors shows the significance of alternative
lxvii
lengthening of telomeres in sarcomas and astrocytomas." Clin Cancer Res
11(1): 217-25.
32. Henson, J. D., A. A. Neumann, ve ark. (2002). "Alternative lengthening of
telomeres in mammalian cells." Oncogene 21(4): 598-610.
33. Iyer, S., A. D. Chadha, ve ark. (2005). "A mutation in the STN1 gene triggers
an alternative lengthening of telomere-like runaway recombinational telomere
elongation and rapid deletion in yeast." Mol Cell Biol 25(18): 8064-73.
34. Kim, N. W., M. A. Piatyszek, ve ark. (1994). "Specific association of human
telomerase activity with immortal cells and cancer." Science 266(5193):
2011-5.
35. Kim Sh, S. H., P. Kaminker, ve ark. (2002). "Telomeres, aging and cancer: in
search of a happy ending." Oncogene 21(4): 503-11.
36. Klugs W. S., Cummings M. R., Genetik, Palme yayıncılık, Ankara, 2003,
338-339.
37. Konig, P. and D. Rhodes (1997). "Recognition of telomeric DNA." Trends
Biochem Sci 22(2): 43-7.
38. Krauskopf, A. and E. H. Blackburn (1998). "Rap1 protein regulates telomere
turnover in yeast." Proc Natl Acad Sci U S A 95(21): 12486-91.
39. Kumakura, S., T. W. Tsutsui, ve ark. (2005). "Reversible conversion of
immortal human cells from telomerase-positive to telomerase-negative cells."
Cancer Res 65(7): 2778-86.
40. Londono-Vallejo, J. A., H. Der-Sarkissian, ve ark. (2004). "Alternative
lengthening of telomeres is characterized by high rates of telomeric
exchange." Cancer Res 64(7): 2324-7.
lxviii
41. Lundblad, V. (2000). "Telomeres: a tale of ends." Nature 403(6766): 149,
151.
42. Lundblad, V. (2002). "Telomere maintenance without telomerase." Oncogene
21(4): 522-31.
43. Lundblad, V. (2003). “Taking the measure” Nature 423(6943):926-7.
44. Lundblad, V. (2003). "Telomere replication: an Est fest." Curr Biol 13(11):
R439-41.
45. Lundblad, V. and E. H. Blackburn (1993). "An alternative pathway for yeast
telomere maintenance rescues est1- senescence." Cell 73(2): 347-60.
46. Marciniak, R. A., D. Cavazos, ve ark. (2005). "A novel telomere structure in
a human alternative lengthening of telomeres cell line." Cancer Res 65(7):
2730-7.
47. McEachern, M. J. and E. H. Blackburn (1995). "Runaway telomere
elongation caused by telomerase RNA gene mutations." Nature 376(6539):
403-9.
48. McEachern, M. J., Blackburn, E. H., (1996). “Cap-prevented recombination
between terminal telomeric repeat arrays (telomere CPR) maintains telomeres
in Kluyveromyces lactis lacking telomerase” Genes Dev. 10:1822-34.
49. McEachern, M. J. and J. E. Haber (2006). "Break-induced replication and
recombinational telomere elongation in yeast." Annu Rev Biochem 75: 11135.
50. McEachern, M. J. and S. Iyer (2001). "Short telomeres in yeast are highly
recombinogenic." Mol Cell 7(4): 695-704.
51. McEachern, M. J., A. Krauskopf, ve ark. (2000). "Telomeres and their
control." Annu Rev Genet 34: 331-358.
lxix
52. McEachern, M. J., D. H. Underwood, ve ark. (2002). "Dynamics of telomeric
DNA turnover in yeast." Genetics 160(1): 63-73.
53. Muntoni, A., Reddel, R.R. (2005). “The first molecular details of ALT in
human tumor cells.” Human Molecular Genetics 14(2):191-6.
54. Murnane, J. P., L. Sabatier, ve ark. (1994). "Telomere dynamics in an
immortal human cell line." Embo J 13(20): 4953-62.
55. Nakamura, T. M., J. P. Cooper, ve ark. (1998). "Two modes of survival of
fission yeast without telomerase." Science 282(5388): 493-6.
56. Natarajan, S., C. Groff-Vindman, ve ark. (2003). "Factors influencing the
recombinational expansion and spread of telomeric tandem arrays in
Kluyveromyces lactis." Eukaryot Cell 2(5): 1115-27.
57. Natarajan, S. and M. J. McEachern (2002). "Recombinational telomere
elongation promoted by DNA circles." Mol Cell Biol 22(13): 4512-21.
58. Neumann, A. A. and R. R. Reddel (2002). "Telomere maintenance and cancer
-- look, no telomerase." Nat Rev Cancer 2(11): 879-84.
59. Nickles,
K.
and
M.
J.
McEachern
(2004).
"Characterization
of
Kluyveromyces lactis subtelomeric sequences including a distal element with
strong purine/pyrimidine strand bias." Yeast 21(10): 813-30.
60. Nugent, C. I. and V. Lundblad (1998). "The telomerase reverse transcriptase:
components and regulation." Genes Dev 12(8): 1073-85.
61. Olaussen, K. A., K. Dubrana, ve ark. (2006). "Telomeres and telomerase as
targets for anticancer drug development." Crit Rev Oncol Hematol 57(3):
191-214.
lxx
62. Pendino, F., I. Tarkanyi, ve ark. (2006). "Telomeres and telomerase:
Pharmacological targets for new anticancer strategies?" Curr Cancer Drug
Targets 6(2): 147-80.
63. Perrem, K., T. M. Bryan, ve ark. (1999). "Repression of an alternative
mechanism for lengthening of telomeres in somatic cell hybrids." Oncogene
18(22): 3383-90.
64. Prescott, J. and E. H. Blackburn (1997). "Functionally interacting telomerase
RNAs in the yeast telomerase complex." Genes Dev 11(21): 2790-800.
65. Price, C., (2001). “How many proteins does it take to maintain a telomere?”
Trends in Genetics 17(8):437-8.
66. Reddel, R. R. (2000). "The role of senescence and immortalization in
carcinogenesis." Carcinogenesis 21(3): 477-84.
67. Reddel, R. R. (2003). "Alternative lengthening of telomeres, telomerase, and
cancer." Cancer Lett 194(2): 155-62.
68. Reddel, R.R., Bryan, T.M., ve ark. (2001). “Alternative lengthening of
telomeres in human cells.” Radiation Research 155:194-200.
69. Reddel, R.R., Bryan T.M.., (2003). "Alternative lengthening of telomeres:
dangerous road less travelled.” The Lancet 361:1840-1.
70. Rezler, E. M., D. J. Bearss, ve ark. (2002). "Telomeres and telomerases as
drug targets." Curr Opin Pharmacol 2(4): 415-23.
71. Roy, J., T. B. Fulton, ve ark. (1998). "Specific telomerase RNA residues
distant from the template are essential for telomerase function." Genes Dev
12(20): 3286-300.
72. Sambrook, J., Fritsch, E. F. and Maniatis, T. (1989). “Molecular Cloning” 2nd
ed. Cold Spring Harbor Laboratory Press, N.Y.
lxxi
73. Scheel, C. and C. Poremba (2002). "Telomere lengthening in telomerasenegative cells: the ends are coming together." Virchows Arch 440(6): 573-82.
74. Stewart, S. A. and R. A. Weinberg (2002). "Senescence: does it all happen at
the ends?" Oncogene 21(4): 627-30.
75. Tarsounas, M. and S. C. West (2005). "Recombination at mammalian
telomeres: an alternative mechanism for telomere protection and elongation."
Cell Cycle 4(5): 672-4.
76. Teixeira, M. T. and E. Gilson (2005). "Telomere maintenance, function and
evolution: the yeast paradigm." Chromosome Res 13(5): 535-48.
77. Teng, S. C., J. Chang, ve ark. (2000). "Telomerase-independent lengthening
of yeast telomeres occurs by an abrupt Rad50p-dependent, Rif-inhibited
recombinational process." Mol Cell 6(4): 947-52.
78. Teng, S. C. and V. A. Zakian (1999). "Telomere-telomere recombination is
an efficient bypass pathway for telomere maintenance in Saccharomyces
cerevisiae." Mol Cell Biol 19(12): 8083-93.
79. Tomaska, L., M. J. McEachern, ve ark. (2004). "Alternatives to telomerase:
keeping linear chromosomes via telomeric circles." FEBS Lett 567(1): 142-6.
80. Topcu, Z., K. Nickles, ve ark. (2005). "Abrupt disruption of capping and a
single source for recombinationally elongated telomeres in Kluyveromyces
lactis." Proc Natl Acad Sci U S A 102(9): 3348-53.
81. Underwood, D. H., C. Carroll, ve ark. (2004). "Genetic dissection of the
Kluyveromyces lactis telomere and evidence for telomere capping defects in
TER1 mutants with long telomeres." Eukaryot Cell 3(2): 369-84.
lxxii
82. Underwood, D. H. and M. J. McEachern (2001). "Totally mutant telomeres:
single-step mutagenesis of tandem repeat DNA sequences." Biotechniques
30(5): 934-5, 938.
83. Wang, R. C., A. Smogorzewska, ve ark. (2004). "Homologous recombination
generates T-loop-sized deletions at human telomeres." Cell 119(3): 355-68.
84. Wang, S. S. and V. A. Zakian (1990). "Telomere-telomere recombination
provides an express pathway for telomere acquisition." Nature 345(6274):
456-8.
85. Wray, L. V., Jr., M. M. Witte, ve ark. (1987). "Characterization of a positive
regulatory gene, LAC9, that controls induction of the lactose-galactose
regulon of Kluyveromyces lactis: structural and functional relationships to
GAL4 of Saccharomyces cerevisiae." Mol Cell Biol 7(3): 1111-21.
86. Zakian, V. A. (1995). "Telomeres: beginning to understand the end." Science
270(5242): 1601-7.
87. Zakian, V. A. (1996). "Telomere functions: lessons from yeast." Trends Cell
Biol 6(1): 29-33.
88. Zakian, V. A. (1997). "Life and cancer without telomerase." Cell 91(1): 1-3.
lxxiii
ÖZGEÇMİŞ
1997 yılında
Ege Üniversitesi Eczacılık Fakültesi’nde lisans eğitimime
başladım ve 2001 yılında mezun oldum. 2002-2004 yılları arasında aynı fakültede
Farmasötik Mikrobiyoloji Anabilim Dalı’nda yüksek lisans eğitimimi tamamladım.
2004 yılında alan değiştirerek aynı fakültede Farmasötik Biyoteknoloji Anabilim
Dalı’nda tekrar yüksek lisans eğitimime başladım ve 2004 yılından beri Ege
Üniversitesi Eczacılık Fakültesi Farmasötik Biyoteknoloji Anabilim Dalı’nda
araştırma görevlisi olarak görev yapmaktayım.
lxxiv