SAKARYA ÜNİVERSİTESİ / METALURJİ VE MALZEME MÜHENDİSLİĞİ
Malzeme
Termodinamiği
Doç.Dr. Kenan YILDIZ
EYLÜL 2012, SAKARYA
1
GİRİŞ – TEMEL KAVRAMLAR
1.1. Termodinamik Kavramı
Termodinamik, fiziksel ve kimyasal dönüşümlerde enerjinin değişimini inceleyen bir bilim
dalıdır. Enerji genellikle kendisini ısı şeklinde belli ettiğinden, termodinamiği ısı
bağıntılarından ve reaksiyonların denge şartlarından bahseden bilim dalı olarak da tarif
edilmektedir.
Başlangıçta ısı ve mekanik enerji arasındaki ilişkileri inceleyen termodinamik, günümüzde en
genel hali ile bir enerji bilimi olarak nitelendirilmektedir.
Termodinamik, fizik ve kimyanın girdiği birçok alana girmektedir. Kimyasal olayların
önceden tahmin edilmesinde, kontrolünde, fizikteki gaz kanunlarında termodinamikten
yararlanılmaktadır. Kimyasal termodinamik kimyasal reaksiyonlardaki enerji değişimlerini,
denge halini ve kimyasal denge çerçevesinde reaksiyonların nasıl gerçekleştiğini
incelemektedir.
Metalurjide ise bu bilim dalı oldukça öneme sahiptir. Cevherden metal üretiminde, kavurma,
kalsinasyon, cevher zenginleştirme, metallerin saf hale getirilmesinde, hidrometalurji,
pirometalurji, elektrometalurji alanlarında, yeni alaşımların meydana getirilmesinde, faz
dönüşümleri, difüzyon, yüzey enerji değişimi, çeşitli içyapı değişimleri ile faz denge
diyagramlarının incelenmesinde termodinamikten büyük oranda faydalanılmaktadır.
Sonuç olarak termodinamik;
Sistemdeki enerjilerin değişimleriyle ve bir sistem içindeki enerjinin dönüşümüyle
ilgilenenen bilim dalıdır
Sistemdeki ısı ve iş ile ve bunların arasındaki ilişkiyi ortaya koyan malzeme özellikleri
ile ilgilenen bilim dalıdır
Sistemde termal enerjinin işe dönüşümüyle ilgilenen bilim dalıdır.
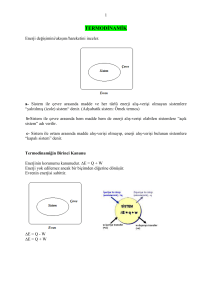
1.2. Sistem ve Özellikleri
Sistem ve Çevre : Belirli bir sınırla çevrilmiş
olan maddeye veya hayali bir alan parçasına
sistem denir. Termodinamik sistem çok defa
maddeden meydana gelmektedir. Bir
sistemin dışında kalan ve sistem ile enerji
veya madde değişimi yapan veya yapmayan
diğer sistem veya sistemlere çevre denir.
Şekil 1.1. Sistem ve çevre
Kapalı Sistem : Çevresi ile enerji değişimi yapan, fakat madde değişimi yapmayan bir
sisteme kapalı sistem denir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 2
Açık Sistem :
Çevresi ile hem enerji hem de madde değişimi yapan bir sisteme denir.
Soyut Sistem :
Çevresi ile hiçbir şekilde enerji alışverişi yapmayan sisteme denir.
Homojen
Sistem :
Her noktasındaki özellikleri eşit olan sistemlere denir.
Heterojen
Sistem :
Birbirinden ayırt edilmesi mümkün olan bölgelerden meydana gelen bir
sistemdir. Örneğin su ve buz aynı zamanda aynı kabın içerisinde bulunursa,
birlikte heterojen sistem meydana getirirler.
Adyabatik
Sistem :
Çevresi ile ısı alışverişi yapmayan fakat iş enerjisi değiştirebilen sistemdir.
Faz :
Fiziksel ve kimyasal özellikleri homojen olan sisteme veya sistem
parçasına faz denir.
Bir sistemin hali, sıcaklık (T), basınç (P), hacim (V) ve kompozisyon gibi hal değişkenleriyle
veya hal özellikleriyle tarif edilmektedir. Heterojen sistemler söz konusu olduğunda partikül
boyut dağılımı ve yüzey alanı gibi ilave değişkenleri de belirtmek gereklidir.
1.3. Termodinamik Durum Denklemi (Hal Denklemi)
Bir sistemin termodinamik durumu, sahip olduğu özellikleri ile tespit olunur. Bu özellikler;
a) Nicelik (Potansiyel) özellikler
b) Nitelik (Kapasite) özellikler
olmak üzere iki çeşittir.
Potansiyel özellikler; basınç, sıcaklık, özgül ağırlık gibi şiddeti ifade eden ve maddenin
durumunu belirten özellikler olup bunlar madde miktarı ile orantılı değildir. Kapasite
özellikleri ise hacim, ağırlık, entropi gibi madde miktarı ile orantılı olan özelliklerdir.
Termodinamik durumun tespit edilebilmesi için söz konusu olan sistemin potansiyel ve
kapasite özelliklerinin bilinmesi gerekmektedir. Bu özellikler arasındaki matematiksel
bağıntıya Termodinamik Durum Denklemi (veya Termodinamik Hal Denklemi) adı verilir.
Kütlesi sabit olan homojen bir sistemin E-enerjisini ifade eden,
(
)
(1-1)
denklemi veya basınç, hacim ve mutlak sıcaklık arasındaki bağıntıyı gösteren,
(
)
(1-2)
şeklindeki fonksiyon, birer termodinamik durum denklemi sayılırlar.
1.4. Gazların ve Buharların Davranışı
Hal özellikleri arasında herhangi bir madde için Hal Denklemi olarak bilinen bir ilişki
mevcuttur. Bu ifade denklem(1-2) de yazılmıştır ve burada basınç (P), hacim (V) ve sıcaklık
(T), maddenin hal özellikleridir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 3
Bir ideal gaz için,
(1-3)
yazılmakta olup burada P gazın mutlak basıncı, V gaz tarafından kaplanan hacim, T gazın
sıcaklığı, n gazın mol sayısı ve R üniversal gaz sabitidir. Gerçek gazlar için P-V-T ilişkisi
ideal gaz kanunu ile karşılaştırıldığında oldukça karmaşıktır. Yüksek sıcaklık ve düşük
basınçlarda ortaya çıkan düşük yoğunluklarda, birçok gaz ideal gaz gibi davranma
eğilimindedir. Daha yüksek basınçlarda ideal gaz davranışından sapma meydana gelir.
1.5. Tersinir ve Tersinir Olmayan Değişimler
Mekanik değişimlerle ilgili olaylarda, hareket halindeki bir cismin veya sistemin hareketsiz
hale gelmesi ile denge kurulmuş olduğu bilinmektedir. Bu taktirde cismin veya sistemin
toplam potansiyel enerjisi en küçük değere ulaşmış bulunur. Fiziksel olayların birçoğunda ve
kimyasal reaksiyonlarda ise denge halini kurmak için farklı şartların yerine getirilmesi
gerekmektedir. Örneğin ısı dengesinin kurulması için sistemin her noktasındaki sıcaklığın eşit
olması, kimyasal dengenin kurulması için ise sistemdeki madde değişiminin durmuş olması
gerekmektedir. Bir sistemde kendiliğinden meydana gelen fiziksel, kimyasal veya mekanik
değişimler, bu sistemin denge halinde olmadığını ifade eder. Bu değişimler deney yolu ile
basınç, sıcaklık, hacim ve bileşim gibi özelliklerin ölçülmesiyle izlenebilir.
Bir sistemin potansiyel özelliklerinde (sıcaklık, basınç, kimyasal potansiyel vb.) çok küçük bir
dI değişimi yapıldığında, çevrede de aynı miktarda bir değişim meydana geliyorsa, ayrıca dI
değişimi sıfıra yaklaştıkça sistem ve çevresi tekrar ilk durumlarına dönmüş olabiliyorsa, böyle
bir değişime Tersinir Değişim (reversible, dönüşümlü) adı verilir. Bu tarifin matematiksel
olarak ifadesi,
(1-4)
şeklindedir. Burada I, potansiyel faktörü göstermektedir. Buna karşılık sistemin potansiyel
faktöründe ΔI değişimi meydana getirildiği ve bunun dI gibi sıfıra yaklaşan çok küçük bir
değere indirilmesi mümkün olmadığı söz konusu ise, diğer bir ifadeyle sistem ile çevresi
arasında daima belirli bir fark kalmakta ise bu çeşit değişime Tersinir Olmayan Değişim veya
Tersinmez Değişim (irreversible, dönüşümsüz) adı verilir. Bu değişimler genellikle belirli bir
hızla meydana gelmekte ve değişim hızı hiçbir zaman sıfıra yaklaşmamaktadır. Bu değişimin
matematiksel ifadesi,
(1-5)
şeklindedir.
1.6. Termodinamik Denge
Bir sistemin potansiyel faktörü ile çevresinin potansiyel faktörü eşit olursa, bu sistem çevresi
ile denge halinde bulunur. O halde denge hali,
(1-6)
denklemi ile gösterilebilir. Termodinamikte denge hali, ancak tersinir değişimlerde söz
konusu olabilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 4
Bir sistemin üç çeşit dengesi olabilir;
a) Devamlı denge
b) Yarı-devamlı denge
c) Geçici denge
Bu üç çeşit denge, Şekil 1.2 de fiziksel bir örnekle gösterilmiştir. Şekil 1.2 de kürenin en
küçük potansiyel enerjiye sahip olduğu A durumu, devamlı denge durumunu temsil
etmektedir. Bundan daha yüksek potansiyel enerjiye sahip olan ve belirli değişimlerden sonra
denge haline gelebilen B durumu yarı devamlı dengeyi göstermekte, C durumu ise iki yönde
yapılacak küçük değişimlerle denge hali bozulan ve eski denge haline gelmeyen durumu
göstermektedir.
Şekil 1.2. Yivli bir yüzey
üzerinde bir kürenin denge
şekilleri.
A:Devamlı denge,
B:Yarı devamlı denge ve
C:Geçici denge
Bir sistemin devamlı denge halinden yarı devamlı denge haline geçmesi veya yarı devamlıdan
devamlı denge haline geçmesi için bu sisteme verilmesi gereken en küçük enerji miktarına
Aktivasyon Enerjisi denir. Şekil 1.2 deki kürenin ağırlığı “M” ile gösterilirse, bu kürenin A
dan B durumuna geçmesi için gereken aktivasyon enerjisi,
(1-7)
olup küre A dan B ye geçerken bir taraftan da,
(1-8)
kadar bir enerji vermektedir. Bu durumda sistemin aldığı net enerji miktarı,
(
)
(1-9)
kadardır. Görülmektedir ki bu değişim ısı alan yani endotermik reaksiyonlara karşılık gelen
bir değişimdir. Şekildeki kürenin B den A durumuna, yani yarı devamlı dengeden devamlı
denge durumuna geçişinde aktivasyon enerjisi,
(1-10)
olup değişimin sonunda sistem,
(
)
(1-11)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 5
kadar bir enerji vermektedir. Bu değişim kimyadaki ekzotermik yani ısı veren reaksiyona
karşılık gelmektedir. A dan B ye geçişte sistemin aldığı enerji, aksi yönde hareket edildiğinde
tekrar sistemden verilmektedir.
İki veya daha fazla maddeden meydana gelen bir sistemde kimyasal reaksiyon basit olarak,
atom, molekül veya iyonların titreşimleri sonucunda gerçekleştiği ifade edilebilir. Titreşimler
madde içerisindeki ısı farklarından ileri gelmektedir. Belirli bir titreşim hali yine belirli bir
enerji seviyesine karşılık gelmektedir. Atom, molekül veya iyonların titreşimleri, aralarındaki
bağlayıcı kuvvetlere göre değişmektedir. Devamlı titreşimler halinde dengede bulunan bir
sisteme dışarıdan ısı enerjisi verilirse titreşimler şiddetlenir ve eğer verilen bu ısı aktivasyon
enerjisine eşit seviyeye ulaşmış ise sistemde kimyasal bir reaksiyon meydana gelmiş olur.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 6
2
TERMODİNAMİĞİN BİRİNCİ KANUNU
2.1. Enerji
Termodinamiğin Birinci Kanunu,
anlatımlarla;
enerjinin korunumu kanununun bir ifadesidir. Diğer
a) Enerji yoktan var edilemez, var olan enerji yok edilemez
b) Enerji bir formdan diğer bir forma taşınabilir veya dönüşebilir, ancak var ya da yok
edilemez
c) Kimyasal ve/veya fiziksel değişimler, enerjideki değişimlerin sonucu meydana gelir
En bilinen enerji türleri olarak Isı enerjisi, İş (veya mekanik enerji), kimyasal enerji, elektrik
enerjisi, nükleer enerji sayılabilir.
Termodinamiğin temel konusu enerjidir. Genel olarak bir cismin veya sistemin iş yapma
kabiliyetine enerji denir. En basit enerji çeşidi mekanik iş olup bu da bir kuvvetin mesafe
katetmesiyle elde edilir. Enerji çeşitleri fazla olmakla birlikte termodinamikte önemli olanları,
Isı Enerjisi = (sıcaklık) x (entropi) = T.S
Kimyasal Enerji = (kimyasal potansiyel) x (kütle) = n.m
Mekanik Enerji = (basınç) x (hacim) = P.V
Genel olarak enerji, iki faktör çarpımına eşittir. Faktörlerden biri kapasite özelliği, diğeri de
potansiyel özellik taşır. Yukarıda belirtilen üç enerjiden başka enerji çeşitleri de
bulunmaktadır. Termodinamik sistemlerde incelenen değişimler genel olarak bu üç çeşit
enerjiden başka enerji çeşitlerinin sabit bulunduğu veya etkileri ihmal edilecek mertebede az
olduğu şartlar içerinde meydana gelmektedir. Bu nedenle özel haller dışında sadece ısı,
kimyasal ve mekanik enerji çeşitleri göz önünde tutulmuştur.
2.2. Mekanik İş (W)
İş (W), bir sistem ile çevresi arasındaki etkileşim olarak tarif edilebilir. Bu etkileşim, enerji
değişimini içermektedir. Birçok iş türü (mekanik, yüzey gerilimi, elektriksel, manyetik vb.)
olmasına karşın burada sadece mekanik iş ile ilgileneceğiz.
Bu amaçla, örnek olarak bir otomobilin silindirindeki sıcak gazların genleşmesini göz önüne
alalım. Sıcak gazlar pistonu yukarıya doğru itecektir. Böylece gazlar tarafından bir iş
gerçekleştirilecektir. Bu iş tipi, genleşme işi olarak bilinmektedir.
Bir başka örnek, bir hava kompresörü yardımıyla havanın sıkıştırılması verilebilir. Hava,
kompresör yardımıyla belirli bir hacime getirilir. Bu örnekteki iş, çevre tarafından sistem
üzerinde gerçekleştirilmektedir ve bu iş türü, sıkıştırma işi olarak bilinmektedir. Bir sistem,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 7
çevresi üzerinde iş gerçekleştirebilir ya da kendi üzerinde iş gerçekleşebilir. Eğer sistem çevre
üzerinde iş gerçekleştiriyorsa W pozitif, aksi durumda, diğer bir ifadeyle iş sistem üzerinde
gerçekleşiyorsa W negatiftir.
Şekil 2.1. Bir gazın tersinir sıkışmasının şematik sunumu
İçerisinde sürtünmesiz bir pistonun hareket ettiği bir silindir (Şekil 2.1) içindeki gazın,
gözlem altındaki sistem olduğunu kabul edelim. Sistem P basıncında, V hacminde ve T
sıcaklığında olup n mol gaz bulunsun. Gazın tersinir olarak sıkıştırıldığını kabul edelim.
Böyle bir proseste, herbir zaman aralığında, uygulanan veya dış basınç (Pe), gazın basıncına
hemen hemen eşittir. Tersinir bir proses esnasında gazın basıncı, sıcaklığı ve yoğunluğu
silindir içinde üniform haldedir. Mekaniksel anlamda yapılan iş,
W (kuvvet) x(katedilen. yol ) A Pe dx
(2-1)
Burada A, pistonun yüzey alanıdır. Bu durumda,
W Pe dV
(2-2)
olacaktır. dV=Adx ifadesi, küçük bir yol kat etmesi sırasındaki hacim değişimidir. Tersinir bir
proseste Pe=P olduğundan,
W P dV
(2-3)
yazılabilir. dV değeri negatif olduğunda dolayı yapılan iş de (δW) negatiftir. δW değeri n
değerine bölündüğünde molar iş elde edilir. Belirli bir andaki gazın molar hacmi Şekil 2-3 de
gösterilmiştir.
Tersinir sıkıştırma prosesinin 1 ile gösterilen bir termodinamik halden 2 ile gösterilen sonuç
termodinamik hale getirilmesi olması durumunda, prosesin yolu P-V diyagramında (Şekil 2.2)
gösterilen eğri şeklindedir. Eğrinin altında yer alan koyu alan, yapılan işi temsil etmektedir.
Prosesin 1 den 2 ye getirilmesinde,
V2
W P dV
(2-4)
V1
denklemi geçerli olup burada W, 1 ve 2 sınırları arasındaki toplam alana eşittir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 8
Şekil 2.2. P-V düzleminde tersinir sıkıştırma prosesini gösteren şematik diyagram
Şekil 2.3. Başlangıç (P1, V1 ve T1) ve son haller (P2, V2 ve T2) arasındaki iki farklı yolu (1A2
ve 1B2) gösteren şematik diyagram
Bir sistem, bir halden diğerine farklı yollarla değişebilir. Diğer bir ifadeyle sistemin
1.halinden 2.haline dönüşümünde, Şekil 2-4 de iki farklı yolun gösterilmesi gibi birkaç farklı
yol bulunabilmektedir. Bu iki yol, 1A2 ve 1B2 olarak isimlendirilmiştir. 1A2 yolu iki farklı
kısım içermektedir. İlk bölümde sistemin hacmi VA(=V2) değerine eşit olana kadar sabit
basınçta sıkıştırılır. İkinci bölümde ise gazın basıncı ve sıcaklığı sırasıyla P2 ve T2 değerlerine
gelinceye kadar sabit hacimde ısıtılır. 1B2 yolu da iki farklı kısım içermektedir. İlk kısımda
gazın basıncı PB (=P2) değerine gelinceye kadar sabit hacimde ısıtılır, ikinci kısımda ise
hacim V2 değerine eşit oluncaya kadar sabit basınçta gaz sıkıştırılır. Bu nedenle sistemde
yapılan iş, bu iki yol için farklıdır. 1A2 yolunun altındaki alan, 1B2 yolunun altındaki alandan
daha azdır. Böylece sistemin termodinamik halinde aynı değişikliği sağlamak için gerekli iş
miktarları farklıdır. İşin bir hal fonksiyonu olmadığı ifade edilebilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 9
2.5. Isı (q)
Bir proseste var olan ısı miktarı (q), önemli bir termodinamik miktardır. Isı, sistemden
çevreye doğru, ya da tersi olacak şekilde, sistemle çevre arasındaki sıcaklık farkı nedeniyle
akar. Sistem tarafından çevreden absorbe edildiğinde ısı pozitif, sistemden çevreye doğru ısı
kaybı söz konusu ise negatiftir. Adyabatik proseste sistemle çevresi arasında ısı alışverişi
yoktur. Diğer bir ifadeyle adyabatik proseslerde q=0 dır.
Isının termodinamik tarifi, her gün kullandığımız anlamdan biraz farklıdır. Termodinamik
problemlerinin çözümünde önemli rol oynamasından dolayı ısının tarifini açıkça yapmak
gerekmektedir.
Isı, belirli bir sıcaklığa sahip bir sistemin sınırından, daha düşük sıcaklığa sahip diğer bir
sisteme (veya çevreye), iki sistem arasındaki sıcaklık farkından dolayı transfer olan bir enerji
formu olarak tarif edilebilir.
Mekanik işin, iki belirli termodinamik hal arasındaki sistem tarafından katedilen yola bağlı
olduğu görülmektedir. q, bir hal fonksiyonu değildir, yani termodinamik koordinatların (P, T
vb.) bir fonksiyonu olarak sunulamaz ve iş gibi prosesin yoluna bağlıdır.
2.6. İç Enerji (E)
Termodinamiğin ilk kanunu, enerjinin korunumu
kanununun yeniden düzenlenmiş bir halidir. Çevre
üzerinde bir işin yapılmadığı, ısı (q) alışverişinin
yapıldığı kapalı bir sistemi göz önüne alalım. İlk
kanuna göre sistemin iç enerjisindeki değişim (ΔE),
(q-W) miktarına eşittir.
E q W
(2-5)
Her ne kadar q ve W, hal fonksiyonları değillerse de, farkları (ΔE) bir hal fonksiyonudur.
Diğer bir ifadeyle E, P ve T gibi termodinamik değişkenlerin bir fonksiyonu olarak
sunulabilir.
Bir hal fonksiyonu veya hal özelliğinin karakteristiklerinden biri, bir döngü prosesinde net bir
değişime uğramamasıdır. Şekil 2.4 de A noktası ile gösterilen termodinamik bir halin
başlangıç noktası olduğu bir döngüyü ele alalım. 1, 2, 3 ve 4 sayılarıyla belirlenmiş dört farklı
kademeyi içeren bir döngü prosesinin sistem olduğunu kabul edelim. Bu döngüde 1 ve 3
kademeleri sabit hacim, 2 ve 4 kademeleri ise sabit basınç kademeleridir. Bu işlemlerin her
biri esnasında sistemin bir miktar ısıyı (q1, q2, q3 ve q4) absorbe ettiğini ve bir miktar da iş
(W1, W2, W3 ve W4) yaptığını kabul edelim. Her bir işleme termodinamiğin birinci kanunu
uygulandığında,
(E)1 q1 W1
(E ) 2 q2 W2
(E ) 3 q3 W3
(E ) 4 q4 W4
Toplam döngüde,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 10
(E) döngü qi Wi
(2-6)
Burada,
q
i
W
q1 q2 q3 q4
i
W1 W2 W3 W4
Şekil 2.4. Dört kademe içeren bir döngü prosesinin şematik sunumu
(E) döngü, sıfırdan küçük, sıfıra eşit ya da sıfırdan büyük bir değerde olabilir. Bu değerin
sıfırdan küçük olduğunu kabul edelim. Bunun anlamı, döngü tamamlanırken her bir zamanda
bir miktar enerji yok olmaktadır. Bu da enerjinin korunumu kanunuyla uyuşmamaktadır. Bu
nedenle (E) döngü değeri sıfırdan küçük olamaz. Denklem (2-6)’nın sağ tarafının değerinin
sıfırdan büyük olduğunu kabul edelim. Bunun anlamı, belirli bir miktar enerjinin oluşmasıdır.
Bu da enerjinin korunumu kanununa zıttır.
(E ) döngü 0 nedeniyle
q W
i
i
sıfıra eşit olmalıdır. Diğer bir ifadeyle bir döngü
prosesinde sistemin iç enerjisi değişmeden kalmaktadır. Sistem, A konumundan B konumuna
bir değişim gösterdiği zaman, iç enerjideki değişim, E ( EB E A ) , bu iki konumun
arasındaki yollardan bağımsızdır. İlk kanun, proses tersinir olsa da olmasa da
uygulanmaktadır. Örneğin ilk kanun aşağıdaki gibi ifade edilebilir;
dE q W
(2-7)
Burada dE bir tam diferansiyel olup proses yolundan bağımsızdır. δq ve δW tam olmayan
diferansiyellerdir ve proses yoluna bağımlıdırlar.
2.7. Tersinir Proseslerde Isı ve İş Değişimleri
2.7.1. İzotermal Proses
Bu proseste sistemin sıcaklığı sabit tutulur. Bununla birlikte proses esnasında basınç ve hacim
değişir. T0 ve T1 de olmak üzere iki izoterm Şekil 2.5 de gösterilmiştir. İdeal gaz kanunundan
yola çıkarak T0 sıcaklığı için,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 11
PV RT0 k 0
(2-8)
yazılabilir. Burada k0 bir sabittir.
Şekil 2.5. Bir P-V diyagramında T0 ve T sıcaklıklarındaki (T>T0) izotermal eğriler
Benzer şekilde T sıcaklığı için,
PV RT k
(2-9)
yazılabilir ki burada k da bir sabittir. T>T0 ve k>k0 olduğunu da kabul edelim. Bir izotermal
proses esnasında yapılan iş,
W PdV
olup ideal gaz için P yerine RT0/V yazıldığında,
W RT0 d (ln V )
halini alır. İntegrasyon yapıldığında,
V
W RT0 d (ln V ) RT0 ln 2
V1
V1
V2
(2-10)
elde edilir. Bu denklem 1 mol gaz içindir. Eğer sistem n mol gaz içermekte ise o zaman
denklem,
V
P
W nRT0 ln 2 nRT0 ln 1
(2-11)
V1
P2
şeklinde yazılır. İdeal bir gaz için, izotermal bir proses esnasında iç enerjide bir değişim
olmaz. Bu nedenle,
V
q W RT0 ln 2
V1
E 0
(2-12)
olur.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 12
2.7.2. Sabit Hacim Prosesi
Sabit hacim prosesinde sistemin basıncı ve sıcaklığı
değişken olup hacmi sabit tutulmaktadır. Şekil 2.6 da
verilen P-V diyagramında bu proses, P eksenine
paralel bir düşey çizgiyle ifade edilmiştir Hacim
sabit kaldığı için,
W 0
olup bunun anlamı sabit hacim prosesinde iş
yapılmamaktadır. İlk kanundan hareketle,
q E
Şekil 2.6. Bir P-V diyagramındaki
sabit hacim prosesi
yazılabilir.
2.7.3. Sabit Basınç (İzobarik) Prosesi
Bu proseste sistemin basıncı sabit
tutulmaktadır. Sistemin sıcaklığı ve hacmi ise
değişkendir. Şekil 2.7 de verilen P-V
diyagramında izobarik proses, bir yatay
çizgiyle tanımlanmıştır.
Sistem bir ideal gaz ise, 1 mol gaz için,
PV RT
veya
R
V T
P
Şekil 2.7. Bir P-V diyagramındaki
izobarik (eşbasınç) proses
olup bu durumda sabit basınçta V, doğrudan T ile orantılıdır. Bu proseste yapılan iş,
W PdV
ve integrasyon sonucu,
2
2
1
1
W PdV P dV PV2 V1
(2-13)
elde edilir.
İç enerjideki değişim,
E E 2 E1
olduğuna göre, ısı değişimi ilk kanun uygulanarak kolaylıkla tespit edilebilir,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 13
qP E W E2 E1 PV2 PV1
qP E2 PV2 E1 PV1
veya diğer bir ifadeyle,
qP H 2 H1 H
elde edilir ki buradaki H yeni bir hal özelliği olup entalpi (veya ısı içeriği) olarak bilinmekte
ve aşağıdaki gibi ifade edilmektedir,
H E PV
(2-14)
Yoğun fazlar için PV çok küçük olduğundan ihmal edilebilir. Bu nedenle yoğun fazlar için,
HE
kabul edilir.
2.7.4. Bir Döngü Prosesindeki İş ve Isı
Yavaşça hareket eden bir pistona sahip bir silindir içinde 1 mol ideal gaz olduğunu kabul
edelim. Bu bizim sistemimiz olsun. Bu sistem bir seri prosese maruz kalacaktır. Bu döngü
prosesini Şekil 2.8 de görebiliriz.
Başlangıç hali = P1, V1, T1 ve E1
Proses 12 = tersinir izotermal proses
Proses 23 = tersinir izobarik (eşbasınç) proses
Proses 31 = tersinir izovolumik (eşhacim) proses
Şekil 2.8. P-V düzleminde bir döngü
prosesi
Proses 12 de yapılan iş, iç enerjideki değişim ve ısı;
W12 RT1 ln V2 / V1
E12 E 2 E1
q12 E 2 E1 RT1 ln V2 / V1
Proses 23 de yapılan iş, iç enerjideki değişim ve ısı;
W23 P2 V1 V2 P2V1 P2V2
E 23 E 3 E 2
q 23 E 3 E 2 P2V1 P2V2
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 14
Proses 31 de yapılan iş, iç enerjideki değişim ve ısı;
W31 0
E 31 E1 E 3
q 31 E1 E 3
Döngü prosesinde yapılan net iş, iç enerjideki değişim ve net ısı;
Wdöngü RT1 ln V2 / V1 P2 V1 V2
E 0
q döngü RT1 ln V2 / V1 P2 V1 V2
Bir döngü prosesinde sistem tarafından yapılan net işin sistem tarafından absorbe edilen net
ısıya eşit olduğu görülmektedir.
Örnek 2.1. Bir sistem, şekilde gösterildiği gibi bir seri proses içermektedir. Sistem, a halinden
b haline acb yolu boyunca değiştiği zaman sisteme 800 J’luk bir ısı akışı olmakta ve sistem
300 J’luk iş yapmaktadır. Buna göre,
a) Sistemin a’dan b’ye adb yoluyla değiştiğini
kabul ederek, sistem tarafından 120 J’luk iş
yapıldığında sisteme akan ısı miktarını
bulunuz.
b) Sistemin b halinden a haline direkt olarak
geri dönüştüğünü kabul ederek, sistem
üzerinde yapılan iş 220 J olduğuna göre, bu
geri
dönüş
esnasında
sistemin
absorblayacağı (alacağı) veya serbest
bırakacağı ısı miktarını bulunuz.
c) Ea=0 ve Ed=400 J kabul edilerek ve
sistemde yapılan işin hacmin yavaşça
değişmesiyle gerçekleşmesi durumunda ad
ve db proses yolunda absorblanan ısıyı
bulunuz.
acb yolu
qacb 800 J
Wacb 300 J
E ab Eacb qacb Wacb 800 300 500 J
E yoldan bağımsızdır.
(a) adb yolu
Wadb 120 J
qadb Eab Wadb 500 120 620 J
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 15
(b) ba yolu
Wba 220 J
Eba E ab 500 J
qba Eba Wba 500 220 720 J
Bu proseste ısı serbest kalmakta, yani açığa çıkmaktadır.
(c) ad ve db yolları
db prosesi sabit hacimde gerçekleşmektedir, yani hacim değişimi yoktur. Bu nedenle yapılan
iş yoktur veya sıfıra eşittir.
Wdb 0
Wadb Wad Wdb Wad 120 J
E ad E d E a 400 J
q ad E ad Wad 400 120 520 J
E ab E ad E db
E db 500 400 100 J
q db E db Wdb 100 0 100 J
Örnek 2.2. Bir g.mol azot, 1000 K de 1 litrelik başlangıç hacminden 5 litrelik bir hacime
tersinir ve izotermal olarak genişlemektedir. Gazın ideal gaz kanununa uyduğu kabul edilerek
genleşme prosesi esnasında yapılan işi lt-atm cinsinden hesaplayınız.
R=0.08206 lt-atm/g.mol.K
PV RT
ve W RT lnV2 / V1 0.08206 1000 ln5 / 1 132.1 lt-atm
2.8. Isı Kapasitesi
Bir sistemin ısı kapasitesi (C), sistemin sıcaklığını 1 derece arttırmak için gerekli ısı miktarı
olarak tarif edilebilir. Sistemin ölçülemeyecek kadar küçük bir proses olduğunu kabul edelim.
Bu proses esnasında ısı sisteme transfer olur, sistem tarafından bir miktar iş yapılır ve iç
enerjide bir miktar değişim olur.
q dE W
İlave olarak prosesin izotermal olmadığı, sıcaklığında dT kadar bir değişim meydana geldiği
kabul edilsin. Bu durumda ısı kapasitesini,
C
q
dT
(2-15)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 16
veya
C lim (q / T )
T 0
şeklinde tarifleyebiliriz. q değerinin bir hal özelliği olmadığını bildiğimize göre q daki bir
değişim tam bir diferansiyelle sunulamaz. Bununla birlikte spesifik proses tipleri için ısı
kapasitesi tanımlaması yapılarak bu zorluğun üstesinden gelinebilir. İki tipte ısı kapasitesi
arasında tercih yapabiliriz. Bunlar sabit basınçtaki ısı kapasitesi (Cp) ve sabit hacimdeki ısı
kapasitesi (Cv) olup,
Cp
q p
(2-16)
dT p
ve
Cv
q v
(2-17)
dTv
şeklinde tanımlayabiliriz. Sabit basınçtaki bir proses için,
q p H p
q p dH p
ve benzer şekilde sabit hacimdeki bir proses için,
qv Ev
qv dEv
ifadeleri geçerlidir. Genel olarak,
Cp
Cv
q p
H
dTp T p
(2-18)
qv
E
dTv T v
(2-19)
Bir maddenin ısı kapasitesi sıcaklıktan önemli derecede etkilenmektedir. Düşük sıcaklıklarda
Cp değeri Cv değerine yaklaşır, mutlak sıfıra yakın sıcaklıklarda hem Cp hem de Cv değeri
sıfıra yaklaşma eğilimindedir.
2.8.1. Cp ile Cv Arasındaki İlişki
Cp ile Cv arasındaki fark 1 mol madde için şu şekildedir;
H E PV
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 17
dH dE d PV
dT dT
dT
CP
dH
dT
CV
ve
C P CV
dE
olduğuna göre,
dT
d PV
dT
Katılar ve sıvılar için d(PV)/dT ifadesi ihmal edilebilir olduğundan CP=CV alınabilir. İdeal
gazlarda PV=RT ifadesinden,
d ( PV )
R
dT
ve
C P CV R
(2-20)
bulunur. Burada R değeri yaklaşık olarak 1,987 cal/mol.derece veya 8,314 jul/mol.derece’dir.
2.9. Tersinir Adyabatik Prosesler
Adyabatik proseslerde sistemle çevresi arasında ısı alışverişi olmadığı için q=0 olup ilk kanun
gereğince dE W dir. Bir mol ideal gaz içeren bir sistemi ele alalım.
W PdV
dE CV dT
Bu durumda,
CV dT PdV
Sistem bir mol ideal gaz olduğundan P=RT/V yazılabilir.
CV dT
CV
RTdV
V
dT
dV
R
T
V
İki farklı hal arasındaki değişimi alarak,
2
CV
1
2
dT
dV
R
T
V
1
T
V
CV ln 2 R ln 1
T1
V2
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 18
veya
T2
T1
CV
V
1
V2
T2 V1
T1 V2
R
(2-21a)
R / CV
(2-21b)
İdeal gaz için CP-CV=R olduğuna göre, her iki tarafı Cv değerine böldüğümüzde,
C P CV
R
CV
CV
CP
R
1
CV
CV
CP
R
kabul edilirse
1 olur. Bu durumda,
CV
CV
T2 V1
T1 V2
1
İdeal gaz denkleminden,
T2 P2V2 V1
T1
P1V1 V2
P2 V1
P1 V2
1
(2-22)
P1V1 P2V2 PV sabit
(2-23)
Bu denklem, tersinir adyabatik bir prosese maruz kalan ideal bir gazın basınç ve hacmi
arasındaki ilişkiyi vermektedir.
Örnek 2.3. 25°C ve 10 atmosferde bulunan 10 lt ideal bir gaz, 1 atm’lik bir basınca
getirilmektedir. Sabit hacimde gazın molar ısı kapasitesi sıcaklıktan bağımsız olup C V=3/2R
dir. Proses,
a) izotermal ve tersinir
b) adyabatik ve tersinir
olarak gerçekleşmesi durumunda yapılan işi, absorbe edilen ısı miktarını, E ve H
değerlerindeki değişimi hesaplayınız.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 19
Çözüm:
n
PaVa
10 10
4.09 mol
RTa 0.0821 298
(a) İzotermal tersinir proses: Gaz, a konumundan b konumuna 298 K de izotermal olarak
gelmektedir. Bu durumda PV değeri sabittir.
Vb
PaVa 10 10
100 litre
Pb
1
İdeal gazın izotermal prosesinde E=0 olduğundan q=W dir.
b
b
dV
100
4.09 8.3144 298 ln
V
10
a
q W PdV nRT
a
q W 23.34 kJ
298 K izoterm eğrisi boyunca a halinden b haline geçerken sistem 23.34 kJ değerinde iş
yapmakta ve sabit sıcaklıktaki çevreden 23.34 kJ ısı absorbe etmektedir.
İdeal gazda H, sadece sıcaklığın bir fonksiyonudur. Bu durumda H=0 olacaktır.
H ab Eab PbVb PaVa PbVb PaVa
nRTb nRTa nRTb Ta 0
(b) Tersinir adyabatik proses: Adyabatik proses, tersinir olarak gerçekleştirilirse, PV
sabittir. Başlangıç noktası a konumundan c konumuna gelinmesinde,
PaVa PcVc ve Vc 10 10 5 / 3
Tc
3/ 5
40 litre
PcVc
1 40
119 K
nR
4.09 0.0821
Proses adyabatik olduğuna göre q=0 dır. Böylece,
c
Eac W nCV dT nCV Tc Ta
a
4.09 1.5 8.3144 119 298 9.13 kJ
Sistem tarafından yapılan iş, sistemin iç enerjisindeki değişimindeki azalıma eşittir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 20
Örnek 2.4. 298 K ve 5 atm basınç altında 1 mol ideal gaz 1 atm basınca kadar genişliyor.
Herbir genişleme için aşağıdaki işlemleri yapınız.
izotermal ve tersinir olarak genişlemedeki işi
izotermal olarak sabit 1 atm dış basınca karşı genişlemedeki işi
adyabatik ve tersinir olarak genişlemedeki işi
adyabatik olarak sabit 1 atm dış basınca karşı genişlemedeki işi esnasında;
1) gazın son sıcaklığını
2) gazın absorbladığı ısı miktarını
3) gazın yaptığı işi
4) gazın iç enerji değişimini hesaplayınız.
5
3
CV R
CP R
2
2
a)
b)
c)
d)
Çözüm:
a) W 2,303 n RT log
P1
P2
W 2,303 1 8,314 298 log
5
4000 J
1
1) izotermal dönüşüm olduğundan T1=T2=298 K
4) izotermal dönüşümde E=0
2-3) E=q-W q = W = 4000 J
b) W PDIŞ V2 V1 PDIŞ V
V
RT
olduğundan
P
RT RT
1 1
PDIŞ RT
W PDIŞ
P1
P2
P2 P1
1 1
W 1 298 8,314 1980 J
1 5
1) izotermal dönüşümde T1=T2=298 K
4) izotermal dönüşümde E=0
2-3) q = W = 1980 J
c) adyabatik tersinir genişlemede
2
T P CP
298
1) 1 1 T2 0, 4 157 K
T2 P2
5
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 21
2) adyabatik dönüşümde q=0
3) W CV T1 T2
3
8,314 298 157 1758 J
2
4) E q W E W 1758 J
d) adyabatik proses
W CV T1 T2 ve W PDIŞ V2 V1
1)
Bu iki denklem birbirine eşitlenirse,
CV T1 T2 PDIŞ V2 V1 P2 V2 V1
RT
RT
CV T1 T2 P2 2 1
P1
P2
T T
3
R T1 T2 R P2 2 1
2
P2 P1
P
3
3
T1 2 T1 T2 T2
2
P1
2
3
1
5
298 298 T2
2
5
2
T2 202,4 203 K
2) adyabatik proseste q = 0
3) W CV T1 T2
3
8,314 298 203 1184 J
2
4) E W 1184 J
Problemler
P1) Bir mol ideal gazın 300 K de ve izotermal koşullarda hacminin 1 m3’den 10 m3’e
genleşmesi sonucu yapılan iş miktarını bulunuz.
P2) 10 mol ideal gaz 300 K ve 10 atm basınçta tutulmaktadır. İzotermal olarak 1 atm basınca
getirildiğinde verilen ısı (q), yapılan iş (W) ve iç enerji değişimlerini (∆E) hesaplayınız.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 22
P3) Bir sistem A halinden B haline yandaki
şekilde verildiği gibi farklı yollarla dönüşmekte,
1.Yolda sisteme 500 J miktarında ısı verildiği
zaman sistem tarafından 200 J değerinde iş
gerçekleşmektedir. Buna göre,
(a) İç enerji değişimini hesaplayınız
(b) 2.Yolda sistem tarafından 100 J değerinde iş
yapılması için sisteme verilen ısı miktarı nedir?
(c) Sistem B halinden A haline 3.yoldan geri
dönmesi durumunda, sistem üzerinde 100 J
değerinde iş yapıldığına göre ısı miktarını
bulunuz.
P4) 273 K ve 1 atm basınçta bulunan bir mol gaz, tersinir olarak aşağıdaki üç olaya maruz
kalmaktadır. Bu üç olay esnasındaki ısı ve iş miktarlarını hesaplayınız. Cv=1.5R
a) sabit basınçta hacminin iki katına çıkarılması
b) daha sonra sabit hacimde basıncının iki katına çıkarılması
c) son olarak P=6,643.10-4 V2+0,6667 yolu boyunca başlangıç haline geri dönmesi
P5) Bir mollük ideal gaz yandaki şekle göre 1 nolu
denge halinden 2 nolu denge haline üç yolla (A, B
ve C) getirilmektedir. 1 nolu haldeki iç enerji 800 J
olup A, B ve C yolları boyunca yapılan iş sırasıyla
120 J, 180 J ve 150 J dür. 2 nolu haldeki iç enerji
değerini ve her üç yoldaki ısı miktarını
hesaplayınız.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 23
3
ENTALPİ – REAKSİYON ISISI
3.1. Maddelerin Oluşum (Teşekkül) Isıları
Bir maddenin entalpisi gibi termodinamik bir özelliğin mutlak değerini ölçmek imkansızdır.
Pratikte bir referans standart hal seçilerek ve standart halin entalpisiyle ilişkili olarak entalpi
hesabı yapılmasıyla bu zorluğun üstesinden gelinmektedir. Bir elementin veya bir bileşiğin
oluşum (teşekkül) entalpisi ya da ısısı, seçilen standart hale bağlı olacaktır. Kolaylık olması
amacıyla aşağıdaki standart haller belirlenmiştir.
1. Katılar: Katı element ve bileşikler için belirli bir sıcaklıktaki ve 1 atm basınçtaki saf madde
standart haldir.
2. Sıvılar: Sıvı element ve bileşikler için belirli bir sıcaklıktaki ve 1 atm basınçtaki saf sıvı
standart haldir.
3. Gazlar: Gaz fazındaki element ve bileşikler için belirli bir sıcaklıkta ve 1 atm basınçta ideal
davranış gösteren saf gaz standart haldir.
Seçilen standart hal öncelikli olarak sıcaklığa bağlıdır. Bu durum bir örnek yardımıyla
açıklanabilir. Titanyum metali göz önüne alındığında, bu metalin iki allotropu (α-Ti ve β-Ti)
bulunmaktadır. α-Ti dan β-Ti fazına dönüşüm 1155°K de gerçekleşir ve 3350 J absorbe eder.
Bu sıcaklığın altında α-Ti, titanyumun en kararlı formudur. Bu sıcaklığın üzerinde ise β-Ti en
kararlı yapı olur. Diğer bir ifadeyle titanyum için standart hal, sıcaklığın 1155°K üzerine
çıkmasıyla α-titanyumdan β-titanyuma değişecektir. Tablo 3.1 de bazı maddeler için teşekkül
ısıları verilmiştir. Tablodan da görüldüğü üzere, elementel halde bulunan (α-Ti, H2 ve Ca için
teşekkül entalpi değerleri sıfırdır. Teşekkül entalpi değerleri bileşikler (CaCO3 gibi) için
mevcut olup rakamsal değerleri negatiftir. Tabloya göre hidrojen normal koşullarda moleküler
halde (H2) bulunur ve bileşik olmadığı için teşekkül entalpi değeri yoktur. Buna karşılık
hidrojeni elementel halde (H) elde etmek isterseniz 218000 J/mol enerji harcamanız
gerekmektedir. Yine tabloya göre Ca, doğada elementel halde bulunmaz, CaO ve CaCO3 olma
eğilimindedir. Bu bileşiklerin oluşması için enerji vermeniz gerekmez. Teşekkül entalpi
değerlerine baktığınızda, CaCO3’ın CaO den daha kararlı olduğu görülecektir.
Tablo 3.1. 298°K de bazı maddelerin oluşum ısıları
Madde
ΔH° (J/mol)
α-Ti
0
Standart hal
β-Ti
3350
H2(g)
0
Standart hal
H(g)
218000
Ca(k)
0
Standart hal
CaO(k)
-634300
CaCO3(k)
-1207130
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 24
3.2. Entalpi Değişimlerinin Hesabı
Bir maddenin sıcaklığındaki değişimle birlikte meydana gelen entalpi değişimi ısı
kapasitesinden hareket edilerek hesaplanabilir. Sabit basınçta,
dH C p dT
(3-1)
İntegrasyon yapıldığında,
T2
H C p dT
T1
C p a bT cT 2
T2
H ( a bT cT 2 )dT
T1
elde edilir.
Örnek 3.1. 25°C de bulunan 1 mol Al2O3 maddesini 100°C ısıtmak için ne kadar ısı
harcanmaktadır?
C P Al 2 O3 27,38 3,08 10 3 T 8,2 105 T 2 cal/mol.K
Çözüm:
398
0
0
H 0 Al 2O3 H 398
H 298
C
P
dT
298
27,38 3,08 10
398
H
0
Al 2O3
3
T 8,2 10 5 T 2 dT
298
H 0Al 2O3 27,38 398 298
3,08 10 3
398 2 298 2
2
1
1
8,2 10 5
398 298
H 0Al 2O3 2738 107,2 691,4 2153,8 cal
Bu durumda 1 mol aluminayı 25°C den 125°C ye ısıtmak için 2153,8 cal ısı harcanmalıdır.
Örnek 3.2. Titanyumun allotropik dönüşümü () 882°C de gerçekleşmektedir ve
dönüşüm ısısı 830 cal/mol’dür. Ergime sıcaklığı 1660°C, ergime ısısı ise 4500 cal/mol’dür.
Titanyumun 927°C deki entalpi değerini bulunuz.
C P Ti 5,28 2,4 10 3 T cal/mol.K
C P Ti 6,91 cal/mol.K
Çözüm: T=927+273=1200 K
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 25
1155
H 1200 H
0
298
C
1200
P Ti
dT H
298
P Ti
dT
1155
5,28 2,4 10 TdT 830 6,91 dT
1155
H1200 0
C
1200
3
298
1155
2,4 10 3
H 1200 5,28 1155 298
1155 2 298 2 830 6,91 1200 1155
2
H1200 4524,96 1494,26 830 310,95 7160 cal/mol
3.3. Hess Kanunu ve Reaksiyon Isısı
Bir kimyasal reaksiyon esnasında açığa çıkan ya da absorbe edilen ısı miktarı, reaksiyonun
gerçekleştiği koşullara ve reaksiyonda yer alan maddelerin miktarlarına bağlıdır. Örnek olarak
aşağıdaki reaksiyonu göz önüne alalım.
2CuFeS2 + 13/2 O2 = 2CuO + Fe2O3 + 4SO2
2 mol kalkopirit (CuFeS2) ile 13/2 mol oksijen sabit sıcaklık ve basınçta reaksiyona girerek 2
mol bakır oksit (kuprik oksit), 1 mol demir oksit (ferrik oksit) ve 4 mol kükürt dioksit
oluştururken açığa çıkan ısı miktarı, sabit basınçtaki reaksiyon ısısı ya da kısaca reaksiyon
ısısı olarak bilinmektedir.
Entalpi bir hal özelliği olup entalpi değişimi, sadece ilk ve son hallere bağlıdır. Hess kanunu,
aynı gerçeği farklı bir yolla sunmaktadır. Bu kanuna göre belirli bir kimyasal reaksiyonla
birlikte oluşan entalpi değişimi, reaksiyon ister bir kademede isterse birkaç kademede
gerçekleşsin aynıdır. Örnek olarak metanın oksidasyonunu ele alalım.
CH4 + 2O2 = CO2 + 2H2O (ΔH1)
İndirekt oksidasyon ya da üç kademeli proses;
CH4 = C + 2H2 (ΔH2)
C + O2 = CO2 (ΔH3)
2H2 + O2 = 2H2O (ΔH4)
Hess kanunu uygulandığında,
ΔH1 = ΔH2 + ΔH3 + ΔH4
bulunur.
Örnek 3.3. Demir oksidi yüksek fırındaki redüksiyonu aşağıda verilen reaksiyonlar yoluyla
gerçekleştiğine göre Fe2O3+3CO=2Fe+3CO2 reaksiyonunun 298 K deki reaksiyon ısısını
hesaplayınız.
(1) 3Fe2O3 + CO = 2Fe3O4 + CO2
0
H 298
12700 cal
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 26
(2) Fe3O4 + CO = 3FeO + CO2
0
H 298
9800 cal
(3) FeO + CO = Fe + CO2
0
H 298
4400 cal
Çözüm:
Temel reaksiyonu elde etmek için (2) nolu reaksiyon 2 ile, (3) nolu reaksiyon işe 6
ile çarpılmalıdır. Bu durumda,
0
3Fe2O3 + CO = 2Fe3O4 + CO2
H 298
12700 cal
2Fe3O4 + 2CO = 6FeO + 2CO2
0
H 298
19600 cal
6FeO + 6CO = 6Fe + 6CO2
0
H 298
26400 cal
Toplam reaksiyon:
3Fe2O3 + 9CO = 6Fe + 9CO2
0
H 298
19500 cal
sadeleştirirsek,
Fe2O3 + 3CO = 2Fe + 3CO2
0
H 298
6500 cal
Örnek 3.4. Aşağıdaki reaksiyonun 1 atm ve 25°C deki standart reaksiyon ısısını hesaplayınız.
3FeO + 2Al = Al2O3 + 3Fe
0
H 298
Al 2O3 400 kcal/mol
0
H 298
FeO 63,3 kcal/mol
Çözüm:
H0298
H
0
ürünler
H
0
reak tan lar
H 0298 H 0298Al2O3 3 H 0298Fe 3 H 0298FeO 2 H 0298Al
Saf bir elementin standart ısısı “sıfır” olduğundan dolayı,
H 0298 H 0298Al2O3 H 0298FeO 400 3 63,3
0
H 298
210,1 kcal/mol
3.4. Reaksiyon Isısının Sıcaklıkla Değişimi (Kirchhoff Kanunu)
Genelde reaksiyon ısısı sıcaklıkla değişmektedir. Kirchhoff kanunu da reaksiyon ısısının
sıcaklığa bağımlılığını miktarsal olarak vermektedir. Endotermik bir reaksiyonu göz önüne
alalım,
aA + bB = mM + nN
Bu reaksiyonun standart ısısı ΔH°298 dir. Daha yüksek bir T1 sıcaklığındaki reaksiyon ısısına
ΔH°T1 diyelim. Bu durumda yukarıdaki reaksiyon için T1 sıcaklığındaki reaksiyon ısısı,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 27
∫
(3-1)
denklemiyle hesaplanırken buradaki ∆Cp değeri, ürünlerin toplam Cp değerinden reaktanların
(reaksiyona girenler) toplam Cp değerinin çıkarılmasıyla elde edilmektedir.
C P
C
P ( ürünler)
C
(3-2)
P( reak tan lar )
Örnek 3.5. Aşağıdaki reaksiyonun 800 K deki entalpi değişiminin bulunuz.
CaO(k) + CO2(g) = CaCO3(k)
0
CP (J/mol.K)
H 298
(kJ)
CaO(k)
-634.3
49.62+4.52x10-3T-6.95x105T-2
CO2(g)
-393.5
44.14+9.04x10-3T-8.54x105T-2
CaCO3(k)
-1206.7
104.52+21.92x10-3T-25.94x105T-2
[
]
[
]
(
)
(
[
(
)
(
(
)
(
)]
)
)
Kirchhoff kanunundan yola çıkarak,
∫
∫ (
)
(
(
)
(
)
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 28
3.5. Yakıtlar ve Yanma Reaksiyonları
Oksijenle reaksiyona girdiğinde endüstriyel işlemler için gereken ısıyı verebilen, özellikle
havanın oksijeni ile reaksiyonu kolaylıkla mümkün olan malzemelere yakıt adı verilmektedir.
Genellikle yanma terimi, herhangi bir maddenin oksijenle birleşmesi anlamında kullanılsa da
özellikle yakıtların reaksiyonu için kullanılmaktadır.
Bir yakıtın tamamen yanarak ihtiva ettiği karbonun tamamı CO2’e dönüşürse, bu tür yanmaya
“tam yanma” denir. Buna karşılık yakıtın yandıktan sonra geride bıraktığı curufta (veya
külde) bir miktar karbon kalmışsa, bu tür yanmalara “tam olmayan yanma” adı verilmektedir.
Gerekli oksijen ihtiyacının sağlanamaması gibi gerekli şartlar sağlanmadığında yakıtın
yanarak CO2 ile birlikte bir miktar da CO vermesine “yetersiz yanma” denilmektedir.
Metalurjik işlemlerde oksijenle birleşmesi sonucu ısı veren elementleri önem sırasına göre C,
H, S, Si, Mn, Al ve P şeklinde sıralamak mümkündür. Bunlardan ilk ikisini teşkil eden C ve
H, ısı veren en önemli elementler olup katı, sıvı ve gaz yakıtların esasını oluşturmaktadır.
Karbon çoğu katı yakıtlarda elmentel halde bulunurken, sıvı ve gaz yakıtlarda bileşik halinde,
hidrojen ise bazı gaz yakıtlarda elementel halde fakat pek çok yakıtta bileşik halinde
(hidrokarbon) bulunmaktadır.
Yakıtlar genellikle fiziksel özelliklerine göre sınıflandırılırlar. Ayrıca üretildikleri kaynaklara
göre de sınıflandırılmaları mümkündür. Yakıtların sınıflandırılması Tablo 3.2 de verilmiştir.
Tablo 3.2. Yakıtların sınıflandırılması
Sınıf
Katı Yakıtlar
Doğal Yakıtlar
(Birincil yakıtlar)
Antrasit kömür
Bitümlü kömür
Linyit
Turba
Odun
Ham petrol
Sıvı Yakıtlar
Doğal gaz
Gaz Yakıtlar
Yapay Yakıtlar
(İkincil yakıtlar)
Pulverize kömür
Briket kömürü
Kok
Odun kömürü
Katran yağı
Petrol destilatları
Petrol artıkları
Alkoller
Kolloid yakıtlar
Yüksek fırın gazı
Kok fırını gazı
Su gazı
Linyit gazı
Rafineri gazı
Hava gazı
Likit petrol gazı
Katı, sıvı veya gaz yakıtların içinde uçucu madde çok ise yakıldığı zaman alev meydana
gelmektedir. Uçucu madde bulunmayan kok ve antrasit yandığı zaman alev vermezler. H 2 ve
CO gazları renksiz sayılabilecek soluk mavi bir alevle yanmaktadır.
Yapısında hidrokarbonlar bulunan çoğu yakıtlar parlak sarı renkte bir alevle yanarlar. Bu
sırada parçalanan hidrokarbonların verdiği karbon zerreciklerinin yanarken ışık vermeleri
aleve sebep olacaktır. Alev aşırı miktarda oksijen içerdiği zaman oksitleyici bir özelliğe sahip
olduğu için “oksidan alev” veya “yükseltgen alev” adını alır. Tersine fazla miktarda
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 29
indirgeyici element ya da bileşik ihtiva ederse “redüktif alev” veya “indirgen alev” adını
almaktadır. Buna göre yakıtın cinsine göre veya yanma şekline bağlı olarak alev ya indirgen
ya da yükseltgen olacaktır. Pratikte nötr bir alev elde etmek mümkün değildir.
Bir sistem çevresi ile ısı değişimi yapmadığı taktirde, böyle bir sistemde meydana gelen
reaksiyon ısısı, reaksiyon ürünlerinin sıcaklığını yükseltmiş olacaktır. Eğer bu reaksiyon ısı
alan bir reaksiyon ise, yani ΔH pozitif işaretli olursa, bu defa da reaksiyon ürünlerinin
sıcaklığı düşmüş olacaktır. O halde, enerjinin korunumu ilkesine dayanan termodinamiğin
birinci kanununa göre reaksiyon ısısı, yanma ürünlerinin değişen ısı miktarına eşittir.
Bir yakıtın yanma reaksiyonu sonucunda ürünlerin sıcaklığını, diğer bir ifadeyle alev
sıcaklığını hesaplamak mümkündür. Ancak böyle bir hesaplamada yanmanın adyabatik olarak
meydana geldiği kabul edilmektedir. Bulunan alev sıcaklığı, uygulamada elde edilebilecek en
yüksek sıcaklıktır. Endüstride, havanın içerisindeki azot gazının, reaksiyon sıcaklığında
bulunan bir ürün olarak hesabedilmesi gerekmektedir. Havaya oksijen ilavesi veya havanın ve
yakıtın ön ısıtmaya tabi tutulması gibi tedbirler ile alev sıcaklığının yükseleceği ifade
edilebilir. Bu tür tedbirlerle en yüksek alev sıcaklığının ne kadar yükseleceği hesap edilebilir.
T sıcaklığında gerçekleşen bir reaksiyonda, oluşan alevin sıcaklığını hesaplamak için
kullanılan denklem,
∫
şeklinde olup buradaki
(3-3)
, sadece ürünlerin Cp değerlerinin toplamına eşittir.
Örnek 3.6. 1 mol karbonun 600 K de havayla tam olarak yakılmasıyla elde edilen alevin
sıcaklığını bulunuz.
C P(CO2 ) 10,55 2,16 10 3 T
CP(C) 4,1 1,02 10 3 T
C P(O2 ) 7,16 110 3 T
C P( N2 ) 6,66 1,02 10 3 T
Çözüm:
Yanma reaksiyonu:
C(k) + O2(g) + 3,76 N2(g) = CO2(g) + 3,76 N2(g)
(havada %21 oksijen, %79 azot bulunduğu kabul edilecektir. 1 O2 için 3,76 N2 )
İlk işlem 600 K deki reaksiyon ısısını bulmaktır.
∫
Bu reaksiyonda teşekkül enerjisi olan tek madde CO2 olup diğerleri elementel haldedir. Bu
nedenle reaksiyonun oda sıcaklığındaki reaksiyon ısısı, CO2’in teşekkül ısısına eşittir. ∆Cp
değerini hesaplarken her iki tarafta da aynı miktarda azot bulunduğundan azotun Cp değerini
göz önüne almak gerekmemektedir.
(
)
(
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 30
∫
∫ (
)
(
)
(
)
Alev sıcaklığı hesaplamasında, ürünler bu ısıyı kullanarak ürünleri (dolayısıyla alevi de) 600
K den daha üst bir sıcaklığa çıkartırlar. Bu açıdan reaksiyon ısısını alev sıcaklığı
hesaplamasında pozitif değerde yazmaya dikkat ediniz.
∫
∑
(
)
(
)
)
∫(
(
)
(
)
Bu denklemin iki kökü olup biri pozitif diğeri negatif değerlidir. Negatif değerli olan alev
sıcaklığı olamayacağına göre pozitif kök, alev sıcaklığıdır.
(
√
)
(
)(
)
√
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 31
Örnek 3.7. Bir pota fırınında %22.4 CO, %11.2 CO2 ve %66.4 N2 den ibaret 1 m3 gaz yakıt
25°C de hava ile yakılmaktadır. Buna göre;
H (0298,CO2 )
a) gazın kalorifik gücünü
b) oluşan alevin sıcaklığını bulunuz
94050 cal/mol H (0298,CO) 26400 cal/mol
Cp(CO2 ) 10,55 2,16 10 3 T
Cp(O2 ) 7,16 1 10 3 T
Cp(CO) 6,79 0,98 10 3 T
Cp( N2 ) 6,66 1,02 10 3 T
Çözüm: Yanma reaksiyonu: CO + ½ O2 + 1.88 N2 = CO2 + 1.88 N2
Yanma reaksiyonunun 25°C de (298 K) reaksiyon ısısı;
0
H 298
H (0298,CO2 ) H (0298,CO) 94050 26400 67650 cal/mol
1 m3 gaz karışımında CO’in mol miktarı; (1 m3 = 1000 lt)
nCO
224
10 mol
22,4
Bu durumda kalorifik güç (pozitif işaretli gösterilir);
Q 67650 10 676500 cal
Yanma reaksiyonu 298 K de gerçekleştiğine göre alev sıcaklığı,
∫
formülüyle hesaplanacaktır. Ürünlerin ısı kapasitesi (Cp) değerleri alındığından ilk önce bu
maddelerin mol miktarları bulunmalıdır. Unutulmamalıdır ki CO2 ile N2 maddesi hem gaz
karışımından hem de yanma reaksiyonundan gelmektedir.
nCO2
112
10 15 mol
22,4
nN2
664
(10 1,88) 48,44 mol
22,4
15 mol CO2 = 158,25 + 32,4.10-3T
48,44 mol N2 = 322,61 + 49,4.10-3T
Cp* = 480,86 + 81,8.10-3T
∫
)
∫(
(
)
(
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 32
Pozitif olan kök, alev sıcaklığıdır.
(
)
(
)(
√
)
√
Örnek 3.8. %96 CH4 ve %4 N2 den ibaret bir doğal gazın 1 m3’ü 298K de hava ile
yakılmaktadır. Kullanılan yakıtın kalorifik gücünü ve elde edilecek alevin sıcaklığını
hesaplayınız.
CH4(g) + 2O2(g) + 7,52 N2(g) = CO2(g) + 2H2O(g) + 7,52 N2(g)
Cp(O 2) 7,16 1 10 3 T
Cp(CO2) 10,55 2,16 10 3 T
Cp(CH 4) 5,65 11,44 10 3 T
Cp( N 2) 6,66 1,02 10 3 T
Cp( H 2O) 7,17 2,56 10 3 T
Çözüm:
0
H 298
, H 2O 57800 cal/mol
0
H 298
,CO2 94050 cal/mol
0
H 298
,CH 4 17890 cal/mol
İlk önce reaksiyon ısısı bulunmalıdır.
[
[(
]
)
(
)]
[
[
]
]
Kalorifik güç hesabı için öncelikle CH4’ün mol miktarı bulunmalıdır.
960
nCH 4
42,857 mol
22,4
Kalorifik güç: Q 191760 42,857 8218258,32 cal/1 m3 yakıt
Ürünlerin mol miktarları;
nCO2 42,857 mol
n N 2 42,857 7,52
nH 2O 42,857 2 85,714 mol
40
324,06 mol
22,4
42,857 mol CO2= 452,14 + 92,57.10-3T
85,714 mol H2O= 614,57 + 219,43.10-3T
324,06 mol N2 = 2158,24 + 330,54.10-3T
Cp* 3224,95 642,54 10 3 T
Alev sıcaklığı;
∫(
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 33
(
)
√
(
) (
)
√
Problemler
P1) 1 ton saf bakır hurdasının ergitilmesi için gereken ısı miktarını (∆H) bulunuz. Bakırın
ergime sıcaklığı 1083°C, ergime ısısı ise 3100 cal/mol’dür.
Cp(Cu) : 5,41+1,5.10-3T cal/mol.K
P2) Zirkonyum 852°C de (1125 K) allotropik dönüşüme uğramakta, 1860°C de ise (2133 K)
ergimektedir. Dönüşüm ısısı 920 cal/mol, ergime ısısı ise 4600 cal/mol olduğuna göre
zirkonyumun 1527°C deki (1800 K) entalpi değerini bulunuz.
Cp(α-Zr): 6,83+1,12.10-3T cal/mol.K
Cp(β-Zr): 7,27+1,2.10-3T cal/mol.K
P3) Bir mol CO’in,
a) hava ile 700 K de
b) saf oksijenle tam yanmasıyla elde edilen alevin sıcaklığını bulunuz.
(veriler aşağıdadır)
P4) %40 CO, %10 CO2 ve %50 N2 den oluşan bir yüksek fırın gazının 1 m3 lük miktarı 25°C
de yakılması durumunda gazın kalorifik gücünü ve alev sıcaklığını hesaplayınız.
Cp(CO2): 10,55+2,16.10-3T cal/mol.K
Cp(O2): 7,16+1.10-3T cal/mol.K
Cp(N2): 6,66+1,02.10-3T cal/mol.K
Cp(CO): 6,79+0,98.10-3T cal/mol.K
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 34
4
TERMODİNAMİĞİN İKİNCİ KANUNU VE ENTROPİ
4.1. Termodinamiğin İkinci Kanunu
Enerjinin miktarına ilave olarak faydası yani kalitesini de göz önüne almalıyız. Enerjiyi
kullanırken miktarı sabit kalır ama kalitesi azalır. Enerji azalması, entropi artışı olarak
isimlendirilmektedir. Deneysel gözlemler, gerçek proseslerde daima net bir entropi artışı
olmamasını termodinamiğin ikinci kanunu olarak ortaya koymaktadır. Bir sistemin enerji
kalitesinin ölçümü olan entropi bir hal fonksiyonudur. Herhangi bir prosesteki hem çevrede
hemde sistemdeki entropi artışını tespit etmek için formüller geliştirilmiştir.
Termodinamiğin birinci kanunu doğada gerçekleşen ve toplam enerjinin korunduğu
proseslerde faydalı sınırlamalar koysa da enerji ile alakalı tüm olaylar tam olarak anlaşılmaz.
İlk kanunda sadece enerji göz önüne alınsaydı herhangi bir enerji azalması olmamalıydı.
Örneğin bir direnç yardımıyla elektrik enerjisini eşit miktarda termal enerjiye dönüştürebiliriz.
Farklı bir cihazı termal enerjiyi orijinal miktardaki elektrik enerjisine dönüştürmede
kullanabiliriz. Aslında böyle bir cihaz icat edilmemiştir. Diğer bir örnek, bir tuğla masadan
yere düşer ve enerji korunur. Tuğlanın başlangıç potansiyel enerjisi ilk önce kinetik enerjiye
dönüşür, tuğla hızlanır, akabinde zemine gelir gelmez termal enerjiye dönüşür. Bu prosesin
sonunda tuğla ve zemin ısınır. Bununla beraber hiçbir makine icat edilmemiştir ki bu termal
enerji tuğlayı masaya geri götürebilsin. Şüphesiz kendimiz tuğlayı yerine koyabiliriz bu
taktirde tuğlanın başlangıç haline gelmesi için enerji üretmiş oluruz. Doğada birçok proses tek
yönlüdür, zıt yönde oluşmaz. Bu gözlemin genelleştirilmesi termodinamiğin ikinci kanunudur
ki bu da bize gerçek proseslerin yönünü vermektedir.
Gerçek proseslerin yönü için kriter nedir? Gerçek proseslerden bazı örnekler verelim. Bu
örnekler çeşitli tipteki enerji dönüşümleridir ve bizler dönüşüm verimleri ile ilgileneceğiz.
Verim, üretilen enerji miktarının kaynak enerji miktarına oranı olarak tariflenmektedir.
1. Mekaniksel potansiyel enerji (pozisyon enerjisi) ve mekaniksel kinetik enerji (hareket
enerjisi) düşen tuğlada olduğu gibi birbirlerine verimli şekilde dönüşebilir. Mekaniksel
enerji elektrik enerjisine mükemmel bir verimle dönüşebilir. Elektrik güç ünitelerinde
bu işlem %99 verimle yapılmaktadır.
2. Elektrik enerjisi mekanik enerjiye (örneğin motorla) verimli şekilde dönüştürülebilir.
3. Hem elektrik hem de mekanik enerjiler, termal enerjiye %100 verimle dönüştürülebilir
4. Termal enerji, ısınmış tuğla ve zemin örneğinde olduğu gibi, mekanik veya elektrik
enerjisine tamamen dönüştürülemez. Örnek olarak yüksek sıcaklıktaki bir mum alevi
birkaç damla suyu kaynatabilir, bu da pistonu hareket ettirebilir. Diğer taraftan ortam
sıcaklığında bulunan bir göldeki çok büyük miktarlardaki termal enerjinin aynı işi
başarması zordur.
5. Yüksek sıcaklıktaki bir nesnenin termal enerjisi, ısı akışı vasıtasıyla düşük sıcaklıkta
bulunan bir nesneye transfer edilebilir. Bununla beraber düşük sıcaklıkta olandan
yüksek sıcaklıkta olana spontane (aynı anda) ısı akışı olmayacaktır.
6. Kimyasal enerji (daha çok ilgi alanımızda olan konu) ısıya (yanma yoluyla), veya
elektrik enerjisine (bir batarya veya yakıt hücresiyle) ya da mekanik enerjiye (bir
adalede olduğu gibi) verimli şekilde dönüştürülebilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 35
4.2. Entropi Kavramı
Termodinamikte bir reaksiyon veya değişimin hangi yönde olacağını önceden tahmin etmek
önemlidir. Daha önceleri reaksiyon ısısının negatif olduğu yönde, diğer bir ifadeyle ısı veren
değişim yönünde reaksiyonun daima kendiliğinden gerçekleşeceği sanılırdı. Ancak bu
düşüncenin her zaman doğru olmadığı anlaşılmıştır. Örnek olarak aşağıdaki değişim
incelenecek olursa,
Sn (beyaz) = Sn (gri)
0
H 298
K 0,50 kcal/mol
25°C de kalayın stabil yani kararlı halinin gri formunda olması gerekirdi. Gerçekte ise 25°C
de kalayın tabiatta rastlanan cinsi beyaz kalaydır.
Bir reaksiyonda denge şartlarını ve belirli bir durumda değişimin hangi yöne doğru olacağını
tayin edebilmek için termodinamikte Entropi kavramı ortaya konmuştur. Bir sistemin ısısı, T
sıcaklığında dq kadar tersinir yani dönüşümlü olarak değiştiği taktirde bu sistemin entropisi,
(4-1)
kadar değişmiş olur. Entropinin bu şekilde tarif edilmesindeki amaç, termodinamik durumuna
tabi olmayan bir dq özelliği yerine sadece sistemin ilk ve son durumlarına tabi olan ve bu
bakımdan enerjiye benzer tarzda,
(
)
(4-2)
tipinde belirli bir fonksiyonla ifade edilebilen bir özellik koymaktır. Örneğin termodinamiğin
I.kanunu gereğince,
(4-3)
bağıntısı ele alınırsa Denklem (4-3)’e
ve eşitliğin tamamı T ye bölündüğünde,
ifadesi eklenip ideal gaza uygulandığında
(4-4)
(4-5)
şeklinde iki tarafı belirli olan bir ifade elde edilmiş olur. Yani
Termodinamiğin 1. kanunu entropi cinsinden,
(
) şeklindedir.
(4-6)
şeklinde ifade edilebilir. Görülmektedir ki TdS teriminin boyutu enerji boyutudur. Bu terim ısı
enerjisini ifade etmektedir. Entropinin boyutu e.b. (entropi birimi) veya cal/mol.K şeklindedir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 36
4.2.1. Sabit Sıcaklıkta Entropi Değişimi
Ergime, buharlaşma, allotropik dönüşümler genellikle sabit basınç altında ve sıcaklıklarda
gerçekleşmektedir. Bu bakımdan sabit sıcaklıkta entropi değişiminin hesaplanması önemlidir.
Sabit basınçta entalpi ifadesinin türevi,
Termodinamiğin 1.kanunundaki
ifadesi dE yerine kullanıldığında,
(4-7)
bulunur. O halde sabit basınçta,
(4-8)
denklemi yardımı ile entalpi değişimi hesaplanabilir. Burada T sabit kabul edilirse söz konusu
madde için T, dönüşüm sıcaklığını göstermiş olur. Bu taktirde dH ifadesi de dönüşüm ısısına
eşittir.
Örnek 4.1. Ergime sıcaklığı 1083°C olan saf bakırın ergime ısısı 3120 cal/mol olduğuna göre
bakırın ergime entropisini hesaplayınız.
Entropi değişiminin pozitif olması, hem entropide (dolayısıyla iç yapı kusurlarında) bir artış
olduğunu, hem de hacimsel bir artış olduğunu göstermektedir.
Örnek 4.2. 760°C de -demirin -demire dönüşme ısısı 660 cal/mol’dür. Bu dönüşüm
sonucunda meydana gelen entropi değişimini hesaplayınız.
Burada da entropi değişimi pozitif çıkmıştır. Ancak ilk örneğe nazaran entropi artışı ve
hacimsel genleşme çok fazla olmamıştır.
Örnek 4.3. İdeal bir gaz olarak kabul edilen azot gazının bir gramlık miktarının hacmi 60°C
de iki misline çıkarılırsa entropisi ne kadar değişir?
olup ideal gazlarda, sabit sıcaklıkta dE=0 ve P=RT/V olduğundan,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 37
∫
1 gr azot için,
bulunur. Görülmektedir ki azotun hacmi iki misline genişletildiğinde entropisi daima aynı
miktarda artmış olur.
4.2.2. Değişen Sıcaklıklarda Entropi Değişimi
Sabit basınçta dönüşümlü bir olay için entropi değişiminde, Denklem (4-8) de
ifadesi yerine yazıldığında,
(4-9)
elde edilir. O halde sabit basınçta sistemin sıcaklığı T1 den T2 ye kadar değişirse ve bu
değişimin tersinir olduğu kabul edilirse sistemin entropi değişimi aşağıdaki denklem
yardımıyla elde edilir.
(4-10)
∫
Örnek 4.4. 120 gram SiO2 nin 800 K deki entropisini hesaplayınız. (SiO2=60 g/mol)
Çözüm:
0
S SiO
2 10 cal/mol.K
Cp(SiO2)= 11,22+8,2.10-3T-2,7.105T-2 cal/mol.K
800
0
S 800 S 298
CpSiO 2
298
S 800
S 800
800
dT
dT
10 11,22 8,2 10 3 T 2,7 10 5 T 2
T
T
298
800
2,7 10 5 1
1
3
10 11,22 ln
8,2 10 800 298
2
298
2 800
298 2
10 11,07 4,12 1,31 23,88 cal/mol.K
nSiO2
120
2 mol
60
S800 23,88x2 47,76 cal/K
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 38
Örnek 4.5. Aşağıdaki reaksiyonun 1000 K deki entropi değişimini hesaplayınız.
3MnO + 2Cr = 3Mn + Cr2O3
Cp(MnO)= 11,11+1,94.10-3T-0,88.105T-2
Cp(Cr2O3)= 28,53+2,2.10-3T-3,74.105T-2
Cp(Mn) = 5,16+3,81.10-3T
Cp(Cr)= 5,84+2,36.10-3T-0,88.105T-2
0
0
S 298
S 298
,Mn 7 ,6 cal/mol.K
,MnO 14,3 cal/mol.K
0
0
S 298
S 298
,Cr 5,63 cal/mol.K
,Cr 2O 3 19,4 cal/mol.K
Çözüm:
[
[
]
]
[
]
[
]
+3(5,16+3,81.10-3T)
+ (28,53+2,2.10-3T-3,74.105T-2)
-2 (5,84+2,36.10-3T-0,88.105T-2)
-3 (11,11+1,94.10-3T-0,88.105T-2 )
ΔCp= -1+3,09.10-3T-0,66.105T-2 cal/mol.K
∫ (
∫
(
)
)
(
)
Bu sonuç entropi değişim değeri bize entropinin azaldığını göstermektedir. Entropi değişim
işaretinin bize verdiği bir başka ipucu ise, entropi değişiminin negatif olduğu reaksiyonların
ekzotermik olduğudur. Dolayısıyla bu reaksiyonda MnO ile Cr metalinin reaksiyona gireceği,
oksijenin kromu tercih edeceği söylenebilir. Kısaca sadece entropi değişimine bakarak
MnO’in metalik Cr ile redüklenebileceği söylenebilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 39
Problemler
P1) Kobalt 440°C de → ve 1120°C de →γ allotropik dönüşümlerine uğramakta 1495°C
de ise ergimektedir. Dönüşüm ısıları sırasıyla 60 ve 70 cal/mol, ergime ısısı ise 3750
cal/mol’dür. Kobaltın 727°C deki (1000 K) entalpi ve entropi değerlerini hesaplayınız.
Cp(-Co)= 5,11+3,42.10-3T
Cp(γ-Co)= 9,6 cal/mol.K
cal/mol.K
Cp(-Co)= 3,3+5,86.10-3T cal/mol.K
S°298= 7,18 cal/mol.K
P2) Aşağıdaki reaksiyonun 298 K deki entropi değişimini hesaplayınız. Entropi değişimine
bağlı olarak reaksiyonun yönü hakkında nedeniyle birlikte fikir yürütünüz.
Fe2O3(k) + 2Al(k) = 2Fe(k) + Al2O3(k)
j/mol.K
j/mol.K
j/mol.K
j/mol.K
P3) Aşağıdaki reaksiyonun 600°K deki entropi değerini bulunuz. NiO ve Cr2O3
maddelerinden hangisi bir redükleyici ile reaksiyona sokulduğunda ilk redüklenecektir?
3NiO + 2Cr = 3Ni + Cr2O3
Cp(Ni)= 6,03-2,5.10-3T
Cp(NiO)=12,91
Cp(Cr)= 5,84+2,36.10-3T
Cp(Cr2O3)=28,53+2,2.10-3T
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 40
5
SERBEST ENERJİ VE DENGE SABİTİ
5.1. Helmholtz Serbest Enerjisi ve Gibbs Serbest Enerjisi
İki farklı serbest enerji mevcuttur. Bunlar,
Helmholtz Serbest Enerjisi, A = E – T . S
Gibbs Serbest Enerjisi,
G = H – T . S = E + P.V – T . S
(5-1)
(5-2)
Bu fonksiyonların her ikisi de termodinamikte önemli rol oynamaktadır. Tersinir olsun ya da
olmasın izotermal bir proseste Helmoltz serbest enerjisindeki değişim,
A E TS
(5-3)
şeklindedir. Benzer şekilde bir sistemin Gibbs serbest enerjisindeki değişim,
G H TS
(5-4)
olarak ifade edilebilir.
Örnek 5.1. Metan gazının su buharı ile reaksiyonunun 298 K deki serbest enerji değişimini
hesaplayınız ve sonucu yorumlayınız.
CH4(g) + H2O(g) = CO(g) + 3H2(g)
S° cal/mol.K
0
cal/mol
H 298
-17890
-26400
-57800
-
Madde
CH4
CO
H2O
H2
44,5
47,3
45,1
31,2
Çözüm:
[
[(
]
)
( )]
[(
[
)
]
(
)]
Reaksiyon ısısına göre bu reaksiyon endotermiktir.
[
[
]
]
[
[
]
]
Entropi değişimi pozitif, bu durum reaksiyonun endotermik olduğunu teyit etmektedir.
Sonuçta reaksiyonun bu sıcaklıktaki serbest enerji değişimi;
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 41
Serbest enerji değişimine bağlı olarak reaksiyon endotermiktir. Reaksiyon ısısı (entalpi)
sistemdeki entropi kavramı göz önüne alınmadan elde edilen bir değerdir. Oysa her sistemde
mutlaka iç yapı kusurları bulunmaktadır. Bu kusurlar maddelerin daha kolay reaksiyona
girmelerini sağlarlar. Bu durumda serbest enerji hesaplamasında sistemdeki entropi değişimi
de dikkate alınmaktadır. Dolayısıyla bu reaksiyonun gerçekleşmesi için gereken enerji,
entropi sayesinde daha az değerde olacaktır.
Örnek 5.2. Silisin 800 K de oksijenle reaksiyona girerek SiO2 oluşturduğu reaksiyonun
serbest enerji değişimini hesaplayınız ve sonucu yorumlayınız.
Si(k) + O2(g) = SiO2(k)
S° cal/mol.K
0
cal/mol
H 298
-217000
Madde
Si
O2
SiO2
4,5
49
10
Cp cal/mol.K
5,7+0,6.10-3T-1.105T-2
7,2+1.10-3T-0,4.105T-2
11,2+8,2.10-3T-2,7.105T-2
Çözüm:
İlk önce ∆Cp nin tespit edilmesi lazımdır.
[
(
)
(
]
)
(
)
800 K deki reaksiyon ısısını hesaplayalım,
∫
[
(
)]
(
∫ (
)
(
)
)
(
)
Reaksiyon ısısına göre bu reaksiyon egzotermiktir, yani reaksiyon ürünler yönündedir.
Reaksiyonun bu sıcaklıktaki entropi değişimini hesaplayalım.
∫
[
]
∫ (
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 42
(
)
(
)
Entropi değişimine göre de reaksiyon egzotermiktir. Son olarak serbest enerji değişimini
hesaplayalım.
(
)
Görüldüğü üzere reaksiyon ısısı ile karşılaştırdığınızda, aslında daha az ısının dışarıya
verildiği ortaya çıkmaktadır. Daha düzenli yapıya geçiş reaksiyonları egzotermik olup
reaksiyon ısısı ile serbest enerji arasındaki bu fark, sistemin daha düzenli hale geçişindeki
bağların kurulması için harcanmıştır.
5.3. Denge Kriteri
0°C sıcaklığında ve 1 atm basınçta dengede bulunan bir buz-su sistemini ele alalım. Sisteme
küçük bir miktar ısı uygulandığını kabul edelim. Bu ısı, bir miktar buzu ergitecektir.
Alternatif olarak küçük miktarda ısının sistemden ayrılırsa, az miktardaki su da katılaşacaktır.
Böylece denge halinde tersinir bir koşul (durum) oluşacaktır. Aynı işlemler denge halindeki
bir kimyasal sisteme uygulanabilir.
Dışarıdan bir müdahale olmaksızın termodinamik durumda bir değişim yoksa sistemin
dengede olduğu anlaşılmalıdır. Denge kavramı üç değişkeni kapsamaktadır: Mekanik denge,
termal denge ve kimyasal denge… Bir sistem içindeki basınç bütün noktalarda aynı olduğu
zaman, sistemin mekanik denge altında olduğu göz önüne alınmalıdır. Benzer şekilde
sıcaklığın üniform olduğu bir sistemde termal denge mevcuttur. Sistemi oluşturan
parçacıkların reaksiyona girme eğiliminin olmadığı durumda da kimyasal dengeden söz
edilebilir. Kimyasal dengenin diğer ifadesi, ileriye doğru olan reaksiyon hızının geriye doğru
olan reaksiyona eşit olmasıdır. Diğer bir ifadeyle kimyasal denge halinde bulunan bir
sistemde, dışarıdan bir müdahale olmadığı sürece reaksiyon gerçekleşmez.
Bir sistem tam bir denge (mekanik, termal, kimyasal) halinde olduğu zaman, bütün alt
sistemler de dengede olmaya eğilimindedir.
Şekil 5.1 de verilen bir sistem ve onun lokal çevresinden oluşan bir bütün sistemi ele alalım.
Şekil 5.1. Sistem ve çevresini içeren izole bir sistem
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 43
Sabit Sıcaklık ve Sabit Basınç Sistemi: Sabit sıcaklık ve basınçta denge halinde bulunan
reaktan ve ürünlerden oluşan bir sistemi göz önüne alalım. Lokal çevre (kısaca çevre) sistem
üzerinde sabit basınçtan başka kuvvet uygulamaz. Sistem ve çevre izole sistem olarak da
isimlendirilir. Denge durumunda, tersinir bir durum var olduğundan, izole sistem için toplam
entropi değişimi sıfırdır.
(5-5)
sistemin ve
çevrenin entropi değişimidir. Bu durumda,
(5-6)
Proses esnasında sistem, çevreden bir q miktar ısıyı absorblar. Böylece,
Çevrenin verdiği ısı = - qs
Sabit sıcaklıkta,
(5-7)
olup bu denklemi, Denklem (5-6)’ya yerleştirirsek,
(5-8)
Sabit hacim prosesi için
(5-9)
olup buradaki
sabit basınçta ve izotermal proseste, faz değişimlerinde kimyasal
reaksiyonlarda entalpideki değişimdir. Denklem (5-8) ve (5-9) kombine edildiğinde,
(5-10)
veya
elde edilir. Buradaki
yalnızca sistemin Gibbs serbest enerji değişimini vermekte,
çevreyi içermemektedir. Serbest enerji değişiminin “sıfır” olduğu durumda sistem denge
durumundadır.
5.4. Serbest Enerji Üzerine Basıncın Etkisi
Gibbs serbest enerji ve entalpi denklemlerinden,
Diferansiyeli alındığında,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 44
Burada
olup
eşitlikleri dikkate alındığında,
ve
(5-11)
Bu önemli bir denklemdir zira serbest enerjinin (dolayısıyla denge durumunun) basınç ve
sıcaklıkla nasıl değiştiğini göstermektedir.
Sabit sıcaklıkta,
veya
(
(5-12)
)
1.halden 2.hale izotermal (T=sbt) değişim için,
∫
1 mol ideal gaz için PV=RT den,
∫
(5-13)
( )
Bu denklem de basınca bağlı olarak serbest enerjideki değişimi vermektedir.
Örnek 5.3. 1 mol ideal gaz 298 K de izotermal olarak basıncı iki katına çıkarılmaktadır. Gibbs
serbest enerjisindeki değişimi hesaplayınız.
Çözüm:
( )
(
)
5.5. Serbest Enerji Üzerine Sıcaklığın Etkisi
Denklem (5-11) den yola çıkalım,
Sabit basınçta,
Diğer ifadeyle,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 45
(
(5-14)
)
Bu denkleme göre serbest enerjinin sıcaklığa göre türevi, entropinin ters işaretlisini
vermektedir.
Helmholtz serbest enerjisi, sıcaklık (T) ve hacmin (V) bir fonksiyonudur.
(
)
Helmholtz serbest enerji tanımından,
(
)
elde ederiz. Terimler yeniden düzenlendiğinde,
(
)
Bu denklemin her iki tarafı –T2 ile bölünürse,
(
veya
[
(
)
)
]
elde edilir. d 1 / T 1 / T 2 dT olduğu için yukarıdaki denklem aşağıdaki şekilde
yazılabilir.
(
)
(5-15)
[
]
(
)
Bu denklem, Gibbs-Helmholtz denkleminin bir formudur. Benzer prosedür kullanılarak diğer
bir form da elde edilebilir.
(
)
(5-16)
[
]
(
)
Yine Denklem (5-16), benzer şekilde yazılabilir.
[
(
)
]
(5-17)
Örnek 5.4. Aşağıdaki reaksiyonun 25°C deki entalpi ve entropi değişimini hesaplayınız.
2Cu(k) + ½ O2(g) = Cu2O(k)
ΔG°= -40500 – 1,702.T.ln T + 29,5.T cal/mol
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 46
Çözüm:
Gibbs-Helmholtz eşitliğinden,
[
(
)
(
]
)
Entropi değişimi,
[
]
5.6. Termodinamiğin Üçüncü Kanunu
Termodinamiğin üçüncü kanunu, mutlak sıfır bölgesinde sistemin davranışı ile ilgilidir.
İzotermal olarak gerçekleşen bir reaksiyon için,
olduğunu biliyoruz. Richards adlı bilim adamı, düşük sıcaklıklarda ΔG ve ΔH değerlerinin
birbirleri yerine geçebileceğini ifade etmiştir. Nerst adlı bilim adamı ise yukarıdaki ifadenin
yanısıra T değeri mutlak sıfıra yaklaştığı zaman H / T P ve G / T P değerlerinin de
birbirinin yerine kullanılabileceğini ifade etmiştir. Yani,
(
)
(5-18)
ΔG ile ΔH arasındaki fark “sıfır” olma eğiliminde olsa da bunun anlamı mutlak sıfır
sıcaklığına ulaşılırken ΔG yada ΔH değerlerinin sıfıra yaklaşacağı anlamına gelmemektedir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 47
Aynı şekilde,
ve
(
)
(
)
(5-19)
(5-20)
yazılabilir. Kirchhoff kanununa göre,
(
(5-21)
)
Denklem (5-21)’i Denklem (5-19)’a yerleştirirsek,
(
)
(5-22)
elde ederiz. A→B gibi bir reaksiyonda ΔCp, (Cp(B)-Cp(A)), mutlak sıfıra ulaşılırken sıfıra eşit
hale gelmektedir.
ΔG değerinin sıcaklıkla değişimi, sabit sıcaklıkta ΔS değerini verdiğine göre,
(
(5-23)
)
(
)
(5-24)
Böylece, Nerst adlı bilim adamına göre;
Yoğun fazlar içeren bir reaksiyonda 0°K de entropi değişimi (ΔS) “sıfır” dır.
Üçüncü kanunun diğer bir ifadesi;
Tamamen denge halinde bulunan herhangi homojen bir madde için
0°K deki mutlak entropisi “sıfır” olarak alınabilir.
5.7. Sabit Sıcaklıkta Serbest Enerji Değişimi
Sabit sıcaklık (dT=0) ve basınçta (dP=0) ΔG=0 dır. Bu durumda faz dönüşümü gibi bir
fiziksel proses tersinir olarak gerçekleşmekte ya da kimyasal bir reaksiyon denge halindedir.
Van’t Hoff adlı bilim adamı, denge sabiti değerini türetmiştir. Örneğin A + B → C + D
reaksiyonu için serbest enerji değişimi,
∑
∑
(
[
[ ]
)
(
[ ]]
[
)
[ ]
[ ]]
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 48
(
)
(
)
[ ][ ]
[ ][ ]
[ ][ ]
[ ][ ]
(5-25)
5.8. Denge Sabitinin Sıcaklıkla Değişimi
Denklem (5-25) de reaksiyonun dengede olduğu kabul edildiğinde, yani ∆G=0 ise,
Her terimin sıcaklığa göre türevini alalım,
(
(5-26)
)
Gibbs-Helmholtz denklemine göre,
Buna göre,
(5-27)
Denklem (5-26) ve Denklem (5-27) birbirine eşitlenirse,
(
)
(
)
(5-28)
Bu denklem Van’t Hoff denklemi olarak bilinmektedir. Denklemin devamında,
∫
∫
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 49
(
(5-29)
)
1/T ye karşılık ln K’nın grafiği çizilirse, elde edilen doğrunun eğimi –ΔH/R değerini
vermektedir.
Örnek 5.5. Aşağıdaki verilerden ve Van’t Hoff denkleminden yararlanarak aşağıdaki
reaksiyonun 700°, 900° ve 1100°K sıcaklıklarındaki denge sabitlerini ve reaksiyon ısısını
hesaplayınız.
FeO(k) + H2(g) = Fe(k) + H2O(g)
Fe + ½ O2 = FeO
H2 + ½ O2 = H2O
ΔG0= -62050+14,95.T cal/mol
ΔG0= -58900+13,1.T cal/mol
Çözüm: İki temel denklemden soruda verilen reaksiyonu elde edelim.
FeO = Fe + ½ O2
ΔG0= 62050-14,95.T cal/mol
H2 + ½ O2 = H2O
ΔG0= -58900+13,1.T cal/mol
----------------------------------------------------------------------FeO(k) + H2(g) = Fe(k) + H2O(g) ΔG0= 3150 -1,85.T cal/mol
G G 0 RT ln K P
Denge halinde,
G 0 RT ln K P
700°K için
3150-1,85 . 700 = -1,987 . 700 . ln Kp
ln Kp = -1,33367
Kp = 0,2635
900°K için
3150-1,85 . 900 = -1,987 . 900 . ln Kp
ln Kp = -0,83039
Kp = 0,4358
1100°K için
3150-1,85 . 1100 = -1,987 . 1100 . ln Kp
ln Kp = -0,51013
Kp = 0,6004
I.Yöntem (Grafik Yöntemi)
1/T ye karşılık ln Kp nin grafiği çizilirse elde edilen doğrunun eğimi –ΔH/R ye eşit olacaktır.
T, °K
1/T
ln Kp
700
14,2.10-4
-1,33367
900
11,11.10-4
-0,83039
1100
9,09.10-4
-0,51013
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 50
H 0
0,51013 1,33367
Egim
4
4
R
14,2 10 9,09 10
H 0
1,987
1611,62
H 0 3202,29 cal/mol
II. Yöntem (Matematiksel)
Herhangi iki sıcaklıktaki Kp değerleri alınarak,
ln
K 700
H 0
K1100
R
ln
0,2635
H 0
5,1948 10 4
0,6004
1,987
1
1
700 1100
0,82354 2,61439 10 4 H 0
H 0 3150 cal/mol
5.9. Heterojen Reaksiyonlarda Denge Sabiti
Heterojen reaksiyonlar iki ya da daha fazla faz içeren reaksiyonlardır. Bir örnek olarak,
aA(k) + bB(g) = cC(k) + dD(g)
reaksiyonu verilebilir. Bütün reaktan ve ürünlerin denge halinde olması durumunda serbest
enerji değişimi,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 51
(5-30)
Saf ve yoğun maddeler (katı ve sıvılar) bir çözelti içinde bulunmadıkları veya çözeltiyi
oluşturan bileşenlerden biri olmadıkları sürece aktivite değerleri “1” dir. Aktivite kavramı
Çözelti Termodinamiği bölümünde daha detaylı olarak incelenecektir. Aktivite, bir bileşenin
çözelti içindeki buhar basıncının saf haldeki buhar basıncına oranıdır. Yoğun maddelerin
aktiviteleri “1” olacağından Denklem (5-30),
(5-31)
halini alacaktır.
Örnek 5.6. Atmosferik koşullarda ve 1000 K de nikel oksitlenir mi?
Çözüm:
Havada bulunan oksijen yüzdesi %21 dir. Bu nedenle oksijen basıncı da 0,21 atm dir. Nikelin
oksitlenme reaksiyonu;
Ni(k) + ½ O2(g) = NiO(k)
cal/mol
1000 K de reaksiyonun serbest enerjisi,
√
Nikel ve nikel katı ve saf halde (çözelti içinde değil) olduklarından aktivite değerleri “1” dir.
√
Sonuçta çıkan serbest enerji değeri -33349,5 cal/mol dür, yani reaksiyonumuz egzotermik
olup ürünler yönüne doğru ilerlemektedir. Bu nedenle NiO oluşmakta, diğer bir ifadeyle nikel
oksitlenmektedir. Bu sonuca göre bu koşullarda nikel oksitlenir.
Örnek 5.7. Aşağıdaki reaksiyonun 1000 K de ve 1 atm basınca sahip hava atmosferinde
reaksiyonun yönünü belirleyiniz.
2Fe(k) + O2(g) + SiO2(k) = Fe2SiO4(k)
Çözüm:
ΔG°= -135300+34,4.T cal/mol
Sonuç olarak serbest enerji değeri negatif çıktığına göre reaksiyon gerçekleşmekte ve ürünler
yönüne doğru ilerlemektedir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 52
Örnek 5.8. %0,15 CO2 içeren 1 atmosferlik havada CaCO3’ın parçalanması (kalsinasyon) için
gereken en az sıcaklığı hesaplayınız.
CaCO3(k) = CaO(k) + CO2(g)
ΔG°= 40250-34,4.T cal/mol
Çözüm:
Reaksiyon denge halindeyken iki tarafa da ilerlemez. Bu durumda denge halindeki sıcaklığı
bulursak, bu sıcaklığın biraz üzeri, reaksiyon için gerekli olan minimum sıcaklık olacaktır.
Böylece denge durumunda,
(
)
850,6 K bu reaksiyonun denge halindeki sıcaklığıdır. Bu durumda sıcaklığı 851 K sıcaklığına
getirirsek reaksiyon gerçekleşmeye ve kireçtaşı parçalanmaya başlayacaktır.
Örnek 5.9. Saf bakırdan bir levhanın 750°C de, içerisinde %10-8 mertebesinde oksijen
bulunan azot gazı ortamında parlak olarak (yüzeyinde CuO teşekkül etmeksizin) tavlanıp
tavlanamayacağını hesapla gösteriniz. Gaz ortamının toplam basıncı 1 atmosferdir.
Çözüm:
2Cu(k) + ½ O2(g) = Cu2O(k)
Cu2O(k) + ½ O2(g) = 2CuO(k)
--------------------------------------2Cu(k) + O2(g) = 2CuO(k)
ΔG°= -40500-3,92.T.log T+29,5.T cal/mol
ΔG°= -34950-6,1.T.log T+44,3.T cal/mol
---------------------------------------------------ΔG°= -75450-10,02.T.log T+73,3.T cal/mol
Reaksiyonun serbest enerjisi (+) değerde çıktığına göre bu reaksiyon gerçekleşmemektedir.
Bu nedenle bu sıcaklık ve ortamda CuO oluşmaz. Sonuçta tavlama işlemi CuO oluşmaksızın
yapılabilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 53
Örnek 5.10. 1000 K de %40 CO, %10 CO2 ve %50 N2 içeren bir ortamda bulunan NiO’in
indirgenip indirgenmeyeceğini gösteriniz.
İndirgenme reaksiyonu: NiO(k) + CO(g) = Ni(k) + CO2(g)
Çözüm:
NiO(k) = Ni(k) + ½ O2(g)
C(k) + O2(g) = CO2(g)
CO(g) = C(k) + ½ O2(g)
----------------------------------NiO(k) + CO(g) = Ni(k) + CO2(g)
ΔG°= 58450-23,55.T cal/mol
ΔG°= -94200-0,2T cal/mol
ΔG°= 26700+20,95.T cal/mol
---------------------------------------ΔG°= -9050-2,8.T cal/mol
Serbest enerji değerimiz (-) çıkmıştır yani reaksiyonumuz egzotermiktir ve ürünler yönüne
doğru reaksiyon oluşacaktır. Bu durumda NiO bu ortamda indirgenir ve Ni oluşur.
5.10. Denge Durumunda Gaz Bileşenlerin Hesaplanması
Bu konuyu en iyi bir örnekle izah edebiliriz.
Örnek 5.11. Boudouard reaksiyonunun 900 K deki CO-CO2 denge bileşenlerinin yüzdelerini
hesaplayınız.
Boudouard Reaksiyonu: CO2(g) + C(k) = 2CO(g)
2C(k) + O2(g) = 2CO(g)
CO2(g) = C(k) + O2(g)
-------------------------------------CO2(g) + C(k) = 2CO(g)
ΔG°= -53400-41,9.T cal/mol
ΔG°= 94200+0,2.T cal/mol
-------------------------------------ΔG°= 40800-41,7.T cal/mol
Çözüm:
Reaksiyon dengede iken,
Giren:
Çıkan:
CO2(g)
1
(1-X)
+ C(k) =
2CO(g)
0
2X
Σn = 1-X+2X = 1+X
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 54
Bu durumda,
(
)
(
)
(
)
(
)
(
)(
)
Bu rakam size reaksiyonun %19,6 oranında gerçekleştiğini söylemektedir. Bu değer
kullanılarak denge anındaki gaz bileşimini bulmak mümkündür.
CO2
CO
= 1-X mol
= 2X mol
= 1-0,196
= 2 . 0,196
= 0,804 mol
= 0,392 mol
Toplam 1,196 mol
→ %67,22 CO2
→ %32,78 CO
Problemler
P1) Bir reaksiyonun sıcaklığa bağlı serbest enerji değişimi aşağıda verilmiştir. Bu
reaksiyonun 500 K deki entropi ve entalpi değişimlerini bulunuz. Bu reaksiyon endotermik mi
yoksa egzotermik midir?
P2) 1 atmosferlik toplam basınca sahip CO ve CO2 gazlarından ibaret bir gaz karışımında
1000 K de %70 CO ve %30 CO2 varken bu ortamda;
a) Cu2O(k) + CO(g) = 2Cu(k) + CO2(g) reaksiyonuna göre bakır oksit indirgenir mi?
b) MnO(k) + CO(g) = Mn(k) + CO2(g) reaksiyonuna göre mangan oksit indirgenir mi?
C(k) + O2(g) = CO2(g)
C(k) + ½ O2(g) = CO(g)
Cu2O(k) = 2Cu(k) + ½ O2(g)
MnO(k) = Mn(k) + ½ O2(g)
G 0
G 0
G 0
G 0
94200 0,2 T cal/mol
26700 20,95 T cal/mol
40500 3,92 T log T 29,5 T cal/mol
91950 17,4 T cal/mol
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 55
P3) Bir pota içerisine krom oksit (Cr2O3) maddesi konmuş ve 1000°C lik atmosfere kapalı bir
fırına yerleştirilmiştir. İlave olarak ortama %25 CO, %35 CO2 ve %40 N2 içeren bir gaz
karışımı verilmiştir. Potadaki krom oksidin redüklenip redüklenmeyeceğini hesaplayınız.
2Cr(k) + 3/2 O2(g) = Cr2O3(k)
C(k) + O2(g) = CO2(g)
C(k) + ½ O2(g) = CO(g)
∆G° = -267750+62,1.T cal/mol
∆G° = -94200-0,2.T cal/mol
∆G° = -26700-20,95.T cal/mol
P4) 1327°C de H2(g) + ½ O2(g) = H2O(g) reaksiyonu gereğince H2, O2 ve H2O dengededir.
Toplam basıncın 1 atm olduğu ortamda oksijen kısmi basıncı 10-8 atm olduğuna göre PH2O/PH2
oranını bulunuz. Bu ortamda FeO redüklenir mi?
H2(g) + ½ O2(g) = H2O(g)
FeO(k) = Fe(k) + ½ O2(g)
∆G°= -57250+4,48.T.log T-2,21.T cal/mol
∆G°= 62050-14,95.T cal/mol
P5) Aluminanın (Al2O3) bir
gaz karışımıyla redüksiyon
deneyi gerçekleştirilmektedir.
Deney düzeneği yanda
verilmiştir. Bu gaz ortamında
ve sıcaklıkta alumina
indirgenir mi?
R=1,987 cal/mol.K
2Al(k) + 3/2 O2(g) = Al2O3(k)
H2(g) + ½ O2(g) = H2O(g)
∆G°= -405760+92,2.T cal/mol
∆G°= -58900+13,1.T cal/mol
P6) Katı ZnO 1300 K’de H2 gazı ile redüklenerek H2O ve Zn buharı meydana gelmektedir.
Kimyasal denge sağlandığı zaman reaksiyon gerçekleşme yüzdesini ve sistemde bulunan
gazların hacim oranlarını bulunuz.
ZnO(k) + H2(g) = Zn(g) + H2O(g)
ZnO(k) = Zn(g) + ½ O2(g)
G 0 115420 10,35 T log T 82,38 T cal/mol
H2O(g) = H2(g) + ½ O2(g)
G 0 57250 4,48 T log T 2,21 T cal/mol
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 56
6
FAZ KANUNU VE FAZ DENGESİ
6.1. Genel Terimler
Genelde maddelerin fiziksel halleri katı, sıvı veya gaz olabilir. Termodinamik analizler
açısından bu genel hallerin herbiri bir faz olarak ele alınmaktadır. Bir maddenin bir fiziksel
halden başka bir fiziksel hale dönüşümü, bir hal dönüşümü veya faz dönüşümü olarak
isimlendirilmektedir.
“Fiziksel ve kimyasal olarak homojen olan sistemlere faz denir”
Bir fazın kendine ait ayrı özellikleri vardır. Bunlar karakteristik x-ışını paternleri, viskozitesi
vb. özelliklerdir. Örneğin buz-su-buhar sisteminde, 273.16 K deki denge konumunda üç farklı
faz bulunmaktadır: katı (buz), sıvı (su) ve gaz (su buharı). Daha kompleks sistemlerde birden
daha fazla katı veya sıvı faz ortamda bulunabilir. Genelde sistemdeki katı veya sıvı çözeltiler
tek bir faz olarak ele alınır. Buharlar ya da gazlar ise, ister saf ister karışım halinde olsunlar,
üniform halde bulunacakları için tek bir faz olarak kabul edilirler.
Çok fazlı sistemlerin termodinamik analizinde diğer bir önemli kavramda bileşendir. Bir
sistemdeki bileşenlerin sayısı, sistemde bulunan elementlerin, parçacıkların veya bileşiklerin
sayısı olmayabilir. Örneğin saf su, tek bileşenli bir sistemdir, oysa su içerisindeki NaCl
çözeltisi iki bileşenli bir sistemdir. Diğer taraftan bir Cu-Au-Ni katı çözeltisi, bakır, altın ve
nikel gibi üç bileşen içermektedir.
6.2. Faz Kanunu
P adet faz içinde dağılım gösteren C adet bileşenli bir sistem ele alalım. Herbir fazın
kompozisyonu C-1 konsantrasyon terimi ile tanımlanır. P fazlarının kompozisyonlarını
tanımlamak için P(C-1) konsantrasyon terimlerini tanımlamak gerekmektedir. Diğer bir
ifadeyle konsantrasyon değişkenlerinin toplam sayısı P(C-1) değerine eşittir. Ayrıca sistemin
basınç ve sıcaklığını da tanımlamak gerekmektedir. Magnetik alan ve elektriksel alan gibi
diğer dış değişkenler göz önüne alınmazlar. Bu durumda denge halinde,
Toplam değişken sayısı = P(C-1) + 2
(6-1)
şeklindedir. Denge durumunda birkaç fazın bulunduğu bir sistemde, herbir bileşenin
karakteristik bir kimyasal potansiyeli vardır. Denklem (6-1) deki değişkenlerin bazıları bu
şekilde tanımlanmıştır. Geri kalan değişkenler sistemin Serbestlik Derecesi’dir.
ve gibi iki faz arasında denge halindeki 1, 2, 3… şeklinde tanımlanmış bileşenleri göz
önüne alalım. Heriki fazdaki herbir bileşen için kimyasal potansiyelleri sabittir.
1 1 , 2 2 ,......
Bu durumda P kadar faz ve C kadar bileşen içeren bir sistem için,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 57
1 1 ...... 1P
2 2 ...... 2P
denklemleri yazılabilir. Herbir set, P-1 bağımsız eşitlik sunmaktadır ve böyle C kadar set
olduğuna göre C(P-1) kadar bağımsız denklem bulunmaktadır. Bu durumda,
Tanımlanmamış Değişken Sayısı = P(C-1) + 2 – C(P-1)
= PC – P + 2 – PC + C
=C–P+2
Sistemdeki Serbestlik Derecesi Sayısı (veya Serbest Değişken Sayısı, F),
F=C–P+2
(6-2)
şeklinde gösterilir be bu denkleme Gibbs Faz Kuralı veya kısaca Faz Kuralı denmektedir. Bu
denklemdeki C bileşen sayısı, P ise faz sayısıdır. 2, sıcaklık ve basıncı temsil etmektedir.
6.2.1. Faz Kuralının Tek Bileşenli Sisteme Uygulanması
Bir bileşenli bir faz diyagramı Şekil 6.1 de
gösterilmiştir. Diyagrama göre bu
bileşenin (maddenin) katı, sıvı ve gaz hali
olmak üzere, sıcaklığa ve basınca bağlı
olarak üç faz hali mevcuttur. Ortam
basıncı 1 atm olduğuna göre, buna karşılık
gelen sıcaklık (kesikli çizgi ile
gösterilmiştir) o maddenin ergime
sıcaklığını göstermektedir. Atmosferik
koşullarda
saf
maddelerin
ergime
sıcaklıklarının
sabit
olduğunu
unutmayınız. Her üç fazın aynı anda
bulunduğu noktaya üçlü nokta (triple
point) denmektedir.
Şekil 6.1. Bir bileşenli faz diyagramı
Şimdi Şekil 6.2 de verilen bir bileşenli faz diyagramının bazı bölgelerine (A, B ve C
noktaları) faz kuralını uygulayalım.
A noktası
A noktasının bulunduğu bölgede sadece katı faz bulunmaktadır. Yani faz sayısı 1 dir. Bileşen
sayısı da 1 olduğuna göre,
F=C–P+2
F=1–1+2=2
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 58
Görüldüğü gibi serbest değişken sayısı 2
çıkmıştır. Bunun anlamı, bu noktada hem
sıcaklığı hem de basıncı arzu ettiğimiz
şekilde ve birbirinden bağımsız olarak
değiştirebiliriz ve aynı faz bölgesinde
kalabiliriz demektir.
B noktası
Diyagramdaki B noktası katıdan sıvıya
geçiş, yani ergimenin gerçekleştiği hat
üzerindedir. Bu nedenle ergime anında
ortamda iki faz ( katı ve sıvı)
bulunacaktır. Sistem 1 bileşenli olduğuna
göre,
Şekil 6.2. Bir bileşenli faz diyagramı
F=C–P+2
F=1–2+2
F=1
Serbest değişken sayısı 1 çıkmaktadır. Bunun anlamı, katı-sıvı ergime çizgisi üzerinde
kalabilmek için, ya sıcaklığı serbest şekilde değiştirebilirsiniz basınç da ona bağlı olarak
değişir ya da basıncı serbest şekilde değiştirebilirsiniz sıcaklık da ona bağlı olarak değişir.
C noktası
Diyagramdaki C noktası üçlü nokta üzerindedir. Bunun anlamı üç faz ( katı, sıvı ve gaz)
denge halinde ortamda bulunmaktadır. Yani faz sayısı 3 dür. Bileşen sayısı 1 olduğuna göre,
F=C–P+2
F=1–3+2
F=0
Serbest değişken sayısı sıfır çıktığına göre bunun anlamı ne sıcaklığı ne de basıncı
değiştiremezsiniz demektir. Yani bu üçlü nokta, herhangi bir madde için sabit sıcaklık ve
basınçta gerçekleşmektedir.
6.2.2. Faz Kuralının İki Bileşenli Sisteme Uygulanması
Bir A-B ikili faz (denge) diyagramı Şekil 6.3 de verilmiştir. İkili denge diyagramları 1 atm
basınç sabit kabul edilerek çizilmektedir. Bu durumda x ekseni % bileşen, y ekseni ise
sıcaklıktır. Dikkat edilmesi gereken nokta, ikili (veya üçlü) faz diyagramları göz önüne
alındığında, ya da atmosferik koşullar göz önüne alındığında faz kanunu,
F=C–P+1
(6-3)
halini almaktadır. Örnek 6.1 de bu durum sergilenmiştir. Faz kuralını Şekil 6.3 deki X ve Y
noktalarına uygulayalım.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 59
X noktası
Bu noktada sıvı ve katı olmak üzere 2 adet
faz bulunmaktadır. Bileşen sayısı A ve B
olmak üzere 2 dir. Diyagram 1 atm sabit
kabul edilerek çizildiğine göre,
F=C–P+1
F=2–2+1
F=1
Serbest değişken sayısı 1 çıkmıştır. Basınç
zaten sabittir. Bu durumda sıcaklığımız
serbest değişkendir.
Şekil 6.3. A-B ikili faz diyagramı
Y noktası
Bu noktada tek bir katı faz vardır. Bileşen sayısı ise A ve B olmak üzere 2 dir.
F=C–P+1
F=2–1+1
F=2
Serbest değişken sayısı 2 dir. Atmosferik koşullar nedeniyle basınç sabit olduğuna göre
buradaki serbest değişkenler sıcaklık ve %bileşimdir.
Örnek 6.1. Atmosferik koşullarda saf elementler tek bir sıcaklıkta ergirken neden iki bileşenli
alaşım bir sıcaklık aralığında ergirler?
Bu sorunun cevabını faz kuralı ile verebiliriz. Atmosferik koşullar geçerli olduğuna göre faz
kuralı F = C – P + 1 halini almaktadır. Bu durumda saf element için ergimede 2 faz (katı ve
sıvı) vardır ve serbest değişken sayısı,
F=C–P+1=1–2+1=0
ve iki bileşenli bir alaşım için serbest değişken sayısı,
F=C–P+1=2–2+1=1
çıkmaktadır. Yani saf elementte ergime sıcaklığı değiştirilemez, sabittir ama alaşımda ergime
sıcaklığı sabit değildir.
6.2.3. Faz Kuralının Kimyasal Reaksiyonlara Uygulanması
Faz kuralını farklı kimyasal reaksiyonlara uygulayalım.
Örnek 6.2. C(k) + ½ O2(g) = CO(g) reaksiyonuna faz kuralını uygulayarak sonucu izah
ediniz.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 60
Bu reaksiyonda ik faz bulunmaktadır. Bunlar katı (C) ve gaz fazıdır. Unutmayın ki
reaksiyonda ne kadar gaz fazı bulunursa bulunsun bunlar birbiri içerisinde homojen olarak
karışırlar ve tek bir faz olarak yani gaz fazı olarak ele alınırlar. Bileşen sayısı ise karbon ve
oksijen olmak üzere ikidir. Bu durumda,
F=C–P+2
F=2–2+2
F=2
Serbest değişken sayısı 2 dir. Bu durumda basınç ve sıcaklık birbirinden bağımsız
değişkenlerdir.
Örnek 6.3. CaCO3(k) = CaO(k) + CO2(g) reaksiyonuna faz kuralını uygulayarak sonucu izah
ediniz.
Bu reaksiyonda faz sayısı 3 dür. Bunlar CaCO3, CaO ve gaz fazıdır. Bileşen sayısı ise
kalsiyum, karbon ve oksijen olmak üzere 3 dür. Bu durumda,
F=C–P+2
F=3–3+2
F=2
Serbest değişken sayısı 2 dir ve bunlar sıcaklık ve basınçtır.
Örnek 6.4. CO(g) + ½ O2(g) = CO2(g) reaksiyonuna faz kuralını uygulayarak sonucu izah
ediniz.
Bu reaksiyonda tek faz, yani gaz fazı bulunmaktadır. Bileşen sayısı ise karbon ve oksijen
olmak üzere 2 dir. Bu durumda,
F=C–P+2
F=2–1+2
F=1
Serbest değişken sayısı 1 dir. Bu nedenle sıcaklık veya basıncı arzu ettiğiniz gibi
değiştirebilirsiniz, diğeri ona bağlı olarak değişecektir.
Örnek 6.5. Cr2O3(k) + 2Al(k) = 2Cr(k) + Al2O3(k) reaksiyonuna faz kuralını uygulayarak
sonucu izah ediniz.
Bu reaksiyondaki faz sayısı Cr2O3, Al2O3, Cr ve Al olmak üzere 4 dür. Bileşenler ise krom,
aluminyum ve oksijendir. Bu durumda,
F=C–P+2
F=3–4+2
F=1
Serbest değişken sayısı 1 dir. Bu nedenle sıcaklık veya basıncı arzu ettiğiniz gibi
değiştirebilirsiniz, diğeri ona bağlı olarak değişecektir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 61
6.3. Clausius-Clapeyron Denklemi
Clausius-Clapeyron denklemi, saf bir maddenin denge dönüşüm sıcaklığı üzerine basınç
değişiminin etkisini tespit etmede büyük önem arzetmekte ve denklem,
(6-3)
ile ifade edilmektedir. Burada H dönüşüm ısısı, V ise dönüşümle meydana gelen hacimsel
değişimdir.
6.3.1. Clausius-Clapeyron Denkleminin Faz Değişimlerine Uygulanması
Clausius-Clapeyron denklemi ergime, buharlaşma, süblimasyon, allotropik dönüşüm vb. gibi
faz değişimlerine uygulanabilir.
Sıvı-Buhar (Buharlaşma) Dengesi
Clausius-Clapeyron denklemini bir sıvı-buhar dengesine uygularsak,
(6-4)
(
)
elde ederiz. Burada Hbuh molar buharlaşma ısısı, Vb buharın molar hacmi ve Vs sıvının molar
hacmidir. Buharın molar hacmi, sıvının molar hacminden çok fazla büyük olduğu için Vs
değeri ihmal edilebilir. Böylece,
(6-5)
yazılabilir. Buharın ideal gaz gibi hareket ettiği kabul edilirse ve
olduğunda,
(6-6)
elde edilir. Bu denklem genelde kullanılan diferansiyel formda yeniden düzenlenerek
yazılırsa,
(
)
(6-7)
elde edilir. Hbuh değerinin sabit kaldığı, bir aralık içerisinde kabul yaparsak, mevcut
denklemin integrasyonu,
(6-8a)
veya
(6-8b)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 62
halini alır ki burada C ve C* integrasyon sabitleridir. Herhangi bir sıvı metal için log P-(1/T)
grafiği çizilirse grafik bir doğru vermelidir. Bu doğrunun eğimi (m),
(6-9)
denklemi ile hesaplanabilir. Doğrunun Y-ekseni ile kesişimi C sabit değerini verecektir.
Doğrunun eğiminden sıvının buharlaşma ısısı hesaplanabilir. Bununla beraber bu yolla
hesaplanan sıvı metalin buharlaşma ısısı, çalışılan sıcaklık aralığındaki ortalama değer
olacaktır.
T1 ve T2 sıcaklıklarında P1 ve P2 değerleri sınırları alınarak Denklem (6-6) integre edilebilir.
Sıcaklık aralığı, Hbuh değerinin sıcaklıktan bağımsız olması için yeterli dar aralıkta olmalıdır.
Böylece,
∫ (
)
∫
[
]
(6-10)
[
]
(6-11)
veya
halini alır. Bu denklem bir sıcaklıktaki buhar basıncı ve ortalama buharlaşma ısısı biliniyorsa
herhangi bir sıcaklıkta buhar basıncını hesaplamada kullanılabilir.
Örnek 6.6. Sıvı titanyumun 2227°C deki (2500 K) buhar basıncı 1.503 mmHg’dır.
Titanyumun normal kaynama noktasındaki buharlaşma ısısı 104 kcal/mol olduğuna göre
normal kaynama noktasını hesaplayınız.
Çözüm:
Titanyumun kaynama noktası Tbuh kabul edilsin. Bu sıcaklıkta buhar basıncı 1 atm veya 760
mmHg değerine eşittir. Buna göre,
[
]
(3285 °C)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 63
Katı-Buhar (Süblimasyon) Dengesi
Sıvı-buhar dengesinde yapılan işlemlere benzer kabuller yapıldığında sıvı-buhar dengesi için,
(
)
(6-12)
olup burada Hsüb süblimasyon ısısıdır.
Katı-Sıvı (Ergime) Dengesi
Clausius-Clapeyron denklemini katı-sıvı dengesine uygularsak,
(6-13)
(
)
elde edilir. Burada Herg molar ergime ısısı, Vs ve Vk sırasıyla sıvı ve katının molar
hacimleridir. Bu denklem, basıncın değişimiyle bir metalin ergime noktasında gerçekleşen
değişimi hesaplamada kullanılabilir.
Örnek 6.7. Galyumun 1 atm’deki ergime noktası 30°C (303 K) olup katı ve sıvı galyumun
yoğunlukları sırasıyla 5.885 ve 6.08 g/cm3’dür. Galyumun ergime ısısı ise 18.5 cal/g olduğuna
göre 1 atm basınç artışıyla galyumun ergime noktasındaki değişimi hesaplayınız.
Çözüm:
Galyumun ergime ısısı değeri cal/g olarak verilmiştir. Cal/mol olarak değerleri bulmak için
atomik ağırlıkla çarpmalıyız. Böylece,
Molar ergime ısısı = 18.5 x cal/mol
[
]
Değerleri atm/derece şeklinde elde etmek için dönüşüm yapmalıyız.
1 cal = 41.293 cm3/atm
Böylece,
[
]
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 64
ters çevirirsek,
dP= 1 atm durumunda,
Görüldüğü gibi galyumun ergime noktası 2.16x10-3 derece azalacaktır.
Katı-Katı Dengesi
Bir katının iki kristalin yapısının basınçla dengede olduğu geçiş (dönüşüm) sıcaklığının
değişim hızı, daha öncekilere benzer denklemle verilebilir. Geçiş sıcaklığının altında
fazının, geçiş sıcaklığının üzerinde ise fazının kararlı olduğu kabul edilirse,
(6-14)
(
)
denklemi yazılabilir. Burada HD molar dönüşüm ısısı, V ve V değerleri ise sırasıyla ve
fazlarının molar hacimleridir.
6.4. Trouton ve Richard Kuralı
Trouton kuralı, buharlaşma ısısının normal kaynama sıcaklığına oranının bütün sıvılar için
sabit olduğunu ve yaklaşık 21 cal/derece.mol değerine eşit olduğunu ortaya koymaktadır.
Diğer bir ifadeyle,
(6-15)
Bu kural sadece bir yaklaşımdır ve bütün sıvı metaller bu kurala uymaz. Bununla beraber
buharlaşma ısısının tahmini bir değerini tespit etmek için bu kural kullanılabilir.
Richard kuralına göre ise saf bir maddenin ergime ısısı (ΔHerg) ile ergime sıcaklığı (Terg)
arasında aşağıdaki bağıntı vardır.
(6-16)
Örnek 6.8. Çinkonun normal kaynama noktası 907°C (1180 K) dir. Çinkonun Trouton
kuralına uyduğu kabul edilerek 800°C deki buhar basıncını hesaplayınız.
Çözüm:
C değeri, sınır şartları kullanılarak bulunabilir. Normal kaynama noktasındaki (1180 K) buhar
basıncı 1 atm’dir. Bu durumda,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 65
Bu durumda denklem,
800°C (1073 K) deki buhar basıncı,
(
)
6.5. Yoğun Fazların Buharlaşması
Yoğun faz ifadesi, sıvı ve katı fazları içerisine almaktadır. Sıvı fazın buharlaşması (kaynama)
ve katı fazın buharlaşması (süblimasyon) olayları bu bölümde incelenecektir. Genel olarak
bir katı fazı, ise bu saf fazın buhar fazını gösterdiğinde, → dönüşüm reaksiyonu için,
denklemi daha basit bir şekle girmektedir. Çünkü fazı gaz halindedir ve normal basınç
altında molar hacim yoğun fazın molar hacminden çok daha büyüktür. Bu nedenle denklemde
ΔV yerine V yazılabilir. Genelde buhar basınçları düşük olduğundan ideal gaz kanunları
geçerli olur.
Bu formül genel olarak,
(6-17)
yazılmakta olup buradaki B bir sabittir. A ise,
(6-18)
şeklindedir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 66
Örnek 6.9. Gümüşün katı ve sıvı durumdaki buhar basınçlarını bulmaya yarayan formülleri
çıkarınız.
Terg = 961°C
Tbuh = 2200°C
ΔHerg = 2690 cal/mol ΔHbuh = 60000 cal/mol
Çözüm:
Buharlaşma sıcaklığında her madde için buhar basıncı P = 760 mmHg dır.
Bu durumda sıvı gümüş için sıcaklığa bağlı olarak buhar basıncını hesaplamaya yarayan
formül,
Katı gümüşün A sabitini A* ve B sabitini B* olarak ele alırsak sıvının değerleriyle karışmaz.
A* sabitini hesaplarken hem ergime ısısının hem de buharlaşma ısısının alınması gerektiğini
unutmayınız.
Ergime sıcaklığında sıvı gümüş ile katı gümüşün buhar basınçları birbirine eşittir. Bu
durumda,
Böylece katı gümüşün buhar basıncını hesaplamaya yarayan formül,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 67
Örnek 6.10. Sıvı kurşunun buhar basıncını hesaplamaya yarayan formül,
olduğuna göre katı kurşunun buharlaşma sıcaklığı ve ısısını, katı kurşunun buhar basıncını
hesaplamaya yarayan formülü, kurşunun 227 ve 727°C deki buhar basınçlarını hesaplayınız.
Terg = 327°C
ΔHerg = 1150 cal/mol
Çözüm:
Sıvı kurşunun buhar basıncını veren formülden kurşunun buharlaşma ısısını ve buharlaşma
sıcaklığını bulabiliriz.
Buharlaşma sıcaklığında basınç 760 mmHg dır. Buradan buharlaşma sıcaklığını bulalım.
Katı kurşunun buhar basıncını veren formüldeki A* ve B* sabitlerini bulalım.
Ergime sıcaklığında katı ve sıvı kurşunun basınçlarının eşit olmasından yola çıkarak,
Bu durumda katı kurşunun buhar basıncını bulmaya yarayan formül,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 68
500 K de kurşun katı haldedir.
1000 K de kurşun sıvı haldedir.
Problemler
P1) Atom ağırlığı 209 g olan bizmutun 1 atm basınçtaki ergime sıcaklığı 271°C dir. Bizmutun
ergime ısısı 2508 cal/mol, katı bizmutun yoğunluğu 9,92 g/cm3 ve sıvı bizmutun yoğunluğu
10,04 g/cm3 dür. Basıncın 100 atm olması halinde bizmutun ergime sıcaklığını bulunuz.
P2) Normal koşullarda saf kurşunun ergime sıcaklığı 327°C, buharlaşma sıcaklığı ise 1740°C
dir. Kurşunun Richard ve Trouton kuralına uyduğu kabul edildiğinde ergime ve buharlaşma
ısılarını bulunuz.
P3) Sıvı demirin buhar basıncını bulmaya yarayan formül aşağıda verilmiştir. Demirin ergime
ısısı 3775,3 cal/mol ve ergime sıcaklığı 1535°C olduğuna göre katı demirin buhar basıncını
bulmaya yarayan formülü, buharlaşma ısısını ve buharlaşma sıcaklığını bulunuz. Saf demirin
1200°C deki buhar basıncını hesaplayınız.
P4) Demirin sıvı ve katı durumda bazı sıcaklıklardaki buhar basınçları aşağıda verilmiştir.
Katı ve sıvı demir için buhar basınçlarını bulmaya yarayan formülleri çıkarınız.
Katı durum
Sıcaklık, K
Buhar basıncı, mmHg
1000
4,95.10-11
1500
1,32.10-4
Sıvı durum
2200
2400
1,34
6,7
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 69
7
ELLINGHAM DİYAGRAMLARI
7.1. Giriş
Ellingham, 1944 yılında oksitli bileşenlerin sıcaklığa karşı oluşum standart serbest enerji
değişimlerini gösteren grafiği çizen ilk kişidir. Daha sonraları aynı diyagram sülfürlü,
klorürlü, florürlü vb. bileşenler için de çizilmiştir.
ΔG° - T diyagramlarından aşağıdaki çıkarımlar yapılabilir:
1) Ellingham diyagramında bulunan lineer doğruların eğimi, reaksiyonun entropisindeki
değişimi vermektedir.
(7-1)
2) ΔG° değerinin sıcaklığa göre olan grafiği, reaktanlarda veya ürünlerde bir faz değişimi
(ergime, kaynama, faz dönüşüm vb.) olmadığı sürece lineer gidecektir. Bunun sebebi, bu tür
reaksiyonlar gerçekleştiği zaman entropi değişimi olmasıdır. Eğim entropideki değişimi
verdiğine göre bu tür reaksiyonlar olduğunda doğruların eğimi de değişecektir.
3) Her bir bileşene ait doğruların mutlak sıfır sıcaklığında ordinatı (y ekseni) kestiği yer,
yaklaşık olarak ΔH° değerini (oksitli bileşen için teşekkül ısısını) verecektir.
T=0 olduğunda,
7.2. Oksitli Bileşenler
Bir oksit oluşum reaksiyonu,
Metal(k) + O2(g) = Metaloksit(k)
şeklinde gösterilebilir. Burada,
(
)
verilebilir. Şekil 7.1 de oksitli bileşenler için Ellingham diyagramı verilmiştir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 70
Şekil 7.1. Oksitli bileşenler için Ellingham Diyagramı
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 71
Şekil 7.1 de verilen her bir doğru, farklı metallerin oksidasyonu için ΔG° grafiklerini
vermektedir. Bu grafiklerden aşağıdaki sonuçlar elde edilebilir;
a) Doğruların eğimleri yaklaşık olarak birbirlerine benzemektedir. Çünkü gaz fazındaki
oksijenden katı oksit oluşumundaki entropi değişimi, birbirlerine benzer özellik
göstermektedir.
b) Bir metalin oksijenle katı oksit oluşturma reaksiyonu, entropide azalmaya neden olur.
Çünkü katı oksit, bir metal ve gaz sisteminden daha düzenli bir yapıya sahiptir. Dolayısıyla
grafiklerdeki eğim pozitif olmalıdır.
c) Eğrilerin eğiminde faz dönüşümü olduğu zaman değişiklik olmaktadır. Bu durum, kaynama
noktalarında daha keskin gözükmektedir.
d) Bir metal ergidiği zaman entropisi artar. Bunun sonucu olarak reaktanların entropisi ve
eğim de artar. Oksitler ergidiği zaman ise toplam entropi değişimi azalır ve eğim de azalır.
(Cu2O eğrisinde olduğu gibi).
(I) metal ergimesinde:
M(k) + ½ O2(g) = MO(k)
M(k) = M(s)
---------------------------------M(s) + ½ O2(g) = MO(k)
entropi değişimi = -S1
entropi değişimi = +S2
----------------------------------S = – S1 – S2 = daha negatif
(II) oksit ergimesinde:
M(k) + ½ O2(g) = MO(k)
MO(k) = MO(s)
----------------------------------M(k) + ½ O2(g) = MO(s)
entropi değişimi = -S1
entropi değişimi = +S2
----------------------------------S = – S1 + S2 = daha az negatif
e) Gerçekleşen bir reaksiyon için ΔG° değeri negatif olmalıdır. Bu nedenle negatif alanda
gözüken metaller oksijenle kolaylıkla okside olurlar.
f) Eğrilerin ΔG° nin pozitif bölgesine geçenlerde, belirtilen sıcaklıklardan daha ileri düzeyde
oksidasyonu gerçekleşmemektedir. Diğer bir ifadeyle bu bölgede oluşan oksit formu stabil
yani kararlı değildir. Örneğin,
4Fe3O4 + O2 = 6Fe2O3
reaksiyonunda 1500°C nin üzerinde Fe3O4 ün oksidasyonu mümkün değildir, çünkü Fe2O3
kararlı bir yapıda değildir.
g) Bir oksidin stabilitesi (kararlılığı) kendi serbest enerji değeri ile doğrudan ilgilidir. Daha
kararlı oksitler, daha az kararlı oksitlerden daha küçük serbest enerji değerine sahiptirler.
h) Bir oksit, ΔG°-T diyagramında sadece kendisinden daha aşağıdaki metaller tarafından
redüklenebilir. Geri dönüşüm olmaz. Örneğin Cr2O3 800°C de aluminyum tarafından
redüklenebilir ama Al2O3 bu sıcaklıkta krom tarafından redüklenemez.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 72
4
/3 Al + O2 = 2/3 Al2O3
/3 Cr + O2 = 2/3 Cr2O3
-----------------------------4
/3 Al + O2 = 2/3 Al2O3
2
/3 Cr2O3 = 4/3 Cr + O2
-----------------------------2
/3 Cr2O3 + 4/3 Al = 2/3 Al2O3 + 4/3 Cr
4
ΔG° = - 214 kcal
ΔG° = - 134 kcal
------------------------ΔG° = - 214 kcal
ΔG° = + 134 kcal
------------------------ΔG° = - 80 kcal
Görüldüğü gibi ΔG° değeri negatif çıkmıştır. Bunun anlamı reaksiyon ürünler yönüne
ilerleyeceğinden aluminyum Cr2O3’ü redükler ancak reaksiyonun tersi, ΔG° değerinin pozitif
olması demektir. Diğer bir ifadeyle reaksiyon gerçekleşmez ve krom, aluminayı redüklemez.
Bir başka örnek olarak 600°C de silisyumun magnezyum oksidi redükleyip redüklemeyeceğini inceleyelim.
2Mg + O2 = 2MgO
Si + O2 = SiO2
---------------------------2MgO = 2Mg + O2
Si + O2 = SiO2
---------------------------2MgO + Si = 2Mg + SiO2
ΔG° = - 246 kcal
ΔG° = - 170 kcal
---------------------ΔG° = +246 kcal
ΔG° = - 170 kcal
---------------------ΔG° = + 76 kcal
Sonuçtan anlaşılacağı üzere ΔG° değeri pozitif çıkmıştır, bu nedenle reaksiyon ürünler
yönüne değil reaktanlar yönüne doğru ilerlemektedir. Diğer bir ifadeyle silisyum, magnezyum
oksidi redüklemez.
i) Bir oksidin ΔG° değeri düşük sıcaklıklarda bir başka oksidin ΔG° değerinden daha büyük,
yüksek sıcaklıklarda ise daha küçük olabilir. Bu durumda, örnek olarak, yaklaşık 400°C nin
altında kobalt, nikel oksidi redüklerken, bu sıcaklığın üzerinde reaksiyon tersine dönmekte
yani nikel, kobalt oksidi redükleyebilmektedir (Şekil 7.2)
Şekil 7.2. Ellingham diyagramının nikel ve kobalt içeren bölgesi
j) C + O2 → CO2 reaksiyonu için Şekil 7.2 de bir yatay çizgi bulunmaktadır. Bunun anlamı
eğim hemen hemen “sıfırdır” ve entropi değişimi yoktur. Diğer bir anlamı da başlangıç ve
sonuç hacimler bu reaksiyon için aynıdır.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 73
k) Aşağıya doğru eğimli olan CO oluşum eğrisi, özellikle pirometalurjide çok önemli bir
reaksiyondur. Yüksek sıcaklıklarda bütün metal oksitler bu doğru ile çakışır. Bunun anlamı,
birçok metal oksidin yüksek sıcaklıklarda karbonla redüksiyonu mümkündür (Şekil 7.3).
Şekil 7.3. Ellingham diyagramında 2C + O2 → 2CO reaksiyonunun grafiği
l) Karbon monoksit, CO2 doğrusunun üzerindeki bütün oksitleri redükleyebilir. Örneğin
700°C de NiO, CO ile redüklenebilir,
2CO → 2C + O2
2C + 2O2 → 2CO2
2NiO → 2Ni + O2
-------------------------2CO + 2NiO → 2Ni + 2CO2
CO + NiO → Ni + CO2
∆G° = +94 kcal
∆G° = - 188 kcal
∆G° = +74 kcal
---------------------∆G° = - 20 kcal
∆G° = - 10 kcal
7.3. Denge oksijen basıncı ile denge CO/CO2 ve H2/H2O oranlarının tespiti
Şekil 7.4 dikkatle incelenirse, diyagramın sol tarafında serbest enerji değerlerine paralel
olarak bir düşey doğru görülecektir. Bu doğrunun en üst noktası oksijen için, “H” ile
gösterilen nokta H2/H2O oranı için ve “C” ile gösterilen nokta da CO/CO2 oranı için
verilmiştir. Şekil 7.4 de oksijen için bir örnek (A noktası), 1400°C de 4/3Cr+O2=2/3Cr2O3
reaksiyonu için denge oksijen basıncı yaklaşık 10-14 mertebesindedir. Bu değer bu reaksiyon
için denge oksijen basıncını vermektedir. Bu değerden daha küçük oksijen basıncı
değerlerinde ortamda metalik krom, daha büyük değerlerde ise ortamda Cr2O3 bulunmakta,
yani oksitlenme olmaktadır.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 74
Şekil 7.4. Ellingham diyagramından denge oksijen basıncı ve CO/CO2 (H2/H2O) oranlarının tespiti
Bir diğer örnek (B noktası), 700°C de 2Mn+O2=2MnO reaksiyonu için denge halindeki
CO/CO2 oranı yaklaşık 106 dır. Bu değerden daha küçük oranlarda redüklenme olmaz (yeterli
CO olmadığı için), daha büyük oranlarda ise redüklenme gerçekleşecektir. Aynı şekilde
H2/H2O oranı da grafikten tespit edilebilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 75
Sorular
Aşağıdaki soruları Ellingham diyagramını kullanarak cevaplandırınız.
1) Mangan oksidin yaklaşık teşekkül entalpi değeri nedir?
2) ZnO katısını mangan tozuyla karıştırıp 600°C lik bir fırına koyarsak, sistemde entropi artışı
mı yoksa entropi azalması mı olur? Hesaplayarak açıklayınız.
3) Metalik kobaltın 1000°C de oksitlenmemesi için ortam oksijen basıncı ne olmalıdır?
4) Atmosferik koşullarda ve oda sıcaklığında demirin iki oksit türünden (Fe2O3 – Hematit ve
Fe3O4 – Manyetit) hangisi, neden daha kararlıdır?
5) Cr2O3, NiO, SiO2, Al2O3 ve MnO maddeleri bir redükleyici ile 1000°C de karşılaştığında
ilk redüklenecek olandan son redüklenecek olana doğru sıralayınız.
6) Titanyum oksidin 1200°C de redüklenebilmesi için ortamdaki CO/CO2 oranı ne olmalıdır?
7) 900°C de titanyum oksidin redüklenebilmesi için ortamdaki H2/H2O oranı ne olmalıdır?
8) C(k) + O2(g) = CO2(g) reaksiyonundaki entropi değişimi ile 2C(k) + O2(g) = 2CO(g)
reaksiyonundaki entropi değişimini karşılaştırınız.
9) Titanyum oksidin CO gazıyla 1200°C de reaksiyona sokulması sonucu redüksiyon
işleminin gerçekleşip gerçekleşmeyeceğini hesaplama yaparak gösteriniz.
10) Elinizde bulunan titanyum oksitten titanyumu metalik olarak kazanmak istiyorsunuz.
Titanyum oksidi redüklemek için hangi metali, ekonomiklik ve bulunabilme açısından tercih
edersiniz.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 76
8
ÇÖZELTİ TERMODİNAMİĞİ
8.1. Giriş
Bu bölüme kadar saf bir yoğun faz ile saf bir gaz fazı arasındaki termodinamik ifadelerle ve
saf bileşiklerin tek bir buhar basıncı ile formüle edildiğini görmüştük. Ancak her zaman saf
maddelerle karşılaşmak mümkün değildir.
Fe-Si katı çözeltisinde (alaşımında) silisyumun silisyum diokside oksidasyonunda silisyum,
saf olarak düşünülemez. Zira silisin tek bir buhar basıncından söz edilemez ve basit reaksiyon
dengeleri artık tatbik edilemez. Bu sistemde denge oksijen basıncının tespiti için silisin buhar
basıncının demir çözeltisinde ne kadar azaldığını bilmek gerekmektedir. Başka bir ifade ile
alaşımdaki silis konsantrasyonu ile alaşımda bulunan silisin buhar basıncı arasındaki ilişkinin
bilinmesi gerekmektedir.
Fe-Si çözeltisinde silisin demir oksitte çözünmüş SiO2 şeklinde (FeO-SiO2 çözeltisi)
oksitlenme durumu çok kompleks bir konudur. Bu durumda denge oksijen basıncı hem demir
içinde çözünmüş silisin, hem de FeO içinde çözünmüş SiO2 nin buhar basıncı-bileşim
ilişkisinin bilinmesi gerekmekte olup sistemdeki bileşen sayısı arttıkça denge daha da
kompleks hale gelecektir.
Çözelti Termodinamiği, bir çözeltideki bileşenlerin buhar basınçları-sıcaklık-bileşim
ilişkilerini incelemektedir.
8.2. Raoult ve Henry Kanunu
Bir A sıvısı, boşaltılmış bir kap içerisine konulursa, bir T sıcaklığında kaptaki basınç A buhar
basıncına ( PAo ) eşit oluncaya kadar (yani doyuncaya kadar) buharlaşır. Bu noktada bir
dinamik denge söz konusudur.
Bu denge nasıldır? Sıvı fazdan A’nın buharlaşma hızı, buhar fazından A’nın yoğunlaşma
hızına eşittir. Buharlaşma hızı, rb( A) , sıvı yüzeyinde A atomları arasındaki çekim güçlerinin
büyüklüğü ile tayin edilmektedir. Bir atomun sıvı yüzeyine gelmesi ve gaz fazına girebilmesi
için kendisine komşu atomların uyguladığı çekim güçlerini yenmesi, yani gerekli bir
aktivasyon enerjisine (Ea) sahip olması gerekmektedir.
T sıcaklığında aktivasyon enerjisinin büyüklüğü, buharlaşma hızını tayin eder. Diğer taraftan
da yoğunlaşma hızı, ry ( A) , birim zamanda sıvı yüzeyine çarpan buhar fazındaki A
atomlarının sayısıyla orantılıdır. Belirli bir sıcaklıkta buhar basıncıyla da orantılıdır. Bu
nedenle,
( )
(8-1)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 77
ve dengede,
(8-2)
( )
yazılabilir. Benzer olarak B sıvısı için T sıcaklığında daha önce boşaltılmış bir kapalı kapta
denge kurulduğu zaman,
(8-3)
( )
yazılabilir.
Şimdi az miktarda B sıvısının A sıvısına ilavesinde ne olacağını inceleyelim. Meydana gelen
A-B çözeltisinde A’nın kısmi molar konsantrasyonu XA ise, sıvının yüzey bileşiminin sıvının
tüm bileşimine eşit olduğu farzedilerek, A atomları tarafından oluşturulan sıvı yüzey alanı
fraksiyonunun XA olduğu kabul edilebilir. A atomları tarafından oluşturulmuş yüzey
noktalarından (sitelerinden) sadece A buharlaşırken, A’nın buharlaşma hızı, XA faktörüne
bağlı olarak azalır ve dengedeyken buharlaşma ve yoğunlaşma hızı eşittir.
A’nın denge buhar basıncı PAo dan PA ya azalır, yani;
(8-4)
( )
ve benzer olarak B için,
(8-5)
( )
yazılabilir. Denklem (8-2) ve (8-4) ile,
(8-6)
ve sonuçta
(8-7)
elde edilir. Benzer şekilde Denklem (8-3) ve (8-5) ile,
(8-8)
yazılabilir. Denklem (8-7) ile (8-8), Raoult Kanunu’nun bir sonucudur. Bu denklemlerin
anlamı şudur;
Çözeltideki bir i maddesinin buhar basıncı, i
maddesinin molar konsantrasyonu ile çözelti
sıcaklığındaki saf i maddesinin basıncının
çarpımına eşittir.
Raoult kanunu, Şekil 8.1 deki
yardımıyla gösterilebilir.
grafik
Şekil 8.1. Molar oran – buhar basıncı ilişkisi
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 78
(8-4) ve (8-5) nolu denklemlerin türetilmesi, A ve B’nin buharlaşma hızları olan ( ) ve
( ) ’nin çözeltinin bileşiminden bağımsız olmasını gerektirir. Bu aynı zamanda A-A, B-B ve
A-B atomlararası etkilerinin aynı olması demektir veya bir başka ifadeyle sıvı yüzeyindeki bir
atomun potansiyel enerji duvarı, bu atoma en yakın olan atomlardan bağımsızdır.
Şimdi A-B atomlararası etkinin, A-A veya B-B atomlararası etkiden daha kuvvetli olduğu ve
sıvı yüzeyindeki herbir A atomunun sadece B atomlarıyla çevrelenmiş olduğu yeterli derecede
seyreltik, B içinde A’nın bir çözeltisini düşünelim. Bu durumda yüzeyindeki A atomları, A
saf sıvısının yüzeyindeki A atomlarından daha kuvvetli bir potansiyel enerjiye sahiptir.
Böylece yüzeyden kaçması veya buhar fazından sıvıya girmesi için A atomları bu potansiyel
duvarı delmelidir. Bu yüzden çözeltiden çıkan A’nın buharlaşma hızı ( ) değerinden ( )
değerine azalır. O zaman,
(8-9)
( )
olmaktadır. Denklem (8-1) ile (8-9) birleştirildiğinde,
(8-10)
( )
( )
elde edilir. ( ) < ( ) olduğundan dolayı denklem (8-10) daki PA, denklem (8-7) deki PA dan
daha küçük değerdedir. Denklem (8-10),
(8-11)
yazılabilir.
B’deki A’nın çözeltisindeki XA artarken sıvının yüzeyindeki A atomlarının hepsinin sadece B
atomlarıyla çevrelenme imkanı azdır. Sıvı yüzeyi üzerindeki komşu A atomları çiftlerinin
oluşumu, bunların bir araya gelmesindeki potansiyel duvarı değerine azaltır ve bu nedenle
( ) nın değeri artar. XA nın kritik değerinin ötesinde
( ) , böylece bileşimden bağımsız
olur. Bu sebeple denklem (8-11), çözeltideki A’ya pek fazla olmaz. Bunun sonucu olarak da
denklem (8-11), sadece B’de A’nın ilk konsantrasyon aralığında geçerlidir. A’da B’nin
seyreltik çözeltileriyle ilgili olarak şu ifade verilmektedir;
(8-12)
Denklem (8-11) ve (8-12), Henry Kanunları olarak bilinmektedir. Şayet A-B arasındaki
etkileşmenin büyüklüğü, A-A ve B-B arasındaki girişimlerden daha büyükse,
( )
( )
olur ve Henry kanunu ile ilgili elde edilen doğru, Raoult kanunu ile elde edilen doğrunun
altında yer alır. Bunun aksi durumda, A-B arasındaki etkileşmenin A-A ve B-B arasındaki
etkileşmelerden daha az ise,
( )
( )
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 79
olur ve böylece Henry kanunu doğrusu, Raoult kanunu doğrusunun üzerinde yer alır. Bu
durum Şekil 8.2 deki grafiklerde görülmektedir.
Şekil 8.2. Raoult ve Henry kanununda molar oran – buhar basıncı ilişkisi
8.3. Çözeltinin Bir Bileşeninin Aktivitesi
T sıcaklığındaki bir çözeltideki i bileşeninin aktivitesi, çözeltideki i maddesinin buhar
basıncının, aynı sıcaklıktaki saf i maddesinin buhar basıncına oranı bize i maddesinin
aktivitesini vermektedir.
(8-13)
Şayet i bileşeni çözeltide ideal olarak davranıyorsa, diğer bir ifadeyle Raoult kanunu
geçerliyse,
(8-14)
kabul edilir. Bu denklem, Raoult kanunun diğer bir ifadesidir. Bu durumda denklem (8-13)
aşağıdaki gibi yazılabilir;
(8-15)
8.4. Çözeltinin Serbest Enerjisi
A ve B gibi iki bileşenden meydana gelen bir çözelti için toplam serbest enerji,
̅
̅
(8-16)
Burada G A ve G B sırasıyla çözeltideki A ve B bileşenlerinin kısmi molar serbest enerjisidir.
Her iki tarafı toplam mol sayısı n A nB N ’e bölerek 1 mol çözelti için,
G X A G A X B GB
(8-17)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 80
şeklindedir. Bu denklemin diferansiyelini alırsak,
dG X A d G A G A dX A X B d G B G B dX B
(8-18)
elde edilir. Burada,
X A dG A X B dG B 0
(8-19)
olduğundan,
dG G A dX A G B dX B
(8-20)
olmaktadır. Çözeltiyi oluşturan bileşenlerin molar oranlarının toplamı 1’e eşittir. Bu durumda,
X A XB 1
dX A dX B 0
(8-21)
dX A dX B
(8-22)
dG G A dX A G B dX B
(8-23)
dG G A dX A G B dX A
(8-24)
dG dX A G A G B
dG
G A GB
dX A
(8-25)
alırsak,
(8-26)
yazılabilir. Denklem (8-26) nın her iki tarafını XB ile çarparsak,
XB
dG
X B G A X B GB
dX A
(8-27)
Denklem (8-27) deki X B G B yerine denklem (8-17) den,
X B GB G X A G A
ifadesini yazarsak,
dG
X B G A (G X A G A )
dX A
dG
XB
X B G A X A G A G
dX A
dG
G XB
G A X A X B
dX A
XB
(8-28)
(8-29)
(8-30)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 81
XA+XB=1 olduğuna göre,
GA G XB
dG
dX A
(8-31)
ve benzer şekilde,
dG
(8-32)
dX B
elde edilmektedir. Bu ifadeler, iki bileşenden oluşmuş bir çözeltide bir bileşenin kısmi molar
serbest enerjisini tespit etmeye yardımcı olmaktadır.
GB G X A
Örnek 8.1. Her oranda çözünürlük gösteren 1377°C de sıvı Cu-Sn çözeltisinin karışım serbest
enerjisi için,
2
G M 3000 X Sn
X Sn
bağıntısı mevcut olduğuna göre XSn=0,3 iken bakır ve kalayın kısmi molar serbest enerji
değerlerini bulunuz.
G M
X Sn
Çözeltinin toplam serbest enerji değerinin XSn ye göre türevinin alınması gerekir.
Çözüm. G Sn G M X Cu
2
G M 3000 X Sn
3000 X Sn
G M
6000 X Sn 3000
X Sn
Bu ifadeyi formülde yerine koyalım,
2
G Sn 3000 X Sn
3000 X Sn 1 X Sn 6000 X Sn 3000
2
G Sn 3000 X Sn
6000 X Sn 3000
G Sn 3000 0.32 6000 0.3 3000
G Sn 270 1800 3000 1470 cal/mol
G M X Sn G Sn X Cu G Cu
2
3000 X Sn
3000 X Sn X Sn 1470 X Cu G Cu
3000 0.32 3000 0.3 0.3 1470 0.7 G Cu
G Cu 270 cal/mol
8.4.1. Bir Çözeltinin Oluşumunda Serbest Enerji Değişimi
Saf bir i maddesi, T sıcaklığında Pio denge buhar basıncına sahiptir. Bu i maddesi bir
çözeltide iken T sıcaklığında daha düşük bir denge buhar basıncı olan Pi değerine sahip olur.
Bu olayı üç adımda düşünebiliriz,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 82
1.Adım (a) : T sıcaklığında Pio basıncında 1 mol i yoğun fazının i buhar
fazına buharlaşması
2.Adım (b) : T sıcaklığında 1 mol i buharının basıncının Pio dan Pi
değerine azalması
3.Adım (c) : 1 mol i buharının Pi buhar basıncında ve T sıcaklığında çözelti
şeklinde yoğunlaşması
Saf i ile çözeltideki i arasındaki molar serbest enerji arasındaki fark,
G(a) G(b) G(c)
değerine eşittir. Ancak olay dengedeyken G(a) ve G(c) değeri sıfırdır. Denge halinde olayın
tamamı G(b) değerine eşittir.
P
G(b) RT ln i
Po
i
veya
G(b) Gi (çözelti ) Gi ( saf ) RT ln ai
ifadesiyle yazarak,
̅̅̅̅
̅
(8-33)
Sabit T ve P de A maddesinin nA molü ile B maddesinin nB molü bir çözelti yapmak üzere
karıştırılırsa,
o
Karışmadan önceki serbest enerji = n A G A
n B GBo
Karışmadan sonraki serbest enerji= n A G A nB G B
Karışma sırasında;
o
G M n A G A nB G B n A G A
n B GBo
̅̅̅̅
̅̅̅̅
o
G M n A G A G A
n B G B GBo
(8-34)
veya 1 mol çözelti için yazarsak,
G M X A G A X B G B
ve
G M X A RT ln a A X B RT ln a B
G M RT X A ln a A X B ln a B
(8-35)
(8-36)
şeklinde yazılabilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 83
8.4.2. Teğet Metodu ile Çözeltinin Molar Değerlerini Bulmak
Çözeltinin toplam serbest enerji değişimi belli ise, çözeltiyi oluşturan bileşenlerin kısmi molar
serbest enerjilerini teget metodu ile tespit etmek mümkündür.
A-B çözeltisinde XA bileşimini (şekildeki p noktası) ele alalım. XA bileşiminde çözeltinin
toplam serbest enerjisi “pq” ya da “or” kadar bir değere eşittir. XB değeri ise “rq” veya “op”
değerine denktir.
G A G
M
G M
XB
X A
denkleminden yola çıkarak,
rs
pq rs os
rq
“os” aralığı çözelti içinde A maddesinin kısmi molar serbest enerji değerini vermektedir.
G A pq rq
Örnek 8.2. 1320°C de sıvı Kalay-Bakır alaşımının teşekkül serbest enerjileri (GM)
verildiğine göre XSn=0.3 deki kalay ve bakırın aktivite değerlerini bulunuz.
XSn
0.0
M
0
G
(cal/mol)
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9 1.0
-1777 -2739 -3187 -3322 -3257 -3025 -2618 -2025 -1264 0
Çözüm.
İlk önce kalayın molar oranına göre çözeltinin toplam serbest enerjisi değişiminin grafiği
çizilir. Daha sonra da XSn=0.3 deki noktadan teğet çizilir ve y eksenindeki kesim noktaları
bakır ve kalayın kısmi molar serbest enerji değerleri tespit edilir. Bu değerler kullanılarak iki
bileşenin aktivite değerleri hesaplanır.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 84
̅̅̅̅
̅̅̅̅
8.5. Çözelti Türleri
8.5.1. İdeal Çözeltiler
İdeal çözeltilerde
(Raoult Kanunu) olup A-B ikili bir ideal çözeltide,
(
)
(8-37)
şeklinde yazılabilir. Burada;
̅̅̅̅
(8-38)
̅̅̅̅
(8-39)
olmaktadır. Yine ideal çözeltide sabit T ve sabit bileşimdeki bir sistem için,
(
)
yazılabilir. Burada G* sistemin serbest enerjisi ve V* sistemin hacmidir. Sabit T, P ve nj de
sistemdeki i bileşeninin mol sayısı ni deki değişme için,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 85
̅
(
)
Bu nedenle çözeltideki “ i ” bileşeni için,
̅
(
)
̅
Saf “ i ” bileşeni için,
(
)
İdeal bir çözeltinin teşekkülünde meydana gelen hacim değişmesi,
[
( ̅
)
(
̅̅̅̅
Bu durumda,
̅̅̅̅
]
)
(̅
)
̅̅̅̅
ifadesinde basınca bağlı bir terim olmadığına göre basınca göre türevi sıfırdır.
̅̅̅̅
(8-40)
Görüldüğü üzere i maddesinin ideal çözelti oluşumunda hacimsel bir değişim olmamaktadır.
Gibbs-Helmoltz denkleminden yola çıkarak ideal çözelti oluşumda entalpi değişimine
bakarsak,
Çözeltideki “ i ” bileşeni için,
[
( ̅
)
(
)
]
̅
Saf haldeki “ i ” bileşeni için,
[
İdeal çözelti oluşumda,
[
̅
(
[
]
)
]
̅̅̅̅
(
)
]
̅
̅̅̅̅
̅̅̅̅
ifadesi T’ye bölünüp T’ye göre türevi alınacaktır. T’ye bölündüğünde kalan
ifadede sıcaklığa bağlı bir terim bulunmamaktadır.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 86
(
̅̅̅̅
̅̅̅̅
)
̅
(8-41)
Görüldüğü üzere ideal çözeltilerde i maddesinin entalpisinde bir değişim olmamaktadır. Diğer
bir ifadeyle i maddesinin saf halindeki entalpi değeri ile çözelti içindeki entalpi değeri aynı
kalmaktadır.
Bir bileşenin serbest enerjisinin sabit basınçta sıcaklığa göre türevinin o bileşenin entropisinin
ters işaretlisini verdiğini biliyoruz. Bu durumda çözeltinin toplam değerleri için,
(
(
)
)
(
(
)
(8-42)
)
Herhangi bir çözelti için,
İdeal çözeltide
olduğundan,
(8-43)
elde ederiz.
Örnek 8.3. Bir Al – Mg alaşımı %91,5 Al içermektedir. Bu çözeltinin ideal davranış
gösterdiği kabul edilmesi durumunda 298 K de çözeltinin toplam serbest enerji, toplam
entalpi ve toplam entropi değerlerini bulunuz. (Al: 26,98 Mg: 24,32)
Çözüm. İlk önce aluminyum ve magnezyumun molar oranlarını bulalım.
İdeal çözelti olduğu için toplam entalpi değişimi sıfırdır.
(
(
)
)
(
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 87
(
)
(
)
(
)
İdeal çözelti için bir başka yol, Denklem (8-43) den,
(
)
Örnek 8.4. 1000 K de ideal çözelti yapan A ve B maddelerinden ibaret sıvı çözeltide XB=0,4
için A ve B maddelerinin buhar basınçlarını bulunuz.
Çözüm:
A maddesinin buhar basıncı,
B maddesinin buhar basıncı,
Örnek 8.5. Bakır-Nikel ikili sistemi ideal çözelti tipinde alaşım yaptıklarına göre 727°C de
XNi=0,3 olan alaşımdaki nikelin oksitlenmemesi için ortamın oksijen basıncı ne olmalıdır?
Ni(k) + ½ O2(g) = NiO(k)
∆G°= -58450+23,55.T cal/mol
Çözüm.
Denge durumunda oksijen buhar basıncını hesaplayalım. Reaksiyon denge halinde iken
serbest enerji değişimi sıfırdır.
√
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 88
İdeal çözeltide molar oran aktiviteye eşittir. Bu nedenle nikelin aktivitesi de molar oranına
eşittir. NiO ise çözeltiyi oluşturan bir bileşen değildir, çözelti bakır – nikel alaşımıdır. Bu
nedenle nikel oksidin aktivite değeri “ 1 ” dir.
√
√
√
√
Alaşımdaki nikelin oksitlenmemesi için ortam oksijen basıncı 6,16.10-15 atm’den küçük
olmalıdır.
8.5.2. İdeal Olmayan Çözeltiler
Bileşenlerin aktiviteleri, kısmi molar konsantrasyonlarına eşit olmayan çözeltilere ideal
olmayan çözelti adı verilmektedir (Henry Kanunu). Bu durumda, bir bileşenin aktivitesi ile
molar oranı arasında bir aktivasyon katsayısı (γ) bulunmaktadır.
(8-44)
Örnek 8.6. 1200 K de sıvı durumda bulunan Pb-Sb ikili sisteminde XSb=0,2 iken karışımın
serbest enerji değişimi -972 cal/mol, antimuanın kısmi molar serbest enerji değişimi ise
-3210 cal/mol dür. 1200 K de sistemdeki kurşunun aktivite ve aktivite katsayısını
hesaplayınız.
Çözüm.
̅̅̅̅
̅̅̅̅
̅̅̅̅
(
̅̅̅̅
)
̅̅̅̅
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 89
Örnek 8.7. Sıvı Zn+A alaşımında 1000 K de XZn=0,5 de çinkonun buhar basıncı 30 mmHg
olarak ölçülmüştür. Bu sıcaklıkta çinkonun aktivitesini, aktivite katsayısını ve kısmi molar
serbest enerji değişimini hesaplayınız.
( )
Çözüm.
( )
̅̅̅̅
8.5.3. Düzgün Çözeltiler
Düzgün çözeltilerin özelliklerine geçmeden önce α fonksiyonunu tanımlamak gerekir. Bu
fonsiyon, düzgün çözeltideki bileşenlerin aktivite katsayıları ile molar oranları arasındaki bir
ilişkiyi göstermektedir ve denklem (8-45) de verilmiştir.
(8-45)
(
)
Düzgün çözeltilerin özellikleri “aşırı fonksiyonlar” kavramı ile açıklanabilir. Bu aşırı
fonksiyon basit olarak ideal çözelti ile ideal olmayan çözelti arasındaki bir farktır. Düzgün
çözeltinin toplam serbest enerjisi,
(8-46)
(8-47)
Burada ∆GM toplam serbest enerji, ∆GM,ideal ideal çözeltinin toplam serbest enerjisi, Gxs ise
çözeltinin aşırı serbest enerjisidir.
Belirli bir çözelti için,
İdeal çözelti için,
Ve sonuçta,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 90
(8-48)
Denklem (8-48) in anlamı, düzgün çözeltide çözeltinin toplam aşırı serbest enerjisi, toplam
entalpi değerine eşittir.
İlave olarak,
(
(
)
)
(
)
Denklemin sağ tarafındaki ilk kısım ideal çözeltinin toplam serbest enerji değerini
vermektedir. Bu durumda ikinci kısım da çözeltinin toplam aşırı serbest enerjisini veya
toplam entalpi değerini vermektedir.
(
)
(8-49)
α fonksiyonunu kullandığımızda,
(
)
(
)
Sonuçta,
(8-50)
Denklem (8-50) den sadece çözeltinin toplam aşırı serbest enerjisini (veya entalpisini)
hesaplayabileceğinizi, A ve B bileşenlerinin aşırı serbest enerjisinin (veya entalpisinin)
hesaplamasında kullanamayacağınızı unutmayınız.
Örnek 8.8. Sıvı Cu-Ag sistemi 1400 K de düzgün çözelti oluşturmaktadır. XCu=0,4 de
çözeltideki bakırla dengedeki kısmi oksijen basıncı 17,378 atm’dir. Buna göre;
a) Bakır ve gümüşün aktivite ve aktivite katsayılarını hesaplayınız
b) Bakır ve gümüşün kısmi molar serbest enerjilerini, entalpilerini ve entropilerini
hesaplayınız.
Çözüm.
2Cu(k) + ½ O2(g) = Cu2O(k)
ΔGo= -46700+34,1.T cal/mol
a) Çözeltiyi oluşturan bileşenler bakır ve gümüştür. Cu2O ise çözelti dışında bir saf
malzemedir ve aktivite değeri “1” dir.
Reaksiyon dengede iken denge oksijen basıncı verilmiştir, buradan bakırın aktivite değeri elde
edilebilir.
√
√
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 91
α katsayısını bularak diğer bileşenin aktivite ve aktivite katsayısını hesaplayabiliriz.
(
(
(
)
)(
(
b)
)
)
)(
)
̅̅̅̅
(
)
̅̅̅̅
(
)
̅̅̅̅
(
)
̅̅̅̅
(
)
̅̅̅̅
(
)
̅̅̅̅
(
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 92
Örnek 8.9. 1027°C deki Cu-Zn düzgün çözeltisi için bazı veriler aşağıda verilmiştir. XCu=0,4
için çözeltinin toplam serbest enerji, toplam entalpi ve toplam entropi değerlerini
hesaplayınız.
XCu
0,8
0,922
γCu
0,7
0,837
0,6
0,728
Çözüm.
Hangi molar oran değeri olursa olsun α değeri sabittir. Tablodan herhangi bir molar orandaki
veriyi ele alalım. XCu=0.7 ve γCu=0.837 değerlerini aldığımızda,
(
(
)
)
Diğer molar oranlarda da aynı α değeri bulunduğuna göre artık sorudaki XCu=0,4 molar
oranındaki aktivite ve aktivite katsayılarını bulabiliriz.
(
)(
(
)(
)
(
)
(
(
)
)(
)
)
(
[
(
)(
)
]
)
[
(
(
]
)
[
(
)
)
]
8.5.4. Seyreltik Çözeltiler
A-B gibi bir ikili çözelti sisteminde bileşenlerden biri çok fazla miktarda (çözen madde),
diğer bileşen ise çok az miktarda (çözünen madde) bulunduğu zaman oluşan çözeltilere
seyreltik çözelti adı verilmektedir. Örneğin çelik bir Fe-C alaşımı olup bir seyreltik çözeltidir.
Burada demir çok fazla miktardaki madde, C ise az miktarda olan maddedir. Bu tip
çözeltilerde çok olan madde ideal davranış (Raoult kanunu) gösterirlerken az olan madde
ideal olmayan (Henry kanunu) davranış gösterirler.
Örneğin Fe-C sisteminde, XFe = aFe (Raoult kanunu) ve aC = XC . γC (Henry kanunu) geçerli
olmaktadır.
Örnek 8.10. %0,6 C içeren çelikteki karbon, 925 K de 1 atm toplam basınca sahip gaz
atmosferinde dengede bulunmaktadır. Çelik seyreltik çözelti tipinde Fe-C ikili sistemidir.
Dengedeki gazların bileşimi %95,2 CO ve %4,8 CO2 dir. Buna göre,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 93
a) çelikteki demir ve karbonun aktivitesini
b) demir ve karbonun kısmi molar serbest enerjileri ile sistemin karışım serbest
enerjini hesaplayınız. (Fe:56, C:12)
ΔG0= 40800 – 41,7.T cal/mol
CO2(g) + C(k) = 2CO(g)
Çözüm.
a) Denge halinde,
(
)
(
)
Çözelti seyreltik çözelti tipinde olup demir çözen maddedir ve XFe=aFe dir.
b)
̅̅̅̅
(
̅̅̅̅
(
̅̅̅̅
̅̅̅̅
(
)
)
)(
)
(
)(
)
8.6. Aktivite Tayinine Gibbs-Duhem Denkleminin Tatbikatı
Sadece bir bileşenin aktivitesinin bileşim ile değişiminin deneysel tayini çok sık
yapılmaktadır. Böyle durumlarda Gibbs-Duhem denkleminin yardımıyla aktivite değeri
bulunabilir.
̅̅̅̅
(
̅̅̅̅
)
(
)
Burada RT ifadesi parantez çarpanı olup elimine edilebilir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 94
(
)
∫
(
∫
(
∫
)
)
∫
(
(
)
(8-51)
)
Bu integral ancak grafik yoluyla çözülebilir. Şekil 8.3 deki gibi grafik çizildiğinde taralı
alandan A bileşeninin aktivitesi tayin edilebilir.
Şekil 8.3. (XB/XA) ya göre log aB nin grafiği
Bu grafikte;
1) XB→1 iken aB→1 olmakta, bununla beraber log aB→0 ve (XB/XA)→∞ olmaktadır.
Yani XB→1 de eğri sonsuza gitmektedir.
2) XB→0 iken aB→0 olup log aB→ -∞ olmaktadır.
Bu iki husustan ikincisi bizim için önemlidir. Çünkü taralı alan hesabı bu durumda kesin
olmamaktadır. Bu nedenle Gibbs-Duhem denkleminde aktiviteler yerine aktivite katsayıları
alınmıştır.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 95
Bu denklemi daha önce yazılan,
denkleminden çıkarırsak,
(
)
∫
(
∫
(
∫
)
)
∫
(
(
)
(8-52)
)
Şekil 8.4, log γB nin A-B ikili çözeltisinde kompozisyona bağlı olan değişimini
göstermektedir. Buradaki taralı alan log γA yı vermektedir.
Şekil 8.4. (XB/XA) ya göre log γB nin grafiği
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 96
Örnek 8.11. Krom-Titanyum çözeltisinde 1250°C için aşağıdaki veriler elde edilmiştir. Bu
verilerden yararlanarak XTi=0,6 için Cr-Ti çözeltisinde aTi değerini hesaplayınız.
XCr
aCr
0,09
0,302
0,19
0,532
0,27
0,660
0,37
0,778
0,47
0,820
0,67
0,863
0,78
0,863
0,89
0,906
Çözüm.
XCr
0,09
0,19
0,27
0,37
0,47
0,67
0,78
0,89
XTi
0,91
0,81
0,73
0,63
0,53
0,33
0,22
0,11
(XCr/XTi)
0,0989
0,2346
0,3699
0,5873
0,8867
2,0310
3,5460
8,0910
aCr
γCr
0,302
0,532
0,660
0,778
0,820
0,863
0,863
0,906
3,356
2,800
2,444
2,103
1,745
1,288
1,106
1,018
log γCr
0,5258
0,4472
0,3881
0,3228
0,2417
0,1100
0,0437
0,0076
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 97
Örnek 8.12. 435°C de sıvı durumda bulunan Zn-Cd ikili alaşımında çinkonun aktivite
katsayıları tespit edilmiş ve aşağıdaki bağıntı ile ifade edilmiştir. Bu sıcaklıkta XCd=0,3 olan
Zn-Cd alaşımında kadmiyumun aktivitesini bulunuz.
2
ln Zn 0,87 X Cd
0,3 X 3Cd
Çözüm.
ln Cd
ln Zn ( X Cd 0 , 3)
ln Zn ( X Cd 1)
X Zn
d ln Zn
X Cd
2
3
ln Zn 0,87 X Cd
0,3 X Cd
2
d ln Zn 2 0,87 X Cd 3 0,3 X Cd
dX Cd
ln Cd
X Cd 0, 3
X Cd 1
ln Cd
X Cd 0, 3
X Cd 1
ln Cd
X Cd 0 , 3
1 X Cd
2
1,74 X Cd 0,9 X Cd
dX Cd
X Cd
2
2
3
1,74 X Cd 0,9 X Cd
1,74 X Cd
0,9 X Cd
X
X Cd
X Cd
X Cd
Cd
1,74 2,64 X
Cd
dX Cd
2
0,9 X Cd
dX Cd
X Cd 1
2,64
0,9
ln Cd 1,74 0,3 1
0,3 2 12
0,33 13
2
3
ln Cd 1,218 1,2012 0,2919
ln Cd 0,3087
Cd 1,3617
aCd Cd X Cd 1,3617 0,3
aCd 0,409
8.7. Çözeltilerde Yarı – Kimyasal Model
Katı ve sıvı maddelerinin meydana getirdikleri çözeltilerin toplam enerjileri başlıca üç etkiye
bağlı olabilir,
a) Mekanik etki: Farklı büyüklükte atomların meydana getireceği iç gerilimler
b) Kimyasal değer etkisi: Farklı kimyasal değerleri olan atomlar dolayısıyla meydana
gelebilecek kuvvetlerin etkisi
c) Kimyasal etki: Atomlar arasındaki kimyasal bağlardan ileri gelen etki
Her maddede bu üç etki az çok birlikte kendini gösterebilir. Ancak üçünü de aynı zamanda
göz önünde tutmak suretiyle maddenin toplam enerjisini hesaplamak çok güç veya
imkansızdır. Bu sebepten dolayı, burada bunlardan birisi, yani kimyasal etki faktörü tek
başına incelenmiştir. Sadece atomlar arasındaki bağları göz önüne alan bu yaklaşım metoduna
yarı-kimyasal metot adı verilmektedir. Bu metot, ancak bir atoma en yakın komşu olan eşit
mesafedeki atomları ele almakta, daha uzaktaki atomların etkisi ihmal edilmektedir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 98
Şekil 8.5. A-B atomlarının oluşturduğu yapı ve farklı bağlar
A ve B atomlarının oluşturduğu bir kristali ele alalım. Bu yapıda A-A, A-B ve B-B atomlar
arası bağları ve bu bağların EAA, EAB ve EBB bağ enerjileri mevcuttur. Buna bağlı olarak
atomlar arası bağ parametresi (Ω),
(
[
(8-53)
)]
ile gösterilmektedir. Bu denklemdeki Z koordinasyon sayısı, N ise Avogadro sayısıdır.
Bir çözeltinin toplam entalpi değerinin atomlar arası bağ parametresiyle olan ilişkisi,
(8-54)
Çözeltideki bir bileşenin entalpisi,
̅̅̅̅
terimini denklem (8-54) den elde edelim ve yukarıdaki denkleme
Olup buradaki
yerleştirelim. Denklem (8-54) deki B’nin molar oranı A’nın molar oranı ile ilişkili olduğu için
XB ifadesini de XA türünden yazalım.
(
)
Bu denklemin XA ya göre türevini alalım.
(
̅̅̅̅
)
[
(
)
(
)]
̅̅̅̅
̅̅̅̅
(8-55)
̅̅̅̅
(8-56)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 99
Bununla birlikte,
̅̅̅̅
(8-57)
(8-58)
Örnek 8.13. Sıvı Al-Zn çözeltisinde aşağıdaki bağıntı mevcuttur. 550°C de XZn=XAl=0,5 olan
alaşımda çinkonun aktivitesini bulunuz.
(
)
Çözüm.
(
)
Örnek 8.14. Sıvı pirinç (Cu-Zn) alaşımında
bağıntısı mevcut olup
saf bakırın buhar basıncını bulmaya yarayan formül aşağıda verilmiştir. 1200°C de XCu=0,6
olan alaşımda bakırın buhar basıncını bulunuz.
Çözüm.
(
)
Bakırın saf haldeki basıncını bulalım.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 100
(
)(
)
Örnek 8.15. 1150°C de Cu-Ag alaşımında XAg=0,4 de atomlar arası bağ parametresi 4000
cal/mol dür. Çözeltinin toplam serbest enerji değerini bulunuz.
Çözüm.
(
)
(
(
(
)
)
)
8.8. İkili Denge Diyagramında Denge Şartları
ve fazlarının bulunduğu denge
diyagramında, ötektik sıcaklığının
altındaki bir T sıcaklığında ve
doymuşluk sınırında, B maddesinin
fazından fazına geçişini ele
alalım. Denge halinde,
Denge halinde serbest enerjiler de
birbirine eşittir.
X A
X B
X A
α fazında A bileşeninin molar oranı
X B
β fazında B bileşeninin molar oranı
α fazında B bileşeninin molar oranı
β fazında A bileşeninin molar oranı
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 101
fazı seyreltik çözelti tipinde olup burada çözen madde (çok olan madde) B maddesi Raoult
kanununa göre hareket edecektir, yani ideal davranış gösterecektir. fazında ise B maddesi
çözünen maddedir (az olan madde) ve Henry kanunu uygulanır.
RT kısmı elimine edilebilir.
Sonuçta,
(8-59)
(8-60)
Bu formüller yardımıyla, ikili bir denge diyagramında ötektik sıcaklığın altında olmak üzere
herhangi bir sıcaklıkta doygunluk sınırlarındaki A ve B bileşenlerinin aktivite katsayılarını
tespit etmek mümkündür.
Örnek 8.16. Aşağıdaki şekilde verilen denge diyagramından yararlanarak 700 K de A ve B
bileşenlerinin aktivitelerini bulunuz.
Çözüm.
Diyagramda 700 K için çözünürlük sınırları X B 0,08 ve X B 0,95 dir. Bu durumda A ve
B bileşeninin aktivite katsayıları ve aktivite değerleri,
A
X A 0,92
18,4
X A 0,05
B
a A A X A 18,4 0,05 0,92
X B 0,95
11,875
X B 0,08
aB B X B 11,875 0,08 0,95
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 102
Örnek 8.17. Aşağıda verilen A-B ikili denge diyagramından yararlanarak 900 K de XB=0,1 de
çözeltinin toplam serbest enerji değerini hesaplayınız.
Çözüm.
XB=0,1 sorulduğuna göre α fazında olduğumuz belli olmaktadır. Bu durumda bu fazda A
bileşeni ideal davranacağından XA=aA=0,9 olarak alınmalıdır. Buna karşılık B bileşeni ideal
davranmamakta ve aktivitesi bulunmalıdır. İlk yapılacak işlem doygunluk sınırından B
bileşeninin aktivite katsayısını bulmaktır.
B
X B 0,91
5,353
X B 0,17
Bu aktivite katsayından yola çıkarak 900 K deki atomlar arası bağ parametresi bulunmalıdır.
Bu değer 900 K için sabit olacağından XB=0,1 olan yerdeki aktivite katsayısı ve akabinde
aktivite değeri bulunabilir.
RT ln B
X
2
1,987 900 ln 5,353
0,832
A
4353,5 cal/mol
XB=0,1 için aktivite katsayısı,
ln B
X A
RT
2
4353,5 0,9
1,97189
1,987 900
2
B 7,184
a B B X B 7,184 0,1 0,7184
Çözeltinin toplam serbest enerjisi,
G M RT X A ln a A X B ln a B
G M 1,987 900 0,9 ln 0,9 0,1ln 0,7184
G M 1788,3 0,09482 0,03307
G M 228,7 cal/mol
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 103
8.8.1. Çözünme Entalpisi
Bir A-B sisteminde, α ve β gibi katı çözeltilerdeki çözünme entalpi değerleri doymuşluk
sınırlarından yola çıkılarak hesaplanabilir.
(8-61)
(8-62)
formülüne göre, ln
X B
ye karşılık (1/T) nin grafiği çizildiğinde elde edilen eğrinin eğimi
X B
H B
bize
değerini verecektir.
R
Örnek 8.18. Aşağıda şekilde verilen denge diyagramından faydalanarak A ve B nin katı halde
çözünürlük sınırlarında çözünme entalpilerini bulunuz.
T, K
X B,d
X B,d
900
800
700
600
0,17
0,12
0,08
0,05
0,91
0,93
0,95
0,97
Çözüm.
T, K
900
800
700
600
1/T
-3
1,11.10
1,25.10-3
1,43.10-3
1,67.10-3
X B,d / X B,d
ln X B,d / X B,d
0,17/0,91 = 0,1868
0,12/0,93 = 0,1290
0,08/0,95 = 0,0842
0,05/0,97 = 0,0515
- 1,6776
- 2,0477
- 2,4744
- 2,9653
Bu datalara göre grafik çizersek, elde edilen grafiğin eğimi bize B bileşeninin α fazı içindeki
çözünme entalpisini verecektir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 104
-4
ln (XB/XB)
-3
-2
-1
0
1,0
1,2
1,4
1,6
1,8
(1/T)x1000
H B
Y
R
X
Y 2,9653 1,6776 1,2877
tg
X 1,67 10 3 1,11 10 3 0,56 10 3
H B
1,2877
R
0,56 10 3
H B R 2299,46 4569 cal/mol
A bileşeninin çözünme entalpisi ise,
T, K
900
800
700
600
-3
1,11.10
1,25.10-3
1,43.10-3
1,67.10-3
X A,d / X A,d
ln X A,d / X A,d
0,09/0,83 = 0,1084
0,07/0,88 = 0,0795
0,05/0,92 = 0,0543
0,03/0,95 = 0,0316
- 2,2216
- 2,5314
- 2,9123
- 3,4553
1/T
Y 3,4553 2,2216 1,2337
X 1,67 10 3 1,11 10 3 0,56 10 3
H A
Y
R
X
Y
1,2337
R
1,987
4378 cal/mol
X
0,56 10 3
tg
H A
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 105
8.8.2. Molar Oran – Serbest Enerji – Aktivite Diyagramları
Örnek 8.19. Aşağıda verilen A-B ikili denge diyagramında T1, T2 ve T3 sıcaklıkları için molar
oran – serbest enerji grafiklerini çiziniz.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 106
Örnek 8.20. Aşağıdaki A-B ikili denge diyagramında T sıcaklığı için molar oran – aktivite
grafiğini çiziniz.
8.9. Çok Bileşenli Çözeltiler
Bir ikili denge diyagramında çözünen “i” bileşeninin aktivite katsayısı,
ilişkisinden bulunmaktadır. Ancak aktivitenin sayısal değeri standart durumdan farklı
olacaktır. Yukarıda verilen denklem çok bileşenli çözeltiler için tam olarak iyi sonuç
vermemektedir. Zira çözelti içinde küçük miktarlarda bulunan çözünen maddeler, diğer
çözünen maddeler üzerinde etkili olmaktadır. Diğer bir ifadeyle A-B ikili sisteminde çözen A
maddesi iken B, C, D… gibi birkaç tane çözünen madde bulunmaktadır. Böyle bir durumda,
örneğin B maddesinin aktivite katsayısına fB denilirse, çok bileşenli çözeltide B maddesinin
aktivite katsayısı, diğer bileşenlerin etkisi de göz önüne alınarak,
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 107
şeklinde bulunur. Burada
terimi, B’nin aktivite katsayısı üzerine C maddesinin etkisinin
bir ölçümü olan etkileme katsayısı’dır. B maddesinin aktivite katsayısını hesaplarken C, D…
gibi maddelerin molar oranları da devreye girecektir.
Bu denklemde,
olduğundan,
(
)
[
]
[
]
[
]
Bu kısmi türevdeki ifadeler
şeklinde gösterilebilir. Bu ifadelere ise “etkileşim
parametresi” adı verilmektedir. Bu durumda,
Bu arada,
kullanılmaktadır.
olmaktadır. Bununla beraber genelde logaritma ve % bileşen değerleri
(8-63)
Buradaki “e” etkileşim parametresidir ve
ilişkisi söz konusudur (M=mol
ağırlığı). Bu arada aktivite değeri de aşağıdaki denklem yardımıyla hesaplanmaktadır.
(8-64)
Örnek 8.21. Fe – Cr alaşımı saf alumina (Al2O3) potada 1700°C de PH2O/PH2 oranı 0,00353
olan bir gaz atmosferi ile dengededir. Denge reaksiyonu,
H2(g) + [O]% = H2O(g)
∆G°= -2262 cal/mol
Alaşım %1,9 Cr ve %0.032 oksijen içerdiğine göre potadan Fe – Cr alaşımına geçen
aluminyum % sini bulunuz. (
)
Çözüm.
(
)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 108
(
)
(
)(
)
(
)
Problemler
P1) 1863 K deki sıvı Fe – Mn alaşımındaki Gxs değerlerinin molar orana göre değişimi
aşağıdaki tabloda verilmiştir.
XMn
Gxs
(jul/mol)
0,1
395
0,2
703
0,3
925
0,4
1054
0,5
1100
0,6
1054
0,7
925
0,8
703
0,9
395
a) Fe – Mn sıvı alaşımının düzgün çözelti oluşturup oluşturmadığını gösteriniz.
b) XMn=0,4 de demirin ve manganın aşırı serbest enerjilerini bulunuz.
c) XMn=0,2 de demirin kısmi buhar basıncını bulunuz. Demirin buharlaşma sıcaklığı 3070°C,
buharlaşma ısısı 81300 cal/mol’dür.
P2) 1590°C deki sıvı Fe-Mn alaşımında XMn=0,5 de çözeltinin aşırı serbest enerjisi 263
cal/mol olduğuna göre XMn=0,7 de demir ve manganın çözeltideki buhar basınçlarını bulunuz.
∆Hbuh(Mn)= 53700 cal/mol
Tbuh(Mn)=2095°C
∆Hbuh(Fe)= 81300 cal/mol
Tbuh(Fe)=3070°C
P3) 1200°C de Atomlararası bağ parametresi (Ω) -5000 cal/mol olan sıvı Cu-Zn alaşımında
XCu=0.3 de, çözelti içindeki bakırın buhar basıncını ve çözeltinin toplam serbest enerjisini
bulunuz.
P4) Düzgün çözelti oluşturan Al-Mg alaşımında 800°C de (1073 K) magnezyumun kısmi
molar entropi değeri 1,92 cal/mol.K ve kısmi molar entalpi değeri -1170 cal/mol olarak tespit
edilmiştir. Çözeltinin toplam serbest enerji değerini bulunuz.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 109
P5)Yanda verilen denge diyagramından
faydalanarak 1000 K de XA=0.9 da
çözeltinin toplam serbest enerjisini,
toplam entalpisini ve toplam entropisini
bulunuz.
P6) Aşağıdaki A-B denge diyagramında T sıcaklığı için molar oran – serbest enerji ve molar
oran – aktivite grafiğini çiziniz.
P7) Çözünmüş oksijen ve kükürt içeren sıvı bakır, 1206°C de N2, O2, SO, SO2 ve SO3
bileşenlerini içeren bir gaz fazıyla dengededir. %0,01 S ile %0,25 Oksijen içeren bakır
ergiyiği ile dengede bulunan kısmi SO2 basıncını bulunuz.(R=8,314 J/mol.K)
½ S2(g) + O2(g) = SO2(g)
½ O2(g) = [O]%
½ S2(g) = [S]%
∆G°= -361670+72,68.T joule/mol
∆G°= -85350+18,54.T joule/mol
∆G°= -119660+25,23.T joule/mol
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 110
9
ELEKTROKİMYA
9.1. Elektrokimyasal Kavramlar
Elektron transferini içeren reaksiyonlar, genel olarak redüksiyon (indirgenme) – oksidasyon
(yükseltgenme) reaksiyonları veya diğer bir ifadeyle Redoks reaksiyonları olarak tarif
edilirler.
Elektronlar bir madde tarafından kaybedilirken diğeri tarafından kazanılır. Aşağıda basit bir
örneği verilmiştir.
Elektron transferi içeren bir reaksiyonun stokiometrisi, Faraday Kanunu ile hesaplanan
elektriksel miktarla ilişkilidir. Bu kanuna göre;
a) Bir eşdeğerlik ürün, 96487 Coulomb değerindeki yük ile üretilir
b) Bir eşdeğerlik kimyasal değişim, 96487 Coulomb değerinde elektrik üretir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 111
Oksidasyona uğrayan eşdeğerlik bir madde, Avogadro sayısı (N) kadar iyon ve elektron
üretir.
Faraday kanununa göre, 96487 Coulomb’luk elektrik, Avogadro sayısındaki elektronlar ile de
ilişkilidir. Kimyasal eşdeğerlikle ilişkili olan yük miktarı, Faraday (F) olarak bilinmektedir.
Bu yolla gerçekleşen bir redoks reaksiyonu, elektrik akımı üretecektir. Reaksiyon fiziksel
olarak ayrıştırılabilirse bu elektrik akımı gerçekleşecektir zira elektronlar sistemin bir
kısmında kaybolacak, diğer kısmında ilave olacaktır.
Yukarıdaki gösterimde, A ve AX karışımı ile B ve BX karışımı fiziksel olarak ayrılmış ancak
iki yolla bağlanmışlardır;
a) sadece elektronların geçmesine izin veren elektronik iletken,
-
b) sadece X iyonlarının geçmesine izin veren iyonik iletken.
Böyle bir düzenek gerçekleştirildiğinde, elektronlar soldan sağa doğru, iyonlar ise sağdan sola
doğru akarak reaksiyon gerçekleşir ve sonunda elektro-nötralite sağlanır. Bu şekilde
gerçekleşen reaksiyon türüne elektrokimyasal reaksiyon denir. Elektrokimyasal reaksiyonun
tespit edilebilir (ölçülebilir) bir elektrik akımı ürettiği bir düzeneğe, Galvanik Hücre adı
verilmektedir. Yukarıda düzenekte gösterildiği gibi bir yarı hücrede oksidasyon, diğer yarı
hücrede redüksiyon gerçekleşir. Oksidasyonun meydana geldiği elektroda anot, redüksiyonun
gerçekleştiği elektroda ise katot adı verilmektedir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 112
A + BX → A + BX
Reaksiyonun serbest enerjisi (ΔG) negatif ise, reaksiyon soldan sağa doğru gerçekleşir.
Elektrokimyasal reaksiyon da temelde yukarıdaki reaksiyon gibi iken (ancak elektronların
anottan katota hareketi gibi farklı bir düzenleme vardır), kimyasal reaksiyon ile
elektrokimyasal reaksiyonun itici güçleri (driving force) birbirleriyle ilişkili olmalıdırlar.
Elektriksel potansiyel farkı veya elektriksel voltaj (gerilim) varsa elektronlar akar. Bir
galvanik hücre, var olan elektrik potansiyelini özdeş ama zıt yönde, bir dış kaynaktan gelen
voltajla engellemek için uygun bir dış devre ile birleştirilirse, hücrenin elektrokimyasal
reaksiyonu sona erer. Elektrokimyasal reaksiyon dengeye getirilmiştir. Bu tip dengeye
elektrokimyasal denge adı verilmektedir. Yani kimyasal itici güç (ΔG) bir zıt itici güç ile
dengelendiğinde, ΔG≠0 olsa bile, reaksiyon elektrokimyasal olarak dengededir.
9.2. Elektrokimyasal Hücre Termodinamiği
Aşağıdaki reaksiyonu göz önüne alalım,
A + BX → A + BX
ΔG < 0
Bütün reaktanlar ve ürünler, karışmış halde aynı reaktörde bulunduğu zaman, yukarıdaki
kimyasal reaksiyon serbest enerji değişimine eşdeğer bir itici güçle soldan sağa doğru (ürünler
yönünde) gerçekleşecektir. ∆G=0 olana kadar reaksiyon devam edecektir. Bir galvanik hücre,
aşağıdaki gibi oluşturulduğunda, aynı reaksiyon elektrokimyasal açıdan gerçekleşecektir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 113
Zıt itici kuvvetin olmadığı durumda, elektrokimyasal reaksiyonun oluşumunu sağlayan soldan
sağa elektron transferi, ∆G ye tam eşdeğer bir itici gücü sağlayacaktır. Bu itici güce karşı bir
kuvvet uygulandığında, elektron transferi için net itici güç azalacaktır. Hücrenin
elektrokimyasal reaksiyonu, itici güçte bir azalmaya imkan sağlayacaktır. Karşıt dış kuvvet
(voltaj), hücrenin elektrokimyasal reaksiyonunun itici gücünü tam olarak dengelemek için
arttırıldığı zaman, elektronlar akmaya başlayacak, böylece hücre reaksiyonu gerçekleşecektir.
Genelde, tersinir koşullar altında bulunan bir hücrenin elektromotor kuvveti,
olarak
ifade edilmektedir. Diğer bir ifadeyle emf (ε), bir galvanik hücrenin üretebileceği maksimum
voltaj olarak tanımlanır.
Bir galvanik hücrenin reaktanının her bir molü için elektriksel iş (Welektrik), taşınan yük (q
coulomb/mol) ve voltajın (V, volt) çarpımına eşittir.
Welektrik = q.V (jul/mol)
(9-1)
Elektriksel yük (q), valans (n) ile faraday sabitinin (F) çarpımına eşittir,
q=n.F
(9-2)
Welektrik = nF.V
(9-3)
Yük taşınımı tersinir olarak gerçekleşirse, yani voltaj = elektromotor kuvveti (V=ε) ise, iş
maksimum değere sabittir.
Welektrik,maks = nFε
(9-4)
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 114
Bir sistem sabit sıcaklık (T) ve basınçta (P) tersinir proses gerçekleştirirse, ∆G = -W olup
galvanik hücrede,
∆G = -Welektrik,maks
(9-5)
∆G = -nFε
(9-6)
Bu denklem önemlidir, çünkü;
Bir dış ve zıt voltaj uygulanan, böylece elektrik akımının olmadığı reaksiyonların ∆G
değerini ölçmek mümkündür
Kimyasal itici güç (∆G) dıştan gelen (uygulanan) zıt voltajla (-ε) tam olarak
dengelendiği zaman tüm sistem (burada hücre) dengededir, yani elektrokimyasal
dengededir
Ölçülen ∆G değeri, prosesin (veya reaksiyonun) kendiliğinden gerçekleşip
gerçekleşmeyeceğini anlamada bir kriter olarak kullanılabilir.
Genel bir reaksiyonu ele alalım.
aA + bB = mM + nN
∆G
(
)
Bu reaksiyon elektrokimyasal olarak gerçekleşirse,
ve
ε0 = bütün bileşenlerin standart halde bulunmaları durumundaki emf değeri
(
)
(9-7)
Bu denklem, Nerst Denklemi olarak bilinir ve elektrokimyada önemli bir rol oynar. Ayrıca bir
hücrenin emf değerinin kompozisyonla nasıl değişebileceğini hesaplamamıza yarar.
Bileşenlerin aktivite ve aktivite katsayıları bulunabilir. Bileşenlerin konsantrasyon değerleri
de kullanılarak hesaplama yapılabilir.
(
[ ] [ ]
)
[ ] [ ]
(9-8)
9.3. Elektrokimyasal Piller
Yükseltgenme – indirgenme reaksiyonlarının uygun düzeneklerle oluşturulmaları ile kimyasal
enerji elektrik enerjisine, elektrik enerjisi kimyasal enerjiye dönüştürülebilir. Bu amaçla
hazırlanan düzeneklere pil denir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 115
Düzenekte kendiliğinden yürüyen bir redoks reaksiyonun; elektron verme eğiliminde ve
elektron alma eğiliminde olan türleri iki ayrı bölmede yer alır ve elektron alışverişi dış
devreden akan elektronlarla sağlanır. Böylece dış devrede elektron akımı sağlanarak elektrik
enerjisi elde edilir. Elektrokimyasal pil adını alan bu tür bir düzenek ile, türlerin yapılarından
kaynaklanan potansiyel enerji farkı, elektrik enerjisine dönüşmüş olur. Şimdi bir
elektrokimyasal pil örneğini yukarıdaki şekil ile açıklamaya çalışalım. Şekildeki pilde; iki ayrı
kapta Zn ve Cu metalleri kendi tuzlarının çözeltilerine batırılması ile iki yarı pil
oluşturulmuştur. Bu iki çözelti bir tuz köprüsü (elektrik akımını iyi ileten KCl gibi bir
elektrolitin çözeltisiyle doldurulmuş cam U boru) ile birleştirilmiştir. Elektrot olarak
adlandırılan metal çubuklar da bir tel ile birbirine bağlanarak devre tamamlanır ve pilin akım
verdiği gözlenir. Şimdi I. ve II. kaplarda oluşan değişimler, maddeler halinde şeklin yanında
açıklanmıştır.
Bir pil sistemi kısaca bir şema ile ifade edilebilir. Şekildeki pil düzeneğinde Zn anot, Cu
katot olduğuna göre pil şeması,
Zn (k) | Zn SO4 (1M) || Cu SO4 (1M) | Cu (k)
şeklinde yazılabilir. Buradaki tek düz çizgiler faz sınırlarını, düz çift çizgi ise tuz köprüsünü
belirtir. Pil şemasının sağ yanı katot bölgesini, sol yanı anot bölgesini ifade eder.
Pil gerilimleri, sıcaklık, derişim ve basınca bağlı olarak değişir. Bu nedenle genellikle
gerilimler 25°C de, çözeltilerde 1M iyon derişimi ve gazlarda 1 atmosfer kısmi basınç olmak
üzere standart koşullarda belirlenir. Bu koşullarda belirlenen pil gerilimlerine standart pil
gerilimi denir.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 116
Örnek 9.1. Cu(k) + Ni+2(sulu) = Cu+2(sulu) + Ni(k) redoks reaksiyonunun kendiliğinden olup
olmayacağını hesaplayınız.
Ni+2 + 2e → Ni
εo= -0.25 volt
Cu+2 + 2e → Cu
εo= 0.34 volt
Çözüm.
Yukarıda verilen iki yarı hücre reaksiyonundan pil reaksiyonunu elde edelim. İkinci reaksiyon
ters çevrilecektir (işareti de değişecektir)
Ni+2 + 2e → Ni
εo= -0.25 volt
εo= -0.34 volt
Cu → Cu+2 + 2e
Toplam:
Cu + Ni+2 → Cu+2 + Ni
Δεo= -0.59 volt
Bu hücrede oluşan gerilim farkı negatif olduğuna göre, reaksiyon kendiliğinden
gerçekleşmez.
Örnek 9.2. Aşağıda verilen şekil, elektrokimyasal olarak gerçekleşen aşağıdaki reaksiyonu
temsil etmektedir.
Zn + CuSO4 = ZnSO4 + Cu
a) |
|
|
| durumunda çinko oksitlenecek midir?
b) |
|
|
| durumunda hangi yönde iş yapılır? Hücre üzerinde mi hücre tarafından
mı?
c) Hücrenin maksimum iş yapma koşullarını bulun.
d) Reaksiyonun 25°C deki standart serbest enerji değişimi -213000 jul olduğuna göre ve
reaksiyonda bulunan bütün parçacıklar standart hallerinde ise çinkonun molü başına hücrenin
gerçekleştireceği maksimum iş miktarını hesaplayınız.
e) 25°C deki standart emf (ε°) değerini hesaplayınız.
f) Hücre saf katı çinko, saf katı bakır, CuSO4 ile ZnSO4 sulu çözeltilerini (her ikisi de aynı
aktivite değerine sahiptir) içermekteyse hücrenin 25°C deki emf değerini hesaplayınız.
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 117
Çözüm.
|
| |
a)
| net itici gücüyle reaksiyon soldan sağa doğru gerçekleşecektir. Yani
+2
Zn→Zn olacağından oksidasyon gerçekleşecektir.
b) Dış voltaj, hücre emf değerinden daha büyük olduğundan iş sistem üzerine yapılır. Bu bir
elektroliz prosesidir, yani akım üretilmekten çok tüketilir.
c) |
|
|
| olduğu zaman hücre maksimum iş üretir.
d) ∆G = -Wmaksimum olduğuna göre Wmaks= 213000 jul/mol
e) n = 2, F = 96487 coulomb
(
)
( )
f)
( )
Örnek 9.3. “Bir elektrokimyasal hücrenin fiziksel boyutu iki katına çıkarılırsa hücrenin emf
değeri de iki katına çıkar” ifadesi doğru mudur?
Çözüm. Aşağıdaki örneği ele alalım.
Zn + CuSO4 = Cu + ZnSO4
∆G°= -213000 jul (298 K de)
Kabuller: aCu=aZn=1, aZnSO4=50.aCuSO4
(
(
)
(
)(
)
(
)
jul
)
Reaksiyonun stokiometrisini iki katına çıkaralım.
∆G°= -426000 jul (298 K de)
2Zn + 2CuSO4 = 2Cu + 2ZnSO4
(
(
)
(
)(
)
(
)
jul
)
Görüldüğü gibi bir hücrenin elektromotor kuvveti (emf), hücrenin boyutundan bağımsızdır
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 118
Örnek 9.4.
Ni | Ni+2 (x M) || Cu+2 (0,75 M) | Cu
Mevcut pilde gerilimin 0.601 volt olması için Ni+2 iyonunun derişimi kaç
molar olmalıdır?
Ni+2 + 2e → Ni
Cu → Cu+2 + 2e
Çözüm.
Ni → Ni+2 + 2e
εo= -0.25 volt
εo= -0.34 volt
εo= 0.25 volt
εo= 0.34 volt
Cu+2 + 2e → Cu
Toplam:
Cu+2 + Ni → Cu + Ni+2
Δεo= 0.59 volt
(
[
[
]
)
]
(
[
[
[
]
)
]
]
[
]
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 119
Problemler
P1) Aşağıdaki reaksiyonun 25°C deki standart emf değeri 1,104 volt olduğuna göre aynı
sıcaklıkta reaksiyonun denge sabitini hesaplayınız.
Zn + CuSO4 = Cu + ZnSO4
P2) Hücre reaksiyonu ve sıcaklığa bağlı standart emf değeri aşağıda verilmiştir. 35°C de
reaksiyonun ∆G°, ∆H° ve ∆S° değerlerini hesaplayınız.
Cd(k) + Hg2Cl2(k) = 2Hg(s) + CdCl2(sulu)
ε°= 0,487+13,3.10-4T-2,4.10-6T-2 volt
P3) Aşağıda verilen hücrenin 25°C deki emf değerini hesaplayınız. CdSO4(sulu) ve
ZnSO4(sulu) bileşenlerinin aktivite değerleri sırasıyla 7x10-3 ve 3,9x10-3 dür. Kadmiyum
alaşım formunda olup aktivite değeri 0,6 dır. 25°C de hücrenin standart emf değeri ise 0,36
volt dur.
Zn(k) + CdSO4(sulu) = Cd(k) + ZnSO4(sulu)
P4) Zn | Zn+2 (0,01 M) | Cu+2 (0,1 M) | Cu
Pilin gerilim değerini bulunuz.
Cu+2 + 2e → Cu
Zn+2 + 2e → Zn
εo= 0.34 volt
εo= -0.76 volt
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 120
MALZEME TERMODİNAMİĞİ DERS NOTLARI İÇİN FAYDALANILAN KAYNAKLAR
V. Aytekin, METALURJİ TERMODİNAMİĞİ, İ.T.Ü. Kimya-Metalurji Fakültesi Ofset Atölyesi, Sayı:1513,
1993.
F. Dikeç, S. Aydın, ÇÖZÜMLÜ METALURJİ TERMODİNAMİĞİ PROBLEMLERİ, İ.T.Ü. Kimya-Metalurji
Fakültesi Ofset Atölyesi, 1991.
A.O. Aydın, EKSTRAKTİF METALURJİ PRENSİPLERİ, İTÜ Sakarya Müh.Fak. Ders Kitapları No:77, 1990.
Y. K. Rao, STOICHIOMETRY AND THERMODYNAMICS OF METALLURGICAL PROCESSES, Cambridge
University Press,
O. Kubaschewski, C. B. Alcock, METALLURGICAL THERMOCHEMISTRY, Int.Series on Mat.Sci.&Tech.,
Vol.24, 5th Ed., Pergamon Press, 1983
L. Goudurier, D. W. Hopkins, I. Wilkomirsky, FUNDAMENTALS OF METALLURGICAL PROCESSES,
Int.Series on Mat.Sci.&Tech., Vol.27, 2nd. Ed, Pergamon Press, 1985
R.E. Sontag, C. Borgnakke, G.J. Van Wylen, FUNDAMENTALS OF THERMODYNAMICS, 5th Ed., John Wiley
& Sons, Inc.
J.J. Moore, CHEMICAL METALLURGY, Butterworth & Co. (Publishers) Ltd., 1981, England.
M. Kaufman, PRINCIPLES OF THERMODYNAMICS, Marcel Dekker, Inc., 2002, New York, USA
Hae-Geon Lee, THERMODYNAMICS FOR METALS AND MATERIALS, Imperial College Press, 2000,
Singapore
Doç.Dr.Kenan YILDIZ | MALZEME TERMODİNAMİĞİ 121