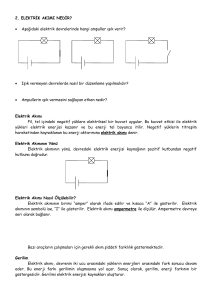
ELEKTROKİMYA
İndirgenme ve yükseltgenme reaksiyonları
Kimyasal piller
Elektroliz
ELEKTRİKSEL İLETKENLİK
Elektronlar
İyonlar
R ρ
: Metalik iletkenlik
: Elektrolitik iletkenlik
l
S
l iletkenin boyu cm
S kesiti, cm2
R elektrik direnci, ohm
özgül direnç,
direnç, iletkenin boyu ile doğru ve kesiti ile ters orantılı
Burada σ öziletkenliktir.
Direncin tersine “iletkenlik”, özgül direncin tersine de “özgül iletkenlik” adı verilmektedir.
İndirgenme ve yükseltgenme reaksiyonları
MnO4- + NO2-
Mn2+ +
MnO4- + 8 H+
NO3- (Asit)
4 O atomu göz önüne alarak
Mn2+ + 4H2O
MnO4- + 8 H+
yükleri dengelemek için 5e- ilave
Mn2+ + 4H2O
+ 5e-
Diğer yarı reaksiyon için
NO2-
NO3-
NO2- + H2O
NO3- + 2H+
NO2- + H2O
2/
5/
NO3- + 2H+ + 2e-
MnO4- + 8 H+
NO2- + H2O
+ 5eMn2+ + 4H2O
NO3- + 2H+ + 2e-
2MnO4- + 16H+ + 10e- + 5NO2- + 5H2O
2MnO4- + 6H+ + 5NO2-
2Mn2+ + 8H2O + 5NO3- + 10e-
2Mn2+ + 5NO3- + 3H2O
1) Aşağıdaki reaksiyonlarını denkleştiriniz.
a) MnO4- + H2O2 O2 + Mn2+ (asidik ortam)
b) Cr2O72- + NO2 - Cr3+ + NO3 –(asidik ortam)
Çözüm a)
(Mn+7O-24)- + 5 e- Mn2+
(H+12O-12) O02 + 2x1e-=2e-
2/
5/
2(Mn+7O-24)- + 10 e- 2Mn2+
5(H+12O-12) 5O02 + 10eToplam:
2MnO4- + 5H2O2 5O2 + 2Mn2+
(-2)
(0)
(-2)
(-2) + 6H+
=
(0)
=
(+4)
=
(+4)
2MnO4- + 5H2O2 + 6H+
8O
10 O
(+4)
5O2 + 2Mn2+ + 8H2O
10 O
8O
Çözüm b)
Cr2O72- + NO2 - Cr3+ + NO3 –
(Cr2+6O-27)2- + 2x3=6e- 2Cr3+
(N+3O-22) - (N+5O-23) - + 2e-
1/
3/
(Cr2+6O-27)2- + 6e- 2Cr3+
(N+3O-22) - (N+5O-23) - + 6eToplam:
Cr2O72- + 3NO2 - 2Cr3+ + 3NO3 –
(-2)
(-3)
=
(+6)
(-3)
(-5)
=
(+3)
(-5) + 8H+
=
(+4)
Cr2O72- + 3NO2 - + 8H+ 2Cr3+ + 3NO3 – + 4H2O
7O
6O
9O
Aşağıdaki reaksiyonlarını denkleştiriniz.
a) MnO4- + C2O42- CO2 + Mn2+ (asidik ortam)
b) MnO4- + Sn2+ Mn2+ + Sn4+ (Asidik ortam)
ELEKTROKİMYASAL PİLLER
4O
2
Zn (k) + Cu (çöz)
2
+ Cu (k)
Zn (çöz)
Şekil : Çinko-bakır pil sistemi
Bu reaksiyondaki elektron alış-verişini,
Zn (k)
2
+ 2eCu (çöz)
2
+ 2eZn (çöz)
Cu (k)
Standart Pil Potansiyeli
Basıncın 1 atm, sıcaklığın 25 oC ve konsantrasyonun 1 molar olduğu şartlara “standart şartlar”
denir.
2
+ 2eZn (çöz)
E0 = 0,76 V
Katot: 2 H (çöz)
+ 2e-
H2 (g)
E0 = 0,00 V
Pil: Zn (k) + 2 H (çöz)
2
+ H2 (g)
Zn (çöz)
Anot: Zn (k)
2 H (çöz)
+ 2e-
H2 (g)
E 0pil = 0,76 V
E0 = 0,00 V
Örnek: Zn ve Cu yarı pillerinin standart potansiyelleri sırasıyla E 0Zn / Zn 2 = 0,76 V ve
E 0Cu 2 / Cu = 0,34 V olarak verilmiştir. Bu durumda oluşturulan çinko-bakır pilinin potansiyelini
hesaplayınız.
Çözüm: Standart yarı pil potansiyellerinin toplamı standart pil potansiyelini
vermektedir.
2
+ 2eZn (çöz)
E0 = 0,76 V
2
Katot: Cu (çöz)
+ 2e-
Cu (k)
E0 = 0,34 V
2
Pil: Zn (k) + Cu (çöz)
2
+ Cu (k)
Zn (çöz)
E 0pil 1,10 V
2
Anot: Zn (çöz)
+ 2e-
Zn (k)
E0 = - 0,76 V
2
Katot: Cu (çöz)
+ 2e-
Cu (k)
E0 = 0,34 V
2
Pil: Zn (k) + Cu (çöz)
2
+ Cu (k)
Zn (çöz)
E 0pil E 0K - E 0A = 0,34 – (-0,76)
= 1,10 V
Anot: Zn (k)
NERNST DENKLEMİ
aA + bB
cC + dD
voltaj (elektromotor kuvveti, EMK) aşağıda yer alan “Nernst denklemi” ile verilmiştir.
C D
RT
ln
nF
Aa Bb
c
E = E0 ya da,
d
C D
0,059
log
E =E n
Aa Bb
c
d
0
şeklinde düzenlenebilir. Burada,
E : pil potansiyeli (EMK)
E0 : standart pil potansiyeli
F: 96480 coulomb
n : alınan veya verilen elektron sayısı
R:8,314 Joule/mol.K
2
Katot: Cu (çöz)
+ 2e-
EK =E0 -
0,059
1
log
n
[Cu 2 ]
Cu (k)
E0 = 0,34 V
EK =0,34 -
0,059
1
log
n
[Cu 2 ]
Şematik gösterim
Faz sınırları
Elektrot/Çözelti Ara yüzeyi
Anot
Zn|ZnSO4(aZn2+ = 0.0100)||CuSO4(aCu2+ = 0.0100)|Cu
Anotla
temastaki
çözelti
-
2 sıvı temas
yüzeyi (Tuz
Köprüsü)
Katot
Katotla
temastaki
çözelti
Zn / ZnSO4 // CuSO4 / Cu+
2
+ 2eZn (çöz)
E0 = 0,76 V
2
Katot: Cu (çöz)
+ 2e-
Cu (k)
E0 = 0,34 V
2
Pil: Zn (k) + Cu (çöz)
2
+ Cu (k)
Zn (çöz)
E 0pil 1,10 V
Anot: Zn (k)
Örnek : 25 oC de - Zn / Zn+2 // Cu+2 / Cu + pilinde Zn+2 değişimi 0,06 M ve Cu+2
derişimi de 0,02 M olarak verilmiştir. Bu durumda pilin elektromotor kuvvetini hesaplayınız.
(E0 = 1,1 V)
Çözüm: Pildeki reaksiyon şu şekildedir.
Zn + Cu+2
E = E0 -
Zn+2 + Cu
0,059
[Zn 2 ]
log
n
[Cu 2 ]
E = 1,1 -
Anot
0,06
(0,06)
= 1,086 V
log
2
(0,02)
Katot
Kurşunlu Akümülatörler
- Pb / H2SO4 (çöz) / PbO2 , Pb +
Böyle bir akümülatörün boşalması (deşarj) sırasında anot ve katottaki reaksiyonlar şu şekilde
yazılabilir.
Anot: Pb (k)
Pb+2 + SO -24
Pb+2 + 2ePbSO4 (k)
Toplam: Pb (k) + SO -24
PbSO4 (k) + 2e-
Katot: PbO2 (k) + 4 H+ + 2ePb+2 + 2 H2O
Pb+2 + SO -24
PbSO4 (k)
Toplam: PbO2 (k) + 4 H+ + SO -24 + 2e-
PbO2 (k) + Pb (k) + 2 H2SO4
boşalma
dolma
PbSO4 (k) + 2 H2O
2 PbSO4 (k) + 2 H2O
sülfürik asit derişimi % 5 ten % 40 a çıktığında, voltaj 1,88 den 2,15 volta yükselir.
Nikel-Kadmiyum Pilleri
Anot: Cd (k) + 2 OHKatot: NiO2 (k) + 2 H2 + 2e-
Toplam: Cd (k) + NiO2 (k) + 2 H2O
Cd(OH)2 + 2eNi(OH)2 + 2 OHboşalma
dolma
Cd(OH)2 + Ni(OH)2
Nikel-kadmiyum pillerinin her bir hücresinin potansiyeli yaklaşık olarak 1,4 volttur.
Kurşunlu akümülatörlerde olduğu gibi, nikel-kadmiyum pilleri de deşarjı takiben tekrar
doldurulabilmektedir.
ELEKTROLİZ
Zn + Cu+2
Zn+2 + Cu
E0=0.000V
Yarı Reaksiyonlar
Minimum
Potansiyel (Volt)
Katyonlar
+
-
K + e
Mg+2 + 2eAl+3 + 3eZn+2 + 2eCr+3 + 3eFe+2 + 2eNi+2 + 2e2 H+ + 2eCu+2 + 2eCu+ + eAg+ + e-
K
Mg
Al
Zn
Cr
Fe
Ni
H2
Cu
Cu
Ag
- 2,93
- 2,63
- 1,66
- 0,76
- 0,74
- 0,44
- 0,25
0,00
+ 0,34
+ 0,52
+ 0,80
Anyonlar
-
F2 + 2eCl2 + 2eO2 + 2 H2O + 4eBr2 + 2eI2 + 2e-
2F
2 Cl4 OH2 Br2 I-
- 2,87
- 1,36
- 1,23
- 1,09
- 0,54
FARADAY KANUNLARI
Michael Faraday (1832)
1- Elektroliz sırasında elektrotlarda serbest halde toplanan ya da elektrotlardan çözeltiye
geçen madde miktarları, devreden geçen elektrik miktarı ile doğru orantılıdır
2- Çeşitli elektrolitlerden aynı miktar elektrik akımının geçirilmesi ile elektrotlarda serbest
halde toplanan veya elektrotlardan çözeltiye geçen madde miktarları, bu maddelerin eşdeğer
ağırlıkları ile orantılıdır.
A I t
n 96500
Q=I t
m=
m
A
n
I
t
: elektrotlarda toplanan veya çözünen madde miktarı (g)
: elektrotlarda toplanan veya çözünen elementin atom ağırlığı
: elektrotlarda alınan-verilen elektron sayısı
: devreden geçen akım şiddeti (amper)
: elektroliz süresi (saniye) olmaktadır.
Örnek : 40 cm2 yüzey alanına sahip ince bir metal levha, bakır sülfat (CuSO4)
çözeltisine daldırılarak, 1 amper akım şiddeti altında 24 saat süre ile bakır kaplanmaktadır.
Metalik bakırın yoğunluğu 8,8 g/cm3 olarak verilmiştir. Meydana gelen kaplamanın
kalınlığını hesaplayınız. (Cu = 64)
Çözüm:
m=
A It
n 96500
m=
64 (1) (24) (60) (60)
= 28,65 g
2
96500
m=Vd
V=
28,65
3,26 cm 3
8,8
Plakanın her iki yüzü de bakır ile kaplanacağından toplam yüzey alanı 2 . 40 = 80 cm2
olacaktır. Bu durumda
hacim = yüzey . kalınlık
olduğundan,
kalınlık =
3,26
0,041 cm
80
PROBLEMLER
1): Bir bakır sülfat çözeltisi 0,02 amperlik bir akım şiddeti altında 5 saat süre ile elektroliz
ediliyor. Bu sırada katotta kaç gram bakır toplandığını hesaplayınız.
Çözüm:
m=
A I t
n 96500
m=
63,5 (0,02) (3600) (5)
= 0,118 g Cu
2
96500
2): Sodyum klorür çözeltisinin elektrolizinde katotta metalik sodyum ayrılırsa da su ile ikinci
bir reaksiyona girerek sodyum hidroksite dönüşüyor. 10 gram NaCl elektroliz edilirse,
a) Elde edilen NaOH miktarını,
b) Devreden geçen elektrik miktarını
c) Normal koşullarda oluşan hidrojen gazının hacmini bulunuz.
Çözüm: Elektroliz edilen sodyum klorür, oluşan metalik sodyum dolayısıyla sodyum
hidroksite eşdeğer olmaktadır.
a) Sodyum hidroksit miktarı:
b) Akım miktarı:
(10) (40)
6,84 gram
58,5
96500
10 16496 kulon
58,5
c) Hidrojen miktarı:
(22,4/2)
16496 1,91 litre
96500
3): Bir gümüş banyosuna batırılmış bulunan ve bir yüzü 800 cm2 olup kalınlığı ihmal
edilebilen bir levha 2 amperlik bir akım şiddeti altında 5 saat süre ile gümüş kaplanıyor.
Kaplamanın kalınlığının kaç mm olduğunu bulunuz. Metalik gümüşün yoğunluğu 10,5 g/cm3
olarak verilmiştir.
Çözüm:
m=
A I t
n 96500
m=
107,8 (2) (5) (3600)
40,22 g Ag
1
96500
Metalik gümüş hacmi:
40,22
3,83 cm 3
10,5
Kaplama kalınlığı:
hacim
2 yüzey alanı
Kaplama kalınlığı:
3,83
0,0024 cm = 2,4 mm
(2) (800)
4): - Zn / ZnSO4 // AgNO3 / Ag + pilinin yarım pil reaksiyonlarını yazarak tam pil
reaksiyonunu çıkarınız.
Çözüm:
Yük. yarı tepkimesi: Zn
İnd. yarı tepkimesi: 2 Ag+ + 2ePil tepkimesi: Zn + 2 Ag+
Zn+2 + 2e2 Ag
Zn+2 + 2 Ag
5): Fe / Fe+2 // Cu+2 / Cu standart pil şeması ile bu pilde yer alan demir ve bakır elementlerinin
yükseltgenme potansiyelleri sırasıyla + 0,44 V ve - 0,34 V olarak verilmiştir.
a) Pilin anot ve katot reaksiyonlarını yazarak pil tepkimesini
çıkarınız.
b) Bu pilin standart pil potansiyelini belirtiniz.
Çözüm: Yükseltgenme potansiyeli büyük olan yükseltgenerek anodu, diğeri de katodu
oluşturacaktır.
a) Katot: Cu+2 + 2eAnot: Fe
Pil: Cu+2 + Fe
Cu
Fe + 2e+2
Cu + Fe+2
E0 = + 0,34 V
E0 = + 0,44 V
b) Bir standart pilin potansiyeli anot ve katot standart potansiyellerinin toplamı
olmaktadır.
E 0pil 0,34 0,44 0,78 V
6) Sn/Sn+2(0,01 M)//Pb+2(1,0 M)/Pb
Elektrokimyasal hücresinin
a) Potansiyelini hesaplayınız.
b) Pil olarak çalışır mı? Belirtiniz
c) Anot ve katot reaksiyonlarını yazınız.
d) Toplam reaksiyonu düşünerek kurşun metali (Pb0), Sn2+ çözeltisine batırılırsa
reaksiyon olur mu? Gösteriniz.
Pb2+ + 2eSn2+ + 2eAnot: Sn
Sn2+ + 2e2+
Katot: Pb + 2e
Pb
Toplam: Sn + Pb2+
E0 = - 0,126 V
E0 = - 0,136 V
Pb
Sn
E0 = + 0,136 V
E0 = - 0,126 V
Sn2+ + Pb
E0 = 0,01 V
0,059
[0,01]
0,059
[Sn 2 ]
a) E = E = 0,01 = 0,069 volt
log
log
2
n
2
[1]
[Pb ]
b) Pil olarak çalışır.
0
c)
Anot: Sn
Sn2+ + 2eKatot: Pb2+ + 2ePb
d) Sn + Pb2+
E0 = + 0,136 V
E0 = - 0,126 V
Sn2+ + Pb
reaksiyonun tersi Sn2+ + Pb
X olmaz
Soru : Ni/Ni2+(0,50 M)//Pb+2(0,03 M)/Pb elektrokimyasal hücresinin
a) Anot ve katot ve toplam reaksiyonları yazınız.
b) Standart pil potansiyelini (E0) hesaplayınız.
c) Belirtilen şartlardaki pil potansiyelini hesaplayınız. Pil olarak çalışır mı? Belirtiniz
d) Toplam reaksiyonu düşünerek kurşun metali (Pb0), 0,05 M Ni2+ çözeltisine batırılırsa
reaksiyon olur mu? Açıklayınız.
Pb2+ + 2eNi2+ + 2ea)
Anot: Ni
Katot: Pb2+ + 2e-
Ni2+ + 2ePb
Toplam: Ni + Pb2+
b)
Anot: Ni
Katot: Pb2+ + 2e-
E0 = - 0,126 V
E0 = - 0,250 V
Pb
Ni
Ni2+ + Pb
Ni2+ + 2ePb
Toplam: Ni + Pb2+
E0 = + 0,250 V
E0 = - 0,126 V
E0 = + 0,250 V
E0 = - 0,126 V
Ni2+ + Pb E0 = 0,124 V
c)
0,059
[0,50]
0,059
[Ni 2 ]
E =E = 0,124 = 0,087 volt Pil olarak çalışır.
log
log
2
2
[0,03]
n
[Pb ]
0
d)
Ni2+ + Pb
Ni + Pb2+ tersi reak. olmaz
SORULAR
S-1: Erimiş sodyum klorürün (NaCl) platin elektrotlar ile 10 amperlik akım şiddetinde 5
dakika süre ile elektroliz edildiğinde kaç gram klor gazı üretilir?
S-2: Erimiş magnezyum klorür (MgCl2) elektroliz edildiğinde, anotta normal şartlar altında
50 litre Cl2 gazı çıktığı zaman, katotta kaç gram metalik Mg üretilir?
S-3: Bir CuSO4 çözeltisi 0,750 amper akım şiddetinde elektroliz edildiğinde 63,5 gram
metalik bakır açığa çıkmaktadır. Elektroliz süresini dakika olarak hesaplayınız.
S-7: 250 mL hacmindeki 0,6 M NiCl2 çözeltisi 5 amper akım şiddetinde ve 55 dakika süre ile
elektroliz ediliyor. Elektroliz sonucunda Ni+2 ve Cl- iyonlarının konsantrasyonunu bulunuz.
Elektroliz esnasında, çözelti hacminin değişmediği kabul edilecektir.
n
mol
Başlangıçta Ni ve Cl miktarları= M= => n= M.V= 0,6
.0,250 L = 0,15 mol
V
L
Ni2+ mikt = 0,15 mol => 0,15 mol . 58 g/mol = 8,7 g
Cl- mikt = 2.0,15 =30 mol => 0,30 mol . 35,5 g/mol = 10,65 g
A I t
58 (5).(55).( 60)
=
= 4,95 g
2
96500
n 96500
A I t
2.(35,5) (5).(55).( 60)
Cl- için m =
=
= 6,06 g elektrolizde açığa çıkan
2
96500
n 96500
Ni2+ için m =
Kalan Ni2+ için 8,7- 4,95 = 3,75 g
Kalan Cl- için 10,65- 6,06 = 4,59 g
n 3,75/58
=
= 0,259 M
V
0,250
n 4,59/35,5
Son kons. Cl- için M=
=
= 0,517 M
V
0,250
Son kons. Ni2+ için M=
S-9: Aşağıda şeması verilen pilin anot ve katot reaksiyonlarını yazarak pil reaksiyonunu
çıkarınız. Hangi elektrotun pozitif olduğunu belirterek pilin standart elektromotor kuvvetini
hesaplayınız.
Sn / Sn+2 // Ag+ / Ag
S-11: 25 oC sıcaklıkta Fe+3 iyonları derişimi 0,02 M ve Fe+2 iyonları derişimi 0,10 M olan bir
çözeltiye bir platin helezon batırılarak hazırlanan elektrotun elektrot potansiyelini
hesaplayınız. Fe+3 iyonunun Fe+2 iyonuna indirgenmesine ait yarım pilin standart potansiyeli
0,771 V olarak verilmiştir.
c
d
0,059
C D
0
E
log
E=
n
Aa Bb
S-13: Aşağıda şeması verilen pilin 25 oC sıcaklıktaki elektromotor kuvvetini hesaplayınız. Bu
pilin her iki elektrotu da aynı olduğu için, pilin standart pil potansiyeli 0,00 V alınmalıdır.
Zn / Zn+2 (0,01 M) // Zn+2 (0,1 M) / Zn
C D
0,059
log
E =E n
Aa Bb
c
d
0
3) Pt Fe3+ (0,13M), Fe2+ (0,068M) Hg2+ (0,067M) Hg
a) Hücrenin potansiyelini hesaplayınız.
b) Hücrenin galvanik mi, yoksa elektrolitik mi olduğunu belirtiniz.
c) Redoks reaksiyonu yazınız.
d) Şeklini çiziniz.
Fe3+ + eFe2+
E0 = 0,771 volt
2+
Hg + 2e
Hg
E0 = 0,854 volt
Çözüm a)
Hg
Fe
0,0592
1
log
= 0,819 volt
2
0,067
0,0592
0,068
log
Ea = 0,771 = 0,787 volt
1
0,13
EK = 0,854 -
EHücre = EK - EA = 0,819 - 0,787 = 0,032 volt
Çözüm b) Galvanik EHücre = 0,032 volt
Çözüm c)
Çözüm d)
Hg2+ + 2Fe2+
Hg + 2Fe3+
Anot: 2H2 => 4H+ + 4eKatot: O2 + 4H+ + 4e- => 2H2O
Toplam : 2H2 + O2 => 2H2O