atomun yapısı - WordPress.com
advertisement

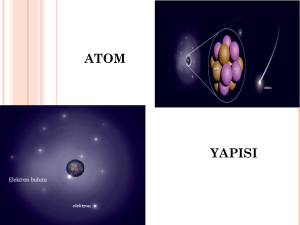
ATOMUN YAPISI ATOMUN PARÇACIKLARI Elementtir adım, Her yerde aynıdır yapım. EtkileĢince atomlarım, Bütün gibi görünür yapım. Peki atomlarımın Var mıdır küçük parçacıkları? Anlamak isterseniz bu gerçeği, KumaĢa sürtün beni. DıĢarıdan olunca etki, Hemen belli ederim kendimi, DüĢünün nasıl elektriklendiğimi. Atomu oluĢturan parçacıklar farklı konumda bulunur. Nötron ve proton atomun merkezinde bulunur. Nötron ve protonların bulunduğu bu kısım çekirdektir. Elektronlar ise çekirdeğin etrafında yer alır. Atomu oluĢturan yükler farklı yüklere sahiptir.farklı yüke sahip olan bu parçacıklar birbirini etkileyerek bir arada bulunur ve atomu oluĢturur. Atomda bulunan yükler negatif ve pozitif yükler olarak adlandırılır.negatif yük elektronun, pozitif yük ise protonun yükünü temsil etmektedir. nötron proto n + elektro n çekirdek atom Atomun çekirdeğinde bulunan proton ve nötronun kütlesi hemen hemen aynıdır. Elektronun kütlesi ise proton ve nötronun kütlesinden çok daha küçüktür.protonun veya nötronun kütlesi elektronun kütlesinin yaklaĢık olarak 2000 katı kadardır. Bu durumda atomun kütlesi yaklaĢık olarak protonun ve nötronun kütleleri toplamıdır. BUNLARı BILIYOR MUYDUNUZ Eğer atomun çekirdeği bir bilye büyüklüğünde olsaydı atom yaklaĢık olarak bir stadyum büyüklüğünde olurdu. Bu durumda elektronların hareket ettikleri bölgenin, çekirdeğe göre ne kadar çok yer kapladığını hayal edebiliyor musunuz? Atomların nötron ve proton sayıları birbirine eĢit olduğunda atomlar yüksüz (nötr) yapıda olurlar. Atomun nötr olması atomda bulunan negatif yükler sayısının pozitif yüklerin sayısına eĢit olması demektir. Diğer bir ifade ile elektron negatif yüklü, proton negatif yüklü olduğu için elektron ve proton sayılarının eĢit olması atomun nötr olduğunu gösterir. BÜTÜN ATOMLAR ELEKTRON,PROTON VE NÖTRONLARDAN OLUġTUĞUNA GÖRE NIÇIN FARKLı ELEMENTLERIN ATOMLARı FARKLı ÖZELLIKLERE SAHIPTIR? Her elemente ait atomun proton, nötron ve elektronlarının sayısı aynı değildir. Bir elementin atomunun diğer elementin atomundan farklı olması çekirdekte bulunan proton sayısına bağlıdır. Örneğin; hidrojen atomunun çekirdeğinde bir proton bulunmasına karĢılık, azot atomunun çekirdeğinde yedi proton bulunmaktadır.bu sebeple hidrojen atomu, azot atomundan farklıdır. Farklı elementlerin atomları aynı sayıda element veya nötron içerebilir.ancak farklı atomların proton sayıları hiçbir zaman aynı olamaz. Bu sebeple atomda bulunan protonların sayısı, o elementin kimliğini belirler. Nötr atomlarda elektron sayısı proton sayısına bağlı olduğu için proton sayısı kadar elektron bulunur. Bir elementin bütün atomlarının çekirdeğinde aynı sayıda proton bulunur. Fakat aynı elementin tüm atomlarının nötron sayıları birbirinden farklı olabilir. Proton sayısının farklı olması ise elementin farklı olması demektir. Atomlar tek tek tartılamaz, doğrudan incelenemez, duyu organlarıyla fark edilemeyecek kadar da küçüktür. Bilim insanlarının geçmiĢten günümüze kadar geliĢtirdikleri atom modellerini inceleyelim. Ben MÖ 400’lü yıllarda maddeleri oluĢturan en küçük birimin atom olduğunu belirttim . ATOM FIKRININ GELIġIM SÜRECINDE BILIM ADAMLARıNıN BU KONUYA KATKıLARı 19. Yüzyılın baĢları. Atom konusunda ilk bilimsel yaklaĢımı ben geliĢtirdim. Bana göre atomlar, içleri dolu ve parçalanamayan berk kürelere benzemektedir. ĠĢte tasarladığım atom modelim. Sene 1897. atomun daha küçük parçacıklardan oluĢtuğunu buldum.atomu, üzümlü keke benzettiğim bir modelle açıkladım. Bu modelde keki pozitif yüklere, üzümü ise negatif yüklere benzettim. Bu sayede atomun parçalanamadığı fikrini yıktım. ĠĢte, bu tasarladığım atom modelim. NOT; Stoney adlı bilim adamı 1891’de negatif yüklü parçacıklara elektron adını vermiĢtir. Gözlemlerim bana Thomson’ın önerdiği atom modelinin doğru olamayacağını düĢündürdü ve yeni bir arayıĢ içine girdim. Pozitif yüklere proton, pozitif yükün bulunduğu kısma ise çekirdek adını verdim. Bence elektron çekirdeğin çevresinde gezegenlerin güneĢ çevresinde dolandığı gibi dönüyorlar. Çünkü çekirdekle elektronlar arasında çekim kuvveti var. Elektronların çekirdeğe düĢmemeleri için tek çare, çekirdeğin çevresinde dönmeleridir. Bu modelle Nobel kimya ödülünü kazandım. Bana göre elektronlar çekirdeğin çevresinde istedikleri gibi dolaĢamazlar. Çekirdeğe belirli uzaklıklardaki katmanlarda döner. Bu açıklamalarımla Nobel fizik ödülü aldım. ĠĢte tasarladığım atom modeli; MODERN ATOM MODELĠ Modern atom teorisine göre elektronlar çok hızlı hareket ettikleri için sabit bir yerleri yoktur. Elektronların yerlerini kesin olarak tespit edememekle birlikte yalnızca nerelerde buluna bileceklerini biliyoruz. BU OLAYı ġU ġEKILDE AÇıKLAYA BILIRIZ; Evinizde bir kedi olduğunu düĢünün. Evde değilseniz kedinin nerede olduğunu bilemezsiniz, ancak nerelerde olabileceğini tahmin edersiniz.benzer Ģekilde bizde atomu göremiyoruz ancak elektronun nerelerde olabileceğini tahmin ediyoruz. Elektronun bulunabileceği ve hareket ettiği alanı, sineğin asılı lambanın çevresinde döndüğü alana benzetebiliriz. ĠĢte elektronların buluna bilecekleri bu kısımlar elektron bulutu olarak adlandırılır.