1
MADDENİİN TANECİKLİ YAPISI VE ISI
Kazanımlarınız
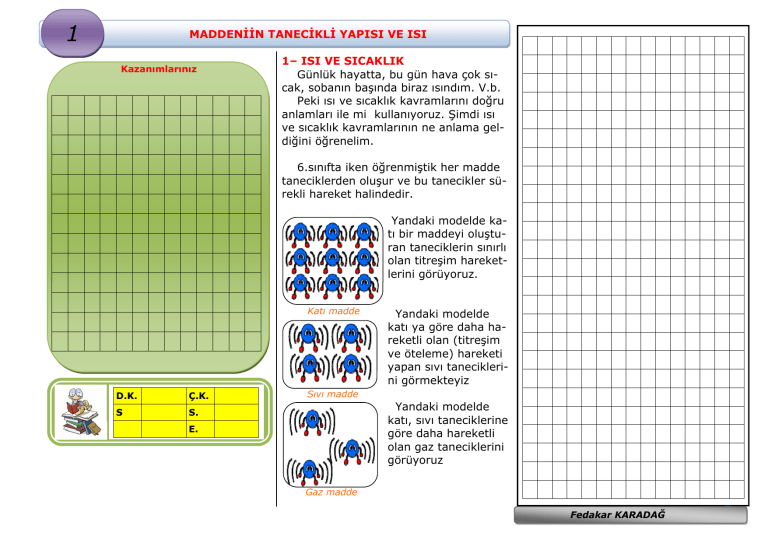
1– ISI VE SICAKLIK
Günlük hayatta, bu gün hava çok sıcak, sobanın başında biraz ısındım. V.b.
Peki ısı ve sıcaklık kavramlarını doğru
anlamları ile mi kullanıyoruz. Şimdi ısı
ve sıcaklık kavramlarının ne anlama geldiğini öğrenelim.
6.sınıfta iken öğrenmiştik her madde
taneciklerden oluşur ve bu tanecikler sürekli hareket halindedir.
Yandaki modelde katı bir maddeyi oluşturan taneciklerin sınırlı
olan titreşim hareketlerini görüyoruz.
Katı madde
D.K.
Ç.K.
S
S.
Yandaki modelde
katı ya göre daha hareketli olan (titreşim
ve öteleme) hareketi
yapan sıvı taneciklerini görmekteyiz
Sıvı madde
Yandaki modelde
katı, sıvı taneciklerine
göre daha hareketli
olan gaz taneciklerini
görüyoruz
E.
Gaz madde
Fedakar KARADAĞ
1
Yan tarafta bir kap
içerisindeki maddenin
taneciklerini ve hareketlerini görmekteyiz.
Bu kap içerisindeki
maddeyi ısıtırsak taneciklerinin hareketleri
Yan taraftaki
maddenin taneciklerinin her birinin enerjisi
ısıtılmadan önce 5 j
dür.(5 tanecik var ve
her birinin enerjisi 1j
dür.)
nasıl değişir.
Yan tarafta yukarıdaki kap içinde bulunan maddenin bir
miktar ısıtılmasını görüyorsunuz. Dikkat
ederseniz taneciklerin
hareketi artmış.
Peki taneciklerin
hareketinin artma nedeni nedir? Taneciklerdeki hareket artışını
hesaplayabilirsem
maddenin ne kadar ısındığını bulabilir
miyim?
Örneğin aşağıdaki taneciklerin hareket
enerjilerini sembolik olarak gösterelim.
D.K.
Ç.K.
S
S.
E.
1 joule hareket enerjisine sahip
tanecik
2 joule hareket enerjisine sahip
tanecik
3 joule hareket enerjisine sahip tanecik
Isıtıldıktan sonra
tanecik sayısı değişmemiştir fakat taneciklerin hareket enerjileri artmıştır.1j den
2j çıkmıştır. Hesaplarsak 5 tanecik var. Her
birinin enerjisi 2j olduğuna göre
(5 x 2 = 10j)
Yukarıdaki durumda olduğu gibi bir
maddenin taneciklerinin sahip olduğu
hareket (kinetik) enerjisinin toplamına o
maddenin ısısı denir.
Bir maddenin taneciklerinin hareket
enerjilerinin toplamına ısı denir; Bir
maddenin taneciklerinin sahip olduğu
hareket enerjilerinin ortalamasına da
Sıcaklık denir
Bir maddenin ısısını ölçemeyiz fakat
aldığı ısıyı veya verdiği ısıyı hesaplayabiliriz.
Fedakar KARADAĞ
2
Alınan ısıyı veya verilen ısıyı matematiksel işlemlerin yanı sıra
kalorimetre kabı ile de
ölçeriz. Ölçüm aletinden de anlaşılacağı gibi ısı birimi olarak kalori (cal) ve enerji birimi olan Joule (J) kullanılır.
Sıcaklık taneciklerin
hareket enerjilerinin
toplamının ortalamasının bir göstergesidir.
Termometre ile ölçülür. Termometreler eskiden beri kullandığımız
sıvı termometreler , metal termometreleri ve
dijital termometreler
olarak kullanılır.
kalorimetre
ISININ AKTARIMI
Sıcaklığı farklı olan iki madde arasında
ısı enerjisinin aktarılması olayına ısı aktarımı denir. Isı aktarımı ısı alış verişi
şeklinde olur.
Isı her zaman sıcaklığı yüksek olan
maddeden sıcaklığı az olan maddeye
doğru aktarılır. Aşağıdaki örneği inceleyelim.
5 0C
40 0C
sıcak-
10 0C
sıcak-
20 0C
40 0C
Sıvı termometreleri
Metal termometreleri
30 0C
Yukarıdaki örneklerde olduğu gibi ısı
aktarımı sıcaklıkları farklı iki cisim arasında ve temas eden yüzeyler arasında
olur.
NOT: İki cisim arasında ısı alış verişi
sırasında her zaman alınan ısı verilen
ısıya eşit olur.
D.K.
Ç.K.
S
S.
E.
Dijital termometreleri
Fedakar KARADAĞ
3
Kaynama sıcaklığında (1000C) bulunan bir bardak su ile
bir kova suyu inceleyelim.
Sıcaklıkları eşit
olduğu için taneciklerinin ortalama hareket enerjileri eşittir.
Isıları ise eşit değildir. Çünkü bir bardak suya göre bir kova suda daha fazla
tanecik vardır.
Isı ile ilgili bilinmesi gereken formül ve işlemler
Daha önceden de bahsettiğimiz gibi bir
maddenin ısısını ölçemeyiz fakat aldığı
veya verdiği ısıyı hesaplayabiliriz bu hesaplamaları yapabilmemiz için öncelikle
öz ısı dediğimiz kavramı öğrenmemiz gerekir.
D.K.
Ç.K.
S
S.
Öz ısı
Daha önce öz kütle (yoğunluk) kavramını öğrenirken her maddenin yoğunluğu farklıdır, onun için yoğunluk ayırt edici bir özelliktir demiştik.
Öz ısıda tıpkı öz kütle gibi maddenin
ayırt edici özelliğidir. Yani her madde için
farklıdır. Şimdi öz ısı kavramını bir deneyle açıklayalım.
Eşit sıcaklık ve
eşit hacimdeki X
ve Y sıvılarını özdeş ısıtıcılarla 5
dakika ısıtalım
daha sonra son
sıcaklıklarını ölçelim.
X sıvısının
370C , Y sıvısının ise 400C olduğunu görürüz.
X sıvısı
0
30 C
100ml
X sıvısı
0
37 C
100ml
Y sıvısı
30 0C
100ml
Y sıvısı
40 0C
100ml
Bu sonuç bize her şey aynı kalmak şartı
ile sıvılar ( maddeler) değiştiğinde aldıkları ısının da farklı olduğunu, yani her
maddenin öz ısılarının farklı olduğunu
gösterir.
E.
Fedakar KARADAĞ
4
Öz ısı bir maddenin 1 gramının sıcaklığını 10C artırmak için gerekli olan ısı
miktarına denir.
Örneğin 1 g suyun sıcaklığını 10C arttırmak için gereken ısı 1 cal/g*0C dir. Bu
örnekleri aşağıdaki tabloda çoğalta biliriz.
Aşağıda bazı maddelerin öz ısıları verilmiştir.inceleyelim
Kavram
Sembolü
Birimi
Isı
Q
Kalori(cal) veya Joule(J)
Öz ısı
c
Kal/gx0C
Kütle
m
Gram (g)
Sıcaklık
t
0
C
Yukarıdaki birim tablosunda verilen
kavramları yapacağımız bir örnek ile öğrenelim.
ÖRNEK: 250C derece sıcaklığındaki
60g suyu 400C ye çıkarmak için ne kadar
ısı verilmelidir. (csu = 1 cal/gx0C )
ÇÖZÜM: 1.yol
1g suyun sıcaklığını 10C arttırmak için
1 cal/gx0C gerekiyorsa 60g suyun sıcaklığını 10C arttırmak için ne kadar gereklidir? Sorusunu cevaplayalım.
1g
1 cal/gx0C
60g
X
X= 60g x 1 cal/gx0C
Öz ısı simgesi olarak ( c ) harfini kullanacağız. Birimini ise yan tarafta verilmiş
olan birim tablosunda gösterelim
Oran orantı
yöntemini
kullanırsak
X= 60cal/0C
Bu sonuç 60g suyu 10C ısıtmak içindi bizden
istenen ise 250C den 400C kadar (yani 150C)
ısıtmamız onun için çıkan sonucu 15 ile çarparsak soruyu çözmüş oluruz.
=60cal/0C x 150C = 900cal
D.K.
Ç.K.
S
S.
E.
Fedakar KARADAĞ
5
2.yol: Formül kullanarak çözülen yoldur. Şimdi bize gerekli olan formülü öğrenelim.
ISI = kütle
x
öz ısı
Q= m
x
x
c
(son sıcaklık—ilk sıcaklık)
x
(ts - ti )
Verilenler
m= 60g
csu = 1 cal/gx0C
Son sıcaklık (ts)=400C
İlk sıcaklık (ti)=250C
İstenen
Isı (Q)
Formülde yerine koyalım.
Q= m.c.(ts - ti)
= 60g . 1 cal/gx0C . ( 400C - 250C)
= 60g . 1 cal/gx0C . 150C
Q= 900cal
ÖRNEK: 200C derece sıcaklığındaki
10g X maddesini 600C ye çıkarmak için
ne kadar ısı verilmelidir? (cx = 2,5 cal/
gx0C )
D.K.
Ç.K.
S
S.
ÖRNEK: 50C derece sıcaklığındaki 6g
Y maddesinin 30C ye kadar soğuması
için kadar ısı vermesi gerekir?. (cy = 8
cal/gx0C )
NOT: Sonuç (—) çıktı diye üzülme
sonucun—olması maddenin ısı verdiğini
gösterir
ERİME VE DONMA ISISI
1g
sıvı
1g
katı
Erime sıcaklığında bulunan 1g katının
erime sıcaklığında bulunan 1g sıvıya dönüşmesi için gerekli olan ısı miktarına
erime ısısı denir.
Donma sıcaklığında bulunan 1g sıvının
1g katıya dönüşmesi için vermesi gereken ısı miktarına donma ısısı denir.
E.
Fedakar KARADAĞ
6
Tanımlardan da anlaşılacağı gibi bir
maddenin erime ısısı ile donma ısısı birbirine eşittir. Erime ısısını ( Le ) ile ,
donma ısısını da ( Ld ) ile göstereceğiz.
Aşağıdaki tabloda bazı maddelerin
erime ve donma ısıları verilmiştir.
ÖRNEK: Erime sıcaklığında bulunan
12g buzu erime sıcaklığında bulunan 12g
suya dönüştürmek için gerekli olan ısı
miktarı ne kadardır? (buz için Le= 80 cal/g)
ÇÖZÜM: bize verilen ve istenenleri
ele alalım
Verilenler
İstenen
Kütle = 12g
ısı
Buz için Le= 80cal/g
1. yol
oran orantı kurma yolu
1g buzun erimesi için 80 cal/g ısı gerekirse 12g erimesi için ne kadar ısı gereklidir?
1g
80cal/g
12g
x
X= 12g . 80cal/g
X = 960cal bulunur.
Erime ve donma ısıları ile ilgili soruları
aşağıdaki formül yardımı ile çözelim.
Q = m . Le
Q = m . Ld
Isı = kütle . Erime Isı = kütle . Donma
ısısı
ısısı
2. Yol
Formül kullanarak çözüme ulaşma
Q= m . Le
Q= 12g . 80cal/g
Q= 960cal
Her iki yoldan hesaplamanın mümkün
olduğu bu durumlarda hangisi daha kolayınıza geliyorsa onu kullanın.
D.K.
Ç.K.
S
S.
E.
Fedakar KARADAĞ
7
BUHARLAŞMA VE YOĞUŞMA ISISI
Buharlaşma sıcaklığında bulunan 1g
sıvının buharlaşma sıcaklığında bulunan
1g gaza dönüşmesi için gerekli olan ısı
miktarına buharlaşma ısısı denir.
Yoğuşma sıcaklığında bulunan 1g gazın 1g sıvıya dönüşmesi için vermesi
gereken ısı miktarına Yoğuşma ısısı
denir.
Tanımlardan da anlaşılacağı gibi bir
maddenin buharlaşama ısısı ile
yoğuşma ısısı birbirine eşittir. Buharlaşma ısısını ( Lb ) ile , yoğuşma ısısını
da ( Ly ) ile göstereceğiz.
Aşağıdaki tabloda bazı maddelerin
buharlaşma ve yoğuşma ısıları verilmiştir.
Erime ve donma ısıları ile ilgili soruları aşağıdaki formül yardımı ile çözelim.
Q = m . Lb
Isı = kütle . Buharlaşma ısısı
Q = m . Ly
Isı = kütle yoğuşma
ısısı
ÖRNEK: Buharlaşma sıcaklığında bulunan 12g suyu buharlaşma sıcaklığında
bulunan 12g su buharına dönüştürmek
için gerekli olan ısı miktarı ne kadardır?
(su için Lb= 540 cal/g)
ÇÖZÜM: bize verilen ve istenenleri
ele alalım
Verilenler
İstenen
Kütle = 12g
ısı
Buz için Le= 540cal/g
1. yol
oran orantı kurma yolu
1g suyun buharlaşması için 540 cal/g
ısı gerekirse 12g erimesi için ne kadar
ısı gereklidir?
D.K.
Ç.K.
S
S.
E.
1g
540cal/g
12g
x
X= 12g . 540cal/g
X = 6480cal bulunur.
Fedakar KARADAĞ
8
2. Yol
Formül kullanarak çözüme ulaşma
Q= m . Lb
Q= 12g . 540cal/g
Q= 6480cal
Her iki yoldan hesaplamanın mümkün
olduğu bu durumlarda hangisi daha kolayınıza geliyorsa onu kullanın.
bu gözeneklerden buharlaşmaya başlar buharlaşırken de testi
içindeki sudan ısı alırlar
ve böylece testi içindeki
su ısı vermiş olur.
Aynı durum % 95 su olan karpuzun
güneşe bırakıldığında bir miktar soğuması da örnek olarak verilebilir.
ERİME, DONMA, BUHARLAŞMA VE
YOĞUŞMANIN GÜNLÜK HAYATTA
KULLANIMI
1– Kış aylarında yolların buz tutmaması için tuzlama ve solüsyon
dökme çalışmalarının yapılması
Saf su 0 0C de
donar fakat içerisine
suda çözünen bir madde attığımızda
maddenin miktarına bağlı olarak daha
düşük sıcaklıklarda (–20C , -60C )gibi
donarlar. Bu duruma donma noktası
alçalması denir.
Günümüzde sadece köylerde kullanılmaya devam eden testiler yaz aylarında içindeki suyu serin tutar. Testi
topraktan yapıldığı için üzerinde çok küçük gözenekler vardır. Testi içindeki su
D.K.
Ç.K.
S
S.
E.
Fedakar KARADAĞ
7
ISINMA VE SOĞUMA EĞRİLERİ
Sıcaklık
Q=m.L
Maddenin ısı aldığı fakat
sıcaklığının yükselmediği durum bu bölgede
madde hem sıvı halde
hem gaz haldedir. Aldığı
ısı enerjisini sıcaklığı arttırmak için değil hal değiştirmek için kullanır.
Maddenin ısı aldığı fakat sıcaklığının yükselmediği durum bu bölgede
madde hem katı halde
hem sıvı haldedir. Aldığı
ısı enerjisini sıcaklığı arttırmak için değil hal değiştirmek için kullanır.
Tamamen gaza
dönüşmüş olan
maddenin ısı alıp
sıcaklığını yükselttiği durum
Zaman
Katı maddenin ısı
alıp yavaş yavaş
sıcaklığının yükseldiği bölüm.
Madde tamamen
D.K.
Ç.K.
S
S.
E.
Tamamen sıvıya
dönüşmüş olan
maddenin ısı alıp
sıcaklığını yükselttiği durum
Q= m
x
c
x
(ts - ti )
Fedakar KARADAĞ
8