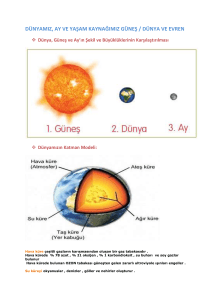
T.C. SAĞLIK BAKANLIĞI
HAYDARPAŞA NUMUNE EĞİTİM
VE ARAŞTIRMA HASTANESİ
PATOLOJİ LABORATUVARI
Şef V Doç. Dr. Fügen Vardar Aker
ÜROTELYAL TÜMÖRLERDE C-erbB-2 EKSPRESYONUNUN
KLİNİK-PATOLOJİK PROGNOSTİK FAKTÖRLER VE SAĞ
KALIM ORANI İLE KARŞILAŞTIRILMASI
UZMANLIK TEZİ
Dr. Aylin GÖNÜLTAŞ
İstanbul 2009
TEŞEKKÜR
Asistanlık eğitimim süresince bilgi ve tecrübesi ile daima yol gösterici olan klinik şef
yardımcımız Doç.Dr. Fügen Vardar Aker’e, asistanlık eğitimimin ilk günlerinden
itibaren değerli bilgilerinden faydalandığm,, Uzm. Dr. Güray Kılıç’a, zorlu asistanlık
süresince bilgi ve tecrübe yanında dostluklarını da esirgemeyen, eğitimime büyük
katkı sağlayan uzmanlarım; başta tezimin hazırlanmasında büyük emek harcayan tez
danışmanım Dr. Güray Kılıç’a ,olmak üzere, Dr. Murat Erkan’ a, Dr. Gülistan
Gümrükçü’ ye, Dr. Pembegül Güneş’e, ve Dr. Selvinaz Özkara’ya
çalışmaktan
birlikte
mutluluk duyduğum asistan arkadaşlarıma, bu çalışmanın teknik
desteğini sağlayan teknisyenlerimize, ömür boyu benden desteğini esirgemeyen aileme
en içten teşekkürlerimi sunuyorum…
ii
İÇİNDEKİLER
1. GİRİŞ VE AMAÇ……………………………………………………………… 4
2. GENEL BİLGİLER .........................................................................................
6
2.1 ÜROTELYAL KARSİNOMLAR……………………………………….…... 6
2.1. 1 Ürotelyal karsinomların epidemiyolojisi…… ………………….…..……6
2.1. 2 Ürotelyal karsinomların etyolojisi ……………….………………… …… 6
2.1.3 Ürotelyal karsinomların klinik bulguları …………..………………………7
2.1.4 Ürotelyal karsinomların lokalizasyonu ve makroskopik bulguları………. 8
2.1.5 Ürotelyal karsinomların histopatolojik özellikleri ve …………………..…8
derecelendirme
2.1.6 Ürotelyal karsinomlarda prognostik faktörler .………………………… .. 12
2.2 KARSİNOGENEZ VE ÜROTELYAL KARSİNOMLARDA
MOLEKÜLER DEĞİŞİKLİKLER
2.2.1 Karsinogenez ve hücre siklusu………………………………………..… 15
2.2.2 Ürotelyal tümörlerde karsinogenez……………………………..………… 17
2.3.ÜROTELYAL TÜMÖRLERDE c-erbB-2 EKSPRESYONU………………... 22
3. GEREÇ VE YÖNTEM ...................................................................................
25
3.1 Olgu seçimi ………………………………………………………….. …
25
3.2 İmmünhistokimyasal inceleme…………………….…………………..
25
3.3 İmmünreaktivitenin değerlendirilmesi…………………………...…...…… 26
3.4 İstatiksel değerlendirme………………………………………………….. 27
4. BULGULAR…………………………………………………..…….………… .
28
5. TARTIŞMA……………………………………………………….……...…..…… 42
6. SONUÇLAR…………………………………………………………..…..….…… 53
7. ŞEKİLLER…………………………………………………….…………...………. 54
8. KAYNAKLAR ……………………………………………….…….…….……… 57
3
1.GİRİŞ VE AMAÇ
Mesane tümörleri endüstrileşmiş ülkelerde çevresel faktörlere bağlı olarak giderek
daha sık görülmektedir. Mesane kanseri dünyada sık görülen tümörler arasında yedinci sırada
olup, rastlanma sıklığı %3.2 olarak bildirilmektedir (1) . Üriner sistem tümörleri arasında
prostat kanserinden sonra ABD’de ikinci, ülkemizde ise ilk sırada yer almaktadır (2).
Dünyada her yıl erkeklerde 260.000, kadınlarda 76.000 yeni mesane tümör olgusu
bildirilmektedir. Mesane tümörlerinin % 98’i karsinomlardır ve bunların % 90’ı ürotelyal
epitelden
karsinomlardır (transizyonel hücreli karsinomlar) (6) . Değişici epitel hücreli
karsinomlara ilk tanı konulduğunda % 85’i mesanede sınırlı ve yüzeyel iken %15’i metastaz
evresindedir (3, 10). Yüzeyel mesane tümörlerinin ise %75’i nüks etmekte, %25’i daha
yüksek histolojik dereceye progresyon göstermektedir. İnvaziv tümörlerde ise radikal cerrahi,
radyoterapi ve kemoterapi birlikte uygulanmasına rağmen kür oranı %20-50’yi aşmamaktadır
(3).
İlk tanı konulduğunda düşük histolojik dereceli olan tümörlerin sık nüks etmesi ve
daha yüksek dereceye ilerlemesi bu tümörlerde progresyon belirteçlerinin bilinmesinin
önemini arttırmaktadır. Histolojik derece, invazyon derinliği, lenf nodu metastazı, uzak
metastaz ve vasküler invazyonun varlığı gibi parametreler mesane tümörlerinde nüksü,
progresyonu ve sağ kalım süresini öngörmede kullanılan konvansiyonel prognostik
faktörlerdir. Mesane tümörlerinin onkogenezinde moleküler yolaklara ait bilginin giderek
artması, bu tümörlerin biyolojik davranışlarının tahmin edilmesine ve böylece yeni prognostik
faktörlerin ortaya çıkmasına olanak sağlamaktadır. Böylece progresyon ve metastaz
gelişmeden optimal tedavi verilmesini de mümkün kılabilmektedir(4).
4
Mesane tümörlerinin onkogenezinde rol alan moleküler yolaklardan olan protein
tirozin kinazlar, hücrede proliferasyon, migrasyon ve transformasyonu sağlayan önemli
mediatörler arasındadır. EGFR, c-erbB-2, c-erbB-3 ve c-erbB-4, tirozin kinaz proteinini
şifreleyen ve protein kinaz aktivitesine sahip reseptörlerdir. C-erbB-2 reseptörlerinin aşırı
üretiminin varlığı bir çok tümörün yanı sıra mesane tümörlerinde de moleküler olarak
gösterilmiştir. C-erbB-2 ekspresyonunun meme karsinomunun prognoz ve tedavisinde önemli
rol oynadığı bilinmektedir. Ürotelyal karsinomlarda da c-erbB-2 ekspresyonunu göstermenin
hem prognozu belirlemek hem de olası tedavi seçeneği oluşturmada katkı sunacağı
düşünülmektedir (4).
Bu çalışmada amaç, hastanemiz patoloji laboratuarında değerlendirilen ürotelyal
karsinomlarda retrospektif olarak c-erbB-2 ekspresyonunun oranını belirlemek; c-erbB-2
varlığı ile invazyon derinliği, histolojik derece, vasküler invazyon ve lenf nodu metastazı gibi
konvansiyonel klinikopatolojik prognostik faktörler ve sağ kalım süresi arasındaki ilişkiyi
araştırmaktır. Bu şekilde c-erb-2’nin olası bir prognostik faktör olarak değerini ortaya
koymaya katkı sunmaktır.
5
2-GENEL BİLGİLER
2.1 İNVAZİV ÜROTELYAL KARSİNOM
2.1.1- Epidemiyoloji:
Dünyada yaygın tümörler arasında %3.2 görülme oranı ile yedinci sıradadır.
Genellikle elli yaşın üstünde, erkeklerde kadınlardan daha sık görülür (3.5/ 1). Kuzey
Amerika, Avrupa ve Avustralya gibi endüstrileşmiş ülkelerde gelişmekte olan ülkelere
göre sıklığı altı kat fazladır (1, 5).
2.1.2-Etyoloji:
Sigara :
Ürotelyal karsinom riski sigara içenlerde içmeyenlere oranla 2-6 kat daha
fazladır ve endüstrileşmiş ülkelerdeki mesane tümörü olgularının %25-60’ında
sebep
sigaradır (1, 5, 6, 7 ).
Mesleki maruziyet:
Mesane kanserleri
meslek ile ilgili kimyasal maddelere maruz kalanlarda sık
görülür. Özellikle boya endüstrisinde çalışanlarda aromatik aminler, benzidine ve 2-naftil
aminler etyolojik ajanlardır. Mesane tümörlerinin % 25’inden fazlası bu karsinojenler ile
temas sonucudur (1, 5, 6, 7).
Fenasetin ve kronik analjezik kullanımı:
Aşırı fenasetin ve analjezik kullanımı renal pelvis , üreter ve mesanede ürotelyal
tümör gelişimi ile ile ilişkilidir. Tahmin edilen risk artışı 2.4-6 kat
arasındadır (1,5).
Medikal ilaçlar:
Sitotoksik bir ajan olan siklofosfamid kullanımı ile skuamöz hücreli karsinom
ve sarkomlar özellikle leiomyosarkom artan gelişim riski rapor edilmiştir (1,5).
Yapay tatlandırıcılar:
Deney hayvanlarında çok yüksek dozda in utero veya neonatal dönemde
yapay
tatlandırıcılara
maruz
kalan
kemirgenlerde
mesane
gösterilmiştir. Ancak insanlarda benzer etki gösterilememiştir (1,2,5).
Gıda maddeleri:
6
tümörü
oluşumu
Yüksek sodyumlu ve özellikle yağ içeren yüksek kalorili gıdalar ile beslenen
65
yaşından
kolesterol
genç
kişilerde
mesane
tümörü
gelişme
riski
artmaktadır.Yüksek
içeren diyetlerin artan mesane tümör riski ile ilişkili olduğu gösterilmiştir
(1,2,5).
Kahve ve çay tüketimi:
Açıkça gösterilmiş kanıtlar olmamakla birlikte bazı epidemiyolojik çalışmalar
kahve içimi ile riskin arttığını bildirmektedir (1).
Klorlanmış içme suyu:
Klorlanmış içme suyu ile mesane tümörü gelişme riski 1.6-2 kat artmaktadır (2).
Kronik sistit:
Bazı araştırmacılara göre mesane tümörleri ile üriner sistem infeksiyonları ve
üriner sistem
taşları arasında ilişki vardır. Tümör gelişiminin altındaki mekanizma
epitelin kronik irritasyonuna bağlıdır. Şistosoma haematobiuma bağlı
kronik sistit
sonucunda genellikle skuamöz hücreli karsinom gelişir (1,5).
11-endojen tritofan metabolitleri:
Kinurenin , kinurenik asit , 3-hidroksikinurenin gibi karsinojen olduğu bilinen
triptofan
metabolitlerine
mesane
tümörlü
hastaların
idrarında
yüksek
oranda
rastlanmaktadır. Ancak yapılan son çalışmalarda triptofan metabolitlerinin etyolojide rol
oynamadığı gösterilmiştir (2).
Radyasyon:
Serviks
kanseri
nedeni
ile radyoterapi gören hastalarda mesane tümörü
gelişme riski normalin 2-4 kat fazlasıdır. Radyasyonun neden olduğu mesane tümörleri
yüksek histolojik derecelidir ve tanı konulduğunda sıklıkla lokal invazyon yapmıştır (2).
2.1.3-Klinik bulgular:
Ürotelyal tümörlerde klinik bulgu ve semptomlar tümörün lokalizasyonuna ve
yaygınlığına bağlıdır. Hastaların çoğunda klinik bulgu mikroskopik hematüridir. En sık
semptom ise hastaların %85’inde görülen makroskopik hematüridir. Dizüri idrar yapma
sıklığında artış gibi irritatif semptomlar mesane boynunda lokalize tümörlerde sık
görülür. Benzer semptomlara yaygın karsinoma in situ vakalarında da rastlanır. Üreteral
orifisleri infiltre eden tümörlerde hidronefroz, ilerlemiş metastazlara bağlı karın ağrısı
veya
kemik
ağrıları
görülebilir. Ultrasonografi, bilgisayarlı tomografi, intravenöz
ürografi, magnetik rezonans gibi radyolojik yöntemler sadece tanı amaçlı değil aynı
zamanda infiltratif ürotelyal karsinomların klinik evrelemesi için de kullanılır (1, 7) .
7
2.1.4-Lokalizasyon ve makroskopik bulgular:
Ürotelyal karsinomlar mesanede bir çok yerden kaynaklanabilir. 1000 vakadan
oluşan bir seride tümör lokalizasyonu % 37’si yan duvarlar, %18’i arka duvar
%12’si trigon, %11’i boyun bölgesi, %10’u üreter orifisleri, %8’i kubbe ve %4’ü
ön duvarda tanımlanmıştır. İnfiltratif ürotelyal karsinomlar makroskopik olarak soliter
yada multifokal olabilirler; papiller, nodüler polypoid, endofitik ve ülseratif gelişim
gösterirler. Tümör dışı mukoza normal veya eritematöz görünür.(1,5)
2.1.5- Histopatolojik özellikleri ve derecelendirme :
Ürotelyal tümörler için ilk olarak 1922’de Broder’in yaptığı sitolojik anaplazi ve
yapısal özellikleri esas alan derecelendirme sistemi önerilmiştir. Günümüze kadar değişik
histolojik derecelendirme sistemleri kullanılmakla birlikte, 1998 yılında o ana kadar
kullanılan çeşitli
sınıflama
ve derecelendirme sistemlerinin
Organization “(WHO) ve “International Society of
Urological
oluşturdukları yeni bir sınıflandırma ve derecelendirme sistemi
2004
yerini “World Health
Pathology” (ISUP)
almıştır. 1999, 2002 ve
yılında yapılan küçük değişikliklerle halen kullanılan WHO -2004 sınıflandırma ve
derecelendirme sistemi ortaya çıkmıştır. WHO/ISUP sınıflamasında ürotelyal neoplazmlar
flat ve papiller lezyonlar olarak iki sınıfa ayrılmıştır. Papiller neoplazmlar ise histolojik
derecesi ve invazyon özelliğine göre; papilloma; düşük malignite potansiyelli papiller
neoplazm; low grade papiller karsinom ve high grade papiller karsinom olarak
sınıflandırılmıştır. Mostofi’nin önerdiği histolojik derecelendirme grade 0-papilloma, grade
1, grade 2, grade 3 idi.
WHO-2004 sınıflamasına göre ise ürotelyal tümörler yapısal ve
sitolojik özellikleri esas alınarak düşük histolojik derece ve
yüksek histolojik derece
(low/high grade) olarak gruplandırıldı (5, 6)
WHO-1998 ( Mostofi):
Grade 0, papilloma: Normal mesane mukozası ile çevrili ince fibrovasküler kor içeren
papiller lezyondur.
Grade 1 ( Düşük malignite potansiyelli papiller neoplazm ) : Yedi ve daha fazla hücre
ile döşeli papiller
yapılardan oluşan tümörlerdir. Hücreler
arasında
polarite kaybı
ve
kohezyon kaybı minimaldir. Nükleus /stoplazma oranı artmıştır, nükleol belirginliği
yoktur, mitoz seyrek ve epitelin bazalinde görülür.
8
Grade 2 ( low grade ) : Birbirleri ile birleşme eğiliminde papiller yapılardan oluşan
tümörlerdir. Hücrelerde hafif ve orta derecede düzenlenim ve polarite kaybı, nükleuslarda
pleomorfizm, artan nükleus / sitoplazma
oranı
ve epitelin
bir
çok seviyesinde
görülebilen seyrek mitoz mevcuttur.
Grade 3 ( high grade) : Birbirleri ile
polarite
ve
kohezyon
kaybı,
birleşen
papiller yapılar, belirgin
derecede
nükleuslarda pleomorfizm ve hiperkromazi, nükleol
belirginliği ve çok sayıda mitoz görülmektedir.
Tablo:1-Papiller ürothelial neoplazmların klasifikasyonu (WHO/ISUP):
WHO
ISUP
Papilloma
Papilloma
Grade 1
Düşük malignite potansiyelli papiller neoplazm(PUNLMP)
Grade 2
Low grade /high grade
Grade 3
High grade
Low grade tümörler hemen daima papiller ve genellikle yüzeyel tümörlerdir
(pTa,pTis, pT1). Yüzeyel tümörler ürotelyal tümörlerin %75-85’ini oluştururlar (9, 10) .
Histopatolojik incelemede küçük büyütmede düzenli gelişim gösteren papiller yapılar
şeklindedirler. Hücreler
genellikle
üniform,
arasında kohezyon ve polarite
nükleuslarda büyüme
ve
hafif
kaybı
minimaldir. Hücreler
pleomorfizm
vardır. Ancak
nükleuslarda kalabalıklaşma, hiperkromazi, nükleol belirginliği yoktur. Mitoz seyrektir.
Jose I.Lopez
ve
ark.’larının
pTa ve pT1 evre olgulardan oluşan “review”
çalışmasında grade 1 ve 2 tümörler low grade sınıfına dahil edilmiştir. Aynı çalışmada
Pauwell
ve
ark.’larının grade 2
sınıfındaki tümörleri
nükleer
polarite
varlığı
ve
yokluğu ile ilişkili olarak grade 2a ve grade 2b olarak iki alt gruba ayırdığı, grade
2a tümörleri low grade sınıfına, grade 2b tümörleri high grade sınıfına dahil ettikleri
belirtilmiştir. Aynı yayında low grade tümörlerin
%17.5’inin
pTa ,
%82.5’inin
pT1
evresinde olduğu bildirilmiştir. PTa evresindeki tümörlerin tamamı low grade (G1-2a) ,
pT1 tümörlerin ise %43.03’ü grade 1, %49.09’ı grade 2 , %7.87’si grade 3 tümörler
olduğu belirtilmiştir (9). Grade 1-2
tümörlerde
ileri
patolojik
evreye progresyon
ve
nüks grade 3 tümörlere oranla daha azdır. Grade 3 tümörler infiltratif paternde invazyon
gösteren ve lamina propria invazyonu kolaylıkla tanımlanabilen tümörlerdir. Grade 1
9
ve grade 2 tümörlerde lamina propria invazyonu belirlemek daha güçtür. Çünkü bu grup
tümörlerin çoğu pushing tarzda infiltrasyon gösteren tümörlerdir. Low grade tümörlerde
kas invazyonu ve high grade tümörlere progresyon %5’ten azdır (1, 6, 8, 9).
High grade tümörler sıklıkla kas invazyonu gösterirler (pT2-T4). Genellikle
solid yapılar oluştururlar. Ancak değişen oranlarda papiller yapılar içerebilirler ya da pür
papiller yapılar gösteren
tümörler high grade
Tümör hücrelerinde polarite ve
kohezyon
sitolojik
özelliklere sahip
olabilirler.
kaybı görülmektedir. Hücrelerde belirgin
pleomorfizm, nükleuslarda irileşme ve kalabalıklaşma, hiperkomazi, nükleol belirginliği ve
çok sayıda mitoz görülmektedir. Desmoplastik stromal reaksiyon ve lenfositik infiltrasyon
belirgindir. Farklı diferansiyasyon alanları eşlik edebilir. Skuamöz ve daha
az
oranda
glandüler diferansiyasyon en sık görülen varyantlardır (1,5,6).
İnfiltratif ürotelyal karsinomların histopatolojik değerlendirmesinde en önemli
parametre invazyonun
varlığı
ve
derinliğidir. Patolojik
evre
önemli
prognostik
faktördür. Ancak invazyon olguların yaklaşık %40’ında hatalı olarak değerlendirilmektedir
(6). Bu duruma lamina propria
invazyonu
olan
erken
evre
invaziv
ürotelyal
karsinomlarda (pT1) daha sık rastlanır. Farklı serilerde lamina propria invazyonu sıklığı
çok değişkendir ve buna bağlı progresyon oranları da değişir. Koter artefaktı, önceki
biyopsi veya intravezikal tedavinin neden
olduğu
anatomik sınırın
ortadan kalkması
biyopsi örneğinin patoloji laboratuarında hazırlanması esnasındaki teknik problemler,
tanjansiyel kesitler lamina propria invazyonun değerlendirilmesinde
güçlüklere
neden
olabilir. Düzensiz şekilli ve bazal membranları izlenmeyen tümör hücre gruplarının varlığı
tümör hücrelerinin tek tek dağılması, tümor adacıklarının çevresindeki retraksiyon artefaktı,
desmoplastik stroma ve infiltrasyon
kenarlarında
geniş eosinofilik sitoplazmalı hücre
grupları varlığı lamina propria invazyonu yönünde değerlendirilen morfolojik bulgulardır.
Muskularis propria invazyonunu (pT2) değerlendirirken muskularis mukozadaki kas
liflerini muskularis
devamlılık
propriadaki
liflerden ayırmak gerekir. Muskularis mukoza lifleri
göstermeyen küçük demetler şeklindedir; ayrıca bu bölgede çok sayıda kan
damarının varlığı muskularis propriadan ayırımında önemli bir ipucudur. Muskularis propria
lifleri gevşek anastomozlaşan içte ve dışta longutidinal kas lifleri ile ortada kalın sirküler kas
liflerinden oluşur. Transüretral rezeksiyon materyalinde derin ve yüzeyel muskularis propria
invazyonu ayırt edilemez ve yağ dokusu içinde tümör hücrelerinin varlığı
10
mutlaka
perivezikal infiltrasyonun kanıtı değildir. Çünkü lamina proriada da yağ dokusu mevcuttur
(1,6,8).
Tablo 2- Mesane ürotelyal karsinomlarında TNM klasifikasyonu(WHO/2004):
T Primer tümör
Ta Non-invaziv papiller karsinom
Tis Karsinoma in situ “flat tümör”
T1 Tümör subepitelyal konnektif dokuya invaze
T2 Tümör kas tabakasına invaze
T2a tümör yüzeyel kas tabakasına invaze (iç ½)
T2b tümör derin kas tabakasına invaze (dış ½)
T3 Tümör perivezikal dokuya invaze
T3a mikroskopik
T3b makroskopik (ekstravezikal kitle)
T4 Tümör prostat, uterus, vagina, pelvik duvar, abdominal duvara invaze
T4a tümör prostat, uterus veya vagene invaze
T4b tümör pelvik veya abdominal duvara invaze
N
Bölgesel lenf nodu
N0 Bölgesel lenf nodu metastazı saptanamadı
N1 2cm veya daha küçük çapta bir lenf nodu metastazı
N2 2 cm ‘den büyük 5 cm’den küçük bir lenf nodu metastazı veya 5 cm’den büyük
çapta olmayan multipl lenf nodu metastazı
N3 5 cm’den büyük çapta lenf nodu metastazı
M Uzak metastaz
M0 Uzak metastaz saptanmadı
M1 Uzak metastaz saptandı
11
Tablo 3-Ürotelyal mesane karsinomlarında klinik evreleme:
Stage 0a
Ta
N0
M0
Stage 0is
Tis
N0
M0
Stage I
T1
N0
M0
Stage II
T2a,b
N0
M0
Stage IIı
T3a,b
N0
M0
T4a
N0
M0
T4b
N0
M0
T
N1,N2,N3
M0
Stage IV
T
N
M1
2.1.6-Ürotelyal karsinomlarda prognostik faktörler:
Ürotelyal yüzeyel tümörlerde nüks ve daha ileri evreye progresyon, invaziv tümörlerde
ise metastaz yapma olasılığı ve böylece sağ kalım süresi tümörün genetik yapısı ile ilişkilidir.
Konvansiyonel histopatolojik değerlendirme (grade ve klinik evre ) mesane tümörlerinde
prognozu tam olarak belirleyemez. Ürotelyal tümörlerin karsinogenezisinin iyi anlaşılabilmesi
sonucunda çeşitli potansiyel prognostik faktörler tanımlanmıştır. Bunlar arasında kan grup
antijenleri, proliferasyon antijenleri, onkogenler, büyüme faktörleri ve reseptörleri, hücre
siklusunu düzenleyen
proteinler, tümör anjiogenezis ve anjiogenetik inhibitörler
hücre
adezyon molekülleri , operasyon sırasında kan trasfüzyonu , nüks sayısı ve nüks görülmeyen
dönemin süresi bulunmaktadır (1, 5, 20, 22, 37). Tümörün progresyonu ile ilgili yapılan
çalışmalar arasında önemli farklılıklar gözlenmektedir. Bu nedenle prognozu belirleyebilmek
için henüz yeterli güvenirlikte parametre mevcut değildir. Çalışmamızda
prognostik
faktörlerden klinik evre (invazyon derinliği, lenf nodu durumu ve uzak organ metastazı
varlığı), histolojik derece ve lenfatik/vasküler invazyon değerlendirildi .
Stage:
Klinik evre en önemli prognostik faktörlerdendir. Tümörün invazyon derinliği
(Ta, Tis, T1, T2a-T2b, T3 ve T4), lenf nodu durumu (N0,N1-N3) ve uzak metastaz varlığı
(M0,M1) esas alınarak klinik evreleme yapılır. Ürotelyal tümörler klinik bir tanımlama ile
12
yüzeyel ve invaziv olarak iki evreye ayrılır. Bu evreleme tümörlerin prognoz ve tedavi
açısından değerlendirilmesi ile yakından ilişkilidir.
ı-yüzeyel ürotelyal tümörler (pTa,pTis, pT1)
ıı-invaziv ürotelyal tümörler (pT2-pT4)
Yüzeyel mesane tümörleri non-invaziv ve lamina propria infiltrasyonu gösteren;
invaziv ürotelyal
tümörler ise muskularis propria ve daha derin invazyon gösteren
tümörlerdir. İlk tanı konulduğunda mesane tümörlerinin %75-85 ‘i yüzeyel, %15-25’i ise
invazivdir. (3, 9, 10). Yüzeyel tümörlerin % 60-70’inde nüks, % 10-20’si progresyon
göstererek invaziv ya da metastatik hastalığa dönüşür (7). Schned ve ark.’larının 342 vakadan
oluşan “review” çalışmasında ürotelyal tümörlerin %25.7’si PUNLMP, %34.3’ü low-grade
papiller ürotelyal karsinom, % 22.6’sı high grade papiller karsinom, % 10.1’i non-papiller
ürotelyal karsinom ve %5.5’i karsinoma in situ olarak bildirilmiştir ve çalışmalarında diğer
serilerden yüksek oranda PUNLMP , düşük oranda high grade papiller karsinom tanımlandığı
belirtilmiştir (12).
İnvaziv tümörlerde invazyon derinliğinin dışında karsinoma in situ ve lenfatik/vasküler
invazyon varlığı, lenf nodu metastazı ve uzak metastaz prognozu kötüleştiren faktörlerdir.
Cahit Ş.’nin çalışmasında beş yıllık sağ kalım pTa tümörlerde %95, pT1 tümörlerde %72, pT2
tümörlerde %64, pT3a pT3b ve pT4 tümörlerde %39 bildirilmiştir (2).
Lenf nodu tutulumu:
Mesane tümörü nedeni ile sistektomi yapılan hastaların otopsilerinde bölgesel lenf nodu
tutulumu %20-35 oranında tespit edilmiştir (2, 5) . En sık sırasıyla obturator (%75), iliak
eksterna, iliak interna, iliak kommunis ve hipogastrik lenf nodlarının tutulumu görülür. İleri
patolojik evre ve high grade tümörlerde tutulum sıktır. Tümör çevresinde lenfatik damar
proliferasyonu lenf nodu metastazı ile ilişkilidir ( 18).
High grade invaziv tümörlerde radikal sistektomi standart ve efektif tedavi yöntemidir.
Sistektomi sırasında lenf nodu diseksiyonunun mutlak sınırları tam olarak tanımlanmamış
olmasına rağmen optimal pelvik lenf nodu disseksiyonu klinik evrenin belirlenmesini ve
hastaların tedavisini sağlar. Lenf nodu diseksiyonlarında çıkartılan total lenf nodu ve
metastatik lenf nodu sayısı, lenf nodu yoğunluğu önemli parametrelerdir. Lenf nodu
yoğunluğu; pozitif lenf nodu sayısının çıkartılan toplam lenf nodu sayısına bölümü ile elde
edilen sonuçtur ve nüks olmaksızın sağ kalım ile ilişkilidir. Lenf nodu yoğunluğu %20’inin
altında olan hastalarda 5 -10 yıllık nüks olmaksızın sağ kalım oranı %44 ve %43, lenf nodu
13
yoğunluğu %20’inin üstünde olan hastalarda nüks olmaksızın sağ kalım oranı %17’dir (14).
Lenf nodu pozitif vakalarda 5 ve 10 yıllık nüks olmaksızın sağ kalım oranı %35 -%34, nüks
ve metastazlar ile birlikte sağ kalım oranı %30-%33’tür (2, 5, 14 ).
Mikroskopik grade :
Grade 1 ve 2 tümörler genellikle yüzeyel tümörlerdir (pTa, pTis,pT1) ve bu tümörlerde
grade en önemli prognostik faktördür. Grade 1-2 tümörler genellikle non-invaziv, grade 3
tümörler ise invaziv tümörlerdir (pT2-T4) (9). Schned ve ark.’larının 342 vakadan oluşan
“review” çalışmasında ürotelyal %52.5’i grade 1, %21.4’ü grade 2 %26.1’i grade olarak
bildirilmiştir (WHO-1973). Bu tümörlerin üçte ikisi evre Ta , % 20.8’i evre T1, % 7.6’sı T2
ve daha ileri evre idi.Aynı çalışmada PUNLMP tümörlerin %100’ü non-invaziv, low grade
karsinomların %6.3’ünün , high grade karsinomların %64.9’unun invaziv tümörler olduğu
gösterilmiştir (12). Ürotelyal tümörlerde progresyon oranları grade 1 için %2, grade 2 için
%11, grade 3 için %45’tir. Bir yıllık takipte nüks oranları grade1 için %25, grade 3 için
%55’tir (2) . Olguların %10-30’unda nüks tümörlerin histolojik derecesi primer tümörün
histolojik derecesinden daha yüksektir (5).
Lenfatik/vasküler invazyon:
Radikal sistektomi yapılan hastalarda lenf nodu metastaz riski, yüksek nüks oranı ve
düşük sağ kalım oranını işaret eden olumsuz prognostik faktördür. Özellikle pT1 hastalarda
lenfatik/vasküler invazyon progresyon riskinde artışı gösterir. PT2 hastalarda ise
lenfatik/vasküler invazyon lenf nodu negatif vakalarda neoadjuvan tedavi lehine karar
verilmesini sağlar. Lakshmi p.Kunju ve ark.’larının retrospektif
çalışmasında TUR
spesmenlerinde lenfatik/vasküler invazyon saptanan vakalara ait sistektomi piyeslerinin ancak
%65’inde bu invazyon gösterilebilmiştir ve %41 vakada lenf nodu metastazı saptanmıştır
(15).
Bu nedenle TUR örneklerinde vasküler invazyon saptanan vakalarda sistektomi
öncesinde neoadjuvan kemoterapi önerilir (15). Linke ve ark.’larının çalışmasında damar
invazyonu görülen hastalarda 5 yıllık sağ kalım oranı %29, vasküler invazyon görülmeyen
hastalarda %51 olarak saptandığı , Lopez ve ark.’larının çalışmasında ise vasküler invazyon
görülen pT1 tümörlerde 5 yıllık sağ kalım %44, vasküler invazyon görülmeyen tümörlerde
%81 olarak saptandığı belirtilmiştir. (5, 25 ).
14
Ürotelyal tümörlerdeki diğer prognostik faktörler :
Karsinoma in situ
Tümör sınırları ve inflamatuar yanıt
Tümör dışı mesane mukozası
Tümör-infiltratif lenfositler
Tümör boyutu
Tümör lokalizasyonu
Yaş
Kan grubu antijenleri
DNA ploidy
Kromozom anomalileri
Proliferasyon antijenleri
p53 overekspresyon
Retinoblastom gen(Rb) ekspresyonunda değişiklik
E-kadherin ekspreson kaybı
Cyclin E ve p27 kaybı
CD 44
Sitokeratin 20
2.2-KARSİNOGENEZ
VE
ÜROTELYAL
KARSİNOMLARDA
MOLEKÜLER DEĞİŞİKLİKLER
2.2.1.Karsinogenez ve hücre siklusu
Karsinogenezisin moleküler temelinde genetik hasar yatar. Genetik kanser hipotezine
göre tümör kütlesi genetik hasara uğrayan tek bir öncü hücrenin otonom klonal büyümesi ile
ortaya çıkar yani karsinogenez monoklonal olarak başlar.
Genetik hasarın esas hedefi olan üç tür normal regülatör gen vardır:
a)Büyümeyi uyaran proto-onkogenler
b)Büyümeyi inhibe eden kanser baskılayıcı genler (tümör süpresor genler)
c)Programlı hücre ölümü veya apoptozu düzenleyen genler
15
Üç gen türüne ek olarak hasara uğrayan DNA onarımını düzenleyen dördüncü gen türü
de karsinogeneziste önemli yer tutar (13). DNA onarım genlerindeki hasar yaygın mutasyona
zemin hazırlayarak neoplastik değişime yol açar.
Hücre büyümesi, farklılaşması ve çoğalmasında rolü olan proto-onkogenlerde meydana
gelen mutasyonlar tümör gelişimine, tümör baskılayıcı genlerde meydana gelen mutasyonlar
ise hücre siklusunun inhibisyonunu engelleyerek anormal hücre büyümesine neden olur.
Fizyolojik şartlarda hücre büyümesi beş basamaklıdır:
1-Büyüme faktörü hücre membranındaki reseptöre bağlanır.
2-Büyüme faktörü reseptörleri plazma membranındaki proteinleri aktive eder.
3-İletilen uyarı ikincil haberciler veya sinyal yapan molekül zinciri ile çekirdeğe sinyal
taşır.
4-DNA kopyalamasını başlatan nükleer düzenleyici faktörler aktive olur.
5-Hücre bölünme siklusuna girer.
HÜCRE SİKLUSU
Hücrenin kendine benzer iki hücreye çoğalması (replikasyonu) ile sonuçlanan
biyokimyasal fazlardan oluşur ve büyüme faktörleri tarafından düzenlenir. Normal hücrelerde
hücre siklusu interfaz (G1-S-G2) ve M(mitoz) fazları olarak tekrarlanır. Siklus süresince
hücre uyarımı ve büyüme meydana gelmektedir. Hücre uyarı almadığı sürece istirahat fazı G0
da durmaktadır. G1 fazında hücreler sinyalleri alır ve büyümeyi uyarır. Bu fazda RNA ve
protein sentezi olur ve DNA sentezi için hazırlık yapılır. S fazında (DNA sentez fazı) DNA
ikiye katlanır. G2 fazında ise hücre büyümeye devam eder. RNA sentezi ve protein sentezi
gerçekleşir ve hücre mitoza hazırlanır. Mitoz bölünme ise profaz, metafaz, anafaz ve
telofazdan oluşur. Telofazda sitoplazmik bölünme tamamlanır aynı genetik materyalli iki yeni
hücre meydana gelir. G1-S- G2 fazları hücre siklusunun %6’ınını kapsar ve 16-24 saat sürer,
mitoz ise 1-2 saat sürer. Hücre siklusunda G1-S geçişinde, G2-M geçişinde, metafaz-anafaz
geçişinde kontrol noktaları vardır. Bu noktalarda hücrenin siklusa devam edip etmeyeceği
kararı verilir.
Hücre siklusu siklinler (A,B,C,D,E), siklin bağımlı kinazlar (CDK) ve siklin bağımlı
kinaz inhibitörleri (CDKIs) tarafından düzenlenir. Siklinler hücre siklusunun çeşitli fazlarında
sentezlenen ve düzeyleri düşen spesifik proteinlerdir. Siklinler inaktif formda olan siklin
bağımlı kinazları fosforile ederek aktive eder. Hücre siklusunda G1’den S fazına geçiş en
16
önemli kontrol noktasıdır. Hücre uyarı ile karşılaştığında G1 fazında ilk olarak siklin D ve
siklin E düzeyi artar, CDK4 ve CDK6 oluşup aktive olur. Siklin bağımlı kinazlar (CDKs )
pRB’a (Retinoblastom proteini) bağlanıp fosforile ederek inaktivasyonuna neden olur ve
böylece hücre siklusu S fazına geçer. SiklinB, CDK1 ile kompleks oluşturarak G2’den M
fazına geçişi sağlar. Siklin ve siklin bağımlı kinaz aktivitesi siklin bağımlı kinaz inhibitörleri
tarafından kontrol edilir. İki farklı CDKIs ailesi vardır ;Cip/Kip(p21, p27, p57) ve INK4 (p15,
p16,p18,p19). Bu proteinler siklin/CDK kompleksi oluşumunu ve DNA replikasyonunu
frenlerler (11, 13, 16 ).
Normal hücrelerde denge; hücre çoğalması ( hücre siklusu), büyümenin durdurulması
ve apoptozis (programlı hücre ölümü) ile sağlanır. Apoptozis normal hücre ölümü ve mutant
hücre çoğalmasını önleyen önemli bir yoldur. Kontrol noktaları hücre siklusuna geçiş
dönemlerinde genetik hasarın düzetiltildiği ve siklusun devamına veya durdurulmasına karar
verilen
dinlenme
peryodlarıdır.
Kontrol
noktalarında
mutasyonlar
ve
apoptozisin
engellenmesi kanser gelişiminde kritik yolaklardır(11).
2.2.2. Ürotelyal tümörlerin karsinogenezisi
Ürotelyal tümörlerde moleküler ve genetik değişiklikler üç gruba ayrılır:
1-Kromozomal değişiklikler (karsinogenezisin başlamasından sorumludur)
2-Tümörün proliferasyonu; hücre siklusu düzeninin ve apoptozisin kaybı
3-Metastaz ; anjiogenezis ve hücre adezyon kaybı
ÜROTELYAL TÜMÖRLERDE MOLEKÜLER DEĞİŞİKLİKLER
Mesane tümörlerinin %98’ı epitelyal orjinlidir ve bunların çoğunluğu değişici epitel
hücreli karsinomlardır (6). Mesane tümörleri moleküler profili ve klinik davranışı ile ilişkili
olarak iki alt gruba ayrılır:
a) Low grade tümörler: Hemen daima papiller ve genellikle yüzeyeldir.
b) High grade tümörler: Papiller veya non-papiller ve genellikle invazivdir.
Mesane tümörleri tanımlanan bu morfolojik antiteler ile uyumlu olarak genetik
instabilite yönünden iki farklı genetik subtip içerir(10).
1-Genetik stabil tümörler: Low grade non invaziv papiller ürotelyal tümörler (pTa).
2-Genetik stabil olmayan tümörler: High grade (pTaG3 ve cıs) ve invaziv gelişen
karsinomlar(stage pT1- pT4 ).
17
Non-invaziv low grade papiller neoplazmlarda (pTa,G1-2) genomik değişiklikler daha
azdır ve bu nedenle genetik stabil tümörlerdir. İnvaziv gelişen tümörler (stage pT1-4) ve high
grade (pTaG3) neoplazmlar ise belirgin genetik değişiklikler içerir (1, 10 ).
Mesane tümörlerinde “Comparative genomik hybridizasyon” (CGH) ile en az 7-10
arasında kromozomal anomali saptanmıştır. En sık kromozom bölgelerinde fonksiyon kayıp
ve kazanç mutasyonları görülür. Mesane tümörlerinin karsinogenezinde en sık onkogenler
(H-RAS c-erbB-2,EGF-R, FGF-R, MDM2), tümör süpresor genler (p53,Rb,p21,PTEN)
kromozomal kayıplar (3q,4q,5q,8p,9p,9q,11p,13q,14q,17p,18q) sebep olarak saptanmıştır. 9q
kromozom kayıpları tüm ürotelyal tümör morfolojilerinde en sık görülen kromozom
harabiyetidir (1, 10, 17, 19, 24, 33, 42, 45, 46) .
Tümörler morfolojilerine göre sınıflandırılarak moleküler genetik değişiklikleri
değerlendirildiğinde:
Hiperplaziler:
Ürotelyum epitelinde displastik değişiklikler olmaksızın önemli kromozomal
değişiklikler saptanmıştır. Kanser öyküsü olan normal ürotelyum epitelinde bile kromozomal
değişiklikler bildirilmiştir (1). Çalışmalar mutasyon ve kromozomal anomalilerin bir kısmının
tümör gelişiminde, diğer bir kısmının ise tümörün progresyonunda rol oynadığını
göstermektedir(45).
Flat lezyonlar (karsinoma in situ):
Bu lezyonlarda fonksiyon kaybı mutasyonlar ile karakterize tümör süpresor gen (p53,
RB,PTEN) değişiklikleri önemli rol oynar. Karsinoma in situ da invaziv gelişen tümörlere
benzer. Kromozom 9 delesyonları ile bir çok kromozamal delesyonlar saptanmıştır (1, 45 ).
Non-invaziv low grade ürotelyal karsinomlar (Ta,Tis):
Fonksiyonel kazanç mutasyonları ile karakterize RAS ve FGFR-3 onkogenlerinde
genetik değişiklilerin ve kromozom 9q kayıpları saptanmıştır (1, 10, 45).
İnvaziv tümörler (pT1-4):
İnvaziv tümörlerde sıklıkla fonksiyon kaybı şeklindeki mutasyonlar tümör süpresor
genleri ( P53,RB VE PTEN) etkileyerek tümör gelişiminde rol oynar (1, 45).
18
Multifokal mesane tümörleri:
Ürotelyal neoplazmlarda multifokalite, nüks ve tümöre eşlik eden flat lezyonlar sık
görülür. Multisentrik mesane tümörleri %80-90’ı monoklonaldir. Neoplastik hücreler bir
alandan orjin almakla birlikte deskuamasyon ve implantasyon sonucu multisentrik görülür.
Bununla beraber poliklonal erken dönem lezyonlar veya prekürsör lezyonlarda bildirilmiştir.
Bu tümörler çevresel mutajenlerin etkisi ile genetik değişiklikler gösteren hücre alanlarının
neden olduğu “field defect” hipotezini destekleyen poliklonal multifokal tümörlerdir (1).
Onkogenler:
Kanser hücrelerinde otonom hücre uyaran genler onkogen adını alır. İlk olarak
hayvanlarda tümör oluşturan akut transforme edici retrovirüslerin genomunda bulunmuştur.
İnsanlarda
da
bu
genlerin
varlığı
gösterilmiştir.
Normalde
hücre
büyüme
ve
diferansiyasyonunu kontrol eden proto-onkogenlerde kromozomal fonsiyonel kazanç
mutasyonları sonucunda meydana gelirler ve onkoprotein adı verilen proteinleri kodlarlar.
Onkoproteinler normal proto-onkogenlere benzerler. Ancak farklı olarak önemli düzenleyici
elemanları yoktur ve transforme hücrelerde üretimleri büyüme faktörleri veya dış uyaranlara
bağlı değildir. Büyüme faktörleri, büyüme faktörü reseptörleri, sinyal üretimde görevli
proteinler ve çekirdekteki nükleer düzenleyici proteinler;
artmış ekspresyon, gen
amplifikasyonu, nokta mutasyonları ve gen reaaranjmanları yolu ile onkogenlere dönüşürler.
Önemli proto-onkogenler RAS onkogen ailesi, EGF-R, c-erbB-2 , MDM2
ve MYC
onkogenleridir (11, 13, 19, 28 ).
Tümör süpresor genler:
Onkogenler hücre büyümesini uyaran proteinleri kodlarken, tümör baskılayıcı gen
ürünleri hücre çoğalmasını frenler. Tümör süpresor genleri kodlayan kromozomlardaki
fonksiyonel kayıp mutasyonları şeklindeki moleküler değişiklikler sonucunda tümör süpresor
genler inaktive olur ve karsinogeneze yardımcı olur. Tümör supresor genler, ilk kez herediter
ve sporadik olarak görülen bir tümör olan retinoblastomda tespit edilmiştir. Retinoblastom
inaktivasyonu sadece retinoblastomda değil meme, mesane, küçük hücreli akciğer
karsinomları ve glioblastomlarda da görülür. Tümör süpresor genlerin en iyi bilinenleri
retinoblastom (RB), p53, TGF(Transforme edici büyüme faktörü), APC (Adenomatöz
Polipozis Koli) genidir. P53,
17q23 kromozomunda lokalize 53kDA ağırlığında DNA
onarımı, apoptoz, hücre büyümesinin kontrolü ve neovaskülarizasyonda rol oynar.
19
İnsanlardaki tümörlerin yaklaşık % 50’sinde p53 mutasyonları vardır. P53 mutasyonları
ürotelyal tümörlerde de tanımlanmış olup, prognostik faktör olarak değerlendirilmektedir (13,
19, 28).
Siklinler :
Hücre siklusunun
düzenli tekrarlayan gidişi siklin/ siklin bağımlı kinaz protein
kompleksi ve siklin bağımlı kinaz inhibitörleri ile düzenlenir. Tümör süpresor gen ve onların
ürünü olan proteinlerin mutasyonları (p53, Retinoblastom geni, p27,p16,p14) siklin
proteinlerinin regülasyonunu bozarak tümörün progresyonuna yol açar (13,19).
Anjiogenez ve hücre adezyon kaybı :
Tümörler damarlanma olmadığı sürece 1-2 mm çaptan fazla büyüyemez ve metastaz
yapamaz. Tümör ile ilişkili anjiogenik faktörler tümör hücreleri ve tümörü infiltre eden iltihap
hücreleri (makrofajlar) tarafından yapılır. Anjiogenik faktörlerin en önemlileri vasküler
endotelyal büyüme faktörü (VEGF) ve temel fibroblast büyüme faktörüdür. Tümör hücreleri
sadece anjiogenik değil aynı zamanda anjiogenezisi inhibe eden faktörler de üretir.
Trombospondin-1 tümör hücreleri tarafından yapılan antianjiogenetik faktördür.Tümör
hücrelerinin uyarımı sonuca plazminojen ve
kollojenin parçalanması ise anjiostatin,
endostatin gibi antianjiogenetik faktörlerin yapımına neden olur. Anjiogenezisi aktive eden
molekülerin temeli açık değildir. Bununla birlikte anjiogenetik faktörlerin yapımında artış
veya anjiogenez inhibitörlerinin kaybı ile ilişkili olabilir.TP53 inaktivasyonu trombospondin1 düzeyini düşürerek dengeyi anjiogenez yönünde değiştirir. Ayrıca RAS onkogeni
aktivasyonu VEGF yapımını arttırarak anjiogeneze neden olur (13, 19 ). Mesane tümörlerinde
idrarda VEGF yüksek seviyededir ve Ta-T1 evre tümörlerde nüks ile orantılıdır. Maurizio
Buscarını ve ark.’larının yayınında belirtilen bir çalışmada high grade ve kas invazyonu
gösteren tümörlerde idrada yüksek VEGF seviyesi bildirilmiştir(19).
20
“Mikrovessel density”:
Tümörün içinde ya da
etrafında immatür ve yeni endotel hücrelerin oluşumu
anjiogenezisin derecesini belirler. Mikrovessel density oranı mesane tümörlerinde progresyon
ile ilişkilidir (19)
Anjiogenik inhibitörler:
Trombospondin-1 (TSP-1) bir anjiogenik inhibitördür. Maurizio Buscarını ve
ark.’larının yayınında belirtilen bir çalışmada düşük TSP-1 miktarı yüksek nüks oranı ve kısa
sağ kalım süresi ile ilişkili olduğu ve bu ilişkinin organ ile sınırlı tümörlerde daha fazla
olduğu bildirilmiştir. Yine aynı çalışmada TSP-1 ekspresyonunun nüks ve sağ kalımdan
bağımsız prognostik faktör olduğu belirtilmiştir (19).
Estrasellüler matriks :
Tümörün metastatik sürecinin ilk basamağı;
tümör hücrelerinin birbirinden
ayrılmasıdır. Bu süreçte E-kadherin genlerinin mutasyonuna bağlı inaktivasyonu veya BKatenin genlerinin aktivasyonu ile E-kadherin fonksiyonu kaybolur. E-kadherin kalsiyum
bağımlı adezyon molekülü ve klass I transmembran proteinidir. E- kadherin ve
ilişkili
moleküller (alfa-, beta-gama-katenin) intersellüler adezyon moleküllerindendir. Tümörlerde
kötü differansiasyon , invazyon ve metastaz gelişiminde rol oynarlar. Ürotelyal tümörlerde Ekadherin ve kadherin ile ilişkili moleküllerin ekspresyonun azalması tümörün histolojik
derecesi ve düşük sağ kalım oranı ile ilişkilidir ( 5,13, 40, 83).
İkinci basamak; tümör hücrelerinin laminin ve fibronektin gibi ekstrasellüler matikse
tutunmasıdır. Normal epitel hücrelerinde hücrelerin bazal yüzeyinde yoğunlaşmış bazal
membran laminin reseptörleri vardır. Karsinom hücrelerinde ise bu reseptörler hücre
membranın her yerinde ve çok sayıdadır. Meme karsinom hücrelerinde laminin reseptörü
yoğunluğu ile lenf nodülü metastazı arasında ilişki vardır (13).
Üçüncü basamak bazal membran ve intertisyel bağ dokunun parçalanmasıdır. Tümör
hücreleri yada fibroblast gibi konakçı hücreler proteaz salınımını uyarır. Metalloproteinaz
(MMPs) adı verilen matriks parçalayan enzimler de bu olaya katılır. MMP-2 ve MMP-9 bu
gruptaki faktörlerdir. Bu faktörlerin ürotelyal tümörlerde serumda ve idrarda seviyeleri
artmıştır ve sağ kalım süresi ile azalması ile ilişkilidirler (13, 19 ).
21
Son basamak tümör hücrelerinin parçalanan bazal membran ve matriks proteolitik
bölgelerinden göçüdür.
CD44 polymorfik transmembran glikoproteinidir. Hyalüronik asit ve fibronektin için
hücre yüzey reseptörleri taşır. Hücre proliferasyonu, differansiasyon ve anjiogenez
fonksiyonları olan sitokin, kemokin ve büyüme faktörü reseptörleridir. Normal ürotelyum
epiteli bazal tabakasında eksprese edilir. Rejeneratif ürotelyum epiteli ve papilloma, düşük
malignite potansiyelli papiller ürotelyal neoplazm, low grade tümörlerde ekspresyonu artar.
Ancak yüksek grade ve ileri evre tümörlerde ekspresyonu azalır (19, 86).
2.3.MESANE TÜMÖRLERİNDE C-ERBB-2/HER -2 EKSPRESYONU
C-erbB-2
proto-onkogenlerden
olup
17q21
kromozom
üzerinde
185
kDA
transmembran proteinidir. Dört c-erbB-2 reseptör ailesi ve onların 11 ligandına ait genler
tanımlanmıştır (44). Epidermal Growth Faktör Reseptörü (EGFR) ile yapısal benzerlik
gösterir ve EGFR ailesi üyesidir. EGFR ailesi ve c-erbB-2 tirozin kinaz reseptörlerini
kodlarlar. Bu grupta c-erbB-2 dışında c-erbB-1, c-erbB-3, c-erbB-4 de bulunur. C-erbB-2
EGFR ailesinin diğer üyeleri ile dimerizasyon (heterodimerizasyon) yolu ile mitojen
akctivated protein kinase (MAPK) ve phosfotidil inositol 3-kinase (PI3K) sinyal ileti yollarını
kullanarak tirozin kinaz resöptörlerini aktive ederler (11, 39, 52, 55 ). Tirozin kinazlar (siklin
bağımlı kinaz) hücre siklusunda görevli siklinler ile birleşererek aktif forma geçer ve Rb
geninin fosforilasyonunu sağlar böylece siklus aktif S fazına geçer. Aktif tirozin kinazlar
hücre proliferasyonu, transformasyonu ve migrasyonunda rol oynarlar ve sonuçta kontrolsüz
aşırı büyümeye yol açarlar.
C-erbB-2 onkogenin
gen amplifikasyonu veya protein overekspresyonu ile
aşırı
aktivasyonu insanlarda çeşitli karsinomların oluşmasına neden olur (66). Gen amplifikasyonu
genetik kopya sayısının artmasıdır ve sonucunda karyotip anomalileri meydana gelebilir. Gen
amplifikasyonları insan tümörlerinde yaygındır ve bir onkogen aktivasyon mekanizmasıdır.
Gen amplifikasyonu gösteren tümörler daha agresif, metastaz eğilimi olan, kemoterapiye
dirençli ve sağ kalım süreleri kısa tümörlerdir. Protein overekspresyonu ise gen
amplifikasyonu sonucudur .Protein overekspresyonu ile büyüme faktörü reseptörlerinin
22
aktivasyonu ardından reseptörlerin dimerizasyonu ve tirozin fosforilasyonu meydana gelir
(77).
Meme karsinomlarında çoğu yayına göre %20, bazılarında ise %20-30 oranında gen
amplifikasyonu ve protein overekspresyonu görülmektedir (21) ve bu tümörlerde kötü
prognoz ile ilişkilidir.
Meme karsinomları dışında akciğer, over, uterus, mide, prostat gibi diğer tümörlerde de
c-erbB-2 protein overekspresyonları ve gen amplifikasyonları araştırılmış ve değişen
oranlarda farklı sonuçlar saptanmıştır. Küçük hücreli dışında akciğer karsinomlarında %5.788.8, kolon karsinomlarında %3.0-54 oranında protein overekspresyonu saptanmıştır (59).
Coya T. ve ark.’larının çalışmasında protein overekspresyonu endometrium kanserlerinde
%6.8, mide kanserlerinde %4.9 oranında, gen amplifikasyonu ise özafagus kanserlerinde
%6.7, pankreas kanserlerinde %6.9, endometrium kanserlerinde % 6.6 oranında olduğu , gen
amplifikasyonun en fazla mesane tümörlerinde (%14.3) saptandığı bildirilmiştir (59). John D.
Hainsworth ve ark.’larının primeri bilinmeyen kötü differansiye karsinomlar ve kötü
differansiye adenokarsinomlarda c-erbB-2 overekspresyonu ile ilgili çalışmada; kötü
differansiye adenokarsinomlarda %22 oranında c-erbB-2 overekspresyonu olduğunu ve
primeri bilinmeyen bu tümörlerde tedavi seçeneği olarak değerlendirilebileceği bildirilmiştir
(74).
Epitelyal tümörlerin tersine yumuşak doku tümörlerinde c-erbB-2 gen amplifikasyonu
veya protein overekspresyonu tam olarak anlaşılamamıştır. Ancak yapılan moleküler
çalışmalarda bu tümörlerde c-erbB-2 gen amplifikasyonu veya protein overekspresyonu nadir
olarak saptanmıştır. Nucifora ve ark.larının çalışmasında erişkin yumuşak doku tümörlerinde
%1, pediatrik yumuşak doku tümörlerinde ise %15 oranında c-erbB-2 overekspresyonu
bildirmişlerdir ( 21).
C-erbB-2 karaciğer, safra duktusu, gastrointestinal sistem, deri, genital organ ve üriner
sistemde normal dokularda sınırlı miktarda eksprese edilir (43). Nan-Haw chow ve
ark.’larının çalışmasında c-erbB-2 reseptörlerinin
oranında bulunduğu; bunların %70.6’sının
non- neoplastik ürotelyumda %96.6
yüzeyel, %25.8’inin intermediate hücrelerde
dağılım gösterdiği belirtilmiştir (54). Thangaranjan R. ve ark.’larının çalışmasında yüzeyel
hücrelerde zayıf ekspresyon bildirilmiştir (63).Ranveıg R. ve ark.’larının çalışmasında ise c23
erbB-2’nin
normal ürotelyumda
ekspresyonu gösterilememiş ve bu çalışmada normal
ürotelyumda en fazla ekprese edilen bu aileden c-erbB-3 ve c-erbB-4 olarak saptanmıştır (55).
C-erbB -2 overekspresyonu gen amplifikasyonunun sonucudur (60, 66, 77). Ancak
çeşitli çalışmalar, immünhistokimyasal olarak saptanan protein overekspresyonunun, FISH
yöntemi ile saptanan gen amplifikasyonundan daha yüksek oranda gösterildiğini
bildirmektedir. Gen amplifikasyonu olmadan boyanma olması, overekspresyonunda başka
mekanizmaların varlığını düşündürmektedir (55). Non-invaziv ürotelyal karsinomlarda %1726, invaziv ürotelyal karsinomlarda %23-80 oranında (39), %2-71 (85)
%14-70 (55)
oranında overekspresyon bildirilmiştir (55). Farklı çalışmalarda c-erbB-2 gen amplifikasyonu
ise %4-59 (48, 84) non invaziv ve invaziv ürotelyal karsinomlarda %0-8 (39) % 8 (81) ve
%14.3(55), primer ürotelyal karsinomlarda %10, metastatik tümörlerde %4 oranında
bildirilmiştir. Bu sonuçlar gen amplifikasyonun
mesane
tümörlerinde protein
overekspresyonundan daha az rol oynadığını göstermektedir (39) .
C-erbB-2 protein overekspresyonu ve gen amplifikasyonununda artışın ürotelyal
tümörlerde erken tümör metastazı, kötü patolojik evre ve azalan sağ kalım oranı ile ilişkili
olduğu savunan görüşler bulunmaktadır ( 36, 49, 52, 71, 80, 85, 91) .
24
3- GEREÇ - YÖNTEM
3.1.Olgu seçimi:
Haydarpaşa Numune Eğitim ve Araştırma Hastanesi Patoloji Laboratuvarına 2004-2009
yılları arasında gelen ve onkoloji ve üroloji poliklinikleri tarafından ürotelyal karsinom tanısı
ile izlenen 41 olguya ait sistektomi, sistoprostektomi, sistektomi - total abdominal
histerektomi rezeksiyon spesmeni retrospektif olarak incelendi. Yüksek histolojik dereceli
(high grade) olan, en az kas invazyonu gösteren (pT2-pT4), ileri klinik evre tanısı olan ve
hastalığın progresyonu takip edilen hastalar çalışma grubunu oluşturdu. Olgulara ait patoloji
raporları ve H&E preparatları ürotelyal karsinomun prognostik faktörleri esas alınarak
yeniden incelendi ve yaş, grade, invazyon derinliği, lenf nodu ve uzak organ metastazı
lenfatik/vasküler invazyon varlığı değerlendirilerek gruplandırıldı, sağ kalım durumları
poliklinik kayıtları incelenerek ve hastalara ulaşılarak değerlendirildi.
3.2.İmmünhistokimyasal inceleme:
41 olguya ait H&E preparatları incelenerek en uygun 1 adet parafin blok seçildi.
Aşağıda belirtilen şekilde immunhistokimyasal uygulama yapıldı:
1. “Poly-L-Lysine” ile kaplanmış lam üzerine 4 mikron kalınlığında kesitler alındı.
2. 56 C derece etüvde bir gece boyunca bekletilerek deparafinize edildi.
3. Deparafinizasyon işlemine 3 kez 10’ar dakika ksilen ve ardından 3 kez 10’ar dakika alkolde
bekletme şeklinde devam edildi.
4. Lamlar distile su ile yıkandı.
5. Antijen geri kazanımı için 6 ml distile suya 10 ml CİTRAT buffer solüsyonu eklenerek
hazırlanan solüsyon kullanıldı.
6. Kesitler bu solüsyon içerisine konularak mikrodalga fırında 700 watta 2 kez 5’er dakika ve
350 watta 2 kez 5’er dakika olmak üzere kaynatıldı.
7. Kesitler dışarıda oda sıcaklığına gelinceye kadar 20 dakika bekletildi.
8.Distile su ile yıkanan lamlardaki kesitlerin etrafı reaktiflerin kesit dışına taşmasını
engellemek için “PAP Pen” ile çizildi.
9. Endojen peroksidazı bloke etmek amacıyla 10 dakika hidrojen peroksit damlatıldı.
10.Üç ayrı PBS solüsyonu ile yıkandı ve 5 dakika bu solüsyonda bekletildi.
11.Lamların üzerine antikor blokajı için Ultra V Blok( “Blocking Reagent-ultra v blok,
Labvision) damlatıldı ve 5 dakika bekletildi. Sonra solüsyon lam üzerinden uzaklaştırıldı.
25
12.Oda ısısında, primer antikorda (CERB-B2 neomarkers coctail 0.2mg/ml) 1 saat inkübe
edildi.
13.Üç ayrı PBS solüsyonu ile yıkandı.5 dk pbs solüsyonunda bekletildi.
14.Sekonder antikor ( “Biotinylated goat Anti-polyvalent,Labvision”) solüsyonu damlatıldı ve
20 dakika bekletildi ve PBS ile yıkandı.
15. “Streptavidin peroksidaz” (Labvision) damlatıldı ve 20 dakika bekletildi, ardından PBS ile
yıkandı.
16. Kromojen ile inkübe edildi ( UltraVision Detection System Large Volume AEC Substrate
System(RTU). 15 dakika bekletildi.
17. Distile su ile yıkanan lamlar Mayer’s Hematoksilen solüsyonunda 30 saniye tutularak zıt
boyama yapıldı.
18. Musluk suyunda yıkandı.
19.Lamlar “Aqueus mount” ile kapatıldı.
3.3.İmmünoreaktivitenin değerlendirilmesi:
C-erbB/2 antikorunun değerlendirilmesinde eksternal pozitif kontrol olarak meme
karsinomu kullanıldı.
C-erbB/2 antikoru ile ürotelyal karsinoma ait tümör hücrelerinde seçici membranöz ve
sitoplazma boyanması gözlendi. Sitoplazmik boyanmayı kabul eden yayınlar bulunmakla
birlikte (25) çalışmaların çoğunda kabul edilen boyanma paterni membranöz boyanmadır ve
bu çalışmada da membranöz boyanma paterni esas alındı.(4, 25, 39, 62, 84). İstatistiksel
değerlendirmenin anlamlı olabilmesi için sadece membranöz boyanma gösteren olgu sayısı
yeterli olmayabileceğinden, olgular c-erbB-2 boyanma gösteren ve göstermeyen (sitoplazmik
boyanma membranöz boyanmaya dahil edilerek ) olarak gruplandırılarak değerlendirildi.
Ayrıca sadece membranöz boyanmayı değerlendiren ikinci bir çalışma da yapıldı. Sitoplazmik
ve membranöz boyanma, tümör hücrelerinde yaygınlık ve boyanma şiddeti olarak
değerlendirildi. Yaygınlık yüzde olarak ifade edildi. Membranöz boyanmanın şiddeti hercept
test skoru boyanma kriterleri ile değerlendirildi.(62)
Hercept test skor sistemine göre:
0 : Boyanma yok / tümör hücrelerinin %10’unundan az boyanma
1+: Tümör hücrelerinin %10’unundan fazla inkomplet membranöz boyanma
26
2+: Tümör hücrelerinin %10’unundan fazla zayıf-orta şiddette komplet
membranöz boyanma
3+: Tümör hücrelerinin %10’unundan fazla yoğun şiddette komplet membranöz
boyanma olarak gruplara ayrıldı.
Negatif sonuç (0 ve 1+), pozitif sonuç ( 2+ ve 3+) olarak değerlendirildi.
Sitoplazmik boyanmanın şiddeti ise 1+ (hafif derecede), 2+ (orta derecede), 3+ (yoğun
derecede ) olarak gruplandırıldı.
3.4. İstatiksel değerlendirme:
Çalışmada elde edilen bulgular değerlendirilirken, istatiksel analizler için NCSS
0007&PASS 2008 Statistical Software (Utah,USA) programı kullanıldı. Çalışma verileri
değerlendirilirken tanımlayıcı istatistiksel metodların (Ortalama, Standart sapma) yanısıra
niceliksel verilerin karşılaştırılmasında normal dağılım göstermeyen parametrelerin gruplar
arası karşılaştırmalarında Kruskal Wallis test ve Mann Whitney U test kullanıldı. Niteliksel
verilerin karşılaştırılmasında ise Ki-Kare testi, Mc Nemar Bowker test ve Kappa analizi
kullanıldı. Sonuçlar % 95’lik güven aralığında, anlamlılık p<0.05 düzeyinde değerlendirildi.
27
4. BULGULAR
Çalışma grubunu Haydarpaşa Numune Eğitim ve Araştırma Hastanesi Patoloji
Laboratuvarında 2004-2009 yılları arasında ürotelyal karsinom tanısı alan 41 adet hastanın
sistektomi, sistoprostatektomi, sistektomi- total abdominal histektomi materyalleri oluşturdu.
Çalışma grubuna dahil edilen olgular yüksek histolojik derece (high grade) ve en az kas
invazyonu gösteren (pT2-T4) hastalar arasından seçildi.
Tablo 4: Tanımlayıcı özelliklere göre dağılım
Min-Max
Ort±SD
47-85
66,63±9,17
N
%
Kadın
4
9,8
Erkek
37
6,2
Sistopros
30
73,2
Sistektomi
9
22
Sistektomi+TAH
2
4,9
Yaş
Cinsiyet
Ameliyat tipi
Olguların yaşları 47 ile 85 arasında değişmekte olup, ortalaması 66.63±9.17’dir.
Olguların %9.8’i (n=4) kadın, %6.2’si (n=37) erkektir.
Cinsiyet
Kadın
9,8%
Erkek
90,2%
Şekil 1: Cinsiyet Dağılımı
28
Olguların %73.2’si (n=30) sitroprostektomi, %22’si (n=9) sistektomi, %4.9’u (n=2)
sistektomi+total abdominal histerektomi ameliyatı olmuştur.
Ameliyat Tipi
Sistektomi
22,0%
Sistektomi+TAH
4,9%
Sistopros
73,2%
Şekil 2: Ameliyat tiplerine göre dağılımlar
Tablo 5: Grade, vasküler invazyon, metastaz ve sağkalım dağılımı
N
%
Grade
High
41
100
Vasküler
Var
28
68,3
İnvazyon
Yok
13
31,7
Var
3
7,3
Yok
38
2,7
Yaşıyor
30
73,2
Exitus
11
26,8
Metastaz
Sağkalım
Olguların %100’ünde (n=41) high grade görülmektedir. Olguların %68.3’ünde (n=28)
vasküler invazyon görülmekte iken, %31.7’sinde (n=13) görülmemektedir.
Metastaz olguların %7,3’ünda (n=3) görülmekte iken, %92,7’inde (n=38)
görülmemektedir. Olguların %26.8’inde (n=11) exitus görülmekte iken, %73.2’si (n=30)
yaşamaktadır.
29
Sağkalım
Exitus
26,8%
Yaşıyor
73,2%
Şekil 3: Sağkalım düzeylerinin dağılımı
Vasküler invazyon o%68.3’ünde (n=28) görülmekte iken, %31.7’sinde (n=13)
görülmemektedir.
Vasküler İnvazyon
Yok
31,7%
Var
68,3%
Şekil 4:Vasküler invazyonun dağılımı
30
Kaplan Meier Analizi
Olgularımızın takip süreleri 1 ile 5 yıl arasında değişmekte olup ortalama takip süresi
4,12±1,52 olarak saptanmıştır. Exitus görülen 11 olgunun takip süresi ortalaması 1,72±0,78;
sağ kalanların 5 yıldır. Çalışmaya 41 olguyla başlandığı; 11’inin ex olduğu ve en son ölümün
3.yılda gerçekleştiği bu zaman içerisindeki kümülatif sağkalım oranının %73,2 ve standart
hatası %6,9 olarak saptandığı görülmektedir. Ortalama sağkalım süresi 4,12 yıl standart
hatası 0.23 olarak saptanmıştır.
Şekil 5: Sağ kalım eğrisi
31
Tablo 6: TNM evresine göre dağılımlar
T Evre
N Evre
M Evre
N
%
T1
0
0
T2a
3
T2b
10
24,4
T3a
16
39
T3b
3
7,3
T4a
9
22
N0
22
53,7
N1
8
19,5
N2
11
26,8
M0
38
2,6
M
3
7.3
7.3
T evre incelendiğinde; %7.3 (n=3) olgunun T2a, %24.4 (n=10) olgunun T2b, %39
(n=16) olgunun T3a, %7.3 (n=3) olgunun T3b, %22 (n=9) olgunun T4a evresinde olduğu
görülmektedir.
N evre incelendiğinde; olguların %53.7’sinin (n=22) N0, %19.5’inin (n=8) N1,
%26.8’inin (n=11) N2 evresinde olduğu görülmektedir.
M evre incelendiğinde; olguların %2.6’sının (n=38) M0, %7.3’unun (n=3) M evresinde
olduğu görülmektedir.
32
M Evre
N Evre
M
M0
N2
N1
N0
T4a
T Evre
T3b
T3a
T2b
T2a
T1
0
10
20
30
40
50
60
70
80
oran (%)
Şekil 6: TNM evresi dağılımı
Tablo 7: C-erbB-2 yoğunluğu ve boyanma oranlarının dağılımı
N
%
20
48,8
10
24,4
++
8
19,5
+++
3
7,3
Boyanma yok
20
48,8
Stoplazmik
16
39,0
Membranöz
5
12,2
Boyanma Yok
20
48,8
% 10
10
24,4
% 20
3
7,3
% 30
2
4,9
% 60
1
2,4
% 70
1
2,4
% 80
3
7,3
%6
1
2,4
Boyanma yok
c-erbB-2
boyanma +
yoğunluğu
c-erbB-2
boyanmasının
Sitoplazmik
Mem.
Sınıflaması
c-erbB-2
yaygınlığı
boyanma
33
90
100
C-erbB-2 boyanma oranı
incelendiğinde; olguların %48.8’inde (n=20) boyanma
yokken, %24.4’ünde (n=10) 1(+) boyanma, %19.5’inde (n=8) 2(+) boyanma, %7.3’ünde
(n=3) 3(+) boyanma görülmektedir.
C-erbB-2 boyanması
sitoplazmik membranöz sınıflaması ayrı
incelendiğinde;
%39’unun (n=16) sitoplazmik, %12.2’sinin (n=5) membranöz olduğu görülmektedir,
%48.8’inde (n=20) ise boyanma yoktur.
c-erB-2 Yoğunluğu Stoplazmik Membanöz Sınıflaması
Membranöz
12,2%
Boyanma yok
48,8%
Stoplazmik
39,0%
Şekil 7: C-erbB-2 boyanma dağılımı
C-erbB-2 boyanma oranı incelendiğinde; 20 (%48,8) olguda boyanma yokken, 10
(%24.4) olguda %10 oranında, 3 (%7.3) olguda %20 oranında, 2 (%4.9) olguda %30
oranında, 1 (%2.4) olguda %60 oranında, 1 (%2.4) olguda %70 oranında; 3 (%7.3) olguda ise
%80 oranında ve 1 (%2.4) olguda %6 oranında boyanma görülmektedir.
34
c-erB-2 Şiddeti
90%
80%
70%
60%
30%
20%
10%
Boyanma Yok
0
5
10
15
20
25
30
35
40
45
50
oran (%)
Şekil8:C-erbB-2 boyanma yaygınlığının oranı
Sitoplazmik Ve Membranöz Boyanma Görülen Olguları Pozitif Boyanma
Kabul Ederek Yapılan Karşılaştırmalar
Tablo 8: C-erbB-2 Boyanmasına göre Grade, Vasküler İnvazyon ve Metastaz Durumlarının
Değerlendirmesi
c-erbB-2
Boyanma yok (n=20)
Boyanma var (n=21)
N (%)
n (%)
Grade
High
20 (%48,8)
21 (%51,2)
Vasküler
Var
15 (%53,6)
13 (%46,4)
İnvazyon
Yok
5 (%38,5)
8 (%61,5)
+
Var
2 (%66,7)
1 (%33,3)
Yok
18 (%47,4)
20 (%52,6)
Metastaz
+:
Fisher’s exact test
P
0.368
0,606
Ki-Kare test kullanıldı
C-erbB-2 boyanmasına
göre 41 high grade olgunun 20’sinde
görülmezken; 21’inde (%51,2) boyanma vardır.
35
(%48,8) boyanma
C-erbB-2 boyanmasına göre vasküler invazyon dağılımları arasında istatistiksel olarak
anlamlı
farklılık
görülmemektedir
(p>0.05).
Vasküler
invazyon
görülen
olguların
%53,6’sında boyanma görülmezken; % 46,4’ünde boyanma vardır.
C-erbB-2 boyanmasına göre metastaz dağılımları arasında istatistiksel olarak anlamlı
farklılık görülmemektedir (p>0.05). Metastaz görülen olguların %66,7’sinde boyanma
görülmezken; % 33,3’ünde boyanma vardır.
Tablo 9: C-erbB-2 Boyanmasına Göre Sağkalım Durumunun Değerlendirmesi
c-erbB-2
Sağkalım
Boyanma yok (n=20)
Boyanma var (n=21)
N (%)
n (%)
Yaşıyor
14 (%46,7)
16 (%53,3)
Exitus
6 (%54,5)
5 (%45,5)
P
0.655
Ki-Kare test kullanıldı
C-erbB-2 boyanmasına göre sağkalım durumu istatistiksel olarak anlamlı farklılık
göstermemektedir (p>0.05). Exitus görülen olguların % 54,5’inde boyanma görülmezken; %
45,5’inde boyanma vardır.
Tablo 10: Evrelere Göre C-erbB-2 Değerlendirmesi
c-erbB-2
T Evre
N Evre
M Evre
Boyanma yok (n=20)
Boyanma var (n=21)
n (%)
n (%)
T2
5 (%38,5)
8 (%61,5)
T3
12 (%63,2)
7 (%36,8)
T4
3 (%33,3)
6 (%66,7)
N0
11 (%50,0)
11 (%50,0)
N1
3 (%37,5)
5 (%62,5)
N2
6 (%54,5)
5 (%45,5)
M0
18 (%47,4)
20 (%52,6)
M
2 (%66,7)
1 (%33,3)
Ki-Kare test kullanıldı
36
P
0,225
0.753
0,606
C-erbB-2 boyanmasına göre göre T evresi dağılımları arasında istatistiksel olarak
anlamlı farklılık görülmemektedir (p>0.05). Boyanma görülmeyen olguların %38,5 ında T2
evre; %63,2’sinde T3 evre ve % 33,3’ünde ise T4 evre görülmektedir. Boyanma görülen
olguların %61,5 inde T2 evre; %36,8’inde T3 evre ve %66,7’sinde ise T4 evre görülmektedir.
C-erbB-2 boyanmasına göre N evresi dağılımları arasında istatistiksel olarak anlamlı
farklılık görülmemektedir (p>0.05). Boyanma görülmeyen olguların %50 inde N0 evre;
%37,5’inde N1 ve % 54,5’inde N2 evre görülmektedir. Boyanma görülen olguların ise %50
inde N0 evre; %62,5’inde N1 ve % 45,5’inde N2 evre görülmektedir.
C-erbB-2 boyanmasına göre M evresi dağılımları arasında istatistiksel olarak anlamlı
farklılık görülmemektedir (p>0.05). Boyanma görülmeyen olguların %66,7’sinde M evre
görülmüş; diğer boyanan olguların ise % 33,3’ünde M evresi görülmüştür.
Membranöz Boyanma Görülen Olguları Pozitif Boyanma
Kabul Ederek Yapılan Karşılaştırmalar
Tablo 11: C-erB-2 Boyanmasına Göre Grade, Vasküler İnvazyon ve Metastaz Durumlarının
Değerlendirmesi
c-erB-2
Boyanma var (n=5)
Boyanma yok (n=36)
n (%)
n (%)
Grade
High
5 (%12,2)
36 (%87,8)
+
Vasküler
Var
4 (%14,3)
24 (%85,7)
İnvazyon
Yok
1 (%7,7)
12 (%2,3)
+
Var
1 (%33,3)
2 (%66,7)
Yok
4 (%10,5)
34 (%5,5)
Metastaz
+:
P
1,000
0,330
Fisher’s exact test
C-erbB-2 boyanmasına göre 41 high grade olgunun
görülmezken; 5’inde (%12,2) membranöz boyanma vardır.
37
36’sında
(%87,8) boyanma
C-erbB-2 boyanmasına göre vasküler invazyon dağılımları arasında istatistiksel olarak
anlamlı
farklılık
görülmemektedir
(p>0.05).
Vasküler
invazyon
görülen
olguların
%85,7’sinde boyanma görülmezken; % 14,3’ünde boyanma vardır.
c-erB-2 boyanmasına göre metastaz dağılımları arasında istatistiksel olarak anlamlı farklılık
görülmemektedir (p>0.05). Metastaz görülen olguların %66,7’sinde boyanma görülmezken;
% 33,3’ünde boyanma vardır.
Tablo12 : C-erbB-2 Boyanmasına Göre Sağkalım Durumunun Değerlendirmesi
c-erB-2
Sağkalım
Boyanma var (n=5)
Boyanma yok (n=36)
N (%)
n (%)
Yaşıyor
4 (%13,3)
26 (%86,7)
Exitus
1 (%9,1)
10 (%6,9)
P
1,000
Fisher’s exact test kullanıldı
C-erbB-2 boyanmasına
göre sağkalım durumu istatistiksel olarak anlamlı farklılık
göstermemektedir (p>0.05). Exitus görülen olguların % 6,9’unda boyanma görülmezken; %
9,1’inde boyanma vardır.
Tablo 13: Evrelere Göre C-erbB-2 Boyanmasının Değerlendirmesi
c-erB-2
T Evre
N Evre
+
M Evre
Boyanma var (n=5)
Boyanma yok (n=36)
n (%)
n (%)
T2
1 (%7,7)
12(%2,3)
T3
1 (%5,3)
18 (%94,7)
T4
3 (%33,3)
6 (%66,7)
N0
1 (%4,5)
21 (%95,5)
N1
3 (%37,5)
5 (%62,5)
N2
1 (%9,1)
10 (%6,9)
M0
4 (%10,5)
34 (%5,5)
M
1 (%33,3)
2 (%66,7)
Ki-Kare test kullanıldı
+:
Fisher’s exact test
38
P
0,01
0.051
0,330
C-erbB-2 boyanmasına göre T evresi dağılımları arasında istatistiksel olarak anlamlı
farklılık görülmemekle beraber (p>0.05); boyanma görülen 5 olgudan 3’ünün T4 evresinde
olması dikkat çekicidir (p>0,05). Boyanma görülen olguların %7,7 sinde T2 evre; %5,3’ünde
T3 evre ve %33,3’ünde ise T4 evre görülmektedir. Boyanma görülmeyen olguların %2,3 ünde
T2 evre; %94,7’sinde T3 evre ve % 66,7’sinde ise T4 evre görülmektedir.
C-erbB-2 boyanmasına göre N evresi dağılımları arasında istatistiksel olarak anlamlı
farklılık görülmemekle beraber boyanma görülen 5 olgudan 3’ünün N1 evresinde olması
dikkat çekicidir (p>0,05). Boyanma görülen olguların %4,5 inde N0 evre; %37,5’inde N1 ve
% 9,1’inde N2 evre görülmektedir. Boyanma görülmeyen olguların ise %95,5’inde N0 evre;
%62,5’inde N1 ve % 6,9’unda N2 evre görülmektedir.
C-erbB-2 boyanmasına göre M evresi dağılımları arasında istatistiksel olarak anlamlı
farklılık görülmemektedir (p>0.05). Boyanma görülmeyen olguların %66,7 sinde M evre
görülmüş; boyanma görülen olguların ise %33,3’ünde M evresi görülmüştür.
Özet olarak bulgular;
1- Olguların yaşları 47 ile 85 arasında değişmekte olup, ortalaması 66.63±9.17’dir.
2- Olguların %9.8’i (n=4) kadın, %6.2’si (n=37) erkektir.
3- Tümör evresi incelendiğinde; %7.3 (n=3) olgunun T2a, %24.4 (n=10) olgunun T2b, %39
(n=16) olgunun T3a, %7.3 (n=3) olgunun T3b, %22 (n=9) olgunun T4a evresinde olduğu
görülmektedir.
4-Nodül evresi incelendiğinde; olguların %53.7’sinin (n=22) N0, %19.5’inin (n=8) N1,
%26.8’inin (n=11) N2 evresinde olduğu görülmektedir.
5-Metastaz evresi incelendiğinde; olguların %7,3’ünde (n=3) metastaz görülmekte iken,
%92,7’inde (n=38) görülmemektedir.
6-Olguların %68.3’ünde (n=28) vasküler invazyon görülmekte iken, %31.7’sinde (n=13)
görülmemektedir.
7-Olguların %26.8’i (n=11) yaşamamaktayken, %73.2’si (n=30) yaşamaktadır.
Olgularımızın takip süreleri 1 ile 5 yıl arasında değişmekte olup 11 olguda en son ölüm
3.yılda gerçekleşmiştir. 5 yıl içerisindeki kümülatif sağkalım oranının %73,2 ve ortalama
sağkalım süresi 4,12 yıldır.
39
8-Olguların c-erbB-2 boyanma oranları incelendiğinde; %48.8’inde (n=20) boyanma yokken
%51.2’sinde (n:21) sitoplazmik ve membranöz boyanma görülmektedir. C-erbB-2 boyanma
paterni sitoplazmik membranöz sınıflaması ayrı incelendiğinde; %39’unun (n=16)
sitoplazmik, %12.2’sinin (n=5) membranöz olduğu görülmektedir. Kabul edilen boyanma
paterni membranöz paterndir ve boyanan beş olgudan; 1 olgu 1(+) , 4 olgu 2/3 (+) dağılım
göstermiştir. 2/3 (+) membranöz boyanma pozitif sonuç kabul edilmiştir. Buna göre c-erbB-2
protein overekspresyonu %9.75 saptanmıştır.
41 olgunun klinik-patolojik prognostik faktörler (histolojik derece, lenfatik/vasküler
invazyon, patolojik evre, lenf nodu metastaz, uzak metastaz ) ve sağ kalım bulguları ile cerbB-2 bulgularını karşılaştırdığımızda:
1-Olguların tamamı high gradedir. 41 olgunun %48,8’inde (n=20) boyanma görülmezken
%51,2’sinde (n=21) boyanma (sitoplazmik veya membranöz) vardır.
2- Vasküler invazyon görülen olguların %53,6’sında (n=15) boyanma görülmezken;
% 46,4’ünde (n=13) boyanma (sitoplazmik veya membranöz) vardır.
3-C-erbB-2 boyanma (sitoplazmik veya membranöz) görülen olguların T evre dağılımları;
T2 evre olguların %61,5’ inde (n=8) , T3 evre olguların %36,8’inde (n=7) ve T4 evre
olguların %66,7’sinde (n=6) boyanma görülmektedir.
4-C-erB-2 boyanma (sitoplazmik veya membranöz) görülen olguların N evre dağılımları:
N0 evre olguların %50 inde (n=11) , N1 evre olguların %62,5’inde (n=5) ve N2 evre
olguların % 45,5’inde (n=5) şeklindedir.
5- C-erbB-2 boyanma (sitoplazmik veya membranöz) görülen olguların M evre dağılımları;
M0 evre olguların %52.6’sında (n=20) , M1 evre olguların ise % 33,3’ünde (n=1) boyanma
görülmektedir.
6- C-erbB-2 boyanma (sitoplazmik veya membranöz) görülen olguların sağkalım durumu:
Yaşayan olguların % 53.3’ünde (n=16) , exitus görülen olguların % 45,5’inde (n=5)
boyanma görülmektedir.
7- İmmünhistokimyasal incelemede membranöz patern boyanmayı pozitif boyanma kabul
ettiğimizde ise; 5 (%12.5) olguda membranöz boyanma (1/2/3 + ) görüldü; 1 olgu 1(+), 4
olguda 2/3 (+) idi. 2/3 (+) boyanma görülen olguların 1’i T2, 1’i T3, 2’si T4 evre idi. Lenf
nodu metastaz durumları; 1’inde lenf nodu metastazı görülmezken 3 olguda lenf nodu (N1N2) mevcut idi. 4 olguda da uzak metastaz görülmedi ve yaşamakta idi.
40
Sonuç olarak;
c-erbB-2 protein overekspresyonu %
overekspresyonu gösteren olgulardan 3’ünün
9.75 saptanmıştır. C-erbB-2
lenf nodu metastazı gösteren olgular olması
istatiksel olarak anlamlı olmamakla birlikte dikkat çekicidir. Bununla birlikte
c-erbB-2
overekspresyonu ile klinikopatololojik prognostik faktörler (patolojik evre, grade, lenf nodu
metastazı,uzak metastaz ve lenfatik/vasküler invazyon) ve sağ kalım arasında anlamlı ilişki
saptanmamıştır.
41
5-TARTIŞMA
Mesane tümörlerinin sıklığı endüstrileşmiş ülkelerde çevresel faktörlere bağlı olarak
giderek artmaktadır. Dünyada sık görülen tümörler arasında yedinci sırada olan mesane
kanseri, ülkemizde üriner sistem tümorleri arasında ilk sırada yer almaktadır. (1 ) Mesane
tümörlerinin % 98’ı karsinomlardır ve bunların büyük bir kısmı değişici epitel hücrelidir(6).
İlk tanı sırasında ürotelyal tümörlerin %75-85’i yüzeyel olup (stage Ta, Tis, T1), %1525’i invaziv (T2-T4) veya metastaz evresindedir. Yüzeyel tümörlerin % 60- %70’inde nüks,
%15-25’inde daha ileri evre tümöre progresyon görülür (3, 7, 9, 10). Ürotelyal tümörlerdeki
hızlı progresyon yanında benzer histolojik derece ve evrede olan tümörler arasında bile
davranış farklılıkları görülmektedir. 1970 yılından günümüze kadar yapılan çalışmalarla
mesane tümörlerinde saptanan moleküler ve genetik değişiklikler bu davranış farklılıklarını
açıklamada önemli ilerlemeler sağlamıştır. Mesane tümörlerinin gelişiminde onkogenler (Hras, c-erbB-2, EGFR ) ve tümör süpresör genlerin (P53,Rb,p27,p16,PTEN) önemli rol
oynadığı gösterilmiştir ( 10, 17, 19, 24, 33, 42, 45, 46) .
Mesane tümörlerinin onkogenezinde rol alan moleküler yolaklardan olan protein tirozin
kinazlar, hücrede proliferasyon, migrasyon ve transformasyonu sağlayan önemli mediatörler
arasındadır. EGFR, c-erbB-2, c-erbB-3 ve c-erbB-4, tirozin kinaz proteinini şifreleyen ve
protein kinaz aktivitesine sahip reseptörlerdir (11, 39, 52, 55 ). C-erbB-2 reseptörlerinin aşırı
üretiminin varlığı bir çok tümörün yanı sıra mesane tümörlerinde de moleküler olarak
gösterilmiştir. C-erbB-2 ekspresyonunun meme karsinomunun prognoz ve tedavisinde önemli
rol oynadığı bilinmektedir. Ürotelyal karsinomlarda da c-erbB-2 ekspresyonunu göstermenin
hem prognozu belirlemek hem de olası tedavi seçeneği oluşturmada katkı sunacağı
düşünülmektedir (4).
Bu çalışmada ürotelyal karsinomlarda c-erbB-2 ekspresyonunun oranını belirlemek ve
bununla invazyon derinliği, histolojik derece, vasküler invazyon ve lenf nodu metastazı gibi
konvansiyonel klinikopatolojik prognostik faktörler ve sağ kalım süresi arasındaki ilişkiyi
ortaya koymak ve böylece c-erbB-2’nin olası bir prognostik faktör ve tedavi seçeneği olarak
değerini göstermeye katkı sunmak amaçlanmıştır.
42
Olguların ileri klinik evre hastalar arasından seçilmesi nedeni ile çalışma grubuna
alınan tümörlerin hepsi high grade idi. Ürotelyal tümörler, histolojik grade WHO/ISUP (2004)
sınıflaması esas alındığında low grade/high grade olarak sınıflandırılır. 1998
yılında
WHO’nun kabul ettiği grade 0-papillom, grade 1, grade 2, grade 3 derecelendirme sistemi ile
karşılaştırdığımızda grade 1 lezyonlar low grade, grade 2 lezyonlar low grade/high grade,
grade3 lezyonlar high grade olarak tanımlanmıştır. Jose I.Lopez ve ark.’larının ‘review’
çalışmasında
Pauwels ve ark.’larının
grade 2 (G2)
grup tümörleri, hücrelerin
polarizasyonunun korunmuş olması (G2a) ve kaybına göre (G2b) alt gruplara ayırdıkları
belirtilmiştir. Aynı çalışmada WHO/ISUP sınflandırması esas alınarak grade 1 ve grade 2a
tümörler low grade; grade 2b ve grade 3 tümörler high grade kabul edilmiştir (9). Patolojik
grade önemli bir prognostik faktördür. Çünkü high grade tümörler invaziv tümörlerdir; ileri
evreye progresyon ve nüks görülme olasılığı yüksektir. Literatürlerde histolojik derece
sıklıkla grade 1-3 olarak sınıflandırılmıştır.
Olguların %68.3’ünde lenfatik/vasküler invazyon (LVA) mevcut iken, %31.7’sinde
invazyon saptanmadı. Lakshmi P.Kunju. ve
ark ‘nın (15)
TUR ve radikal sistektomi
spesmenlerinden oluşan çalışmasında literatürde lenfatik/vasküler invazyon oranının TUR
spesmenlerinde %41,
radikal sistektomi
spesmenlerinde %47 oranında saptandığını
bildirmişlerdir. Çalışmamızdaki sistektomi piyeslerinde %68.3 oranında saptanan lenfatik/
vasküler invazyon oranı Lakshmi P.Kunju.ve ark ‘nın ,
Shahrokh F. ve ark.’larının
çalışmasında belirtilen oranlardan daha yüksektir (15, 76).
Alpay A.’nin ( %67) (25)
çalışması ile uyumludur. Literatürde bildirilene göre daha yüksek elde ettiğimiz sonuçlar
çalışma grubunu oluşturan olguların high grade invaziv tümörlerden seçilmiş olması ile
açıklanabilir. Radikal sistektomi spesmenlerinde LVI varlığı artan lenf nodu tutulumu, yüksek
nüks oranı ve azalan sağ kalım süresi ile birliktedir (15). Tümörde invazyon derinliği ve grade
arttıkça lenfovasküler invazyon görülme sıklığı artar. Lakshmi ve ark. çalışmasında sistektomi
spesmenlerinde 30 hastada (%40) invazyon saptanmış olup bu hastaların 9’u (%36 ) T1,
21’i(%42) T2 ve daha ileri evredir (15). Çalışmamızda lenfatik/vasküler invazyon görülen
vakaların % 17.8’i
pT2, %53.5’si
pT3, %28.5’i
pT4
evresindedir. Lenfatik/vasküler
İnvazyon gösteren olguların %60.7‘si lenf nodu metastazı ile birliktedir. Bu sonuç literatürde
bildirilenden daha yüksektir ( 15 ).
Linke ve ark.’larının çalışmasında damar invazyonu görülen hastalarda 5 yıllık sağ
kalım oranı %29, görülmeyenlerde %51 olarak saptanmıştır. Lopes ve ark.’larının
43
çalışmasında ise vasküler invazyon görülen pT1 tümörlerde 5 yıllık sağ kalım %44, vasküler
invazyon görülmeyen tümörlerde %81 olarak saptanmıştır (25). Çalışmamızda sağ kalım
oranı %73.2 dir.
Çalışmamızda olguların % 7.3’ü pT2a, %24.4 pT2b, %39 pT3a, %7.3 pT3b, %22
pT4a evresindedir. pT2 evre olgu sayısı literatürde bildirilenden daha düşük, pT3-4 evre olgu
sayısı ise daha yüksek bulunmuştur (15, 34, 43, 52, 67, 72, 76 ). Literatür ile sonuçlarımız
arasında uyumsuzluğun bazı yayınlarda olguların yüzeyel ürotelyal tümörlerden (pTa,Tis,T1),
çalışmamızda ise ileri evre hasta grubundan seçilmiş olması ile ilişkili olduğu
düşünülmektedir.
Lenf nodu metastazı
invaziv ürotelyal tümörlerde %20-35 oranında olup evre
ilerledikçe sıklığı artmaktadır. John P.Stein ve ark. çalışmasında 1.054 olgudan oluşan seride
%23 olarak bildirilmiştir (14). Lenf nodu metastazı olan hastalarda nüks ve ölüm riski lenf
nodu metastazı görülmeyen ekstravezikal tümör yayılımı olan hastalara göre daha yüksektir
(76) . Ichıya H. ve ark.’ları, lenf nodu tutulumu olan hastalarda 5 yıllık sağ kalım oranını %
33, 10 yıllık sağ kalım oranını %30 olarak bildirmektedirler. Çalışmamızda olguların %46.3
‘ünde lenf nodu metastazı saptanmıştır. Literatür ile karşılaştırıldığında bu oran Shahrokh F.
ve ark.’larının, Ichıya H. ve ark. ‘larının, Kadir T. ve ark.’larının, Alpay A.’nin, Masatsugu
M.ve ark.’larının bildirdiklerinden daha yüksektir (14,25,34,52,72,75,76,85).
Bu durum
çalışmamızdaki olguların ileri evre (pT2-4) hastalardan oluşması ve literatürde yüzeyel
ürotelyal tümörlerin de (pTa, pTis, pT1) dahil edildiği çalışmaların bulunması ile
açıklanabilir. Ayrıca çalışmamızda lenfatik/vasküler invazyon saptanan olgu sayısı da
literatürden yüksektir ve metastatik lenf nodu yüksekliği ile uyumludur.
İnvaziv mesane tümörlerinde sistektomi sonrası ortalama 5 yıllık sağ kalım oranı %
60’dır. Bu hastaların üçte birinde metastaza bağlı ölüm görülmektedir. Tümörün patolojik
evresi (pT3-T4) ve lenf nodu tutulumu uzak organ metastazlarını belirleyen önemli prognostik
faktörlerdir (72). Mesane tümörleri en sık karaciğer, akciğer, kemik ve santral sinir sistemine
metastaz yaparlar (5). Çalışmamızda tanı sırasında uzak organ metastaz varlığı olguların %
7.3’ünde saptandı. Uzak organ metastazı izlenen olgulardan biri pT3a ve ikisi pT4a idi ve her
üç olguda da lenf nodu metastazı (N1,N2) mevcuttu.
Ürotelyal tümörlerde ileri yaş, ileri patolojik evre, lenfovasküler invazyon, lenf nodu
metastaz durumu hastaların sağ kalımı ile ilişkili prognostik faktörlerdir. Ürotelyal tümorlerde
44
çalışmaların çoğunda beş yıllık sağ kalım oranları; pTa tümörlerde %95, pT1 de %72, pT2
de %64, pT3a, pT3b ve pT4 tümörlerde ise %39’dur (25). Bazı çalışmalarda ise beş yıllık sağ
kalım oranları %31, %39, %50 , %60 , %66 olarak bildirilmektedir (25,26, 67,72, 75, 76).
Kadir T.ve ark.’larının çalışmasında invaziv tümörlerde (pT2-T4) iki, üç, beş yıllık sağ kalım
oranları sırasıyla %75, %62,%50 ‘dir (75). Hüsnü Tokgöz ve ark.’larının çalışmasında pT2a
ve pT2b evre hastalarda iki, üç, beş yıllık sağ kalım oranları sırasıyla pT2 grup tümörlerde;
pT2a tümörlerde %6.1, %71, %44.3, pT2b tümörlerde ise % 1.9, % 64.6 ve %43 olarak
bildirilmektedir (23). Surendra B.ve ark.’larının (85) çalışmasında sağ kalım oranı %57.8
olup ortalama yaşam süresi 50 aydır. Çalışmamızda 2004-2009 yılları arasında izlemde
olguların %73.2’si (n:30) yaşamakta olup %26.82’i (n:11) kaybedilmiştir. Operasyondan
sonra 5 olgu 1 yıl, 4 olgu 2 yıl, 2 olgu 3 yıl içinde ölmüştür. Bir yıl içinde ölen 3 olgudan 2’si
metastaz gelişimi ile hastalığa bağlı olarak bir olgu ise operasyondan sonra hastalık dışı neden
ile ölmüştür. Diğer 8 olgunun ölüm sebebi ise kayıtlara ulaşılamadığından bilinememektedir.
Çalışmamızda 5 yıllık sağ kalım oranı %73.2 olarak saptanmıştır. Ölen olguların ikisi pT2
evre, 6 sı pT3 evre, 3 ü pT4 evresinde idi. Sonuçlarımız literatürdeki çalışmaların bir
kısmından daha yüksek (25,72,75,76,85), Per Larsson ve ark.’larının çalışmalarından daha
düşük orandadır (67). Literatürlerde serilerdeki farklı sonuçlar tanı protokolleri, hasta seçimi,
hastaların karakteristik özellikleri ve tedavi protokollerindeki farklılıklar ile açıklanabilir (76)
C-erbB-2, kromozom 17q21’de lokalize proto-onkogen, 185 kDA moleküler
ağırlığında transmembran reseptör proteinidir. Bu protein tirozin kinaz tipinde hücre yüzey
reseptörüdür. Aminoasit dizilimleri epidermal growth faktör reseptörüne benzer. Tirozin kinaz
aktivitesine sahip olup, hücrenin proliferasyonunda rol oynar ve çeşitli tümörlerdeki malign
hücre proliferasyonu, metastaz ve anjiogenezden sorumludur.
Meme karsinomları ve diğer tümörlerde c-erbB-2 overekspresyonu ve gen
amplifikasyonu ile ilgili 600’den fazla çalışma yapılmıştır. Bu çalışmalarda birçok tümörde
çok geniş aralıklarda değişen c-erbB-2 overekspresyonu ve gen amplifikasyonları
gösterilmiştir (59). C-erbB-2
protein overekspresyonunun yüksek histolojik grade, ileri
patolojik evre, artan nüks oranı ve azalan sağ kalım süresi ile orantılı olduğunu savunan
görüşler yanında c-erbB-2’nin prognostik değeri olmadığını belirten görüşlerde vardır
(30,34,43,51,82 ).
45
Çalışmamızda
immünhistokimyasal
yöntem
ile
olguların
c-erbB-2
protein
overekspresyonu durumları incelendi. Boyanma Hercept standart kriter ile değerlendirildi.
Olguların %51.2 (n:21) ‘sinde pozitif boyanma saptandı. Ancak boyanan olguların %39 ‘u
(n:16) sitoplazmik , %12.2 ‘si (n:5) membranöz karakterde idi. Önceki yıllarda Coombs LM.
ve ark.’ları (25,56)
karsinomlarının
sitoplazmik boyanmanın daha belirgin olduğunu ve meme
aksine
ürotelyal
tümörlerde
boyanmanın
sitoplazmik
olduğunu
belirtmişlerdir. Dara O Kavanagh ve ark.’ları, kolorektal kanserler ile ilgili benzer bir
çalışmada c-erbB-2 protein overekspresyonun, yayınların bir kısmında % 70’inde sitoplazmik,
bazılarında
%
50’sinde
membranöz
overekspresyon
gösterdiği
ve
sitoplazmik
overekspresyonun mitojenik sinyali iletmede güçsüz olduğunu belirtmiştir ve bu nedenle
sadece membranöz overekspresyonu
değerlendirmiştir (89) . Son yıllardaki literatür
araştırıldığında; ürotelyal tümörlerde kabul edilen boyanma paterninin membranöz olduğu,
sitoplazmik boyanmanın reaktif olması nedeniyle değerlendirmede ihmal edildiği
görülmüştür. Çalışmamızda olgu sayısının ve membranöz boyanma oranının ( %9.75) az
olması nedeni ile istastiksel olarak anlamlı çalışma yapılamadığından olgularda sitoplazmik
yada membranöz boyanma pozitif , boyanmayanların tamamı negatif olarak değerlendirildi.
Ayrıca membranöz boyanmayı pozitif, sitoplazmik boyanma ve boyanma olmayan olguları
negatif kabul ederek ayrı bir değerlendirme daha yapıldı.
C-erbB-2 gen amplifikasyonu ve protein overekspresyonu 1990 yılında Zhau ve
ark.’ları tarafından rapor edilmiş olup %70 hastada protein overekspresyonu gösterilmiştir
(85). Günümüze kadar çeşitli araştırmalarda protein overekspresyonun non-invaziv ürotelyal
karsinomlarda %17-76, invaziv ürotelyal karsinomlarda %23-80 oranında (39) , %14-70 (55)
ve %2-71 (85)
oranında overekspresyonu bildirilmiştir. Farklı çalışmalarda c-erbB-2 gen
amplifikasyonu ise %4-59 (48,84) non invaziv ve invaziv ürotelyal karsinomlarda %0-8 (39)
%14.3 (55), %3-63 (85) , primer ürotelyal karsinomlarda %10, metastatik tümörlerde %4
oranında bildirilmiştir.
C-erbB2 protein overekspresyonu ve gen amplifikasyonu pTa-pT1 tümörler ile
karşılaştırıldığında pT2 tümörlerde daha sık görülmektedir. Çalışmalarda non-invaziv
tümörlerde
%17-76,
invaziv
tümörlerde
ise
%23-80
oranında
c-erbB-2
protein
overekspresyonu gösterilmektedir. Hauser-Kronberger C.ve ark.’rının çalışmasında noninvaziv ve invaziv ürotelyal tümörlerden oluşan 25 olguda invaziv tümörlerin %58’inde, noninvaziv tümörlerin %76 ‘sında c-erbB-2 overekspresyonu gösterilmiştir (48).
46
Latif Z. ve ark. çalışmasında protein overekspresyonu invaziv olmayan ürotelyal
tümörlerde %52 , invaziv ürotelyal tümörlerde %76 oranında saptanmıştır.FISH yöntemi
ile gen amplifikasyonu non-invaziv ve invaziv tümörlerde %8 oranında gösterilmiştir (87) .
Surendra B. Kolla ve ark.’larının 90 hastadan oluşan çalışmasında overekspresyon
%55.6 oranında saptanmıştır. C-erbB-2 pozitif olguların patolojik evre ve grade dağılımları
ise; pT2 tümörlerin %16.7’sinde, pT3a tümörlerin %69.2’si , T3b tümörlerin %76.9’u , pT4
tümörlerin %75’i , grade 1 tümörlerin %32’si, grade 3 tümörlerin %71’i, lenf nodu pozitif
olguların %76.9’unda gösterilmiştir . Sağ kalım süreleri ortalama cerbB-2 negatif hastalarda
60 ay, pozitif hastalarda 30 ay olarak saptanmıştır. C-erbB-2 pozitif tümörlerin sıklıkla pT3T4 evre ve lenf nodu pozitif olgular olduğu belirtilmiştir (85) . Aynı yayında bildirilen
çalışmalarda; Jimenez ve ark.’larının (85) c-erbB-2 protein overekpresyonunun yalnızca kas
invazyonu gösteren tümörlerde saptandığı ve c-erbB-2 pozitif hastalarda sağ kalımın c-erbB2 negatif hastalara göre daha kısa olduğu ancak bu farklılığın önemli olmadığı belirtilmiştir.
Kruger ve ark. ‘larının 138 hastadan oluşan serilerinde kas invaziv tümörlerde c-erbB-2
overekspresyonu ile sağ kalım arasında önemli ilişki olduğu belirtilmiştir (85).
Gandour-Edwards R ve ark.’larının çalışmalarında opere edilemeyen ve metastaz
tespit edilmiş paclitaxel
bazlı kemoterapi alan hastalarda c-erbB-2 protein ekspresyonu
araştırılmış ve olguların %71’inde protein overekspresyonu gösterilmiştir. Çalışmanın
sonucunda bir çok araştıma ile uyumlu olarak c-erbB-2 overekspresyonunun high grade ve
invaziv ürotelyal
tümörlerde önemli oranda yüksek olduğunu, bununla birlikte diğer
araştırmaların tersine ürotelyal karsinomlarda paclitaxel
bazlı kemoterapi alan c-erbB-2
eksprese eden hastalarda ölüm riskinin azaldığını belirlemişlerdir (80).
Coogan CL ve ark.’larının 54 olgudan oluşan çalışmasında
c-erbB-2 protein
overekspresyonu 14 ( %26 ) olguda gösterilmiştir. Bir olgu (%14) grade 1, 3 olgu (%12)
grade 2, 10 olgu (%48) grade 3 tümörlerdir. Bu çalışmada diğer araştırmaların bir kısmı ile
uyumlu olarak tümörün histolojik derecesinin arttıkça c-erbB-2 protein overekspresyonunun
arttığı belirtilmiştir (88 ).
Sato K ve ark.’larının
çalışmasında c-erbB-2
saptanmış olup, C-erbB-2 overekspresyonunun
47
overekspresyonu %23 oranında
tümör grade ve stage ile uyumlu olarak
arttığını belirtmişlerdir. Sağ kalım oranını (5 yıllık) c-erbB-2 negatif tümörlerde %65.5, cerbB-2 pozitif tümörlerde %41.8 olarak belirtmişlerdir (90).
Jimenez RE. ve ark’.’larının çalışmasında %28 vakada c-erbB-2 overekspresyonu
gösterilmiştir. Lenf nodu metastaz gösteren olguların %53’ünde c-erbB-2 overekspresyonu
olduğu, sağ kalım oranlarının c-erbB-2 pozitif olgular ile negatif olgular arasında önemli
farklılık olmadığı belirtimiştir (35).
Eissa
S
ve
ark.’larının
çalışmasında
c-erbB-2
overekspresyonu
“enzyme
immunoassay”(EIA) ve “Western blot”(WB) yöntemi ile değerlendirilmiştir. Bu çalışmada cerbB-2 overekspresyonu ile evre ve grade arasında önemli ilişki bulunmazken lenf nodu
durumu ile ilişki olduğu bildirilmiştir (64).
Krüger
S.
ve
ark.’larının
203
olgudan
oluşan
çalışmasında
c-erbB-2
overekspresyonunun (%37) tümörün yüksek histolojik derecesi, invazyon özelliği ve lenf
nodu metastazı ile ilişkili olduğu bildirilmiştir. Aynı çalışmada gen amplifikasyonu ise %5
oranında saptanmış ve protein overekspresyonunun gen amplifikasyonundan farklı bir
mekanizma ile oluştuğu görüşünü belirtmişlerdir (27) .
Jalali N. ve ark’nın .çalışmasında 75 vakada %37.8 c-erbB-2 overekspresyonu
saptanmış, c-erbB2 ile histolojik grade arasında önemli ilişki olduğu belirtilmiştir. Büyük
serili
çalışmalar
ile
c-erbB-2’nin
prognostik
faktör
olarak
muhtemel
rolünün
gösterilebileceğini savunmuşlardır (36).
Wülfing C ve ark.’larının çalışmasında, c-erbB-2 overekspresyonunu 127 ürotelyal
karsinom tanısı olan radikal sistektomi piyeslerinde %74.8 (2/3 +) oranında gösterilmiştir. 41
(%32.2) vaka 2 (++ ) olup fluorescent in situ hybridisation yöntemi ile çalışılmış ve 11
(%26.8) vakada pozitif gen amplifikasyonu gösterilmiştir. Bu çalışmada c-erbB-2 over
ekspresyonunun karsinogenesisin lenfangiogenez ve uzak metastaz gelişimi gibi evreleri ile
birlikte olduğu belirtilmiş, ancak klinopatolojik parametreler ve sağ kalım arasında önemli bir
ilişki belirtilmemiştir (82).
Tsai YS. ve ark.’nın çalışmasında radikal sistektomili hastalarda c-erbB-2 ve p53
ekspresyonları karşılaştırmalı olarak değerlendirilmiştir. C-erbB-2 pozitifliği %58.2 oranında
48
belirtilmiş ve c-erbB-2’nin prognostik önemi olmadığı ancak p53 ‘ün prognostik önemi
olduğu vurgulanmıştır. Ayrıca p53 ve c-erbB-2 ‘nin birlikte ekspresyonu ile lenf nodu
metastazı arasında önemli ilişki olduğu bildirilmiştir (51).
Gorgoulis ve ark.’ları c-erbB-2 overekspresyonunun EGFR ekspresyonu ile uyumlu
olduğunu ve tümörün grade ve patolojik evresi ile ilişkili olduğu belirtilmiştir (49).
Lee SE ve ark.’nın
82 hastadan oluşan serisinde %35 oranında c-erbB-2 protein
overekspresyonu gösterilmiştir. C-erbB-2 overekspresyonu ile tümör grade ve evre arasında
önemli bir korelasyon görülmediğini savunmuşlardır. Bu çalışmada nüks oranları ile c-erbB-2
overekspresyon ilişkisi değerlendirilmiş ve hastaların ilk nüksünü tümörün evresi, ikinci
nüksü ise c-erbB-2 pozitifliğinin belirlediğini bildirmişlerdir. C-erbB-2’nin nüks için yüksek
riskli popülasyonu belirlemesine rağmen tümörde kötü prognozu göstermediğini bu
uyumsuzluğun anlaşılabilmesi için ürotelyum epitelinde c-erbB-2 ekspresyonunu düzenleyici
mekanizmayı anlamak gerektiğini belirtmişlerdir (30).
Yoshıakı
Y
.ve
ark.’larının
çalışmasında
tartışılan
serilerde
c-erbB-2
overekspresyonunun %43, %51, %55, %81 oranında olduğunu belirtmişler ve %81 gibi
yüksek bir sonucu metastatik tümörler ve high grade sitolojik atipiye bağlamışlardır.Yine bu
çalışmada gösterilen literatür sonuçlarının bir kısmında c-erbB-2 overekspresyonunun yüksek
grade ile uyumlu olarak arttığını ancak kendi çalışmalarında önemli bir uyum olmadığını
belirtip bunu seriyi oluşturan vaka sayısının azlığına bağlamışlardır (43).
Hıroyukı M.ve ark.’larının 40 hastadan oluşan çalışmasında hasta grupları pT2-T4’den
oluşmaktadır. Olguların 17’sinde ( %42.5 ) c-erbB-2 ekspresyonu gösterilmiştir. C-erbB-2
pozitif olguların 1’i grade 1 , 16’sı grade 3 , 12’si pT2, 2’si pT3, 3’ü pT4 evrededir.
Metastatik lenf nodu olan olguların sayısı 10 olup 3’ünde c-erbB-2 pozitiftir. Bu çalışmada cerbB-2 overekpresyonu
histolojik grade, patolojik evre ve lenf nodu ile ilişkili
bulunmamıştır (34).
Truls G ve ark.’ları primer ürotelyal
tümörlerde %79
overekspresyonu göstermişlerdir. Bu çalışmada iki farklı
oranında c-erbB-2
immünhistokimyasal boyanma
protokolü Hercept Test ve Modifiye Hercept Test(MH) kullanılmıştır. Hercept Test kullanılan
kesitlerde boyanma standart ve modifiye skor sistemi ile değerlendirilmiş. Modifiye Hercept
49
kullanılan kesitlerde boyanma modifiye sistem ile değerlendirilmiş. Kesitlerde c-erbB-2
boyanması “Target score” kriterleri ile ayrıca değerlendirilmiş. “Target score” sistemi ile
değerlendirildiğinde primer tümörde %45, hercept test ve hercept standart kriter ile
değerlendirildiğinde
%55,
Modifiye Hercept Test
yöntemi ve“target score” ile
değerlendirildiğinde %79 overekspresyon gösterilmiştir. (62) Araştırmaların çoğu, yüksek
olan % 79 sonucunun seçilen olguların metastaz gösteren high grade tümörler olması ve
farklı immünhistokimyasal boyanma protokolüne bağlı olduğunu belirtmişlerdir. Meme
karsinomlarında kabul edilen yöntem Hercept Test Kittir ve boyanma standart skor protokolü
ile değerlendirilir. Ancak mesane ürotelyal tümörlerde MH yöntemi ile standart protokolden
daha fazla pozitif olgu elde edildiğini ve bu protokolün modifiye edilmesinin gerektiğini
vurgulamışlardır.(62)
Çalışmamızda olgulardan boyanma gösterenlerin % 12.2 ‘si membranöz, %39.0’ı
sitoplazmik boyanmadır. Membranöz boyanmada 1 olgu 1(+) , 4 olgu 2/3 (+) dağılım
göstermiştir. 2/3 (+) membranöz boyanma pozitif sonuç kabul edilmiştir. Buna göre c-erbB-2
protein overekspresyonu %9.75 saptanmıştır. Literatürdeki çalışmalarda % 2- 71 (85) arasında
değişen farklı sonuçlar görülmektedir. Sonuç literatür ile uyumlu olmakla birlikte bir
çokaraştırmadan daha düşük bir sonuçtur ( 25, 27, 30,34,35,36,38,41,52,60,61,62,80,82,84,85,
88, 90) . Patolojik evre dağılımına göre
( 2 +/3+) 1 olgu pT2b, 1 olgu pT3a, 2 olgu pT4a ,
3 olguda lenf nodu metastazı pozitifti. Ölen hastalarda
Çalışmamızda
pozitif
pozitif
boyanma görülmedi.
olguların %75’inde (n:3) lenf nodu metastazının varlığı dikkat
çekicidir. Ancak istatiksel açıdan anlamlı ilişki saptanmamıştır. Olgu sayısının yeterli
olmaması nedeni ile c-erbB-2 overekspresyonunun diğer klinik-patolojik prognostik faktörler
(grade, patolojik evre, lenf nodu durumu, metastaz lenfovasküler invazyon) ve sağ kalım
oranı ile karşılaştırılmasından anlamlı bir sonuç alınamamıştır.
Literatürlerde c-erbB-2 over ekspresyonunun
high grade ve invaziv ürotelyal
tümörlerde daha yüksek olduğunu, artan lenf nodu metastaz riski ve azalan yaşam süresi ile
ilişkili olduğunu savunan görüşler ( 36, 49, 52, 71, 80, 85, 90 ) yanında prognostik önemi
olmadığını savunan görüşler de bulunmaktadır ( 35,30,34,43,51,73, 82 ) . Çalışma grubumuzu
oluşturan olgular high grade ve ileri evre ürotelyal tümörler olmasına rağmen çok düşük
oranda (%9.75) protein overekspresyonu saptanmıştır. C-erbB-2 overekspresyon oranının
düşük olması literatür ile karşılaştırıldığında olgu sayısının
50
yetersiz olması ve/veya
kullanılan laboratuvar metodu , antijenin doğru saklanmaması ve kullanılan antijen retrieval
ile ilişkili olarak açıklanabilir.
Olgular ayrıca sitoplazmik veya membranöz boyanan (%51.2 ) ve boyanmayan (%48.8)
olarak gruplandırarak değerlendirme yapılmıştır. Sitoplazmik boyanmada anlamlı kabul
edildiğinde
pozitif
olgu
sayısı
literatür
ile
uyumludur.
Patolojik
evreleri
ile
karşılaştırdığımızda pT2 %61.5, pT3 %36.8, pT4 %66.7 oranında boyanma saptandı. Lenf
nodu pozitif olguların %52.6’sında boyanma tespit edildi. Metastaz gösteren olguların
%33.3’ünde,
görülmeyen olguların %52.6’sında boyanma saptandı. Lenfatik/vasküler
invazyon gösteren olguların ise %46.4’ünde boyanma gözlendi. Ölen hastaların %45.5’inde,
yaşayan hastaların ise %53.3’ünde boyanma saptandı. PT2 evre, pT4 evre ve lenf nodu
pozitif vakalarda c-erbB-2 pozitifliği istatiksel açıdan anlamlı olmamakla birlikte dikkat
çekicidir. Çalışmamızda istatiksel açıdan c-erbB-2 protein ekspresyonu ile grade, patolojik
evre lenf nodu durumu, metastaz ve sağ kalım arasında anlamlı ilişki saptanmamıştır.
C-erbB-2 gen amplifikasyonu , protein overekspresyonu ve mRNA overekspresyonu
FISH, southern blot, PCR metodları ile analiz edilir.Tümörlerde bu yöntemler ile c-erbB-2
protein overekspresyonu ve gen amplifikasyonu saptanarak aralarındaki uyum karşılaştırılır.
Meme karsinomlarının %25-30’u c-erbB-2 protein overekspresyonu gösterir. Aynı zamanda
bu olgular gen amplifikasyonu da gösterirler. Meme karsinomlarında c-erbB-2 protein
overekspresyonunun kötü prognostik faktör olduğu ve aynı zamanda bu vakaların hormona
dirençli olduğu bildirilmiştir (34).
Meme karsinomlu hastalarda c-erbB-2 pozitifliğinin
saptanmasında c-erbB-2 gen amplifikasyonu protein overekspresyonundan daha güvenilir
yöntemdir (34). Meme karsinomlarında tedavide kullanılan Trastuzumab c-erbB-2
reseptörüne karşı geliştirilen monoklonal antikordur. Moleküler hedef tedavi grubunda bir
ilaçtır ve reseptöre bağlanarak sinyal iletimini bloke eder. Sonuçta kanser gelişimi inhibe olur.
Anti-HER/2 tedavisine yalnızca c-erbB-2
gen amplifikasyonu gösteren kanserler yanıt
verirler. Meme karsinomlarının çoğunda yüksek protein overekspresyonu ile birlikte gen
amplifikasyonu da gösterilmiştir (84) .
Ürotelyal
karsinomlarda ise
protein overekspresyon ile gen amplifikasyon
birlikteliğinin düşük oranda olduğu bildirilmektedir. Bu sonuçlar ürotelyal karsinomlarda
protein overekspresyonunun gen amplifikasyonu dışında başka mekanizmalarında etkisi ile
geliştiği görüşünü desteklemektedir (27, 84 ) . Aynı görüş Delphine A. Ve ark.’larının “real –
51
time quantitative reverse trancription polymerase chain reaction” (RT-PCR) tekniği ile cerbB-2 mRNA ekspresyonu ve immünhistokimyasal yöntem ile protein ekspresyonunu
karşılaştırdıkları çalışmada da belirtilmiştir. Bu çalışmada ; immünhistokimyasal sonuçlar ile
RT-PCR sonuçları arasında ki uyumun gen amplifikasyonundan daha iyi olduğu ve 2(+)
immünhistokimyasasal
sonuçların
gerçekte
mRNA
ekspresyonuna
sahip
olduğunu
bildirmişlerdir . Gen amplifikasyonun protein overekspresyon ve mRNA ekspresyonunda
belirgin mekanizma olmadığını belirmişlerdir (58).
Ürotelyal tümörlerde gen amplifikasyonu %3-63 oranında olup çok değişkendir (85).
Underwood M . ve ark.’larının çalışmasında normal mesane kontrol grubu ve nüks
göstermeyen tümörlerde gen amplifikasyonu saptanmadığı, nüks tümörlerde ise gen
amplifikasyonunun görüldüğü ve tümörün progresyonu ile ilişkili olduğu bildirilmiştir (29).
Gen amplifikasyonları ile ilgili çalışmalarda sonuçlar farklı olmakla birlikte; ortak sonuç kas
invaziv tümörlerde yüzeyel tümörler ile karşılaştırıldığında daha yüksek olduğudur (29, 31,32,
84). C-erbB-2 protein overekpresyonu ve gen amplifikasyonunda
farklı sonuçlar çalışma
gruplarında seçilen olguların farklılığı (stage, grade), kullanılan teknik (FISH, southern blot,
PCR) , materyalin niteliği (formal fiske,
taze doku),immünhistokimyasal yöntem
ile
açıklanmaktadır (85). Ortak bir sonuca ulaşabilmek için standart laboratuar yöntemleri ile
büyük serilerden oluşan çalışmalara ihtiyaç vardır.
Mesane kanserlerinde radikal sistektomi ve adjuvan kemoterapiye rağmen düşük sağ
kalım oranı nedeni ile yeni tedavi seçeneklerine ihtiyaç duyulmaktadır. Bu hastalarda yüksek
oranda c-erbB-2 protein overekspresyonu gösterilmesi nedeni ile anti-HER2/neu monoklonal
antikorunun kombine kemoterapide veya direkt tedavide rolü araştırılmaktadır. Literatürde
ürotelyal tümör tanısı olan hastalarda yapılan çalışmalarda farklı oranlarda anti-HER2/neu
monoklonal antikor tedavisine yanıt verebilecek hastaların varlığı bildirilmiştir (34,43,84).
Ürotelyal tümörlerde yüksek oranda c-erbB-2 protein overekspresyonu ve düşük gen
amplifikasyonu
gösterilmektedir.
Anti-HER2/neu
tedavisine
yanıt
ise
ancak
gen
amplifikasyonu yüksek tümörlerde görülebilmektedir. Bu nedenle ürotelyal tümörlerde antiHER2/neu tedavisine yanıt verme olasılığı taşıyan ve yüksek protein overekspresyonuna
neden olan başka mekanizmaları ortaya koyacak önemli çalışmalara ihtiyaç vardır (27,58, 84)
52
Çalışmamızda c-erbB-2 overekspresyonu % 9.75 oranında gösterilmişt olup; C-erbB-2
varlığı ile invazyon derinliği, histolojik derece, vasküler invazyon ve lenf nodu metastazı gibi
konvansiyonel klinikopatolojik prognostik faktörler ve sağ kalım süresi arasında istatiksel
olarak anlamlı ilişki saptanamamıştır. C-erbB-2 protein overekspresyonun ürotelyal
tümörlerde prognostik faktör olarak değerlendirilebilmesi için literatürde de belirtildiği gibi
daha büyük seri çalışmalara ihtiyaç vardır.
6-SONUÇ
Bu çalışmada ürotelyal karsinom tanısı alan 41 sistektomi, sistoprostektomi ve
sistektomi-total abdominal histerektomi rezeksiyon spesmeninde klasik klinik-patolojik
prognostik faktörlerden grade, lenfatik /vasküler invazyon , patolojik evre(invazyon derinliği)
, lenf nodu durumu, uzak organ metastazı ve sağ kalım oranları değerlendirildi. C-erbB-2
protein overekspresyonu saptanarak bu prognostik faktörler ile ilişkisi ve olası prognostik
faktör olarak önemi araştırıldı.
I-Ortalama erkek/kadın oranı yüksektir. Ürotelyal karsinomlarda sigara etyolojik nedenlerin
başında gelir. Sigara kullanımı erkeklerde sık görüldüğünden bu durum toplumda sigara içen
erkek oranının yüksek olması ile ilişkili olabilir.
II-Lenfatik/vasküler invazyon saptanan ve lenf nodu pozitif olgu sayısı literatürden yüksek
saptandı. Lenfatik/vasküler invazyonun artan lenf nodu metastaz riski ile ilişkili olduğu
söylenebilir.
III-C-erbB-2 protein overekspresyonu immünhistokimyasal incelemede iki ayrı boyanma
paterni nedeni ile iki ayrı değerlendirme yapıldı . Çalışmalarda kabul edilen membranöz
boyanma paterninin değerlendirmesinde % 9.75 oranında c-erbB-2 protein overekspresyonu
saptandı. Sonuç literatürdeki çalışmaların çoğundan düşüktür. Bu durum diğer çalışmalar ile
karşılaştırdığımızda olgu sayısının azlığı ve laboratuvar yöntemine bağlı olabilir.
IV-C-erbB-2 ekspresyonu ile grade, invazyon derinliği, lenf nodu metastazı, uzak organ
metastazı ve yaşam süresi arasında anlamlı ilişki saptanmadı.
53
ŞEKİLLER
Şekil 9 :High grade ürotelyal tümör (hematoksilen&eosinX 400
Şekil 10 : C-erbB-2 1 (+) sitoplazmik boyanma (immünhistokimya X 200)
54
Şekil 11 : CerbB-2 2(+) sitoplazmik boyanma (immünhistokimyaX200)
Şekil 12 : C-erbB-2 1(+) membranöz boyanma (immünhistokimyaX400)
Şekil 13 : C-erbB-2 2(+) membranöz boyanma (immünhistokimyaX200)
55
Şekil 14 : C-erbB-2 3(+) membranöz boyanma (immünhistokimya X 100)
Şekil 15: C-erbB-2 3(+) membranöz boyanma (immünhistokimya X200)
56
9-KAYNAKLAR
1-International Agency for Research on Cancer (IARC), Pathology and Genetics of Tumours of the
Urinary System and Male Genital Organs , World Health Organization Classification of Tumours,
Edited byJohn N. Eble, Guido Sauter, Jonathan I.Epstein, Isabell A.Sesterhenn 2004, chapter: 2, 89120
2- Cahit Şahin , T1 Mesane tümörlerinde invazyon derinliği kullanılarak yapılan mikroevrenin
hastalığın seyrini öngörmede etkinliği ve değeri.in, Uzmanlık tezi, 2006
3-Sanchez-Carboya M, Cordon-Cardao C , Molecular alterations associated with bladder cancer
progression. Semin Oncol. 2007 Apr;34(2):75-84
4-Wasiim Kassouf, Peter c. Black, Tomasz Tuziak, Jolanta Bondaruk, Sangkyou Lee, Gordon
A.Brown,Liana Adam,Caimio Wei, Keith Baggerly,Menashe Bar Eli, David Mcconkey , Bogdan
Czerniak, Colin P.Dinney , Distinctive expression pattern of ErbB family receptors signifies an
aggressive variant of bladder cancer. J Urol. 2008 Jan;179(1):353-8. Epub 2007 Nov 19
5-Rosai J. Carcinoma, Bladder. İn: Rosai J, editor. Rosai and Ackerman’s Surgical Pathology 9th ed.
Mosby; Bladder , 2004. vol:1 1327-1341
6- Mılls Stacey E. .İn: Darryl Carter , Joel K. Greenson Harold A.Oberman , Vıctor Reuter, Mark H.
Stoler.Sternberg’s Diagnostic Surgical Pathology 4th ed. 2004 vol:3, 2035-2074
7- Amling CL, Diagnosis and management of superficial bladder .Curr Probl Cancer 2001 JulAug;25(4):219-78
8-Wıllıam M. Murphy .Urological Pathology , Dısease of the urınary bladder , uretra, ureters and renal
pelves, 2th ed. 1997 , chapter:2, 34-147
9-Jose I.Lopez, Javier C.Angulo, Growth pattern in superficial urothelial bladder
carcinomas.Histological review and clinical relevance .Int Urol Nephrol DOI10.1007/5 11255-00099537-x
10-Cordon-Cardo C , Molecular alterations associated with bladder cancer initiation and
progression.1: Scand J Urol Nephrol Suppl. 2008 Sep;(218):154-65
11-Hülya Cabadak , Hücre siklusu ve kanser.in , ADÜ Tıp Fakültesi Dergisi 2008 ;9(3):51-61
12- Schned AR, Andrew AS, Marsit CY, Kelsey KT, Zens MS, Karagas MR, Histological
classification and stage of newly diagnosed bladder cancer in a population-based study from the
Northeastern United States .Scand J Urol Nephrol 2008;42(3):237
13-Vınay Kumar, Ramzi S.Cotran, Stanley L,Robbıns , Temel Patoloji ,Neoplazi 7.th ed.Uğur
Çevikbaş. 2003, 165-210
14-John P.Stein,Jıe Caı, Susan Groshen,Donald G.Skinner, Risk factors for patients with pelvic lymph
node metastases following radical cystectomy with en bloc pelvic lymphadenectomy: concept of
lymph node density. J Urol. 2003 Jul;170(1):35-41
15- Kunju LP, You L, Zhang Y, Daignault S, Montie JE, Lee CT, Lymphovascular invasion of
urothelial cancer in matched transurethral bladder tumor resection and radical cystectomy specimens. J
Urol. 2008 Nov;180(5):1928-32; discussion 1932. Epub 2008 Sep 17
16-BarryB.Lowtz , Dennıs A.Casciato, Medıcal Oncology & Prıncıples Of Cancer Bıology
Kanser Biyolojisi ve Onkogenler
17- Baffa R, Letko J, McClung C, LeNoır J, Vecchine , Gomella G , Molecular genetics of bladder
cancer: targets for diagnosis and therapy.J Exp Clin Cancer Res 2006 Jun;25(2):145- 60
18- Fernandez MI,Bolenz C, Troian L, Steidler A, Weiss C, Alken P, Grobholz R, Michel
MS,Prognostic implications of lymphangiogenesis in muscle-invasive transitional cell carcinoma of
the bladder. Eur Urol. 2008 Mar;53(3):571-8
19- Maurızıo Buscarını, Marcus L.Quek, Parksh Gıll, Gangbın Xıa, Davıd Guınn Anda John P.Steın,
Molecular prognostic factors in bladder cancer.BJU. 95, 739-742
20- Stein JP,Grossfeld GD,Ginsberg DA, Esrig D, Freeman JA, Figuerroa AJ, Skinner DG,Cote RJ ,
Prognostic markers in bladder cancer: a contemporary review of the literature.J Urol 1998 Sep;160(3
Pt 1):645-59
21-Christopher S.Foster , HER 2 /neu Expression in cancer:The pathologist as Diagnostician or
prophet? Human Pathology 34, ıssue 7, Jul 2003,Pages 635-638
57
22- Willams SG, Buscarini M, Stein JP , Molecular markers for diagnosis, staging, and prognosis of
bladder cancer.Oncology(Williston park) 2001 Nov;15(11):1461-70, 1473-4, 1476; discussion 147684
23-Husnu Tokgoz , Kadir Turkolmaz , Berkan Resorlu , Kenan Kose, Ozden Tulunay, Yaşar
Beduk,Pathological staging of muscle invaziv bladder cancer.İs substaging of pT2 tumor really
necessary? Clinical Urol ogy Vol.33(6):777-784
24- Lorenzo Gomez MF, Schroeder,The role of tumor markers in prognosing transitional bladder
cancer.Actas Urol Esp.2003 Jul.Aug:27(7):501-12
25 – Alpay Aktümen , Mesanenin değişici epitel hücreli karsinomlarında nüks c-erbB-2 ile diğer
prognostic faktörlerin karşılaştırılması in, Uzmanlık tezi.2002
26- Thieblemont C, Fendler JP, Trillet-Lenoir V, Petris C, Chauvin F, Braunat-Mentigy M, Devaux Y,
Devonec M , Gerard JP,Perrin P , Prognostic factors of survival in infiltrating urothelial bladder
carcinoma. A retrospective study of 158 patients treated by radical cystectomy Int Urol Nephrol
2008;40(2):321-7
27- Krüger S, Weitsch G, Büttner H, Matthiensen A, Böhmer T, Marquard T, Sayk F, Feller AC,Böhle
A, Overexpression of c-erbB-2 oncoprotein in muscle-invasive bladder carcinoma: relationship with
gene amplification, clinicopathological parameters and prognostic outcome. Int J Oncol 2002
Nov;21(5):981-7
28-Doç.Dr.Nilgün Kapucuoğlu, Onkogenler ve tümör supressor genler
29- Underwood M, Bartlett J, Reeves J, Gardiner DS, Scott R, Cooke T , C-erbB-2 gene amplification:
a molecular marker in recurrent bladder tumors? : Cancer Res 1995 Jun 1;55(11):2422-30
30- Lee SE, Chow NH, Chi YC, Tzai TS, Yang WH, Lin SN, Expression of c-erbB-2 protein in
normal and neoplastic urothelium: lack of adverse prognostic effect in human urinary bladder
cancer.Anticancer Res 1994 May-Jun;14(3B):1317-24
31- Miyamota H, Kubota Y, Noguchi S, Takase K, Matsuzaki J, Moriyama M, Takebayashi S,
Kitamura H, Hosaka M , C-ERBB-2 gene amplification as a prognostic marker in human bladder
cancer. : Urology 2000 May;55(5):679-83
32- Orlando C, Setsini R, Vona G, Pinzani P, Bianchi S, Giacca M, Pazzagli M, Selli C.Detection of cerbB-2 amplification in transitional cell bladder carcinoma using competitive PCR technique.Urol
1996 Dec;156(6):2089-93
33- Rosenblatt,jonmarker S, Lewensohn R, Egevad L, Sherif A,Kalkner KM, Nilson S, Valdman A,
Ullen A; Current status of prognostic immunohistochemical markers for urothelial bladder cancer .
Tumor biol.2008;29(5) :311-22.Epub 2008 Nov 5
34- Hıroyukı Matsubara,Yoshıakı Yamada, Katsuya Naruse,Kogente Nakamura,Shıgeyukı
Aokı,Tomohıro Takı, Motoı Tobıume,Kenjı Zennamı, Remı Katsuda , Nobuakı Honda, Potential for
HER-2/neu molecular targeted therapy for invasive bladder carcinoma: comparative study of
immunohistochemtistry and fluorescent in situ hybridization.Oncol Rep 2008 Jan;19(1):57-63
35- Jımenez RE, Hussain M, Bianco FJ Jr, Vaishampayan U, Tabazcka P, Sakr WA, Pontes JE, Wood
DP JR, Grignon DJ , Her-2/neu overexpression in muscle-invasive urothelial carcinoma of the
bladder: prognostic significance and comparative analysis in primary and metastatic
tumors.Clin.Cancer.Res.2001 Aug:7(8):2440-7
36- Jalali Nadoushan MR,Taheri T, Jouian N, Zaeri F, Overexpression of HER-2/neu oncogene and
transitional cell carcinoma of bladder.Urol J 2007 Summer;4(3):151-4
37-Yang Tu-bao, Zeng Fu-hua,Sun Zhen-qiu, Prognostic factors for primary superficial transitional
cell carcinoma of bladder:a retrospectiva cohort study , Chineese Medical Jor
urnal, 2006, Vol.119 No:21:1821-1828
38-Wang C, Liu X,Wang L, Chend ,Tan Z , Wang Z, Chen T, (p16, p53 and c-erbB-2 gene
expression in bladder carcinoma) , Zhonghua Bing , Li Xue , Za Zhi . 2000 Feb; 29(1): 20
39- Dona E.Hansel,MD,PhD, Eric Swain, Robert Dreicer, MD , Raymound R.Tubbs , HER 2
overexpression and amplification in urothelial carcinoma of the bladder is associated with MYC
coamplification in a subset of cases. Am J Clin Pathol. 2008 Aug;130(2):274-81
40-T.Otto,M .Goppel,K.H.Heider,H.Rübben, Prognostic factor for bladder cancer, Urol Res(1995)
23:137-141
58
41-Tetu B, Fradet Y, Allard P, Veilleux C, Roberge N, Bernard P, Prevalance and clinical significance
of HER2/neu , p53 and Rb expression in primary superficial bladder cancer . J.Urol.1996 May 155 (5)
: 1784-8
42-Behfar Ehdaie , Dan Theodorescu , Molecular markers in transitonal cell carcinoma insight into
mechanisms and ve prognosis , İndian J Urol .2008 Jan-Mar: 24(1):61-67
43-Yoshıakı Yamada , Katsuya Naruse ,Kogenta Nakamura , Shıgeyukı Aokı,Tomohıro Taı, Motoı
Tobıume,Kenjı Zennamı, Remı Katsuda, Yasusuke Inoue , Hıroshı, Noguchı,Nobuakı Honda,
Potential for molecular-targeted therapy targeting human epidermal growth factor receptor-2 for
invasive bladder cancer. Oncol Rep. 2007 Jul;18(1):3-7
44-Quazona D ,Bieche I ,Tozlu S, Botto H,Debre B, Lidereau,Gene expression profiling of ERBB
receptors and ligands in human transitional cell carcinoma of the bladder. J Urol. 2006 Mar;175(3 Pt
1):1127-32
45-Cordon –Cardo C, Cote RJ,Sauter G, Genetic and molecular markers of urothelial premalignancy
and malignancy .Scanda J Urol Nephrol Suppl 2000;205:82-93
46-Modlich O,Prisack HB, Pitschke G, Ramp U, Ackermann R,Bojar H,Vögeli TA,Grimm MO,
Identifying superficial, muscle-invasive, and metastasizing transitional cell carcinoma of the bladder:
use of cDNA array analysis of gene expression profiles. Clin Cancer Res. 2004 May 15;10(10):341021
47- Montironi R, Mazzuchelli R, Scarpelli M, Lopez –Beltran A, Cheng L. Morphological diagnosis
of urothelial neoplasms.vJ Clin Pathol. 2008 Jan;61(1):3-10.
48- Hauser-Kronberger C,Peham K,Grall J,Rausch W,Hutarew G, Dietze O, Novel approach of human
epidermal growth factor receptor 2 detection in noninvasive and invasive transitional cell carcinoma of
the bladder.J. Urol.2006 Mar;175 (3pt1) ; 875-80
49- Gorgolulis VG,Barbatis C, Poulias I, Karameris, Molecular and immunohistochemical evaluation
of epidermal growth factor receptor and c-erb-B-2 gene product in transitional cell carcinomas of the
urinary bladder: a study in Greek patients. Mod Pathol. 1995 Sep;8(7):758-64
50-Imai T,Kimura M,Takeda , Tomita Y, Significance of epidermal growth factor receptor and cerbB-2 protein expression in transitional cell cancer of the upper urinary tract for tumour recurrence at
the urinary bladder. Br J Cancer. 1995 Jan;71(1):69-72
51- Tsai YS, Tzai TS, Chow NH, Yang WH, Tong YC, Lin JS,Chang CC, Cheng HL, Lin YM,
Prognostic values of p53 and HER-2/neu coexpression in invasive bladder cancer in Taiwan. Urol
Oncol 2004 Mar-Apr;22(2):93-101
52-Masatsugu Morıyama, Teysu Akıyama,Tadashı Yamamoto,Tomoyukı Kawamoto Tetsuro Kato,
Kazunarı Sato , Tsutomu Watanukı, Takashı Hıkage, Norıko Katsuta , Shıgeo Morı Expression of cerbB-2 gene product in urinary bladder cancer .J Urol 1991 FEB;145(2):423-7
53- Chow NH, Chan SH, Tzaı TS, ho CL, Liu HS, Expression profiles of ErbB family receptors and
prognosis in primary transitional cell carcinoma of the urinary bladder.Clin Cancer Res. 2001
Jul;7(7):1957-62
54- Nan-Haw Chow,Hsiao-Sheng Liu,Hsiao-Bai Yang, Shih – Huang Chan , Ih-Jen Su, Expression
patterns of erbB receptor family in normal urothelium and transitional cell carcinoma. An
immunohistochemical study. Virchows Arch. 1997 Jun;430(6):461-6
55- Ranveıg Rotterud , Jahn Marthın Nesland , Aasmund Berner,Sophıe D.fossa, Expression of the
epidermal growth factor receptor family in normal and malignant urothelium. BJU Int. (2005),
95,1344-1350
56- Coombs Lm,Oliver S, Sweeney E,Knowles M,Immunocytochemical localization of c-erbB-2
protein in transitional cell carcinoma of the urinary bladder. J Pathol. 1993 Jan;169(1):35-42
57- HER-2 (c-erbB-2) test update: present status and problems.Breast Cancer. 2006;13(3):236-48
58-Delphine Amsellem-Quazona , Ivan Bieche ,Vincent Moline ,Caroline Elie,Annick
Viellefond,Sengül Tozlu,Henry Botto,Bernard Debre , Rosette Lidereau, Is quantitative real –time
RT-PCR an adjunct to ımmunohistochemistry for the evaluation of ErbB2 status in transitional
carcinoma of the bladder? European Urol 49(2006) 1035-1043
59- Coya Tapia , Katharina Glatz, Hedvika Novotny , Alessendro Lugli , Milo Horcic. Christian A
Seemayer , Luigi Tornillo , Luigi Terracciano, Hanspeter Spichtin, Martina Mirlacher, Ronald Simon ,
Guido Sauter, Close association between HER-2 amplification and overexpression in human tumors
of non-breast origin.Mod Pathol. 2007 Feb;20(2):192-8
59
60-Bankfalvi A, HER 2 diagnostics Magy Onkol. 2002;46(1):11-5. Epub 2003 Feb 3
61- Wester K, Sjöström a, de la Torre M, Carisson J, Malmström PU, HER-2--a possible target for
therapy of metastatic urinary bladder carcinoma.vActa Oncol. 2002;41(3):282-8
62- Truls Gardmark, Kenneth Wester , Manuel De Torre, Jörgen Carlsson , Per-Uno Malmström ,
Analysis of HER2 expression in primary urinary bladder carcinoma and corresponding metastases. :
BJU Int. 2005 May;95(7):982-6
63-Rajkumar T, Stamp GW, Pandha HS, Waxman J, Gullick WJ, Expression of the type 1 tyrosine
kinase growth factor receptors EGF receptor, c-erbB2 and c-erbB3 in bladder cancer, Journal of
pathology,vol.179;381-385
64-Eissa S, Ali HS, Al Tonsai AH, Zaglol A, El Ahmady O, HER2/neu expression in bladder cancer:
relationship to cell cycle kinetics. Clin Biochem. 2005 Feb;38(2):142-8
65- Rotterud R, Fossa SD, Nesland JM, Protein networking in bladder cancer: immunoreactivity for
FGFR3, EGFR, ERBB2, KAI1, PTEN, and RAS in normal and malignant urothelium. Histol
Histopathol. 2007 Apr;22(4):349-63
66- Wang SC, Hung MC, HER2 overexpression and cancer targeting.Semin Oncol 2001 Oct;28(5
Suppl 16):115-24
67- Per Larsson , Hans Wijikström, Andreas Thorstenson, Jan Adolfsson , Ulf Norming, Pe Wilklund,
Erik Onelev, Gunnar Steineck, A population-based study of 538 patients with newly detected urinary
bladder neoplasms followed during 5 years. Scand J Urol Nephrol. 2003;37(3):195-201
68- Lindemann-Docter K, Knüchel,Update on urothelial carcinoma histopathology Pathologe. 2008
Sep;29(5):331-8
69- Bartlett J, Mallon E, Cooke T, The clinical evaluation of HER-2 status: which test to use? J Pathol.
2003 Apr;199(4):411-7
70- Sauter G , Lee J, Barttlett JM, Slamon DJ, Pres MF, Guidelines for human epidermal growth
factor receptor 2 testing: biologic and methodologic considerations. J Pathol. 2003 Apr;199(4):411-7
71-Mohammad Reza Jalali Nadushan , Touraj Taheri , Neda Joian, Farid Zaeeri, Overexpression of
HER-2/neu Oncogene and Transitional Cell Carcinoma of Bladder Urology Journal ; vol 4; no3;
summer 2007
72- Ichıya Honma , Noya Masumorı , Eıjı Sato, Akıo Takayanagı, Atsushı Takahashı,Naokı,
Mıtsuharu Tamagawa,Masa-AKI Sato, Taıjı Tsukamoto, Local recurrence after radical cystectomy for
invasive bladder cancer: an analysis of predictive factors.Urology. 2004 Oct;64(4):744-8
73- Peter C.Black , M.D., Piyush K.Agarwall, M.D.,Colin P.N.Dinney,M.D. , Targeted therapies in
bladder cancer-an update , Urologıc Oncology and Original Investigations 25(2007) 433-438
74-John D.Hainsworth, Wayne J, Lennigton,F.Anthony Greco.Overexpression of Her-2 in Patients
With Poorly Differantiated Carcinoma or Poorly Differantiated Adenocarcinoma of Unknown Primary
Site Journal Oncology Vol 18, Issue 3 2000:632
75-Kadir Türkölmez,Hüsnü Tokgöz,Berkan Reşorlu, Kenan Köse, Yaşar Bedük, Muscle-invasive
bladder cancer: predictive factors and prognostic difference between primary and progressive tumors.
Urology. 2007 Sep;70(3):477-81
76- Shahrokh F.Sharaiat, Pierre I.Karakieweicz, Ganesh S.Palapattu, Yair Loatan,Craig
G.Rogers,Gilad E.Amiel , Amnon Vazina Amit Grupta , Patrick J.Bastian, Arthur I Sagalowsky,Mark
P.Schoenberg, P.Lerner , Outcomes of radical cystectomy for transitional cell carcinoma of the
bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol. 2006
Dec;176(6 Pt 1):2414-22; discussion 2422
77- Lucimari Bizari, Ana Elizabete Silva , Eloiza H.Tajara , Gen Amplification in carcinogenezis
,Genet.Mol.Biol.vol.29 no.1 Sao Paulo 2006
78-Hartmann A.Molecular changes in development and progression of urothelial carcinoma Verh
Dtsch Ges Pathol 2003 87:172-84
79-Clinical outcome in patients with locall advanced bladder carcinoma treated with concervative
multimodality therapy .Urology 64: ıssue 3. 488-493 (september 2004)
80-Gandour-Edwards R, Lara PN Jr, Folkins AK, LaSalle JM, Beckett L, Lİ Y, Meyers FJ, DeVere –
White R , Does HER2/neu expression provide prognostic information in patients with advanced
urothelial carcinoma? Cancer 2002 Sep 1;95(5):1009
81-Krüger S, Lange I, Kausch I, Feller AC, Protein expression and gene copy number analysis of
topoisomerase 2alpha, HER2 and P53 in minimally invasive urothelial carcinoma of the urinary
60
bladder--a multitissue array study with prognostic implications. Anticancer Res 2005 JanFeb;25(1A):263-7
82-Wülfing C, Von Struensee D, Bierer S, Bögemann M, Hertle L, Eltze E, Expression of Her2/neu
in locally advanced bladder cancer: implication for a molecular targeted therapy Aktuella Urol 2005
Sep;36(5):423
83-Anne Clairotte MD, Isabelle Lascombe PhD, Slyvie Fauconnet , PhD, Frederıc Mauny , MD, PhD,
Sophie Felix,MD,Marie –Pule Algros , MD,Hugues Bittard ,MD, PhD, Bernadette Kantelip,MD,PhD,
Expression of E-Cadherin and alfa-,beta-,gama catenin in patientes with bladder cancer , Identification
of gama katenin as a New Prognostic Marker of neoplastic progression in T1 süperficial urothelial
tumors,Am J Clin Pathol. 2006 ;125;119-126
84-Z.Latif, A.D.Watters , I.Dunn, K.Grigor, M.A.Underwood , J.M.S.Bartlett, HER2/neu gene
amplification and protein overexpression in G3 pT2 transitional cell carcinoma of the bladder: a role
for anti-HER2 therapy? Eur J Cancer 2004 Jan;40(1):56-63
85- Surendera B. Kolla , Amlesh Seth , Manoj K.Singh,Narmada P. GUPTA, Ashok .Hemal, Prem
N.Dogra , Rajeev Kumar , Prognostic significance of Her2/neu overexpression in patients with muscle
invasive urinary bladder cancer treated with radical cystectomy.Int Urol Nephrol 2008;40(2):321-7
86-Sangeta desai, so dug lim, rafael e jimenez, Thomas chun , Thomas e.keane, jess k.mckeney, angel
zavala-pompa,cynthia cohen, Robert h.young,mahul b.amin,
Relationship of cytokeratin 20 anda CD44 protein expression with WHO/ISUP grade in PTA anda
PT1 papillary urothelial neoplasia Mod Pathol 2000 dec ; 13(12) 1315-23
87-Latif Z,Watters AD, Dunn I, Grigor KM, Underwood MA, Bartlett, HER2/neu overe xpression in
the development of muscle-invasive transitional cell carcinoma of the bladder. Br J Cancer 2003 Oct
6;89(7):1305-9
88-Coogan CL, Estrada CR, Kapur S , Bloom KJ, HER-2/neu protein overexpression and gene
amplification in human transitional cell carcinoma of the bladder. Urology 2004 Apr;63(4):786-90
89-Dara O Kavanagh, Gillian Chambers,Liam O Grady, Kevın M Barry,Ronan P Waldron, Fadel
Bennani,Paul W Eustace and Iqdam Tobbia, Is overexpession of HER2 a predictor of prognosis in
colorectal cancer? BMC Cancer 2009, 9:1
90- Sato K, Moriyama M,Mori S, Satio M, Watanuki T, Terada K, Okuhara E, Akiyama T, Toyoshima
K, Yamamoto, et al, An immunohistologic evaluation of C-erbB-2 gene product in patients with
urinary bladder carcinoma.Cancer 1992 Nov 15;70(10):2493-8
61