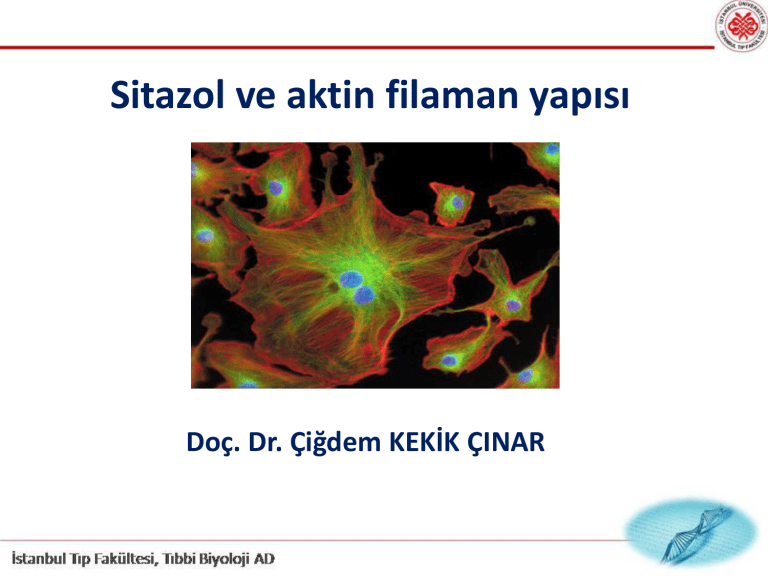
Sitazol ve aktin filaman yapısı
Doç. Dr. Çiğdem KEKİK ÇINAR
Sitoplazma
Organel
Hücre iskeleti
Sıvı
Sitazol
(Şekilsiz temel plazma)
Yarı akışkan, kolloidal sıvıdır.
Çoğunluğu (%90) sudan oluşur.
Geri kalan %10’luk kısmın %90’ı organik, %10’u inorganik
maddedir.
Mitokondri
Golgi kompleksi
Peroksizom
nukleus
Plazma membranı
Ribozom
Endoplazmik retikulum
Kolloidal yapı
Suda çözünmüş inorganik ve organik moleküller içerir.
İnorganik moleküller; asit, baz, tuz
Hücredeki çeşitli moleküllerin yapısına
(C,H,O,N,K,Ca,Mg vb) elementler bulunur.
Organik moleküller; Proteinler, amino asitler
Tüm partiküller hidrofilik özelliktedir.
giren
Sitozol içerisinde hücrenin
şekilli elemanları bulunmaktadır.
1. Hücre iskeleti
2. Organeller
Hücre iskeleti
Hayvan hücrelerinin genel yapısı
Lenfosit
Nöronlar, astrosit
Beyaz Kan Hücreleri
Kırmızı Kan
Hücreleri
Nöronlar
Kalp Kası Hücreleri
Hücre iskeleti,
Hücre şeklini ve sitoplazmanın organizasyonunu belirleyen bir
yapı iskelesi görevi yapar.
Hücre hareketlerinin gerçekleşmesinden sorumludur.
Dinamik bir yapıdır.
Hücre iskeleti, aktin filamanları, ara filamanlar, mikrotübül gibi üç
temel proteinden oluşur. Bunlar bir arada bulunur ve çok sayıda
aksesuar proteinler aracılığı ile hücre içi organeller ve plazma
zarı ile bağlantılıdır.
***Bakterilerde gözlenmez.
HÜCRE İSKELETİ; Karmaşık, protein
filamanları şebekesi
Hücre/çekirdek şeklinin ve yerleşiminin belirlenmesi ve
korunması (elastikiyet, sağlamlılık)
Hücre hareketi (göç, diapedez vb), hücrenin bir bölümünün
hareketi (siliyum, kuyruk vb)
Fagositoz, endositoz, ekzositoz
Sitokinez
Hücre içi taşıma
Kasılma
Hücre-hücre ve hücre-matriks ilişkilerini destekleme
Hücre İskeleti
İlk olarak artefakt zannedilmiş
100 farklı protein
Plazma membranına bağlı
3 filaman sistemi
Mikrotübüller (25 nm)
Intermediate (ara) filamanlar
(10 nm)
Mikrofilamanlar –Aktin
filamanlar (5-7 nm)
Hücre İskeletinin Temel Elemanları
MİKROFİLAMANLAR
(7 nm)
• Aktin (F ve G)
MİKROTUBULLER
(25 nm)
• Tubulin (alfa, beta, gamma)
ARAFİLAMANLAR (IF)
(10nm)
•Keratinler
•Nörofilaminler
•Vimentin
•Desmin
•GFAP
•Laminler
•Nestin
•Periferin
Mikrofilamanlar
Mikrotubuller
Hücre içi hareketten
sorumludurlar
Intermediate (ara)
Filamanlar
Yapısal destek
sağlarlar
Aktin filamanlar
(Mikrofilamanlar)
Mikrotubuller
İntermediate
filamanlar
Hücre
iskeletini
oluşturan üç
protein
filaman
ARA ÇAPLI FİLAMANLAR
MİKROTUBULLER
AKTİN FİLAMANLAR
Aktin filamanlar kırmızı, mikrotubuller yeşil ve nukleus
mavi
Hücre Hareketi
Ameboid hareket
Sol-jel geçişi
Lamellipod
Filopod
Özelleşmiş Yapılar
Silya
Flagella
Kas
Aktin-miyozin etkileşimi
Hücre iskeleti elemanları
Hücre iskeletini oluşturan filamanların her biri identik
protein moleküllerinin polimerleşmesi sonucunda oluşur.
Filamanların üç tipi de kendi kendilerine hücreye şekil
yada güç veremezler.
Fonksiyonları kendilerine bağlı motor proteinler aracılığı
ile gerçekleşir.
Bütün bu sitoiskelet elemanları aksesuar proteinlerle etkileşim
halindedirler.
Bu proteinler; filamentlere yada alt ünitelerine bağlanır.
Filamentleri birbirine, organellere yada plazma membranına
bağlar.
Aktin filamanlar
(Mikrofilamanlar)
Mikrofilamentler; (7-9 nm)
AKTİN
Globüler yapısal bir proteindir.
Ökaryotlarda en çok bulunan hücre içi proteindir.
43 kD ağırlığında ve yüksek oranda korunmuştur.
Hücreye mekanik destek sağlar.
Hücre hareketinde rol oynar (lamellipod,filopod).
Hücre bağlantılarında rol alır (fokal adezyon).
Kas hücrelerinde miyozinle birlikte kontraksiyonu sağlar.
İnsan ve hayvan hücrelerinde altı farklı aktin izoformu
tespit edilmiştir:
Doku /hücre tipi
Aktin tipi
İskelet kası
α-iskeletal
Kalp kası
α-kardiyak
Damar sistemi düz kaslar
α-vasküler
İç organlardaki düz kaslar
γ-enterik
Kas dışı hücreler
β-sitoplazmik
Kas dışı hücreler
γ-sitoplazmik.
Aktin polimerizasyonu
Her monomer 1660 açı ile bağlandığı için 37nm’de bir sağa
dönüm yapar.
(+) uç
Birleşme yönüne
polarize olur.
(-) uç
göre
(-) uç nispeten daha yavaş,
(+) uç daha hızlı büyür.
Kısa, ince ve bükülebilir
özelliklidir.
(+)
(+)
(+)
(-)
(-)
(-)
POLİMERİZASYONU ETKİLEYEN FAKTÖRLER
Mantar toksinleri
Latrankulin: G aktine bağlanıp filamente eklenmesi önlenir.
Sitokalasin B: + uca bağlanarak polimerizasyonu engeller.
Amanita Phaloidin: F-aktine bağlanır. Yeni alt ünitelerin
bağlanmasını bloke eder. Depolimerizasyonu engeller.
Proteinler
Kofilin: F aktin’de - uçtaki ADP-aktinlere bağlanıp ayrışmasını
sağlar. Ayrıca filamenti 2’ye bölerek daha fazla + uç oluşumuna
neden olur.
Profilin: ADP-G aktine bağlanır ve ATP-G aktine dönüştürür.
Polimerizasyona katılır.
Timosin β4: ATP-G aktine bağlanarak polimerize olmalarını
inhibe eder.
Cap Z: Dimer yapıdadır. + uca bağlanıp yeni monomer
eklenmesini önler. Etkisi PIP2 ve diğer + uç proteinlerince
baskılanır.
Tropomodülin: - uca bağlanarak ayrışmayı önler.
Gelsolin: Yüksek Ca’da + uca bağlanır. Filamenti kırar,
depolimerizasyona neden olur.
2 sınıf protein, sinyal iletimi kontrolünde nükleasyonda görev alır.
Formin
FH1 ve FH2 domainlerinden oluşur. 2 FH2 halka şeklinde birleşir ve
filament + ucuna bağlanır. Monomer bağlanmasına olanak sağlar.
FH1 domaini, prolince zengindir ve Profilin bağlanma bölgesi
oluşturur. Formin N ve C ucu üst üste katlanınca inaktif haldedir.
Zara bağlı Rho (GTPaz) ile aktive olur. GTP-Rho, forminin RBD’e
bağlanır ve aktifler.
Nüve oluşumu
Stres lif oluşumu
Kasılabilir halka oluşumu
ARP2/3
Öncü uç oluşumunu sağlar. 7 alt üniteden oluşur. 2’si aktin bağlama
bölgesidir. Filamente Arp2/3 kompleksi bağlanarak + uca benzer
yapı oluşturur ve ATP-G aktin bağlar. Eski ile yeni filament arasında
700 vardır. WASP (Wiskott-Aldrich Send proteini) ve Cdc42 (GTP bağlı
protein) ile aktive olur. Arp2/3 için bağlanma bölgesi oluşturur.
Aktin bağlayıcı proteinler
Aktine çapraz bağlanarak
organizasyonunu sağlarlar.
kortikal
filamanların
1.Demetleyici proteinler; fimbrin ve α-aktinin
Filamanların aynı yönde düzenlenmelerini ve paralel
sıralar oluşturmalarını sağlarlar.
10-20 nm
Fimbrin
α-aktinin
30-60 nm
2. Jel oluşturan proteinler; Filamin, Spektrin
Aktin filamanların gevşek, jel benzeri organizasyon
oluşturmasını sağlarlar.
Filamin
Stres lifi
Kontraktil demetler
(α-aktinin)
Hücre korteksi
Jel benzeri ağ
(filamin)
Filapod
Paralel demetler
(fimbrin)
Tüm ökaryotik
filamanları taşırlar.
hücreler
aktin
Hücrede hem stabil,
Mikrovilli
Kas hücresi kontraktil apereyi
Hem de labil yapılar
bunurlar;
İnvaginasyon
Lamellipod
Kontraktil halka
halinde
Kas hücresi kontraktil apereyi
Z
diski Aktin filaman
M çizgisi Miyozin
Sarkomer
MİKROFİLAMENTLERİN FONKSİYONLARI
Hücre membranı ile aktin filamentleri ilişkisi
1) İntegrinler ile adezyon plaklarında
matriks - hücre bağlantısı
2) Kaderinler ile bağlantı komplekslerinde
Hücre- hücre bağlantısı
Sitokinez (myosin II+Aktin )
Vezikül transpotu
Aktin filamentleri boyunca Miyosin I ve 5 ile.
Hücre hareketi
örn: Fibroblast
Filopod — parmak şeklinde çıkıntı oluşumu
Lamellipod — yaprak şeklinde uzantılar
Mekanik destek ve gerginlik
-Stres fibrilleri
Yarıklanma bölgesi
Mikroflamanlardan oluşan
kontrktil halka
Mitoz bölünmede
Sitokinez aşamasında
Yavru hücreler
Eritrositlerde plazma zarının altında bulunan
Periferal mambran proteinleri
kortikal hücre iskeletinin bileşenleri
olarak davranırlar.
Eritrosit membranlarında aktin-spektrin bağlantısı
α - aktinin
Aktin
filament
Vinkulin
Paksilin
Protein
kap /Z
başlığı
Talin
Sitozol
Hücre membranı
İntegrin (fibronektin
reseptörü)α/β alt üniti
Fibronektin
Ekstrasellüler matriks
Aktin filamentlerinin hücredeki yerleşimi
Labil Yapılar;
1- Hücre Korteksinde
2- Hücre adezyon kemerlerinde
3- Stress fibrilleri
4- Kotraktil halka
Stabil yapılar;
1-Mikrovillus yapısında
2- Sarkomerde
Mikrofilaman motorlar
Miyozin
Kas hücreleri
Kas olmayan hücreler
Hareketli bir başı olan büyük protein
Baş
Boyun
Kuyruk
Miyozin I
Kalmodulin hafif zincir
Miyozin II
Esas hafif zincir
Düzenleyici hafif zincir
Miyozin V
Kalmodulin hafif zincirler
Sınıfı
Adım boyutu
Fonksiyonu
Zara bağlı,
Endositoz
10-14 nm
I
(-)
(+)
(+)
(-) (-)
(+)
5-10 nm
II
Kontraksiyon
(+)
(-) (-)
(+)
Vezikül
V
36 nm
Organel
transportu
(-)
(+)
Miyozin motor proteinleri
Miyozinler genellikle aktinin (+) ucuna doğru hareket
ederler.
Miyozin VI farklı olarak (-) uca doğru hareketi sağlar.
Herediter Sferositoz
Otozomal dominant bir hemolitik bozukluk
Primer defekt, lipid memebranın kaybı
Lipid
membranı
destekleyen
iskelet
proteinlerindeki genetik defektler membran
kaybından sorumludur.
Membranlarını kaybeden hücreler giderek
küreselleşir ve esnekliğini kaybeder
Amasya
Teşekkürler...






![(Microsoft PowerPoint - M\335YOKARDIN YAPISI [Uyumluluk Modu])](http://s1.studylibtr.com/store/data/000940173_1-fe572bf26229e6f02435f270a825d565-300x300.png)