Dr. VURAL ve Arkadaşları / Tci Heratmate
KALICI AMAÇLI SOL VENTRİKÜL DESTEK CİHAZLARI:
TCI HEARTMATE® VE
PERMANENT LEFT VENTRICULAR ASSIST DEVICES: TCI HEARTMATE® VE
Dr. M. Kerem VURAL, Dr. Mehmet C. ÖZ
Cardiothoracic Surgery Department, College of physiians and Surgeons, New York, NY 10032, U.S.A.
Adres: Doç. Dr. Kerem VURAL, N. Tandoğan Caddesi 5/6, 06540, Kavaklıdere-ANKARA
e-mail: kvural¹tr-net.net.tr
Giriş ve Kısa Tarihçe
Amerika Birleşik Devletleri’nde azami tıbbi tedaviye cevap
vermeyen kalp yezmezliği yılda yaklaşık 60.000-70.000
vakada görülmektedir (1). Halen yılda 20-25 bin civarında
hastaya kalp transplantasyonu gerekirken ancak 2500’ine
transplantasyon yapılabilmektedir (2). Bu tablo, alternatif
tedavi metodlarına yönelme gereği yanında hastaların
transplantasyon için sıra beklerken yaşatılabilmelerini
gerektirmiştir. Günümüzde uzun süreli yatak istirahati tıbbi ve
ekonomik yönlerden istenmeyen sonuçlar getiridiği için
kronik kalp yetmezliğinin tedavisinde istenmemektedir (3).
Uzun süreli dolaşım desteği sağlamaya yönelik sol ventrikül
destek cihazları (LVAD), kalbin yükünü çok daha etkin bir
biçimde üzerinden alarak hastayı yatağa bağlamaktan
kurtarmakta, aktif bir yaşam imkanı verirken, kalbe uzun
süreli yatak istirahatinin veremeyeceği önemli bir istirahat
süreci sağlamaktadır. Ayrıca, hastalara bir transplantasyon
olanağı sağlanıncaya kadar yaşamı sürdürmeyi ve kalp
yetmezliğinin organlar ve sistemler üzerindeki bozucu
etkilerini düzeltmeyi amaçlamaktadır. Alternatif olarak, bu
cihazların kalıcı amaçlı implantasyonlarının uygunluğu
araştırılmaktadır. 1985’de HeartMate (Thermo Cardiosystems,
Inc, Woburn, MA) sol ventrikül assist cihazı, transplantasyona
köprüleme (bridging) amaçlı kullanım için klinik
araştırmalarda kullanılmak üzere Food and Drug
Administration (FDA)’dan onay almıştır. Bu amaçla ilk kez
kullanımı 1986’da gerçekleşmiştir. İlk başlarda takılan
HeartMate’ler pnömatik bir güç kaynağı kullanan IP modelleri
idi. Bunlarda cihaz bir hat ile hastanın yanıbaşında bulunan ve
tekerlekli bir araba üzerinde taşınan bir pnömatik konsola
bağlıydı ve hastanın mobilizasyonu ileri derecede
kısıtlanmıştı. 1990 yılında kullanıma giren, elektrikle çalışan
ve gücünü hastanın belinde taşıdığ küçük elektrik
bataryalardan alan “vented electric” (VE) modeli ile bu
anlamda önemli bir ilerleme sağlanmıştır. Baştan beri uzun
süreli implantasyon için dizayn edilmiş olan bu cihazın,
geçtiğimiz yıllarda, transplantasyona köprü olarak değil, kalıcı
amaçlı kullanımının uygunluğunu araştırmak için bir çalışma
başlatılmıştır (4,5).
Cihaz ve Özellikleri
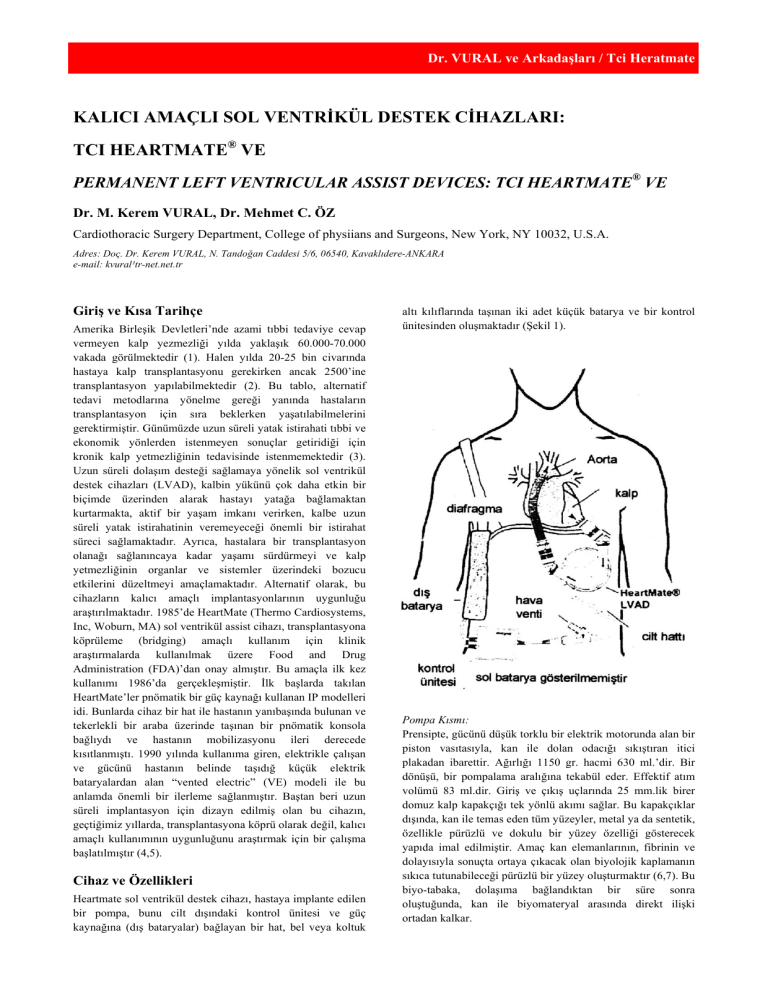
Heartmate sol ventrikül destek cihazı, hastaya implante edilen
bir pompa, bunu cilt dışındaki kontrol ünitesi ve güç
kaynağına (dış bataryalar) bağlayan bir hat, bel veya koltuk
altı kılıflarında taşınan iki adet küçük batarya ve bir kontrol
ünitesinden oluşmaktadır (Şekil 1).
Pompa Kısmı:
Prensipte, gücünü düşük torklu bir elektrik motorunda alan bir
piston vasıtasıyla, kan ile dolan odacığı sıkıştıran itici
plakadan ibarettir. Ağırlığı 1150 gr. hacmi 630 ml.’dir. Bir
dönüşü, bir pompalama aralığına tekabül eder. Effektif atım
volümü 83 ml.dir. Giriş ve çıkış uçlarında 25 mm.lik birer
domuz kalp kapakçığı tek yönlü akımı sağlar. Bu kapakçıklar
dışında, kan ile temas eden tüm yüzeyler, metal ya da sentetik,
özellikle pürüzlü ve dokulu bir yüzey özelliği gösterecek
yapıda imal edilmiştir. Amaç kan elemanlarının, fibrinin ve
dolayısıyla sonuçta ortaya çıkacak olan biyolojik kaplamanın
sıkıca tutunabileceği pürüzlü bir yüzey oluşturmaktır (6,7). Bu
biyo-tabaka, dolaşıma bağlandıktan bir süre sonra
oluştuğunda, kan ile biyomateryal arasında direkt ilişki
ortadan kalkar.
Böylece embolizasyon ihtimali en aza, infeksiyon ajanlarının
kolonizasyonuna direnç de azamiye çıkarılmış, lumene
sarkmayan, disseke ve embolize olmayan, flepleşmeyen bir
tabaka elde edilmiş olur (8). Dolaşım taklit eden düzenekler
kullanılarak, genetik yöntemlerle bu hücre katmanının cihazın
implantasyonu öncesinde oluşturulmasına çalışılmaktadır
(9,10).
Driveline Hattı:
Pompa ünitesi, ciltten dışarıya uzanan bir koaksiyal
elektrik/vent hattı ile belde taşınan küçük bir kontrol ünitesine
bağlanmıştır. Hat, vücut dışına çıkınca ikiye ayrılır; bunların
biri kabloları kontrol ünitesine taşır, diğeri de dış ortamdan bir
filtre ile korunmakta olan hava hattına gider. Hava hattı,
pompada pistonun arkasında birikecek havayı vent etmeyi ve
acil durumlarda bir el pompası ya da pnömatik konsol
takılabilmesini sağlar.
Kontrol Ünitesi:
Pompanın çalışma modunun seçilmesini, sistemin kontrolünü,
gereğinde de yedek sistemlerin devreye girmesini sağlar.
1. Sabit atım modunda (Fixed rate Mode) cihaz, 50-120 bpm
arasındaki bir sabit atım sayısında çalışarak belli bir debi
sağlar.
2. Auto Modu ise, kardiyak debiyi maksimize etmek amacıyla
kullanılır. Burada pompa 76 ml.’ye dolana kadar bekler ve
ancak o zaman enjeksiyona müsaade eder.
3. Rate Control Modu. Bataryaların takati azaldığında,
elektriksel iletim sorunları yaşandığında veya kontrol
ünitesinin bozulduğu hallerde devreye giren ve olağanüstü hal
giderilene kadar bazal şartlarda da olsa pompalamanın
idamesini sağlayan bir grup programdan ibarettir.
Bataryalar:
Şarj edilebilir bataryalar 4-6 saat dayanır. Her hastaya 8 pil
verilmekte, bunların ikisi belde taşınmaktadır. Geceleri hasta
güç konsoluna bağlanır, bu esnada tüm bataryalar şarj edilir.
Günümüzde belde taşınabilir olan bu bataryalardan daha
küçük, hafif ve kapasiteli yeni hidrojen hücreli güç kaynakları
üzerinde çalışmalar sürmektedir (11).
Endikasyonlar
Dolaşım destekleyici aygıtların kullanım alanlarından en
önemli üç tanesi şunlardır:
1. Açık kalp cerrahisi sonrası akut gelişen ve hastanın kaybo
ile sonuçlanabilen “postcardiotomy failure”ın tedavisinde (12)
veya kardiyojenik şokta (13).
2. Kalp nakli öncesi uygun kalp bulunana kadar hastayı
hayatta tutmak üzere akut veya kronik son dönem kalp
hastalığında (bridging to transplantation) (14). Bugün
HeartMate ve benzeri cihazların en önemli kullanım alanı
budur.
3. Halen sürdürülmekte olan çalışmalar neticesinde kalp
yetmezliğinin akut ya da kronik formlarının tedavisinde kalıcı
implantasyon
(15-17).
En eski LVAD kullanım
endikasyonlarını belirleyen Norman Kriterleri’nden bu yana,
endikasyonlar önemli derecede esneklik kazanmışsa da,
hastanın maksimum inotropik ilaçlar ve intra aortik balon
desteğine rağmen kardiyak indeksinin 2 lt/dk/m2’nin altında,
pulmoner kapiller wedge basıncının 20 mmHg’nın üzerinde,
kan basıncının 80 mmHg’dan düşük seyretmesi LVAD
implantasyon için endikasyon oluşturur (18).
Kontrendikasyonlar
1. Vücut yüzey alanı 1.5 m2’nin altında olmamalı, tercihen 1.8
m2 üzerinde olmalıdır. Çünkü:
a) Cihazın implante edilebileceği yeterli yere ve çevre destek
dokusuna ihtiyacı vardır.
b) Cihaz, daha küçük vücutlarda, daha düşük debi ile
çalışacağından akım yavaşlar, pıhtılaşmaya meyil olur.
2. Hastada aort yetmezliği olmamalıdır. Katastrofik
sonuçlanır. Bu durumda sirküler akım denilen durum ortaya
çıkar. LVAD tarafından aortaya pompalanan kan, yetmezlikli
kapaktan tekrar sol ventriküle döner, oradan tekrar pompalama
odacığına alınarak yine aortaya pompalanır. Eğer hastada
önceden aort yetmezliği varsa kapak dikilir. Aort stenozunda
ise embolizasyon riski artmaktadır. Daha önceden takılmış
mekanik aort kapağı varsa, kapak trombozuna ve embolizme
neden olacağından bir patch ile kapatılmalıdır (19); biyoprotez
ise olduğu gibi bırakılabilir.
3. Hastada iskemik kalp hastalığı varsa, LVAD implantasyonu
sonrası iskemi ve angina devam edebilir. Daha önemlisi bu
iskemi sağ ventrikülü de ilgilendiriyorsa, çalışması için sağ
kalbin iyi çalışmasına güvenen LVAD başarısız olabilir. Daha
önce yapılmış bypass greftleri korunmalı, özellikle sağa ait
greftler gerekirse yenilenmelidir. Böylece hem sağ ventrikülün
pompa fonksiyonu gözetilmiş, hem de aritmilerin iskemik
kaynaklı olanları için önlem alınmış olur (20). Myokard
infarktüsü sonrası ventriküler septum yırtıklarında, septum
onarımı ve LVAD implantasyonu sonrasında, sekonder
yırtıkların gelişebileceği ve bu durumun önemli desatürasyon
sonucu
serebral
anoksiye
bağlı
ağır
nörolojik
komplikasyonlarla fatal sonuçlanabileceği bildirilmiştir (2).
4. Bunun dışında kronik obstrüktif akciğer hastalığı, ciddi
periferik damar hastalığı (acil müdahale veya reoperasyonda
femoral kanülasyon yapılmasında sorun yaratacağı için), kan
diskrazileri ve psikiyatrik sorunlar da (bu hasta grubunda
depresyonun yaygın olması ve hastanın cihazı durdurarak
kolaylıkla intihar edebilmesi nedeniyle) istenmeyen
patolojilerdir.
Hasta Seçimi ve Risk Faktörleri
Mortalitenin en önemli sebebi hasta seçimidir. LVAD
adayları, bırakıldıkları taktirde ölecek çok ağır hastalar
olduklarından, negatif seçim kriterleri oldukça esnek
tutulmuşsa da, yine de mortalite ve morbiditeyi artıran bazı
risk faktörlerinin hatırda tutulması gerekir (22):
1. İdrar çıkışının 30 ml/saatin altında olması önemli risk
faktörüdür. Kreatinin < 5 mg/dl olmalıdır. İmplantasyon
sonrası yoğun bakım dönemini komplike etmesi ve
retansiyona uğramış sıvının atılmasını engellemesi yanında,
end-organ hasarına da işaret edebilir. Ancak kardiyojenik şoka
bağlı prerenal bir oligüri, LVAD implantasyonunu takiben
düzelebilecektir. Postoperatif dönemde erkenden diyalize
(CAVH: Continuous Arterio-venous Hemodialysis)’e
geçilmesi önerilmektedir (23). Preoperatif diyalize gerek
yoktur.
2. Santral ven basıncının daha başlangıçtan yüksek olması,
LVAD implantasyonunun hemen çıkışında daha da artacağı ve
sağı şişireceği için sakıncalıdır.
3. Mekanik ventilasyona ameliyat öncesi dönemde bağımlılık,
pulmoner dolaşımın önünde engel oluşturacaktır. LVAD’ın
doluşu pulmoner dönüşe dayanmaktadır.
4. Protrombin zamanı 16 sn. üzerinde ve medikal girişimlerle
düzelmiyorsa, LVAD sonrası zaten beklenen koagülopati ve
medikal cerrahi kanamanın boyutlarını ve riskini fazlasıyla
artırır. Ayrıca karaciğer fonksiyonlarının iyice kötülediğine ya
da sağ kalp yezmezliğinin ileri bir aşamada olduğuna işaret
edebilir.
5. Reoperasyon: Sternal re-entry riskleri ve diğer tüm
reoperasyon risklerini taşımaktadır. Eski bypass greftleri,
özellikle sağa ait olanlar hem pompa fonksiyonları, hem de
iskemik aritmilerin önlenmesi açısından korunmalıdır.
Reoperasyon LVAD implantasyonunu zorlaştırır.
6. İnfeksiyon: Lökositoz (15.000 ve üzeri) ile vücut ısısının
38.5 °C’nin üzerinde olması risk faktörüdür denilse de, yine de
sadece perioperatif dönem için ateş tek başına önemli değildir.
Zaten LVAD adayı hastaların 1/3’ü ameliyatta ciddi
infeksiyonla gelmektedir. Eğer infeksiyonun sebebi ve
kaynağı biliniyorsa, implantasyonun gecikmeden yapılması
savunulmaktadır. Aksi taktirde hasta zaten kaybedilecektir.
Preoperatif dönemde tespit edilen bu infeksiyonların nispeten
benign seyrine karşın, postoperatif dönemde ortaya çıkan
infeksiyonlarda tablo karanlıktır.
7. Bundan başka preoperatif bilirubin yüksekliği, preoperatif
ECMO gereksinimi ve implantasyon öncesi pulmoner basınç
düşüklüğü de risk faktörleri arasındadır (24).
yavaş yavaş ejeksiyona başlatılır. Daha sonra elektriksel güç
ünitesi ve kontrol modülüne bağlanır. Rutin intraoperatif
transözofageal ekokardiyografi LVAD implantasyonunda
vazgeçilmez bir yardımcıdır. Inflow kanülün uygun
pozisyonda yerleştirilip yerleştirilmediğini, pompa çıkışında
kalpte rezidüel hava kalıp kalmadığını, aort yetmezliği,
triküspit yetmezliği, patent foramen ovale gibi farkedilmediği
taktirde LVAD implante edilmiş bir hastada kötü sonuçlara
neden olacak durumların bulunup bulunmadığı hakkında
değerli bilgiler verir. İşlemin herhangi bir aşamasında
defibrilasyon gerekirse, kontrol ünitesi ve batarya cihazından
ayrılmalıdır.
Eksplantasyon:
Transplantasyon sırası geldiğinde veya infeksiyon gibi bir
nedenle LVAD’nin çıkarılması gerektiğinde, nadir olarak da
sol ventrikül fonksiyonlarının LVAD desteği olmaksızın idare
edebilecek kadar düzeldiği durumlarda yapılır. Eksplantasyon
için cihazın üzeri açılır, grefti izleyerek ve hep greftin
üzerinden gidilerek serbestleştirme yapılır. Genellikle
eksplantasyonu transplantasyon takip eder. Bazen uzun süreli
istirahat ile kısmen toparlamış olan bu hasta kalpler,
eksplantasyon sonrası kendi başına idare edebilecek kadar iyi
bir performans gösterebilirler. Örneğin bir hastaya
transplantasyon yapılırken cihaz kapatılarak gözlenmiş ve
ventrikül fonksiyonları yeterli bulunarak transplantasyondan
vazgeçilmiştir. Hasta 6 ay oldukça iyi durumda yaşamış ancak
9. ayda birdenbire kaybedilmiştir. Eksplantasyon sonrası 2 yıl
yaşayanlar vardır. Bu kalplerin LVAD ile bir süre
dinlendirildiklerinde normal basınç-volüm eğrisi paternine
geri döndükleri, reverse remodellinge uğradıkları ama sonra
zaman içinde tekrar bozuldukları izlenmiştir (27).
İmplantasyon
Pompa ünitesi, diafragma altında preperiotenal (periton dışı)
veya abdominal (periton içi) olarak implante edilir. Her iki
yaklaşımın da savunucuları vardır. Preperitoneal yerleştirmede
cep seroması veya hematomu, bunun infekte olması ile de
sepsise bağlı multi-organ yetmezliği (MOF) olabilmektedir.
İntraperitoneal yerleştirmede ise abdominal komplikasyonlar
(barsak adezyon ve perforasyonu, barsak ve mideye bası
sonucu erken doyma, yapışmalar, diafram herniasyonları vs.)
gelişebilmektedir (25). Bu gün için tercih edilen, preperitoneal
implantasyondur. Acil bir gereksinim yoksa, pompa ünitesinin
yerleştirileceği cep, hasta heparinize edilmeden önce karın ön
duvarının üst-sağ kadranında koterle açılarak hazırlanmalıdır.
Driveline hattı ise sol alt kadrandan çıkartılır.
Heparinizasyondan sonra median sternotomiyi takiben
kanülasyon (aorta ve sağ atriumdan) yapılıp kardiyopulmoner
bypassa girilir. Tam doz aprotinin kullanılması önemle tavsiye
edilmektedir (26) Sol ventrikül apeksinden bir vent sokulur ve
kros-klemp veya kardiyopleji kullanmaksızın cihaz dolaşıma
implante edilir. Inflow kondisi sol ventrikül apeksine teflon bir
kaf ve plejitli suturler konularak tutturulup, diafragmada
açılan bir delikten geçirilerek preperitoneal cepten pompaya
ulaştırılır. Outflow kondui vazifesi gören dakron greft ise,
heparinsiz kanla muamele edildikten sonra, çıkan aortanın sağ
yanına uç yan olarak anastomoz edilir. Cihazın bağlantıları
fibrin glue ile izole edilir. Kalp doldurulurken hasta
Trendelenburg pozisyonuna alınarak el pompası ile LVAD
LVAD Fizyolojisi
HeartMate® VE, 15 mmHg doluş basıncında ve dakikada 120
atım ile, 10 lt/dak.’lık kan debisi, ortalama 120 mmHg arteriel
basıncı sağlayabilmektedir. Cihaz bir sol ventrikül destek
cihazından fazla olarak, gerektiğinde ventrikülün tüm yükünü
üzerine alabildiğinden “suni bir sol ventrikül” olarak
düşünülmesi daha uygun olur. Pulsatil akım sağlayan pompa,
kalp ile paralel çalışmaktadır. Bu sayede gerek sol ventrikül,
gerekse LVAD birbirini bloke etmeksizin aortaya kan
pompalayabilirler. Hasta egzersiz yapmadığı sürece genellikle
aortik kapak açılmaz. Egzersiz gibi venlerin konstrikte olup
kan dönüşünün artarak end-diastolik volümü artıracağı
hallerde aort kapak açılır ve hastanın kalbi bir miktar ek debi
sağlayabilir. Pompa pasif olarak dolmaktadır. Yani preloadbağımlıdır; sağ ventrikül fonksiyonları ve pulmoner dönüşün
yeterli olmasına gereksinim duyar. Bu yüzden kombine output
(LVAD + sol ventrikül) asla sağ ventrikül outputunu atamaz.
Cihaz sağ ventrikülü doğrudan desteklemediği halde, sol
ventriküle verdiği destek nedeniyle sağ ventrikülün önündeki
basınç yükünü azaltacağından, sağ ventriküle de bir dereceye
kadar dolaylı bir destek sağlamış olur (28). Cihaz preload
bağımlı olduğundan, özellikle ilk günlerde sağ ventrikül ve
pulmoner dolaşımın intakt olması gerekmektedir. İlk 3-4
günde gelişen ventriküler fibrilasyonu sağ kalbi devre dışı
bırakacağından hastalar bunu tolere edemezler ve müdahale
edilmesi gerekir.
Ama implantasyondan yaklaşık 3-4 hafta sonra pulmoner arter
basıncı düşeceği için, bu dönemden sonra gelişebilecek
ventrikül fibrilasyonuna daha kolay adapte olurlar. Kalp fibrile
olursa, sağ ventrikül devre dışı kalır ve Fontan tipi
sirkülasyona benzer prensiplerle dolaşım sürer. İmplantasyon
sonrası dönemde akut miyosit hasarı gibi histolojik
parametrelerde gerileme (29), patolojik remodellingde geriye
dönüş (30) ve epinefrin ve norepinefrin gibi nörohormonların
düzeyinde azalma gözlenmektedir (31). Plazma volümü
azalmaktadır. Renal perfüzyon arttığından fazla sıvı vücuttan
atılmakta, sağ ve sol atrial basınçlarla pulmoner arter
basıncındaki azalmalar sayesinde plazma renin aktivitesi,
aldosteron ve ADH regülatuar sistemlerinin etkinliği
gerilemektedir. Plazma renin aktivitesinin LVAD sonrası
persistansı ise kötü prognoza ve mortaliteye işaret etmektedir
(32).
LVAD İmmunolojisi
Tıpkı kardiyopulmoner bypass gibi, LVAD’de vücutta
immunolojik ve humoral mekanizmalar tetikler. Sonuçta
protrombotik, prokoagülan ve proinflamatuar bir ortam
meydana gelir. Hastalarda kısmi bir DIC beklenir. Bu durum
implantasyon sonrası erken dönemde kanamaların fazla
olmasının başlıca nedenidir. Trombotik aktivite sürer ve
fibrinoliz gelişir (33). Ancak bu fibrinoliz cihazın içinde
pseudointima oluşumu ile ilgili gibi görünmektedir (34).
Normalde sıfır olması gereken makrofaj prokoagülan
aktivitesinde LVAD’li hastalarda yükselme saptanmıştır. AntiHLA antikorlar, konjestif kalp yetmezlikli hastalarda %4 iken
LVAD implante edilen hastalarda %47’ye yükselmektedir.
Bunlar, ileride transplantasyon sonrası red ihtimalini
artırabilecek panel reaktif antikorların düzeyinde artışın
habercisidirler (35). Antifosfolipid antikorlar LVAD’lilerin
%43’ünde gelişmektedir. Koagülasyon kaskadında bifazik
aktivasyon olur. Burada erken pik, kardiyopulmoner bypass ve
LVAD implantasyonuna aittir. Geç olan ve daha uzun süre
devam eden pik ise, cihazın iç yüzeyini kaplayan fibrinli
tabakada immun potansiyelli hücre populasyonunun yerleşip
büyümesi sonucu meydana gelmektedir. Bu yüzey selektif
olarak dendritik (VWB, TM, CD34) ve monositik (CD68,
CD14) hücreleri tutar ve bunlar cihaza yerleşip aktive olurlar.
Aktivasyona uğrayan bu hücreler önemli miktarda IL-1b, IL2,6,8, TNF, TF üretirler (36). Yüzeylerinde lökositler için
adezyon reseptörleri olan ICAM, VCAM, E-selectin gibi
molekülleri oluştururlar. Bu durum, duyarlı bazı hastalarda Tlenfositleri (CD2,3,25) ile LVAD yüzey hücreleri arası
etkileşim sonucunda
a) Otoimmuniteye
b) B-lenfosit (CD20) hiperaktivitesine neden olabilir. CD4
T-lenfosit populasyonunda apoptoza bağlı daimi bir gerileme olmaktadır (37). LVAD hücreleri, bunun dışında
Nükleer Transkripsiyon Faktörü – KB (NF-KB) de
içermektedirler. Günde 80 mg asetil salisilik asit (ASA)
verilmesi ile bu faktörün aktivasyonu önlenmektedir.
LVAD implantasyonunun ilk 3 günü içinde peroral veya
rektal yolla başlanırsa, prokoagülan özelliğe sahip TF
gibi substansların üretimi engellenir, CD68 makrofaj aktivasyonu önlenir, VCAM-1 ekspresyonu, T ve B hücrelerinin istenmeyen etkileşimlerinin önüne geçilmiş olur.
Sonuçta makrofaj prokoagülan aktivasyonu azalır.
Hastaların ileriki bir transplantasyon şansını önemli
ölçüde etkileyecek olan panel reaktif antikorlar (PRA),
ASA uygulamasıyla %10’un altında kalır.
Erken Dönemde Hasta Bakımı ve Sorunları
Perioperatif bakım döneminde özellik arz eden noktalar
şunlardır:
Transfüzyon:
Kan ürünleri mutlaka verilecekse, donör spesifik antijenle ön
teması azaltmak için filtreden geçirilerek verilir. Kanamanın
sitokin ve tromboksan aracılıklı yollarla pulmoner rezistansı
artıracağı, daha çok kanamaya ve sağ kalp yetmezliğine
meyile neden olacağı akıldan çıkarılmamalıdır.
Hipotansiyon:
LVAD implantasyonunu takiben septik şoktaki gibi, sebebi
bilinmeyen bir periferik vazodilatasyon ve şok tablosu
gelişebilmektedir. Katekolamin pressörlere pek cevap vermez.
Ayrıca, bunların endorgan hipoperfüzyonu, aritmi,
insensitivite gelişimi gibi dezavantajları vardır. Bu durumda
volüm yüklenir.
Katekolamine dirençli bu tip hipotansiyonu olan hastalarda
arginin vazopressin 0.04U/dk gibi düşük dozlarda çok etkilidir
(38).
Atriyal Fibrilasyon:
Sağ kalp fonksiyonlarını bozar, engeller. LVAD takılmış
hastalarda atrial fibrilasyon gelişirse antikoagülasyon
uygulanmaz, çünkü uzun dönemde karaciğer konjesyonu ve
koagüloati beklenmektedir. Atrial fibrilasyon amiodaron gibi
farmakolojik müdahalelerle çevirilmeye çalışılır.
Ventrikül Aritmileri:
İlk 3-4 günde gelişen ventriküler fibrilasyonu sağ kalbi devre
dışı bırakacağından hastalar bunu tolere edemezler ve
müdahale edilmesi gerekir. Ama implantasyondan yaklaşık 34 hafta sonra pulmoner arter basıncı düşeceği için, bu
dönemden sonra gelişebilecek ventrikül fibrilasyonuna daha
kolay adapte olurlar. Bunun dışında, LVAD ile kombine
olarak
implante
edilebilir
kardiyoverter-defibrilatör
yerleştirilmesi deneyimleri de bildirilmiştir (39).
Antimikrobiyal Profilaksi:
Güçlü anti-fungal ve anti-stafilokoksik proflaksi esastır.
Proflakside genellikle tercih edilen, vankomisin + aztreonam +
flukonazol üçlü kombinasyonudur. Mantar infeksiyonu
gelişirse amfoterisin kullanılır. Hattın vücuda girdiği yer, doku
ile kaplanana kadar, çıkış yerine klorhekzidin, sonra silverdin
ile muamele edilir. İntravasküler hatlar mümkün olan en kısa
sürede çıkarılmalıdır.
Düşük Debi:
Sebep %90 olguda sağ kalp yetmezliğidir. Çoğunlukla
kanama, sağ kalp iskemisi, ventriküler aritmiler gibi hastaya
bağlı bir nedenden kaynaklanır. Derhal EKG kontrol edilmeli,
fibrilasyon varsa hemen düzeltilmelidir. Akciğerler
kardiyopulmoner bypass esnasında atelektatik, hiperkarbik
kalırlar. Bu pulmoner vasküler rezistans artışına neden olur.
Ayrıca hastanın göğsü kapatılınca, toraks içi basınç
artacağından, venöz dönüş azalır.
Bu, hastaya verilecek 500 ml volüme iyi cevap verir. Yoğun
bakımda ilk 6 saatte kanama ve bunu takiben yapılacak
transfüzyon ile pulmoner vasküler rezistans artar. Bu yüzden
hasta ameliyathaneyi iyice dolu olarak terketmelidir.
Hipotermi hem kanama hem de pulmoner vasküler rezistans
artışı yönünden son derece tehlikeli olup, önlenmelidir.
Uyanma, otonomik kontrol fonksiyonlarını devreye
sokacağından istenen bir durumdur. Hemodinami stabil olur
olmaz hasta ekstübe edilmelidir.
LVAD Dolumunda Ani Bozulma:
Buna, mesele inflow kanül obstrüksiyonu neden olabilir ve bu
ekoda görülür. Sol ventrikül distansedir. LVAD’de akım
azaldığında, diğer sebepler olarak özellikle protez inflow
kapağında infeksiyon da varsa, kapak trombozu, inflow
kanülünün yukarıda kalıp sol ventrikül duvarına basması, sağ
kalp yetmezliği, kink oluşumu gibi ihtimaller akla gelmelidir.
Persistan Hipoksi:
Hastada patent foramen ovale olabilir, kontrast eko ile bu
yönden incelenmelidir. Akciğer kaynaklı hipokside ECMO
kullanılmamaktadır.
Bu,
pulmoner
komplikasyonları
artırmakta, sonuçta işleme son verildiğinde hasta
kaybedilmektedir. Hipoksi ile savaşımda en önemli konu sağ
kalp yetmezliği ile mücadeleyi öğrenmektir.
Trombositopeni:
Trombositler ilk gün süratle azalırlar, cihazın içinde çöker,
birikirler.
Abdominal Şikayetler:
Cihaz mide boşalmasını yavaşlatır. Ufak-sık öğünler
verilmelidir. Genellikle karın ağrısı olur. Bazen bu karın ağrısı
infeksiyon habercisi olabilir.
Diyaliz:
İmplantasyon öncesi zorlanmış olan böbrek fonksiyonları ve
sıvı retansiyonu gözönüne alındığında erken postoperatif
dönemde hemodiyalizin (CVVHF veya CAVH şeklinde)
erken ve liberal kullanımı yoğun bakım dönemindeki seyri
büyük ölçüde kolaylaştırmaktadır (23).
Hipertansiyon:
Normal debi LVAD ile sağlandığında bazı hastalarda
hipertansiyon gelişmektedir. Bu hastalar muhtemelen kalp
yetmezliği gelişiminden önceki dönemde hipertansif olan
hastalardır. Hidralazin gibi pür arteriyel etkili bir vazodilatatör
tercih edilir. Mümkünse kalsiyum antagonisti veya beta bloker
vermemeye çalışılır.
Komplikasyonlar, Tanı ve Sağaltımları
Kanama:
Cerrahi kanama sebepleri (sızıntı, garft komplikasyonları,
sütür yetmizliği, aort rüptürü) yanında karidyopulmoner
bypass veya LVAD kaynkalı medikal kanamalar görülebilir
veya hastanın preoperatif karaciğer fonksiyon bozukluğuna
bağlı olabilir. Bu sonuncu için preoperatif K vitamini
verilmesi önerilmiştir.
İnfeksiyon:
Literatürde bildirilen infeksiyon oranı %30-50 (%13-80 arası)
civarındadır. Yaklaşık olarak %20-70 mortalite taşımaktadır.
Bunun
dışında
infeksiyon
nedeneyli
%20
hasta
transplantasyon bekleme listesinden çıkarılabilmektedir.
Özellikle kapaklarda yerleşen vejetasyonlar tromboembolizm
riskini
artırabilmektedir.
Burada
önde
gelen
mikroorganizmalar Staphylococcus epidermidis ve Candida
albicans olup protez domuz kapaklarda vejetasyon
yapabilmekte, infeksiyon implantasyondan yaklaşık 1 ay sonra
başlamakta ve bakteriemi/fungemi ile devam etmektedir.
Cihaz eksplantasyonu ve transplantasyon gerekebilmektedir
(40). İnfeksiyon tanısı, ateşin 38.5 ºC’yi, beyaz küre sayısının
da 11000’i aşması ya da varsa pürülan akıntının görülmesi ile
konulur.
Tromboemboli ve Strok:
Hastalarda, genelde antikoagülan kullanılmamasına, sadece
80mg/gün aspirin verilmesine rağmen stroke insidansı %24/hasta/yıl’ı gibi düşük bir seviyede gitmektedir. Diğer LVAD
sistemlerinde bu oran %25 hatta %50 olarak verilmektedir. Bu
önemli farklılıkta, daha önce açıklandığı gibi özel dizaynının
rolü büyüktür. Klinik olarak saptanan tromboemboli ve strok
dışında, mikroembolilerin ve subklinik kalan nörolojik
olayların saptanması için uzun vadeli nörokognitif testler ve
hematolojik değerlendirme esasına dayanan çalışmaların
yapılması gerekmektedir (41).
Sağ Ventrikül Yetmezliği:
Altta yatan etyoloji veya sol ventrikül yetmezliğinin getirdiği
yük nedeniyle genellikle sağ ventrikül de olumsuz
etkilenmiştir. Klinik olarak bariz sağ kalp yezmezliği %20
vakada görülmektedir. Yaklaşık %10 olguda sağ ventrikül
destek cihazı (RVAD) gerekmekte, bu durumda genellikle
ABIOMED BVS 5000 (23), bazen de BIOMEDICUS gibi bir
santrifugal pompa kullanılmaktadır. Sağ kalp yetmezliği
LVAD’in başarısını engelleyen en önemli sebeplerden biridir.
Nedenleri:
a) İmplantasyon öncesi mevcut sağ kalp yetmezliği.
b) Hava embolisi. İşlem sırasında ve wean periyodunda sağ
kalbin yeterince korunamaması ve distansiyona maruz
kalması (42).
c) Nativ koroner hastalığı
d) LVAD’nin yerleştirilmesiyle sol ventrikülün sönmesi ve
septumun paradoks hareketini takiben ortadan kalkması
sonucunda normal şartlarda sağ ventrikülün, sol
ventrikül üzerini yarım ay şeklinde örtmesi ile ondan
aldığı desteğin (interdependence) ortadan kalkması.
e) LVAD yerleştirilmesini takiben göğsün kapatılması.
Debide 300 cc azalma olur. Hemodinamisi kritik
hastalarda göğüs kapatılmaz, 1 gün açık bırakılır.
f)
Majör sebep: KANAMA. Daha önce belirtildiği gibi
kanama ve transfüzyon, pulmoner direnci önemli ölçüde
artırarak, sağ ventrikülü yükler ve latent bir yetmezliği
manifest hale getirebilir. Tromboksan A2, sitokinler ve
immunolojik mekanizmalar yanında, kardiyopulmoner
bypass sonrası artmış kompleman (özellikle C5a)
stimulasyonu bu tabloda sorumludur. Perioperatif
g)
dönemde mutlaka Aprotinin kullanılmalı, transfüzyonlarda lökosit filtresi takılmalıdır. Bu hem kanamayı
hem de lökositlerden dolayı gelişebilecek akciğer
hasarını önler. Sağ ventrikül yetmezliğini farketmede
gecikilmemelidir. Santral ven basıncının 20 mmHg’yı
aşması, dev v dalgaları, sol atrial basıncın 10 mmHg
altında seyretmesi, kardiyak indeksin
1.8 lt/dk/m2’den düşük olması, yatakbaşı ekoda
septumun durumu, sağ ventrikülün şiş görünmesi ve
bariz triküspit kaçağı olması tanıyı destekler.
Tedavi seçenekleri: Nitrik oksit inhalasyonu (43),
inotroplar, venoarteriel şant (44) veya, fazla
desatürasyon yapmayacak şekilde Fontan fenetrasyon
benzeri uygulamalar denenebilir. Ayrıca vücut dışı
dolaşımla yaşam desteği (23,45) denenebilir. Sağ
atriumdan veya juguler kateterden femoral artere
santrifugal pompa ile kan pompalanabilir. Oksijenatör
olmayan bu destekleme devresiyle önemli desatürasyon
olmamaktadır. Beyin, kalp, böbrekler arteryelize kanla
beslenir.1-125 lt/dk. Debi yeterli gelir. Yaklaşık 6-12
saat kullanılır, heparinizasyon gerektirmez. Son çare
RVAD yerleştirmektir. Burada bir kez endikasyon
görüldüğünde erken davranılması gerekir, böylece
survival %55 olabilmektedir. Yaklaşık 5 gün kullanılır.
Göğüs açık bırakılır ve kanama durana kadar heparin
verilmez. Diyaliz devresi, faydalı olabilir ve eğer
kullanılacaksa RVAD devresine yerleştirilir (25).
Bunlardan başka lead kırılması, inflow kondui rüptürü
(46) gibi mekanik komplikasyonlar ve cihaz arızaları
gibi nadir görülen sorunlar da komplikasyonlar arasında
sayılabilir.
Rehabilitasyon ve Fizik Tedavi
Yatak istirahati, end-stage kalp yetmezliği olan hastalarda
istenmeyen etkileri nedeniyle yüksek riski beraberinde
getirmektedir.
Prensip,
erken
ambulasyon
ve
rehabilitasyondur. Hastalar hastanede kalmak için fazla
“iyi”dirler. Bu nedenle erken yoğun bakım ve servis
dönemlerini atlattıktan sonra kısa sürede taburcu olmaları ve
günlük hayatlarına adaptasyonları ön görülmektedir. Uzun
süre yatağa bağlanan, infeksiyon veya nörolojik
komplikasyonları olan hastalarda rehabilitasyon zor
olmaktadır. Bunlar, fizik tedavi proramının öngörüldüğü gibi
yürütülmesini engelleyerek prognoz üzerinde olumsuz etkiye
sahip olurlar (47).
Fizik tedavi programı yoğun bakım ünitesinde ilk postoperatif
gün başlar ve cihaz çıkartılıncaya kadar da sürer.
1. Aşama: Erken döemde amaç yatağa bağlı kalmanın
getireceği komplikasyonları önlemektir. Göğüs-akciğer
fizyoterapisi, ROM (range of motion) ve pozisyon verme
çalışmaları uygulanır. Hasta hemodinamik olarak stabilize
olduğunda (ameliyat sonrası 2-7.günler arası) bir sandalyeye
oturtulur. Yeterli kas gücü gösterdiğinde yoğun bakım
ünitesinde ambulasyon başlar. Yoğun bakımda ortalama kalış
süresi 8 ± 5 gündür.
2. Aşama: Hasta yoğun bakımdan çıkınca, bu kez amaç, yatak
hareketlerinde, günlük yaşam aktiviteleri ve ambulasyonda
başkasına bağımlılıktan kurtulma olur.
3. Aşama: Hasta, bu bağımsızlığı kazandığında (yaklaşık
olarak postoperatif 2. hafta), jimnastik salonunda treadmill
veya bisiklet egzersizine alınır. Esneklik ve spesifik güç
kazandırıcı egzersizler yaptırılır.
4. aşama: Direnç egzersizleri, sternal iyileşmeyi beklemek
için 6-8 hafta geciktirilir. Egzersiz seansı, eğer subjektif
intolerans, sistolik kan basıncında 20 mmHg’dan fazla düşme,
debide 3lt/dk. altına semptomatik düşme varsa sonlandırılır.
5. Aşama: Hastalar bisiklete binme, yürüyüş, dans ve günlük
aktivitelerini sorunsuzca yapabilirler. Genelde sıçrama, suya
dalma ve bunu içeren faaliyetler yasak olup, LVAD’de yer
değiştirme, aortik anastomoz yerinde yırtık, hava vent hattına
su kaçması gibi potansiyel tehlikeleri içerir. Hastalara duşa
sorunsuzca girebilmelerini sağlayan duş kılıfları verilir. Üç ay
boyunca zorlu aktivite yaptırılmaz. Egzersizler cihaz Auto
modunda iken yapılır. LVAD, transplant öncesi ambulasyon,
kas tonusu, gücü ve kitlesinde artış, nutrisyonel durumun
optimizasyonu gibi potansiyeller taşır (47).
Uzun Dönem Sonuçlar, Yaşam Kalitesi
Columbia Üniversitesi, Columbia Preesbyterian Medical
Center’da bu yazının hazırlandığı zamana dek 147 hastaya bu
cihaz takılmış olup, yaşam oranı %70, perioperatif mortalite
%20 idi. Buna ek olarak destek dönemi sırasında %5 ve
transplantasyon sonrası da %6 mortalite bildirilmiştir. 1998
Temmuzuna kadar TCI Heart Mate cihazı dünya üzerinde 122
merkezde 1387 hastaya takılmıştır. Bunların 97’li (%70)
pnömotik model olup, 416 tanesi (%30) VE (vented electric)
modelidir (48). İmplantasyonuna ilk kez 1990 yılında başlanan
HeartMate VE (Vented Electric) cihazı kendi sınıfındaki en
kullanışlı ve küçük cihaz olup klinik kullanımda geçen 10
yıllık tecrübe, hem hastanede yatan, hem de evine çıkarılan
hastalarda etkinliği ve güvenilirliğini kanıtlamıştır. HeartMade
VE hastalara daha önce terminal kalp yetmezliği nedeniyle
uzun süredir yapamadıkları bisiklete binme, yürüyüş, dans,
bahçe işleriyle uğraşma gibi pek çok aktiviteyi yapabilme ve
kendi yaşam tarzlarına tekrardan dönebilme imkanı tanır (4951).
Yaşam Beklentisi:
HeartMate®, kalp yetmezlikli hastanın yaşam beklentisi
üzerinde dramatik bir değişim yapar. Çok merkezli geniş
kapsamlı çalışmalarda, hastaların %69’u transplantasyona
kadar yaşatılabilmektedir. Bu oran, LVAD takılmayan
hastalarda ancak %33’tür. Bu farklılık LVAD grubunda
mortalitenin yarıya inmesi anlamına gelir. Transplantasyon
sonrasında bir yıllık survival ise, muhtemelen hastaların daha
optimal hemodinami ve genel kondisyon şartlarında kalp
nakline verilebilmesi nedeniyle LVAD grubunda (%8,
implantasyon yapılmayan kontrol grubuna göre (%60) belirgin
derecede fazladır.
Fonksiyonel Kapasite Düzelmesi:
İmplantasyon öncesi büyük çoğunluğu evre-IV’de olan
hastaların %77’si, transplantasyondan 60 gün sonra evre-I’e
dönerler. Bu oran LVAD implante edilmeyenlerde sadece
%46’dır. HeartMate hastaların fiziksel ve psikolojik olarak
daha iyi bir kondisyonda ve daha bağımsız olmalarını
mümkün kılmaktadır.
Organ Fonksiyonlarında İyileşme:
LVAD desteği klinik çalışmalarda gösterildiği üzere sağladığı
hemodinamik iyileşme ile organ fonksiyonlarındaki bozulmayı
durdurmakta hatta geri çevirebilmektedir (52). LVAD sonrası
transplantasyonlarda alınan sonuçların direkt transplantasyonlara göre daha iyi olması buna bağlanmaktadır (53). Klinik
çalışmalar göstermiştir ki, hepatik ve renal fonksiyonlardaki
düzelme, genellikle implantasyondan sonra en az 4-5 hafta
almaktadır. Bu da, hastalara reperfüzyonun etkilerinden
faydalanabilmeleri için uzun vadeli bir LVAD desteği
gerektiğini göstermektedir (54).
Süregelen Klinik Çalışmalar
Rematch: (Randomized Evaluation of Mechanical Assistance
for the Treatment of Congestive Heart Failure) çalışması:
Transplantasyona uygun olmayan hastalarda, kronik LVAD
kullanımının yerini araştırmak için düzenlenmiştir. Üretici
firma (TCI), Ulusal Sağlık Kurumu (National Institutes of
Health) ve Columbia Üniversitesi arasında ortaklaşa
düzenlenen bu çalışma, 20 tanınmış ve prestijli
transplantasyon merkezinde sürmektedir.
Heratpak® Klinik Çalışması:
Bu, taşınabilir pnömatik HeartMate cihazı ile TCI ve katılan
25 hastane arasında işbirliği ve FDA onayı ile yapılan bir
çalışmadır. Pnömatik cihazlar için özel bir kontrol konsolu
olan HeartPak’ın güvenliği ve etkinliğini araştırmaktadır.
Hastaların hastane veya hastane dışı günlük aktivitelerini
yapabilmeleri hedeflenmiştir. 5 yıllık sonuçlar elde edilene
dek non-randomize şekilde devam edecektir. Hastalardan
ayrıca klinik durumun seyri, NYHA fonksiyonel evreleme,
günlük aktivite düzeyi ve cihazın işletimi konularında veri
toplanacaktır.
Phade: (Pneumatic HeartMate Assist as Destination
Evaluation) çalışması:
The Heart Institute of Spokane ve Sacred Heart Medical
Center merkezlerinde FDA onayı ile pnömatik modelin kalıcı
amaçlı yerleştirilmesi konusunda bir araştırma çalışmasıdır.
Transplant adayı olmayan hastalarda, HeartPak konsolu ile
idare edilen bu cihazın güvenliğini, yaşam kalitesini ve
implantasyon masraflarını değerlendirmeyi hedeflemektedir.
Bu uzun vadeli çalışmaların çoğu daha önce hizmete girmiş
olan pnömatik model (IP) ile yapılmış çalışmalardır. Daha
yakın dönemde klinik kullanıma sunulmuş elektrikli model
(VE) üzerinde de kapsamlı ve uzun vadeli çalışmalar
sürmektedir. Ancak bunlar henüz tamamlanmamış olup, ilk
sonuçları pnömatik model ile elde edilenlere benzemektedir.
Esasen bu iki model arasındaki fark sadece kullanıldıkları güç
kaynaklarında olup, dizaynları diğer yönlerden birbirinin
aynıdır.
Maliyet
Cihazın A.B.D.’deki fiyatı 60.000 dolar civarında olup,
A.B.D. dışında daha pahalı satılmaktadır. Hasta maliyeti
120.000 Amerikan Doları civarında seyretmektedir. Onsekiz
günlük bir hospitalizasyonun maliyeti yaklaşık 141.000 ±
19.000 dolar olarak hesaplanmıştır. Yapılan bir çalışmada,
yoğun bakımda transplantasyon bekleyen bir hastanın günlük
maliyeti 5150 dolar, LVAD ile hastanede genel bakım
şartlarında desteklenen bir hastanın günlük maliyeti 3178
dolar, evinde LVAD desteği alan bir hastanın ise günlük
maliyeti sadece 27 dolar olarak bulunmuştur (55). Ayrıca
LVAD takılan bir hasta işinin başına dönerek, ekonomik
olarak üretici olabilmektedir.
Not:
Yazar, 1997-1998 arasında Türk Eğitim Vakfı Bursiyeri
olarak Amerika Birleşik Devletleri, New York eyaleti,
Columbia Presbyterian Medical Center, Columbia University,
New York’da sol ventrikül destek cihazları ve başlıca TCI
HeartMate sistemleri üzerinde çalışmıştır.












