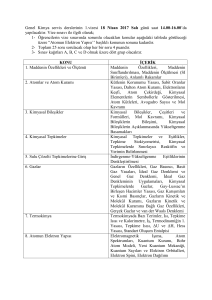
3. KİMYASAL TEPKİMELER
Bileşikler ve Formüller
Birden fazla elementin belirli sayılarda bir araya gelerek oluşturduğu yeni özellikteki saf maddelere
bileşik denir.
Bileşikler, farklı elementlerin belirli sayılarda ve belirli kurallarla bir araya gelmesiyle oluşur.
Bileşik Formüllerinin Yazılması
Elementlerin grupları ve yükleri bulunur.
Katyon (+ yüklü iyon) önce, anyon (- yüklü iyon) sonra olmak üzere yan yana getirilir.
İyon yükleri çaprazlanarak element sembollerinin sağ alt tarafına yazılır (ancak yüklerdeki (+) ve (-)
işaretler yazılmaz.)
Meydana gelen formüllerde varsa sadeleştirme yapılır.
D!kkat: Bir bileşiği oluşturan elementlerin yükleri toplamı daima sıfır olmalıdır.
Örnekler
1. Atom numarası 3 olan Li ile 9 olan F elementleri arasında oluşan bileşiğin formülü nedir?
2.
12Mg
ile
17Cl
elementlerinin arasında oluşan bileşiğin formülü nedir?
3. 8O elementi ile 13Al elementi arasındaki bileşiğin formülü nedir?
D!kkat: İyonik bileşiklerin formülleri en sadeleşmiş halleriyle yazılır. Bu nedenle varsa
formülde sadeleştirme yapılır.
Önemli İyonlar ve Yükleri
Bileşik oluşurken, her zaman tek tür atomdan oluşan anyon ve katyonlar birleşmez. Birden fazla
atomdan oluşan anyon ve katyonlar da vardır.
KATYONLAR
+2 yüklü
+1 yüklü
+3 yüklü
-1 yüklü
ANYONLAR
-2 yüklü
-3 yüklü
Hidrojen
Berilyum
Alüminyum
Florür
Oksit
Nitrür
Lityum
Magnezyum
Bor
Klorür
Sülfür
Fosfür
Sodyum
Kalsiyum
Hidroksit
Sülfat
Fosfat
Nitrat
Karbonat
Potasyum
Amonyum
Örnek: Ca2+ ile OH- arasında oluşacak bileşiğin formülü nedir?
D!kkat: Çok atomlu iyonlarla oluşan bileşik formüllerinin çaprazlamalarında çok atomlu
iyonlar parantez içine alınır.
Bileşiklerin Adlandırılması
Yeryüzünde birçok bileşik vardır. Bu kadar bileşiği birbirinden ayırt etmek için bileşikler
adlandırılmıştır. Ancak bu adlandırma rastgele yapılmaz. Adlandırma belirli bir kurala göre yapılır.
Adlandırmada önce katyonun adı, sonra da anyonun adı söylenir.
Katyonun Adı + Anyonun Adı => Bileşiğin Adı
NaCl: Sodyum klorür
Al2S3:
CaO:
NH4NO3:
Mg(OH)2:
Mg(NO3)2:
İyonları Birleştirip Oluşan Bileşiği Adlandıralım!
Katyon
Na+
Anyon
F-
Bileşik Formülü
Bileşiğin Adı
CaCl2
Magnezyum nitrat
Al3+
OHNa2CO3
Sodyum hidroksit
Ca2+
NO3MgO
Amonyum sülfür
NH4+
SO42Mg3N2
Kalsiyum karbonat
K+
CO32Ca(OH)2
Potasyum oksit
Fiziksel ve Kimyasal Değişimler
Fiziksel değişime uğrayan maddeler asıl yapılarını korur ve başka bir maddeye dönüşmez. Ancak,
kimyasal değişime uğrayan maddeler bütün özelliklerini kaybedip yeni özellikte madde veya maddelere
dönüşür.
Değişimin Türünü Belirleyelim!
Değişim
Kağıdın yırtılması
Kömürün yanması
Suyun donması
Demirin paslanması
Sütten yoğurt yapılması
Yoğurttan ayran yapılması
Telefon tellerinin yazın sıcaktan uzaması
Petrolün yanması
Kolonyanın buharlaşması
Etin kokuşması
Değişimin Türü
Kimyasal Tepkimeler
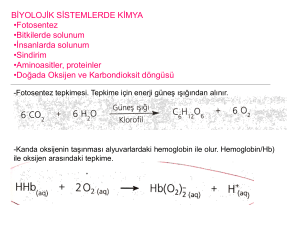
Maddelerin kimyasal değişime uğrayarak yeni maddelerin oluşması sürecine kimyasal tepkime
denir. Kimyasal tepkime, kimyasal değişim ve kimyasal olay eş anlamlıdır. Canlılarda büyüme, sindirim,
solunum, fotosentez gibi olaylar kimyasal tepkimeler sonucu gerçekleşir.
İki madde arasındaki etkileşim sonucu kimyasal bir değişim olduğu renk değişiminden, gaz
çıkışından, ısı çıkışından, çökelme olmasından anlaşılabilir. Örneğin, bir kağıt yakıldığında ısı açığa çıkar ve
kağıdın rengi değişir. Bir elmayı kestiğimizde iç kısmı başlangıçta beyazdır. Sonra kararmaya başlar.
Elmanın yapısındaki maddeler havanın etkisiyle kimyasal değişime uğrar. Bu dönüşüm bize renk değişikliği
şeklinde yansır.
Kimyasal tepkimelerde maddelerin toplam kütlesi artmaz ya da azalmaz. Kimyasal tepkime
gerçekleştiğinde maddeleri oluşturan atomlar yer değiştirir ve madde bir başka maddeye veya maddelere
dönüşür. Bu durum, atomlar arası bağların kopması, yeni bağların oluşması ile açıklanabilir.
Kimyasal tepkimelerde atomlar yok olmadığı ve yeni atomlar oluşmadığı için tepkimeden sonra yeni
madde oluştuğunda kütlede herhangi bir değişiklik olmaz. Başka bir ifadeyle kimyasal tepkimelerde,
tepkimeye giren madde miktarı ve tepkime sonucu oluşan madde miktarı birbirine eşittir. Dolayısı ile kütle
korunur. Aynı zamanda atom sayıları da korunur.
Kimyasal tepkimeler, kimyasal denklemlerle gösterilir.
Giren Madde 1 + Giren Madde 2
Ürün (birden fazla ise aralarına + konularak gösterilebilir.)
D!kkat: Kimyasal tepkimelerde; atom sayısı ve toplam kütle değişmez.
Kimyasal Tepkimelerin Denkleştirilmesi
Kimyasal bir tepkime atom türü ve atom sayısı yönünden denkleştirilmiş olmalıdır. Denkleştirilmiş
tepkime demek tepkimeye giren atomların tür ve sayıları tepkime sonunda oluşan atomların tür ve
sayılarına eşit olması demektir.
CH4 + 2O2
CO2 + 2H2O
1 tane C
4 tane H
4 tane O
1 tane C
4 tane H
4 tane O
Örnekler: Aşağıdaki kimyasal tepkimeleri denkleştiriniz.
1.
H2 + O2
H2O
2.
H2 + Cl2
HCl
3.
SO2 +
O2
SO3
4.
Ag +
O2
Ag2O
5.
Al +
Cl2
AlCl3
6.
KCl +
F2
KF +
Cl2