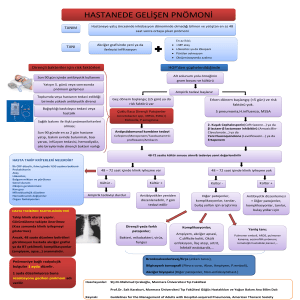
Solunum Hastalıkları
Cilt 20, Sayı 3, 2009,102–107
ISSN 1300-2961
Tüm hakları saklıdır, tamamen ve kısmen tıpkıbasımı yasaktır
Olgu Sunumu / Case Report
Kriptojenik Organize Pnömoni: Olgu Sunumu ve
Literatürün Gözden Geçirilmesi
Cryptogenic Organizing Pneumonia: Case Report and Review
of the Literature
İbrahim Onur Alıcı1, Deniz Köksal1, Nihal Başay1, Hülya Bayiz1, Neslihan Mutluay1, Ebru Çakır2,
Bahadır Berktaş1, Mine Berkoğlu1
1
2
Atatürk Göğüs Hastalıkları ve Göğüs Cerrahisi Eğitim ve Araştırma Hastanesi, Göğüs Hastalıkları, Ankara
Atatürk Göğüs Hastalıkları ve Göğüs Cerrahisi Eğitim ve Araştırma Hastanesi, Patoloji, Ankara
Geliş Tarihi: 20 Mart 2009
Kabul Tarihi: 8 Temmuz 2009
Özet
Abstract
Kriptojenik organize pnömoni (KOP), idiyopatik interstisyel pnömonilerin nadir
rastlanan bir biçimidir ve iyi bir prognoza sahiptir. Günümüzde giderek artan
sıklıkta tanı almakta olan bu hastalık, olgu sunumu ve literatür eşliğinde sunulmuştur. Elli dört yaşında kadın hasta kuru öksürük, iştahsızlık ve halsizlik yakınmalarıyla başvurdu. Hasta başka bir merkezden rezolüsyonu gecikmiş pnömoni tanısıyla sevk edilmişti. Toraksın bilgisayarlı tomografisinde bilateral bazal
segmentlerde konsolidasyon alanları saptandı. Fiberoptik bronkoskopi bulguları normaldi. Bilgisayarlı tomografi eşliğinde transtorasik biyopsi yapılarak organize pnömoni tanısı kondu. Etyoloji açısından değerlendirildikten sonra hastaya
KOP tanısı kondu.
Cryptogenic organizing pneumonia (COP) is a rare form of idiopathic interstitial
pneumonias and it has a better prognosis. The disease which is more
commonly diagnosed nowadays is presented with a case report and review of
the current literature. Fifty-four years old female patient admitted with the
symptoms of dry cough, anorexia, and fatigue. The patient was refered with
the diagnosis of unresolved pneumonia from a different center. Computed
tomography of thorax revealed consolidation areas on bilateral basal
segments. Fiberoptic broncoscopy findings were normal. Computed
tomography guided transthoracic biopsy confirmed the diagnosis of organizing
pneumonia. After evaluation for etiology, the patient diagnosed as COP.
Anahtar sözcükler: kriptojenik organize pnömoni, tanı, tedavi
Keywords: cryptogenic organising pneumonia, diagnosis, treatment
Giriş
İletişim adresi:
Deniz Köksal,
Atatürk Göğüs Hastalıkları ve Göğüs
Cerrahisi Eğitim ve Araştırma Hastanesi,
Ankara
Tel.:+90 312 355 21 10;
Faks:+90 312 355 21 35;
[email protected]
102
Kriptojenik organize pnömoni (KOP), subakut idyopatik interstisyel pnömonilerin
nadir rastlanan bir biçimidir (1). Daha önceleri bronşiyolitis obliterans organize pnömoni olarak adlandırılan klinikopatolojik durumun altta yatan herhangi bir nedenle
ilişkilendirilememiş alt grubunu oluşturmaktadır. Günümüzde giderek artan sıklıkta tanı almakta olan bu hastalığın genel özellikleri, kliniğimizde KOP tanısı
almış olgu eşliğinde sunulmuştur.
Olgu
Elli dört yaşında kadın hasta, bir ay önce başlayan kuru öksürük, iştahsızlık ve halsizlik yakınmalarıyla başvurdu. Az miktarda kilo kaybettiğini, hiç ateşi olmadığını
© 2009 Atatürk Göğüs Hastalıkları ve Göğüs Cerrahisi Eğitim ve Araştırma Hastanesi
www.solunumhastaliklari.org
Solunum Hastalıkları
belirtti. Dış merkezde pnömoni tanısıyla yatırılarak intravenöz yolla antibiyotik tedavileri verilmiş; ancak yakınmalarında ve kontrol akciğer grafilerinde gerileme olmaması üzerine
hastanemize yönlendirilmişti. On yıl önce tiroidektomi öyküsü vardı. Operasyondan sonra tiroid hormonu replasmanı başlanmıştı. Bunun dışında düzenli ilaç kullanım öyküsü yoktu.
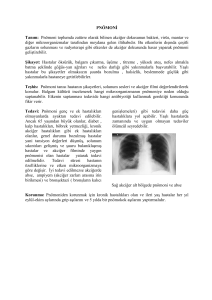
Biyolojik yakıt maruziyeti vardı. Fizik muayenede, vital bulguları normal sınırlardaydı. Oda havasında ölçülen pulse oksijen satürasyonu %91 idi. Sistem muayeneleri sağ akciğer bazalinde yer yer duyulan raller dışında doğaldı. Boyunda tiroidektomi insizyon skarı vardı. Posteroanterior akciğer grafisinde
(Resim 1), sağ alt zonda periferik alanda, solda alt zon parakardiyak alanda belirginleşen nonhomojen gölge koyulukları
izlendi. Bilgisayarlı tomografide (Resim 2), bilateral, sağ alt
lob posterior ve lateral bazal segmentlerde daha belirgin, hava
bronkogramları içeren konsolide alanlar saptandı. Laboratuvar
incelemelerinde, tam kan sayımı, kan biyokimyası ve idrar
tahlili normal sınırlardaydı. Eritrosit sedimantasyon hızı 69
mm/saat, C-reaktif protein düzeyi 4.55 mg/dL (0-0.8) bulundu. Kollajen doku belirleyicileri negatif bulundu. Arter kan
gazı analizinde orta dereceli hipoksemi saptandı (pO2: 58.5
mmHg). Solunum fonksiyon testlerinde FEV1: %53 (1.39 L),
FVC: %56, FEV1/FVC: %81 idi. Hasta karbonmonoksit
difüzyon testine uyum sağlayamadı. Fiberoptik bronkoskopi
bulguları normaldi. Sağ alt lob posterior segmentten alınan
transbronşiyal biyopsi tanısal olmadı. Hastaya bilgisayarlı
tomografi eşliğinde kesici iğne biyopsisi yapıldı. Patolojik
incelemede (Resim 3), akciğer parankiminde alveol septalarını
kalınlaştıran lenfositik iltihabi hücreler ve alveol lümenlerine
uzanan genç fibröz bağ doku (masson body) artımı ile karakterize organize pnömonik değişiklikler izlendi. Etyoloji açısından değerlendirilen hastanın, nedeni belli olmayan tiroidektomi öyküsü üzerine yapılan tiroid bezi ultrasonografisin-
Cilt 20, Sayı 3, 2009,102–107
de, tiroid dokusu izlenmedi. Tiroid fonksiyon testleri normal
sınırlardaydı, anti-TPO ve tiroglobulin negatif bulundu. Ek
hastalığı ve sürekli ilaç kullanımı öyküsü olmayan hasta KOP
olarak değerlendirildi. Sistemik glukokortikoid tedavisi (1
mg/kg/gün prednizolona eşdeğer dozda deflazokort) başlandı.
Tedavinin birinci ayında kontrole gelen hastanın akciğer grafisinde belirgin düzelme izlendi (Resim 4). Semptomları kaybolmuştu. Solunum fonksiyon testlerinde FEV1: %92 (2.09
L), FVC: %94, FEV1/FVC: %83, DLCO: %94, VA: %84,
DLCO/VA: %112 bulundu. Klinik, fonksiyonel ve radyolojik
düzelme saptanan hastanın glukokortikoid dozu düşürülerek
tedaviye devam edildi. Olgu halen tedavisinin üçüncü ayında
olup sistemik kortikosteroid tedavisi sürmektedir.
Tartışma
Kriptojenik organize pnömoninin erken tanımlarına ilk olarak 1878-1879’da J.M. Charcot’un Paris’te “Kronik
Pnömoniler” adı altında verdiği derslerde rastlanmaktadır.
1900’lü yılların başlarında konjesyon ve hepatizasyon sonrası,
rezolüsyonu gecikmiş pnömoniler konusunda birçok yazar
görüş bildirmiştir.[2] Milne, 1911 yılında, “beklenen rezolüsyon sürecinin sekteye uğradığı ve alveol içerisindeki inflamatuar eksudanın fibröz dokuyla organize olduğu” bir pnömoni
tanımlamıştır.[3] Yirminci yüzyılın sonlarına dek organize
pnömoni süreci derinlemesine araştırılmıştır. KOP terimi ilk
olarak 1983’te[4] kullanılmış olsa da, son yıllara dek İngiliz
literatüründe “bronşiyolitis obliterans organize pnömoni” adı tercih edilmiştir. Ancak 2002 yılında ATS/ERS’nin yayınladığı
konsensus raporunda KOP terimi hastalığın kriptojenik
doğasını tarif etmede daha doğru bulunduğundan kullanılmıştır.[1] Günümüzde, idyopatik interstisyel pnömonilerin
Resim 1 PA akciğer grafisinde sağ alt zonda periferik
alanda, solda alt zon parakardiyak alanda belirginleşen
nonhomojen gölge koyulukları.
Cryptogenic organizing pneumonia: Case report and review of the literature İ. O. Alıcı et al.
103
Solunum Hastalıkları
Cilt 20, Sayı 3, 2009,102–107
Resim 2 Bilgisayarlı toraks tomografide bilateral
yerleşimli, sağ alt lob posterior ve lateral bazal
segmentlerde daha belirgin, hava bronkogramları
içeren konsolide alanlar.
Tablo 1 Organize pnömoni paterniyle birlikte olan klinik durumlar[1]
Kriptojenik organize pnömoni
Organize diffüz alveoler hasar
Organize infeksiyonlar
Obstrüksiyonun distalinde organizasyon
Organize aspirasyon pnömonisi
Organize ilaç reaksiyonu, duman ve toksik madde maruziyeti
Kollajen vasküler hastalık
Hipersensitivite pnömonisi
Eozinofilik akciğer hastalığı
İnflamatuar barsak hastalığı
Kronik bronşite sekonder reaksiyon olarak
Diğer lezyonların (abse, Wegener granülomatozisi ve neoplaziler gibi) etrafında
tamir reaksiyonu olarak
Resim 3 Akciğer parankiminde alveol septalarını kalınlaştıran lenfositik iltihabi
hücreler ve alveol lümenlerine uzanan genç fibröz bağ doku (mason body) artımı
ile karakterize organize pnömonik değişiklikler (H&E X200).
nadir rastlanan bir alt grubu olmasına rağmen, birçok klinisyenin antibiyoterapiye yanıt vermeyen ve gezici-geçici infiltratlarla başvuran olgularda ayırıcı tanıda değerlendirdiği klinikopatolojik bir durum haline gelmiştir.
KOP’un insidans ve prevalansına ait fazla veri yoktur.
Alasaly ve ark. tarafından insidansının 6-7/100.000 olduğu
bildirilmiştir.[5] Daha çok 5-6. dekatlarda ve kadın erkekte
benzer oranda görülmektedir. Sigara içimi ile ilişkisi saptanmamıştır.
KOP, altta yatan bir hastalığa sekonder olarak akciğerlerde oluşan organize pnömoni paterninden ayrılmalıdır (Tablo
1). Organize pnömoni, birçok infeksiyöz etkene (Chlamydia
pneumoniae, Mycoplasma pneumoniae, Legionella pneumophila,
HIV, influenza, adenovirus, P. jirovecii vs), ilaçlara (amiodaron,
104
busulfan, bleomisin, karbamazepin, nitrofurantoin, sirolimus, sulfasalazin vs), radyasyona, toksik gaz inhalasyonuna,
bağ dokusu hastalıklarına (dermatomyozit-polimyozit, romatoid artrit, sistemik lupus eritematozus, Wegener granülomatozu, skleroderma), malignitelere, inflamatuar barsak hastalıklarına bağlı olarak ve transplantasyon sonrası gelişebilir.[2] Patolojik örneklerin değerlendirilmesi yoluyla kriptojenik veya sekonder ayrımı yapılamaz. Tanı sürecinde dikkatli
bir anamnez alınmalı; hasta, ekstratorasik patolojiler açısından dikkatlice değerlendirilmelidir. Bazı durumlarda primer
hastalık, akciğerlerde organize pnömoni paterni ile kendini
gösterebilir. KOP tanısına ancak tüm bu klinik durumların
dışlanmasıyla ulaşılabilir. Bizim olgumuzda da diğer etyolojiler dışlanarak KOP tanısına ulaşılmıştır.
KOP’un oluşum mekanizması yara yeri iyileşmesindeki
basamaklarla birçok benzerlik gösterir. Alveoler epitel hasarı,
nekroz ve buna bağlı pnömosit dökülmesi hastalığın başlangıç aşamasını oluşturur. Bazal laminada hasar fokal boyuttadır. Hyalen membranlar görülmez. Bu hasara sekonder inflamatuar hücre göçü oluşur. Lenfositler en belirgin hücre gru-
Kriptojenik organize pnömoni: Olgu sunumu ve literatürün gözden geçirilmesi İ. O. Alıcı ve ark.
Solunum Hastalıkları
Cilt 20, Sayı 3, 2009,102–107
Resim 4 Tedavinin birinci ayında çekilen kontrol PA
akciğer grafisinde lezyonlarda gerileme.
budur. İnterstisyumda fibroblastlar, yer yer polimorfonükleer
lökositler, bazofiller, mast hücreleri ve fibrin yutan alveoler
makrofajlar patogeneze katılan diğer hücrelerdir. İlk aşama
bu hücrelerin alveol boşluğunda birikimleridir. Daha sonra
bazal membrandaki boşluklar vasıtasıyla alveoler alana geçen
fibroblastlar, prolifere olmaya ve miyofibroblastlara dönüşmeye başlar. Alveol lümenindeki fibrin parçalanmaya başlar.
Proinflamatuar hücre sayısı giderek azalmaya başlamıştır. Bu
sırada patogenezde çok büyük öneme sahip olan alveol duvarının reepitelizasyonu oluşur. Fibroblast ve miyofibroblastların mikroçevreye hâkim olmalarıyla beraber, kollajen sentezi
ve alveol boşluğunda fibrotik tomurcukların oluşumu görülür.[2] Tomurcuklar içerisindeki kollajen, gevşek yapıdaki Tip
III’ten zengin olduğundan bozulmaya ve fibrozisin düzelmesine daha uygundur.[6-8] Aynı zamanda perialveoler kapillerlerde belirgin artış görülür. Bu yapılanmanın yara iyileşmesindeki granülasyon dokusuyla benzer olduğu belirtilmektedir. Alveol boşluğunda yer alan tomurcuklarda, yaygın olarak
vasküler endotelyal büyüme faktörü ve fibroblast büyüme
faktörü ekspresyonu görülür. Buna bağlı olarak vaskülarizasyondaki belirgin artış, mevcut fibroinflamatuar lezyonun geri
dönüşümlü olmasının olası nedenleri arasında gösterilmektedir.[2,9,10] Bu aşamayı genellikle fibroblast ve miyofibroblastların ortadan kaybolmasına neden olan apopitoz izler.[2]
Ancak KOP’taki fibrotik çevre apopitoz ile ortadan kaybolurken, olağan interstisyel pnömonideki fibrozisin neden kalıcı
olduğuna dair sorular hâlâ gündemdedir. Son yıllarda yapılan
çalışmalarda kollajenolitik metalloproteinazlar (özellikle
MMP-2) ve doku metalloproteinaz inhibitörlerinin düzeyleri
arasındaki ilişkinin, KOP’ta görülen iyileşme sürecinde rolü
olduğu öne sürülmektedir.[11]
Patolojik incelemelerde, alveol boşluklarında bol miktarda
granülasyon dokusu birikimi (proliferatif bronşiyolit) görü-
lür. Alveol lümeni içerisinde gevşek kollajenöz bağ dokusu
içerisinde gömülü halde fibroblastlar ve miyofibroblastların
oluşturduğu tomurcuklar (Masson cisimcikleri) saptanır. Bu
tomurcuklar, Kohn porları aracılığıyla komşu alveol boşluklarına ilerleyebilir ve “kelebek görünümü”ne yol açabilir. Bu
granülasyon dokuları bronşiyollere (proliferatif tipte bronşiyolitis obliterans) uzanım gösterebilir. Alveol boşluğunda
köpüksü makrofajlar saptanabilir.[12-14] İnterstisyel alanda
hafif bir inflamasyon mevcuttur. Ciddi fibrozis bulguları, dev
hücre oluşumu ve vaskülitik patolojiler izlenmez. Akciğerin
yapısal özellikleri genellikle korunur ancak kimi zaman, hafif
derecede fibrozis ve remodelling görülebilmektedir.[12]
Organize pnömonide görülen intraalveoler tomurcukların
histolojik olarak gösterilmesi KOP’a özgü değildir.
Nonspesifik interstisyel pnömoni (NSIP), Wegener granülomatozisi, eozinofilik pnömoni, hipersensitivite pnömonisi,
postobstrüktif pnömoniler, aspirasyon pnömonileri, abseler,
kistik fibrozis ve plevral plaklar gibi bir dizi rahatsızlığın
çevresinde de değişen miktarlarda bulunabilirler.[2,15-24] Bu
sebeple alınan biyopsi materyalinin boyutları, bu gibi patolojilerin dışlanabilmesi için yeterince büyük olmalıdır. Tanıda
çoğu zaman video yardımlı torakoskopik girişimler veya açık
akciğer biyopsileri gerekebilmektedir. Bizim olgumuzda bilgisayarlı tomografi eşliğinde kesici iğne ile biyopsi yapılmış
ve alınan doku tanı için yeterli bulunmuştur.
En sık yakınmalar kuru öksürük, eforla belirginleşen nefes
darlığı ve kilo kaybıdır. Başlangıç genellikle ateş, halsizlik,
yorgunluk ve öksürük gibi nezle benzeri tablo ile olur.
Nadiren göğüs ağrısı, gece terlemesi ve artralji görülebilir.
Hemoptizi sık değildir. Genellikle hasta; yakınmalarının,
başvurusundan 2-3 ay önce başladığını belirtir. Kimi hastalar; pnömoni tanısıyla antibiyotik tedavileri kullanmalarına
rağmen, akciğer grafilerindeki infiltrasyonlarda gerileme
Cryptogenic organizing pneumonia: Case report and review of the literature İ. O. Alıcı et al.
105
Solunum Hastalıkları
Cilt 20, Sayı 3, 2009,102–107
olmaması veya tedavi sonrası tekrarlaması/yer değiştirmesi
nedeniyle ileri sağlık kuruluşlarına yönlendirilir. Fizik muayenede yüksek ateş ve dispne bulguları saptanabilir.
Akciğerlerde inspiratuar raller sıklıkla duyulur. Çomaklaşma
nadirdir. Bazı hastalarda muayene tamamen normal olabilir.
Bizim olgumuzda da bir aydır olan kuru öksürük yakınması
vardı ve iyileşmeyen pnömoni nedeniyle başka bir merkezden
sevk edilmişti.
KOP için özgün tanısal laboratuvar testi bulunmamaktadır. Hafif derecede lökositoz saptanabilir. Bizim olgumuzda
da olduğu gibi, çoğu olguda eritrosit sedimantasyon hızında
ve C-reaktif protein düzeylerinde yükselme görülür.
Otoantikorlar sıklıkla negatif bulunur. Arter kan gazı analizinde hipoksemi saptanabilir.
Spirometrik değerlendirmede sıklıkla hafif-orta derecede
restriktif solunum bozukluğu izlenir. Sigara kullanımı olan
olgularda, obstrüktif patern de eşlik edebilir. Karbonmonoksit
difüzyon kapasitesinde (DLCO) düşme izlenir.
KOP hastasının bronkoalveoler lavaj (BAL) incelemesinde
mikst patern saptanır. Klinik ve radyolojik olarak uyumlu
bulunduğu takdirde, mikst patern varlığı KOP’u kuvvetle
düşündürebilir. BAL sıvısının mikroskopik incelemesinde,
makrofaj yüzdelerinde düşme gözlenirken, lenfosit, nötrofil
ve eozinofil yüzdeleri yükselmiş bulunur. CD8 (⫹) lenfositler
özellikle artmış, CD4/CD8 oranı azalmıştır. Köpüksü makrofajlar ve plazma hücreleri diğer hücresel elemanlardır. Mast
hücreleri ve triptaz salınımı artmıştır.[21] Özellikle monosit
kemotaktik protein-1, IFN-γ, IL-12 ve IL-18 KOP’lu hastaların BAL’ında artmış bulunur.[25] BAL sıvısının sitolojik
incelemesi ile bronkoalveoler karsinom, lenfoma ve eozinofilik akciğer hastalıkları dışlanabilir.
KOP’un radyolojik olarak üç ana karakteristik görünümü vardır.[2] Bunlar multiple alveoler (tipik), soliter (fokal)
ve infiltratif tiptir. Tipik KOP, en sık görülen formdur.
Bilateral ve periferik yerleşimli, çoğunlukla gezici, hava
bronkogramları içeren konsolide alanlar olarak görülür.
Tüm lobu tutabilir. Bilgisayarlı tomografi bulgularının
ayırıcı tanısında, eozinofilik pnömoniler, lenfoma ve bronkoalveoler karsinom yer alır. Soliter (fokal) KOP sıklıkla
başka ön tanılarla alınan biyopsilerde tesadüfen saptanır.[26]
Üst loblarda kavitasyon içerebilen nodüller halinde görülebilir. Cerrahi rezeksiyon sonrası genellikle nüks etmezler.
İnfiltratif KOP’ta interstisyel görünümlerin eşlik ettiği
alveoler opasiteler mevcuttur. İdiopatik interstisyel pnömonilerin diğer formları (IPF ve NSIP) ile beraber bulunabilir. KOP’ta plevral kalınlaşma ve plörezi görülmesi sık
değildir.
KOP tanısı koyabilmek için, dokuda organize pnömoni
paterninin histolojik olarak gösterilmesi ve buna yol açabilecek diğer tüm nedenlerin dışlanması gerekir. Bu amaçla öncelikle kullanılabilecek yöntem, minimal invazif olması nedeniyle fiberoptik bronkoskopi kullanılarak alınan transbronşiyal biyopsilerdir. Radyolojik ve klinik özellikleri ile KOP’u
düşündürmekte olan bir olguda, transbronşiyal biyopsi ile
alınan dokuda, histolojik olarak organize pnömoni paterninin
106
gösterilmesi tanı için yeterlidir.[27,28] Ancak şüpheli olgularda birlikte bulunabileceği diğer hastalıkların dışlanabilmesi
için günümüzde video yardımlı torakoskopi veya açık akciğer
biyopsileri güvenle kullanılabilecek yöntemlerdir.
KOP’ta spontan rezolüsyon nadirdir.[29] Genel olarak tedavi, glukokortikoidlere dayanmaktadır. Tedaviye 1-1.5
mg/kg/gün prednizolon (ideal vücut ağırlığı kullanılır) ile
başlanır. Günlük maksimum doz 100 mg’dır. Tedaviye bu
doz ile 4-8 hafta devam edilir. Hastalık stabil halde kalmış
veya düzelme saptanmışsa, doz tedricen azaltılarak 0.5-1
mg/kg/gün’e düşülür. Bu dönem 4-6 hafta sürmelidir.
Sonrasında nüks gözlenmezse 3-6 ay içerisinde tedavi kesilir.
Bu dönem sonrasında hasta, bir yıl süresince her 6-8 haftada
bir akciğer grafisi ve solunum fonksiyon testleriyle takip
altında tutulmalıdır. Nüks olması halinde tedaviye tekrar
başlanmalıdır. Nüks hastaların %13-58’inde gözlenir.[30,31]
Bazı hastalarda uzun süreli düşük doz glukokortikoid tedavisi gerekebilmektedir. Bazı yazarlar tarafından nükslerin mortaliteyi artırmadığı ve uzun süreli mortalite yaratmadığı
belirtilmektedir. Bu sebeple glukokortikoidlerin yan etkilerinden ve nüks göstermeyen hastalarda gerekmediği halde
uzun dönemler boyunca tedaviden kaçınmak amacıyla düşük
glukokortikoid dozları ve kısa bir tedavi süresi önermektedirler.[2,31] Glukokortikoid tedavi ile gereken etkinliğin sağlanamadığı ya da yan etkilerin hasta tarafından tolere edilemediği durumlarda tedaviye bir sitotoksik ajanın eklenmesi uygun
olabilir. Bu tedaviyle beraber steroid dozu düşük tutulabilmektedir (0.25 mg/kg/gün). Bu amaçla en çok kullanılan
ajan siklofosfamid’dir. 50 mg/gün dozunda başlanıp 2-4 hafta
içerisinde maksimum doza (150 mg/gün) ulaşılır. Tedaviye
3-6 ay devam edilir. Bu tedavi süresince total beyaz küre sayısı haftalık takiplerle ⬎4000/mm³ düzeyinde tutulmalıdır.
Lökopeni, anemi ve trombositopeni sıklıkla karşılaşılan yan
etkileridir. Bazı yayınlarda hafif semptomları olan ve kortikosteroid tedaviyi tolere edemeyen hastalarda makrolid antibiyotiklerinin etkili olduğu ve alternatif bir tedavi seçeneği
olarak kullanılabileceği bildirilmiştir.[29,32,33] Soliter KOP’un
tedavisinde cerrahi rezeksiyonun yeri vardır. Toplam 43 hastanın retrospektif olarak değerlendirildiği iki çalışmada cerrahi olarak rezeke edilen soliter KOP olgularından 41’inde
nüks gözlenmemiştir.[34,35]
Sistemik glukokortikoid tedavi ile hastaların büyük bir
bölümünde yüz güldürücü sonuçlar alınır. Tedaviye yanıt
sıklıkla 3-4 hafta içerisinde belirgin hale gelir. Ancak klinik
ve radyolojik nüksler sıktır.[27,28] Seyri sırasında üçten fazla
nüksün görüldüğü hastalarda uzun dönem düşük doz glukokortikoid tedavi gerekebilmektedir. İdiopatik interstisyel
pnömoniler içerisinde en iyi prognoza sahip formlardan biridir. Hızlı progresyon gösteren ölümcül KOP çok nadirdir.[36]
Kaynaklar
1.
Kriptojenik organize pnömoni: Olgu sunumu ve literatürün gözden geçirilmesi İ. O. Alıcı ve ark.
Wittram C, Mark EJ, McLoud TC. Histologic correlation of the ATS/ERS 2002
classification of idiopathic interstitial pneumonias. Radiographics
2003;23:1057–71.
Solunum Hastalıkları
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
Cordier JF. Cryptogenic organising pneumonia. Eur Respir J 2006;28:422–46.
Milne LS. Chronic pneumonia (including a discussion of two cases of syphilis
of the lung). Am J Med Sci 1911;142:408-38.
Davison AG, Heard BE, McAllister WA, et al. Cryptogenic organizing
pneumonitis. Q J Med 1983;52:382-94.
Alasaly K, Muller N, Ostrow D, et al. Cryptogenic organising pneumonia. A report
of 25 cases and a review of the literature. Medicine 1995;74:201-11.
Peyrol S, Cordier JF, Grimaud JA. Intra-alveolar fibrosis of idiopathic
bronchiolitis obliterans-organizing pneumonia. Cell-matrix patterns. Am J
Pathol 1990;137:155-70.
Takiya C, Peyrol S, Cordier JF, Grimaud JA. Connective matrix organization in
human pulmonary fibrosis. Collagen polymorphism analysis in fibrotic deposit
by immunohistological methods. Virchows Arch 1983;44:223-40.
Kuhn C, Boldt J, King TE, et al. An immunohistochemical study of architectural
remodeling and connective tissue synthesis in pulmonary fibrosis. Am Rev
Respir Dis 1989;140:1693-703.
Lappi-Blanco E, Kaarteenaho-Wiik R, Soini Y, et al. Intraluminal fibomyxoid
lesions in bronchiolitis obliterans organizing pneumina are highly capillarized.
Hum Pathol 1999;30:1192-6.
Lappi-Blanco E, Soini Y, Kinnula V, Paakko P. VEGF and bFGF are highly
expressed in intraluminal fibromyxoid lesions in bronchiolitis obliterans
organising pneumonia. J Pathol 2002;196:220–7.
Suga M, Iyonaga K, Okamoto T, et al. Characteristic elevation of matrix
metalloproteinase activity in idiopathic interstitial pneumonias. Am J Respir
Crit Care Med 2000;162:1949-56.
Drakopanagiotakis F, Polychronopoulos V, Judson MA. Organizing pneumonia.
Am J Med Sci 2008;335:34-9
Colby TV. Pathologic aspects of bronchiolitis obliterans organizing pneumonia.
Chest 1992;102:38S-43S.
Myers JL, Colby TV. Pathologic manifestations of bronchiolitis, constrictive
bronchiolitis, cryptogenic organizing pneumonia, and diffuse panbronchiolitis.
Clin Chest Med 1993;14:611-22.
Basset F, Ferrans VJ, Soler P, et al. Intraluminal fibrosis in interstitial lung
disorders. Am J Pathol 1986;122: 443-61.
Mark EJ, Matsubara O, Tan-Liu NS, Fienberg R. The pulmonary biopsy in the
early diagnosis of Wegener’s (pathergic) granulomatosis: a study based on 35
open lung biopsies. Hum Pathol 1988;19:1065-71.
Travis WD, Hoffman GS, Leavitt RY, et al. Surgical pathology of the lung in
Wegener’s granulomatosis. Review of 87 open lung biopsies from 67 patients.
Am J Surg Pathol 1991;15:315-33.
Uner AH, Rozum-Slota B, Katzenstein AL. Bronchiolitis obliterans-organizing
pneumonia (BOOP)-like variant of Wegener’s granulomatosis. A
clinicopathologic study of 16 cases. Am J Surg Pathol 1996;20:794-801.
Kawanami O, Basset F, Barrios R, et al. Hypersensitivity pneumonitis in man.
Light-and electron-microscopic studies of 18 lung biopsies. Am J Pathol
Cilt 20, Sayı 3, 2009,102–107
1983;110:275-89.
20. Bulmer SR, Lamb D, McCormack RJ, Walbaum PR. Aetiology of unresolved
pneumonia. Thorax 1978;33:307-14.
21. Yousem SA, Lohr RH, Colby TV. Idiopathic bronchiolitis obliterans organizing
pneumonia/ cryptogenic organizing pneumonia with unfavorable outcome:
pathologic predictors. Mod Pathol 1997;10:864-71.
22. Bedrossian CW, Greenberg SD, Singer DB, et al. The lung in cystic fibrosis. A
quantitative study including prevalence of pathologic findings among different
age groups. Hum Pathol 1976;7:195-204.
23. Hausler M, Meilicke R, Biesterfeld S, et al. Bronchiolitis obliterans organizing
pneumonia: a distinct pulmonary complication in cystic fibrosis. Respiration
2000;67:316-9.
24. Pesci A, Majori M, Piccoli ML, et al. Mast cells in bronchiolitis obliterans
organizing pneumonia. Mast cell hyperplasia and evidence for extracellular
release of tryptase. Chest 1996;110:383-91.
25. Forlani S, Ratta L, Bulgheroni A, et al. Cytokine profile of bronchoalveolar
lavage in BOOP and UIP. Sarcoidosis Vasc Diffuse Lung Dis 2002;19:47-53.
26. Sen S, Sentürk E, Kacar F, et al. Bronchiolitis obliterans organizing pneumonia
presenting with solitary pulmonary nodule and spontan pneumothorax Tuberk
Toraks 2004;52:280-4.
27. Azzam ZS, Bentur L, Rubin AH, et al. Bronchiolitis obliterans organizing
pneumonia. Diagnosis by transbronchial biopsy. Chest 1993;104:1899-901.
28. Dina R, Sheppard MN. The histological diagnosis of clinically documented
cases of cryptogenic organizing pneumonia: diagnostic features in
transbronchial biopsies. Histopathology 1993;23:541-5.
29. Epler GR, Colby TV, McLoud TC, et al. Bronchiolitis obliterans organizing
pneumonia. N Engl J Med 1985;312:152-8.
30. Lohr RH, Boland BJ, Douglas WW, et al. Organizing pneumonia. Features and
prognosis of cryptogenic, secondary, and focal variants. Arch Intern Med
1997;157:1323-9.
31. Lazor R, Vandevenne A, Pelletier A, et al. Cryptogenic organizing pneumonia.
Characteristics of relapses in a series of 48 patients. Am J Respir Crit Care
Med 2000;162:571-7.
32. Stover DE, Mangino D. Macrolides: a treatment alternative for bronchiolitis
obliterans organising pneumonia? Chest 2005;128:3611-7.
33. Ichikawa Y, Ninomiya H, Katsuki M et al. Low-dose/long term erythromycin for
treatment of bronchiolitis obliterans organising pneumonia (BOOP). Kurume
Med J 1993;40:65-7.
34. Maldonado F, Daniels CE, Hoffman EA, et al. Focal organising pneumonia on
surgical lung biopsy: causes, clinicoradiologic features and outcomes. Chest
2007;132:1579-83.
35. Melloni G, Cremona G, Bandiera A, et al. Localized organising penumonia:
report of 21 cases. Ann Thorac Surg 2007;83:1946-51.
36. Cohen AJ, King TE Jr, Downey GP. Rapidly progressive bronchiolitis obliterans
with organising penumonia. Am J Respir Crit Care Med 1994;149:1670-5.
Cryptogenic organizing pneumonia: Case report and review of the literature İ. O. Alıcı et al.
107