T.C.
EGE ÜNİVERSİTESİ
DİŞ HEKİMLİĞİ FAKÜLTESİ
AĞIZ, DİŞ VE ÇENE RADYOLOJİSİ ANABİLİM DALI
KANSER RİSKİNİN BELİRLENMESİ VE ORAL MALİGNENSİLERİN
TANISINDA MİKRONÜKLEUS TESTİNİN DEĞERLENDİRİLMESİ
BİTİRME TEZİ
Stj. Dişhekimi Levent SAVRAN
Danışman Öğretim Üyesi: Prof. Dr. Pelin GÜNERİ
İZMİR-2010
İÇİNDEKİLER
1. GİRİŞ VE AMAÇ
1
2. GENEL BİLGİLER
3
2.1. Kanser
3
2.2. Kanser Epidemiyolojisi
5
2.3. Oral Kanser Epidemiyolojisi
5
2.4. Oral Kanserlerin Lokalizasyonu
6
2.5. Oral Kanserlerin Etiyolojik Faktörleri
9
2.5.1. Sigara ve Alkol Tüketimi
10
2.5.2. Viral Enfeksiyonlar
11
2.5.3. Beslenme
12
2.5.4. Ağız Hijyeni
12
2.5.5. Diğer Faktörler
12
2.6. Premalign Lezyonlar
13
2.6.1. Oral Lökoplaki:
13
2.6.2 Eritroplaki:
14
2.6.3. Oral Liken Planus:
15
2.6.4. Submüköz Fibrozis:
15
2.7. Oral Kanserlein Tanısı
15
2.8. Oral Kanserin Erken Tanısı ve Dişhekimlerinin Tanıdaki Rolü
16
2.9. Genotoksik Hasar
20
3. MİKRONÜKLEUS TESTİ
22
3.1. Mikronükleus Nedir:
22
3.2. Mikronükleus Tekniğinin Gelişimi:
22
3.3. Eksfolyatif Hücrelerde Mikronükleus Testi
23
3.4. Mikronükleus Testinin Uygulanması
24
3.4.1. Örnek Toplanması :
24
3.4.2. Örneklerin Hazırlanması :
26
3.4.3. Örneklerin İncelenmesi :
26
3.4.4. Sonuçların Değerlendirilmesi :
28
3.5. Mikronükleus Tekniğinin Kullanım Alanları
29
3.5.1. Mesleki ve Çevresel Etkenlerin Araştırılmasında
29
3.5.2. Kanser Tedavisinin Gözlemlenmesi ve Kemo Prevensiyon
30
3.5.3. Kanser Riski Taşıyan Bireylerin Tanısında
31
3.5.4. Yaşam Biçimi ve Konak Faktörü
33
4. SONUÇ
35
5. ÖZET
36
6. KAYNAKLAR
38
7. ÖZGEÇMİŞ
44
1. GİRİŞ VE AMAÇ
Oral kanserler, malign neoplazmlar arasında
mortalite nedenlerinden
yer alan önemli morbidite ve
biridir. Oral kanserlerin dünyada en sık izlenen altıncı
kanser olduğu bilinmektedir. Kanser riski taşıayan hastalarda kemoprevensiyon
kullanımıyla premalign lezyonların progresyonunun engellenmesi gerçekleştirilebilir;
bu da oral kanser risklerinin ve oral kanserlerin erken tanısını gerektirir.
Lokalizasyonları nedeniyle
etkili
oral kanserlerin erken teşhisini yapabilecek en
grubu diş hekimleri oluşturmaktadır. Diş hekimleri
iyi bir anamnez ve
dikkatli bir muayenenin yer aldığı teşhis süreci ile hayat kurtarıcı olabilir. Erken
teşhisin hayat kurtardığı ve yaşam kalitesini arttırdığı bu sürecin, hem hastalar hem
de diş hekimleri tarafından çok iyi değerlendirilmesi gerekmektedir.
Mevcut olan oral kanserlerin teşhis yöntemleri (fırça biyopsisi, toluidin mavisi
veya renk analizleri gibi) lezyonları malign transformasyonlarından sonra tespit
edebilmektedir. Bu sebeplerden dolayı bu araştırmada, kanser riskinin önceden
belirlenmesinde
ve
premalign
lezyonların
tanısında
kullanılabilecek
olan
mikronükleus (MN) testi incelenmektedir.
MN testi sitogenetik harabiyetin tespitinde, kromozom analizine göre kolay
uygulanabilmesi, daha fazla sayıda hücre sayılması ve istatistiksel yönden daha
anlamlı sonuçlar elde edilmesi avantajı sağlamasıyla yaygın kullanım alanı bulan bir
teknik olmuştur. Bu yöntemle bireylerin maruz kaldıkları etkenler sonucu oluşan
kanser riskleri incelenebildiği gibi, mevcut olan premalign ve malign lezyonların
değerlendirilmesi de yapılabilmektedir. Bu testin dişhekimlerine tanıtılması ve
kullanımının sağlanması sayesinde kanser olgularının erken tanısında ya da
prekanseröz
durumların
malign
dönüşümlerinin
kaydedilmesi mümkündür.
2
engellenmesinde
gelişme
2. GENEL BİLGİLER
2.1 Kanser.
Her hücre doğar, çoğalır (proliferasyon), farklılaşır (diferansiyasyon) ve ölür
(apoptozis); bütün bu olaylar doğal bir denge halinde sürer gider. Doku homeostazisi
yani yeniden yapım ve yıkımın bir düzen içinde oluşu, apoptozis/proliferasyon
dengesinin sağlıklı bir şekilde sürdürülmesine bağlıdır (1,2). Son yıllarda, birçok
önemli hastalığın patogenezinde bu dengenin bozulmasının (proliferasyonun artması
ve apoptozisin azalması) rol aldığı gösterilmiştir (3). Apoptozis (programlanmış
hücre ölümü), hücre intiharı olarak da bilinen fizyolojik bir olaydır (4). Embriyolojik
gelişimde ve erişkin dokunun gelişiminin sürdürülmesinde anahtar rol oynayan
apoptozis, hücrenin yaşam çemberi boyunca yapım-yıkım dengesinin sürdürülmesini
de sağlamaktadır. Örneğin kemik iliğinden devamlı olarak hücre üretimi devam
ederken, günde yaklaşık 5x1011 kan hücresi apoptozis yolu ile yok edilmektedir (5).
Barsak epitel hücrelerinin devamlı yenilenmesinde, menstürasyon esnasında uterusun
iç yüzündeki hücrelerin öldürülerek uzaklaştırılmasında ve fazla sayıda üretilen
nöronların %50’den çoğunun ortadan kaldırılmasında apoptozis rol almaktadır (5).
Apoptozis, organizmada hasar görmüş veya organizma için tehlikeli olabilecek
hücrelerin yok edilmesinde de görev alır; virüsle enfekte hücrelerin yanı sıra, hasarlı
DNA da apoptozis yolu ile yok edilir (5,6). Hücrenin DNA’sında meydana gelen
mutasyonlar kanser gelişimine neden olabilecekleri için bu hasarlı hücrelerin
apoptozis yolu ile öldürülmesi büyük önem taşımaktadır (1-6).
Apoptozisin hızının bozulduğu yani yavaşladığı veya arttığı hallerde çeşitli
hastalıklar ortaya çıkar. Örneğin, viral bir enfeksiyon sırasında, virüsler enfekte
3
ettikleri hücrede kendi proteinlerini sentezletirler ve hücrenin kendisi için gerekli
proteinlerin yapımını durdururlar. Bu yüzden virüsle enfekte olmuş hücrede
apoptozis indüklenir ve hücre ölür; böylece virüs kendisini de yok etmiş olur. Fakat
bazı virüsler (ör.Epstein-Barr virüs veya Human Papilloma virüsü), enfekte ettikleri
hücrenin apoptozise gitmesini baskılayan yollar geliştirmişlerdir. Örneğin EpsteinBarr virüsü, apoptozis sinyalini kontrol eden regülatörlerden biri olan Bcl-2’ye
benzeyen moleküller üreterek ve ayrıca enfekte ettiği hücrenin kendi Bcl-2 üretimini
indükleyen moleküller yaratarak apoptozisi durdurmaktadır (2). Papilloma virüs de,
güçlü bir apoptozis indükleyicisi olan p53’ü etkisizleştirmektedir. Virüslerin bu
etkileri sonucunda, bazı hematolojik kanserlerin gelişimine neden oldukları
düşünülmektedir (6).
Malign değişmelere karşı kritik bir savunma oluşturan birtakım proteinler,
apoptozis mekanizması içerisinde yer alırlar ve tümör baskılayıcı ajanlar olarak
fonksiyon görürler. Tümör baskılayıcı genlerin etkilerinin ortadan kaybolması ise,
hücrenin ölmesini durdurur. DNA yapısı bozuk bir hücre söz konusu olduğunda
hatalı hücrenin üremesi engellenemez ve kanser oluşumunun ilk çekirdeği meydana
gelir. Özellikle hızlı gelişen tümörlerde tümör baskılayıcı genlerin düzeyinin çok
düşük olduğu veya mutasyona uğradıkları gösterilmiştir (7).
Onkojen genler ise hücre büyümesini uyararak görev yaparlar; örneğin, normal
durumda hücre dışındaki büyüme faktörlerinin uyarılarını hücre içine taşıyan ras geni
mutasyona uğradığında büyümeyi uyaran yollar sürekli olarak aktive edilir ve hücre
çoğalması başlar. DNA tamirini sağlayan proteinlerin mutasyonları durumunda,
başka mutasyonlar da gözlenmektedir. Ayrıca anjiogeneze etki eden ve tümörün
invaziv ve metastatik potansiyelini belirleyen, tütündeki karsinojen maddelerin
4
metabolize edilmesini etkileyen, ya da virüslerin kanserojen etkilerine yardımcı olan
genlerin ve moleküllerin varlığı da bildirilmektedir (7).
2.2. Kanser Epidemiyolojisi.
Epidemiyoloji, hastalıkların sıklık ve dağılımına ait bilgileri kullanarak
nedenlerini arama bilimidir (8); kanser epidemiyolojisi ise toplumdaki kanser
özelliklerini ve kanser nedenlerini araştırır. Epidemiyolojik çalışmaların sonucunda,
dünya üzerinde kanser görülme ve ölüm oranlarındaki değişim özelliklerinin yanı
sıra, bazı kanserler için özgün risk faktörlerinin, potansiyel korunma stratejilerinin ve
kanser etiyolojisindeki genetik farklılıkların rolü belirlenebilmektedir. Dünyada ve
Avrupa'da en sık tanı konan kanserlerin akciğer (%13,3), meme (%13) ve kolorektal
kanseri (%13,2) olduğu bildirilmiştir (9,10). Amerika'da ise 2006 raporuna göre
erkeklerdeki kanser olgularının %56'dan fazlasını prostat, akciğer ve kolon-rektum
kanserlerinin oluşturduğu, kadınlarda ise ilk üç sırayı (yaklaşık olguların %54'ü)
meme, akciğer, kolorektal kanserlerin aldığı belirtilmiştir (11). Bununla birlikte,
kanser tiplerinin dağılımı gelişmişlik düzeylerine bağlı olarak ülkeden ülkeye, hatta
aynı ülke içinde şehirden şehire değişebilmektedir (9).
Kanser, nedeni bilinen ölümler arasında 1970’li yıllarda 4. sırada iken,
günümüzde kalp-damar hastalıklarından sonra 2. sıraya yükselmiştir ve her on
ölümden birinin nedeni olarak gösterilmektedir (12). Uluslararası Kanser Araştırma
Derneği (International Agency for Research on Cancer) GLOBOCAN 2002
projesinde elde edilen veriler doğrultusunda Avrupa'da 2,9 milyon (%54 erkek, %46
kadın) yeni kanser olgusu ve 1,7 milyon kansere bağlı ölüm beklenildiği
bildirilmiştir (10).
5
2.3. Oral Kanser Epidemiyolojisi.
Dünya çapında en sık görülen kanserler içerisinde yer alan oral kanserler,
oldukça yüksek morbidite ve mortalite oranına sahiptir. Diğer kanserler arasında
görülme sıklığı açısından altıncı sırada yer alırken, dünyanın çeşitli coğrafik
bölgelerinde bu insidans %1-40 arasında değişmektedir. Bu değişkenliğe rağmen
Dünya Sağlık Örgütü’nün tespit ettiği en ölümcül sekiz kanser türü içerisinde yer
almaktadır. Oral kanser insidansının yaş ile birlikte arttığı ve hastaların %95’inden
fazlasının 40 yaş üzerinde olduğu bildirilmektedir. Oral kanser erkeklerde kadınlara
oranla iki kat fazla görülmektedir. Oral kavite kanserleri mukoza, tükürük bezi veya
ağzın diğer yumuşak ve sert dokularından köken alan çok çeşitli türde kanserleri
kapsamaktadır ancak bunların %90’ından fazlasını, mukozanın yüzey epitelinden
gelişen skuamöz hücreli karsinom oluşturmaktadır. Oral kanser tanı ve tedavi
yaklaşımlarındaki gelişmelere rağmen hastaların yarısının yaşamlarını ilk beş yılda
kaybettiği bildirilmektedir (11).
Genellikle 45 yaşın üzerinde görülen oral kanserin oluşma riski ilerleyen yaşla
birlikte artar; bununla birlikte, son yıllarda skuamöz hücreli karsinomanın 40
yaşından daha genç hastalarda sıklıkla saptanmaya başladığı bildirilmiştir. Bu
durumun da kanser oluşumunu etkileyen diğer karsinojen faktörlerin etkileri veya
genetik predispozisyon nedeniyle meydana gelebileceği öne sürülmüştür. Gelişmiş
ülkelerde oral kanser oranı, gelişmemiş ülkelerdekinden daha düşüktür ve bu durmun
sağlık hizmetlerinin gelişmişlik düzeyiyle ilişkili olduğu düşünülmektedir. Bununla
birlikte, sosyokültürel ve coğrafik alt yapı da risk faktörleri üzerindeetkili
olduğundan, oral kanser olgularının dünya üzerindeki dağılımı da değişmektedir (7).
6
2.4. Oral Kanserin Lokalizasyonları.
Oral kanserlerin yaklaşık üçte birini ağız tabanı kanserleri oluşturmaktadır.
Genellikle bu bölgedeki premalign lezyonlardan sonra gelişen ağız tabanı kanserleri,
özellikle lingual frenulum ve sublingual bezin kanal ağızları etrafında yerleşir ve
kenarları sert ve düzgün olmayan, ülser benzeri bir lezyon olarak gözlenir.İleri
evrelerde dişetine ve dilin derinlerine doğru ilerleyebilir ve dil hareketlerinde
kısıtlama yaratabilirler. İlerlemiş olgularda submandibuler lenf düğümlerine, jugulodigastrik lenf düğümüne ve boyun lenf zincirinin üst ve alt düzeydeki dokularına
metastaz yapabilirler (7).
Dil kanserleri ise özellikle dilin posterolateral ve ventral yüzeylerinde meydana
gelir (Şekil 2). Dorsumundaki kanserler ise tersiyer sifiliz veya atrofik liken planus
gibi kronik lezyonlar sonrasında gözlenmektedir. Dil kökünü tutan skuamöz hücreli
karsinoma ise farenjit benzeri yakınmalar, konuşma güçlüğü, disfaji, dil
hareketlerinde kısıtlılık gibi klinik bulgular verebilir (7).
Yumuşak damak ve buranın alt arka bölgesinde bulunan komşu retromolar
bölge, ağız kanserlerinin yaklaşık %15’inin gözlendiği bölgelerdir ve genellikle bir
premalign lezyon sonrasında kanser gelisir. Lezyonların merkezi sert olmakla birlikte
perifere doğru sertlik azalır ve daha az infiltratif özellik taşırlar. Bu bölgedeki
skuamöz hücreli karsinomalar kötü differansiye ve boyutlarının küçüklüğü ile
orantısız
biçimde
derinlere
yayılan
lezyonlardır;
hastalar
farenjit
benzeri
yakınmalarla hekime başvurduklarında, lezyon çoktan bölgesel ve uzak lenf
düğümlerine metastaz yapmış durumdadır (7).
Yapışık dişeti ve alveolar gingival mukoza ağız kanseri lezyonlarının yaklaşık
%5'inin görüldüğü bölgelerdir ve lezyonlar daha çok posterior mandibuler
bölümlerde ağrısız olarak oluşumlar şeklinde gözlenir. Gingival karsinomanın
7
periodontal membran yoluyla alveol boşluğuna veya çenenin alveolar bölümüne
geçmesinden sonra, mandibulanın medüller kısmı da olaya katılır ve dişlerde
sallanma, ilk bulgu olarak görülebilir (7).
Bukkal mukoza, ağız kanserlerinin yaklaşık %2'sinin lokaliza olduğu
bölgelerdir. Posterior kısımda yer alan ağrısız küçük ülserler veya sert yapılar
şeklinde görülen lezyonlar, genellikle bu bölgedeki premalign bir lezyondan
kaynaklanırlar ve rutin fonksiyonlarla tramvaya uğrayarak ülserleşebilirler (7).İleri
evrelerde trismus yaratarak çiğneme fonksiyonununu kısıtlayan bu lezyonlar,
maksilla ve mandibulanın mukobukkal kıvrımlarına yayılarak ekzofitik bir görünüm
alabilirler (Şekil1). Fark edilemeyen veya tedavide gecikilen lezyonların ciltte
fistüller oluşturabildikleri de bildirilmiştir (7).
Şekil 1. Bukkal mukozada görülen papiller ekzofitik lezyon (12).
8
Şekil 2. Dilin ventral bölgesi ile ağız tabanı sınırı arasındaki ülseratif lezyon
(12).
Tablo 1: Bölgelerine göre yeni gözlenen oral kanser olguları. İngiltere 2007
(13)
Bölge
Erkek
Kadın
Toplam
E:K oranı
Dudak (ICD10 C00)
Dil (ICD10 C01-02)
Ağız tabanı (ICD10 C03-06)
Orofarenks (ICD10 C09-10)
Piriform sinus (ICD10 C12)
Hipofarenks (ICD10 C13)
Diğer bölgeler (ICD10 C14)
220
1008
954
799
267
109
183
113
590
620
264
59
62
77
333
1598
1574
1063
326
171
260
1.9:1
1.7:1
1.5:1
03:01
4.5:1
1.8:1
2.4:1
Toplam oral kanser
3.540
1.785
5.325
02:01
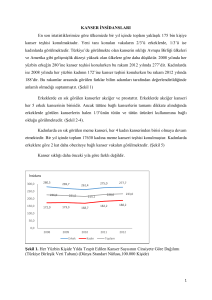
Tabloda görüldüğü üzere, İngilterede 2007 yılında yapılan bir araştırmaya göre
oral kanserlerin yaklaşık 1/3’ü ağız tabanı ve dil üzerinde görülmektedir. Orofarenks,
piriform sinus ve hipofarenks kanserleri oral kanserlerin toplam ancak %29 unu
oluştururken, en az görülen oral kanser tipi olan dudak bölgesinin kanseri %6’sını
9
meydana getirmektedir. Oral bölge malign lezyonlarının %90’dan fazlasının
skuamöz hücreli karsinoma olduğu bildirilmektedir (3).
2.5. Oral Kanserlerin Etiyolojik Faktörleri.
Oral malignansiler kavramına ait biyolojik temeli inceleyen hayvan
çalışmalarından genetik araştırmalara dek tüm değelendirmeler, insan epiteliyal
kanserinin tek bir olaya bağlı olarak gelişmediğini ve zamanla birikerek, vücudun
immün kontrolüne ve apoptozise direnen anormal hücrelerin çoğalmasına olanak
tanıyan birden fazla etkene bağlı olduğunu ortaya koymuştur (14). Karsinogenez
klinik olarak yakınma oluşturan bir bulgu yaratana dek zaman içinde birtakım
çevresel faktörlerin etkisi ile gelişir; bu nedenle insan kanserlerinin çok büyük bir
kısmı ileri yaştaki ve belirli faktörlerin etkisi altındaki bireylerde daha sık
görülmektedir.
Tablo 2. Oral kanserlerde risk faktörleri (15).
Risk faktörü
Risk artışı
Bölge
Sigara - tütün
5-9
Oral
Alkol
3-9
Oral
Sigara + alkol
13
HPV 16
6
Aile öyküsü
2-4
Fanconi anemisi
500-700
Lingua, palatin tonsil
2.5.1. Sigara ve Alkol Tüketimi.
Sigara içmek ve tütün çiğnemek oral skuamöz hücreli karsinoma (OSHK)
gelişiminde iki önemli risk faktörüdür (Tablo 2). Sigara içenlerde içmeyenlere oranla
OSHK gelişme riskinin 5-9 arttığı gösterilmektedir (15).
10
Yalnızca
alkol
kullanımı
OSHK
riskini
3-9
kat
arttırmaktadır;
ancak, sigara ile birlikte kullanıldığında sinerjik etki gösterir (Tablo 1). Fazla
miktarda alkol ve sigaranın beraber tüketimi aynı miktar alkol ve sigaranın tek başına
kullanımına kıyasla oral kanser riskini 13 kat arttırmaktadır. Kanser riskinin tüketilen
sigara ve alkol miktarı ile doğru orantılı olduğu saptanmıştır. Tütünde elliden fazla
karsinojen bulunmaktadır, bu karsinojenleri inaktive-aktive eden enzimleri kodlayan
genlerdeki polimorfizmler oral kanser gelişme riskini etkiler. Etanolün direkt
karsinojenik etkisi yoktur, karsinogenlere mukozal maruziyeti artıran bir solventtir.
Hücre membranını direkt etkileyerek permeabiliteyi artırır. Ayrıca nütrisyonel ve
immün eksikliklere yol açarak ve karaciğer fonksiyonlarını bozarak kanser
gelişiminde rol oynamaktadır (15).
Tütündeki aromatik hidrokarbonlar ve nitrozaminler gibi güçlü kanserojenlerin
yanı sıra, duman ve ısı da ağzın müköz membranlarını irrite ederek kanser riskini
arttırır. Yılda tüketilen sigara sayısı, sigaranın filtreli ve filtresiz oluşu, içerdiği
katran miktarı, tüttürme frekansı ve inhalasyon şekli ile kanser riski arasında bir ilişki
olduğu saptanmıştır. Tütünü sigara olarak kullananların yanısıra, tütün çiğneme,
betel yapraklarını çiğneme gibi alışkanlıkları olanlarda da oral kavite kanserleri
sıklıkla görülmektedir.
Alkol kullananlarda larenksin dış kısmında yerleşen kanserlerin oranının iç
kısımına yerleşenlerden daha fazla olmasının nedeni, bu bölgenin alkolle daha uzun
süre temas
etmesidir. Bu sonuç ayrıca alkolün topkal etkisinin de önemli
olabileceğini göstermiştir. Nitekim uzun süre ve yoğun olarak ağız gargarası
kullananlarda oral kanser riskinin arttığını gösteren çalışmalar, bu görüşü
desteklemektedir (15).
11
2.5.2. Viral Enfeksiyonlar
Human papilloma virus (HPV)’ün; kadınlarda serviks kanseri gelişiminde rol
oynadığı gibi, oral karsinogenezde de etkili olduğu çeşitli çalışmalarda gösterilmiştir.
Serviks kanserinde rol oynayan HPV 16 ve 18 oral kanserlerin sırasıyla % 22 ve
14’ünde saptanır. Özellikle orofarinksin lingula ve palatin tonsillerden gelişen SHK
etiyolojisinde HPV rol oynar. Kanada’da yapılan bir çalışmada tonsil kökenli
OSHK’lerde %43 oranında viral DNA saptanmıştır. Onkojenik HPV genomu
saptanan bireylerde dil kanseri gelişme riskinde %25 artış bildirilmiştir. Oral HPV
infeksiyonu seksüel davranış ile ilişkilidir. HPV 16 seropozitifliği oral kanserlerde 2
kat fazladır ve HPV 16 enfeksiyonu oral kanser riskini 6 kat artırır (Tablo 2). Oral
kavite kanserlerinde HPV prevalansı %23 olarak bildirilmiştir.(15)
Oral kanserlerin oluşumunda katkıları olduğu düşünülen diğer virüsler ise,
Herpesvirüs grubu içerisinde yeralan Epstein-Barr ve Humanherpesvirusleri’dir.
2.5.3. Beslenme
Etiyolojik faktörler arasında beslenmenin de çok önemli bir yerinin olduğu son
epidemiyolojik çalışmalarla gösterilmiştir. Vitamin C içeren ve karotenden zengin
olan narenciye ürünlerinin, diyette yer alan süt ve süt ürünlerinin, kalsiyum, vitamin
D ve vitamin E’nin oral/farengeal kanserlerle
aralarında ters yönlü bir ilişki
bulunmaktadır (15).
2.5.4. Ağız Hijyeni
Ağız hijyeninin kanser riski üzerine yapılan araştırmalarda periodontal
hastalıkları bulunan bireylerin risk faktörünün daha yüksek olduğu belirlenmiştir(16).
Aynı araştırmada kayıp diş sayısının neoplazik oluşumların riskini arttırdığı
görülürken,
restorasyon
veya
protez
izlenmektedir(16).
12
varlığının
bu
oluşumu
etkilemediği
Oral kanser hastalarının
oral hijyenlerinin beligin biçimde kötü olduğu
gösterilmiştir. Ağız hijyeninin kötü olması, uyumsuz protezlerin ve hatalı dolgu
kenarlarının yumuşak dokuda kronik travma oluşturması oral kavite kanser riskini
arttıran faktörler arasında sayılmaktadır. Hastaların çoğunun dişlerini nadiren
fırçaladıkları, dişhekimine hiç gitmedikleri ve fazla sayıda diş kaybettikleri
gösterilmiştir (15).
2.5.5. Diğer Faktörler.
Kronik aktinik maruziyeti: Dudak kanseri riskini arttırdığı saptanıştır.
Plummer-Vinson sendromu: Demir eksikliği anemisi, disfaji ve özefagial
webden oluşan bu sendromda orofarinks ve özefagus kanseri olguları bildirilmiştir.
Fanconi anemisi (FA): Fanconi Anemisi % 90'in üzerinde aplastik anemi,
% 10 civarında da lösemi veya solid tümörler ve mültipl konjenital defektler ile
birlikte olabilen otozomal resesif bir hastalıktır. Kromozomal instabilite, özellikle
klinik tablonun çok fazla fikir vermediği olgularda iyi bir tanı kriteri olarak
kullanılmaktadır Baş boyun kanseri gelişme riski 500-700 kat artmıştır. %14 FA’li
hastada 40 yaşına geldiğinde baş boyun kanseri gelişir (Tablo 2).
Pozitif aile öyküsü: Bir ya da daha fazla birinci derece akrabasında baş boyun
kanseri görülen bireylerde baş boyun kanseri görülme riski 2-4 kat artmıştır, bu risk
artışı sigara ve alkol kullanımı gibi bilinen risk faktörleri olan bireylerde daha
belirgindir (Tablo 2). Benzer şekilde, 487 hastayı içeren bir olgu-kontrol
çalışmasında aile öyküsünün oral-farengeal kanser eğiliminde hafif bir artışa yol
açtığı, özellikle sigara içen erkeklerde riskin arttığı bildirilmiştir.
İmmünosüpresyon: Renal transplant alıcılarında lökoplaki, saçlı lökoplaki,
gingival hiperplazi, displazi ve dudak kanseri riski artmıştır. HIV pozitif hastalarda
13
oral kanserin daha genç yaşta ve daha sık görüldüğü ve daha agresif seyrettiği
gösterilmiştir (15).
2.6. Premalign Lezyonlar:
Oral kansere dönüşme riski taşıyan başlıca lezyonların lökoplaki, eritroplaki,
submüköz fibrozis ve liken planus oldukları kabul edilmektedir. Bu lezyonlar tek
başlarına görülebildikleri gibi, “alan kanserizasyonu” teorisine uygun olarak, ikili ve
çoklu halde de bulunabilmektedir.
2.6.1. Oral lökoplaki (OL):
Klinik ya da patolojik olarak herhangi bir hastalığa ait olmayan oral
mukozadaki beyaz-gri plaklardır. Oral mukozanın en sık premalign lezyonudur. İleri
yaşta (özellikle 50 yaşından sonra) ve erkeklerde daha sık görülür (15). Sigara, alkol,
tütün çiğneme, kötü ağız hijyeni gibi etkenler OL gelişiminde rol oynar. Altta yatan
faktörler elimine edildikten sonra persiste OL için tedavi gerekmektedir; ancak hiçbir
tedavinin diğerine üstünlüğü belirlenememiştir. Onüç yıllık sürede toplanan 3256
lökoplaki tanısı almış patoloji örneğinin incelenmesi sonucunda; OL’nin bukkal,
alveolar ve mandibular mukozada sık görüldüğü, dudak (%24), ağız tabanı (%42), ve
dilde (%24) yerleşen lezyonlarda displastik ya da maligniteye dönüşümün daha sık
olduğu bildirilmiştir. Hafif-orta epitelyal displazi %12, ciddi epitelyal displazi %4.5,
invaziv skuamöz hücreli karsinom %3 oranında görülmüştür. Oral lökoplakili 130
hastayı içeren daha güncel bir çalışmada benzer şekilde ağız tabanı, yumuşak damak,
alveoler mukoza ve bukkal mukozadaki lezyonlarda kanser riskinin daha fazla
olduğu, lökoplakinin nodüler tipinde displazi ve invaziv kanser riskinin arttığı, %28
hafif-orta displazi, %4.2 ciddi displazi-karsinoma in-situ, %7 verrüköz ya da
skuamöz hücreli karsinom saptandığı bildirilmiştir. Oral premalign lezyonların
cerrahi eksizyon sonrası 7.5 yıllık takibinde %11’inde karsinom geliştiği
14
saptanmıştır.( 17). Lökoplakinin malign tranformasyona uğramasını önleyecek bir
tedavi yoktur.
2.6.2. Eritroplaki (OEL):
Lökoplakiden daha nadir görülürler ancak malignite riski daha fazladır. Klnik
ya da patolojik olarak herhangi bir hastalığa ait olmayan oral mukozadaki kırmızı
plaklardır. Bazen lökoplaki ile beraber görülürler ve kanser riskini arttırırlar. Altmış
beş hastalık bir seride OEL görülen hastaların %51’inde displazi, %40’ında invaziv
kanser görülmüştür (18). Tayland’da yapılan 123 vakayı içeren bir çalışmada
lökoplakinin eritroplakiden 13 kez fazla görülmesine rağmen, skuamoz hücreli
karsinomun eritroplakide daha sık saptandığı bildirilmiştir (19).
2.6.3. Oral Liken planus (OLP):
Prekanseröz bir mukokutanöz lezyondur. Histolojik olarak doğrulanmış 241
oral liken planus vakasının kayıtlarının retrospektif olarak incelendiği bir çalışmada
10 yıllık takip sonunda %3,7 hastada OLP alanlarında invaziv skuamöz hücreli
karsinom veya in-situ karsinom geliştiği bildirilmiştir, çoğu kanserizasyon atrofik
ve/veya eroziv LP alanlarında görülmüştür. (20) Benzer olarak 326 OLP hastasını
içeren bir çalışmada %1,3 hastada ortalama 6,5 yıl sonra oral kanser gelişmiştir ve bu
hastaların çoğunun eroziv form LP’dan kaynaklandığı görülmüştür. Tekrarlayan
karsinojen uyarılarla OLP kansere dönüşebilir. Daha geniş çaplı bir çalışmada OLP
tanısı konulmuş 723 hastanın ortalama 4,5 yıllık izlemi sonucunda %0,8 hastada
eroziv ya da eritematöz LP alanlarında invaziv kanser geliştiği bildirilmiştir. (21)
OLP lezyonlarını stres, gıdalar, dental işlemler, sistemik hastalıklar ve oral hijyen
bozukluğu gibi faktörler tetikleyebilir. (21)
15
2.6.4. Submüköz Fibrozis (SF):
Oral dokuda sarı-beyaz renk değişimidir, üst gastointestinal kanalın
submukozal tabakasını etkileyen bir kollagen bozukluğudur. En önemli sebebi
özellikle Asya ülkelerinde yaygın olan tütün çiğneme alışkanlığıdır, uzamış B
vitamini eksikliği, acı biber tüketimi gibi faktörler de etiyolojide rol oynamaktadır.
(22)
2.7. Oral Kanserlerin Tanısı.
Oral kavite kanserleri özellikle dudak kanserleri kolay tanına kanserlerdir. Bu
bölge kanserleri ile ilgili başlıca semptomlar iyileşmeyen yara, kanama, ağız kokusu,
konuşma bozukluğu, yutma güçlüğü, trismus ve kulak ağrısıdır. Bu semptomlardan
bir veya birkaçı ile başvuran hastada detaylı bir anamnez alınmasını takiben
(özellikle baş boyun kanserleri açısından risk faktörleri, geçirilmiş tedaviler vs
sorgulanmalı) tam bir KBB muayenesi yapılmalıdır. Bu hem ikincil primer
lezyonların saptanması, hem de oral kavite kanserlerinde sık gözlenen multifokal
hastalığın belirlenebilmesi için çok önemlidir.
Oral kavite kanserlerinde multifokal hastalık tarlaya ağaç dikimi şeklinde tarif
edilir. Bu nedenle mutlaka bimanuel muayene yapılmalı ve eldiven giyilerek dil, ağız
tabanı, damak gibi bölgeler palpe edilerek gözden geçirilmelidir. Ağız tabanı,
özellikle arka kısımlar, dili sağa ve sola doğru çekerek araştırılmalı ve verrüköz,
ekzofitik veya ülseratif bir lezyon olup olmadığı incelenmelidir (15).
Lökoplaki, eritroplaki ve diğer şüpheli lezyonların tanılanmasındaki zorluk,
lezyonların klinik görünüşlerinin birbirlerine çok benzemesinden kaynaklanmaktadır:
Friksiyonel keratoz lökoplakiye, enflamatuvar lezyonlar ise eritroplakiye benzeyen
klinik özelliklere sahiptir (23). Gözle ayırt edilmesi zor olan premalign ve malign
lezyonların erken evrede tanılanmasını sağlamak amacıyla, çeşitli yöntem ve gereçler
16
geliştirilmektedir. Dişhekimlerinin de bu yöntem ve gereçleri tanımaları ve gereken
olgularda doğru olarak kullanmaları hastalığın tanısında yaşamsal önem taşımaktadır.
2.8. Oral Kanserin Erken Tanısı ve Dişhekimlerinin Tanıdaki Rolü.
Tavsiye Edilen Oral Kanser Muayenesi (12):
1. Ekstraoral muayene
• Baş ve boyun muayene edilmesi.
• Lenf nodüllerinin ve tükrük bezlerinin bimanuel palpasyonu.
2. Dudaklar
• Dudak dış yüzeylerinin ve vermilion hattının muayene ve edilip palpe
edilmesi.
•Dudak iç mukozasının muayene ve palpe edilmesi.
3. Bukkal mukoza
• İç yanak hattının muayene ve palpe edilmesi.
4. Gingival/alveoler mukoza
• Bukkal ve lingual yönlerdeki gingival/alveolar mukozanın muayenesi.
5. Dil
• Hastaya dilini çıkarmasını söyleyerek dil dorsumunun muayenesi.
• Hastaya dilini yukarı kaldırmasını söyleyerek ventral bölgenin muayenesi.
• Dilin gazlı bez yardımıyla tutularak dışarı ve her iki yana çekilmesi (Şekil 4)
ve lateral bölgelerinin ucundan lingual tonsil bölgelerine kadar muayene edilmesi
(Şekil 3) .
• Dilin palpe edilmesi.
6. Ağız tabanı
• Ağız tabanını muayene edilip ve palpe edilmesi.
7. Sert damak
17
• Sert damağın muayene edilmesi.
8. Yumuşak damak ve orofarenks
• Dilin ayna veya spatül yardımıyla deprese edilerekbastırılması ve yumuşak
damak ve orofarenksin muayene edilmesi.
Şekil 3 ve 4. Oral kanserlerin önerilen muayenesinde dilin incelenmesi (12).
Şekil 3.
Şekil 4.
Bireylerin çoğunluğu uzmanlara nazaran pratisyen hekim ve dişhekimleri
tarafından daha sıklıkla muayene edilmektedir; bu nedenle klinisyenlerin potansiyel
oral ve farengeal kanserlerin tanılanması için gereken ve yukarıda tavsiye edilen oral
kanser muayenesini daha sık uygulamaları gerekmektedir (21). Şüpheli bir lezyon
saptandığında, bistüri ya da ufak biyopsi forsepsi ile alınan konvansiyonel bir biyopsi
hala en güvenilir ve en detaylı bilgiyi sunan tek yöntemdir (12). Biyopsi direkt olarak
birincil hekim tarafından yapılabildiği gibi, hastanın sevk edildiği KBB uzmanı, baş
boyun cerrahı, maksillofasiyal cerrah tarafından da yapılabilir. Ayrıca, tanıdaki
gecikmeler şüpheli lezyonların ileri evre kanser olgularına dönüşmelerine neden
18
olduğundan ve iyileşme şansını düşürdüğünden, erken tanıda ilerleme kaydedilmesi
için hastaların ve halkın kanser hakkında bilgilendirilmesi gerekmektedir (21).
Gellrich ve ark. OSHK nedeniyle tedavi görmüş 1761 hasta üzerinde yaptıkları
çalışmada, diş hekimlerinin erken teşhis, tedavi ve postoperatif bakım üzerindeki
etkinliklerini araştırmışlardır. Elde edilen sonuçlar diş hekimlerinin (%40), aile
hekimleri (%27) ve maksilofasiyal cerrahlara (%23) göre daha erken dönemde oral
kanserleri teşhis edebildiklerini göstermiştir (25).
Alonge ve ark.’nın yaptıkları
araştırmaya 398 diş hekimi katılmış ve bu hekimlerin
%90’ı, 40 yaş ve üstü
hastalara rutin olarak yılda bir defa oral kanser muayenesi yapılması gerektiğini
belirtmiş ve diş hekimlerinin %99’u bu konuda gerekli bilgiye sahip olduklarını
vurgulamıştır (24).
Clovis ve ark. tarafından yapılan araştırmalarda,
diş
hekimlerinin %70-81’inin, 40 yaş ve üzerindeki hastalara ilk randevuda oral kanser
muayenesi yaptıkları bildirilmiştir (25). İngiltere’de yapılan bir çalışmada, genel
pratisyen diş hekimleri, oral cerrahlar, ağız hastalıkları uzmanları ve cerrahi diş
hekimlerini içeren uzman hekimlerin, oral kanser taramaları ile ilgili düşünceleri ve
tutumları değerlendirilmiş, pratisyen diş hekimlerinin uzman diş hekimlerine göre
oral kanserler hakkındaki son gelişmeler ve risk faktörleri hakkında bir takım bilgi
eksiklikleri olduğu saptanmıştır. Pratisyen diş hekimlerinin %41’i mezuniyet
sırasındaki oral kanser bilgilerinin yetersiz olduğunu, ancak bu eksikliğin mezuniyet
sonrası kurslar ile giderilebileceğini belirtmişlerdir (11).
Gellrich ve ark. yaptıkları çalışmada
(24)
oral kanser hastalarında
semptomların ilk ortaya çıkışı ve oral cerrahların ilk muayenesi arasında geçen
ortalama sürenin 4,9 ay olduğunu ve bu sürenin yapılan başka çalışmalardaki
sürelerle benzerlik gösterdiğini belirtmişlerdir. Bu gecikme, hastanın ağzındaki
mevcut duruma zamanla alışmasından, lezyonun zaman içinde kendi kendine
19
iyileşeceğini
düşünmesinden
ya
da
gittiği
hekimlerin
semptomları
doğru
değerlendirememesinden kaynaklanmaktadır (11). Alkol kullanımına bağlı oluşan
analjezik etkinin,
tümör kaynaklı ağrıları baskılayarak hastanın mevcut duruma
alışmasında etkili olabileceği de düşünülmektedir (24).
Son yıllarda, oral mukozada görülen primer ve sekonder malign değişimlerin
erken tanısının koyulması ve sınırlarının belirlenmesini kolaylaştırmak için “yüksek
riskli hastalar’ da uygulanan çeşitli tanı yöntemleri araştırmacılar tarafından
geliştirilmiş ve tartışılmıştır. Lugol’s iodine yada toluidine mavisi gibi boya ve
vernikler bu sahada başarılı birer potansiyel göstermişlerdir. Ayrıca 1970’lerin
başından itibaren araştırmacıların dikkati hematoporfirin türevleri ve tetrasiklinler
gibi floresans belirleyicilerin selektif intraselüler çökelmelerine çekilmiştir.(26)
Oral kanserlerin tanısı eksfolyatif sitoloji veya biyopsi prosedürleri gibi
yöntemlerle de gerçekleştirilebilmektedir. Yakın geçmişteki elektron mikroskopları,
histokimya, immünoloji, kromozomal çalışmalar gibi bilimsel gelişmeler bu
prosedürlere önemli seviyede spesifisite katılmıştır. Sitogenetik çalışmalar
karsinomalarda ve lenfomalardaki hücre popülasyonlarında anormal kromozom
bileşenlerini açığa çıkarmıştır. Kardeş-kromatid değişimi, kromozom hasarı ve
mikronükleus içeren hücre frekansı gibi sitogenetik son nokta çalışmaları da
kimyasal ve fiziksel mutajenlerin oral kavitedeki genotoksik etkilerini belirlemek
için önerilmiştir.(23)
2.9. Genotoksik Hasar.
Genotoksisite, fiziksel ya da kimyasal ajanlarla genetik materyalde oluşan
hasardır. Bu hasarlar; tek zincir kırıkları (SSB), çift zincir kırıkları (DSB), alkali labil
bölgeler (ALS) ve DNA katımlarıdır . Genetik materyalde oluşan hasarlar tamir
edilemediğinde
DNA
sekans
değişiklikleri,
20
kromozom
aberrasyonları
ile
sonuçlanabilen tek veya birden fazla nükleotid değişiklikleri ve bunların sonucu
olarak da rekombinasyon, mutasyon, doku hasarı, yaşlanma, kanser oluşabilmektedir.
Mutasyonlar
sıklıkla
sonuçlanabilmektedir.
gen
fonksiyonlarında
Moleküler
kanser
değişiklik
genetiğindeki
ya
son
da
kayıpla
gelişmeler,
karsinojenlerin çoğunun genotoksik olduğunu ve karsinogenezisin onkojenler ve
antionkojenlerdeki mutasyonlarla ilişkili olduğunu göstermiştir. Genotoksisite testleri
esas olarak kanserden korunmada,
çevresel etkenlerin (UV, irradyasyon),
endüstriyel kimyasalların etkisini araştırmada, ilaçların piyasaya sürülmeden önce
toksik etkilerini ve güvenilirliğini belirlemede kullanılmaktadır (27).
Son yıllarda yapılan oral kanser çalışmalarında, karsinoma oluşturan insan
karsinojenlerinin ağız mukozasındaki sitogenetik hasarının tesbiti için mikronükleus
testi kullanımı dikkate çarpmaktadır. Bu test bukal mukoza ekfoliatif epitel
hürelerine uygulanmaktadır. Mikronükleus içeren hücrelerin frekansı hedef dokunun
prokarsinojenleri reaktif/inaktif türlerine yada mutlak karsinojene dönüştürme
kapasitesini yansıtmaktadır.(23)
21
3. MİKRONÜKLEUS TESTİ
3.1. Mikronükleus Nedir:
Şekil 5. Bütün kromozomlardan ya da periferal kromozomal parçalardan izole
olan mikronükleusun anafaz da bölünen bir hücredeki görünümü.
Mikronükleuslar (MN) hücrenin mitoz bölünmesi sırasında ortaya çıkan, esas
çekirdeğe dahil olmayan, tam kromozom veya asentrik kromozom fragmanlarından
köken alan oluşumlardır (Şekil 5). MN sayısındaki artış, çeşitli ajanların hücrelerde
oluşturduğu sayısal ve yapısal kromozom düzensizliklerinin indirekt göstergesi
olarak değerlendirilmektedir. Anöploidiyi uyaran ajanlar, sentromer bölünme
hatalarına ve iğ iplikçiklerinde fonksiyon bozukluklarına yol açarak; klastojenler ise
kromozom kırıkları oluşturarak MN oluşumuna katkıda bulunmaktadırlar. (28)
3.2. Mikronükleus tekniğinin gelişimi:
MN testi 1950’lerde bitki hücrelerinde kromozom hasarının ölçülmesinde,
1970’lerde hayvan hücrelerinde ve daha sonra Haddle ve arkadaşları tarafından
kültüre edilmiş insan lenfositlerinde kimyasal karsinojenleri belirlemeye yönelik bir
test olarak kullanılmaya başlanmıştır (29). Bazı araştırmacılar (30,31) geliştirdikleri
modifiye metotlarla anöploidiye yol açan ajanlar ile klastojenleri birbirinden
ayırmada MN büyüklük farkından yararlanmışlar; klastojenlerce uyarılan MN’lerin
22
asentrik kromozomal fragmanlar içeren küçük, anojenlerce uyarılan MN’lerin tam
kromozomlar içeren daha büyük ebatlı olduğunu göstermişlerdir. Eastmond ve
Tucker (31) aynı amaçla antikinetokor antikorlarını kullanarak kinetokor pozitif
MN’lerin tam bir kromozom, kinetokor negatif MN’lerin ise asentrik kromozom
fragmanı içerdiğini ve bu yöntemin anöploidi uyaran ajanları klastojenlerden
ayırmada daha kesin bir yol olduğunu vurgulamışlardır.
3.3. Eksfolyatif hücrelerde Mikronükleus testi.
Lenfosit kültürlerindeki çalışmalara paralel olarak MN tekniği, eksfolyatif
hücrelere 1982 yılında ilk defa Stich ve arkadaşları (32) tarafından uygulanmıştır. Bu
teknik sayesinde ağız, burun, bronş ve ürotelyal eksfolyatif hücrelerde kimyasalların
ve enfeksiyonların etkilerini değerlendirmek mümkün olmuştur. Hızla çoğalan bu
epitelyal dokular çevreleriyle sürekli temas halindedir ve epitelin yüzeyel tabakasını
oluşturan eksfolyatif hücreler kolaylıkla elde edilebilmekte, dolayısıyla uğradıkları
genotoksik hasar da kolaylıkla gösterilebilmektedir (Şekil 6) (33). Böylece bu
hücreler ait oldukları dokularda meydana gelen morfoloji bozukluğunu, kromozom
kırıklarını, premalign değişiklikleri ve kanseri gösterebildiklerinden bir biyomarker
olarak değerlendirilebilmekte ve karsinojenlere maruz kalmış bireylerde artmış
kanser riskini göstermek amacıyla kullanılabilmektedir (33).
23
Şekil 6. Bukkal mukozanın sagittal kesitinin şematizasyonu. (sağlıklı
mukozadaki farklı hücre katmaları ve çeşitli hücre tiplerinin olası bölgesel ilişkileri
gösterilmiştir) (33)
3.4. Mikronükleus Testinin Uygulaması
3.4.1. Örnek Toplanması
İlk olarak örnek toplanmadan önce ağızdaki debrisin giderilmesi için hastanın
ağzını 100 ml su ile 2 kere çalkalaması gerekmektedir. Sürüntü örneği 2 cm baş
uzunluğuna sahip küçük bir diş fırçasının genişleyen bir dairesel hareketle
uygulanması sonucunda elde edilmektedir. Dairesel hareketin sebebi, geniş bir
alandan örnek toplanmasını sağlamak ve bukkal mukozada tek bir noktada erozyon
yaratmamaktadır. Bu uygulama ağzın her iki yanından da örnek alabilmek amacıyla,
her iki taraftaki yanak mukozası için farklı fırçalar kullanılarak gerçekleştirilmelidir;
böylece alınan hücre örneklerinin sayısı maksimuma ulaşırken, tek taraflı bir
araştırmada meydana gelebilecek olası hatalar elimine edilmektedir. Uygulama
24
sırasında oluşan farklılıklara göre toplanan hücre tipleri (Şekil 7) de değişiklik
gösterebildiğinden, örnekleme metodunun standart şekilde ve hiç değiştirilmeden
uygulanması önemlidir.(34) Tekrarlanan invaziv örneklemenin sonucunda bazal
hücrelerin ve karyorektik hücrelerin görülme frekansının arttığı gözlenmektedir,
fakat buna karşın bukkal mukoza sitoloji testindeki diğer biyo-işaretlerde bir
değişiklik görülmemiştir.(33)
Şekil 7. Bukal mukoza sitolojik incelemesinde elde edilen çeşitli hücre
tiplerinin şematik gösterimi.(33)
25
3.4.2. Örneklerin Hazırlanması :
Hücrelerin fiksasyonunda metanol: glasial asetik asit ya da %80 metanol gibi
alternatif fiksatifler kullanılabilir; fakat etanol: glasial asetik asit kullanımına karşı
hücrelerde değişiklikler görülebilmektedir. Bu teknikte kullanılan feulgen boyama
tekniğinin en önemli özelliklerinden birisi de DNA materyallerinin floresan
mikroskop altında koyu kırmızı (emülsiyon dalga boyu 580-620 nm) ışık altında
belirgin
parlak
kırmızı
bir
şekilde
görülebilmesidir.
Floresan
mikroskop
kullanılması,ışık mikroskobu altında MN’un görülememesi ya da farklı bir anomali
olarak belirlenmesi gibi hataların oluşmasını engellemektedir. Ayrıca, kondanse
kromatin ve karyorektik hücrelerin belirlenmesinde önem taşıyan hücre dokusunun
incelenmesi, floresan mikroskop altında daha doğru görülmektedir. Bu ise hatalı
pozitif ve hatalı negatif sonuçların minimale indirilmesini sağlarken, DNA hasarı ya
da nükleer anomalilerin belirlenmesinde daha kesin değerlendirmeler yapılmasını
sağlamaktadır.(33)
3.4.3. Örneklerin İncelenmesi :
Bukkal
mukozanın
sitolojik
incelemesinde
nükleer
anomalilerin
skorlanmasında uygulanan kriterler Tolber ve ark. tarafından belirtilmiştir. (35) Bu
kriterler, sitolojik ve nükleer özelliklerine göre “normal” hücreler ve DNA hasarı,
sitokinetik hata veya hücre ölümüne işaret eden, “anormal” hücreleri birbirinden
ayırmak üzere belirlenmiştir. Bukkal mukoza sitolojik incelemesinde karşılaşılan ve
skorlamada dikkat edilmesi gereken hücre tipleri Tablo 3’ te belirtilmiştir.
26
Tablo 3. Bukkal mukoza sitolojik incelemesinde karşılaşılan ve skorlamada
dikkat edilmesi gereken hücre tipleri (33).
Bukkal hücre tipi
Bazal
Morfolojik özellikleri
Differansiye olmuş
Mikronükleus
içeren
Nükleoplazmik
köprü içeren
(kırık yumurta,
NBUD)
Kondanse
kromatin
Karyorektik
Çift çekirdekli
Piknotik
Karyolitik
Şekil
Büyük nükleus: sitoplazma oranı differansiye 8a
hücrelere nazaran daha az.
Ufak ve oval sınırlar
Uniform boyanmış nükleus
Differansiye hücrelere nazaran daha koyu
boyanmış nükleus
Ufak nükleus: sitoplazma oranı bazal hücrelere 8b
göre daha fazla
Bazal hücreye nazaran daha büyük ve köşeli
sınırlar.
Uniform boyanmış nükleus
Nükleusu ve mikronükleusu aynı anda 8c,d
barındırmakta
Mikronükleuslar ana nükleusla aynı yoğunlukta
boyanmış, yuvarlak yada oval şekilde.
Mikronükleuslar ana nükleusun çapının 1/3 yada
1/16’sı büyüklüğünde.
Mikronükleus mutlaka hücre sitoplazması
içerisinde bulunmalıdır.
Sadece bazal ve differansiye hücrelerde
skorlanmalıdır
Ana nükleus keskin bir köprü eklentisi 8e
içermektedir.
Uzantı nükleusla aynı yoğunlukta boyanmıştır.
Uzantının çapı nükleusun çapının ¼ ya da ½’ si
kadardır.
8f
Hücreler iki ana nükleus içermektedir
Nükleusların yoğunluğu eşit olmalıdır.
Nükleus çökelmiş kromatin alanları içermektedir.
Nükleusta daha yoğun boyanma alanları
belirmektedir.
Nükleusta kümelenmiş kromatin parçacıkları
vardır
Nükleer parçalanmalar gözlenmektedir.
Hücre küçülmüş bir hücreye sahiptir.
Nükleus eşit ve yoğun olarak boyanmıştır.
Hücrede DNA materyali kalmamıştır.
Nükleus Feulgen ile boyanamamıştır.
27
8g
8h
8i
8j
Şekil 8. Bukkal mukoza sitolojik incelemesinde skorlanan Feulgen ve Açık
Yeşil boya ile boyanan farklı hücrelerin ışık mikroskopu / floresan mikroskoptaki
görüntüleri (33).
Örnekler en iyi X1,000 büyütmede kaliteli bir ışık ya da floresan mikroskop
altında incelenebilmektedir. Bukkal mukozanın sitolojik değerlendirmesi, bilgisayar
programı kullanılarak otomatize edilmiş görüntü sitometrisi ile de yapılabilir ve bu
sayede geniş popülasyon içindeki hücreler daha kolaylıkla incelenebilir; ancak, bu
çalışmaların geliştirilmesi ve onaylanması gerekmektedir. (36) Optimal skorlama için
izlenmesi gereken yol; ilk olarak 1,000 hücre içinde bulunan yukarıda belirtilen
hücre çeşitlerinin frekansını çıkartmak, ardından DNA hasar biyo-işaretlerini
(Mikronükleus ve nükleoplazmik uzantı içeren hücreler) 2,000 hücre içinde
skorlamak olmalıdır (33).
28
3.4.4. Sonuçların Değerlendirilmesi:
Toplanan örneklere ilişkin aşağıdaki bilgiler kayda alınmalıdır:
1. İncelenen 1,000 hücredeki bazal ve differansiye hücrelerin sayısı.
2. İncelenen 1,000 hücredeki piknotik, kondanse kromatidli, karyorektik ve
karyolitik hücrelerin sayısı.
3. İncelenen 1,000 hücredeki çift çekirdekli hücrelerin sayısı.
4. En az 2,00 hücrede görülen mikronükleus ve nükleoplazmik uzantı içeren
hücrelerin sayısı.
5.Çalışmada belirlenen çeşitli hücrelerin frekansları 1,000 hücre içerisindeki
sayıyla ya da yüzde olarak belirtilmelidir (33).
Mikronükleus testinden beklenen sonuçların alınması, sitotoksik veya
genotoksik ajanlara maruz kalınma süresi, genetik geçmiş, yaş ve cinsiyete göre
değişmektedir. Bu aşamada bukkal mukoza MN incelemesi henüz tanısal amaçla
kullanılmak üzere onaylanmamıştır, sadece araştırma amaçlı uygulanmaktadır.
3.5. Mikronükleus Tekniğinin Kullanım Alanları
3.5.1. Mesleki ve Çevresel Etkenlerin Araştırılması
Geçtiğimiz 15 -20 yıl içerisi MN testi, çeşitli kimyasal yada fiziksel mutajenik
ve karsinojenik ajanlara maruz kalmış insan topluluklarında kromozol hasarın
incelenmesi ve biyolojik izlemenin geliştirilmesi için kullanılmaktadır. (37) Çeşitli
çalışmalarda sağlıklı bireyler için referans olarak 0,5 ve 2,5 MN/1000 hücre aralık
mesafesinde frekans değerleri verilmiştir. (37). Farklı ülkelerdeki labratuarların bu
araştırmalarının sonuçları arasında anlamlı bir patern izlenememektedir; fakat çoğu
çalışmalarda etkenlere maruz kalan gruplarda kontrol gruplarına nazaran MN
frekansının istatiksel olarak anlamlı bir oranda arttığı görülmüştür. Bazı çalışmalarda
etkene maruz kalma sonucu MN frekansında istatiksel olarak anlamlı farklılıklar
gözlenebilirken, kimi çalışmalarda istatiksel bir farklılık görülmemiştir (37). Örneğin
3 ay boyunca morgda staj yapan tıp öğrencilerinde, formole maruz kalma sonucunda
29
staj öncesine göre MN frekansında 12 kat artış gözlenmiştir. Organik çözücüler,
antineoplastik ajanlar, petrol türevleri, polisiklik aromatik hidrokarbonlar, kurşun
içeren boyalar ve arsenik içeren içme suyu gibi etkenlere maruz kalan bireylerde
bukkal mukoza hücrelerinde MN frekansında daha anlamlı artışlar görülmüştür. (37)
Tarım ilaçlarına maruz kalmanın araştırıldığı çalışmalarda, genellikle MN
frekansında yükselme görülmese de Meksika’da çiçek yetiştiren bir grubun
çalışmasında MN frekansında 2,6 artış görülürken, tarım ilaçları üreten bir
fabrikadaki araştırma ise 3,9 kat artış izlenmektedir (37).
Sonuç olarak, her ne kadar etkenlere maruz kalma ve MN frekansının artması
arasındaki bağlantının güçlü olduğu görülse de, sık görülen kanser etkenlerinin
etkilerini belirlemek için güvenilir bir veri tabanı oluşturulması için daha fazla
çalışmaların yapılması gereklidir.
3.5.2. Kanser Tedavisinin Gözlemlenmesi ve Kemo Prevensiyon
İyonize radyasyon neoplazilerin tedavisinde önemli bir rol oynamaktadır, fakat
aynı zamanda genetik hasara da sebep olmaktadır. Sonuç olarak tedaviden yıllar
sonra sekonder tümörler ortaya çıkabilmektedir. Birçok çalışmada baş boyun
bölgesinde sürmekte olan radyoterapi sırasındaki MN frekansını incelenmiş ve 34004000 cGy kümülatif doza maruz kalan kalan hastalarda yüksek sitogenetik hasar (150
– 300 MN / 1000 hücre) gözlenmiştir (14).
Diğer çalışmalar 2000 cGy dozda 68 MN/1000 hücre ve 3 haftalık 1000 cGy
doz radyoterapi tedavisinde 16 MN/1000 hücre frekanslarını göstermiştir. Farklı doz
ve tedavi periyotlarının sonucunda ulaşılan farklı değerler, zaman ve doz
değişkenlerinin bukkal mukozadaki MN oluşumu üzerindeki etkilerini öne
çıkarmıştır.
Moore ve ark. çalışmalarında MN frekansında radyoterapi
başlangıcından hemen sonra 16 kat artış olduğunu, 12 hafta sonra ve tedavi
30
bitiminden 3 hafta sonra ise bu frekansın başlangıç noktasına döndüğünü ortaya
koymuştur (37).
Çalışmalar sonucu oral mukozada radyosensitivitesi yüksek olan tümörlerde
radyasyona daha dirençli olan tümörlere göre MN seviyesinde daha fazla artış olduğu
gözlenmiştir ve MN testinin tümörlerin radyasyon duyarlılığının belirlenmesinde
kullanılabileceği öne sürülmüştür (38). Bu çalışmalardan alınan bilgiler bukkal
mukoza hücrelerinde MN görülmesindeki ya da görülmemesindeki kinetiklerin
belirlenmesini sağlayarak, optimal tedavi süresinin saptanmasına yardımcı olmuştur.
(37) Başka bir çalışmada, tedavi edilmiş ya da cerrahi olarak çıkartılmış tümörlerin
veya
lökoplazik
lezyonların
kemoterapi
veya
radyoterapiye
yanıtlarının
incelenmesinde MN testi kullanılmış ve MN frekansı değişimlerinin
tedavi
prognozunun değerlendirilmesinde yol gösterici olduğu belirtilmiştir (39).
Kemoprevensiyon
çalışmalarında, beta-karoten ve diğer vitaminler gibi
mikronutrientlerin tütün kullanan sağlıklı bireylerde ve prekanseröz lezyonu bulunan
bireylerde MN frekansında 1.4-4 kat azalma yarattığı görülmüştür (15) Hollanda’da,
yoğun sigara içen bireylerde yapılan bir araştırmada kemoprevensiyon amacıyla
verilen N- asetilsitein’in MN frekansını anlamlı oranda düşürdüğü belirtilmektedir
(37). Kemoprevensiyon çalışmalarının lökoplaki gibi prekanseröz lezyonların
geriletilmesinde ve yeni lezyonların oluşumunun engellenmesindeki etkisi, tedaviden
sonra MN frekansının düşmesi ile belirlenebilmektedir. Genetik olarak düzensiz olan
prekanseröz lezyonlardaki MN frekansında görülen bu azalmalar, lezyonun daha
“düzenli” bir fenotipe dönüştüğü düşünülmektedir, ancak söz konusu değişimlerin
rastlantısal olup olmadıkları henüz kesin olarak kanıtlanamamıştır.
31
3.5.3. Kanser Riski Taşıyan Bireylerin Tanısı
Kanser oluşumuna ilerleyebilecek patolojik değişimleri ya da tanısı koyulmuş
lezyonları olan hastaların biyolojik olarak incelenmeleri günümüzde popülerleşen bir
konudur ve belki de epitel hücrelerine MN testinin uygulanması çalışmalarının en
hızlı gelişen kısmını oluşturmaktadır. Prekanseröz lezyonların değerlendirilmesi
amacıyla kullanılan MN testi bukkal mukozadaki, direkt olarak etkilenmiş
dokulardan örneklerin alınmasıyla yapılmıştır. Oral liken planus, oral lökoplaki,
eritroplaki ve submüköz fibrozis gibi lezyonları bulunan hastalarda sağlıklı bireylere
kıyasla MN frekansında artış gözlenmiştir (40), fakat kimi çalışmalarda hastalıklar
arasına anlamlı bir fark saptanamamıştır (38) . Başka bir araştırmada, tedavi
görmemiş kanser hastalarının somatik hücrelerinde (kan lenfosit hücreleri, eksfoliye
olmuş bukkal epitel hücreleri) sağlıklı kontrol grubuna göre genetik düzensizliklerin
artmış olduğu görülmüştür (41). Kamboj ve Mahajan’ın 2006 daki MN çalışmasında
(31) kontrol grubu (I), premalign (II) ve malign lezyonları olan (III) hastalar arasında
MN frekansında anlamlı farkların olduğu gösterilmiştir (sırasıyla, 0,64-2,30-2,71).
Aynı çalışmada, malign ve premalign lezyolu hastaların lezyondan etkilenmiş
taraftaki yanak mukozalarından alınan örneklerle etkilenmemiş taraftaki MN frekansı
karşılaştırıldığında, sağlıklı alandaki örneklerin MN frekansının anlamlı olarak az
olduğu gözlenmiştir.
Bukkal mukozada uygulanan MN testinin üst solunum ve sindirim yollarındaki
oral lökoplaki gibi premalign evrelerden başlamak üzere, kanser riskinin
belirlenmesinde kullanılabilecek bir yöntem olduğu düşünülmektedir. (42)
Birçok araştırma, DNA hasarının tamir eksiklerinin görüldüğü kimi
hastalıklarda MN frekanslarının belirleyici olduğunu ortaya koymuştur. Örneğin,
Louis-Bar sendromu görülen hastalarda MN frekansında yükselme görülmezken
32
(37), Ataxia telanjezi ve Bloom sendromu hastalıklarında genetik düzensizliklerin
arttığı saptanmıştır (37). Bir diğer çalışmada Kseroderma pigmentosum hastalarında
dilin dorsal ucunda bölgeye özgü bir MN artışı olduğu gözlenmiştir. (52) Down
sendromunda sağlıklı bireylerle karşılaştırıldığında MN frekansında genç sendromlu
bireylerde %733 yaşlı bireylerde ise %78,5 artış olduğu gözlenmektedir. Ayrıca
diyabet hastalarında, sağlıklı bireylere göre MN frekansında 2 kat artış izlenirken,
tedavi edilmiş ülseratif kolitis veya Crohn hastalığı bulunan pediyatrik hastalarda da
MN artışı görülmüştür. (37)
3.5.4. Yaşam Biçimi ve Konak Faktörü
Genetik hasar ile ilgili olan yaşam biçimi faktörleri arasında sigara içme, alkol
tüketimi ve diyet gibi özellikle vitamin eksiklikleri sayılmaktadır. Oral kanser riskini
arttıran faktörlerin araştırıldığı MN çalışmalarının büyük bir çoğunluğu, betel
yaprağı çiğneyenler, ters sigara içiciler, Khaini tütünü kullananlar gibi belirli bir
alışkanlığa bağlı bireylerde gerçekleştirilmektedir. Bu nedenle, söz konusu
çalışmalardaki sonuçlar, normal popülasyonlarda gözlenenden daha yüksek oranda
MN hasarı gösterebilirler, çünkü sigara içme ve tütün çiğnemenin hücreler üzerinde
dejeneratif etki yarattığı ve MN benzeri çekirdek yapıları oluşturabildiği
bilinmektedir.
Yaşam biçimi faktörlerinin araştırıldığı çalışmalarda sadece alkol veya sadece
sigara kullanımının MN frekansını belirgin derecede arttırmadığı, ancak birlikte
kullanıldığında sinerjik bir etki oluşturdukları ve MN oranının her ikisini de
kullanmayan bireylere göre 5,5 kat fazla olduğu belirtilmiştir (37). Başka bir
araştırmada oral veya orofarengeal kanserli alkolik bireyler ile sağlıklı ve alkol
kullanmamış bireyler değerlendirilmiş ve MN frekansının alkolü kullanma, başlama
ve bırakma süreleri ile anlamlı olarak değiştiği gösterilmiştir (39).
33
Bloching ve ark. 2006 da yaptığı bir çalışmanın hedefi, MN frekansı üzerinde
oral hijyenin etkisinin incelenmesidir. (16) Bu çalışmada diş kayıpları, papiller dişeti
kanaması ve periodontal problemleri olan hastalarda sağlıklı bireylere göre MN
frekansının daha yüksek olduğu izlenmiştir. Aynı çalışmada, amalgam restorasyon
bulunan bireylere nazaran kompozit restorasyon bulunan bireylerde daha fazla MN
görüldüğü belirtilmiştir. Alkol tüketimi ve sigara kullanımı gibi sinerjik etki yaratan
diğer etkenlerin etkileşimlerinin bukkal mukoza hücreleri üzerindeki etkilerini
belirlemek için daha fazla araştırmaya gerek duyulmaktadır.
34
4. SONUÇ
Sonuç olarak; sayısal ve yapısal kromozom düzensizliklerinin indirekt
göstergesi olarak değerlendirilen MN testi, organizmayı etkileyen çeşitli fiziksel ve
kimyasal ajanların sitogenetik etkilerini belirlemek amacıyla yapılabilecek büyük
çaplı tarama çalışmalarında güvenle kullanılabilir. Aynı zamanda, premalign
durumların incelenmesinde MN frekansında görülecek olan kayda değer bir sapma,
yüksek risk gruplarının belirlenmesinde tanı yöntemi olarak kullanılabilir. Görüldüğü
üzere kanser riskini ve premalign lezyonların erken tanısını belirlemede yardımcı
olan böyle bir yöntemin kanserin görülme sıklığını azaltabileceği gibi tedavi
sonuçlarını da olumlu yönde etkileyeceği düşünülmektedir. Kolay uygulanması, ucuz
maliyeti ve hızlı netice vermesi nedeniyle kullanımının sıklaştırılması mümkün olan
bu yöntemin, kanser teşhisinde önemli rol oynayan klinisyenler tarafından bilinmesi
önem arz etmektedir.
35
5. ÖZET
Oral kanserler, malign neoplazmlar arasında yer alan önemli morbidite ve
mortalite nedenlerinden biridir. İnsanlarda görülen tüm malign tümörlerin yaklaşık
%4’ü oral kavite ve boyunda meydana gelir. Oral kanserlerin erken teşhisi şüphesiz
prognozun iyi yönde ilerlemesi için en önemli kriterdir. Şuan kullanılmakta olan oral
kanser teşhis yöntemleri lezyonları malign transformasyonlarından sonra belirlemek
üzere tasarlanmıştır ve bu amaç doğrultusunda kullanılmaktadır.
Mikronükleuslar hücrenin mitoz bölünmesi sırasında ortaya çıkan, esas
çekirdeğe dahil olmayan, tam kromozom veya asentrik kromozom fragmanlarından
köken alan oluşumlardır. MN sayısındaki artış, çeşitli ajanların hücrelerde
oluşturduğu sayısal ve yapısal kromozom düzensizliklerinin indirekt göstergesi
olarak değerlendirilmektedir.
Bu teknik sayesinde ağız, burun, bronş ve ürogenital? eksfolyatif hücrelerde
kimyasalların ve enfeksiyonların etkilerini değerlendirmek mümkün olmuştur. Hızla
çoğalan bu epitelyal dokular çevreleriyle sürekli temas halindedir ve epitelin yüzeyel
tabakasını oluşturan eksfolyatif hücreler kolaylıkla elde edilebilmekte, dolayısıyla
uğradıkları genotoksik hasar da kolaylıkla gösterilebilmektedir. Böylece bu hücreler
ait oldukları dokularda meydana gelen morfoloji bozukluğunu, kromozom kırıklarını,
premalign değişiklikleri ve kanseri gösterebildiklerinden bir biyomarker olarak
değerlendirilebilmekte ve karsinojenlere maruz kalmış bireylerde artmış kanser
riskini göstermek amacıyla kullanılabilmektedir.
Dişhekimleri oral kanserlerin erken teşhisinde ve önlenmesinde çok önemli bir
role sahiptir. Her randevuda, özellikle yüksek risk altındaki hastalar başta olmak
36
üzere, tüm hastalarını oral kanser açısından dikkatlice incelemelidir. MN testi
klinisyenlerin gerek kanser teşhisini yapmasında gerek mevcut risk faktörlerini
belirleyip hastayı yönlendirmesinde yardımcı ve faydalı bir yöntem olarak karşımıza
çıkmaktadır. Fakat henüz yeterli güvenirliliği ve belirlenmiş standartları bulunmayan
bu test, ancak ileride yapılacak olan araştırmalar doğrultusunda standartlar arasına
girebilecektir.
37
6. KAYNAKLAR
1.
Halilçolar H, Tatar D, Ertuğrul G, ve ark. Epidemiyoloji. Akciğer Kanseri
Multidisipliner Yaklaşım. Akkoçlu A, Öztürk C (ed). Ankara: Bilimsel Tıp Yayınevi
1999, S.17-23.
2.
Thompson CB. Apoptosis in the pathogenesis and treatment of disease.
Science 1995; 267:1456-62.
3.
Nagata S, Golstein P. The Fas death factor. Science 1995; 267: 1449-56.
4.
Cooper GM. Programmed cell death. The cell, Ed. Cooper GM, Washington:
ASM Pres: 1994, S.592-6.
5.
Nagata S. Apoptosis by death factor. Cell 1997; 88:355-65.
6.
Perkins AS, Stern DF, Apoptosis. Cancer Principle and Practice of Oncology.
In: Devita VT, Hellman S, Rosenberg SA (eds). Philadephia: Lippincott-Raven;
1997, S.96-100.
7.
Kaya A, Oral mukozal malignansilerin erken tanısında kullanılan non-invaziv
yöntemlerin karşılaştırılmalı değerlendirilmesi, Doktora Tezi, E.Ü. Dişhekimliği
Fakültesi, 2007
8.
Hossfeld DK. Manual of clinical oncology-5, New York: Springer-Verlag;
UICC, 1992.
9.
Jemal A, Clegg LX, Ward E, Ries LA, Wu X, Jamison PM, et al. Annual
report to the nation on the status of cancer, 1975-2001, with a special feature
regarding survival. Cancer 2004; 101:3-27.
10.
Boyle P, Ferlay J. Cancer incidence and mortality in Europe, 2004. Ann
Oncol 2005; 16:481-8.
38
11.
Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, et al. Cancer statistics,
2006. CA Cancer J Clin 2006; 56:106-30.
12.
Strensward J, Clark D. Palliative medicine-a global perspective. In: Doyle D,
Hanks G, Cherny N, Camlan K, editors. Oxford textbook of palliative medicine. 3rd
ed. Oxford: Oxford University Press; 2004. S.1119-224.
13.
Neville BW, Oral Cancer and Precancerous Lesions. CA Cancer J Clin 2002;
52:195-215
14.
Stich HF, San RH, Rosin MP, Adaptation of the DNA-repair and
micronucleus tests to human cell suspensions and exfoliated cells. Ann. N.Y. Acad.
Sci. 1983; 40793–105
15.
Öztürk B, Coikun U, Yaman E, Kaya AO, Yıldız R, Benekli M, Büyükberber
S. The Risk Factors, Premalignant Lesions and Chemoprevention Oral Cavity
Cancers. UHOD 2009; 19
16.
Bloching M. Micronucleus rate of buccal mucosal epithelial cells in relation
to oral hygiene and dental factors: Oral Oncology 2008; 44:220– 226
17.
Sidransky D. Nucleic acid-based methods for the detection of cancer. Science
(Wash DC) 1997; 278:1054–9
18.
Mashberg A, Samit A. Early diagnosis of asymptomatic oral and
oropharyngeal squamous cancers. CA Cancer J Clin 1995; 45: 328-351,.
19.
Lapthanasupkul P, Poomsawat S, Punyasingh J. A clinicopathologic study of
oral leukoplakia and erythroplakia in a Thai population. Quintessence Int. 2007;
38:448-455.
20.
Barnard NA, Schully C, Eveson JW, et al. Oral cancer development in
patients with oral lichen planus. J Oral Pathol Med 1993; 22:421-424,.
39
21.
Eisen D. The clinical features, malignant potential and systemic associations
of oral lichen planus: a study of 723 patients. J Am Acad Dermatol 2002; 46:207214.
22.
Lee CH, Ko YC, Huang HL, et al. The precancer risk of betel quid chewing,
tobacco use and alcohol consumption in oral leukoplakia and oral submucous fibrosis
in sauthern Taiwan. Br J Cancer 2002; 88:366-372.
23.
Kumari R, Arun C, Goyal PK. Karyoanomalic frequency during radiation
therapy. J Cancer Res Ther. 2005; 1: 3
24.
Gellrich NC,
Suarez-Cunqueiro MM, Bremerich A,
Schramm A.
Characteristics of oral cancer in a central European population: defining the dentist's
role. J Am Dent Assoc. 2003; 134:307-14.
25.
Clovis JB, Horowitz AM, Poel DH. Oral and pharyngeal cancer: practices
and opinions of dentists in British Columbia and Nova Scotia. J Am Dent Assoc
2002; 68:421-5
26.
Betz SC. A Comparative Study of Normal Inspeciton, Autofluorescence and
5-ALA-Induced PPIX Fluorescence for Oral Cancer Diagnosis. Int J Cancer 2002;
97:245-52.
27.
Bedir A, Bilgici B, Yurdakul Z, Gürsel BŞ, Alvur M. The Comparison of µ-
FADU and COMET Methods in DNA Damage Analysis. Türk Klinik Biyokimya
Derg 2004; 2: 97-103
28.
Zijno A, Marcon F, Leopardı P, Salvatore G, Carere A, Crebelli R. An
assessment of the in vivo clastogenicity of erythrosine. Fd Chem Toxic 1994;
32:159-63
29.
Widel M, Kolosza Z, Jedrus S, Lukaszczyk B, RaczekZwierzycka K,
Swierniak A. Micronucleus assay in vivo provides significant prognostic information
40
in human cervical carcinoma: The updated analysis. Int J Radiat Biol 2001; 77:6316.
30.
Fenech M, Morley AA. Cytokinesis-block micronucleus method in human
lymphocytes: Effect of in vivo ageing and dose X-irradiation. Mutat Res 1986;
161:193-8.
31.
Eastmond DA, Tucker JD. Identification aneuploidy inducing agents using
cytokinesis-blocked human lymphocytes and an antikinetochore antibody. Environ
Mol Mutagen 1989; 13:34-43.
32.
Stich HF, Stich W, Parida BB. Elevated frequency of micronucleated cells in
the buccal mucosa of individuals at high risk for oral cancer: Betel quid chewers.
Cancer Lett 1982; 17:125-34
33.
Thomas P, Holland N, Bolognesi C , Volders MK, Bonassi S , Zeiger E,
Knasmueller S & Fenech M. Buccal micronucleus cytome assay. Nature Protocols
2009; 4: 6
34.
Thomas P, Hecker J, Faunt J. Fenech M. Buccal micronucleus cytome
biomarkers may be associated with Alzheimer’s disease. Mutagenesis 2007; 22:371–
379.
35.
Tolbert PE, Shy CM & Allen JW. Micronuclei and other nuclear anomalies in
buccal smears: methods development. Mutat. Res. 1992; 271:69–77.
36.
Neher A, Ofner G, Appenroth E & Gschwendtner A. High-resolution image
cytometry on smears of normal oral mucosa: a possible approach for the early
detection of laryngopharyngeal cancers. Head & Neck 2004; 26:694–700.
37.
Holland N, Bolognesi C , Volders MK, Bonassi S , Zeiger E, Knasmueller S,
Fenech M. The micronucleus assay in human buccal cells as a tool for biomonitoring
41
DNA damage: The HUMN roject erspective on current status and knowledge gaps.
MUTREV 2008; 7892:16
38.
Bindu L, Balaram P,.Mathew A, P. Remani, V.N. Bhattathiri,M.K. Nair,
Radiation induced changes in oral carcinoma cells—a multiparametric evaluation,
Cytopathology 2003; 14:287–293.
39.
Ramirez A, Saldanha H. Micronucleus investigation of alcoholic patients with
oral carcinomas. Genet. Mol. Res. 2002; 1:246-260
40.
Ergun S, Warnakulasuriya S, Duman N, Saruhanoglu A, Sevinc B et al.
Micronuclear and sister chromatid exchange analyses in peripheral lymphocytes of
patients with oral lichen planus – a pilot study. Oral Diseases 2009; 15:499–504
41.
Schmid W. The micronucleus test for cytogenetic analysis. Hollaender A, ed.
Chemical Mutagens, Principles and Methods for Their Detection-4, New York:
Plenum, 1976, S.31-53.
42.
Sivasankari PN, Kaur S. Micronucleus Index : An Early Diagnosis In Oral
Carcinoma. J. Anat. Soc. 2008; 57: 8-13.
43.
Mavournin KH, Blakey DH, Cimino MC, Salamone MF, Heddle JA. The in
vivo micronucleus assay in mammalian bone marrov and peripheral blood: A report
of the U.S. Environmental Protection Agency Gene-Tox Program. Mutat Res 1990;
239:29-80.
44.
. Stich HF, Rosin MP. Micronuclei in exfoliated human cells as a tool for
studies in cancer risk and cancer intervention. Cancer Lett. 1984 Apr;22(3):241-53.
45.
Kausara A, Giri S, Mazumdara M, Giri A, Roya P, Dhar P. Micronucleus and
other nuclear abnormalities among betel quid chewers with or without sadagura, a
unique smokeless tobacco preparation, in a population from North-East India.
Mutation Research 2009; 677:72–75
42
46.
Bonassi S, Biasotti B, Kirsch-Volders M, Knasmueller S, Zeiger E et al. State
of the art survey of the buccal micronucleus assay—a first stage in the UMNXL
project initiative. Mutagenesis 2009; 1–8.
47.
Minicucci EM, Cytogenetic damage in circulating lymphocytes and buccal
mucosa cells of head and neck cancer patients undergoing radiotherapy. J. Radiat.
Res. 2005; 46:135-142.
48.
Fenech M, Holland N, Chang PW, Zieger E, Bonassi S. The HUman
MicroNucleus Project—An international collaborative study on the use of the
micronucleus technique for measuring DNA damage in humans . Mutation Research
1999; 428:271–283.
43
7. ÖZGEÇMİŞ
1984 yılında İzmir‘de doğdum. İlköğrenimimi 1995 yılında İzmir Hakimiyet-i
Milliye İlkokulu’nda, orta ve lise öğrenimimi İzmir Konak Anadolu Lisesi’nde
bitirdim. 2002 yılında Ege Üniversitesi Dişhekimliği Fakültesi’nde üniversite
öğrenimime başladım.
44