TÜBĠTAK – BĠDEB
KĠMYA LĠSANS ÖĞRENCĠLERĠ – KĠMYAGERLĠK, KĠMYA ÖĞRETMENLĠĞĠ,
KĠMYA MÜHENDĠSLĠĞĠ – BĠYOMÜHENDĠSLĠK – ARAġTIRMA PROJESĠ
KĠMYA – 3 (ÇalıĢtay 2012)
KĠMYA PROJE RAPORU
GRUP MORĠN
PROJE ADI
MALATYA KAYISISI ÜZERĠNE BAZI KĠMYASAL MADDELERĠN ĠNHĠBĠTÖR
ETKĠSĠ VE ENZĠM KĠNETĠĞĠNĠN ĠNCELENMESĠ
PROJE EKĠBĠ
Mehtap UĞUR
Kader ÖZGÜR
PROJE DANIġMANLARI
Prof. Dr. Nevin GÜRBÜZ
Prof. Dr. Halit DEMĠR
MALATYA
29 HAZĠRAN – 8 TEMMUZ 2012
PROJENĠN AMACI
Malatya kayısısından elde edilen polifenol oksidaz enzimi (E.C. 1.14.18.1; PFO) üzerine
uygulanan bazı kimyasal maddelerin inhibitör etkilerinin araĢtırılması, enzim substrat
iliĢkisinin ve reaksiyon kinetiğinin incelenmesi.
1. GĠRĠġ
1.1 Enzim
Hücre içinde meydana gelen kimyasal değiĢmeler metabolik olay olarak ifade edilmektedir.
Metabolik olaylar ile birçok madde parçalanır ve yeni maddeler sentezlenir. Metabolik
olaylar, hücre ve canlıya özgü olan kendi özel koĢullarında gerçekleĢen olaylardır. Bu
olaylardan biyolojik ve biyokimyasal tepkimeler; vücut sıcaklığında, dar bir pH aralığında ve
canlı için yeterli olabilecek bir hızla gerçekleĢir. Hücresel olayların bu koĢullarda
gerçekleĢmesi, enzim denilen biyolojik katalizörlerle olmaktadır.
Meyve ve sebzelerin hasat edilmesi, taĢınması, depolanması veya iĢlenmesi sırasında
meydana gelen doku zedelenmeleri, bir takım kimyasal reaksiyonlara maruz kalarak
kahverengi veya esmerleĢme olarak bilinen kararmalara neden olduğu bilinmektedir.
KurutulmuĢ meyvelerde, elma, armut, Ģeftali, muz, kayısı gibi çeĢitli ürünlerde oluĢan
esmerleĢme istenmeyen olgulardır. Aynı zamanda çayın, çikolatanın tadı ve kokusu,
kavrulmuĢ kahve, bisküvi ve benzeri unlu mamullerin
kavrulmuĢ gibi olan renkleri,
kavrulmuĢ fındık, fıstık, ceviz ve patates cipsi gibi gıda
maddelerinin kontrollü olarak
kızartılmıĢ renkleri açısından arzu edilen bir durumdur. Enzimatik esmerleĢme, meyve ve
sebzelerin üretim kayıplarının %50’sinden fazlasının sorumlusu olabilir. Zarar gören bitki
dokularında meydana gelen kararma polifenol oksidaz enzimi katalizörlüğü eĢliğinde
gerçekleĢen kimyasal bir reaksiyondur. Bunun nedeni gıda maddelerinde bulunan fenolik
bileĢiklerin
oksijen
varlığında
kinonlara
yükseltgenmesidir.
Örneğin
patateslerin
kararmalarında kafeik asit ve klorogenik asit yanında tirozin de önemli rol oynamaktadır.
ġekil 1.1 Enzimatik kararmada polifenol oksidazın rolü
Enzimlerin miktarı, aktiviteleri esas alınarak belirlenir ve enzim ünitesi (E.Ü) cinsinden
verilir. 25 oC’ de ve optimal Ģartlarda 1 mikromol substratı 1 dakikada ürüne dönüĢtüren
enzim miktarı, 1 enzim ünitesi olarak kabul edilmiĢtir.
Enzimler katalizledikleri reaksiyonları açısından spesifiktirler. Enzimleri diğer katalizörlerden
daha önemli özellikleri Ģunlardır:
Enzim katalizli reaksiyonların hızları çok yüksektir,
Reaksiyon sonucu yan ürün oluĢmaz,
%100 verimle çalıĢırlar.
1.2 Polifenol Oksidaz Enzimi (E.C. 1.14.18.1; PFO)
PFO enzimi ilk olarak 1856 yılında Schoenbein tarafından yemeklik mantarlarda
bulunmuĢtur. Polifenol oksidaz bitkilerde kararmaya sebep olan oksidoredüktaz sınıfından bir
enzimdir. Birçok meyve ve sebzede bulunmasının yanı sıra ıstakoz, karides, yengeç gibi
kabuklu deniz hayvanlarında ve bazı mikroorganizmalarda da bulunmaktadır.
Meyve ve sebzelerin olgunlaĢması süresince, içerdikleri PFO enziminin aktivitesi
değiĢmektedir. Ham meyvelerde, PFO aktivitesi ve dolayısıyla renklenme dahafazladır.
Zeytinin olgunlaĢması sırasında o-difenol konsantrasyonunun arttığı, enzim aktivitesinin
azaldığı görülmüĢtür.
1.3 Molekül yapısı
Polifenol oksidaz, birden fazla alt birimden oluĢan oligomerik yapıda bir enzimdir. PFO'nun
içerdiği alt birimlerin sayısı enzimin izole edildiği kaynağa ve substrata bağlı olarak
değiĢmektedir.
1.4 Substratları
Meyve ve sebzeler fenolik bileĢiklerinin geniĢ bir karıĢımını içerirler. Ancak bunların çok az
bir kısmı polifenol oksidaz enzimine substrat olarak uygundur.
Meyve ve sebzeler, yapısında çeĢitli fenolik bileĢikler bulundurmaktadır. Bu substratlara baĢta
katekol, 4-metil katekol, pirogallol, dopa olmak üzere gallik asit, tirozin, kafeik asit ve
sinnamik asit esterleri örnek verilebilir.
Sinnamik asit türevlerinden klorojenik asit ve kafeik asit (3,4-dihidroksi sinnamik asit) PFO
enziminin yaygın olarak kullanılan substratlarıdır. Katekol (o-dihidroksi fenol); enzimatik
oksidasyon çalıĢmalarında model substrat olarak kullanılmaktadır. Dopa ve tirozin hemen
hemen bütün bitki dokusunda bulunan aminoasitlerdir ve PFO'nun substratlarıdır.
Tirozin
4- Metil katekol
Katekol
Pirogallol
Kayısı da bulunan PFO nun fenolik substratları; izoklorogenik asit, kafeik asit, 4-metil
katekol, klorogenik asit, katekin, epikatekin, pirogallol, katekol, flavanol, p- koumarik asit
türevleridir.
1.5 Aktivatörleri
Aktivatörlerin, enzimin içerdiği monomerlerin Cu2+ iyonu içeren oligomer oluĢturacak Ģekilde
etki gösterdiği ve enzimin aktivite göstermesi için gerekli polimerizasyonu sağladığı
düĢünülmektedir.
1.6 Ġnhibisyon
Enzimlerin hücre içi ve hücre dıĢı aktivitelerinin bazı bileĢikler tarafından azaltılması ve hatta
yok edilmesi olayına inhibisyon adı verilir. Buna sebep olan bileĢiklere de inhibitör
denilmektedir. Ġnhibitörler genelde küçük molekül ağırlığına sahip bileĢikler ve iyonlardır.
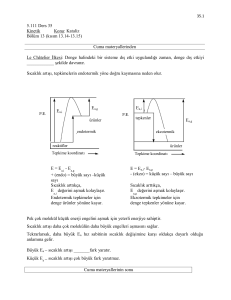
1.7 Enzim Kinetiği
Enzim reaksiyonları üzerinde ilk geniĢ kinetik çalıĢmalar 1913 yılında Michaelis-Menten
tarafından yapılmıĢtır. Michaelis-Menten kinetiğine göre baĢlangıç enzim deriĢimi sabit alınıp
reaksiyon hızının substrat deriĢimine bağlılığı incelenir. Sonuçta hiperbolik bir fonksiyon ve
eğri elde edilir (ġekil 1.2). Bunun çözümü ile Michaelis-Menten bağıntısı bulunur.
ġekil 1.2 Michaelis-Menten grafiği.
Michaelis-Menten Bağıntısı
Michaelis-Menten grafiği hiperbol olduğu için bağıntı doğru denklemi elde etmek amacıyla
çeĢitli Ģekillere dönüĢtürülür. Bunlardan en çok kullanılanı Lineweaver-Burk denklemidir.
Lineweaver-Burk denklemi
ġekil 1.3 Lineweaver-Burk grafiği
Vmax ve Km bir enzimin aktivitesini belirleyen önemli enzim sabitleridir. Vmax maksimum hız
olarak belirtilir. Km Michaelis-Menten sabiti olarak belirtilir ve maksimum hızın (Vmax/2)
yarısına karĢılık gelen substrat deriĢimidir.
2. MATERYAL VE YÖNTEM
2.1 Kullanılan Materyaller
Malatya kayısısı
Benzoik asit
Pirogallol
NaCl
KCl
CaCl2
Askorbik asit (Vitamin C)
Fosfat tamponu (pH=7.5)
Süzgeç kağıdı
Spektrofotometre
Isıtıcı
Terazi
Beher
Baget
Huni
Dereceli silindir
Erlenmayer
Mikropipet
Damlalık
2.3 Polifenol Oksidaz Enziminin Eldesi
Öncelikle kayısılar bagetle beherde ezildi. YumuĢayan kayısılar 50 mL fosfat tamponu
eklenerek süzgeç kağıdına kondu ve süzülmeye bırakıldı. Kalıntılardan arındırılmak için
süzüntü tekrar süzüldü.
2.4 Substratın Hazırlanması
Substrat olarak baĢlangıçta 0,04 M’ lık benzoik asit çözeltisi kullanıldı. Bunun için 0,4886 g
benzoik asit 100 mL sıcak suda çözüldü.
Ġkinci substrat olarak 0,01 M’ lık pirogallol çözeltisi hazırlandı. Miktar olarak katı
pirogallolden 0,1260 g alınıp 100 mL suda çözüldü.
2.5 Ġnhibitörlerin Hazırlanması
0,5 M NaCl çözelitisi: 2,9225 g NaCl 100 mL suya tamamlandı.
1,0 M NaCl çözeltisi: 5,8439 g NaCl 100 mL suya tamamlandı.
0,5 M KCl çözeltisi: 3,7276 g KCl tartılıp 100 mL suda çözüldü.
1,0 M KCl çözeltisi: 7,4550 g KCl tartılıp 100 mL suda çözüldü.
0,5 M CaCl2 çözelitisi: 5,5493 g CaCl2 100 mL suda çözülerek hazırlandı.
1,0 M CaCl2 çözeltisi: 11,0980 g CaCl2 100 mL suda çözülerek hazırlandı.
0,5 M Askorbik asit çözeltisi: 2,2013 g askorbik asit alınarak 25 mL de çözüldü.
1,0 M Askorbik asit çözeltisi: 4,407 g askorbik asit alınarak 25 mL de çözüldü.
2.6 Ġnhibisyon
Sodyum klorür (NaCl), potasyum klorür (KCl), kalsiyum klorür (CaCl2) ve askorbik asit
inhibitörleri kullanılarak polifenol oksidaz enziminin inhibisyonu, benzoik asit ve pirogallol
substratları varlığında incelendi.
2.7 Spektrofotometrik Ölçümler
Kör çözelti hazırlanması: 2,8 mL fosfat tamponu, 0,1 mL PFO ve 0,1 mL substrat, toplam
hacim 3 mL olacak Ģekilde karıĢtırıldı.
Örneklerin hazırlanması: 2,7 mL fosfat tamponu, 0,1 mL PFO, 0,1 mL substrat ve 0,1 mL
inhibitör, 3 mL olacak Ģekilde karıĢtırıldı.
Hazırlanan karıĢımlar 3 mL’lik, 1 cm ıĢık yollu plastik küvete yerleĢtirildi. Örneklerin
Pharmacia Biotech Novaspec II spektrofotometresinde 420 nm dalga boyunda absorbans
değerlerine bakıldı.
2.8 Enzim Kinetiğinin Ġncelenmesi
Kinetik inceleme için; ilk numune 0,1 mL PFO enzimi, 2,8 mL tampon çözeltisi ve 0,1 mL
substrat, toplam hacim 3 mL olacak Ģekilde karıĢtırıldı. Sonraki örneklerde enzim miktarı
sabit tutulup substrat miktarı arttırılarak tüm numunelerin 420 nm’de absorbans değerleri
ölçüldü ve böylece enzim-substrat iliĢkisi incelendi.
3. BULGULAR
Bu bölümde çalıĢmalar sonucunda elde edilen deneysel veriler sunulmaktadır.
3.1 Benzoik Asit Substratı Varlığında Elde Edilen Enzim Aktivite Sonuçları
Spektrofotometreden alınan absorbans değerleri kullanılarak enzim aktivite ve inhibisyon
hesapları yapıldı. Elde edilen sonuçlar Çizelge 3.1’de gösterilmiĢtir. Sonuçlara göre NaCl ve
askorbik asitin PFO’nun aktivitesini inhibe ettiği, dolayısıyla bu inhibitörlerin PFO içeren
meyve ve sebzelerin kararmasını geciktici olarak kullanılabileceği tespit edilmiĢtir.
Diğer taraftan sonuçlar gösteriyor ki 1,0 M KCl inhibitör etki gösterirken, 0,5 M KCl enzim
aktivitesini arttırıcı özelliğe sahiptir.
0,5 M ve 1,0 M CaCl2 ’ün enzimi aktif hale getirdiği ve bu özelliğinden dolayı Malatya
kayısısında kararmayı önleyici olarak kullanılamayacağı gözlenmiĢtir.
Ġnhibisyon değerleri aĢağıdaki bağıntı kullanılarak elde edildi;
Çizelge 3.1 PFO enziminin benzoik asit substratlığında çeĢitli inhibitörlere karĢı aktivitesi ve
inhibisyon değerleri
PFO Aktivitesi
Madde
EÜ/mL
Ġnhibisyon (%)
Ham ekstrakt
0,112
-
0,5 M NaCl
0,035
31,25
1,0 M NaCl
0,040
35,71
0,5 M KCl
0,203
181,25
1,0 M KCl
0,093
83,04
0,5 M CaCl2
1,599
1427,68
1,0 M CaCl2
2,529
2258,04
0,5 M Vitamin C
0,050
44,64
1,0 M Vitamin C
0,022
19,64
3.2 Pirogallol Substratı Varlığında Elde Edilen Enzim Aktivite Sonuçları
Diğer substrat çeĢidi pirogallolde elde edilen aktivite ve buna bağlı olarak hesaplanan %
inhibisyon değerleri Çizelge 3.2 ‘de belirtilmiĢtir. Aktivite birimi olarak l mL enzim çözeltisi
baĢına l dakikada absorbansta meydana gelen 0,001 birimlik değiĢme kullanıldı. l Enzim
ünitesi (U) reaksiyonun oluĢtuğu küvette l dakikada meydana gelen 0,001'lik artıĢ olarak
tanımlandı. Genel olarak sonuçlara bakıldığında pirogallol substratı varlığında hesaplanan
değerler benzoik asit substrat verilerinden daha düĢük sonuçlar verdiği gözlenmiĢtir. Buna
göre NaCl, KCl ve askorbik asitin değiĢik konsantrasyonları dahi PFO enzim aktivitesini
inhibe edici özelliğe sahiptir. Fakat yapılan çalıĢmada CaCl2 ‘ün 0,5 M ve 1,0 M ‘lık
konsantrasyon değerlerinin ters etki gösterdiği saptanmıĢtır. Ayrıca benzoik asitin inhibitör
özelliğinin incelenmesi için pirogallol substratlığında aktivite tayini yapıldı ve sonuca göre
%8,56’lık değerle inhibitör özelliğine sahip olduğu gözlendi.
Çizelge 3.2 PFO enziminin pirogallol substratlığında çeĢitli inhibitörlere karĢı aktivitesi ve
inhibisyon değerleri
PFO Aktivitesi
Madde
EÜ/mL
Ġnhibisyon (%)
Ham ekstrakt
0,327
-
0,5 M NaCl
0,051
15,60
1,0 M NaCl
0,031
9,48
0,5 M KCl
0,106
32,42
1,0 M KCl
0,102
31,19
0,5 M CaCl2
0,203
62,08
1,0 M CaCl2
1,179
360,55
0,5 M Vitamin C
0,025
7,65
1,0 M Vitamin C
0,066
20,18
0,04 M Benzoik asit
0,028
8,56
3.3 Enzim Kinetiği Değerleri
4.000
3.500
3.000
1/V
2.500
2.000
y = 0.2251x + 1.2684
R² = 0.868
1.500
1.000
0.500
0.000
0.000
2.000
4.000
6.000
1/S
8.000
10.000
ġekil 3.1 Lineweaver-Burk grafiği
Grafikteki (ġekil 3.1) doğru denklemi kullanılarak Vmax ve Km değerleri Lineweaver-Burk
bağıntısına benzetilerek hesaplandı:
Çizelge 3.3 Absorbans ölçümleri, Vmax ve Km değerleri
Substrat Miktarı
Absorbans
0,1
0,290
0,2
0,413
0,3
0,454
0,4
0,505
0,5
0,514
0,6
0,886
Vmax (U/dk-1)
Km (mM)
0,7884
177,5
4. SONUÇ VE TARTIġMA
Bu çalıĢmada Malatya kayısısından elde edilen polifenol oksidaz enziminin benzoik asit ve
pirogallol substratlığında çeĢitli kimyasallarla inhibisyonları gözlenmiĢtir. Ayrıca pirogallol
substratlığında enzim kinetiği hesapları yapılarak enzim-substrat iliĢkisi incelenmiĢtir.
Ġnhibisyonla ilgili çalıĢmalarda NaCl, KCl, CaCl2 ve askorbik asit inhibitör olarak kullanılmıĢ
ve polifenol oksidaz enzimi üzerindeki etkileri araĢtırılmıĢtır. Aktivite hesaplamalarına göre
NaCl ve askorbik asit meyve ve sebzelerin doğal renginin ve içeğinin korunmasında
kararmayı önleyici madde olarak kullanılabileceği ispatlanmıĢtır. Fakat CaCl2 aktivatör etkiye
sahip olduğu, dolayısıyla bu enzimi içeren sebze ve meyvelerin içeriğinin korunmasında
kullanılacak bir madde olmadığı gözlenmiĢtir. Yapılan çalıĢmalarda elde edilen değerlerin
literatür bulgularıyla paralel olduğu saptanmıĢtır. Ancak çeĢitli kayısı türlerinde polifenol
oksidaz enziminin araĢtırılması çalıĢmaları literatürlerde kısıtlı sayıdadır. Bu yüzden çok fazla
karĢılaĢtırma yapılamamıĢtır.
Enzim kinetiği hesaplamalarında ise substrat olarak pirogallol kullanıldı. Bu substratın çeĢitli
konsantrasyonları için ölçülmüĢ reaksiyon hızlarının kinetik analizleri Lineweaver-Burk
denklemi kullanılarak, grafiğin eğiminden Vmax ve Km değerleri hesaplandı. Km değeri 177,5
mM ve Vmax=0,7884 U olarak hesaplandı.
TEġEKKÜR
ÇalıĢtay koordinatörü: Prof. Dr. Mehmet AY’ a sunuları ve çalıĢmalarıyla bizleri aydınlatan
danıĢmanlarımız: Prof. Dr. Nevin GÜRBÜZ, Prof. Dr. Halit DEMĠR, Teknisyen Zeynel
ġAHĠN’e, tüm çalıĢtay ekibine, grup arkadaĢlarımıza ve Malatya Üniversitesi’ ne teĢekkür
ederiz…
KAYNAKÇA
1. ÇĠMEN Ç., Iğdır Kayısısından (şalak) SaflaĢtırılan Polifenol Oksidaz Enzimi Üzerinde
Bazı Ġlaç ve Kimyasalların Ġnhibisyon Kinetiğinin AraĢtırılması, Yüksek Lisans Tezi,
Yüzüncü Yıl Üniversitesi, Fen Bilimleri, ĠSTANBUL, 2007.
2. TURAN P., Ocimum Basilicum L.’ den elde edilen Polifenol Oksidaz Enziminin
SaflaĢtırılması, Kinetik ve Elektroforetik Özelliklerinin Ġncelenmesi, Yüksek Lisans Tezi,
Balıkesir Üniversitesi, Fen Bilimleri, BALIKESĠR, 2005.
3. Meslekî Eğitim Ve Öğretim Sisteminin Güçlendirilmesi Projesi, KĠMYA TEKNOLOJĠSĠ,
ANKARA, 2009.
4. AKBULUT N., Dereotundan (Anethum Graveolens) Ġzole Edilen Polifenol Oksidaz
Enziminin Bazı Killerle Ġmmobilizasyonu Ve SeçilmiĢ Özelliklerinin Ġncelenmesi, Yüksek
Lisans Tezi, ATATÜRK ÜNĠVERSĠTESĠ, Fen Bilimleri, ERZURUM, 2011
GRUP ÜYELERĠNĠN ÖZGEÇMĠġLERĠ
Mehtap UĞUR ( Ġstanbul Üniversitesi- ĠSTANBUL )
1989 yılında Ġstanbul’da doğdu. Ġlköğretim ve liseyi Ġstanbul’da tamamladı. 2012 yılında
Ġstanbul Üniversitesi Kimya Mühendisliği Bölümünden mezun oldu. Bilim ve müzik tarihi ile
ilgilenmeyi sever.
Kader ÖZGÜR ( Ġzmir Yüksek Teknoloji Enstitüsü- ĠZMĠR )
1989 yılında Bulgaristan’da doğdu. Ġlkokul dördüncü sınıfa kadar Bulgaristan’da okudu.
Ortaöğretim ve liseyi Çorlu / Tekirdağ’da tamamladı. 2008 yılında Ġzmir Yüksek Teknoloji
Enstitüsü Kimya Bölümünü kazandı. Halen ĠYTE’ de öğrenimine devam etmektedir.