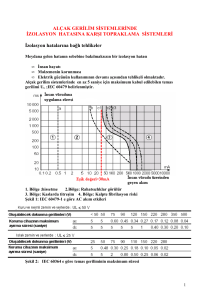
KÖK HÜCRE ( Stem cell ) TEDAVİSİ
Kök hücre temelli rejeneratif ve trofik
tedaviler
Dr. Emin ÖZMERT
Ankara Üniversitesi
Vehbi Koç Göz Hastanesi
Retina Günleri – 2013 / İSTANBUL
RETİNA PİGMENT EPİTELİ
•
•
•
•
Dış retinanın çoğu hastalığında, RPE dejenerasyonu önemli anahtar ( Stargardt, RP, geografik atrofi – YBMD )
İleri aşamalarda fotoreseptör kaybı, ganglion hücreleri canlı
RPE; nisbeten basit, polarize, tek katlı epitelial tabaka
Çok yüksek metabolik aktivite gösteren
Normal
frajil PR tabakası için temel destek dokusu:
* Retinol siklusu
* Besin maddelerinin transportu
* Büyüme faktörü üretimi
apikal: PEDGF, basal: VEGF * Apikal mikrovilliler, kon‐rod
dış segmentlerinin fagositozu
* Sıkı bağlantılar ile dış kan‐retina bariyeri
* Bazal membran çok katlantılı,
sıvı ve iyon transportu
RP
Kök hücre tedavisi için hedef hastalıklar
•
Yaşa bağlı maküla dejenerasyonu:
* Kuru tipin ileri aşaması: geografik atrofi
* Kompleks dejeneratif hastalık, poligenik herediter komponenti var
* Santral dış retinada kronik / low‐grade inflamasyon ( yıllar boyunca, sistemik )
* Lipofuscin birikimi, Bruch’s membranının 2 kat kalınlaşması
Bazal membran, Bruch’s membranı,RPE dejenerasyonu
•
Stargardt’s maküler distrofi:
* Çocuklardaki maküla hastalıklarının en sık nedeni
* STGD 1: en yaygın formu, OR, ABCA 4 genindeki mutasyon
* PR dış segmentindeki transporter proteinini kodlar
•
Retinitis pigmentosa:
* Çoğunlukla rod görme sistemini etkileyen bir grup herediter retinal dejenerasyonlar
* RP yapan 100’ den fazla genetik mutasyon ( OD, OR, X‐linked )
* Çoğu RP tipleri, primer RPE yetersizliği olarak başlar
* RPE spesifik genler ( RPE 65, MERTK ), RP’ ya dahil olur
YBMD’ nda maküladeki RPE’ nin değiştirilmesi çabaları
•
•
•
Submaküler cerrahi ile kan + CNV alınması
Maküler translokasyon cerrahisi: Maküla altına yeni RPE greftleri:
* Periferik RPE‐koroid saplı fleplerin kaydırılması
* Otolog serbest RPE‐koroid grefti
* Otolog periferik RPE hücre süspansiyonları
‐
‐
‐
‐
İmplante edilebilir minyatür teleskop ( 2010 )
Gen tedavileri –RPE 65
Kök hücre ( 2009, USA’ da onay )
Retinal implantlar ( 2011 )
( epiretinal, subretinal, suprakoroidal )
Göz, kök hücre çalışmaları için çok uygun bir organdır
* Modern VRC teknikleri ile retinaya kolay ulaşılabilir
* Retinanın belirli bir bölgesine, hücrelerin direkt transplantasyonu yapılabilir
* Gözün immün ayrıcalığı, verilen hücrelerin reddini azaltabilir ( Hastalıklı gözde immün ayrıcalıkda değişme ? )
* Retinanın yapısını ve fonksiyonlarını ölçmek ve kayıt için uygun yöntemler var ( OCT, FFA, FAF, mikroperimetri, multifokal ERG )
* Transplante edilmiş hücrelerin emniyeti ve etkinliği kolayca test edilebilir
Terminoloji
• Farklılaşma ( differentiation ): Bir hücrenin, daha özelleşmiş hücre tipine dönmesi
• Kök hücre ( Stem cell ):
* Kendi indiferansiye ( farklılaşmamış ) durumlarında, kendi kendini sonsuz yenileme yeteneği
* Pek çok hücre tipine farklılaşabilme özelliği
• Potansiyeline / etki gücüne göre kök hücreler:
* Omnipotent: embriyonik ve ekstra‐embriyonik dokulara farklılaşma
* Pluripotent: sadece embriyonik dokuları oluşturma yeteneği ( ektoderm, mesoderm, endoderm )
* Multipotent: sınırlı sayıda hücre tipine farklılaşma
Kök hücrelerin tedavide kullanılma şekilleri
• Rejeneratif yaklaşım( hücreyi yerine koyma ):
* Kök hücrelerden farklılaştırılmış RPE, PR gibi fonksiyonel hücrelerin hasarlı dokuya verilmesi
* Hastalıklı dokuyla bütünleşme, fonksiyonunu onarma
• Trofik yaklaşım ( kök hücresinin paracrine etkisi ):
* Farklılaşmamış veya kısmen farklılaşmış kök hücrelerin hasarlı dokuya verilmesi
* Sitokin / trofik faktörlerin salınması ‐‐‐‐‐‐ hasarlı dokunun uyarılması proliferasyon, restorasyon
* Kök hücrelerin, mevcut hasarlı hücrelerle kaynaşması?
* Yeterli çalışma yok
Orijinlerine göre kök hücreler
• Human Embriyonik kök hücreler ( hESC ):
* Pluripotent
* Blastosit (5 günlük) evre aşamasında, implantasyon öncesi embriyonun iç hücre kümelerinden elde edilir
* Nisbeten kolay büyür
* Red olasılığı fazla ( allogenik ise, HLA uygun değilse )
* Donörün hastalık yapan genlerini barındırır
• Fötal kök hücreler:
* Multipotent
* Fötus dokusundan elde edilir
• Adült kök hücreler: * Multipotent
* Kemiğin iliğinde hematopoetik , stromasında mezanşimal kök hücreler bulunur
* Göbek bağı dokusu
* Elde edilmeleri nisbeten zor
* Donörün hastalık yapan genlerini barındırır
Embriyonik kök hücreler ( h ESC )
•
•
•
Anlaşmış çiftler tarafından bağışlanır, artan in vitro fertilizasyon
embriyolarından elde edilir ‐‐‐‐‐‐‐‐ etik, hukuki sorunlar
Kültür ortamında devamlı olarak genişletilerek, pluripotent durumları idame ettirilir
ESC serileri, multiple hücre tipleri için kullanılır. RPE‐like hücrelerin üretilmesi:
* Spontan
* Yönlendirilmiş: Hasılat ve hız fazla
‐ DKK1, LEFTY faktörleri ile ile Wnt ve Nodal signalling yollarının bloke edilmesi ( bu faktörler, hayvan ve bakteriden elde edilir )
‐ Nikotinamid ve activin‐A ile ardaşık inkubasyon
‐ Bu dış faktörler pahallıdır, hücre kültür teknikleri zahmetli, metot komplike
Kök hücre tedavisinde immün reddin önlenmesi
•
•
•
Hücre temelli tedavide, transplante edilen hücrelerin immünolojik red potansiyeli, hedef doku ile bütünleşememe
Bunların önlenebilmesi:
Alıcılara immünosupresan tedavi verilmesi
Hücrelerin, HLA uygun şahıslardan alınması
Hücrelerin, hastanın kendisinden alınması ( IPSC ):
* Hastanın deri fibroblastları , IPC olması için yönlendirilir
( transfection gen teknikleri, özel küçük moleküllerle kültür )
* Hastanın genetik defekti varsa, düzeltilmesi
( hedeflenmiş gen tamiri , farmakolojik tedavi ile )
* Fonksiyonel olarak restore edilmiş IPSC’ lerin ‐‐‐‐‐‐‐‐ PR, RPE ‘ ye yönlendirilmesi
IPSC ( induced pluripotent kök hücre ) Bireyselleştirilmiş tıbbın bir başlangıcı olabilir
Nisbeten daha kolay büyürler
Embriyo‐derived kök hücredeki etik sorunlar yok
Farklılaşmamış hücrelerin bankasını kurmak , arzulanan hücre tipinin farklılaştırılması ve transplantasyonu ( HLA tipleme ile )
• ESC’ ye eşdeğer olarak düşünülse de, İPSC’ ler klinikte yaygın olarak kullanılmadan önce bazı sorunlar aydınlatılmalı:
•
•
•
•
* DNA ile ilgili emniyet sorunları * Kromozomal telomerleri çok kısa ‐‐‐ yaşlanan DNA
Tekrarlanan tedavi seansları gereksinimi ?
* Pluripotent otolog İPSC’ ler immünojenik olabilir
* Bilinen proto‐oncogen genlerin uzun süreli etkileri ?
* Güncel teknolojilerle yüksek tedavi maliyeti RP’ da submaküler alana süspansiyon halindeki kök hücrelerin verilmesi
İşlem sonrası 6. saat
İşlem sonrası 3. gün
2x10(6) / 0.2ml kök hücre
PAHAD 13
Kök hücrelerinin göze verilme şekli
• Hücre süspansiyonu enjeksiyonu: intravitreal, subretinal
* Hücrelerin, enjeksiyon öncesi saline içinde ayrıştırılması ve süspanse edilmesi
* Sorunlar:
‐ Farklılaşması bozulur ; fonksiyonel tek tabaka oluşturabilmesi için, invivo tekrar farklılaştırılmalı
‐ Çözülmüş hESC hücreleri, transplantasyondan sonra teratoma oluşturmaz, ama nöral rosetlere farklılaşır
‐ Çözülmüş hücrelerin etkinliğini ve lokalizasyonunu değerlendirmek zor
• Yapay tabaka üzerinde hücre kültürü : Terapötik greft olarak subretinal alana konması
Human embriyonik kök hücreler ( h ESC )‐1
hESC’ den geliştirilen RPE hücreleri, endojen doku morfolojisini ve fonksiyonlarını kopya eder
• RCS ratlarında subretinal enjeksiyon: PR dejenerasyonunda yavaşlama, görme performansı artar, retinal
elektrik aktivitesinin idamesi
• 45 tane NIH III mice’ de emniyet değerlendirilmesi: Teratoma veya displazi gelişmedi
( hESC‐derived RPE çok diferansiye )
• Diğer mice çalışmalarında: hESC‐derived nöral prekursor, subretinal alana verildi. % 50 tümör oluşumu var ( bu hücreler daha az diferansiye )
Human embriyonik kök hücreler ( h ESC )‐2
İlk klinik Sonuçlar
•
•
•
•
•
•
Subretinal, dissociated hESC‐derived RPE süspansiyonu kullanıldı
1 Stargardt, 1 geografik atrofi
2012‐ Advanced Cell Technology, California / USA
4. ayda: Teratoma yok, enjeksiyon yerinin
kenarında yeni pigmentasyon
hESC‐derived RPE hücreleri,
transplantasyon için ideal kaynak olabilir. Kaynağı etik olarak tartışmalı, diğer kök hücre kaynakları çalışılmalı
Human Fötal Kök Hücreleri
• Human fötal nöral kök hücreler, enzimatik olarak beyin dokusundan isole edildi
( 16‐20 haftalık gestasyonu olan, bağışlanmış düşük fötus )
• Bu hücre süspansiyonu RCS ratlarında subretinal alana enjekte edildi. Visual parametreler ve histolojide düzelme
• Bu hücreler ( HuCNS‐SC ), Stem Cell Inc. / Newark – USA tarafından geliştirildi. 16 kuru ‐ARMD’ lu hastada çalışma başlatıldı ( subretinal
enjeksiyon )
Adult kök hücreler‐1
Otolog kemik iliğinden geliştirilen kök hücreler
• Hematopoetik kök hücreler
* 3 RP’ lı hastada intravitreal enjeksiyon
* Yan etki yok, visual parametreler önemli oranda düzelmedi
* YBMD, retinal iskemi yapan vasküler retinopatilerde de deneniyor
• Mezanşimal kök hücreler
* Subretinal enjekte edilen hayvanlarda RPE ve PR morfolojisinde düzelme, visual parametrelerde iyileşme
* Daha az immünojeniktir. RPE hastalıklarının hücresel tedavisi için faydalı bir kaynak olabilir
* Görmeyi restore etme potansiyelleri ? Adult kök hücreler‐2
Human Umbilical tissue‐derived kök hücre
• Multipotent adült kök hücreleri bulundurur
• Enzimatik sindirme ile elde edilme, kültürde geliştirme
• 80 RCS ratında subretinal enjeksiyon, kontrole göre iyi sonuçlar
• Tamirin mekanizması paracrine ?
Morfolojiyi değiştirmedi, braid‐derived nörotrofik faktör salımı
• Janssen Research and Development – USA, kuru‐ARMD’ da faz I / II klinik çalışma başlattı. Katater ile sklera ve koroidden geçilerek submaküler alana verildi.
Trofik kök hücre tedavisi
•
•
Ciliary neurotrophic faktor implant: intravitreal enjeksiyon
Encapsulated cell teknolojisi Nörotrofik sitokin ‐‐‐‐ PR kaybını azaltma , geografik atrofide görme kaybını yavaşlatma
Fötal kök hücreler
•
Otolog kemik iliğinden geliştirilen kök hücre: intravitreal enjeksiyon
İnterlökin ‐‐‐‐‐‐‐ damar stabilizasyonu, konların korunması Faz I klinik çalışma: 3 RP, 2 cone‐rod distrofisi
10. ayda toksisite yok, 4 hastada 1 sıra görme artışı, ilave çalışmalar gerekli
•
İnsan umbilical dokusundan ( hUTC ) geliştirilen hücreler: subretinal enjeksi.
Rat modelinde: PR hücrelerin kurtarılması, korunması,, idamesinde faydalı
Faz I /II çalışma: human adult UTC’ nin mikrokatater ile verilmesi, geografik atrofi
YÜRÜTÜLMEKTE OLAN KLİNİK ÖNCESİ KÖK HÜCRE ÇALIŞMALARI
ESC’ den, in‐vitro 3 boyutlu retina oluşturma
( mouse modeli )
Tek hücre tipinin naklinden ziyade, farklılaştırılmış kök
hücreler ile tüm retinanın yerine konması
•
•
•
•
•
ESC + ekstraselüler matriks komponentleri ile kültür
Optik vezikül, iki tabakalı optik cup oluşumuna giden dinamik morfogenezis
Retinal progenitor ( ata ) hücreler ‐‐‐‐ ana retinal nöral hücre tipleri oluşur ( yapay retinal doku yaprakları )
Son çalışmalarda: uygun kültür ortamlarında, hESC ve IPSC’ lerden optik veziküle benzer yapılar oluşturuldu ( çok katlı retinal tabakalar )
Farmakolojik tedavilerin test edilmesi
h ESC‐derived RPE’ nin monolayer olarak transplantasyonu
•
•
Hücre süspansiyonunun kullanıldığı yöntemde hücreler, Bruch’s
membranına dezorganize olarak yapışırlar. Hücreler monolayer olarak gelişmez ve red olma ihtimalleri var. “ London Project to Cure Blindness “ klinik deneyler başlatıyor:
* hESC’ nin, ince bir polyester membran üstünde monolayer olarak kültürü * Yaşlanmış ve kalınlaşmış Bruch’s membranının değiştirilmesi için plastik polymer geliştirildi ( RPE patch graft )
Kök hücre kaynaklı transplante edilebilir fotoreseptörler
• İleri evre ARMD, STGD, RP’ da: hastalanmış RPE sonucu PR tahribatı
• Fötal retina, retinal öncü hücrelerin kaynağıdır, dejenere retina ile birleşme potansiyeline sahiptir
• İnsandaki uygulamaların sakıncası:
* Fötal dokunun sınırlı tedariği
* Etik sorunlar: Gestasyondan sonra 13. haftadaki fötus olmalı
Fotoreseptörlerin üretilmesi:
* Pluripotent kök hücre kullanımı * hESC‐derived embryoid cisimler ( IGFI, noggin, DKK 1 katılmış nöral kültür ortamında büyütüldü )
* Mouse ESC’ lerden PR oluşumu,çoğaltma: DKK 1, LEFTY, activin A + relatif
hipoksi ( % 2 )
SONUÇ
•
•
•
Preklinik araştırmalardan, faz I / II klinik deneylere geçildi
Hem rejeneratif hem de trofik kök hücre tedavileri, çeşitli klinik çalışmalar ile araştırılıyor
Bunların ilk, kısa süreli sonuçları: emniyetli, görme fonksiyonlarını düzeltmede faydalı
Açıklığa kavuşturulması gerekenler:
* Gerekli immün supresyon seviyesinin belirlenmesi
* RPE yerleştirme ile, paracrine model arasındaki fark
* Transplante ediliş yolu
* RPE süspansiyon / monolayer ?
* İPSC, hESC’lerin immünojenik durumları , malign potansiyelleri
* Nöral retina tamiri için, kök hücreden PR geliştirilmesi * İleri ARMD’ da: PR + hESC‐derived RPE nakli gerekli ( dual RPE + PR graft )
* ESC’ lerden, bütün optik cup’ ın oluşturulması
Good Manufacturing Practices – USA / FDA + protokoller