atomun yapısı - files.eba.gov.tr
advertisement
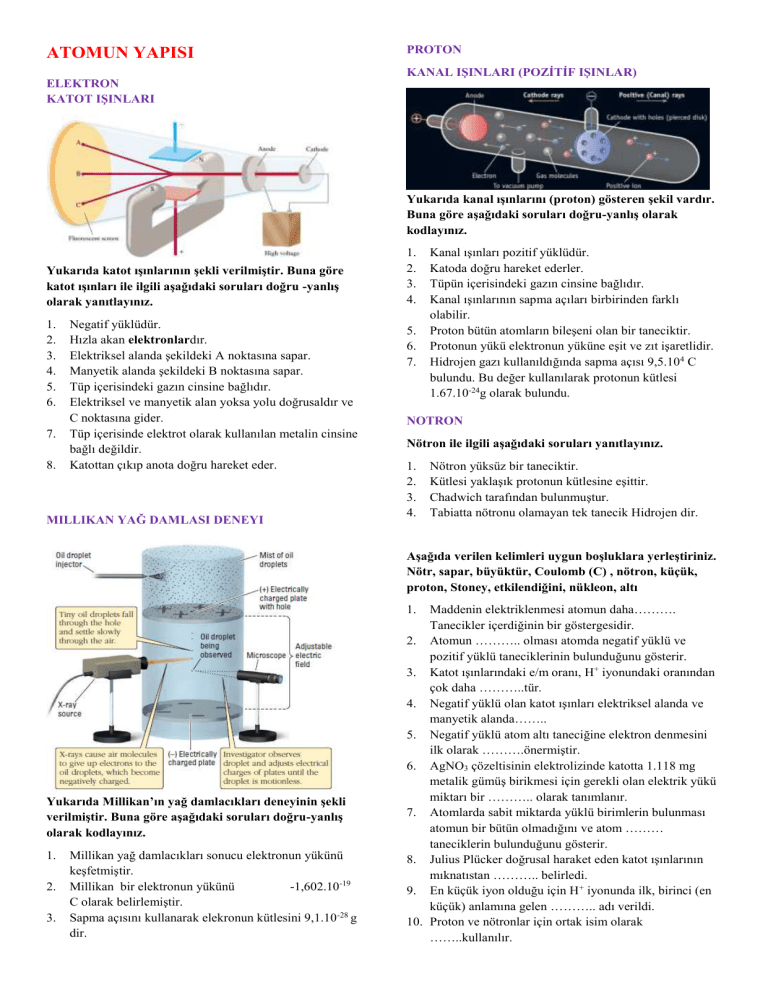
ATOMUN YAPISI PROTON KANAL IŞINLARI (POZİTİF IŞINLAR) ELEKTRON KATOT IŞINLARI Yukarıda kanal ışınlarını (proton) gösteren şekil vardır. Buna göre aşağıdaki soruları doğru-yanlış olarak kodlayınız. Yukarıda katot ışınlarının şekli verilmiştir. Buna göre katot ışınları ile ilgili aşağıdaki soruları doğru -yanlış olarak yanıtlayınız. 1. 2. 3. 4. 5. 6. 7. 8. Negatif yüklüdür. Hızla akan elektronlardır. Elektriksel alanda şekildeki A noktasına sapar. Manyetik alanda şekildeki B noktasına sapar. Tüp içerisindeki gazın cinsine bağlıdır. Elektriksel ve manyetik alan yoksa yolu doğrusaldır ve C noktasına gider. Tüp içerisinde elektrot olarak kullanılan metalin cinsine bağlı değildir. Katottan çıkıp anota doğru hareket eder. MILLIKAN YAĞ DAMLASI DENEYI 1. 2. 3. 4. 5. 6. 7. Kanal ışınları pozitif yüklüdür. Katoda doğru hareket ederler. Tüpün içerisindeki gazın cinsine bağlıdır. Kanal ışınlarının sapma açıları birbirinden farklı olabilir. Proton bütün atomların bileşeni olan bir taneciktir. Protonun yükü elektronun yüküne eşit ve zıt işaretlidir. Hidrojen gazı kullanıldığında sapma açısı 9,5.104 C bulundu. Bu değer kullanılarak protonun kütlesi 1.67.10-24g olarak bulundu. NOTRON Nötron ile ilgili aşağıdaki soruları yanıtlayınız. 1. 2. 3. 4. Nötron yüksüz bir taneciktir. Kütlesi yaklaşık protonun kütlesine eşittir. Chadwich tarafından bulunmuştur. Tabiatta nötronu olamayan tek tanecik Hidrojen dir. Aşağıda verilen kelimleri uygun boşluklara yerleştiriniz. Nötr, sapar, büyüktür, Coulomb (C) , nötron, küçük, proton, Stoney, etkilendiğini, nükleon, altı Maddenin elektriklenmesi atomun daha………. Tanecikler içerdiğinin bir göstergesidir. 2. Atomun ……….. olması atomda negatif yüklü ve pozitif yüklü taneciklerinin bulunduğunu gösterir. 3. Katot ışınlarındaki e/m oranı, H+ iyonundaki oranından çok daha ………..tür. 4. Negatif yüklü olan katot ışınları elektriksel alanda ve manyetik alanda…….. 5. Negatif yüklü atom altı taneciğine elektron denmesini ilk olarak ……….önermiştir. 6. AgNO3 çözeltisinin elektrolizinde katotta 1.118 mg metalik gümüş birikmesi için gerekli olan elektrik yükü miktarı bir ……….. olarak tanımlanır. 7. Atomlarda sabit miktarda yüklü birimlerin bulunması atomun bir bütün olmadığını ve atom ……… taneciklerin bulunduğunu gösterir. 8. Julius Plücker doğrusal haraket eden katot ışınlarının mıknatıstan ……….. belirledi. 9. En küçük iyon olduğu için H + iyonunda ilk, birinci (en küçük) anlamına gelen ……….. adı verildi. 10. Proton ve nötronlar için ortak isim olarak ……..kullanılır. 1. Yukarıda Millikan’ın yağ damlacıkları deneyinin şekli verilmiştir. Buna göre aşağıdaki soruları doğru-yanlış olarak kodlayınız. 1. 2. 3. Millikan yağ damlacıkları sonucu elektronun yükünü keşfetmiştir. Millikan bir elektronun yükünü -1,602.10-19 C olarak belirlemiştir. Sapma açısını kullanarak elekronun kütlesini 9,1.10 -28 g dir. DALTON ATOM MODELİ ELEKTROMANYETİK IŞINLAR Dalton atom modeli için aşağıdaki soruları doğru-yanlış olarak kodlayınız. Aşağıda tanımlarla kavramları eşleştiriniz. 1. 2. 3. 4. 5. Maddenin özelliklerini gösteren birim parçacıklar atom yada atom gruplarıdır. Aynı cins elementlerin atomları birbiriyle tamamen aynıdır. Atomlar içi dolu kürelerdir. Farklı cins atomlar farklı kütlelidir. Atomlar parçalanamaz. Tanım Kavram Elektromanyetik ışıma Bir dalganın maksimum yüksekliği yada derinliğidir.her hangi bir dalganın şiddedi genliğin karesi ile orantılıdır. (a2) Dalga boyu (lamda, λ ) Bir dalga hareketinin birim zamanda aldığı yoldur.elektromanyetik dalgalar boşlukta ışık hızında hareket eder.ancak hava veya başka bir ortamda daha düşük hızlıdırlar. Frekans (nü, ν ) Belli bir noktadan bir saniyede geçen dalga sayısıdır. Birimi 1/sn yada Hertz (Hz) tir. Hız (c) Ard arda gelen iki çukur yada iki tepe arasındaki uzaklıktır. Genlik (a) Elektrik ve manyetik alan enerjisi taşıyan dalgalardır. THOMSON ATOM MODELİ Thomson atom modeline göre aşağıdaki soruları doğru yanlış olarak kodlayınız. 1. 2. 3. 4. 5. 6. Thomson katot ışınlarının elektriksel ve manyetik alandaki sapma açılarını hesaplamıştır. Sapma açısı, yük ile doğru kütle ile ters orantılıdır. Sapma açısı tüpün içerisindeki gazdan bağımsızdır. 𝑒 Sapma açısı, 𝛼 = = 1,75. 108 C/g dir. 𝑚 Thomson modeline göre atomun merkezinde artı yükler toplanmıştır. Elektronlar atom içerisinde gelişigüzel dağılmıştır. Aşağıda elektromanyetik dalgalar ve dalga boylarını gösteren bir şekil verilmiştir. Buna göre aşağıdaki soruları yanıtlayınız. RUTHERFORD ATOM MODELİ Yukarıdaki deneyde Rutherford’un alfa parçacıkları deneyi gösterilmiştir. Buna göre aşağıdaki soruları doğru ve yanlış olarak kodlayınız. 1. 2. 3. 4. Atomun çok büyük bir kısmı boşluktur. Atomdaki pozitif yükler çekirdek denen küçük bir merkezde toplanmıştır. Atomda pozitif yüke eşit sayıda elektron bulunur. Elektronlar çekirdek etrafındadır. Atomun kütlesi çekirdekte yoğunlaşmıştır. Pozitif yüklerin kütlesi atomun kütlesinin yaklaşık yarısıdır. 1. 2. 3. 4. 5. 6. 7. Dalga boyu en düşük olan ışınlar …….. Enerjisi en yüksek olan ışınlar………… Dalga boyu ile enerji …….. orantılıdır. Frekansı en düşük ışınlar…………. Enerji ile frekans ……..orantılıdır. Mor ışığın enerjisi kırmızı ışıktan……. Kırmızı ışıktan mor ışığa gidildikçe frekans ……… Aşağıda verilen problemleri çözünüz. ( c=3.108 m/s ) 1. Boşlukta hareket eden bir ışının frekansı 1,2.1014 Hz tir. Buna göre bu ışının dalga boyu kaç metredir. 2. Kırmızı ışığın dalağa boyu 750 nm dir. Buna göre kırmızı ışığın frekansı kaç Hertz tir. 3. Trt fm 92.0 frekansında yayın yapmaktadır. Buna göre trt fm nin dalga boyu kaç metredir. IŞIĞIN İKİ YÜZÜ 2. Aşağıdaki ifadeleri doğru yanlış olarak kodlayınız. 1. 2. Işığın kırınımı, kırılması, saçılması, girişimi ışığın dalga karakteri ile açıklanabilir. Siyah cisim ışıması ve fotoelektrik olay ışığın tanecik karakterini açıklamak için kullanılır. KUANTUM TEORİSİ 3. 4. 5. 6. Aşağıdaki ifadeleri doğru yanlış olarak kodlayınız. 1. 2. 3. 4. 5. 6. 7. Enerji belirli büyüklükteki birimlerden oluşr. Bu enerji birimleri için kuantum kelimesi kullanılır. Enerji maddeler tarafından kuantumlar halinde alınır yada verilir. Işık hızı ile haraket eden kuantumlara foton denir. Işık fotonlardan oluşan bir enerji akımıdır. Işındaki foton yoğunluğu arttıkça ışının toplam enerjisi artar. Bir maddenin sıcaklığı artırıldığında yüksek enerjili foton yayar. 𝐸 = ℎ. 𝑣 = ℎ.𝑐 λ formülü ile hesaplanır. Elektron haraketinin mümkün olduğu yörüngeler K, L, M, N, O, gibi harflerle yada n=1, 2, 3,….. gibi tam sayılarla ifade edilir. Her bir yörünge için elektronun sahip olması gereken belirli bir enerji vardır. Elektron en düşük enerji gerektiren düzeyde bulunmak ister. Bu durumda elektron en kararlı haldedir. Buna temel hal düzeyi denir. Elektron kararlı haldeyken atom ışın yayınlamaz. Atom ısıtıldığında elektron temel hal enerji düzeyinden daha yüksek enerji düzeyine çıkar. Bu duruma uyarılmış hal denir. Uyarılmış düzeydeki elektron kararsızdır ve temel hale inerek kararlı hale geçer. Bu sırada dışarı enerji verir. ELEKTRON ENERJİSİNİN HESAPLANMASI Bohr atom modeline göre Hidrojenin temel enerji seviyesindeki bir elektronun enerjisi aşağıdaki formülle hesaplanır. 𝑬𝒏 = − 𝟐,𝟏𝟖.𝟏𝟎−𝟏𝟖 𝒏𝟐 J (n= temel enerji seviyesi) Tek elektronu bulunan Hidrojen benzeri iyonlar (He+, Li2+….) için bu formül, Aşağıdaki problemleri çözünüz. 1. 2. Verilen bir molekülün bozunmasını sağlayan en uzun dalga boylu ışımanın dalga boyu 221 nm’dir. Bu ışığın bir fotonunun enerjisi kaç jouledür? (h=6,63.10 -34 j.s c=3.108 m/s 1nm=10-9 m) Enerjisi 2.10-18 joule olan ışının frekansını ve dalga boyunu hesaplayınız. (h=6,63.10-34 j.s c=3.108 m/s) BOHR ATOM MODELİ Aşağıdaki ifadeleri doğru yanlış olarak kodlayınız. 1. Elektron, çekirdeğin etrafında anck belirli uzaklıklardaki enerji düzeylerinde (dairesel yörünge) haraket edebilir. 𝑬𝒏 = 𝟐, 𝟏𝟖. 𝟏𝟎−𝟏𝟖 𝒁𝟐 𝒏𝟐 J (z= atom numarası) şeklindedir. buna göre aşağıdaki hesaplamaları yapınız. 1. Hidrojen atomunun 1. temel enerji düzeyinde bulunan bir elektronun enerjisi kaç jouledir. 2. Hidrojen atomunun 2. temel enerji düzeyinde bulunan bir elektronun enerjisi kaç jouledir. 3. Hidrojenin birinci ve ikinci enerji seviyeleri arasındaki enerji farkı E kaç jouledir. 4. Hidrojen atomu spektrumunda uyarılmış elektronun 2. enerji düzeyinden temel hale dönerken (1. enerji düzeyi) açığa çıkan fotonun dalga boyunu ve frekansını hesaplayınız. ( h=6,63.10-34 j.s) 5. Li2+ iyonunda 1. enerji düzeyinde bulunan elektronun iyonlaşması için soğurması gereken fotonun minumum enerjisi kaç jouledir. (3Li) 6. Frekansı 2.1017 s-1 olan bir fotonun etkisiyle 4Be3+ iyonundan koparılan elektronun kinetik enerjisi kaç jouledir. De Broglie dalga eşitliği 𝒉 şeklindedir. 6. 7. 8. Buna göre aşağıdaki soruları yanıtlayınız. 1. 1. 2. 3. 4. 5. DALGA-TANECİK İKİLİĞİ (DE BROGLİE EŞİTLİĞİ) 𝛌 = 𝒎.𝒗 Aşağıdaki soruları doğru-yanlış olarak kodlayınız. 400 m/s hızla haraket eden bir 250 gramlık topun yaptığı de Broglie dalga boyu kaç metredir. (h=6,63.10 34 kg.m2.s-1) 9. Elektronların atomda bulunma ihtimalinin olduğu uzay bölgelerine orbital denir. Bir elektronun 4 kuantum sayısı aynı olamaz. Bir elektronun 3 kuantum sayısı aynı olabilir. Bir yörüngedeki orbital sayısı n2 formülü ile hesaplanır. Bir yörüngedeki maksimum elektron sayısı 2n2 formülü ile hesaplanır. n=2 enerji düzeyinde d orbitallerinden bulunamaz Tüm enerji seviyelerinde s orbitali vardır. Aynı enerji seviyesindeki bir orbitallere birer elektron girmeden ikinciler giremez. Bir orbitale birbirine zıt spinli olmak üzere en fazla iki elektron girebilir. ELEKTRON KONFİGÜRASYONU 2. Yaklaşık hızı 1.108 m/s olan bir elektronun dalga boyu kaç nanometredir. (h=6,63.10-34 kg.m2.s-1 me=9,1.1031 kg) Aşağıdaki orbital enerji seviyeleri verilmiştir. Buna göre aşağıdaki ifadeleri doğru-yanlış olarak kodlayınız. ATOMUN KUANTUM MODELİ KUANTUM SAYILARI Çekirdek etrafındaki herhangi bir elektronun durumu dört kuantum sayısı ile belirtilir. Bunlar; 1. 2. 1. 3. 2. 3. 4. 4. Aşağıdaki tabloyu doldurunuz. Başkuantum sayısı (n) Açısal kuantum sayısı (l) (l=n-1) Manyetik kuantum sayısı (ml) (ml=2l+1) Orbital sayısı Elektron sayısı 5. n=1 n=2 n=3 n=4 Elektronların dağılımı en düşük enerji seviyesinden başlanarak yapılır. Orbitalin enerjisi n+l bağlantılıdır. n+l değerinin eşit olduğu durumda küçük n değerine sahip orbitalin enerjisi daha düşüktür. Orbitallerin artan enerjilerine göre sıralanışı 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p…… şeklindedir. Temel haldeki elektron dağılımı; 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 şeklindedir. Aşağıda verilen elementlerin elektron dağılımını yapınız. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 1H 2He 5B 6C 7N 8O 9F 10Ne 13Al 17Cl 26Fe 12. Aşağıdaki kavram ve ifadeleri eşleştiriniz 35Br Kavram İfade Nötr atom Elektron sayıları ve dizilişleri aynı olan taneciklerdir. İyon Kütle numaraları aynı proton sayıları farklı olan atomlardır. Katyon Nötron sayıları aynı proton sayıları farklı olan atomlardır. Anyon Proton sayıları aynı kütle numaraları farklı olan atomlardır. İzotop Eksi (-) yüklü iyonlardır. İzoton Artı (+) yüklü iyonlardır. İzobar Yüklü taneciklerdir. İzoelektronik Proton sayısı=elektron sayısı olan atomlardır. KÜRESEL SİMETRİ Aşağıda verilen elementlerin hangilerinde küresel simetri vardır. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 1H 4Be 7N 8O 12Mg 18Ar 21Sc 24Cr 25Mn 29Cu 30Zn İYON ELEKTRON DAĞILIMI Aşağıda verilen iyonların elektron dağılımını yapınız. 1. 2. 3. 4. 5. 6. 7. 8. 8O 2- Aşağıdaki soruları yanıtlayınız. 1. Başkuantum sayısı n=4 için açısal kuantum sayısı ( l ) nin hangi değerleri olasıdır.açısal kuantum sayısı l=3 için hangi ml (manyetik kuantum sayısı) değerleri olasıdır. 2. Aşağıdakilerden hangisi olanaksızdır. n=1, l=0, ml=0, ms=+1 + 11Na 5+ 17Cl 2+ 22Ti + 24Cr 3+ 26Fe + 29Cu 3+ 31Ga n=1, l=3, ml=+3, ms=+1/2 n=3, l=2, ml=+3, ms=-1/2 Aşağıdaki tabloyu doldurunuz. n=0, l=1, ml=0, Atom 7N Elektron dağılımı (orbitalleride gösteriniz) Küresel simetri Değerlik orbitallerin türü Değerlik elektron sayısı ms=+1/2 n=2, l=1, ml=-1, ms=+1/2 3. Aşağıdaki kuantum sayılarından hangileri olası hangileri olanaksızdır. n=0, l=0, ml=0, m =+1/2 s n=1, l=1, ml=0, ms=+1/2 12Mg n=1, l=0, ml=0, ms=-1/2 n=2, l=1, ml=2, ms=+1/2 16S n=2, l=1, ml=1, ms=+1/2 27Co 4. Bir fotonun enerjisi 4.10-19 jouledir. Bu ışının dalga boyunu ve frekansını hesaplayınız. (h=6,63.10-34 j.s c=3.108 m/s) 5. Aşağıdaki orbital diyagramlarından hangileri Paulinin dışlama ilkesine uygundur. Neden? 19K 35Br 6. Aşağıdaki elektron dağılımlarından hangileri olası hangileri olanaksızdır. Neden? 1s12s22p7 1s22s22p5 1s22s22p63s23d7 1s22s22p63s23d8 1s22s12p6 1s22s22p8 1s22s22p63s23p63d7 1s22s32p63s13d9 Aşağıda X, Y ve Z elementlerin orbital diyagramları verilmiştir. Buna göre aşağıdaki soruları yanıtlayınız. 1. X elementinin atom numarası kaçtır 2. Hangi elementler küresel simetriktir. 3. Hangi elementler temel haldedir. 4. Hangi elementlerin tam dolu orbital sayıları aynıdır. 5. Y ve X elementlerinin değerlik orbitalleri nedir. 6. X elementinin en büyük başkuantum sayısı kaçtır. 7. Y elementi için l=2 kuantum sayısına sahip kaç elektronu vardır.






