Periyodik cetvel
•
Periyodik Cetvel
Çok eskiden beri kimyacılar, elementleri sınıflandırmayı
düşünmüşlerdi. Böyle bir sınıflandırmada elementlerin özellikleri,
belirli bir düzen içinde değişirse, kimyacıların işi epeyce
kolaylaşacaktı. Geçen yüzyılın ortalarında, şimdi bilinen
elementlerin yarısından biraz fazlası biliniyordu. Bilinen
elementleri, özelliklerine göre sınıflandırmak için o zamanki
kimyacılar, değişik fikirler ileri sürmüşlerdir.
Bugünkü anlama yakın periyodik sistem, 1869 yılında Rus kimyacısı
Dimitri Mendeleev tarafında yapılmıştır. 1877 yılında Alman bilgini
Lothar Meyer de Mendeleev’ den habersiz olarak bir periyodik
cetvel yapmıştır. Bu iki cetvel hemen hemen birbirinin aynıdır.
Meyer; elementleri, cetvelinde fiziksel özelliklerine göre sıralamış,
Mendeleev ise elementlerin atom kütlelerini dikkate alarak artan
atom kütlelerine göre cetvelinde sıralamıştır
• Bu gün ise elementler, özellikleri
birbirine benzeyenler alt alta gelecek
şekilde, artan atom numaralarına göre
sıralandığında bir cetvel oluşturur.
Oluşan bu cetvele periyodik cetvel
denir. Günümüzde kullanılan periyodik
cetvel aşağıdaki gibidir;
• Periyodik cetvel elementlerin elektron dizilişine
bağlı olarak dört bloktan meydana gelir. Cetvelde
yatay sütunlara periyot, düşey sütunlara grup
denir.Periyodik cetvel 7 periyot ile 8A, 8B grubu
olmak üzere 16 gruptan oluşur. 4. ve 5.
periyotlarda periyodun 10 element uzamasına d
orbitalinin dolması neden olur. 6. ve 7. periyotlarda
ise sıranın 14 element uzamasına f orbitalinin
dolması neden olur. F orbitaline elektron dolan 14
elementten 6. sıradaki lantanitler ve 7. sıradaki
aktinitler, cetvelin daha fazla uzamaması için alt
sırada f bloğuna alınmıştır.
• Periyodik cetvelin s bloğunda IA ve
IIA, p bloğunda IIIA, IVA, VA, VIA,
VIIA ve 0 grupları, d bloğunda ise
IIIB, IVB, VB, VIB, VIIB, VIIIB, IB
ve IIB grupları yer alır.
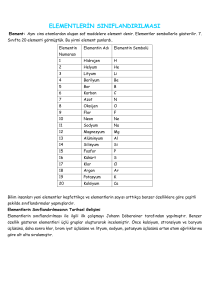
*Elementler artan atom numaralarına
göre periyodik cetvele
yerleştirildiğinde, cetvelin sol
tarafında metallerin sağ tarafında
ametallerin yer aldığı görülür.
• PERİYOTLAR VE GRUPLAR
• Periyodik cetvel elementlerin elektron dizilişine
bağlı olarak dört bloktan meydana gelir. Cetvelde
yatay sütunlara periyot, düşey sütunlara grup
denir.
• Periyodik cetvel 7 periyot ile 8A, 8B grubu olmak
üzere 16 gruptan oluşur. 4. ve 5. periyotlarda
periyodun 10 element uzamasına d orbitalinin
dolması neden olur. 6. ve 7. periyotlarda ise sıranın
14 element uzamasına f orbitalinin dolması neden
olur. F orbitaline elektron dolan 14 elementten 6.
sıradaki lantanitler ve 7. sıradaki aktinitler,
cetvelin daha fazla uzamaması için alt sırada f
bloğuna alınmıştır.
• Periyodik cetvelin s bloğunda IA ve IIA, p bloğunda
IIIA, IVA, VA, VIA, VIIA ve 0 grupları, d
bloğunda ise IIIB, IVB, VB, VIB, VIIB, VIIIB, IB
ve IIB grupları yer alır.
• Elementler artan atom numaralarına göre periyodik
cetvele yerleştirildiğinde, cetvelin sol tarafında
metallerin sağ tarafında ametallerin yer aldığı
görülür.
• Elementlerin atomlarındaki elektron dizilişleri ile
periyodik cetvelde bulundukları yer arasında yakın
bir ilişki vardır. Bu ilişki Mendeleev’ in periyodik
cetvelinin günümüz modern atom teorisine uyumunu
gösterirken, elementlerin periyodik cetveldeki
yerlerini bulmamıza da ışık tutar
• Bir Periyotta Soldan Sağa Doğru Gidildikçe ;
• a) Atom no, kütle no, proton sayısı, atom kütlesi,
nötron sayısı, elektron sayısı, değerlik elektron
sayısı artar.
• b) Atom çapı ve hacmi küçülür.
• c) İyonlaşma enerjisi artar.
• d) Elektron ilgisi ve elektronegatifliği artar. (8A
hariç)
• e) Elementlerin metal özelliği azalır, ametal
özelliği artar. (8A hariç)
• f) Elementlerin oksitlerinin ve hidroksitlerinin
baz özelliği azalır, asitlik özellik artar. (8A hariç)