İçindekiler Tablosu
1.
ELEKTRON .................................................................................................................................... 1
1.1.
2.
Milikan Yağ Damlası Deneyi .................................................................................................. 1
ATOM MODELLERİ ..................................................................................................................... 2
2.1.
Dalton Atom Modeli ............................................................................................................... 2
3.1.
Thomson Atom Modeli ........................................................................................................... 3
4.1.
Rutherford Atom Modeli ......................................................................................................... 3
5.1.
BOHR ATOM MODELİ......................................................................................................... 5
3.
ENERJİ DÜZEYLERİ .................................................................................................................... 7
4.
FOTONLARLA UYARMA .......................................................................................................... 10
5.
ATOMU ISITARAK UYARMA .................................................................................................. 10
6.
ATOMLARI ÇARPIŞTIRARAK UYARMA............................................................................... 10
7.
KENDİLİĞİNDEN EMİSYON UYARILMIŞ EMİSYON .......................................................... 11
8.
HİDROJEN SPEKTRUMUNDA SERİLER ................................................................................ 13
9.
MODERN ATOM TEORİSİ......................................................................................................... 15
1. ELEKTRON
Atomun temel taşlarından birisi olan elektron, doğadaki elektriğin en küçük parçasıdır. 1896
yılında Thomson tarafından bulundu. Thomson, katot ışınlarının negatif yüklü parçacıklardan
oluştuğunu, bu parçacıkların kütlelerinin hidrojen atomu kütlesinden yaklaşık 2000 kez daha hafif
olduğunu saptadı. Bu parçacıklara elektron adı verildi. Daha sonraları Milikan'ın yaptığı deneylerle
elektronun yükünün 1,6.10-19 coulomb değerinde olduğu saptandı. Daha sonraları elektronun
kütlesinin 9,11. 10-31 kg olduğu bulunmuştur. Bu da hidrojen atomu kütlesinin yaklaşık 1/1837 sidir.
1.1.Milikan Yağ Damlası Deneyi
Elektronun yükünün belirlendiği deneydir. 1908'de Robert Andrew Milikan yağ damlası
deneyi ile elektronun kütlesinin ve yükünün hassas ölçümünü yapmıştır. Millikan'ın hazırladığı
düzenek, bir püskürtücü (atomizer) ile yağ damlacıklarının içine püskürtüldüğü oda ve elektrik
alanının bulunduğu ikinci bir odadan oluşmaktadır.
Bu düzenekte yağ damlacıkları birinci odaya püskürtülürler ve odanın tabanındaki delikten
elektrik alanının bulunduğu odaya geçerler. Bu damlacıkların elektrik yüklü olmaları gerekir. Bunun
için X ışınları kaynağı kullanılır. İkinci odaya X ışınları gönderilerek havadaki moleküllerin
iyonlaşması sağlanır. İyonlaşma sonucunda havadan koparılan elektronlar, yağ damlacıklarını negatif
yüklerler. Daha sonra elektrik yüklü damlacıkların yerçekimi ve elektriksel kuvvetlerin etkisindeki
hareketi bir mikroskopla incelenir. Plakalar arasındaki potansiyel farkı değiştirilerek yağ
damlacıklarının asılı kalması sağlanır. Bu şekilde asılı kalan yağ damlasına etki eden m.g yerçekimi
kuvveti ve q.E elektriksel kuvvetlerinin eşitliği sağlanır. Asılı kalması sağlanan m kütleli ve q yüklü
damlacıklar için m.g = q.E m.g olacağından, yağ damlasının yükü q= olarak hesaplanır.
Milikan, yaptığı deneylerde yağ damlacıklarının üzerindeki yükü 1,593.10-19 coulombun tam
katları olarak bulmuştur. Bunun sonucu olarak bir elektronun yükü 1,6. 10-19 C olarak kabul
edilmiştir. Bu değer negatif elektrik yükünün en küçük değeridir. Bundan dolayı elektronun yüküne
elemanter yük (ey) denir. Elde edilecek tüm elektrik yükü değerleri elektronun yükünün tam katlarıdır.
2. ATOM MODELLERİ
Bilim insanları, maddenin yapısını ve maddenin nelerden yapıldığını açıklayabilmek için
birçok çalışma yapmışlar ve bu çalışmalar sonucunda çeşitli teoriler ortaya koymuşlardır. Maddeni
yapısı ile ilgili ilk teoriyi M.Ö. 400 yılında Yunanlı filozof Leucippus ve Democritus yaptı.
Democritus, maddenin taneciklerden oluştuğunu savunmuş ve bu taneciklere atom adını vermiştir.
Democritus, atom hakkındaki görüşlerini deneylere göre değil varsayımlara göre söylemiştir.
ğında en sonunda bölünemeyen bir tanecik elde edilir
Atom görülemediği için bölünemez. Ancak o zamanlar bu hipotez pek ilgi görmedi. Daha sonraları
Aristo elementleri hava, su, toprak ve ateş olmak üzere dörde ayırdı. Aristo'ya göre bu dört elementin
farklı şekillerde bir araya gelmesiyle farklı maddeler oluşmaktaydı.
2.1. Dalton Atom Modeli
Dalton Atom Modeli, John Dalton'un 1805 yılında bugünkü atom modelinin ilk temellerini
attığı modelidir. Dalton'un atom kuramına göre elementler kimyasal bakımdan birbirinin aynı olan
atomlar içerirler. Farklı elementlerin atomları birbirinden farklıdır. Daltonun atom teorisi kimyasal
reaksiyonların açıklanmasına, maddenin anlaşılmasına ve atomun temel özelliklerinin ortaya
atılmasına oldukça büyük yararlar sağlamıştır. Bu sebeple ilk bilimsel atom teorisi olarak kabul edilir.
Dalton'a göre: 1. Bir elementin bütün atomları şekil, büyüklük ve kütle yönüyle aynıdır. 2. Atomlar içi
dolu küreciklerdir. 3. Bilinen en küçük parçacık atomdur.4.Atomlar parçalanamaz, yeniden
oluşturulamaz. 5. Atomlar belirli oranlarda birleşerek molekülleri meydana getirir. Elementin bütün
atomları aynı olduğu gibi bir bileşiğin de bütün atomları aynıdır. Dalton teorisinde pek çok yanlışlık
ve eksiklik olmasına rağmen çok önemlidir. Kendisinden sonra gelen bilim adamlarına bir kapı
aralamış, fikir ortaya atarak tartışılmasını sağlamıştır. Böylece daha doğruya ulaşma imkânı
sağlamıştır. Dalton Atom Teorisindeki Eksiklik ve Hatalar 1. Bir elementin bütün atomları aynı
değildir. O dönemde nötron tanecikleri tespit edilemediği için izotop atomların farkına varılamadı. Bir
elemente ait bütün atomların proton ve elektron sayısı aynı olmak zorundadır. Nötron sayısı farklı olsa
da aynı elemente aittir, fakat farklı atomdur. 2. Atomların içi dolu değildir. Aksine boşluklu yapıya
sahiptir. 3. Bilinen en küçük parçacık atom değildir. Günümüzde atom çekirdeğini oluşturan 70 çeşit
parçacığın var olduğu ve bunların bilinen 50 hareketinin olduğu ifade edilmektedir. 4. Bir elementin
bütün atomları aynı olmadığı gibi bir bileşiğin bütün molekülleri de aynı değildir.
3.1.Thomson Atom Modeli
Bu modele göre atom yaklaşık 10-10 metre çaplı küre biçimindedir. Bu kürenin içi pozitif
yüklü madde ile düzgün olarak doldurulmuştur. Negatif yüklü elektronlar ise atomu elektrikçe nötr
tutacak şekilde küre içinde çeşitli yerlerde gömülü olup hareketsizdirler. Elektronların atom içindeki
durumu göz önüne alınarak, bu modele üzümlü kek modeli de denilmiştir.
Bu modele göre elektronlar atomun kütlesinden binlerce defa daha hafif ve hareketsizdirler.
Atomun kütlesinin tamamına yakın kısmını pozitif yükler meydana getirir. Thomson Atom Modelinde
Eksiklikler ve Hatalar 1. Çekirdek yapısından bahsetmemiştir. 2.Atom pozitif yüklü bir küre değildir.
3. Proton ve elektronlar rast gele dağılmamışlardır. 4. Nötrondan bahsetmemiştir.
4.1.Rutherford Atom Modeli
Yirminci yüzyılın başlarına kadar yapılan araştırmalar, atomun elektrikçe nötr olduğu ve
içinde pozitif ve negatif yüke sahip çok küçük taneciklerin yer aldığı küre şeklinde bir yapıdan
oluştuğu varsayımlarına dayanıyordu. Peki, gerçekte atom içerisindeki yükler bu varsayımlardaki gibi
atomu nötrleyecek durumda hareketsiz bir şekilde mi dağılmıştır? Bu varsayımlar ancak fotoelektrik
olay, termoiyonik olay ve gazlardan elektron boşalması gibi olayları açıklamakta yeterli olmuştur.
Ernest Rutherford yaptığı deneylerle radyoaktiviteye büyük ölçüde katkı sağlamıştır. Ayrıca alfa
taneciğinin yükünün elektronun yükünün iki katı (+2e) büyüklükte ve pozitif olduğunu, kütlesinin ise
elektronun 8000 katı kadar olduğunu hesaplamıştır. Daha sonra alfa taneciğinin helyum atomu
olduğunu keşfetmiştir. Yapılan atom modellerinin yetersiz kaldığını gören Rutherford, bir düzenek
kurmuştur. Rutherford aşağıdaki şekildeki gibi hazırladığı bu düzenekte kurşun bir blok içine
hapsettiği radyoaktif maddelerden çıkan alfa taneciklerinin çok küçük bir delikten çıkmasını ve
saçılma açılarını doğru hesaplamak için de çinko sülfür (ZnS) sürülmüş çembersel bir levha
kullanmıştır. Altın
etkilenmeden yoluna devam etmesini beklemiştir. Rutherford'a göre taneciğinin elektrona çarpması şut
çekilen bir futbol topunun sineğe çarparak yön değiştirmesine benzer. Bundan dolayı Rutherford ve
kısmının altın levhadan doğrultu değiştirmeden (00'lik açıyla) geçtiğini bazılarının ise farklı açılarda
Rutherford'un atom hakkında önceki görüşlerin yetersiz kaldığını hatta yanlış olduğunu kavramasını
taneciklerinin, saçılması için atomun merkezinde kütlesi büyük pozitif yüklerin olduğunu
göstermektedir.
Joseph John Thomson (1856 - 1940)
Ernest Rutherford (1871 -1937)
Rutherford'un geliştirdiği atom modeli, ''Atomun içindeki pozitif yük, kütlenin çoğunu
oluşturur ve çekirdek denilen bir merkezdedir. Çekirdeğin dışındaki boşluklarda elektronlar güneş
sistemindeki gezegenler gibi çekirdeğin etrafında dönmektedir.'' şeklinde ifade edilir.
İlk defa atomun çekirdekli yapıda olduğu fikri bu modelde ortaya atılmıştır.
çekirdek ile bu çekirdeğin etrafında dairesel yörüngelerde dolana
şartlarda (+) yük ile (Thomson'un dediği gibi durgun halde değildir. Böyle olsaydı elektrostatik çekimden dolayı elektronlar
çekirdek üzerine düşerdi. Elektrostatik kuvvet dönme hareketinden dolayı oluşan merkezkaç kuvvetine
araştırmalarda altın atomu çekirdeğinin çapını yaklaşık olarak 3.10-14 m bulmuştur. Bu değer daha
önceden hesaplanan atom boyutu (10-10 m) ile kıyaslanınca çekirdeğin, atomun 1/10.000'i olduğu
görülür. Ayrıca Rutherford atom çekirdeğinde pozitif yüklerin kütlesine denk başka parçacıkların
olabileceğinden bahsetmiş fakat bu yüksüz parçacıkların varlığını 1932 yılında James Chadwick
kanıtlamıştır. Rutherford atom modeli, iki temel yönden geçersiz sayılmıştır. 1. Elektromanyetik
teoriye göre, yüklü tanecikler ivmeli hareket yaparsa elektromanyetik dalga yaymaları gerekir.
Rutherford atom modelinde, çekirdek etrafında dolanan elektronlar, coulomb çekim kuvvetinin
etkisiyle çekirdeğe düşmemeleri için çekirdek çevresinde sürekli ivmeli hareket yapmaları gerekir. Bu
durumda, elektromanyetik ışımanın olması gerekir. Işıma yaparak enerjisi azalan elektronlar spiral bir
yörünge çizerek çekirdeğe düşmeleri gerekirdi. Bu atomun çökmesi, yapısının bozulması demektir.
Gerçekte ise atomların kararlı bir şekilde var oldukları bilinmektedir. 2. Elektromanyetik ışıma
yaparak çekirdeğe yaklaşan elektronun hızı ve frekansı artar. Böylece, ışımanın enerjisi sürekli artar.
Bu durum, atomdan yayınlanan ışımalardan sürekli bir spektrum elde edilmesi anlamına gelmektedir.
Ancak bilim insanlarının yaptığı araştırmalara göre, atomlardan elde edilen spektrumlar sürekli değil
belirli enerji seviyelerindedir.
5.1.BOHR ATOM MODELİ
Rutherford atom modelindeki belirsizlikler bilim insanlarını atomun yapısıyla ilgili yeni
araştırmalar yapmaya yöneltti. Thomson ve Rutherford’un yanında çalışmış Danimarkalı Fizikçi Niels
Bohr, Rutherford modelindeki eksiklikleri gidermek ve atom spektrumlarına bir açıklama getirmek
için 1913 yılında Rutherford atom modelini temel alarak kendi adıyla anılan bir atom modeli geliştirdi.
Bohr’a göre de, Coulomb kuvveti elektronları çekirdek etrafında döndürüyordu. Bohr buna ek olarak,
Rutherford atom modelindeki güçlükleri gidermek için iki postülat (varsayım) ortaya koymuştur.
Bunlar; 1. Elektronlar, yalnızca belirli yörüngelerde dolanabilir. Bu yörüngeleri belirleyen koşul,
elektronun açısal momentumunun tam katları olmasıdır. Bir başka deyişle, elektronlar açısal
momentumlarınin tam katları olan kararlı yörüngede ışıma yapmadan dolanır.
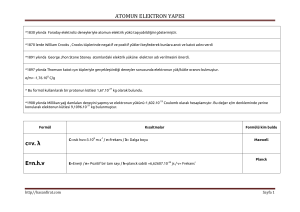
n : Yörünge numarası olup tam sayıdır. (n=1,2, ...) h : Planck sabiti ( h= 6,62.10-34 J.s ) h :
İndirgenmiş Planck sabiti olup “çizgili h” diye okunur. L : Açısal momentum (J.s)
2. Elektron, bulunduğu yörüngeden daha yüksek enerjili bir yörüngeye ancak dışarıdan enerji
alarak çıkabilir. Yüksek enerjili kararlı bir yörüngeden (bir dış yörüngeden), daha düşük enerjili kararlı
bir yörüngeye (bir iç yörüngeye) kendiliğinden atlayabilir. Bu atlayışta elektron, yörüngeler
arasındaki enerji farkını bir foton olarak salar.
Yayılan bu fotonun enerjisi ve frekansı elektronun ilk ve son yörüngelerindeki enerji farkı ile
belirlenir.
Burada; Ei : Elektronun ilk yörüngedeki enerjisi Es : Elektronun son yörüngedeki enerjisi h :
-
- nilk
bağıntısından bulunur.
Elektronların Bulunabileceği Yörünge Yarıçapları Bohr atom teorisi tek elektronlu atomlar
için geçerlidir. Atomun elektron sayısı birden fazla ise iyonlaştırılarak Bohr atom modeli uygulanır.
Yani Bohr modeli 1H atomu ile 2He+ ve 3Li+2 gibi tek elektronlu iyonlara uygulanabilir. Buna göre
Bohr atomu +Ze yüklü bir çekirdek ve çekirdek çevresinde r yarıçaplı bir çember üzerinde dolanan -e
yüklü bir elektrondan ibarettir.
Şekildeki elektron dairesel hareket yaptığına göre, elektrona uygulanan Coulomb çekim kuvveti,
merkezcil kuvvete eşit olmalıdır. Bu durumda,
Fçekim = Fmerkezcil q1 . q2 m.v2 k
= d2 r e.Ze
m.v2 k
= r2 r
hızıyla dolanırken h açısal momentumunun tam katlarına eşit
n. yörüngede dönen bir elektronun yörünge yarıçapı,
rn : n. yörüngenin yarıçapı n : Elektronun bulunduğu yörünge numarası (n=1,2, ...) Z : Atom numarası
Hidrojen atomunun atom numarası Z = 1 olduğundan, 1. yörüngede (n=1) dolanan elektronun yarıçapı,
o r0 = 0,53 Aolur. Bu sabite Bohr yarıçapı denir.
a Bir atom için
oranı sabit olduğundan, Bohr Z yörüngelerinin yarıçapları n2 ile doğru orantılıdır.
Bohr Yörüngelerinde Elektronun Enerjileri v hızı ile çekirdek çevresinde rn yarıçaplı yörüngede
dolanan bir elektronun elektrik potansiyel enerjisi,
Ze2 Ep = -k
dir. rn Kinetik enerjisi, 1 Ek =
m v2 dir. 2 Elektronun bulunduğu bu
yörüngedeki toplam enerjisi,
Ze2 1 En = Ep + Ek = -k
+
m v2 rn 2 m v2 kZe2 = rn rn 2 değerleri ve gerekli sabitlerden
faydalınalarak toplam enerji,bağıntısından bulunur.
Burada, Z : Atom numarası n : Yörünge numarasıdır. Bağıntının önündeki (-) işareti
elektronun çekirdeğe bağlı olduğunu gösterir. Enerji bağıntısında yörünge numarası (n) büyüdükçe
toplam enerji, sıfıra yaklaşacağından büyür. Bir elektronun çekirdekten uzakta bir yörüngede iken
sahip olduğu enerji, çekirdeğe daha yakın bir yörüngede iken sahip olduğu enerjiden daha büyüktür.
Çünkü toplam enerji bağıntısı negatif olduğundan n büyüdükçe eşitliğin sağ tarafı küçülür. Öyleyse,
bir elektronun bulunduğu yörünge çekirdeğe ne kadar yakınsa bağlanma enerjisi (iyonlaşma enerjisi)
yani toplam enerjiyi sıfır yapan enerji o kadar büyük olur.
Bir elektronun atoma bağlanma enerjisi, toplam enerjiyi sıfır yapmak için atoma verilmesi
gereken enerjidir. Yani bağlanma enerjisi toplam enerjinin pozitif değerlisine eşittir.
Bohr atom modelinin yetersiz olduğu bazı durumlar; 1. Bohr atom modeli tek elektronlu
atomlar (1H, 2He+, 3Li+2, ...) için geçerlidir. Birden fazla elektronu bulunan elementlerde
elektronların çekirdekle ve birbirleri ile, elektriksel ve manyetik etkileşimleri hesaba katılmamış ve
açıklanamamıştır. 2. Atomon saldığı ışığın spektrumu çizgiler biçimindedir. Bu çizgiler, tek gibi
görünüyorsa da tek olmayıp birbirine yakın birkaç çizgiden oluşmaktadır. Ayrıca ışıma yapan kaynak
kuvvetli bir magnetik alan içine sokulursa, tüm spektrum çizgilerinde yarılmalar olur. Bir başka
deyişle her çizgi yeni çizgilere bölünür. Bohr atom modeli bu durumu açıklayamamıştır. 3. Atomların
spektrumundaki bazı çizgilerin daha parlak oluşunu açıklayamaz. 4. Atomlar arasındaki bağlar ve
atomların birleşerek molekülleri nasıl oluşturduğu açıklanamamıştır. 5. Elektronun dalga hareketi
dikkate alınmamıştır. Bohr modelinin bu yetersizlikleri 1920’li yıllarda, kuantum mekaniğinde
yapılacak önemli gelişmelerle giderilmeye çalışılmıştır.
ÖRNEK-1 : Bohr atom modeline göre; I. Elektron çekirdekten uzaklaştıkça, elektriksel potansiyel
enerjisi sıfıra yaklaşır. II. Elektron çekirdekten uzaklaştıkça, bağlanma enerjisi azalır. III. Elektron
çekirdeğe yaklaştıkça, kinetik enerjisi artar. yargılarından hangileri doğrudur?
A)Yalnız I
B) Yalnız II
C) I ve III D) II ve III
E) I, II ve III
ÖRNEK-2 : Bohr hidrojen atomu modeline göre, hidrojen atomunda r yarıçaplı yörüngede dolanan
elektronun; I.Toplam enerjisi ve yörünge yarıçapı, yörünge numarasının karesi ile doğru orantılıdır.
mu L/r oranına eşittir. yargılarından
hangileri doğrudur? (L : açısal momentum; h : planck sabiti)
A)Yalnız I
B) Yalnız II
C) Yalnız III
D) I ve II
E) II ve III
3. ENERJİ DÜZEYLERİ
Atom hakkında yapılan çalışmalarla ulaşılan en önemli sonuç, atomun enerji seviyelerinin var
olmasıdır. Enerji seviyeleri, elektronların atom içinde olabilecekleri enerji basamaklarıdır. Normal
şartlarda atomlar, minimum enerji düzeyinde bulunur. Bu enerji düzeyine temel hal denir. Temel
haldeki elektronlar bazı dış etkilerle bir miktar enerji kazanır ve üst enerji seviyelerine çıkabilir. Bu
duruma atomon uyarılması denir. Uyarılmış durumdayken fazla enerjisi olan atom, 10-8 saniye gibi
çok kısa bir süre içinde fazla enerjisini atarak temel hale döner. Atomun ışıması denen bu olay,
atomdan “foton salınması” ile gerçekleştirilir. Yani atomun uyarılması ve ışıması birbirini takip eden
olaylardır. ATOMUN UYARILMASI Atomun uyarılması için dışarıdan enerji alması gerekir. Dolaylı
veya dolaysız, atomda enerji artışına neden olacak her türlü dış etki, aynı zamanda uyarma sebebidir.
Örneğin, sıcaklığın arttırılması ve buna neden olan basınç artışı atomun uyarılması için yeterli
nedendir. Fazla sıcaklık veya basınç, atomlar arası çarpışmayı arttırır. Bu şekilde uyarılan atomlar,
foton yayarak fazla enerjilerinden kurtulurlar. Atomları uyarmanın başka yolları da vardır. Özellikle
elementlerin spektrum çizgilerinin elde edilmesinde başvurulan metot atomları “elektronlarla” veya
“fotonlarla” uyarmaktır. Atomdaki enerji seviyeleri ile ilgili bulgular sadece çizgi spektrumlarından
elde edilmemiştir. Atomun uyarılması deneylerinden elde edilen sonuçlar da atomda enerji
seviyelerinin bulunduğunu hatta bunların spektrumlarla elde edilen bilgilerle tamamen uyum
sağladığını gösterdi. Bu konuda en göze çarpıcı araştırma, Bohr’un hipotezinden yaklaşık bir yıl sonra,
James Frack ve Gustav Hertz tarafından yapıldı. 1. Elektronlarla Uyarma Atomun elektronla
uyarılabilmesi için elektronun atomun uyarılma enerjisi seviyesinde bir enerjiye sahip olması gerekir.
Şayet elektronun yeterli enerjisi yoksa çarpışma yapar ve enerji kaybetmeden atomu terk eder. Yeteri
kadar enerjisi varsa elektron çarpışma yaparak enerjisinin bir kısmını atoma aktarır ve geri kalan
enerjisi ile atomu terk eder. Çarpışma sonucu bir üst enerji seviyesine çıkmış atomu başka bir elektron
uyaramaz. Yandaki şekilde, hidrojenin enerji seviyeleri iki farklı açıdan ele alınmıştır. Şeklin sol
tarafında hidrojen atomu için eV cinsinden verilmiş enerji seviyeleri, sağ tarafında ise sol taraftaki
enerji seviyelerinde temel hâl 0 eV kabul edilerek oluşturulmuş uyarılma seviyeleri bulunmaktadır.
Atomun temel hâlin üstünde uyarıldığı seviyelere uyarılma seviyeleri denir. Elektron, enerjisi
yeterliyse birden fazla atomu aynı anda uyarabilir.
6
Z2 Ebağ = 13,6
eV n2
Franck - Hertz Deneyi Franck ve Hertz, kurdukları düzenekle, bazı elementlerin gaz hâlindeki
atomlarını elektronlarla uyarmak istediler. Böylece, Bohr’un dediği gibi, atomda enerji seviyelerinin
olup olmadığı anlaşılacaktı. Franck-Hertz deneyinde, hızlandırılmış elektronlarla, atomlar çarpıştırılıp,
çarpışmadan sonra enerjileri ölçülür. Bu enerji elektronun ilk enerjisi ile karşılaştırılır.
Akkor hâldeki fitilden termiyonik olayla elektron salan elektron tabancasından salınan
elektronlar, hızlandırıcı potansiyel farkı (VH) ile kinetik enerji kazandırılarak, içinde enerji seviyeleri
ölçülecek gaz bulunan odaya gönderilir. Deney, cıva elementi ile yapılmış olsun. Bunun için gaz
odacığına, cıva buharı doldurulur. Düzenek çalıştırılır. Elektron tabancasına uygulanan hızlandırıcı
potansiyel farkı yavaş yavaş, ancak sürekli olarak arttırılır. Bu sırada gaz odasında, cıva atomları ile
etkileşen elektronlardan ölçüm odasına gelenlerin buradaki enerjileri saptanır. Sonra elektronların,
elektron tabancasındaki hızlandırıcı potansiyelin değerinden belirlenen ilk enerjileri ile ölçüm
odasındaki enerjileri karşılaştırılır. Hızlandırıcı potansiyel farkı sıfır değerinden yavaş yavaş artırılıp 5
volt dolayına gelinceye kadar, ölçüm odasına gelen elektronların enerjileri, elektron tabancasında
kazandıkları ile aynıdır. 5 volttan küçük her bir hızlandırıcı potansiyel için, elektronların cıva
atomlarıyla çarpışmalarında elektronlarda bir enerji kaybı görülmez. Öyleyse bu durumda elektron ile
cıva atomları arasındaki çarpışmalar, esnek çarpışmalardırve elektron ile çarpışan bir cıva atomu enerji
kazanmaz denebilir. Hızlandırıcı potansiyel farkı 5 volt dolayında örneğin; tam 5 volt ise, ölçüm
odasındaki elektronların enerjilerinde, büyük bir değişiklik gözlenir. Cıva atomları ile çarpışmalardan
sonra elektronların enerjileri, hemen hemen sıfır düzeyine iner. Hızlandırıcı potansiyel farkı 5 volt
olduğu zaman gaz odacığına giren elektronların ilk kinetik enerjileri 5 eV olur. Çarpışmadan sonra bu
değer, hemen hemen sıfır değerine düştüğüne göre, cıva atomları ile elektronlar arsındaki çarpışmalar,
bu kez tümden esnek olmayan çarpışmadır. Bu çarpışmada elektronun kaybettiği enerji, etkileştiği cıva
atomunca alınmıştır. Hızlandırıcı potansiyel farkı 5 voltu aşınca, ölçüm odasındaki elektronların
kinetik enerjileri yeniden artmaya başlar. Hızlandırıcı VH potansiyel farkı 5 volttan 6 volta çıkaracak
olursak, ölçüm odasında elektronların kinetikenerjileri 1 eV dolayında olur. Öyleyse bu aşamadaki
çarpışma yarı esnek bir çarpışmadır. Cıva atomu ile çarpışan bir elektronun 6 eV luk ilk enerjisi, cıva
atomu ile elektron arasında paylaşılmıştır. 6 eV luk enerjinin yaklaşık 6-1= 5 eV luk bölümü cıva
atomunca alınmış, gerisi elektronda kalmıştır. Buradan cıva atomlarıyla elektronların etkileşmesi
sonucu, cıva atomunun belirgin bir değerde (yalnız 5 eV) olan enerjiyi alabildiğini, bunun dışındaki
enerji değerlerini kabul etmediğini görürüz. Daha duyarlı ölçmeler, etkileşimlerde cıva atomlarının
kazanabileceği en küçük enerjinin 4,86 eV (yaklaşık 4,9 eV) değerinde olduğunu göstermiştir. Eğer
gaz atomlarını bombardıman eden elektronların enerjileri 6,7 eV veya bundan biraz büyük yapılırsa,
elektronların ya 4,9 eV ya da 6,7 eV enerji kaybettikleri görülür. Bombardıman enerjisi daha da
artırılırsa, büyük enerji kayıplarının olduğu daha başka basamakların da olduğu görülür. O hâlde
atomlar iç enerjilerini değiştirebilirler, ancak bu değişmeler kesin olarak belirli basamaklarla olabilir.
Bir atom tarafından alınabilecek en küçük enerji değerine, o atomun birinci uyarılma enerjisi ya da ilk
uyarılma enerjisi adı verilir. Cıvanın birinci uyarılma enerjisi 4,86 eV tur. İlk uyarılma enerjisi en
büyük olan atom, helyumdur. Helyumun ilk uyarılma enerjisi 19,8 eV tur. Sezyum 1,38 eV luk ilk
uyarılma enerjisi ile en düşük ilk uyarılma enerjisine sahip atomdur. Uyarılma enerjileri atomda, enerji
düzeylerini belirler. Hiçbir uyarılma enerjisi almamış, doğal hâlinde bulunan bir atoma temel enerji
düzeyindedir (atom, temel durumda ya da taban durumundadır) denir.
Hızlandırma gerilimindeki artma sürdürülürse atom, yüksek enerji düzeyine çıkar. Yüksek
enerji düzeylerine çıkıldıkça, atomun kararlılığı bozulur. Atoma verilen enerji, o atoma özgü belirli bir
değeri aşarsa, atomdan bir elektron kopar ve böylece (+) yüklü bir iyon ile bir serbest elektron doğmuş
olur. Atomdan bir elektron koparabilecek enerji değerine, atomun iyonlaşma enerjisi denir. Bu değer,
cıva için 10,4 eV, sezyum için 3,87 eV tur. Her elementin kendine özgü bir iyonlaşma enerjisi vardır.
İyonlaşma sonucu elde edilen serbest elektronun kinetik enerjisi, herhangi bir değerde olabilir. Bu
nedenle atom, iyonlaşma enerjisinden büyük olan her değerdeki enerjiyi alabilir.
4. FOTONLARLA UYARMA
Fotonlar elektronlardan farklı olarak atomla etkileşirken taşıdıkları enerjinin ya tamamını atoma
aktarırlar ya da hiç enerji kaybetmeden atomu terk ederler. Fotonların atomu uyarması için uyarılma
seviyesine eşit enerjiye sahip fotona ihtiyaç vardır. Aksi durumda foton, atomu uyarmadan esnek
çarpışma yaparak atomu terk eder. Fotonla uyarma olayı, hidrojen atomu üzerinde incelendiğinde
aşağıdaki sonuçlara ulaşılır. 8 eV’luk bir enerjiye sahip foton, hidrojen atomuna gönderildiğinde
atomu uyaramaz ve 8eV’luk enerjiyle atomu terk eder . 10,2 eV’luk bir enerjiye sahip foton hidrojen
atomuna gönderildiğinde atom 1. uyarma seviyesinde uyarılır ve fotonun tüm enerjisi atom tarafından
soğurulur. 12 eV’luk bir enerjiye sahip foton hidrojen atomuna gönderildiğinde atomu uyaramaz ve 12
eV’luk enerjiyle foton atomu terk eder. Foton, enerjisi yeterli olsa bile temel hâldeki atomlardan
sadece bir tanesini uyarabilir. Uyardığında ise enerjisinin tümünü yitirir. Gelen fotonun enerjisi,
atomun iyonlaşma enerjisinden büyük ise, enerjisinin iyonlaşma enerjisi kadarlık kısmı ile atom
iyonlaştırır. Artan enerji kopan elektrona aktarılır ve atom fotonu soğurur. (Fotoelektrik olay)
5. ATOMU ISITARAK UYARMA
Hidrojen atomu ısıtıldığında iç yörüngedeki elektronun enerjisi artar ve bu elektron bir üst yörüngeye
sıçrar. Daha sonra atom temel halde bulunma isteğinden dolayı 10-8 s’de ışıma yaparak bünyesindeki
fazla enerjiyi dışarı salar. Enerji salınımı sonucunda elektron eski yörüngesine döner. Bohr atom
hakkındaki varsayımlarını yaparken incelediği atomları bu yöntemi kullanarak uyarmıştır.
6. ATOMLARI ÇARPIŞTIRARAK UYARMA
Atomlar yüksek sıcaklık ve basınçta birbirleriyle çarpıştırılabilirler. Birbirleriyle çarpıştırılan atomlar,
değişik enerji seviyelerinde uyarılırlar ve aldıkları fazla enerjiyi 10-8 saniye içinde ışıma yoluyla salar.
ÖRNEK-1: Sezyum atomunun enerji düzeyleri sırasıyla 1,38 eV, 2,30 eV ve iyonlaşma enerjisi de
3,87 eV tur. 2,40 eV enerjili k elektronu 2,40 eV enerjili l fotonu 4,0 eV enerjili m fotonu
parçacıklarından hangisi ya da hangileri sezyum atomunu uyarabilir? (k ve m)
ÖRNEK-2: Enerji seviyeleri şekilde verilen atomun iyonlaşma enerjisi 10 eV tan büyüktür. Bu atomun
buharı içinden 5,5 eV enerjili bir elektron demeti geçiriliyor. Buradan dışarı çıkan elektronların
enerjisi; I. 0,5 eV II. 1,5 eV III. 2,5 eV değerlerinden hangilerini alabilir?
(I ve III)
ÖRNEK-3: Cıva atomunun enerji düzeyleri şekildeki gibidir. Temel durumdaki cıva buharı, enerjisi 8
eV olan fotonlarla bombardıman edilirse, bu fotonlar dışarıya hangi enerji ile çıkabilirler?
(8 eV)
ÖRNEK-4: Sezyum atomunun ilk iki enerji düzeyi 1,38 eV, 2,30 eV tur. Sezyum atomunu 2. enerji
düzeyine uyarabilen fotonun o dalga boyu kaç A dur? o (5391 A)
7. KENDİLİĞİNDEN EMİSYON UYARILMIŞ EMİSYON
Atom hangi yolla uyarılırsa uyarılsın kazandığı fazla enerji foton şeklinde yayınlar. Atomdaki
ışıma enerjisi elektronun sıçrama yaptığı yörüngelerin enerji seviyeleri arasındaki farka eşittir. Bilim
insanları ışımalar üzerinde yaptıkları araştırmalar sonucunda, uyarılmış atomların iki çeşit ışıma
yaptıklarını keşfetmişler ve bunlara kendiliğinden ışın yayma (kendiliğinden emisyon) ve uyarılmış
ışın yayma (uyarılmış emisyon) adlarını vermişlerdir. Kendiliğinden ışın yayma: Bir atoma belirli
değerde enerji verilirse atom uyarılır. Uyarılan atom bu enerjiye eş değerde, zorlama olmaksızın bir
ışıma yaparak temel hâle geçer. Bu duruma kendiliğinden ışın yayma denir. Bu işlem 10-8 saniyede
gerçekleşir.
Kendiliğinden ışın yayacak maddede atomların çoğu temel hâl düzeyindedir. Bu maddenin atomlarına
farklı değerlerde enerjiye sahip bir foton demeti yollanırsa foton demeti ile bir grup atom etkileşir ve
atom, enerjiyi soğurarak bir üst enerji seviyesine geçer. Uyarılmış atom yaklaşık 10-8 saniye sonra
soğurduğu enerjiye eş değerde bir ışıma yaparak temel hâle geçer. Bu geçişler farklı olasılıklarla
gerçekleşebilir.
1. Şekil’deki atom, E2 enerji seviyesinde uyarıldığından kendiliğinden ışın yaymak için tek yolu
vardır.
2. Şekil’deki atom, E3 enerji seviyesinde uyarıldığından kendiliğinden ışın yaymak için üç farklı yolu
vardır.
3. Şekil’deki atom, E4 enerji seviyesinde uyarıldığından kendiliğinden ışın yaymak için altı farklı yolu
vardır.
n(n-1)
Kendiliğinden yayılan farklı ışın sayısı, 2formülüyle hesaplanır. Burada; n : Yörünge numarasını ifade
eder.
ÖRNEK : Uyarılma seviyeleri verilen hidrojen atomu, 13,5 eV enerjili elektronlarla uyarılıyor. a)
Uyarılan hidrojen atomunda farklı enerjili kaç ışıma gerçekleştiğini ve bu farklı ışımaların enerjisinin
ne olduğunu bulunuz. b) Işımaların frekanslarını sıralayınız.
10
Uyarılmışışın yayma: Yarı kararlı seviyeye sahip atomlarda, uyarılmış bir atomun zorlama sonucu
yaptığı ışımaya uyarılmış ışın yayma denir. Uyarılmış ışıma yapacak maddede atomların çoğu temel
hal düzeyinin üzerindeki enerji seviyelerindedir. Bu duruma tersine birikim olayı denir.
Yukarıdaki şekilde de
- E2) enerjili gelen foton, atomu E3 seviyesinden E2
- E2) enerjili uyarılmış bir foton yayınlar. Böylece iki
fotonserbest bırakılmışolur. Bu iki fotonun enerjileri ve fazları aynı büyüklüktedir. Eğer bu iki foton,
uyarılmış atomlardan diğer ikisini üst enerji seviyesinden alt enerji seviyesine geçmeye zorlarsa dört
foton serbest bırakılmış olur. Bu işlem, E3 seviyesindeki uyarılmış atom sayısı, E2 seviyesindeki atom
sayısından çok olduğu sürece devam eder. Uyarılmış ışın yayma, hologramlarda kullanılan lazer
teknolojisinin temelini oluşturur. LAZER Lazer, uyarılmış ışın yayma yoluyla ışığı şiddetlendirerek
aynı frekans ve fazda uyumlu fotonlardan oluşan ve güçlendirilmiş ışık oluşturan alettir. Lazer ışığı
1960 yılında Theodore Maiman tarafından elde edilmiştir. Bu aletin çalışma prensibini anlayabilmek
için, iki ucunda birbirine paralel aynalar (biri tam yansıtıcı, diğeri yarı geçirgen) bulunan ve lazer için
gerekli madde (katı, sıvı, gaz, yarı iletken) ile dolu cam bir tüp düşünelim. Tüpün içindeki atomlar
hızlandırılmış elektron veya foton kullanılarak uyarıldığı zaman, üst enerji seviyelerine çıkar. Uyarılan
bu atomlar üst enerji seviyesinden alt enerji seviyelerine dönerken foton yayınlar. İlk ve son
yörüngelerdeki atomların enerji seviyeleri farkı kadar enerjiye sahip fotonlar, uyarılmış atomlara
çarptığı zaman bu atomlar bir alt enerji seviyesine geçmeye zorlanır. Bu sırada, gelen fotonla aynı
yönlü bir foton daha yayınlanır. Bu fotonlar yarı geçirgen ve tam yansıtıcı aynalardan yansıyarak
atomları foton yaymaya zorlar ve kendileriyle aynı yönlü fotonlar oluştururlar. Aynalardan sürekli
yansıyarak sayısı artan aynı fazlı bu fotonlar, yarı geçirgen aynadan lazer ışığı olarak çıkar.
Kaplama kalınlığı ayarlanan yarı geçirgen aynanın üzerine düşen fotonlar belli sayıya ulaşınca lazer
ışığı olarak dışarı çıkarlar. Şimdi, lazer ışığının özelliklerini sıralayalım. 1. Lazer ışığı aynı frekans ve
fazda fotonlar oluşturduğu için tek renklidir ve bu renk lazerin cinsine göre değişebilir. 2. Normal bir
ışık gibi dağılmaz, çok az sapar. Örneğin, Dünya’dan gönderilen lazer ışını, Apollo 11’in Ay’a
bıraktığı bir aynadan yansıyıp hiç sapmadan geri dönmüştür. Işığın bu esnada aldığı yol 750000
km’dir. 3. Yüksek enerjili olduklarında delme, kesme, kaynak yapma vb. olaylarda kullanılabilirler.
Lazer ışığındaki yüksek enerjiyi ancak 1030 K sıcaklığında elde ederiz. 4. Lazer ışığı, atmosferik
olaylardan (yağmur, kar, sis vb.) etkilenir. Lazerler; katılı, sıvılı ve gazlı olmak üzere üç çeşittir. Katılı
lazerler: İlk katılı lazer 1960’da Theodore H. Maiman tarafından icat edilen yakut lazeridir. Yakut, %
0,04 oranında krom (Cr+3) ihtiva eden alüminyum oksit kristalinden oluşur. Kırmızı lazer ışınlarını,
bu kristal içindeki krom atomları yayar. Krom atomları optik olarak yeşil ve mor ışıkla uyarılır. Yakut
kristalinden çıkan lazer ışığının dalga boyu 6943 Å, ışın demetinin şiddeti 10 kW/mm2 dir.Bu kadar
güçlü olmasına karşı yakut lazerin verimliliği %1 civarındadır. Bunun yanı sıra zenginleştirilmiş katı
malzemeden (neodyumla zenginleştirilmiş silisyum oksit bazlı kristaller) ve yarı iletken maddeden
(galyum arsenik kristali) yapılanlar katılı lazerler sınıfındadır. Sıvılı lazerler: En çok kullanılan sıvılı
lazer türü, organik bir çözücü içindeki organik boyanın seyreltik bir çözeltisidir. Bunlardan morötesi
ile kızılötesi arasında lazer türleri elde edilebilir. Boya lazerlerinin en önemli özelliği tek dalga boyu
yerine, maddeye bağlı olarak belirli spektrumda ve istenilen dalga boyunda çalışmasıdır. En bilinenleri
Rhodamine 6G ve 4-Methylum Belliferone’dir. Gazlı lazerler:Lazer maddesinin kimyasal yapısına
göre; atom, molekül ve iyon lazeri olmak üzere üçe ayrılır. 6328 Å’luk ışık veren helyum-neon lazeri
atom lazerine, kızılötesi ışık veren karbondioksit lazeri molekül lazerine, aynı anda yeşil-mavi ışık
yayan argon lazeri ise iyon lazerine örnektir. Atom lazerler; Asal gaz (Xe, Ar, Ne ,He) ve Metal buharı
(Cd, Sn, Pb,Zn) İyon lazerler; Asal elementli (Xe, Ar, Ne, He) ve Metal buharlı (Cd, Sn, Pb,Zn),
Molekül lazerler (CH3F, CO2, N2, CO) şeklindedir. Lazerler, günlük yaşantıda başta haberleşme
teknolojisi olmak üzere pek çok alanda kullanılmaktadır. Özellikle yeryüzü ile uydular arasındaki
haberleşme sistemleri, fiber optik sistemlerle yapılan telefon iletişimi ve yüksek yoğunlukta ses veya
görüntü depolama (CD, hologram teknolojisi) sistemlerinde kullanılmaktadır.
8. HİDROJEN SPEKTRUMUNDA SERİLER
Rutherford atom modeli, atomların çizgi spektrumlarını açıklayacak bir bilgi içermiyordu. Hatta, bu
modele göre atomlar ışıma yaparsa sürekli spektrum oluşturmalıydılar. Çünkü, spiral çizerek çekirdek
üzerine düşen elektron, bu sırada sürekli hızlandığı için, frekansı devamlı artacak ve her frekansta
ışıma yapması gerekecekti. Bu ise atomların çizgi spektrumları gerçeğine ters düşüyordu. 1860’dan
1885 e kadar birçok bilim adamı spektrum çizgileri üzerine araştırma yaptı. Spektrum çalışmalarında
en kolay incelenebilecek element Hidrojen’di. Çünkü Hidrojen atomunun çizgi spektrumu, görünür
renklerde çok belirgin çizgiler içermekteydi. Bazı spektrum analizcilerine göre, çizgilerin
spektrumdaki yerleri belirli bir matematiksel kurala uyacak gibi görünüyordu. Nihayet 1885 te Johann
Jacob Balmer isimli İsviçreli fizikçi, hidrojen spektrumundaki çizgileri fiziksel olarak açıklayamasa
da, bu çizgilerin yerlerinin matematiksel bir formüle uyduğunu buldu. Balmer’in yaptığı çalışmalar,
sadece atomların çizgi spektrumları hakkında isabetli matematiksel yorumlar içeriyordu. Olayın atom
ile ilgili çok enteresan veriler içerdiğinin ortaya konması ise yıllar sonra Bohr tarafından yapıldı.
Bohr’un 2. potulasına göre; bir elektron, enerjisi E2 olan bir üst yörüngeden enerjisi E1 olan bir alt
yörüngeye inerse bir foton salınır. Salınan bu fotonun enerjisi;
-13,6 ifadesi kullanılırsa, n2 (Hidrojen için Z= 1 dir.)
h.c E2 h.c
-13,6
-13,6 = ( )-
-13,6
1 1=
( ) elde
ıntıda, 13,6/h.c sabit değeri 1,097373. 107 m-1 olarak hesaplanır. Bu
değere Rydberg sabiti denir ve Rile gösterilir. Bağıntı daha sade olarak yazılırsa, n2 yörüngesinden n1
yörüngesine geçen elektronun yapacağı ışımanın dalga boyu,
Bu denklem, Balmer’in yıllarca önce, fiziksel anlamını bilmeden bulduğu formüle aynen uyar. R sabiti
de, daha önceki araştırmacıların hesapladığı değerle hemen hemen aynıdır. Yani, Bohr’un hipotezleri,
deneylerle de tamamen uyum içindedir.
Balmer yaptığı deneyde, hidrojen atomundaki elektronların n=2’nin üstündeki enerji seviyelerinden
n=2. yörüngeye geçişleri sırasında salınan fotonların dalga boylarının, görünür ışığın dalga boylarına
eşit olduğunu keşfettiği için bu fotonlar Balmer serisi olarak adlandırılmıştır. Balmer serisinde
hidrojen spektrumu n=3. yörünge kırmızı, n=4. yörüngede yeşil, n=5. yörüngede ise mavi çizgiye
karşılık gelir.
Hidrojen atomunda elektronların üst enerji seviyelerinden alt seviyelere geçişi sadece n=2. yörüngeye
değildir. Bunun yanında; n=1, n=3, n=4 ... seviyelerine de geçişlerin olduğu gözlenmiştir. 1908
yılında, F. Paschen, hidrojen atomundaki kızıl ötesi ışınlar serisinin, üst enerji seviyelerinden n=3.
seviyeye geçişlerinde gerçekleştiğini buldu. Benzer çalışma, 1914 yılında T. Lyman tarafından yapıldı.
Lyman, üst enerji seviyelerinden n=1’ e geçişlerde mor ötesi ışınlar serisinin oluştuğunu buldu. Lyman
sembolleriyle gösterilerek özel olarak tanımlanmıştır. Paschen’in bulduğu seriye Paschen serisi ve
Lyman’ın bulduğu seriye de Lyman serisi dendi. n=4 ve n=5. yörüngelere geçişlerde oluşan Brackett
ve Pfund serileri de 1920 de farkedildi. Bu serilerin hepsi, Bohr’un hidrojen atomu için genelleştirdiği
yukarıdaki bağıntı ile tamamen uyum içindedir. Bohr’un bu başarısı da, daha sonraki yıllarda
geliştirilen kuantum mekaniğinin temel başarılarından sayıldı.
Hidrojen atomundaki seriler ve Balmer serisinden oluşan çizgi spektrumu.
12
ÖRNEK : Şekilde H atomunun bazı enerji düzeyleri verilmiştir. n=5 enerji düzeyine uyarılmış H
kaç eV tur?
(0,96 eV)
9. MODERN ATOM TEORİSİ
Modern Teoriye Geçiş Bohr atom modeli 1920'lere kadar ciddi bir tenkit görmemesine rağmen,
birçok fizikçi, henüz atomun tamamen tarif edildiği kanaatini taşımıyordu. Özellikle spektrum
tekniğinin gelişmesi , Bohr modelinin yetersizliklerini gündeme getirdi. Bohr, atomdaki elektronun
hareketi ile ilgili açıklamalarını klasik fizik çerçevesinde yapmıştı. Yani, bir tanecik olan elektron,
atom içinde, elektrostatik ve merkezcil kuvvetlerin etkisinde belirli yörüngelerde dolanmaktadır.
Klasik fizik anlayışına göre, etrafımızdaki her şey tamamen madde (tanecik) veya tamamen dalgadan
oluşmaktadır. 1923'te, de Broglie, madde ve dalganın birbirinden bağımsız olmayıp birbirlerini
tamamlayan parçalar olduğunu iddia etti. De Broglie'ye göre, daha önce de öğrendiğimiz gibi, hareket
halindeki maddeler dalgalar eşlik edebilir. Özellikle bazı şartlar altında bu olay oldukça belirginleşir.
sürmüştü. Bu hipotezinin atomdaki elektronlara da uygulanabileceğini belirten de Broglie,
elektronların sadece tanecik olarak değil, onlara eşlik eden dalgalarla birlikte düşünülmesi gerektiğini
savundu. De Broglie, bu görüşü ile Bohr'un postulatlarından birisinin fiziksel dayanağını, yaklaşık on
yıl sonra bulmuş oldu. Bohr, atomda elektronların yerleşimini belirleyen değişkenin açısal momentum
kuralın ne olduğunu açıklayamamıştı. De Broglie
denklemde, me.ve yerine yazılırsa,
ve buradan
elde edilir.
Bu bağıntıda; n : yörünge numarası rn : n numaralı yörüngenin yarıçapı Bağıntı, atom için anlamlı bir
yörüngenin çevre uzunluğu, elektrona eşlik eden dalganın dalga boyunun tam katları olur.
Broglie, atomun yapısının Bohr’un anlattığı kadar basit olmadığı hipotezini öne sürmüştür. Bu
hipotezin günlük yaşantıdaki en önemli uygulama alanı elektron mikroskoplarıdır. Elektron
mikroskobu, Broglie’nin de açıkladığı gibi elektronların parçacık ve dalga etkileşiminin gerçekleştiği
bir alet olup tıpta ve kriminal incelemelerde kullanılır. Broglie’nin ‘‘Elektron, sadece tanecik olarak
değil dalga olarak da düşünülmelidir.” şeklindeki açıklaması pek çok bilim insanının atom hakkında
yeni araştırmalar yapmasında etkili olmuştur. Atomun kompleks bir yapıda olduğunu düşünen bilim
insanları atomu incelemek için geliştirdikleri mekaniğe kuantum mekaniği adını vermiştir. hatta bazı
fizikçiler; mekaniğin sadece meddesel cisimler için değil, de Broglie’nin “madde dalgaları” dediği,
onlara eşlik eden dalgalar için de düşünülmesi gerektiğini kabul ederek dalga mekaniği ifadesini
kullandılar. 1920'li yıllarda de Broglie ile başlayan yeni düşünceler, 1925'ten sonra değişik
yaklaşımlarla birçok fizikçi tarafından desteklendi. Fizik alanındaki bu yeni gelişmeler , daha sonradan
modern fizik olarak tanımlandı. 1925'te, Werner Heisenberg'in görüşleri, atom içi hareketlerin ve
dolayısı ile kuantum mekaniğinin temelini oluşturdu. Heisenberg'in bu ilginç prensibine göre, atom
içinde elektronların yerini veya hareketini tam olarak belirlemek imkansızdır. Yani, bir elektronun
pozisyonu tam olarak belirlediğiniz zaman momentumunu ancak belirli aralıkta ifade edebilirsiniz.
Bunun tam tersi de geçerlidir.
Elektronun momentumunu tam olarak belirlediniz zaman pozisyonunu belirli bir aralıkta ifade etmek
gerekir. Bunun anlamı şudur: Elektronun atom içinde pozisyonu ve momentumu hakkında bir miktar
toplam belirsizliğin
olur. Yani, elektronun, atom içindeki yerini ne kadar net belirlerseniz, momentumu o kadar
belirsizleşir. Aynı şekilde, elektronun momentumunu ne kadar net belirlerseniz pozisyonu o kadar
belirsizleşir. Heisenberg'in, belirsizlik prensibi olarak meşhur olan bu görüşleri, atomda elektronların
yerlerinin Bohr'un dediği gibi net ifade edilemeyeceğini ortaya koydu. Heisenberg'in bu çalışmaları ile
aynı tarihlerde başka bir modern fizikçi de yaklaşık aynı şeyleri ifade eden araştırmalar içerisindeydi.
Avusturyalı fizikçi Erwin Schrödinger, yaptığı çalışmaları açıkladığında Heisenberg'i destekleyecek
kuvvetli deliller ileri sürmüş oldu. Schrödinger'e göre, atom içinde hareket eden elektronların net
yerlerinden söz etmek mümkün değildir. Ancak, elektronların bulunma ihtimallerinin yüksek olduğu
yerler tespit edilebilir. Schödinger'in bu görşlerini, örneğin hidrojen atomu için düşünecek olursak,
şekilde görüldüğü gibi, bir elektronun atom içinde bulunabileceği yerler, çekirdekten itibaren sonsuza
kadar düşünülebilir, fakat belirli bir uzaklıktan sonra ihtimal hemen hemen sıfırdır. Belirli uzaklıklarda
ise elektronun bulunma ihtimali çok yüksektir. İşte, elektronun, atomda bulunma ihtimalinin yüksek
olduğu bu yerlere elektron bulutu denir.
Kuantum Sayıları Modern atom teorisinden önce sadece Bohr modeli, atomdaki elektronların yerleri
ve enerjileri ile ilgili bilgiler vermekteydi. Bohr modelinde elektronların çekirdekten uzaklıkları ve
sahip olabilecekleri enerjiler; n = 1, 2, 3,… gibi tam sayılarla bağıntılı olarak ifade edildi. Atomların
çizgi spektrumlarının manyetik alan içinde incelenmesiyle ortaya çıkan "bazı çizgilerin daha alt
çizgilere ayrılması" olayı enerji seviyelerinin belirlenmesinde başka etkenlerin de rol oynadığı fikrini
doğurdu. Elektron bulutu kavramını ileri süren modern fizikçilere göre elektronların atom içindeki
yerlerinden çok, onların değişik fiziksel özelliklerinin tanımlanması gerekmektedir. Böylece enerji
seviyelerinin, farklı enerjili daha alt seviyelere ayrılması olayı açıklanabilecektir. Atom hakkında
somut düşünceler ileri süren modern fizikçiler arasında Schrödinger'in görüşleri çok kabul gördü.
Schrödinger, atoma matematiksel bir yaklaşımla bakmıştı. Elektronların birçok özelliklerinin, onlara
ait dalga denklemi ile ifade edebileceğini gösteren Schrödinger, böylece dalga mekaniğini kurmuş
oldu. "Schrödinger denklemi" olarak meşhur olan denklemin çözüm kümesi; elektronların atom
içindeki yerleri, enerjileri ve açısal momentumları gibi fiziksel özellikleri hakkında tatmin edici
bilgiler verdi. Artık, elektrona ait özelliklerin, Bohr'un dediği gibi sadece yörünge numarası ile
sınırlandırılmamış olduğu anlaşıldı. Schrödinger ile çalışmalarını birlikte yürüten Paul A.M. Dirac da
elektronların kendilerine özgü bir takım özelliklerinin olduğu buldu. Daha birçok fizikçinin, yaklaşık
aynı yıllarda yaptığı deneyler ve bunların sonuçları, atomun bu kompleks yapısının yeniden
yorumlanması gerektiğini vurguladı. Böylece, elektronun atom içindeki davranışlarını belirleyen
sayılar ve semboller kullanıldı. İşte, modern atom teorisinde, atomdaki elektronun durumunu net
olarak açıklamak için kullanılan bu sayılara kuantum sayıları denir. Kuantum sayıları dört tanedir ve
bunlar, 1. Baş kuantum sayısı (n) 2. Orbital kuantum sayısı (l) 3. Manyetik kuantum sayısı (ml) 4. Spin
kuantum sayısı (ms) Kuantum sayılarının ilk üçü, elektronun sahip olduğu enerji ve açısal momentum
gibi özelliklerini belirtir. Özellikle spin kuantum sayısı ise elektronun kendine özgü özelliğini ifade
eder.
1. Baş kuantum sayısı (n) Atom içerisindeki elektronun zamanının çoğunu geçirdiği bölgelere kabuk
denir. n ile gösterilen baş kuantum sayısı, kabukların pozitif tam sayılarla numaralandırılmasıdır (n =
1, 2, 3, 4, ...). Kabuklar .K, L, M, N, O, P...” harfleriyle gösterilmektedir.
Baş kuantum sayısı, çok elektronlu atomların kabuklarının yerinin tespitinde yetersiz kalmaktadır.
Ancak, hidrojen atomu gibi tek elektronlu atomlarda kabukların yeri kesin çizgilerle bellidir.
Erwin Schrödinger (1887-1961)
14
Karl Werner Heisenberg (1901-1976)
Baş kuantum sayısı (n) 1 2 3 4 5 6 ... Kabukları gösteren harfler K L M N O P ...
Bir elektronlu olan hidrojen atomu için kabukların yerleri şu şekilde tanımlanmıştır: Birinci kabuk (K
kabuğu), o çekirdekten a0 (0,53 A)uzaklığı civarında dar bir bölgedir. İkinci kabuk (L kabuğu), biraz
daha yayvan olup 4a0 ile 5,2a0 arasında , üçüncü kabuk (M kabuğu) ise iyice dağınık olup 9a0 ile
13,1a0 arasındadır.
Şekilde hidrojen atomu için kabukların yerleri sembolik olarak gösterilmiştir. Her ne kadar kabuk
kelimesi tam olarak bir küreyi ifade etmese de farklı baş kuantum sayılarına karşılık gelen kabuklar
birbirinden oldukça aralıklıdır. Birden fazla elektrona sahip atomlarda, elektronlar arası etkileşmeler
ve enerji seviyelerinin belirlenmesinde diğer kuantum sayıları daha etkin rol oynar. Bunun nedeni
elektron bulutlarının şeklinin elektronların açısal momentumundan etkilenmesidir. 2. Orbital
(yörüngesel) kuantum sayısı ( l ) Bohr atom modelinde, elektronun bulunduğu yerlere yörünge adı
verilirken kuantum mekaniğinde bu yörüngeler için orbital kavramı kullanılmaktadır. Orbital,
elektronun atom çekirdeği etrafında en fazla bulunduğu yerlerdir.Her orbitalin kendine özgü bir
elektron yoğunluğu ve enerjisi vardır. Orbital kuantum sayısı l ile gösterilir ve baş kuantum sayısı n’
ye bağlıdır. Orbital kuantum sayısı, n-1’e kadar bütün tam sayı değerlerini alabilmektedir (l= 0, 1, 2, 3,
... (n-1)). l değerleri alt kabukları ifade eder. Yani elektronlar kabuklarda farklı enerji seviyelerine
ayrılır. Alt kabuklar “s, p, d, f, g, h... ” harfleriyle gösterilmektedir.
Baş kuantum sayısı ile orbital kuantum sayısı arasındaki ilişkiyi birkaç örnekle açıklayalım; n = 1 (K
kabuğu) için
l = 0 1s orbitali (alt kabuğu), n = 2 (L kabuğu) için
kabuğu), l = 1 2p orbitali (alt kabuğu), n = 3 (M kabuğu) için
l = 0 2s orbitali (alt
l = 0 3s orbitali (alt kabuğu), l = 1
3p orbitali (alt kabuğu), l = 2 3d orbitali (alt kabuğu), n = 4 (N kabuğu) için
l = 0 4s orbitali (alt
kabuğu), l = 1 4p orbitali (alt kabuğu), l = 2 4d orbitali (alt kabuğu), l = 3 4f orbitali (alt kabuğu)
şeklindedir. Alt kabuklar için elektron bulutlarının şekli birbirinden farklılıklar göstermektedir.
Örneğin, yandaki şekildeki gibi hidrojen atomu için s alt kabuğu için elektron bulutunda her zaman
küresel simetri varken p, d ve f alt kabuklarının elektron bulutları kompleks şekillerden oluşmaktadır.
Bo
-1)) 2p şekline
dönüştürmüşlerdir. Bu ifadeden hareketle üç farklı çıkarımda bulunmuşlardır. Bunlar; 1.Açısal
momentum sıfır olabilir. 2. Her bir kabuktaki elektronların sahip olabileceği açısal momentum
değerleri birden fazla olabilir. 3. Farklı kabuklardaki elektronlar aynı açısal momentum değerinde
olabilir. 3. Manyetik kuantum sayısı ( ml ) Modern fizikçiler, dış manyetik alan etkisinde kalan
atomlar üzerinde deneyler yaparken aynı alt kabuktaki elektronların açısal momentumlarının
büyüklüklerinin aynı olmasına karşın bu vektörlerin yönlerinin farklı olduğunu keşfettiler. l =0
kabuğunda, açısal momentum sıfır (açısal momentum manyetik alana dik) olduğundan yönlenme
olmazken l =1’de 3, l =2’de 5 farklı yönlenme tespit ettiler. L açısal momentum vektörünün manyetik
alan yönündeki bileşenine manyetik kuantum sayısı adı verilir. Manyetik kuantum sayısı, ml ile
gösterilir ve orbital kuantum sayısı l ye bağlıdır. ml, (- l ) ile (+ l ) değerleri arasındadır. 2l+1 tane
değer alır. Manyetik alanın, z ekseni yönünde kabul edilmesi koşuluyla açısal momentum vektörünün
z eksenindeki bileşeni Lz = ml. h olur. Bu durumda; (ml = - l, ....., 0, ....., +l) arasında değerler alır.
Orbital kuantum sayısıyla manyetik kuantum sayısı arasındaki ilişkiyi ml ‘nin 2l+1 adet değer aldığı
ifadesiyle açıklayacak olursak; l = 0 için ml = 0 (1 tane s orbitali), l = 1 için ml = -1, 0, +1 (3 tane p
orbitali), l = 2 için ml = -2, -1, 0, +1, +2 (5 tane d orbitali), l = 3 için ml = -3, -2, -1, 0, +1, +2 , +3 (7
tane f orbitali) şeklindedir.
Orbital kuantum sayısı (l) 0 1 2 3 4 5 ... Alt kabukları gösteren harfler s p d f g h ...
15
ÖRNEK : Hidrojen atomunun l= 2 durumunda olduğunu varsayarak yörüngesel açısal momentumunu
(L) ve Lz değerlerini hesaplayınız.
4. Spin manyetik kuantum sayısı (ms) Otto Stern ve Walter Gerlach adlı iki fizikçi yaptıkları deneyle
çok elektronlu atomların spektrum analizlerinin o zamana kadarki teoriyle uyuşmadığını fark etmiş ve
elektronun kendine özgü bu hareketini açıklayamamışlardır. Daha sonra bu harekete spin (dönme)
hareketi adını vermişlerdir. 1929 yılında İngiliz fizikçi Paul Dirac, elektronların hareketini göreli
açıdan incelemiş. Dirac, kendi eksenleri etrafında dönmeseler bile elektronların böyle bir etkiyi
oluşturacak özelliğe sahip olduklarını söylemiştir. Spin, elektronun kütle, yük ve çevresel
koşullarından bağımsız özel bir hareketidir. Spin kuantum sayısıyla (ms) tanımlanır. Spin kuantum
sayısı, sadece 1/2 değerini alabilir. Elektron spini, şekilde görüldüğü gibi dış manyetik alan etkisinde
spin yukarı ve spin aşağı yönlenmeleri yapar. Spin kuantum sayısı, ms = + 1/2 ve ms = - 1/2
değerlerindedir.
Kuantum sayıları elektronun yerini ve bulunduğu yerdeki davranışını kolayca açıklayabilirken
elementlerdeki elektronların enerji seviyelerine göre yerleşimini ve kimyasal bağların nasıl molekül
oluşturduğunu açıklayamamaktadır. İsviçreli Fizikçi Wolfgang Pauli tarafından 1925 yılında ortaya
atılan bir görüşle kuantum sayılarıyla anlatılan kabuk ve alt kabuklarda ne kadar elektron
bulunabileceği belirlenmiştir. Bu sayede, elementlerin elektron sayıları net bir şekilde tespit edilebilir.
Pauli Dışarlama İlkesi olarak adlandırılan bu ilkeye göre, bir atomda iki elektron hiçbir zaman aynı
kuantum sayılarına sahip olamaz. Bu nedenle her bir orbitale ancak iki elektron yerleşebilir.
Elementlerin kimyasal özellikleri, bu durumla ilişkilidir. Pauli araştırmalarını kabuklara indirgeyerek
bir kabukta bulunabilecek maksimum elektron sayısının, n kabuk numarası olmak şartıyla, 2n2
formülüyle belirler. Kabuklarda bulunabilecek maksimum elektron sayıları; n = 1 (K kabuğu)
= 2.12 = 2 elektron, n = 2 (L kabuğu)
=18 elektron, n = 4 (N kabuğu)
2n2 = 2.22 = 8 elektron, n = 3 (M kabuğu)
2n2
2n2 = 2.32
2n2 = 2.42 = 32 elektron şeklindedir. Periyodik tabloda
elementlerin elektron dizilişleri bu kurala göre yapılmaktadır. Kuantum sayılarının birbiriyle ilişkisi
tabloda gösterilmiştir.