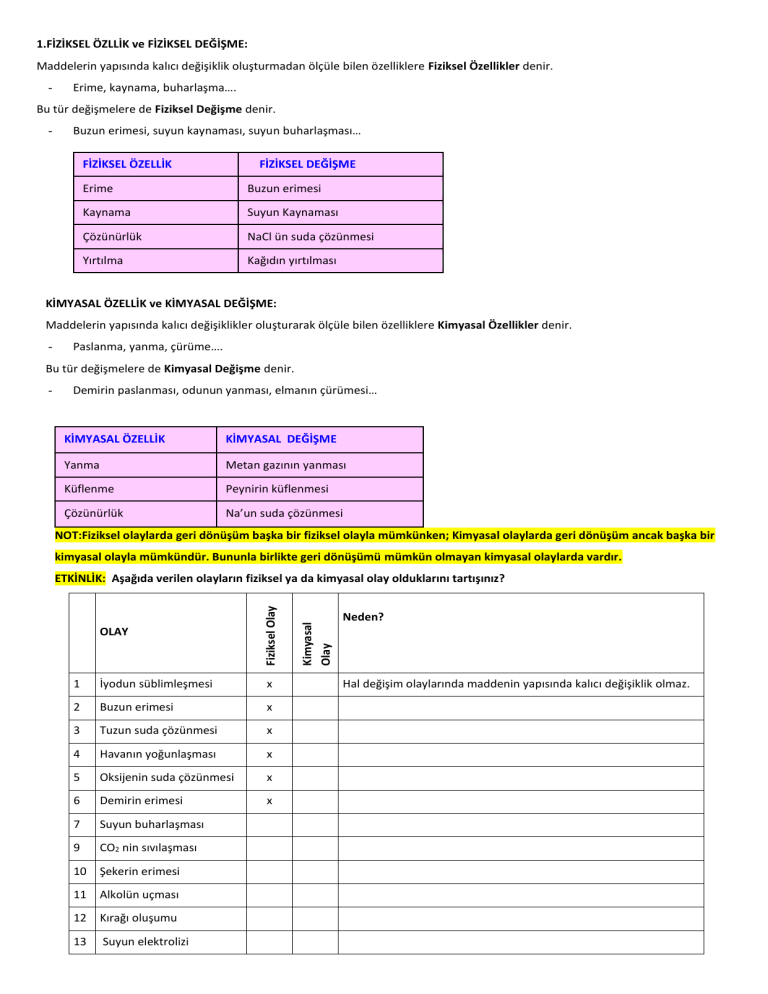
1.FİZİKSEL ÖZLLİK ve FİZİKSEL DEĞİŞME:
Maddelerin yapısında kalıcı değişiklik oluşturmadan ölçüle bilen özelliklere Fiziksel Özellikler denir.
-
Erime, kaynama, buharlaşma….
Bu tür değişmelere de Fiziksel Değişme denir.
-
Buzun erimesi, suyun kaynaması, suyun buharlaşması…
FİZİKSEL ÖZELLİK
FİZİKSEL DEĞİŞME
Erime
Buzun erimesi
Kaynama
Suyun Kaynaması
Çözünürlük
NaCl ün suda çözünmesi
Yırtılma
Kağıdın yırtılması
KİMYASAL ÖZELLİK ve KİMYASAL DEĞİŞME:
Maddelerin yapısında kalıcı değişiklikler oluşturarak ölçüle bilen özelliklere Kimyasal Özellikler denir.
-
Paslanma, yanma, çürüme….
Bu tür değişmelere de Kimyasal Değişme denir.
Demirin paslanması, odunun yanması, elmanın çürümesi…
KİMYASAL ÖZELLİK
KİMYASAL DEĞİŞME
Yanma
Metan gazının yanması
Küflenme
Peynirin küflenmesi
Çözünürlük
Na’un suda çözünmesi
NOT:Fiziksel olaylarda geri dönüşüm başka bir fiziksel olayla mümkünken; Kimyasal olaylarda geri dönüşüm ancak başka bir
kimyasal olayla mümkündür. Bununla birlikte geri dönüşümü mümkün olmayan kimyasal olaylarda vardır.
OLAY
1
İyodun süblimleşmesi
x
2
Buzun erimesi
x
3
Tuzun suda çözünmesi
x
4
Havanın yoğunlaşması
x
5
Oksijenin suda çözünmesi
x
6
Demirin erimesi
x
7
Suyun buharlaşması
9
CO2 nin sıvılaşması
10
Şekerin erimesi
11
Alkolün uçması
12
Kırağı oluşumu
13
Suyun elektrolizi
Kimyasal
Olay
ETKİNLİK: Aşağıda verilen olayların fiziksel ya da kimyasal olay olduklarını tartışınız?
Fiziksel Olay
-
Neden?
Hal değişim olaylarında maddenin yapısında kalıcı değişiklik olmaz.
14
Camın buğulanması
15
Yağmur oluşumu
16
Mumun erimesi
18
Çiğ oluşumu
19
Alkolün suda çözünmesi
20
Çimentonun donması
21
Camın kırılması
22
Naftalinin süblimleşmesi
23
Gümüşün havada
kararması
24
Demirin asitte çözünmesi
25
Sütün ekşimesi
26
Sütten yoğurt eldesi
27
Na metalinin suda
çözünmesi
28
Baraj suyundan içme suyu
eldesi
29
Yoğurttan ayran eldesi
30
Üzümden şarap eldesi
31
Ekmeğin küflenmesi
33
Şeker pancarından şeker
eldesi
Yağlı boyanın kuruması
34
Odunun yanması
32
2. KİMYASAL TEPKİMELER:
Kimyasal olayların denklemlerle ifade edilmesine Kimyasal Denklemler denir.
ÖR: Bir miktar C ile yeteri kadar O2 tepkimeye girerek karbon dioksit oluşturur, ifadesini kısaca;
C(k) + O2(g) → CO2(g)
ÖR: Bir miktar CH4 (metan) ile yeteri kadar O2 tepkimeye girerek karbon dioksit ve su oluşturur, ifadesini kısaca;
C(k) + O2(g) → CO2(g)
Şeklinde denklemlerle ifade edilirler.
Denklemlerde;
Girenler( reaktifler) → Çıkanlar (ürünler)
ÖRNEK:
C(k)
+
O2(g)
Girenler, Reaktifler
→
CO2(g)
Çıkanlar, Ürünler
Kimyasal tepkimelerde, tepkimeye giren;
Atomların Cinsi Atomların Sayısı Toplam Kütle Toplam Elektron Sayısı… her zaman korunur.
Kimyasal tepkimelerde, tepkimeye giren;
Toplam Mol Sayısı (Mol kavramını şimdilik bilmiyoruz)
Toplam Molekül Sayısı Toplam Hacim Toplam Madde Sayısı Toplam Madde Türü ... her zaman korunmayabilir.
N2(g)
+
3 H2(g)
→
2NH3(g)
1 tane N2
+
3 tane H2
→
2 tane NH3 + ısı
2 tane N
+
6 tane H
→
2 taneN + 6 tane H
1 Mol N2
+
3 Mol H2
→
2 Mol NH3
V lirte N2
+
3V lirte H2
→
2V lirte NH3
28 g
+
6g
→
2*17 = 34 g
CaCO3 (k)
→
CaO (k)
+
CO2(g)
1 tane CaCO3
→
1 tane CaO
+
1 tane CO2
1 mol CaCO3
→
1 mol CaO
+
1 mol CO2
100 g CaCO3
→
56 g CaO
+
44 g CO2
-
→
-
+
V litre
BASİT YOLLARLA DENKLEM DENKLEŞTİRME:
Bunun için;
1. Denklem üzerinde en karmaşık maddenin katsayısı 1 alınır.
2. “Kimyasal tepkimelerde atomların sayısı ve cinsi korunur” ilkesi gereği diğer maddeler in katsayıları, bu madde temel
alınarak denkleştirilir.
Denkleştirme esnasında; Önce metallerin, sonra ametallerin, sonra H’in, en son olarak ta O’nin denkliği kontrol edilir.
Örnek:
Ca +H2SO4
→
Ca2SO4 + H2
en karmaşık olan Ca2SO4 ün kat sayısı 1 alınarak işe başlanır. Ca +H2SO4 → 1 Ca2SO4 + H2
Önce metaller denkleştirilir.
2Ca +H2SO4
→ 1 Ca2SO4 + H2
Sonra ametaller denkleştirilir.
2Ca +1H2SO4
→ 1 Ca2SO4 + H2
En son hidrojen denkleştirilir.
2Ca +1H2SO4
→ 1 Ca2SO4 +1 H2
ETKİNLİK-1: Aşağıda verilen denklemleri denkleştiriniz?
N2(g) + H2(g) → NH3(g)
H2(g) + O2(g)
N2O4(g)
Fe(k) + O2(g)
→
NO2(g)
C2H4 + O2
→ CO2 + H2O
C6H12O6 + O2
Li +
H2O
Ca +
H2O →
→
→
CO2 +
LiOH +
H2
Ca(OH)2 + H2
C2H5OH +
H2 O
CS2 +
Na +
→
→
→
O2
→
H2O →
Fe + H2O
→
HCl
NH4Cl
CaCO3(k)
1. YANMA TEPKİMELERİ:
→
CO2 + SO2
H2
Fe(OH)2 + H2
H3PO4 + NaOH
→
CO2 + H2O
NaOH +
Na2SO4 + H2O
NH3
Fe2O3(k)
O2
H2SO4 + NaOH →
+
H2O(s)
→
Na3PO4 + H2O
CaO(k) + CO2(g)
Maddelerin O2 ile tepkimesine denir.
Yanma olayı için; yanıcı madde, hava, tutuşma sıcaklığı gerekmektedir. Bu 3 faktörden biri tükenirse yanma olayı sona erer.
Yanma tepkimeleri genelde hızlı gerçekleşir. Ancak demirin paslanması gibi bazı yanma olayları yavaş gerçekleşir. Yavaş yanmalara
genel olarak paslanma denir.
Yanmayan ve havadan ağır maddeler yangın söndürücü olarak kullanılır (CO 2)
C + O2
→
CO2
S + O2
→
SO2
N + O2
→
NO2 (Yüksek sıcaklıkta hızlı gerçekleşir)
CH4 + 2O2
→
CO2 + 2H2O
C3H8 + 5O2
→
3CO2 + 4H2O
C2H4 + 3O2
→
2CO2 + 2H2O
C6H12O6 + 6O2 →
6CO2 + 6H2O
CS2 + 2O2
→
CO2 + 2SO2
4Fe + 3O2
→
2Fe2O3
2. ÇÖZÜNME VE ÇÖKELME TEPKİMELERİ
“ Farklı iki çözelti karıştırıldığında, farklı çözeltilerdeki katyon ve anyonlar bir araya gelerek çökelti oluştururlar.”
ÖRNEK:
2KI(aq) + Pb (NO3)2 →
PbI2(k) +KNO3(aq)
Renksiz iki çözelti karıştırıldığında, sarı renkli PbI2 çöker. KNO3 suda çözündüğünden çözeltide kalır. Bu tepkime PbI2 yi elde etmek
için yapıldığından dolayı, PbI2 süzülerek çözeltiden ayrılır.
ÖRNEK:
NaCl(aq) + AgNO3(aq)
+
-
+
Na Cl ve Ag
NO3-
→ AgCl (k) + NaNO3(aq)
karıştırıldığında, beyaz renkli AgCl çöker. NaNO3 suda çözündüğünden çözeltide kalır. Bu tepkime AgCl ü elde
etmek için yapıldığından dolayı, ACl süzülerek çözeltiden ayrılır.
3. ASİT-BAZ TEPKİMELERİ:
ASİTLER
Suda çözündüğünde ortama H+ iyonu salabilen yada
ortamın H+ derişimini artıran maddelere ASİT denir.
ÖZELLİKLERİ:
1. Tatları ekşidir.
2. Turnusol kağıdının rengini kırmızıya çevirirler.
3. Suda iyonlaşarak çözünürler.
4. Sulu çözeltileri elektrik akımını iletir.
5. Aktif metallerle tepkimeye girerek H2 gazı açığa çıkartırlar.
6. Bazlarla tepkimeye girerek Tuz+Su oluştururlar.
BAZI KUVVETLİ ASİTLER
HCl :Klorik asit
HNO3 : Nitrik asit
HBr :Bromik asit
H2SO4 : Sülfirik asid
HI :İyodik asit
HClO4 : Klorat asiti
BAZI ZAYIF ASİTLER
HF :Florik asit
H2CO3 :Karbonik asit
H2S :Sülfür asiti
HCN :Siyanür asiti CH3COOH :Asetik Asit
BAZLAR: Suda çözündüğünde ortama OH- iyonu salabilen yada ortamın OH- derişimini artıran maddelere BAZ denir.
ÖZELLİKLERİ:
1.Tatları acıdır.
2.Turnusol kağıdının rengini maviye çevirirler.
3.Suda iyonlaşarak çözünürler.
4.Sulu çözeltileri elektrik akımını iletir.
5.Anfoter metallerle tepkimeye girerek H2 gazı açığa çıkartırlar.
6.Asitlerle tepkimeye girerek Tuz+Su oluştururlar.
BAZI KUVVETLİ BAZLAR
LiOH
: Lidyum Hidroksit
NaOH
: Sodyum Hidroksit
KOH
: Potasyum Hidroksit
ASİT VE BAZLARIN AYIRACI
1.
Turnusol
kağıdı:
Asitler
turnusol kağıdının rengini
kırmızıya, bazlar ise maviye
çevirirler. Tuzlar ise turnusol
kağıdının
rengini
değiştirmezler.
2.
Metil
oranj
baoyası:
Asitlerde kırmızı, bazlarda
sarı, nötr ortamda ise
portakal rengini alırlar.
BAZI ZAYIF BAZLAR
AgOH
: Gümüş Hidroksit
Al(OH)3
: Alemünyum Hidroksit
NH3
: Amonyak
TUZLAR : Başlıca katyon ve anyon bileşiklerine TUZ denir.
ÖZELLİKLERİ:
1.Başlıca katyon-Anyon bileşikleridir. (K+ A-)
2.Katyon-Anyon arasında iyonik bağ bulunur.
3. Suda Katyon ve Anyonlarına ayrışarak çözünürler.
4. Sulu çözeltileri, azda olsa elektrik akımını iletir.
TUZ ÇEŞİTLERİ
ASİDİK TUZ:
Kuvvetli asitlerle, zayıf bazın tuzuna denir.
BAZI ASİTLERİN BULUNDUĞU
YERLER
1.
2.
3.
4.
5.
6.
7.
Ekşi elma
:Malik asit
Limon
:Sitrik asit
Isırgan otu :Formik asit
Sirke
:Asetik asit
Akülerde
:Sülfirik asit
Midede
:Klorik asit
Bal arısı salgısı: Asitiik
ASİT- BAZ TEPKİMELERİ:
Asit veya asidik özelliğe sahip olan maddelerle, baz veya bazik özelliğe sahip maddelerle tepkime verirler. Bu tür tepkimelere
genel anlam da Asit - Baz tepkimesi de denir.
Asitler, bazlarla tepkimeye girerek tuz ve su oluştururlar. Ancak baz NH 3 ise, su meydana gelmez, sadece tuz oluşur.
Tuzlar, bazın katyonu ile asitin anyonundan meydana gelir.
HCl(suda) + NaOH(suda) → NaCl(suda) +H2O(S)
asit
baz
Tuz
Su
Burada; Na+ ve Cl- iyonları birleşerek tuz oluştururken, H+ ve OH- iyonları da nötürleşerek su oluştururlar. Bu tür tepkimelere
asit-baz tepkimeleriyle birlikte nötürleşme tepkimeleri de denir.
Ancak her asit baz tepkimesi nötürleşme tepkimesi değildir.
HCl(suda) + NH3(suda) → NH4Cl(suda)
asit
baz
Tuz
NH4Cl çözeltisi bazik özellik gösterdiği için ortam nötr olmaz. Bu asit baz tepkimesi bu sebeple nötürleşme tepkimesi değildir.
Asit-baz tepkimeleri ;
1) Kuvvetli asit ile kuvvetli bazın tepkimesi, nötrleşme tepkimesi olacağından, pH değeri 7 olur.
2) Kuvvetli asit ile zayıf bazın tepkimesi sonucu pH değeri 7 den küçük olur.
3) Zayıf asit ile kuvvetli bazın tepkimesi sonucunda pH değeri 7 den büyük olur.
NOT:
Asitler; Na,K,Ca,Fe,Zn,Pb,Al….gibi metalleri ve karbonatlı bileşikleri çözer. Ancak Cu,Hg,ag,Pt,Au gibi metalleri
çözemez.
Ca + H2SO4
→
Ca SO4+ H2
Fe + HNO3
→
Fe(NO3)3 + H2
Mg +H3PO4
→
Mg3(PO4)2+ H2
Pb+ H2SO4
→
PbSO4+ H2
CaCO3 + HCl
→
CaCl2 +CO2 + H2O
Hg + HCl
→
Tep.Olmaz
Hg + H2CO3
→
Tep.Olmaz
Hg + H2SO3
→
Tep.Olmaz
Hg + H2SO4
→
Tep.Olmaz
Hg + H2SO4
→
HgSO4 + SO2+ H2O
Hg + HNO3
→
Hg (NO3)2 + NO+ H2O
Hg + HNO3
→
Hg (NO3)2 + NO2+ H2O
Pt + HNO3
→
Tep.Olmaz
Au+ HNO3
→
Tep.Olmaz
NOT: Bazlar ise ancak; Zn,Al,Sn,Pb,Cr…gibi anfoter matlleri çözerler.
Zn +KOH
→
K2ZnO2 + H2
Al +KOH
→
K3AlO3 + H2
NOT:Tepkimeler denkleştirilecektir.Lütfen denkleştiriniz.
4.REDOKS TEPKİMALERİ:
Başlıca indirgenme ve yükseltgenme tepkimelerine denir.
Elektron veren madde, verdiği elektron sayısı kadar + yükle yüklenir. Yükseltgenir. İndirgendir.
Elektron alan madde, aldığı elektron sayısı kadar - yükle yüklenir. İndirgenir. Yükseltgendir
2Na + Cl2
→
2NaCl
Görüldüğü gibi Na + Cl2 tepkimesinde Na elektron vererek + yükle yüklenmiş ve yükseltgenmişir.
Klor ise elektron alarak – yükle yüklenmiş ve indirgenmiştir.
Dolayısıyla Cl yükseltgen , Na indirgendir.
Örnek: Aşağıda verilen tepkimede; elektron alan, elektron veren, indirgenen ve yükseltgenen maddeleri bulunuz?
Cu + H2SO4
→ CuSO4 + SO2+H2O
Çözüm:
Cu0 + H2S+6O4 →
Elektron veren: Cu0
Elektron alan: S+6
İndirgenen: H2SO4
Yükseltgenen: Cu0
Cu+2SO4+ S+4O2+H2O
Örnek:
Fe0 + O20 → Fe+2O-2
Yukarıda verilen tepkimede; elektron alan, elektron veren, indirgenen ve yükseltgenen maddeleri bulunuz?
Çözüm:
Fe0 + O2 0 → Fe+2O-2
Elektron veren: Fe0
Elektron alan: O20
İndirgenen: O20
Yükseltgenen:Fe0
Örnek:
H2O2(aq) +2Fe+2(aq) +2H+
→ 2H2O(s) + 2Fe +3
Yukarıda verilen tepkimede; elektron alan, elektron veren, indirgenen ve yükseltgenen maddeleri bulunuz?
Çözüm:
H2O2-1 (aq) +2Fe+2(aq) +2H+
→ 2H2O-2(s) + 2Fe +3
Elektron veren: Fe+2
Elektron alan: O2-1
İndirgenen: O2-1
Yükseltgenen: Fe+2
ETKİNLİK: Aşağıda verilen asit-baz tepkimelerinde oluşacak ürünü yazınız?
TEPKİME
HCl + NaOH
H2SO4+ NaOH
HNO3+ KOH
H2S+ KOH
H2CO3+ NaOH
HCN+ KOH
CH3COOH+ NaOH
HBr+ Mg(OH)2
H2SO4+ Ca(OH)2
HNO3+ Mg(OH)2
H2CO3+ Ba(OH)2
CH3COOH+ Ca(OH)2
HI+ Al(OH)3
H2SO4+ Ba(OH)2
ÜRÜN
HNO3+ Al(OH)3
HF+ Al(OH)3
HCl+ NH3
H2SO4+ NH3
HNO3+ NH3
HClO4+ NaOH
HIO+ KOH
HBrO2+ NH3
ETKİNLİK: Aşağıda verilen etkinlikleri irdeleyiniz?
TEPKİME
İNDİRGEN
YÜKSELTGEN
İNDİRGENEN
H2 + ½ O2 → H2O
CaO2 →
CaO + ½ O2
CuO →
Cu + ½ O2
N2(g) + 3H2(g)
→ 2 NH3(g)
2 Fe(k) + 3/2 O2(g) → Fe2O3(k)
KCl (k) + 3/2 O2(g) → KClO3(k)
Cu
+
Ca +
Hg
→
H2SO4
H2SO4
+
H2SO4
CuSO4 + SO2 + H2O
→
CaSO4 + H2
→
HgSO4 + SO2 + H2O
→
2 CO2 + 2 H2O
C6H12O6 + 6 O2 →
6 CO2 + 6 H2O
C2H5OH + 7/2O2 →
2 CO2 + 3 H2O
C2H4 +
3 O2
CS2 + 2 O2
→
CO2 + 2 SO2
ETKİNLİK: Aşağıda verilen tepkimeleri tamamlayıp, indirgen ve yükseltgen maddeleri gösteriniz?
YÜKSELTGENEN
TEST – 1
1.
I. Yumurtanın pişmesi
Na(k) ‘nın suda çözünmesi
II. Bakır telin elektriği iletmesi
II. NaCl(k) ‘nin suda çözünmesi
III. Peynirin küflenmesi
III. NaCl(aq) elektrolizi.
Yukarıdaki olaylardan hangileri kimyasaldır?
Yukarıdaki olayların hangilerinde maddenin yalnız
A) Yalnız I
fiziksel özelliği değişmiştir?
B) Yalnız II
D) I ve II
2.
6 I.
C) Yalnız III
E) II ve III
A) Yalnız I
B) Yalnız II
D) I ve II
E) I, II ve III
I. Elmanın çürümesi
II. CO2 gazının kireç suyunu bulandırması
7I. Çimentonun donması
III. Şeker pancarından şeker eld
II. Camın kırılması
Yukarıdaki olaylardan hangileri kimyasaldır?
A) Yalnız I
B) Yalnız II
D) I ve II
3.
C) Yalnız III
III. Naftalinin süblimleşmesi
C) Yalnız III
E) II ve III
Yukarıdaki olayların hangilerinde kimyasal değişme
I. Sütün ekşimesi
olmuştur?
II. İyodun süblimleşmesi
III. Yemek tuzunun elektrolizi
A) Yalnız I
Yukarıdaki olayların hangilerinde maddenin yalnız
B) Yalnız II
D) I ve II
C) Yalnız III
E) I, II ve III
fiziksel özelliği değişmiştir?
A) Yalnız I
B) Yalnız II
D) I ve II
4.
C) Yalnız III
E) I, II ve III
8
I.
Oksijenin suda çözünmesi
I. Mumun erimesi
II.
Demirin asitte çözünmesi
II. Mumun yanması
III.
Tuzun suda çözünmesi
III. Mumun ezilmesi
Yukarıdaki olayların hangilerinde maddenin sadece
Yukarıdaki olayların hangilerinde maddenin yalnız
kimyasal özelliği değişmiştir?
fiziksel özelliği değişmiştir?
A) Yalnız I
B) Yalnız II
D) I ve II
C) Yalnız III
E) I, II ve III
A) Yalnız I
B) Yalnız II
D) I ve II
9.
C) Yalnız III
E) I, II ve III
I. Na metalinin suda çözünmesi
II. Baraj suyundan içme suyu eldesi
III. Yoğurttan ayran eldesi
5.
I. Sütün ekşimesi
Yukarıdaki olayların hangilerinde maddenin kimyasal
II. Mumun erimesi
özelliği değişmiştir?
III. Sütten yoğurt eldesi
Yukarıdaki olayların hangilerinde maddenin kimyasal
özelliği değişmiştir?
A) Yalnız I
B) Yalnız II
D) I ve II
B) Yalnız II
D) I ve II
A) Yalnız I
E) I, II ve III
C) Yalnız III
E) I, II ve III
C) Yalnız III
10.
I. Üzümden şarap eldesi
II. H2 ve O2 ile tepkimesi
II. Suyun elektrolizi
III. Na ‘nın Cl2 ile tepkimesi
III. Suyun donması
Yukarıdaki olayların hangilerinde tepkimenin geri
Yukarıdaki olayların hangilerinde maddenin kimyasal
dönüşümü mümkündür?
özelliği değişmiştir?
A) Yalnız I
A) Yalnız I
B) Yalnız II
D) I ve II
11.
C) Yalnız III
B) Yalnız II
D) I ve II
C) Yalnız III
E) II ve III
E) I, II ve III
I. Ekmeğin küflenmesi
II. Şeker pancarından şeker eldesi
14. Aşağıdaki olaylardan hangisinde kimyasal değişme
III. Yağlı boyanın kuruması
olmuştur?
Yukarıdaki olayların hangilerinde maddenin kimyasal
özelliği değişmiştir?
A) Naftalinin süblimleşmesi
B) Kâğıdın yırtılması
A) Yalnız I
B) Yalnız II
D) I ve II
C) Yalnız III
C) Odunun talaş hale getirilmesi
E) I, II ve III
D) Çözeltilerin elektrik akımını iletmesi
E) Suyun donması.
12.
I. Erime
II. Yanma
III. Kâğıdın yanması
15. Aşağıdaki olaylardan hangisinde fiziksel değişme
olmuştur?
Yukarıdaki olayların hangileri kimyasal olaydır?
A) Yalnız I
B) Yalnız II
D) I ve II
C) Yalnız III
A) Kırağı oluşması
E) I, II ve III
B) Suyun oluşumu
C) Suyun elektrolizi
D) Sodyumun suda çözünmesi
E) Ekmeğin küflenmesi
13.
I. C ’nin yanması
TEST – 2
1. Aşağıda verilen ifadelerden hangileri asitler için
doğrudur?
2. H2SO4 için;
I.
Aktif metallerle tepkimeye girer.
I.
Tatları ekşidir.
II.
Bazlarla tuzları oluşturur.
II.
Suda iyonlaşarak çözünürler.
III.
Pasif metallerle tepkimeye girerek SO2 gazı
III.
Suda çözündüklerinde H+ iyonu salarlar.
açığa çıkartır.
yukarıda verilen bilgilerden hangileri doğrudur?
A) Yalnız I
B) Yalnız II
D) I ve III
E) I, II ve III
C) I ve II
A) Yalnız I
B) Yalnız II
D) I ve III
E) I, II ve III
C) I ve II
7. Aşağıdaki ifadelerden hangisi tuzlara ait değildir?
3.
I. Turnusol kâğıdına etki ederler.
A)
Kristal yapıdadır.
II. Sulu çözeltileri elektrolittir.
B)
Katyon anyon bileşikleridir.
III. Amfoter metallere etki ederler.
C)
Asit baz tepkimesinin ürünüdür.
Yukarıdaki ifadelerden hangileri asit ve bazların ortak
D)
Çözeltileri iletkendir
özelliklerindendir?
E)
Turnusol kâğıdına etki ederler.
A) Yalnız I
B) Yalnız II
D) I ve III
C) I ve II
E) I, II ve III
8. X + 3 O2 → 2 CO2 + 3 H2O
4.
I. CH3COOH
II. HNO3
III. C2H5OH
Denklem denkleştirildiğinde X bileşiği aşağıdakiler-
Yukarıdaki maddelerden hangileri turnusol kağıdına
den hangisidir?
etki eder ?
A) CH4
B) C2H4
D) C2H6O
A) Yalnız I
B) yalnız II
C) C2H4O
E) C6H12O6
C) I ve II
9. X + ½ O2 → Y
D) I ve III
Y + H2O
E) I, II ve III
→ T
T + 2 NaOH → Na2SO4 + H2O
5.
I. Tatları acıdır.
Yukarıda verilen kademeli tepkimede X maddesi
II. Turnusol kâğıdına etki ederler.
aşağıdakilerden hangisidir?
III. Tüm aktif metallerle tepkimeye girerler.
Yukarıdaki
ifadelerden
hangileri
yalnız
bazların
A) S
B) S2
C) SO2
D) SO3 E) H2SO3
özelliklerindendir?
10. Aşağıdaki olaylardan hangisinde yalnızca fiziksel
B) Yalnız II
D) I ve III
C) I ve II
değişme olmuştur?
E) I, II ve III
I.
6.
+
NaCl(k) → Na (aq) +
..
...
...
..
A) Yalnız I
N N
I. NH3
II. H2O(k) → H2O(s)
II. HCOOH
III. Na(k) + H2O → NaOH + ½ H2
III. C2H5OH
Yukarıdaki kaplardan hangileri turnusol kâğıdının
rengini maviye çevirir?
A) Yalnız I
B) Yalnız II
D) I ve III
B) Yalnız II
D) I ve III
A) Yalnız I
E) I, II ve III
C) I ve II
E) II ve III
C) Yalnız III
1.
Aşağıdakilerden
hangisi
arkeolojik
tarihlendirilmiş
ve
eski
çağlarda
maddelerdendir?
kayıtlarla
üretilen
A)Yalnız I
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
A) Otomobil
6.
B) Bilgisayar
C) Mumya
I. İnsan ruhunun saflaştırılması için çalıştılar.
D) Kurşun kalem
II. Maddelerin dönüşüm yapa yapa en saf madde
olan altına dönüşebileceğine inanıyorlardı.
E)
2.
Silgi
Aşağıdakilerden hangisi eski çağlarda yapılan işlerden
biri değildir?
A) Metallerin eldesi
III. Çalışmalarında
kullandılar.
belli
kimyasal
Pratik simyacılarla
ifadelerden hangileri doğrudur?
B) Madencilik
A)Yalnız I
C) Mayalama
ilgili
B)Yalnız II
D) I ve II
yöntemler
olarak
verilen
C)Yalnız III
E)I, II ve III
D) Dericilik
E)
3.
Elektroliz
Aşağıdakilerden hangisi eski
maddelerden biri değildir?
çağlarda
üretilen
7.
A) Cam
I. İnsanın içine yönelmesi ile, saflaşa bileceklerine
inandılar.
B) Değerli Taşlar
II. İnsanların içine yönelmesiyle ölümsüzlük iksirini
bulacaklarına inanırlar.
C) Boyalar
D) Kozmetikler
E)
4.
III. Ölüme çare olan iksiri keşfettiler.
Aspirin
Kimyanın gelişimini kısaca;
Ezoterik(mistik) simyacılarla
ifadelerden hangileri doğrudur?
A) Simya Çağı
A)Yalnız I
B) “İatro” Simya Çağı
C) Aristo kimya çağı
D)
“Flijiston“ Simya Çağı
E)
“Nicel” Kimya Çağı
D) I ve II
ilgili
B)Yalnız II
olarak
verilen
C)Yalnız III
E)I, II ve III
8.
I.
Simyacının işinin sadece ilaç üretmek olduğunu
iddia ettiler.
II. Çalışmalarında belli bilimsel yöntemleri ilk defa
kullandılar.
5.
I. Simya ; bir tür saflaştırma sanatıdır.
II. Simya ile uğraşan insanlara, simyacı (alşimist)
denir.
III. Simya bir bilim dalıdır.
Verilen ifadelerden hangileri doğrudur?
III.
Eski simyacıların element kavramını çürüttüler.
İatro simyacılarla ilgili olarak verilen ifadelerden
hangileri doğrudur?
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
9.
I. Simyacının işinin yanma
olduğunu iddia ettiler.
olayını
açıklamak
13.
I. Maddenin tanecikler
görüsünü savundu.
II. Demir, bakır gibi maddeleri sentezlediler.
II.
III. Çalışmalarında bilimsel yöntemleri kullandılar.
Flijiston simyacılarla ilgili olarak verilen ifadelerden
hangileri doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
C)Yalnız III
boşluktan
E)I, II ve III
oluştuğu
Uzayda
tanecikler
ne
kadar
sıkışık
kümelenirlerse, oluşturdukları maddenin de o
kadar yoğun olacağını hava, su ve toprak
örnekleriyle ortaya koymuştur.
III. Simyacıların değerli metalleri
uğraşlarına karşı çıkmadı.
elde
etme
El Razi ile ilgili olarak verilen bilgilerden hangileri
doğrudur?
10.
I. Deney ve gözleme dayalı çalışmalar yaptılar.
A)Yalnız I
II. Çalışmalarında belli bilimsel metotları kullandılar.
B)Yalnız II
D) I ve II
Nicel kimyacılarla ilgili olarak verilen ifadelerden
hangileri doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
TEST-2
1.
C)Yalnız III
E)I, II ve III
Aşağıdaki ifadelerden hangisi doğrudur?
I.
Çeşitli yollarla sarartılan maddeler altın olamaz.
II.
Çeşitli yollarla sarartılan maddeler gümüş olamaz.
III.
Boyamayla hiçbir maddenin özü değişmez.
Yukarıdaki ifadeler hangi simyacıya aittir.
A) Bilinen en eski simyacı; Empedokles’tir.
A)Aristo
B) Simyacılar birtür filozoflardır.
B)Epikür C)İbn-i Hayyan
D) El Razi
C) Simya bir bilim dalıdır.
C)Yalnız III
E)I, II ve III
III. Çalışmalarını kayıt altına alıp gelecek kuşaklara
aktardılar.
11.
ve
E)İbni Sina
2.
D) Simya bir tür saflaştırma sanatıdır.
E) Simyacılar zamanlarının bilge insanlarıdır.
I. Maddenin atomlu yapıda
küçümseyip karşı çıktılar.
olduğu
görüşünü
II. Maddenin “yüksek aklın” görüntüleri olduğunu
savundular.
12.
III. Evrende her şey, topraktan doğup toprağa dönerdi.
I. Buğdayın bölünerek una dönüşmesi,
II. Büyük kum taneciklerinin ufalanmasını,
III. En saf madde olan altının bile atomlardan
oluşması
Demokrit’i “maddelerin bölünemeyen en küçük
birimi olmalıdır,” fikrine verilen örneklerden
hangileri götürmüş olabilir?
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
Aristo ve onun izleyicilerine göre verilen bilgilerden
hangileri doğrudur?
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
3. Aristo’ya göre maddelerin donüşüm zinciri aşağda
verilenlerden hangisi gibidir?
II. Metauruji, cam,
III.Boya, toprak, hava, vakum
A) Toprak → hava→su→ ateş ve yeniden toprak
Verilen konuların hangilerinde çalışmalar yapıldı.
B) Toprak →ateş→hava→su ve yeniden toprak
A)Yalnız I
C) Toprak →su →ateş→hava ve yeniden toprak
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
D) Su →Toprak →ateş→hava ve yeniden toprak
E) Toprak →ateş→hava→su ve yeniden çamur
8.
4.
I.
İatro simya çağı, uygulanabilir kimyanın
başlangıcını oluşturdu,
I. Demokrit’in görüşlerini, antik çağın en büyük iki devi
Platon ve Aristo’ya karşı ateşli bir biçimde savundu,
II. İatro simyacılardan Robert Boyle sistematik
çalışmaların temellerini atan adam olarak bilinir.
II. Evrenin atomlar ve onların hareketinden oluştuğunu
savundu,
III. İatro simyacılar Aristo’nun fikirlerine karşı çıkmaya
cesaret edememişlerdir.
III. Atomun proton ve nötronlardan oluştunu savundu.
Epikür’e göre verilen bilgilerden hangileri doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
Verilen ifadelerden hangilerinde doğrudur?
C)Yalnız III
A)Yalnız I
E)I, II ve III
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
5.
I. Ebu Musa Cabir ibn-i Hayyan ,
II. Ebubekir Muhammed bin Zekeriya el Razi,
III. İbni Sina, Abdurrahman el Hazeni
Yukarıdakilerden hangileri İslam dünyasından önemli
simyacılardandır?
9.
I. Metaluruji üzerinde yoğunlaşan çalışmalar
A)Yalnız I
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
6.
III. Yanma olayının çözülme isteği
Yukarıdaki olaylardan hangileri filojiston simyasının
doğmasına sebep olmuştur?
I. Albertus Magnus (Büyük Albert),
II. Roger Bacon
A)Yalnız I
III.Ainstain
D) I ve II
Yukarıdakilerden hangileri batı dünyasından önemli
simyacılardandır?
A)Yalnız I
B)Yalnız II
D) I ve II
7.
II. Metallerin paslanması,
İatro simya döneminde,
I. Bazı ilaçların sentezi,
C)Yalnız III
E)I, II ve III
B)Yalnız II
C)Yalnız III
E)I, II ve III
10.
TEST-3
I. Yana bilen maddeler filojiston (alev ilkesi) maddesi
içeriyor.,
1.
Aşağıdaki olaylardan hangisi
başlangıcıyla ilgili değildir?
Nicel
Kimyanın
A) Bilimsel anlamda kimyanın temelleri 18.yüz yılın
başlarında atılmıştır,
II. Yanma sırasında filojiston maddeyi terk ediyordu.
III. Flojistonlu maddeler iyi yanıyor,
Flojiston kuramına göre
hangilerinde doğrudur?
A)Yalnız I
D) I ve II
verilen
B)Yalnız II
B) Özellikle gazların bir kaos yada bir element
olmadığının anlaşılması,
ifadelerden
C) Yanma olayının filojiston kavramıyla açıklanamıyor
olması,
C)Yalnız III
E)I, II ve III
D) Damıtma işleminin bilimsel tekniklerle yapılıyor
olması,
E) Nötronun keşfi
11.
I. Filojiston kuramı düşüncenin temelleri çok eskilere
dayanıyordu,
II.
Maddelerin ruhu, filojiston denen bu maddeydi,
III. Yandığında madde ölüyor, ruh alev şeklinde
ayrılıyordu,
Flojiston kuramına göre
hangilerinde doğrudur?
A)Yalnız I
verilen
B)Yalnız II
2.
ifadelerden
Aristo’ya göre maddeyi özellikleri belirler. Bu özellikler
aşağıdakilerden hangisi değildir?
A) Kuru
B) Islak,
C)Yalnız III
C) Ilık
D) I ve II
E)I, II ve III
D) Soğuk,
E) Sıcak,
12.
I. Joseph Priestly, cıva II oksitin ısıtılmasıyla bir tür
havanın (gazın) kolayca ayrıldığını görmüştür.
II. Aslınada bir Filogistonist olan Joseph Priestly,
oksijeni bilmeyerek bulmasıyla, ekolünün temellerine
dinamiti koymuş oldu,
III. Oksijen gazının elde edilmesi
sürat kazandırmış.
3.
Aristo’ya göre maddeyi özellikleri belirler. Buna göre
aşağıdaki ifadelerden hanisi yanlıştır?
A) Soğuk ve ıslak: (su) sıvı,
kimya bilimine bir
B) Soğuk ve kuru: (toprak) katı,
C) Kuru ve sıcak: (oksijen) gaz
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
D) Islak ve sıcak: (hava) gaz,
E) Kuru ve sıcak: (ateş) ateşi
4.
Yakın zamana kadar parçalanması zor olan bazı
tuzlar bir element olarak düşünülüyor ve uzun yıllar
öyle kabul ediliyordu. Bunun sebebi aşağıdakilerden
hangisi olamaz?
7.
Element tanımı uzun yıllar, “kendinden daha basit
maddelere dönüştürülemeyen homojen maddelere
denir.” şeklinde ifade edildi. Bu tanımın yanlış olduğu;
I. Uzun yıllar element olarak kabul edilen
ayrıştırılması güç bazı tuzların element olmadığının
anlaşılması,
A) Parçalanması güç olması
B) Isıya karşı dayanıklı olması
II.
Radyo aktifliğin keşfinden sonra atomların
da daha basit parçalara ayrışa bileceğinin görülmesi,
C) Homojen olması
D) Heterojen olması
III. Çekirdek tepkimeleriyle atomlar parçalana
bilmesi ve çekirdekler kaynaştırılarak farklı
elementlere dönüştürüle bilmesi,
E) Element tanımı
Verilen ifadelerden hangilerinde doğrudur?
5.
A)Yalnız I
I. İlk defa gazlarla buharlar arasındaki ayırımı yaptı,
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
II. Soğukta sıvı hale geçenler buhardır şeklinde buharın
tanımını yaptı,
III. Havada çok farklı gazların olduğunu öne sürerek,
havanın tek türden bir cisim olduğu düşüncesine de ilk
kez karşı çıkmıştır.
Van Helmont
yapmıştır?
yukarıdaki
A)Yalnız I
çalışmalardan
B)Yalnız II
D) I ve II
8.
I. Element; Aynı cins atomlardan meydana gelmiş saf
maddelerdir.
hangilerini
II. Elementlerin, kendi özelliğini taşıyan en küçük
birimine atom denir.
C)Yalnız III
III. Elementlerin, en küçük birimine atom denir,
E)I, II ve III
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve III
6.
C)Yalnız III
E)I, II ve III
9.
I. Bir madde eğer tam bir homojenlik göstermiyorsa o
bir elementtir,
I. Elemente kimyasal özelliklerini kazandıran yegane
faktör, protonlarıdır.
II. Tüm homojen maddeler elementtir,
II. Bir elementim tüm atomlarının, proton sayısı aynıdır.
III. Belli maddelere ayrışa bilen maddeler, gerçek bir
element değildir,
III. Bir elementim tüm atomlarının, nötron sayısı aynıdır.
Verilen ifadelerden hangilerinde doğrudur?
Robert Boyle ile ilgili olarak, yukarıdaki tanımlardan
hangileri doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
A)Yalnız I
C)Yalnız III
B)Yalnız II
D) I ve III
C)Yalnız III
E)I, II ve III
E)I, III
10.
I. Bir elementim atomlarının, nötron sayısı aynı
olmayabilir.
II. Bir elementim atomlarının, kütle numaraları aynı
olmayabilir.
I.
Tüm atomlarda; Ps + Ns = Kn dır.
II. Nötr ataomlarda; Ps= Es
III. Bir elementim tüm nötr atomlarının, elektron sayıları
aynıdır.
IV.
Tüm atomlarda; Yük+ Es=Ps
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
Verilen ifadelerden hangilerinde doğrudur?
C)Yalnız III
A)Yalnız I
E)I, II ve III
B)Yalnız II
D) I ve III
C)Yalnız III
E)I, II ve III
2.
11.
I. Elementler milyonlarca aynı cins atomların bir araya
gelerek oluşturdukları saf maddedir.
I. Lavoisier, "Kütlenin Korunumu Yasası" diye bilinen
çok önemli bilimsel bir ilkeyi ortaya koydu.
II. Bir elementin tüm atomları
bakımından bir birinin aynıdır.
II. Lavoisier'i unutulmaz yapan en önemli özelliği
nesnelerin kimyasal değişimlerini ölçmede gösterdiği
olağanüstü duyarlılıktı,
şekil,
büyüklük
III. Bir elementin tüm atomlarının proton sayıları
farklıdır.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
C)Yalnız III
III. Lavoisier’e göre “Madde yoktan var edilemediği gibi,
vardan da yok edilemez. Sadece birinden ötekine
dönüşe bilir”
Verilen ifadelerden hangilerinde doğrudur?
E)I, II ve III
A)Yalnız I
B)Yalnız II
D) I ve III
C)Yalnız III
E)I, II ve III
12.
I. Elementlerin Latince isimlerinin baş harfinin büyük
harflerle, ihtiyaç duyuluyorsa ardından gelen diğer
harflerinden birinin küçük harflerle gösterilmesiyle
oluşturulan simgeye, sembol denir.
II. J.J.Berzellius; Bu gün kullandığımız, alfabedeki
harflerden türetilen simgeleme yöntemini bulmuştur.
III. Elementler sembollerle gösterilirler.
3. Kütlenin korunumu kanunuyla ilgili olarak;
I.
Lavoisier kanunu diye de bilinir.
II. Tepkimeye giren maddelerin kütleleri,
maddelerin kütleleri toplamına eşittir,
çıkan
III. Tepkimeye giren maddelerin mol kütleleri, çıkan
maddelerin mol kütleleri toplamına eşittir,
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve III
C)Yalnız III
E)I, II ve III
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
4. sabit oranlar kanunuyla ilgili olarak;
TEST-4
1.
I.
Sabit oranlar kanununun 1807 de bir grup bilim
insanı tarafından ispat edildi,
II. Sabit oranlar kanunun ortaya atılması, Dalton’un
düşündüğü atom teorisi fikrini kuvvetlendirdi.
I. Katlı oranlar yasasını J.Dalton bulmuştur.
II. J.Dalton katlı oranlar yasasının tanımını yapmıştır.
III. Bir bileşik hangi yolla elde edilirse edilsin, bileşiği
oluşturan maddelerin (atomların) kütleleri arasında
basit tam sayılarla ifade edilen sabit bir oran vardır.
III. Elementler; sabit oranları ya da katlı oranları
sağlayan tanecikler, yani atomlar yoluyla kimyasal olaya
katılırlar.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve III
J.Dalton’un yaptığı tanımdan verilen
hangileri çıkartılabilir?
C)Yalnız III
E)I, II ve III
A)Yalnız I
B)Yalnız II
D) I ve II
ifadelerden
C)Yalnız III
E)I, II ve III
5.
I. Dalton bir bakıma kimyayı ve kimyasal çözümlemeyi
tanımlayan ilk kişidir.
8.
I. Maddelerin en küçük yapıtaşı atomdur.
II. Dalton’a göre, kimyanın başlıca işlevi; “maddesel
parçacıkları birbirinden ayırmak ya da birbiriyle
birleştirmektir.”
II. Atomlar içi dolu taneciklerdir.
III. Her elementin, kütle, büyüklük, kimyasal özellik
yönünden kendine özgü ve özdeş yapılı atomları vardır.
III. Dalton’un sözünü ettiği parçacıklar maddenin, o
zaman bölünmez, parçalanmaz sayılan en ufak öğeleri,
yani atomlarıydı.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve III
Dalton Atom Modeline göre;
B)Yalnız II
D) I ve II
C)Yalnız III
C)Yalnız III
E)I, II ve III
E)I, II ve III
9.
I. Atomlar parçalanamazlar.
6.
I.
II. Aynı cins elementlerin atomları, büyüklük ve kütlece
birbirinin aynıdır.
Kütlenin korunumu kanunu
II. Sabit oranlar kanunu
III. Farklı cins elementlerin atomları da farklıdır.
III. Şartlı oranlar kanunu
Yukarıdakilerden
kanunlarındandır?
A)Yalnız I
D) I ve II
Verilen ifadelerden hangilerinde doğrudur?
hangileri
B)Yalnız II
kimyanın
temel
A)Yalnız I
D) I ve II
C)Yalnız III
B)Yalnız II
C)Yalnız III
E)I, II ve III
E)I, II ve III
7.
J.Dalton, yaptığı çalışmaların sonucundan “iki
element aralarında birden fazla bileşik oluşturuyorsa,
bunlardan birinin sabit miktarıyla birleşen ikincisinin
değişen miktarları arasında basit tam sayılı bir oran
bulunur.”
10.
Dalton atom teorisinin hataları hangi şıkta yanlış
verilmiştir?
A) Bu gün biliyoruz ki; “Maddelerin en küçük yapıtaşı
atom değildir.”
B) Bu gün biliyoruz ki; “Atomların içi tamamen dolu
değildir. Büyük oranda boşluklar vardır.”
I. Dalton suyun formülünü; H + O → HO şeklinde
düşünüyordu,
C) Bu gün biliyoruz ki; “Atomlar, sadece küresel olmayıp
çizgiseldir.”
II. Gay-lussak yaptığı çalışmalarla bunun
H2 + O2 → 2H2O şeklinde olması gerektiğini savundu.
D) Bu gün biliyoruz ki; “Atomlar nükleer yollarla
parçalanabilirler.”
III. Bu gün biliyoruz ki; Suyun birleşme oranı 1/16 değil
1/8 dir. (H:1, O:16)
E) Bu gün biliyoruz ki; “Aynı cins elementlerin atomları,
büyüklük ve kütlece birbirinin aynısı değildir.”
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
11.
C)Yalnız III
E)I, II ve III
I. Dalton iatro simyacılardan biridir.
II. Dalton, o zamana kadar bulunan bazı atomlar belli
geometrik işaretlerle de simgeledi.
2.
I. Aynı sıcaklık ve basınçta, gazların eşit hacimlerinde
eşit sayıda molekül bulunur demiştir.
III. Dalton’ dan sonra, kimya biliminde süratli bir
gelişme gözlenmeye başlandı.
II. 6.02.1023 sayısı, meşhur Avagadro Sayısıdır.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
Avagadro, “0 0C de ve 1 atmosfer basınçta 22,4 litre
hacimde, 6.02.1023 tane tanecik bulunur.” .
III. Avagadro, gaz halinde bulunan atomların 2 atomlu
halde yani moleküler halde olabileceğini savundu.
C)Yalnız III
E)I, II ve III
Verilen ifadelerden
çıkartılabilir?
12.
A)Yalnız I
I. Gay-Lussac; aynı sıcaklık ve basınçta gazların, ancak
belirli ve tamsayılı oranda tepkimeye girdiklerini
gösterdi.
II. N2 +3H2 → 2NH3 tepkimesinde; 1 hacim azot, 3
hacim hidrojen tepkimeye girerek 2hacim amonyak
oluşturmuştur.
D) I ve II
hangileri
verilen
B)Yalnız II
tanımdan
C)Yalnız III
E)I, II ve III
3.
I. CO bir element Co bir bileşiktir.
II. CO bir bileşik Co bir elementtir
III. N2 +O2 → 2NO tepkimesinde; 1 hacim azot 1 hacim
oksijen tepkimeye girerek 2 hacim azot monoksit
oluşturmuştur.
III. P bir element P4 bir bileşiktir
Verilen ifadelerden hangilerinde doğrudur?
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
A)Yalnız I
B)Yalnız II
D) I ve II
D) I ve II
B)Yalnız II
C)Yalnız III
C)Yalnız III
E)I, II ve III
E)I, II ve III
TEST-5
4.
1.
“Gay-Lussac,
avagadro hipotezinden de
esinlenerek, molekül kavramına açıklık getiriyor ve
hesaplamalarını yapıyordu.”
Aşağıdaki ifadelerden hangisi yanlıştır?
A) Bazı atomlar oda şartlarında moleküler halde
bulunurlar.
B) H2, O2, N2, P4, S8 element sembolleridir.
C) Na,K,Mg element sembolleridir.
A)Yalnız I
D) NO, bir element sembolüdür.
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
E) H2, O2, N2 moleküllerdir.
5.
Bağlarla ilgili olarak aşağıdaki ifadelerden hangisi
yanlıştır?
8.
A) Empedokles ve Aristo’ya göre; tabiatta bulunan 4
elementi bir arada tutan sevgi ve iten nefret güçleri
vardır.
Maddelerin katı, sıvı yada gaz halde olmasının
sebebi;
I. Moleküller
arsındaki
kaynaklanmaktadır.
bağın
durumundan
II. Moleküllerin şekillerinden (polar
olmasından kaynaklanmaktadır.
B) Demokritos’a göre, bütün maddelerin tanecikleri
(atomları) aynı, ancak atomların dış yapıları farklıydı.
yada
apolar)
III. Moleküllerin büyüklüklerinden kaynaklanmaktadır.
C) Demokritos’a göre, suyun tanecikleri (atomları)
pürüzsüz olduğundan
kaygan ve akışkan, demir
tanecikleri (atomları) sert ve pürüzlü olduğundan bir
birlerine yapışıklardı.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
D) I ve II
D) Eski bilim insanlarının diğer bir bağ görüşü de
“Çengelli İğneler” modelidir. Atomlar bu çengeller
sayesinde tutunarak bağları oluşturuyordu.
E) Eski bilim insanlarının diğer bir bağ görüşü de
“Zambk” modelidir. Atomlar birbirine yapışarak bağları
oluşturuyordu.
B)Yalnız II
C)Yalnız III
E)I, II ve III
9.
I. Son yörüngedeki elektronlara “Değerlik Elektronları”
denir.
6.
II. I. Yörüngeye en fazla 2 elektron yerleşir.
Kimyasal bağ;
III. 3.elektron ancak 2.yörüngeye yerleşe bilir.
I. Atomların elektron alış verişleri,
Verilen ifadelerden hangilerinde doğrudur?
II. Elektronların ortaklaşa kullanmalarıyla,
A)Yalnız I
III. Dipol-dipol çekimiyle oluşur.
D) I ve II
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
C)Yalnız III
E)I, II ve III
10.
I. Atomların I.yörüngesindeki elektron sayılarını 2 ye
tamamlamaya “dublet” kuralı denir.
7.
I.
Katılarda moleküller bir biriyle tamamen bağımlı,
II. Sıvılarda yarı bağımlı,
III. gazlarda ise tamamen bağımsızdır.
Verilen ifadelerden hangilerinde doğrudur?
II. Son yörüngesindeki elektron
tamamlamaya “Okted Kuralı” denir.
sayısını
8
e
III. Dubletini ve oktedini tamamlayan atomlar kararlı
atomlardır.
2.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
Başlangıç miktarları 16 gram Fe
ve
8 gram S
tepkimeye girdiklerinde Fe nin 2 gramı artıyor. Buna
C)Yalnız III
göre oluşan bileşiğin formülü nedir ? ( Fe : 56 S : 32 )
D) I ve II
E)I, II ve III
A) FeS
B) FeS2
C) Fe2S3
D) Fe2S
E) Fe3S2
11.
I. Tüm soygazlar
tamamlamışlardır.
dubletini
ya
da
oktedini
II. 2He; dubletini tamamlamış, kararlı atom, soygazdır.
3.
III. 2Be; dubletini tamamlamış, soygazdır.
B)Yalnız II
D) I ve II
X
Y
oranı
9
16
dır. X in atom
ağırlığı 27 ise Y nin atom ağırlığı kaçtır ?
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
X2Y3 bileşiğinde kütlece
A) 12
C)Yalnız III
B) 24
C) 32
D) 64
E) 80
E)I, II ve III
4.
12.
XY4 bileşiğinin % 75 i X olduğuna göre X elementinin
mol kütlesi nedir ? ( Y : 1 )
A) 6
I. Ne; oktedini tamamlamış, soygazdır.
II. Diğer soygazlar;
tamamlamışlardır.
Ar,Kr,Xe,Rn
B) 8
C) 10
D) 12
E) 14
oktedini
III. Soygazların, elektron alma verme ihtiyaçları yoktur.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
5.
Pb3O4
bileşiğinde 8 gram oksijen kaç gram Pb ile
birleşmiştir ? ( Pb : 208 O : 16 )
A) 104
B) 208
C) 52
D) 156
E) 78
TEST-6
1.
Al ve S nin tepkimesinden Al2S3 oluşur. 15 gram Al2S3
6.
15 gram azot oksit bileşiğinin 8 gramı oksijendir.
oluşurken kaç gram S harcanır ? ( Al: 27 S : 32 )
Bileşiğin formülü nedir ?
A) 2,4
A) NO
B) 3,2
C) 4,8
D) 7,2
E) 9,6
B) N2O
C) NO2
D) N2O3
E) N2O5
7.
4 gram X ile 6 gram Y nin oluşturduğu bileşiğin formülü
XY2 ise 10 gram X ile 12 gram Y nin oluşturduğu
12. X3Y2 bileşiğinde 21 gram X elementi ile 16 gram Y
bileşiğin formülü nedir ?
A) X2Y3
B) X4Y5
C) X5Y8
D) XY4
E) X3Y8
elementi bulunduğuna göre, 32 gram Y ile 14 gram X
etkileştirildiğinde en fazla kaç gram XY oluşur ?
A) 20
8.
B) 30
C) 42
D) 45
E) 56
8 ‘er gram Ca ve Br2 den en çok kaç gram CaBr2
bileşiği oluşturmak mümkündür ? ( Ca : 40 Br : 80 )
A) 10
B) 12
C) 14
D) 8
E) 4
13. XY3 bileşiğinin kütlece % 60 ‘ ı Y dir. Eşit m kütlede X
ve Y nin tepkimesinden en çok kaç gram bileşik elde
edilir ?
A) 2m/3
9.
B) 3m/5
C) 3m/2
D) 5m/3
E) 2m
Aşağıdakilerden hangisi sabit oranlar kanununa uyar ?
A) Homojen karışım
C) Element
B) Heterojen karışım
D) Bileşik
E) Çözelti
14. X ve Y birleşerek XY3 bileşiğini oluşturuyorlar. Ve
10. XaYb bileşiğinin ağırlıkça % 70 ‘i
X olduğuna göre
bileşiğin formülü nedir ? ( X : 56 Y : 16 )
A) XY
B) XY2
11. 9,4 gram Cu
C) X2Y
D) XY3
ile 7,1 gram Cl2
E) X2Y3
nin tam verimle
tepkimesi sonucu en çok kaç gram CuCl2 oluşabilir ?
( Cu: 64
Cl : 35,5 )
A) 31,5
B) 26
C) 13,5
D) 11,2
E) 9,6
nin ağırlıkça birleşme oranı
7
3
X
Y
tür. Buna göre, 8 gram
XY3 bileşiğini oluşturmak için kaç gram Y elementi
kullanılmalıdır ?
A) 0,6
B) 1,2
C) 2,4
D) 3,2
E) 6,4
15. - 3 gram X ile 8 gram Y den en fazla 11 gram XY2 oluşur.
- 3 gram X ile 11 g. Y den en fazla 11 gram XY2 oluşur
-6 gram X ile 8 gram Y de en fazla 14 gram XY oluşur.
Bilindiğine göre aşağıdaki yasalardan hangileri
kullanılmıştır ?
I. Kütlenin korunumu kanunu
II. Sabit oranlar kanunu
III. Katlı oranlar kanunu
A) I , II ve III
D) II ve III
B) I ve II
C) I ve III
E) Yalnız I
2.
X2Y3 bileşiğinin 10 gramında 7 gram X vardır. 1,6 gram
Y kullanıldığında en fazla kaç gram X3Y4 elde edilir ?
A) 5,8
B) 2,9
C) 3,2
D) 4,7
E) 1,85
16. 15 gram Ca , 16 gram S ve 40 gram O ‘ dan en fazla
kaç gram CaSO4 bileşiği oluşur ? (Ca:40 S:32 O:16 )
A) 51
B) 68
C) 71
D) 85
E) 102
3.
15 gram X , 6 gram Y ile XY bileşiğini oluşturuyor. Aynı
miktar Y , X ile 16 gram X – Y bileşiğini oluşturuyor. II.
Bileşiğin formülü nedir ?
A) X2Y
17. 6,2 gram X ile 4,8 gram Y den oluşan bileşiğin formülü
B) X3Y2
C) X2Y3
D) XY2
E) XY3
X2Y3 ise 16 gram Y kullanılarak elde edilen X2Y5 kaç
gramdır ?
A) 7,1
B) 14,1
C) 22,2
D) 28,4
E) 34,6
4.
Aşağıdaki bileşiklerden hangisinde X in kütlece
yüzdesi en büyüktür ?
A) XO
B) XO2
D) X2O3
C) X2O
E) X2O5
18. Bir miktar Kükürt 15 gram oksijenle tepkimeye girerek
SO3 bileşiğini oluşturuyor. Tepkime tamamlandığında 3
5.
Katlı oranlar yasasını doğrulamak için;
gram Kükürt arttığına göre başlangıçta kaç gram
I.
kükürt alınmıştır? ( S : 32 O : 16 )
II. N2O4 – NO2
A) 32
B) 16
C) 13
D) 10
E) 8
NO2 – NF3
III. C2H6 – C3H8
Bileşik çiftlerinden hangilerinin seçilmesi gerekir ?
A) Yalnız I
D) I ve III
1.E 2.A 3.C 4.D 5.E 6.A 7.C 8.A 9.D 10.E
11.C 12.B 13.D 14.C 15.A 16.A 17.D 18.C
TEST-7
B) Yalnız II
6.
C) Yalnız III
E) II ve III
X ve Y elementleri arasında oluşan I .Bileşiğin % 70 ‘ i ,
II. bileşiğin ise 34 gramının 28 gramı Y dir. Buna göre ,
1.
Kütlece
sabit oranlar yasasının ifadesini doğrulamak
I. Bileşiğin formülü XY ise II. bileşiğin formülü nedir?
için ;
A) X2Y
B) XY2
C) XY3
D) X3Y
E) X2Y3
I. Bileşiğin formülü
II. Elementlerin atom ağırlıkları
III. Elementlerin atom numaraları
Bilgilerinden hangileri gereklidir ?
A) Yalnız I
B) Yalnız II
C) Yalnız III
D) I ve II
E) I ve III
7.
X ve Y elementleri arasında oluşan I. bileşiğin formülü
X2Y3 , II. bileşiğin formülü ise X3Yn dir.
X ‘ in eşit miktarına karşılık I. bileşikteki Y nin II.
bileşikteki Y ‘ ye oranı 9/8 ise n kaçtır ?
A) 5
B) 4
C) 3
D) 2
E) 1
11. Azot ve Oksijenden oluşmuş iki bileşikten ;
I. Bileşikte 7 g. Azot 8 g. Oksijenle ,
II. Bileşikte 7 g. Azot 12 g. Oksijenle birleşmiştir.
8.
I. Bileşik
X
Y
14
4
I. Bileşik NO ise II. Bileşiğin formülü aşağıdakilerden
hangisidir ? ( N : 14 O : 16 )
II. Bileşik
28
12
A) NO2
X ve Y arasında oluşan iki bileşikte tepkimeye giren
B) N2O
C) N2O3
D) N2O4
E) N2O5
X ve Y nin kütleleri tabloda verilmiştir.
I.Bileşiğin formülü XY2 ise II.Bileşiğin formülü nedir ?
A) X2Y3
9.
I.
B) X2Y4
C) XY3
D) X3Y
E) X3Y2
SO2 – S2O3
12. X ve Y nin oluşturdukları I. Bileşiğin formülü XY, II.
II. N2O5 – NO2
Bileşiğin ki X2Yn dir.
Aynı miktarda X ile birleşen I. Bileşikteki Y nin II.
III. C2H6 – C3H8O
Bileşikteki Y miktarına oranı 1/3 tür.
Yukarıdaki bileşik çiftlerinden hangilerinde katlı oran
Buna göre II. Bileşiğin formülündeki ( n ) kaçtır ?
belirlenebilir ?
A) Yalnız I
B) Yalnız II
D) II ve III
A) 1
C) I ve II
B) 2
C) 3
D) 6
E) 9
E) I , II ve III
13.
10. I. 10 g. X ile 8 g. Y tepkimeye girerse 2 g. Y artıyor.
II. 16 g. X ile 18 g. Y tepkimeye girerse 1 gram X artıyor.
X
Y
I. Bileşik
13
12
II. Bileşik
13
6
Buna göre, I. bileşik XY2 is II. bileşik aşağıdakilerden
X ve Y elementlerinin oluşturduğu iki bileşikten
hangisidir ?
birincinin kimyasal formülü XY3
A) XY2
B) XY
C) X2Y3
D) X3Y2
E) X3Y4
ise ikinci bileşiğin
formülü nedir ?
A) XY
B) X2Y
C) X2Y3
D) XY4
E) X3Y
14.
X
Y
I. Bileşik
14
16
II. Bileşik
14
32
1.
I. Plastik çubuk yünlü kumaşa sürtüldüğünde, yünlü
kumaştan plastik çubuklara elektronlar yani (–) yükler
geçerler.
X ve Y elementlerinin oluşturduğu iki bileşikten
birincinin kimyasal formülü XY
II. Plastik çubuklar elektron aldığı için negatif (–) yükle
yüklenirler.
ise ikinci bileşiğin
formülü nedir ?
A) XY
B) X2Y
III. (-) yüklü atomlara anyon denir.
C) X2Y3
D) XY2
Verilen ifadelerden hangilerinde doğrudur?
E) X3Y
A)Yalnız I
B)Yalnız II
D) I ve II
15.
X
Y
I. Bileşik
3,2
3,2
II. Bileşik
32
48
C)Yalnız III
E)I, II ve III
2.
I. Cam çubuk ipek kumaşa sürtüldüğünde, cam
çubuklardan ipek kumaşa elektronlar yani (–) yükler
geçer.
X ve Y elementlerinin oluşturduğu iki bileşikten
II. Cam çubuklar elektron kaybettiği için pozitif (+) yükle
yüklenirler.
birincinin kimyasal formülü XY2 ise ikinci bileşiğin
formülü nedir ?
III. (+) yüklü atomlara katyon denir.
A) XY
B) X2Y
C) XY3
D) XY2
E) X3Y
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
NOT:7 ve 8. Testlerde çözülemeyen sorular olabilir.
C)Yalnız III
E)I, II ve III
Bunun sebebi orta okuldan kalan boşluklardır. Bunun
için üzülmeyiniz.
Test-8
3.
I. Aynı cins elektrik yüküyle yüklü plastik çubuklar
birbirlerine yaklaştırılırsa birbirlerini iterler.
I.
Bağlar kuvvetli ve zayıf etkileşimler diye 2 kısımda
incelenirler.
II. Elektriklenmiş plastik ve cam çubuklar birbirlerine
yaklaştırılırsa üzerlerinde farklı cins elektrik yükleri
birikeceğinden birbirlerini çekerler.
II. Aynı ya da farklı tür atomların kuvvetli
etkileşimlerle bir arada tutunmalarını sağlayan kuvvete
“Kimyasal Bağ” denir.
III. Farklı cins elektrik yükü bir birini çeker.
III. Aynı ya da farklı tür atomların zayıf etkileşimlerle
bir arada tutunmalarını sağlayan kuvvete “fiziksel Bağ”
denir.
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
D) I ve II
B)Yalnız II
B)Yalnız II
D) I ve II
E)I, II ve III
C)Yalnız III
E)I, II ve III
4.
17Cl;2)8)7
C)Yalnız III
buna göre Cl atomu için;
I.
1 elektron alarak, oktedini tamamlar,
Verilen ifadelerden hangilerinde doğrudur?
II. -1 yükle yüklenir,
A)Yalnız I
III. Cl-1 iyonu oluşur,
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
8.
12Mg;2)8)
2; buna göre Mg atomu için;
I. 2 elektron vererek, oktedini tamamlar
5.
20Ca:
2)8)8)2; buna göre Ca atomu için;
II. 3 tane katmandan oluşur
I. 2 elektron vererek, oktedini tamamlar
III. +2 yükle yüklenir,
II.
Verilen ifadelerden hangilerinde doğrudur?
+2 yükle yüklenir,
III. Ca+2 iyonu oluşur.
A)Yalnız I
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
B)Yalnız II
D) I ve II
C)Yalnız III
E)I, II ve III
C)Yalnız III
E)I, II ve III
9.
18Ar:
2)8)8; buna göre Ar atomu için;
I. 3 katman içerir
6.
8O;2)6;
buna göre O atomu için;
II. +2 yükle yüklenir,
I. 2 elektron alarak, oktedini tamamlar
III.Tabiatta moleküler halde bulunur
II. -2 yükle yüklenir,
Verilen ifadelerden hangilerinde doğrudur?
III. O-2 iyonu oluşur.
A)Yalnız I
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
B)Yalnız II
D) I ve II
7.
11Na;2)8)
C)Yalnız III
E)I, II ve III
1; buna göre Na atomu için;
I. 1 elektron vererek, oktedini tamamlar
II. +1 yükle yüklenir,
III. Na+1 iyonu oluşur.
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
10.
1H:
1) ; buna göre H atomu için;
I. Değerlik elektron sayısı 1 dir.
11.
2He:
2) ; buna göre He atomu için;
II. +1 yükle yüklenir,
I. Değerlik elektron sayısı 2 dir.
III.-1 yükle yüklenir,
II. Dubletini tamamlamıştır.
Verilen ifadelerden hangilerinde doğrudur?
III.Oktedini tamamlamıştır.
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
Verilen ifadelerden hangilerinde doğrudur?
A)Yalnız I
D) I ve II
B)Yalnız II
C)Yalnız III
E)I, II ve III
. BÖLÜM: Simyadan Kimyaya
İnsanoğlu yaratıldığı günden itibaren hep arayış içinde olmuştur .Issız bir
adada kaybolsanız ve hiç bir şeye sahip olmazsanız acaba neleri hayatınıza
hangi öncelikle katarsınız? Eski çağlarda insanlar da bu şekilde düşünmüş
olabilirler.
1-Beslenme ihtiyacı: Önce hayatta kalabilmek için doğadaki yenilebilir
maddeleri keşfetmekle işe başladılar.
2-Barınma ve korunma ihtiyacı Sonra yıldırımlardan ve diğer hayvanlardan
korunmak için kendilerine uygun barınaklar hazırlamakla işe devam ettiler
Mağaralar ve değişik barınma yerleri inşaat ettiler.
3-Savunma ve avlanma ihtiyacı: Hayatta kalabilmek ve hayatı kolaylaştırmak
için değişik aletler ürettiler.
4- Isınma ihtiyacı:Ateşi kullanmayı öğrendiler.
5-Günlük hayatını kolaylaştırma ihtiyacı: Demire ve bakıra şekil vermeyi
keşfettiler.
6-Giyinme ihtiyacı: Avladıkları hayvanların derilerinden elbiseler ürettiler.
7-Dış görünüşünü değiştirme çabası: Güzelleşmek ve dış görünüşlerini daha
güzel göstermek için değişik boyaları ürettiler ve kullandılar.
8-Değişik tatları kullanma ve gıdalarını daha uzun saklama ihtiyacı: Tuzu
buldular.
9-Hastalıkları ve yaraları tedavi etme ihtiyacı:Yaralarını iyileştirmek için
değişik bitkilerden elde ettikleri maddeleri ilaç olarak kullandılar.
Simyacılar bitkilerden yararlanarak hastalıkların tedavisi için bazı iksirler
oluşturmuşlardır.Kendir,çam terebentini,safran,ısırgan otu,çivit
otu,nane,limon,bu gün de yaygın olarak kullanılan bitkilerdir.Lokman Hekim'in
bitkilerden elde ettiği iksirlerle şifa dağıttığı hatta ölümsüzlük iksirini bulduğu
bile söylenir. İnsanoğlu ölümsüzlüğe çare arayışlarında başarılı olamamış ancak
sınama yanılma yolu ile pek çok hastalığı tedavi etmeyi başarmış ve çoğu
kimyasalların bilgilerinin günümüze kadar gelmesine,yardımcı
olmuşlardır.Örneğin kükürt buharı yardımı ile kaysı ,muz ,narenciye, gibi
meyvelerin sarartılması,bir çok zararlı haşereden korunması ve olgunlaşması
metotları günümüzde de yoğun olarak kullanılmaktadır.Balık,et ,sebze ve
meyvelerin tuzlanarak ,salamura yapılarak,uzun süre kullanılması da bize
onlardan kalan metotlardır.
Göztaşı (CuSO4)
Şap (KAl(SO4)2 . 12H2O) t
Kıbrıs taşı (FeSO4)
SİMYA
Bazı bitkisel ürünlerin ilaç olarak yararlarının fark edilmesi; ölümsüzlük
veya sonsuz zenginlik sağlayan madde arama hayali ve buradan maddenin
deneme yanılma yoluyla incelenmesi ile simya doğmuştur. Eski
dönemlerde değersiz metalleri altına çevirme,hastalıkları iyileştirme ve
ölümsüzlük iksirini bulmaya çalışma uğraşılarına simya,bu işle uğraşan
kişilere de simyacı denirdi.
Simya,ölçümlerin kullanılmadığı,teorik temelleri olmayan,deneme
yanılmaya dayanan ve sistematik bilgi birikimi sağlayamayan bir uğraş
olduğundan bilim olarak kabul edilemez.Ancak kimyaya geçişin öncüleridir
ve bugün bile kullanılan birçok araç ve gereç üretmişlerdir.Ayrıca barut,bazı
metallerin işlenmesi, mürekkep,kozmetik,boya, deri işleme,seramik,cam ve
esans üretimi gibi yaralı bilgi ve yöntemleri de kimyaya aktarmışlardır.
Orta çağ simyacıları FeSO4 (vitriol) ya da şapı kil kaplarda kızıl
renk alana kadar ısıtarak ya da güherçileye (KNO3-Hint güherçilesi, NaNO3Şili güherçilesi) kükürt katıp su dolu kapta yakarak sülfürik asit (H2SO4-zaç
yağı) elde ediyordu.18. yüzyılda ise sülfürik asit boyama ve ağartma
işlemlerinde kullanılarak önemini hissetirdi . Günümüzde ise aşındırıcı (asit)
olarak, altın ve gümüş saflaştırılmasında,gübre, pigment, boyar madde,
patlayıcı madde, ilaçlama, inorganik tuz ve petrol arıtım ve metalurji
işlemlerinde kullanılmaktadır.
Maddeleri tek tek ele alıp diğer maddelerle etkileşimini incelemek
simyanın yöntemidir.Maddenin yapısı ile özellikleri arasında ilişki kurup bu
ilişkiler çerçevesinde araştırmak ise kimyanın yöntemidir.Kimyayı simyadan
ayıran en önemli özelliklerden biri de kimyanın ölçmeye dayalı olmasıdır.
Simyanın doğmasına sebep olan, iki temel dürtü;sonsuz zenginlik hayali ve
ölümsüzlük hayalidir.İnsanlar deneme yanılma yolu ile kısa zamanda zengin
olmayı ve ölümsüz olma hayallerine kapılmıştır.
Simya diğer adı ile Alşimi, XII. yüzyıldan itibaren Ortaçağ Avrupa'sında
yayılmış olan bir düşünce ve bilgi akımına verilen isimdir. Sözcüğün kökeni
tartışmalıdır. Alşemi'nin Latin yazılış biçimindeki Al-chemie'deki Al takısının Arap
kökenli olduğu , Chemie'nin de Sami kökenli Heme, Hema sözcüklerinden
geldiği ifade edilmektedir.Simya ile uğraşan kişilere simyacı denir.
Simyacıların en çok bilinen iki hedefi ,madenlerin altına dönüştürmek ve
bütün hastalıkları iyileştirecek ve hayatı sonsuz biçimde uzatacak
ölümsüzlük iksirini bulmaktır. Orta Çağ'dan itibaren Avrupalı simyagerler
hem madenleri altına çevirmek hem de ölümsüzlük iksiri yapmada
kullanılacağını düşündükleri efsanevi bir madde olan " felsefe taşı " nın
bulunması için büyük çaba harcadılar.
Simyagerler,yüzyıllar boyunca büyük saygınlık gördüler ve destek aldılar.
Bu saygınlığın ve desteğin sebebi zamanlarının kimya endüstrisine
yaptıkları katkılardı. Bu katkılar arasında barutun keşfi, madenlerin test
edilmesi ve saflaştırılması , metallerin işlenmesi üzerindeki çalışmaları,
mürekkep, boya üretimi,deri boyanması, seramik ve cam üretimi, likör ve
esans üretimi vb. sayılabilir.
Simya teorik temellere sahip değildir.
Sınama-yanılma yolu ile olayları anlamaya çalışır.
Sistematik bilgi birikimine sahip değildir.
Bir bilim değildir.
Roma Bizans İmparatorluklarında,daha sonra da İslam ülkelerinde kimya
alanlarında pek çok gelişmeler olmuştur."Dört öge kuramı " (su
,toprak,ateş,hava) ve elementlerin dönüşümüne ilişkin
düşünceler,İskenderiye'de ve daha sonra İslam alimleri Cabir İbn Hayyan
,El Razi ve İbni Sina tarafından geliştirilmiştir.Örnek olarak imbik
(damıtmada kullanılan bir alet) Arap alimleri tarafından geliştirilmiştir ve
halen kullanıldığı yerlar vardır.
Ancak simyanın ve simyacıların kimyaya katkıları da göz ardı
edilmemelidir.Son simyacı sayılan Johann Joachim Bacher (6 Mayıs 1635
– Eylül 1682) "Ateş elementinin" yanması sırasında havanın bir kısmının
(Oksijen) kaybolduğunu ve geriye yanmadan kalan elverişsiz atık (Azot)
bıraktığını tespit etmiştir.Yanarak kaybolan havanın bu kısmı daha sonraları
"filojiston" (ateş ruhu) olarak anılmıştır. Bacher'e göre yanıcı olan cisimler
,yanıcı olmayan filojistondan oluşmuştur.Metal oksitleri birer element olarak
tanımlarken metalleri kül Yani metal oksitler ile filojistondan oluşan bilşikler
olarak tanımlamıştır.Oysa bu gün bunun tamamen zıt olduğu kanunlar ve
deneylerle ispatlanmıştır.
İMBİK, sıvıların damıtılmasında
kullanılan aygıt. Birden çok sıvı
karışımlarının ya da içinde yabancı
maddeler bulunan sıvıların buharlaşma
sıcaklıklarındaki farklılıklardan
yararlanarak saflaştırılmasına yarar.
Gülsuyu, gülyağı üretiminde, esans
üretiminde imbiklerden yararlanılır. İmbik, ısıtıcı bir fırın, buharlaşmanın
olduğu başlık ve başlığa bağlı kuğu boynu biçiminde uç tarafı helezoni bir
soğutucudan oluşur.Başlıkta buharlaşma sıcaklığına dek ısıtılan sıvı buharı
kuğu boynu boyunca ilerler. Helezon borudan geçerken borunun dışındaki
soğuk su dolaşımı, yoğunlaşarak alttaki kapta sıvı olarak toplanmasını
sağlar
18. yüzyılda çivit otunun (indigo) ile sülfürlenmesinden elde edilen boya
yün boyacılığında kullanılması sülfürik asidin önemini arttırmış ve sanayinin
ilgili bölümlerinde yerini almıştır.Sülfürik asit aynı dönemlerde ağartma
işlemlerinde de kullanılmıştır.Nicolas Le Blanck'ın geliştirdiği metot yardımı
ile Sülfürik asit üretimi sanayide yerini almıştır.Sülfürik asit aşındırıcı
özelliğinden dolayı, boyacılıkta bazı boyaların üretiminde,altın ve gümüşün
saflaştırılmasında kullanılmıştır.
Simyacıların boyamacılıkta kullandıkları bazı maddeler.
Renk
Metal tuzu
Koyu mavi
Kobalt tuzu
Acik mavi
bakır ve demir tuzu
Yesilimsi
mavi
Yesil
Kirmizi
(opak)
Sarı
bakır tuzu
bakır tuzu
Kırmızı bakır oksit
Antimon ve kurşun
tuzlan
Purpur
(erguvan)
Mangan tuzu
Simyacıların çalışmalarında keşfedilen kimyasallar:
Sülfürik asit H2SO4 (zaç yağı)
Nitrik asit H2SO4 (kezzap)
Hidroklorik asit HCl (tuz ruhu)
Demir II sülfat FeSO4 (Kıbrıs taşı - Zaç-ı Kıbrıs-Vitriyol)
Asetik asit CH3COOH (sirke ruhu)
Potasyum alüminyum sülfat KAl (SO4)2 (şap)
Sodyum sülfür Na2SO4 (sarı zırnık)
Potasyum nitrat KNO3 (hint güherçilesi)
Sodyum nitrat NaNO3 (Şili güherçilesi)
Na-stearat + Na-oleat + Na-palmitat (Sabun)
K-stearat + K-oleat + K-palmitat (Arap sabunu)
Pb3O4 Kurşun oksit ( Sülyen ,turuncu boya )
ZnS Çinko sülfür (Üstübeç-beyaz boya)
Cu SO4 Bakır sülfat (Göz taşı )
Element Kavramlarının Tarihsel Gelişimi
Antik çağın en etkin ve en büyük otoritesi olan Aristo'ya göre madde dört
ana element (unsur) dan oluşur.Bunlar toprak ateş,hava, su , Aristo’ya göre
yüksek aklın kurduğu evrende her şey, topraktan doğup toprağa dönerdi.
Bu dönüş zinciri; toprak→ateş→hava→su ve yeniden toprak şeklindeydi.”
Soğuk ve ıslak (suyu)
sıvıyı,
Soğuk ve kuru (topragı)
katıyı,
Islak ve sıcak (havayı)
gazı,
Kuru ve sıcak (yanıcı)
ateşi oluşturur.
Element" kavramının
isim babası olan Robert Boyle, Aristo'nun elementler öğretisine karşı çıkarak ilk
kez modern element kavramını ortaya koydu ve oksijenin yanma olayındaki
rolünü keşfetti. 18. yüzyılda kimyanın temel sorunu yanma olayının (ateş
ruhlarının işlevlerinin) açığa kavuşturulması oldu. 17. yüzyıl ortalarına doğru
maddedeki elementlerden birinin yanmaya neden olduğu ileri sürülmüş ama bu
sav, ateşin maddesel bir cisim olamayacağı gerekçesiyle ünlü simyacı Van
Helmont tarafından reddedilmişti. Alman simyacı Johann Joachim Becher
(1635-82) bu öneriyi daha sonra 1669'da yeniden gözden geçirdi ve ateş
elementinin yanma sırasında kaçıp giden bir nesne olduğunu varsaydı.
Becher'in öğrencisi ve Berlinli bir hekim olan Georg Ernst Stahl ( 1660- 1734)
bu nesneye simya konusunda anlatıldığı gibi "flojiston" adını verdi. Yanma
olayına yanlış da olsa ilk kez bir bilimsel açıklama getiren flojiston kuramına
göre yanıcı maddeler, yanıcı olmayan bir kısım ile flojistondan oluşur. Buna göre
metal oksitler birer element, metaller ise kil (metal oksit) ile flojistondan oluşan
birer bileşik maddedir. Metal yandığında eksi kütleli "plan flojiston bir ruh gibi
ayrılır ve elementin külü (metal oksit) açığa çıkar. Küle yeniden flojiston
verildiğinde de yeniden metal oluşur. Örneğin çinko oksit flojistonca zengin olan
kömürle ya da hidrojen gazıyla ısıtıldığında yeniden çinko oluşur ve hafifler. Bir
yüzyıl boyunca kimyaya egemen olan bu kuram element kavramına uygun
olmamakla birlikte kimyanın bilimsel gelişmesinde çok büyük rol oynadı.
19. yüzyıl başlarında kimyasal çözümleme yöntemlerinde hızlı gelişmeler
elementlerin ve bileşiklerin fiziksel ve kimyasal özelliklerine ilişkin çok geniş
bir bilgi birikimine neden oldu. Bunun sonucunda bilim adamları elementler
için çeşitli sınıflandırma sistemleri bulmaya çalıştılar. Rus kimyacı Dimitriy
İvanoviç Mendeleyev 1860'larda elementlerin özellikleri arasındaki ilişkileri
ayrıntılı olarak araştırmaya başladı.
1869'da, elementlerin artan atom ağırlıklarına göre dizildiklerinde
özelliklerinin de periyodik olarak değiştiğini ifade eden periyodik yasayı
geliştirdi ve gözlemlediği bağlantıları sergilemek için bir periyodik tablo
hazırladı. Alman kimyacı Julius Lothar Meyer de, Mendeleyev'den bağımsız
olarak hemen hemen aynı zamanda benzer bir sınıflandırma yöntemi
geliştirdi. Mendeleyev'in periyodik tablosu o güne değin tek başına
incelenmiş kimyasal bağlantıların pek çoğunun birlikte gözlemlenmesini de
olanaklı kıldı. Ama bu sistem önceleri pek kabul görmedi. Mendeleyev
tablosunda bazı boşluklar bıraktı ve bu yerlerin henüz bulunmamış
elementlerle doldurulacağını ön gördü. Gerçekten de bunu izleyen 20 yıl
içinde skandiyum, galyum ve germanyum elementleri bulunarak boşluklar
doldurulmaya başlandı
Sayfa başı
II. BÖLÜM: Kimyanın Temel Kanunları
A. Kütlenin Korunumu Kanunu
Lavoiser miktarı belli olan kalay (Sn) parçasını içinde bir miktar hava
bulunan bir fanusa koyarak tartmış.Daha sonra fanusu içindekilerle birlikte
ısıtmış ,ısınan kalayın beyaz bir toz haline ( Sn O )dönüştüğünü gözlemlemiştir.
Oluşan beyaz tozu ve fanusu tekrar tarttığında başlangıçta belirlediği kütle ile
eşit olduğunu gözlemlemiştir.Benzer deneylerle aynı sonuca ulaşmıştır.Oluşan
beyaz tozu (Kalay oksit ) benzer yolla ısıttığında ise başlangıçta fanusa koyduğu
Kalayın kütlesin eşit kütlede kalay elde ettiğini gözlüyor ve kendisini unutulmaz
yapan şu sonuca varıyor.“Madde yoktan var edilemediği gibi, vardan da yok
edilemez. Sadece birinden ötekine dönüşebilir”
Bu ifadesi "Kütlenin Korunumu Yasası" diye bilinir
Bu günkü ifadesi ile;
Kimyasal olaylarda, tepkimeye giren maddelerin kütleleri toplamı, tepkime
sonunda oluşan maddelerin kütleleri toplamına eşittir. Bu olaya KÜTLENİN
KORUNUMU KANUNU denir.
Kütlenin korunumu Kanunu
1-Erime,donma,buharlaşma,yoğunlaşma gibi hal değişimleri ile çözünme gibi
fiziksel olaylarda da korunur.
2-Kimyasal olaylara giren maddelerin kütleleri toplamı, elde edilen ürünlerin
kütleleri toplamına eşittir.
ÖRNEK;
Bir parça magnezyumun tümü 98 gr sülfürik asit ile tepkimeye giriyor.Oluşan
magnezyum sülfatın kütlesi 120 gr ve açığa çıkan hidrojenin kütlesi ise 2 gr
olduğuna göre kullanılan magnezyum kaç gramdır.
Magnezyumun kütlesi +Sülfürik Asidin kütlesi=Magnezyumun sülfatın kütlesi +Hidrojenin
kütlesi
?
+
+
98
=
120 gr
2 gr
Kütlenin korunumu kanununa göre;
Magnezyumun kütlesi+98=120+2
Magnezyumun kütlesi=24 gr dır.
ÖRNEK;
40 mlt Kükürt di oksit gazının 32 gr oksijenle tepkimesinden 160 gr Kükürt
tri oksit oluştuğuna göre Kükürt di oksitin aynı koşullarda öz kütlesi nedir?
Kükürt di oksit gazı kütlesi + oksijen gazı kütlesi
?
+
32 gr
= Kükürt tri oksit gazı kütlesi
=
160 gr
Kükürt di oksit gazı kütlesi+32=160
Kükürt di oksit gazı kütlesi=128 gr
Kükürt di oksit gazı öz kütlesi= m /V
Kükürt di oksit gazı öz kütlesi=128 gr/40mlt
Kükürt di oksit gazı öz kütlesi= 3.2 gr/mlt
ÖRNEK;
Saf olmayan 8 gr magnezyum 14,6 gr hidroklorik asitle reaksiyondan 19 gr
magnezyum klorür ile 0,4 gr hidrojen gazı oluşuyor. Magnezyumun yüzde kaçı
reaksiyona girmiştir?
Mg'mun kütlesi + Hidroklorik Asidin kütlesi = Mg'mun klorürün kütlesi +Hidrojen gazının
kütlesi
?
0,4 gr
14,6 gr
19 gr
Kütlenin korunumu kanununa göre;
Magnezyumun kütlesi+14,6=19 + 0,4
Magnezyumun kütlesi=4,8 gr'dır
8 gr Magnezyumdan kimyasal reaksiyona giren magnezyum kütlesi 4,8 gr dır
100 gr Magnezyumdan
girer
kaç gr magnezyum reaksiyona
----------------------------------------------------------------------------------------------------------------?= % 60 ' reaksiyona girmiştir.
B.Sabit Oranlar Kanunu
1799 yılında Joseph Proust elementler birbirleri ile bileşik oluştururlarken
belli oranda birleştiklerini buldu. Bugün sabit oranlar yasası olarak bilinen
yasaya göre “Bir bileşiğin miktarı ne kadar olursa olsun, hangi yolla
elde edilirse edilsin, bileşiği oluşturan elementlerin kütleleri arasında sabit
bir oran vardır ”.
Suyu örnek verecek olursak, suyun 18 gramında 16 gram oksijen varken
2 gramı hidrojendir. 9 gram suyun 8 gramı oksijen ve 1 gramı hidrojendir.
Bu oran suyun ne şekilde elde edildiğine bağlı değildir ve su için her zaman
sabittir
H2 (g) +O2 (g)→ H2O (g)
2 g + 16 g = 18 g
Kütlece hidrojenin oksijene oranı daima
m H / m O = 2/16 = 1/8’ dir.
Bir başka örnekte bu oranın ne anlama geldiğini görelim.
Kalsiyum oksit bileşiğinde sabit oran m Ca /mO = 5/2’ dir.
Bu oran aşağıdaki şekilde yorumlanabilir.
1) 5 gram kalsiyum ile en fazla 2 gram oksijen birleşebilir; 7 gram
kalsiyum oksit oluşur.
2) 7 gram kalsiyum oksit elde etmek için 5 gram kalsiyum 2 gram oksijen
kullanılır
3) 7 gram kalsiyum oksit ayrıştırılırsa 5 gram kalsiyum 2 gram oksijen
elde ederiz.
C.Katlı Oranlar Kanunu
J.Dalton, yaptığı çalışmalarda Joseph Proust'un sabit oranlar kanunundan
yararlanarak iki farklı atom bir araya geldiğinde hep aynı bileşikleri mi oluşur
sorusuna aradığı cevapta katlı oranlar kanununa ulaşır.Karbon elementiyle
oksijenin oluşturduğu iki bilşik vardır bunlar karbon mono oksit ve karbon di
oksit Karbon mono oksit bileşiğinde bir karbon atomu ile bir oksijen atomu
birleşirken , Karbon di oksit bileşiğinde bir karbon atomu ile iki oksijen atomu
birleşir.Her iki bileşikte karbon atom sayıları sabit tutulduğunda oksijen
atomları arasında 1/2oranının olduğu gözlenir.Dalton'un ulaştığı sunuca göre
“iki element aralarında birden fazla bileşik oluşturuyorsa, bunlardan birinin
sabit miktarıyla birleşen ikincisinin değişen miktarları arasında basit tam sayılı
bir oran bulunur.” Bu şekilde “Katlı Oranlar Kanunu” olarak bildiğimiz yasa
bulunmuş oldu.
Dalton atom kuramı, kütlenin korunumu ve sabit oranlar yasalarına ve diğer
deneysel gözlemlere dayanılarak önerilmiştir.
Dalton kuramının postulatları aşağıdaki gibi sıralanabilir:
Elementler, görünmeyen ve atom denilen bölünmeyen
parçacıklardan oluşmuştur..
Bir elementin bütün atomları özdeş olup aynı, kütleye,
büyüklüğe ve kimyasal özelliklere sahiptir ve diğer bir elementin
atomlarından farklı özelliklere sahiptir.
Kimyasal tepkimeler, atomların düzenlenme türünün, birleşme
seklinin değişmesinden ibarettir. Atomlar kimyasal tepkimede
oluşamaz ve parçalanamazlar
Bileşikler birden çok elementin atomlarından oluşmuşlardır.
Herhangi bir bileşikteki iki elementin atom sayılarının oranı bir tam
sayı ya da basit tam sayılı kesirdir.
Dalton kuramı, iki açıdan başarılıdır.
Birincisi, kütlenin korunumu yasasını açıklar. Bir kimyasal
tepkime, atomların yeniden düzenlenmesinden ibarettir ve sistemden
hiçbir atom kaybolmuyorsa, tepkime sırasında toplam kütle sabit
kalacaktır (Kütlenin korunumu)
İkincisi, bir elementin tüm atomlarının kütlesi ve özelliği aynıdır.
Eğer bir elementin tüm atomları kütlece aynı ise Bileşik nasıl elde
edilirse edilsin. bileşiğin kütlece yüzde bileşimi aynıdır. (sabit oranlar)
NO2 ile N2O
Katlı oranı 4/1
N2O ile N2O3
Katlı oranı 1/3
NO2 ile N2O4
Katlı oran.Kanuna Uymaz
C2H4 ile C3H6
Katlı oran.Kanuna Uymaz
NO2 ile H2O
Katlı oran.Kanuna Uymaz
D.Sabit Hacimler Kanunu
Dalton'a göre eğer iki element birbiriyle yalnızca bir bileşik veriyorsa bu
bileşiğin molekülünde her bir atomdan bir tane bulunur. Bu ifade suyun
oluşumunu , NH3 ve NO2 gibi gazların oluşumlarını ve moleküllü taneciklerin
verdiği reaksiyonları açıklamada yetersiz kalır.
NO
+
O2
→
2NO
1 Hacim
1 Hacim
2 Hacim Dalton'un ifadesi bu
reaksiyonu açıklar ancak aşağıdaki reaksiyonları açıklamada yetersiz
kalır.
ÖRNEK A
N2
+
3H2
1 Hacim
→
2NH3
3 Hacim
2 Hacim
ÖRNEK B
2H2(g)
+
02(g)
→
2H20(g)
2 Hacim
1 Hacim
2 Hacim bu tür reaksiyonların
açıklanması Joseph Gay-Lussac tarafından gerçekleştirilmiştir
Joseph Gay-Lussac,
Kimyasal reaksiyonlara giren maddelerim kütleleri arasında sabit bir
oranın bulunduğunu inceledik.Benzer şekilde bu maddeleri hacimleri
arasında da sabit bir oran vardır.Sadece gazlara uygulanan ve Gay Lussac
tarafından önerilen Hacim Oranları Kanunu şu şekilde tanımlanabilir.
"Kimyasal reaksiyona giren gaz halindeki element ya da bileşiklerin aynı
basınç ve sıcaklık şartlarında hacimleri arasında tam sayılarla gösterilen bir
oran vardır.Reaksiyon ürünü de gaz halinde ise ürünün reaksiyona giren
gazlardan herhangi birinin hacmi arasında da sabit bir oran vardır."
Örnek 1
N2
1V
+
3H2
3V
VN2 / VH2 =1/3
→
2NH3
2V
VN2 / VNH3 =1/2
VH2 / VNH3 =1/3
Örnek 2
2H2(g)
+
02(g)
→
2H20(g)
VH2 / VO2 =2/1
VH2 / VH2O=2/2= 1/1
VO2 / VH2O =1/2
Örnek soru:
I- 1 litre Bütanı (C3H8) yakmak için 25 litre hava gerekir.
II- 1 Litre bütanın yanması sonucu 3 litre CO2 ve 4 lt H2O (su buharı)
oluşuyor .
III- Havanın hacimce 1/5 'i oksijendir.
8 litre Bütanı ve 25 litre Oksijen reaksiyona girdiğinde
A) Hangi gazdan kaç litre artar?
B) Kaç litre CO2 ve kaç litre H2O oluşur?
C) Reaksiyon sonucunda oluşan tüm gazların toplam hacmi nedir?
D) Hacim değişimi ne kadardır?
ÇÖZÜM :
A) Havanın 1/5 i Oksijen olduğuna göre 1 lt Bütan ile reaksiyona
giren bütanın hacmi
25x 1/5= 5 litredir.
5 Litre oksijen 1 litre bütan ile birleşirse
25 lt oksijen ile;
25x1/5= 5 litre bütan ile birleşir.
Bu durumda bütandan;
8-5= 3litre artar
B) Bir litre bütan yandığında 3 litre CO2 ve 4 lt H2O (su buharı)
oluştuğuna göre;
5 litre bütan yandığında ise
5x3= 15 litre CO2
5x4= 20 litre H2O (su buharı) oluşur.
C) Reaksiyondan sonraki toplam hacim =artan bütan +oluşan CO2 +
oluşan H2O (su buharı)
3+15+20=38 Litre
D) Başlangıç hacmi =8 litre bütan +25 litre Oksijen = 13 litre
Son hacim 38 litre
Hacimdeki artış= 38-13= 15 litredir.
Amedeo Avagadro ;“Aynı sıcaklık ve basınçta, gazların eşit hacimlerinde
eşit sayıda atom ve molekül içerir.” diyerek, Avagadro hipotezini ortaya attı.
Avagadro gaz halinde bulunan atomların 2 atomlu halde yani moleküler halde
olabileceğini savundu. Dolayısıyla kimya tarihine bu şekilde “molekül” kavramı da
girmiş oldu.
Amedeo Avagadro'ya göre
1- Aynı sıcaklık ve basınçta, farklı gazların eşit hacimlerinde eşit
sayıda atom veya molekül vardır.
2- Aynı sıcaklık ve basınçta, farklı gazların eşit sayıdaki molekülleri
eşittir
Örnek 1
N2
+
1 Hacim
3H2
→
3 Hacim
2NH3
2 Hacim
1 molekül
3 molekül
2 molekül
Örnek 2
2H2(g)
+
02(g)
→
2H20(g)
2 Hacim
1 Hacim
2 Hacim
2 molekül
1 molekül
2 molekül
Sayfa başı
III. BÖLÜM: Kimyasal bağ Kavramının Gelişimi
1-Kimyasal Bağın Tarihsel Gelişimi
Democritus, (M.Ö. 460 - 370)lü yıllarda yaşamış "Atom veya
bölünmeyen öz" teorisi ile ünlenmiştir. Buğdayın bölünerek una dönüşmesi,
büyük kum taneciklerinin ufalanmasını, hatta en saf madde olan altının bile
aşınmasını görüyor, öyleyse atom; “maddelerin bölünemeyen en küçük
birimi olmalıdır,” fikrine götürüyordu. Ona göre hareket, hem maddelerin
hem de onların en küçük tanecikleri olan atomların özelliğidir. Atomların bir
arada tutularak maddeyi oluşturduğunu var sayıyordu. Demokritos’a göre
bütün maddelerin atomları aynı, ancak atomların dış yapıları farklıydı.
Örneğin suyun atomları pürüzsüz olduğundan kaygan ve akışkan, demir
atomları sert ve pürüzlü olduğundan bir birlerine yapışıklardı.
Empedokles, (M.Ö. 490-430),Aristo ile aynı düşünceleri paylaşan
Empedokles, kendinden önceki doğa düşünürlerinin temel öğe (arkhe)
olarak belirlediği, su, ateş ve havaya toprak öğesini de ekleyerek, hepsini
bir arada kullanan ilk düşünür olmuştur. Empedokles'e göre bu dört temel
öğe, sevgi ve nefret (iticilik) gücü ile birleşip ayrılırlar. Bir başka deyişle
sevgi ve nefret de, maddeyi meydana getiren temel öğelerdendir ve
değişimleri açıklamak için kullanılmışlardır.
Empedokles'in iki önemli düşüncesi vardır: Bunların ilki, temel öğenin
birden fazla olduğunu kabul etmesidir. Kendisinden önceki düşünürlerin öne
sürdüğü temel öğeler su, hava ve ateşti. Empedokles ise bunlara bir de
toprak öğesini eklemiştir. Diğeri ise ;" bu dört öğe baştan beri vardır. Bunlar
ne değişir ne de yok olur, yani başlangıcı ve sonu yoktur. Evrende bunların
miktarları hep aynı kalır. Her şey bu dört öğenin belirli birleşmelerinden
oluşur"der Empedokles'in kendisinden sonra gelen düşünürler arasında
özellikle Aristoteles üzerinde etkisi olmuştur
Aristoteles'e göre her maddenin atomu aynı olmasına karşılık madde
içindeki atomların yerleşimi ve düzeni değiştiğinde yeni bir madde
oluşmasına neden oluşuyordu.O'na göre atomlar harflere benziyordu ve
yerleri değiştirildiğinde harflerle nasıl yeni kelime yada cümle yada bir kitap
yazılabiliyorsa,atomların da yerlerinin değiştirilmesi maddelerin farklı
formlarını oluşturuyordu.
Eskiden bilim insanlarının atomları bire arada tutan onların çengelli
yapıya sahip olmalarıydı:Bu modele çengelli iğneler modeli denir.. Atomlar
bu çengeller sayesinde tutunarak bağları oluşturuyordu.Günümüzde bunun
tamamen yanlış olduğu bilinmekte ver günümüz modelleri ile
uyuşmamaktadır.
Suyun çengelli iğne modeli
Dalton'un atomları bölünemez ve içi dolu küreler olarak benimsemesi. Atom
modellerinin hızla gelişmesine bir başlangıç oluşturmuştu.Birbirine benzeyen
atomların birbirini itmesi gerektiğini savunmuştu.Oysa günümüzde atomları bir
arada tutulmasını sağlayan kimyasal bağların oluşumunda negatif yüklü
elektronların rol aldığı bilinmektedir. .
Bağ kavramındaki gelişmeler, Avagadro’ nun bazı atomların molekül
şeklinde bulunabileceğini açıklamasıyla hız kazandı. "İki atom bir arada
bulunuyorsa mutlaka bu atomları bir arada tutan bir kuvvet olmalı" fikri bilim
adamlarının ilgilerinin bu konuya odaklanmasına neden oldu
Bu gün biliyoruz ki kimyasal bağ; atomların elektron alış verişleri ve ya
ortaklaşa kullanmalarıyla oluşmuştur.
2-Maddenin Halleri ve Kimyasal Bağlar:
Aşağıdaki şekilde aynı şartlarda suyun katı,sıvı ve gaz hali bir arada
görülmektedir.
Aynı maddenin, aynı şartlarda farklı formlarda bir arada tutan nedir?
Bunlar; Katı, sıvı ve gaz halleridir. (plazma hali özel bir haldir)
Şekil a-SUYUN KATI-SIVI-GAZ HALLERİ BİR ARADA
Şekil b-Isı değişimi ile hal değişimi
Şekil c- KATI
SIVI
GAZ
Şekil c de de görüldüğü gibi katılarda moleküller birbirine daha yakın,
sıvılarda moleküller birbirine daha uzak, gazlarda ise moleküller tamamen
bağımsızdır. Bunun sebebi; moleküller arsındaki çekim kuvvetinin farklı
olmasıdır.Bu maddelerin molekülleri arasındaki çekim kuvveti azaltılırsa
sıvı ya da gaz haline geçebilir. Bunu daha iyi anlamak için şekil b
incelenmelidir. Maddenin kazandığı enerji maddede nerede saklanır?
Maddenin bıraktığı enerji nereden gelmektedir?
Maddenin katı ve sıvı halleri sahip oldukları enerjilere göre farklılıklar
gösterirler .Katı maddeler en az enerjiye sahiptir.Bu yüzden molekülleri
birbirine çok yakındır.Madde katı halden sıvı hale geçerken dışarıdan enerji
alır ve aldığı bu enerji ile molekülleri daha uzak konumunda durabilir.Sıvı
molekülleri katı moleküllerine göre birbirlerinden daha uzakta
dururlar.Madde sıvı halden gaz haline geçerken enerji alırlar.Aldıkları bu
enerji gaz moleküllerini birbirinden daha da uzaklaştırır.Hatta birbirinden
bağımsız hareket ederler.
Moleküllerin bu davranışlarını gözlemlemek için resimlerin altındaki KATI-SIVIGAZ kelimelerine tıkla .
KATI
SIVI
GAZ
Benzer biçimde atomlar ve iyonlar arasında kuvvetler vardır. Atom ve
iyonları bir arada tutan bu kuvvetlere kimyasal bağ denir.Atomları
molekülde bir arada tutan bağlar ( H2O molekülündeki H ve O atomu nu bir
arada tutan bağlar gibi), molekülleri bir arada tutan kuvvetlere göre (bir
bardak su içindeki moleküllerin bir arada durmasını sağlayan kuvvetler gibi)
daha kuvvetlidir.
Atomlar bileşik oluştururken ya elektron vererek pozitif yüklü hale
geçerler,ya da elektron alarak negatif yüklü hale geçerler.Negatif ve pozitif
yüklü bu taneciklere iyon adı verilir.Elektron veren atom verdiği elektron
sayısı kadar + yükle yüklenir.Elektron alan atom aldığı elektron sayısı kadar
- yükle yüklenir
Pozitif yüklü iyonlara katyon,negatif yüklü iyonlara anyon denir.
Atomlar bileşik oluştururlarken son katmandaki elektronlarını kullanırlar
bu elektronlara değerlik elektronları denir.Atomlar bileşik oluştururlarken
son katmanındaki elektron sayılarını dublet kuralına , ya da okted kuralına
uyarlar.
Dublet kuralı: Atomlar son katmanında bulunan elektronlarını, elektron
alarak veya elektron vererek kendinden bir sonraki yada bir önceki He
atomunun elektron dizilişine benzetirler.
Okted kuralı:Atomlar son katmanında bulunan elektronlarını, elektron
alarak veya elektron vererek kendinden bir sonraki yada bir önceki Soy
gaz atomunun elektron dizilişine benzetirler ve Ne Ar,Kr,Xe,Rn soy
gazlarının elektron dizilişine uyarlar
Değerlik elektronları atomun hangi yükseltgenme basamağına sahip
olacağını belirler.Atomlar değerlik elektronlarını alır,verir yada ortaklaşa
kullanarak farklı bağların oluşmasını sağlarlar.Böylece oluşan maddelerinde
sayısı ve çeşidi artar.
Öğrendiklerimizi aşağıda verilen tabloda periyodik cetvelin bir kısmındaki
atomlar yer almaktadır.Atomların üzerine tıklayarak katman elektronlarını
inceleyin
Periyodik Cetveldeki 11 Elementin Katman elektron dağılımı
IA
VIIIA
1
H
1.01
3
Li
6.94
11
Na
22.99
IIA
4
Be
9.01
IIIA
IVA
VA
VIA
2
He
VIIA 4.00
5
6
7
8
9
B
10.81
C
12.01
N
14.01
O
16.00
F
19.00
10
Ne
20.18







