Amino Asitler,
Peptidler ve Proteinler
Dr. Serkan SAYINER
[email protected]
2
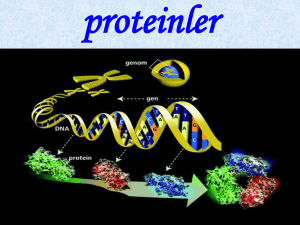
Genel Bakış
Proteinler, canlı organizmanın çok önemli bir bölümünü
oluştururlar.
Protein kelimesi Yunanca’ da «önde gelen» anlamına
gelir.
Yapılarında C, H, O ve N mutlaka taşırlar. Yaşam için son
derece önemlidirler.
Yaşamın başlıca özelliklerinden olan büyüme, çoğalma
ve kendi kendini onarma olaylarının proteinlerle ve
proteinlerle çok önemli bileşikler oluşturan nükleik
asitlerle yakın ilişki vardır.
3
Genel Bakış
Bitkiler, karbondioksit, su ve anorganik azot gibi
bileşiklerden proteinleri sentez ederler. Hayvanlar ise
bunu yapamazlar. Hayvanlar, protein gereksinimleri için
bitkilere muhtaçtırlar.
Proteinler büyük moleküllü maddelerdir.
Şekilleri lifsel, oval veya küresel olabilir.
Yapı taşları amino asitlerdir.
• Proteinler amino asit polimerleridir. Sentezlerini belirleyen
genetik şifredir.
• Proteinlerin sentezinde 20 amino asit kullanılır.
4
Genel Bakış
Protein sentezinde kullanılan amino asitlerin ~yarısı ara
metabolik ürünler olarak sentez edilirken, bazılarının
besin maddeleri ile alınması gereklidir.
Protein molekülünde oranla C % 45-55, H % 6-8, O % 2025, N % 15-17 arasında olabilir.
• N, protein için özel bir element gibi görülür.
◦ Ortalama molekülde % 16 oranında bulunur. Buradan yola çıkarak azot
miktarı tayini ile total protein miktarı hesaplanabilir.
Değişik dokularda çok değişik proteinler bulunur.
• Vücutta sentez edilen her bir protein yapısal ve fonksiyonel
olarak benzersizdir.
5
Genel Bakış
Hücrelerin, dokuların, organların ve organ sistemlerinin
bireyselliğini karakterize eden süreçlere katılırlar.
Bir hücre her biri farklı fonksiyona sahip binlerce protein
içerir. Örnek olarak,
◦
◦
◦
◦
◦
◦
◦
Enzimler; Yaşayan hücrelerde her reaksiyon enzime ihtiyaç duyar...
Transport proteinler; Lipoproteinler, transferrin...
Bilirubin-bağlayıcı proteinler,
Depo proteinleri; myoglobin...
Savunma proteinleri; pıhtılaşma, immunoglobulinler...
Kontraktil proteinler; aktin, miyosin, troponin...
Yapısal proteinler; kolajen, elastin... verilebilir.
6
Bazı Doku ve Besinlerdeki Protein Oranları
Besinler
Oranı %
Besinler
Kaslar
18 – 20
Marul
1,2
6,5 – 7,5
Lahana
1,6
Beyin
8
Patates
2
Yumurta sarısı
15
Badem
21
Yumurta akı
12
Meyveler
İnek Sütü
3,3
Kurufasulye
Kan plazması
Peynir
14 - 49
Soya fasulyesi
%
0,4 – 1,5
18-22
37
7
Amino Asitler
D- ve L-Formları, Sınıflandırılması, Esansiyel Amino Asitler, Modifiye Amino Asitler,
Non-protein Amino Asitler, Fiziksel ve Kimyasal Özellikleri
8
Proteinlerin Hidrolizi
Proteinler, asitlerle, alkalilerle veya enzimlerle hidrolize
edildiğinde amino asit’ lere parçalanırlar.
Moleküllerinde amino (-NH2) ve karboksil grubu (COOH) bulunan bileşiklere amino asit denir.
Amino asitlerin yapısında bir karbonunun 4 valansına 4
farklı grup bağlanmıştır.
1.
2.
3.
4.
Karboksil grubu
Amin grubu
Hidrojen
R grubu
9
Amino Asitlerin Genel Yapısı
Amino Grubu
(NH2)
Karboksil Grubu
(COOH)
R Grubu(Yan zincir)
10
Proteinlerin Hidrolizi
Amino asitler kısaca tek karf veya üç harf ile gösterilir.
• Örneğin Glisin; Gly veya G
Sadece en basit amino asit olan glisin de R grubu H’ dir.
• Glisin ilk izole edilen amino asittir (1820).
• En son tespit ve izole edilende Treonine’ dir (1935).
Amino asitlerdeki karboksil grubuna en yakın karbon
atomuna α-karbon atomu denir.
İki aminoasit dışında amino asitlerde NH2 grubu α-karbon
atomuna bağlı olduğundan bu amino asitlere α-amino
asitler denir.
11
Proteinlerin Hidrolizi
Amino asitler, aralarında peptid bağı denen asit amid
bağı ile birbirileriyle bağlanarak proteinleri meydana
getirirler.
Protein molekülü hidrolize olduğunda sadece amino
asitleri veriyorsa basit protein, aminoasitlerle birlikte
başka moleküllerde veriyorsa konjuge protein veya
proteid adı verilir.
12
Kaynak: W.H. Freeman and Company 2012. Biochemistry, 7th ed.
13
Amino Asitlerin Sınıflandırılması
Amino asitler özelliklerine göre çeşitli şekillerde
sınıflandırılmaktadır. En yaygın sınıflandırma, nötral
amino asitler, asidik aminoasitler ve bazik amino
asitlerdir.
Diğer bir sınıflandırma bir yolu moleküllerinde bulunan
amino ve karboksil grupları sayısına göredir.
•
•
•
•
Mono-amino mono-karboksilik asitler,
mono-amino di-karboksilik asitler,
di-amino mono-karboksilik asitler,
di-amino di-karboksilik asitler.
14
Amino Asitlerin Sınıflandırılması
Amino asitler, moleküllerinde bulunan zincir ve halka
yapıları esas alınarak da sınıflandırılır. Alifatik
aminoasitler, aromatik aminoasitler, heterosiklik
amino asitler.
Sınıflandırmada Amino asitler;
• Zincir ve halka yapılarında göre alifatik, aromatik ve
heterosiklik aminoasitler diye üç gruba ayrıldıktan sonra kendi
içlerinde de asit, baz ve nötr reaksiyon gösterdiklerine göre ve
kükürt ihtiva ettiğine bakılarak tekrar bir alt sınıflandırma
yapılır.
15
Amino Asitlerin Sınıflandırılması
Alifatik Amino Asitler
• Nötral amino asitler: Glisin, Alanin, Valin, Serin, Treonin,
Lösin, İzolösin
• Asidik amino asitler: Aspartik asit, Asparajin, Glutamik asit,
Glutamin
• Bazik amino asitler: Arjinin, Lizin, Hidroksilizin
• Kükürt taşıyan amino asitler: Sistein, Sistin, Metiyonin
Aromatik Amino Asitler
• Tirozin
• Fenil alanin
Heterosiklik Amino Asitler
•
•
•
•
Tiroptofan
Prolin
Histidin
Hidroksiprolin
16
Amino Asitlerin Sınıflandırılması
Bir diğer sınıflandırılmada;
• Hidrofobik Amino Asitler
◦ Alifatik yan zincirli
◦ Aromatik yan zincirli
◦ Dallı zincirli amino asitler(Branched-chain amino acids)
• Hidrofilik Amino Asitler
◦ Yüksüz (uncharged) yan zincirli
◦ Yüklü (charged) yan zincirli; Bazik ve Asidik amino asitler.
• Ne Hidrofilik ne de Hidrofobik Amino Asit
17
Hidrofobik Amino Asitler
Hidrofobik amino asitlerin yan zincirleri suyla iyi
etkileşime girmez ve bu nedenle genellikle proteinlerin
iç kısmına doğru bulunurlar.
Metiyonin ve sisteindeki kükürt atomları ve
triptofandaki azot atomu haricinde büyük oranda
hidrokarbonlardan oluşurlar.
Sistein'in -SH grubu, disülfid (-S-S-) bağı yoluyla
dimerize olmasına izin verdiğinden, bu amino asit,
sıklıkla proteinlerinde oksitlenmiş formunda bulunur. Bu
oksitlenmiş form sistindir.
18
Hidrofobik Amino Asitler
Sistin polipeptit zincirlerinin farklı bölgelerini kovalent
olarak bağlanır. Böylece proteinleri dengeler ve
denatürasyona daha dayanıklı hale getirir.
Prolin genellikle hidrofobik olarak kabul edilir,
katlanmış polipeptit zincirlerinin kıvrım bölgelerinde
sıklıkla bulunur ve özellikle kolajende görülür.
Prolin glutamatın siklizasyonu yoluyla oluşturulabilir.
19
Alanin
Sistein
(Cys veya C)
Metiyonin
(Met veya M)
(Ala veya A)
Prolin
(Pro veya P)
Hidrofobik, Alifatik Yan
Zincirli Amino Asitler
(İmino asit)
20
Sistein
Sistein
(Cys veya C)
(Cys veya C)
Sistin
21
Hidrofobik Amino Asitler
Aromatik amino asitler (AAA) kategorisinde fenilalanin,
tirozin ve triptofan bulunur.
Fenilalanin içindeki R grubu bir benzen halkası içerir,
tirozin içinde bir fenol grubu bulunur ve triptofandaki R
grubu bir indol olarak bilinen heterosiklik bir yapı içerir.
Bu üç amino asitte aromatik kısım α-karbona bir metilen
(-CH2-) köprüsü vasıtasıyla bağlanmaktadır.
22
Hidrofobik Amino Asitler
Aromatik amino asitler önemli hepatik metabolitlerdir.
Hidrofobik olsalar da, tirozinin fenol (-OH) grubu ve
triptofanın indol grubundaki -NH, suyla etkileşime
girmelerine izin verir, böylece özelliklerini biraz belirsiz
hale getirir.
23
Fenilalanin
(Phe veya F)
Tirozin
(Tyr veya Y)
Triptofan
(Trp veya W)
Hidrofobik, Aromatik Yan
Zincirli Amino Asitler
24
Hidrofobik Amino Asitler
Valin, Lösin ve İzolösin dallı zincirli amino asitlerdir
(BCAA).
Her biri bir metil grubu (substitüent olarak) içeren
alifatik yan zincir taşır.
Yüksek yapılı hayvanlarda diyetle alınmalıdırlar. Bir
başka deyişle esansiyeldirler. Bu canlılarda sentezi için
gerekli enzimler bulunmamaktadır.
Birçok dokuda bulunmasına rağmen, BCAA'lar özellikle
açlığın son evresinde enerji amaçlı yoğun şekilde kas
doku tarafından katabolize edilirler.
25
Valin
Lösin
(Leu veya L)
İzolösin
(Ile veya I)
(Val veya V)
Hidrofobik, Dallanmış Yan
Zincirli Amino Asitler (BCAA)
26
Hidrofilik Amino Asitler
Pozitif yüklü yan zincirlere sahip amino asitler, histidin,
lizin ve arjinin gibi bazik amino asitler içerir.
Histidin sadece fizyolojik pH'da zayıf yüklüdür.
Aksine, negatif yüklü yan zincirlere sahip amino asitler
asidiktir ve glutamik asit ile aspartik asitleri içerir
(glutamat ve aspartat olarak bulunur).
27
Hidrofilik, Yüklü
Yan zincirli
Asidik Amino Asitler
Aspartat
Glutamat
(Glu veya E)
(Asp veya D)
28
Hidrofilik, Yüklü
Yan zincirli
Bazik Amino Asitler
Histidin
(His veya H)
Lizin
(Lys veya K)
Arjinin
(Arg veya R)
29
Hidrofilik Amino Asitler
Alanin’ in hidroksillenmiş bir versiyonu olan serin ve
treonin yüklü olmayan yan zinciri bulunur ve –OH grubu
içerir. Bu nedenle hidrojen bağlarının oluşması
neticesinde su ile güçlü etkileşime girer.
Hidroksilasyona uğramamış yakın ilişkili diğer amino
asitlere (alanin ve valine) kıyasla çok daha hidrofilik
(dolayısıyla su seven) yapıdadırlar.
30
Hidrofilik Amino Asitler
Asparajin ve glutamin’ in yüklenmemişyan yan
zincirleri, daha fazla hidrojen bağlama kapasitesine
sahip amid gruplarına sahiptir.
Bununla birlikte, asparajin ve glutamin, asit veya baz
ile non-amid formlarına (aspartik asit ve glutamik asit)
kolaylıkla hidroliz edilir.
Bu dokuz amino asitin hepsi hidrofiliktir ve bu nedenle
su ile olumlu etkileşim içindedir. Sıklıkla yan zincirlerin
sulu bir ortama maruz bırakıldıkları protein yüzeyinde
bulunurlar.
31
Serin
Asparajin
(Asn veya N)
(Ser veya S)
Glutamin
(Gln veya Q)
Treonin
(Thr veya T)
Hidrofilik, Yüksüz
Yan zincirli
Amino Asitler
32
Glisin
Ne Hidrofilik ne de Hidrofobik bir amino asittir.
Yan zincir içinde sadece bir hidrojen atomuna sahip olan
glisin, bilinen en basit amino asittir ve hidrofobik ya da
hidrofilik değildir.
Basit yapısından dolayı, polipeptid zincirlerindeki birçok
boşluğa sığabilir ve bu nedenle protein moleküllerinin
hem yüzeyinde hem de iç kısmında bulunur.
33
Ne Hidrofilik ne de
Hidrofobik
Amino Asit
Glisin
(Gly veya G)
34
Esansiyel Amino Asitler
Organizmaya alınan proteinlerin barsaklardan emilmesi
için amino asitlere parçalanması gerekir. Barsaklardan
emilen amino asitler kan yolu ile dokulara gider ve
protein sentezinde kullanılır.
Bitkiler, mikroorganizmalar ve mantarlar ototrofturlar.
Beslenmeleri için amino asitlere ihtiyaç göstermezler.
Kendileri sentezleyebilir.
Gelişmiş organizmalar ise heterotrofdur. Bir kısım amino
asitleri dışarıdan almak zorundadırlar. Bu organizmalar
amino asitlerden protein sentezini kendileri
gerçekleştirebilir.
35
Esansiyel Amino Asitler
Organizma tarafından sentez edilemeyen ve besinlerle
birlikte dışarıdan alınmaları gerekli olan amino
asitlere esansiyel amino asitler veya eksojen amino
asitler denir.
Amino asit karşıtı olan α-ketoasidi oluşturabiliyorsa o
asit metabolizmada sentez edilebilir ve esansiyel
değildir.
Kurufasulye, etten daha çok protein içerir ama et kadar
değerli değildir. Neden ?
• Çünkü; gerektiği kadar esansiyel amino asit içermez.
36
Esansiyel Amino Asitler
Eğer bir esansiyel amino asit noksansılığı söz konusu ise
geri kalan 19 amino asit protein sentezi için
kullanılamaz. Bununla birlikte katabolize olurlar ve
negatif azot dengesi ortaya çıkar.
Esansiyel amino asitler hayvanlar arasında farklılıklar
gösterirler. Bazı türler için esansiyel olan amino asitler,
bazı türlerde esansiyel amino asit olmayabilir.
Ayrıca yaşa bağlı olarak da değişkenlik gösterir.
37
Esansiyel Amino Asitler
Lizin
Triptofan
Fenilalanin
Lösin
İzolösin
Treonin
Metiyonin
Valin
Histidin
Gençlerde
Arjinin
Glisin
Glutamik Asit
İNSAN
KÖPEK
SIÇAN
DOMUZ
TAVUK
38
Esansiyel Amino Asitler
BCAA’ lar kas dokuda devamlı okside olurlar.
Fenilalanin, tirozin biyosentezi için gereklidir. Dolayısı
ile katekolaminler ve tiroid hormonları için gereklidir.
Metiyonin, sistein formasyonu için gereklidir.
Triptofan, serotonin ve melatonin biyosentezi için
gereklidir.
Esansiyel olmayanlar ise çoğunlukla metabolizma
sırasında enzimler (aminotransferazlar) tarafından
dönüştürülmek suretiyle elde edilir.
39
Modifiye Amino Asitler
Protein yapısında bazı modifiye amino asitler yer
almaktadır.
Metilhistidin ve metillizin, histidin ve lizinin metil
deriveleridir ve bazı proteinlerin yapısında yer alır.
Hidroksiprolin, prolin derivesidir. –ProlinHidroksiprolin-Glisin- şeklinde (tripeptid) kolajen
yapısında yer alır.
•
•
•
•
Kolajen fibröz bağ doku proteinidir.
Kan damarları, tendonlar, kıkırdak ve kemik dokuda bulunur.
Memeli canlılardan en çok bulunan proteindir.
Total vücut proteininin ~%30’u, vücut ağırlığının ~%6’ sı
kolajendir.
40
41
Modifiye Amino Asitler
Hidroksilizin, lizinin 5-hidroksi türevidir ve kolajen
yapısında bulunur.
Dezmosin ve izodezmosin, 4 lizin molekülün
oksidayon ve çapraz bağlanması ile oluşur.
• Bağ dokuda bulunan elastin isimli proteinin yapısında yer alır.
• Kollajen ile birlikte düz kas içeren dokularda (kan damarları
gibi) bulunur.
• Elastin iki yönlü esneme özelliğine sahiptir.
• Arterler, venalara göre daha çok elastin içerir.
42
43
44
Modifiye Amino Asitler
Treonin, tirozin ve serin amino asitlerinin yan
zincirlerinde bulunan hidroksil gruplarının fosforile
olması ile fosfotreonin, fosfotirozin ve fosfoserin
oluşur.
• Bu üç derive amino asit, özellikle düzenleyici proteinlerin
yapısında yer alır.
γ-Karboksiglutamat, karaciğerde glutamik asidin
karboksilasyonu ile sentez edilir.
• Bu amino asit, pıhtılaşma faktörlerinden bir olan protrombinin (faktör
II) yapısında yer alır.
• Kalsiyum şelasyonunu sağlamaktadır.
45
46
Non-protein Amino Asitler
Protein yapısına katılan 20 amino asit dışında bulunan
amino asitlerde bulunmaktadır. Bu amino asitler protein
yapısına katılmazlar.
Metabolizma sırasında önemli ara metabolitler veya
öncü (precursor) moleküllerdir.
• β-Alanin, pantotenik asidin (B5 vitamini) yapı bileşenidir.
◦ Bu vitamin de koenzim A’nın yapı bileşenidir.
• Homosistein ve homoserin, metiyonin metabolizmasında
önemli ara maddelerdir.
• Ornitin ve sitrulin, hepatik üre siklüsünda yer alırlar ve arjinin
sentezinde önemli ara maddelerdir.
47
Non-protein Amino Asitler
• Taurin, sisteindeki sülfidril grubunun oksidasyonu ve daha
sonra karboksilasyonu ile oluşur.
◦ Kediler, yeteri kadar sentezleyemedikleri için diyetle almak
durumundadırlar, yani kediler için esansiyel amino asittir.
◦ Kedilede taurin yetmezliğine bağlı olarak retinal dejenerasyon, körlük,
üreme bozuklukları, büyümede yavaşlama ve iskelet deformiteleri
görülür.
• γ-Aminobütirik Asit (GABA), merkezi sinir sisteminde
nörotransmitter inhibitörüdür (glisin ile birlikte).
◦ Başlıca substansia nigra, globus pallidus ve hipotalamusda bulunur.
◦ Alkol, barbitüratlar ve benzodiazepanlar GABA etkisini özellikle
postsinaptik bölgelerde artırırlar.
48
Non-protein Amino Asitler
49
Amino Asitlerin Fiziksel Özellikleri
Çözündükleri Ortam
Su
Asit
Alkali
Etanol
Eter
Çözünürlük Durumları
+
+
+
±
-
Erime Noktaları: 200° C hatta bazen 300° C’ de erirler.
Tatları
Tatsız
Acı
Tatlı
Löysin
İzolöysin, Arjinin
Diğerleri
50
Amino Asitlerin Fiziksel Özellikleri
Amfolit Yapıları
• Aminoasitler, amin grubu ile birlikte karboksil grubuda
taşıdıkları için, aynı zamanda hem asit hem de bazdırlar.
• Amino asitlerin α-karbon atomu fizyolojik pH’ da;
◦ H, R grubu, protonsuz COO- ve protonlu NH3+’ e bağ yapar.
◦ Prolin’ de ise bir farklılık bulunur. Amino grubu yerine imino grubu
(NH2+) içerir.
• COOH grubu alkalik ortamda H iyonları vererek -COO(karboksilat anyonu) ve H+ iyonlarına dissosiye olur.
• NH2 grupları ise asit ortamda H iyonlarını alır ve pozitif yüklü
-NH3+ gruplarına (amonyum katyonu) değişir.
51
Amino Asitlerin Fiziksel Özellikleri
• İzolelektrik noktalarında (fizyolojik
pH’da) H iyonları, COOH grubundan, NH2
grubuna geçer. Yani COOH grubu H iyonu
verdiği için negatif yük taşıyan bir COOgrubu ve, bu H’i aldığı için yükü pozitif
olan NH3+ grubu ile yan yana bulunur.
• Hem pozitif hem de negatif yük taşıyan
iyonlara zwitterion denir. Zwitterion
oluşturabilen maddelere de amfolit
(amfoter) adı verilir.
Glisin
(Gly veya G)
52
Amino Asitlerin Fiziksel Özellikleri
• İyonizasyon durumları pH’ ya bağlı olarak değişkenlik gösterir.
• Alkali çözeltilerde (pH > 7.4), karboksilik grubu genellikle
iyonize formda kalır (-COO-). Buna karşın amino grubu
aniyonize olur (-NH2).
• Asidik çözeltilerde (pH < 7.4), karboksil grubu aniyonize (COOH) kalır, amino grubu ise iyonize formunu (NH3+) korur.
• Her bir amino asidin karboksil veya amino grubunun pK değeri
farklıdır. Bu farklılık; sıcaklık, iyonik güç ve mikroçevredeki
iyonize olabilen grupların varlığı gibi faktörlere bağlı olarak
ortaya çımaktadır.
53
Katyon
(asidik çözelti)
Zwitterion
(izoelektrik nokta)
Anyon
(alkali çözelti)
54
Amino Asitlerin Fiziksel Özellikleri
Optik Aktiviteleri
• Glisin hariç tüm amino asitler α-karbon atomlarına
sahiptirler ve bu nedenle optikçe aktifdirler.
• Ayna hayali iki form L-izomer ve D-izomer (enantiomer) söz
konusudur.
• D-gliserilaldehite benzeyen aminoasitler D-amino asit, Lgliseralaldehite benzeyen aminoasitlere de L-aminoasit denir.
Polarize ışığı sağa çevirirse (+), sola çevirise (-) ile gösterilirler.
• Bitki ve hayvanlarda hemen hemen tüm karbonhidratlar D
serisine ait iken, proteinlerdeki amino asitler L serisine
aittirler.
55
Amino Asitlerin Fiziksel Özellikleri
• D-amino asitleri ise genellikle
bakterilerin hücre duvarlarında
ve bazı antibiyotiklerde
bulunurlar (D-glutamik asit
vb).
• Bazı insekt larvalarından yada
krizalitlerinden elde edilen Dalanin ve yer solucanından
elde edilen D-serin diğer
örnekleri oluştururlar.
D-Form
L-Form
Fonksiyonel
grup sağda
ise
Fonksiyonel
grup solda
ise
56
H C
O
H C
OH
H C
HO
C
O
H
CH2OH
CH2OH
D-Gliseraldehit
L -Gliseraldehit
COOH
H C
H2N
R
D-Amino asit
COOH
NH2 C
H
R
L-Amino asit
Fischer projeksiyonuna göre;
• D-Amino asitlerde -NH3+
grubu sağ taraftadır. Bu
amino asitler doğada nadiren
görülür.
• L- Amino asitlerde -NH3+
grubu sol taraftadır. Doğada
yaygın olarak bu amino asitler
bulunur.
57
AYNA
L-Amino asit
D-Amino asit
58
59
Amino Asitlerin Kimyasal Özellikleri
Amino asit molekülünde 3 çeşit fonksiyonel grup vardır.
• Amino grupları
• Karboksil grupları
• R grupları
Amino asitlerin kimyasal özellikleride bu 3 gruba
bağlıdır.
60
Amino Gruplarının Reaksiyonları
Amino grubunun alkol ile inaktivasyonu
• Alkollü ortamlarda, amino grupları amonyum katyonlarına
(NH3+) değişmez. Bu olaya amino gruplarının alkol ile
inaktivasyonu denir.
• O halde alkollü ortamda amfoter değiller. Asittirler. Titre
edilebilir.
Sörensen Titrasyonu
• Amin asit çözeltisinde bulunan karboksil grubunun tayin edilme
yöntemidir. Bir çözeltideki amino asit miktarınının
saptanmasında kullanılır.
61
Amino Gruplarının Reaksiyonları
Amino grubunun aromatik asitlerle bağlanması
• Amino asitlerin aromatik asitlerle birleşmesi sonunda
çözünmeyen maddeler olur.
• Böylece zararlı maddelerin organizmadan atılması sağlanır. Ör.
Hippürik asit (Ot yiyenlerde üreden sonra idrarla atılan en
önemli azotlu maddedir).
Betain Reaksiyonu
• Amino asitler zwitter iyon durumunda iken,
NH3+ grubundaki 3 H yerine 3 CH3 grubu
geçmekle birlikte betainler oluşur. En basit
betain glikokolbetaindir.
62
Amino Gruplarının Reaksiyonları
Karbomino asit reaksiyonu
• Amino gruplarına, CO2 bağlanması ile karbamino asitler oluşur.
• Isıtılınca tekrar CO2 ve amino asite parçalanır. Hemoglobin,
CO2 ile karbamino asit meydana getirir ve CO2‘in dokulardan
akciğere taşınmasında önemlidir.
Ninhidrin Reaksiyonu
• Serbest amino gruplarının hepsi bu reaksiyonu verir (amino
asitler, peptidler, proteinler).
• Ninhidrin amino asitler için önemli bir nitel tayin yöntemidir.1
gramdan aza dahi hassastır. Pratik önemi büyüktür.
63
Amino Gruplarının Reaksiyonları
Nitrik asit reaksiyonu
• Amino asitler nitrik asit ile reaksiyona girerlerse amino
gruplarının azotu nitrik asidin azotu gibi serbest element
haline geçer.
• Diğer tarafdan amino grubunun yerine -OH grubu girer.
• Reaksiyonda her bir amino grubunda karşılık bir molekül azot
serbest hale geçer.
• Bu nedenle nitrik asit reaskiyonu, serbest amino gruplarının
miktarının saptanmasında kullanılabilir.
• Nitrik asit reaksiyonu; Van Slyke yöntemi de denir.
64
Amino Gruplarının Reaksiyonları
Üramin Asit Reaksiyonu
• Amino gruplarına bir üre molekülü eklenirse üramin asitler
oluşur.
• Amino asitlerin tanısında kullanılır.
Diketopiperazin oluşumu
• Amino asitlerin etil esterleri iki amino asit grubun taşıyan
anhidrid halka yapılarını oluşturmak üzere kondanse olurlar ve
sonuçta diketopiperazin oluşur.
Kaynak: Ası T. Tablolarla Biyokimya Cilt I
Amino Gruplarının Reaksiyonları
Amino asitlerin metal iyonları ile kelatlanması
• Amino grupları, Cu++, Co++, Mn++, Fe++ gibi bir çok ağır metal
iyonları ile kompleks kelatlar oluşturular.
65
66
Karboksil Gruplarının Reaksiyonları
Tuz oluşumu
• Amino asitler ağır metaller ile tuz oluşturabilir ve kolay
kristalize olurlar.
• Özellikle Cu ile oluşan tuzlar kolay kristalize olur. Bu özellik,
amino asitlerin saf elde edilmesinde yaralanılır.
Esterleşme
• Alkol ile susuz hidroklorik asit eşliğinde reaksiyona girerlerse
esterlerini meydana getirirler.
• Amino asitlerin esterlerinden, bunların fonksiyonel
distilasyonunda yararlanılır.
67
Karboksil Gruplarının Reaksiyonları
**Amino asitlerin dekarboksilasyonu
• Amino asit molekülünden karbondioksit ayrılması olayına
verilen addır. Böylece aminler meydana gelir.
• Dokularda da amino asitler dekarboksile olarak aminleri
meydana getirirler.
• Ör; histidin’den histamin, lizin’ den kadaverin, ornitin’ den
putressin, tirozin’ den tiramin, triptofan’ dan triptamin.
• Anaerob mikroorganizmaların etkisiylede olur.
◦ Barsakdaki kokuşma olayı bundandır. Kadaverin ve putressin kokuşmuş
etlerde bulunan aminlerdir. Zehir etkileri azdır. Esas zehirli olan
bunları oluşturan mikroorganizmaların saldıkları toksinler.
Kaynak: Ası T. Tablolarla Biyokimya Cilt I
Amino asitlerin dekarboksilasyonu
Histidin
dekarboksilaz
Histidin
Histamin
68
69
R Gruplarının Reaksiyonları
Amino asitlerin «R» grupları çok değişken gruplarıdan
oluşur.
Grupların farklılığından dolayı değişik reaksiyonlar
meydana gelir.
Özellikle kendilerine has renk reaksiyonları verirler. Bu
renk reaksiyonları amino asitlerin birbirinden ayrılması
ve tanınmasını sağlarlar.
70
R-Grupları
Amino asit
Reaksiyon
Oluşan Renk
Reaksiyon özel
adı
Fenil
Tirozin, Fenilalanin
Hg(NO3)2 ve yoğun HNO3 ile ısıtma
Kırmızı
Millon Reaksiyonu
Fenil
İmidazol
Tirozin,
Fenilalanin,
Histidin
Alkalik ortamda, sulfanilik asit ve NaClO ile
işlemde
Kırmızı
Pauly Reaksiyonu
Guanidin
Arjinin
Alkaliortamlarda, α-naftol ve NaClO ile
işlemde
Kırmızı
Sakaguchi
tepkimesi
Serbest SH
Sistein
Seyreltik NH4OH çözeltilmiş Na nitroprussid
ile işlemde
Kırmızı
Nitroprussid
reaksiyonu
İndol
Triptofan
H2SO4 çözeltilmiş pdimetilaminobenzaldehit ile işlemde
Pembe
Ehrlich tepkimesi
Halkalı
amino asitler
Fenil alanin,
triptofan
İndol
Triptofan
Yoğun HNO3 ile Beyaz tortu
Isıtılınca
Sarı
Alkali ilavesinde Turuncu
Gliyoksilik asitle işlemden sonra yoğun
sülfirik asitle tabakalandırılırsa
Menekşe
halka
Ksantoprotein
reaksiyonu
Hopkins Cole
Reaksiyonu
71
Peptidler
Peptid Bağı, Oligo- ve Polipeptidler, Bazı önemli di-, oligo- ve polipeptidler,
Proteinlerdeki Amino Asitlerin birbirinden ayrılmaları ve miktar tayinleri
72
Peptid Bağı ve Oligo-Polipeptidler
Amino asitler asitamid bağı/peptid bağı ile polimerize
olarak proteinleri oluşturur.
Peptid bağları ile birbirine eklenen amino asitlerin sayısı
peptidin isimlendirilmesinde önemlidir.
•
•
•
•
2 ise dipeptid, 3 ise tripeptid
4 - 10 iseoligopeptid
10-100 arasında ise polipeptid
> 100 ise makropeptid
73
Peptid Bağı ve Oligo-Polipeptidler
Peptid zinciri oluşurken
amino asitlerden birinin
COOH grubu ile diğer
aminoasitin NH2 grubu
birleştiği için sonunda
muhakka bir COOH grubu ile
bir NH2 grubu serbest olarak
uçlarda kalacaktır.
• Uçlar kağıt üstünde; sol uçta
NH2 olacak şekilde gösterilir. N
terminal / C terminal
Serbest kalan NH2 grubuna
serbest amino grubu denir.
74
Bazı önemli di-, oligo- ve polipeptidler
Amino asitler
Özellikleri
Karnolin
β-alanin histidin
Dipetid. Kaslarda bulunur.
Anterin
β-alanin N-metil histidin
Dipeptid. Kaslarda bulunur.
Glutatyon
Glutamil sisteil glisin
Tripeptid. Oksidoredüksiyon’ da rol alır.
Bazı enzimlerin yapısında bulunur. Fe
emilimini kontrol eder.
Oftalmik asit
Glutamil aminobutiril glisin
Tripeptid. Göz merceğinde bulunur.
Non-oftalmik asit
Glutamil alanin glisin
Tripeptid. Göz merceğinde bulunur.
Oksitosin
8 amino asit
Oktapeptid. Hipofiz hormonudur.
Vazopressin
8 amino asit
Oktapeptid. Hipofiz hormonudur.
ACTH
39 amino asit
Hipofiz ön lob hormonu.
İnsulin
51 amino asit
Pankreas hormonu. Glikoz
metabolizmasında rol oynar.
Glukagon
29 amino asit
Pankreas hormonu
75
İnsulin
Pankreasın langerhans
adacıklarının β-hücreleri
tarafından salgılanır.
21 amino asitli A-zinciri, 30
amino asitli B-zinciri ve 31
amino asitli C-peptid
zincirinden proinsulin şeklinde
sentezlenir.
Aktif şeklinde C-peptid zinciri
yoktur.
76
77
Proteinlerdeki Amino Asitlerin birbirinden ayrılmaları ve
miktar tayinleri
Tirozin
• İzoelektrik noktada az çözündüğünden kolayca kristalize
edilerek ayrılabilirler.
Arjinin, Lizin, Histidin
• Bu amino asitler, protein çözeltisinden fosfotungstik asitle
çöktürülebildiğinden, toplam miktarları kolayca saptanabilir.
Tirozin, Triptofan
• Bu amino asitler renk reaksiyonları verebildiklerinden
kolorimetrik yöntemlerle miktarları kolayca saptanabilir.
Monoamino asitler
• Bu amino asitler etil esterlerine çevrilebildikleri için sonradan
fraksiyonlu destilasyon yöntemi ile birbirilerinden ayrılabilir.
78
Proteinlerdeki Amino Asitlerin birbirinden ayrılmaları ve
miktar tayinleri
Yöntemler
Kromatografik
Adsorpsiyon Yöntemi
-
Kağıt kromotografisi
İyon değişim kromotografisi
İnce tabaka kromotografisi
HPLC
Prensip
Çeşitli amino asitlerin değişik adsorbanlar tarafından farklı
derecede adsorbe edilmesi olayıdır. Asit karakterde amino asitler,
bazik adsorbanlar, bazik amino asitler ise asit adsorbanlar
tarafından tutulur.
İzotop seyreltme
yöntemi
Bilinmeyen bir amino asit karışımında, izotop atomu ile
işaretlenmiş, belli bir amino asitten bilinen miktarda ilave
edildikten sonra, bu karışımdan aynı amino asitin saf olarak elde
edilmesini takiben, ne ölçüde seyreltildiğinin saptanması olayıdır.
Mikrobiyolojik Yöntem
Bazı mikroorganizmaların üremesi için üreme ortamında belli
amino asitlerin belli miktarlarda bulunması gerektiği esasına
dayanan bir olaydır.
79
Proteinler
Protein molekülünde yapı, Genel nitelikleri, Sınıflandırılması (Yapılarına Göre:
Basit-Konjuge-Türev Proteinler; Fonksiyonel açıdan: Katalitik Proteinler, Taşıyıcı
Proteinler (transport proteinleri), Besleyici ve Depo Proteinler, Kontraktil Proteinler,
Yapısal Proteinler, Savunma Proteinleri, Fizyolojik Düzenleyici Proteinler),
Nükleoproteinler (DNA, RNA, ATP...), Kromoproteinler (Porfirinler, Safra renkli
maddeleri), İkterus (Sarılık), Organizmanın Sıvı ve Dokularındaki Başlıca Proteinler
80
Protein Molekülünde Yapı
Proteinler peptid zincirlerinden oluşurlar. Yani
polipeptid yapısındadır.
Protein yapısında n sayıda amino asit var ise, n-1
sayıda peptid bağı vardır.
Tam bir protein molekülü birbirini tamamlayan dört alt
yapı gösterir.
a)
b)
c)
d)
Primer Yapı
SekunderYapı
Tersiyer Yapı
Kuvarterner Yapı
81
Protein Molekülünde Yapı
Primer Yapı
• Belirli sayıda amino asidin, belli diziliş sırası ile sıralanarak
meydana getirdikleri zincir şeklindeki yapıyı ifade eder.
Sekunder Yapı
• α-Heliks: Peptid zincirinin bir eksen etrafında helezon
şeklinde kıvrılmasıyla meydana gelir.
• β-Heliks: İki veya daha fazla sayıda polipeptid zincirinin H
bağları ile birbirine birleşmesiyle meydana gelen yapıdır.
82
Protein Molekülünde Yapı
Tersiyer Yapı
• Heliks yapıların , —S—S— köprüleri ile katlanarak globüler ve
elipsoidal hale geçmesidir.
Kuarterner Yapı
• Primer, sekunder ve tersiyer yapılı tabakaların birleşmesi ile
oluşur.
• Benzer özelliklere sahip alt üniteler, salkımlar, topluluklar
yaparak dördüncü yapıyı oluşturur.
Kaynak: McDarby M.
83
84
Proteinlerin Genel Nitelikleri
Proteinlerin Tatları
•
Saf proteinler genellikle tatlıdır. Hidroliz ürünleri ise çoğunlukla acıdır.
Kokusu
•
Saf proteinler kokusuzdur.
Homojenite
•
Proteinlerin bir çoğu saf olmayıp, alt fraksiyonlara sahiptir.
Çözünürlük
•
•
•
Suda ve nötr tuzlu çözeltilerde çözünürler.
Eşit miktarda amonyum sülfat çözeltisinde çöken proteinlere globulin,
çökmeyenlere albümin denir.
Suda ve nötr tuz çözeltilerinde hiç çözünmeyen proteinler ise
skleroprotein adını alır.
85
Proteinlerin Genel Nitelikleri
Proteinlerin denatürasyonu
•
•
•
•
Denatürasyon proteinlerin doğal yapısının bozulmasıdır.
Doğal yapının bozulması içinde protein molekülünün bir
takım etkenlere maruz kalması gerekmektedir.
Protein molekülünün, katlarının açılması ve değişik bir
biçimde tekrar katlanması yani sekunder ve tersiyer
yapılardaki değişikliklerde protein molekülünün niteliklerini
değiştirir.
Denatürason için peptid bağlarının çözülmesi şart değildir.
Tersiyer yapının bozulması geri dönebilir bir denatürasyon
olduğu halde, sekunder yapının bozulduğu durumlarda,
oluşan denatürasyon geriye dönüşü yoktur.
86
Proteinlerin Genel Nitelikleri
•
•
Denatürasyona uğrayan proteinlerin, çözünürlüğü değişir,
bazı renk tepkimeleri şiddetlenir, enzim ve hormonların
biyolojik etkinliği kaybolur.
Asit’te bekletme, alkalide bekletme, etanolde çözme, ısı, Xışınları, UV ışınkarı, kuvvetli çalkalama, SDS (sodyum dodesil
sülfat) ile işlem, üre tuzları ile işlem, dondurup çözme ve
yüksek basınç bazı denatürasyon nedenlerindendir.
87
Etkenler: pH, Sıcaklık, İyonik güç, Çözünürlük, UV ışınları, SDS ...
Denatürasyon
Biyolojik aktivite
kaybı
Renatürasyon
Normal
Protein
Biyolojik aktivite geri
kazanımı
Denatüre
Protein
88
Protein Structure and Denaturation - A Level Biology
89
Proteinlerin Genel Nitelikleri
Molekül ağırlığı
•
•
Yüksek molekül ağırlığına sahip maddelerdir.
Molekül ağırlıkları dördüncü yapının oluşması ile artar,
monomerlere ayrılması ile de azalır. Dolayısı ile molekül
ağırlığı koşullara göre değişir.
Protein
Ağırlığı
İnsulin
12.000
Myoglobin
17.000
Hemoglobin
68.000
Albümin
69.000
Tireoglobin
660.000
Fibrinojen
450.000
90
Proteinlerin Genel Nitelikleri
Proteinlerin molekül biçimi
•
•
•
Küre biçiminden iplik biçimine kadar değişen biçimler
gösterir.
Kolay çözünenlerin çoğu küre biçimindedir.
İplik biçiminde olanlar çözünmeyen proteinlerdir.
Biçimleri
Küresel
Çomak
Fibriler
Özellikleri
Kolay çözünürler.
Çözeltileri viskoziteyi azaltır.
Çözeltilerin viskozitesini çok artırır.
Çözünmezler.
91
Proteinlerin Genel Nitelikleri
Proteinlerin çöktürülmeleri
•
•
•
•
Proteinler, belirli asitler, ağır metaller ve spesifik antikorlar
ile çökerler.
Ağır metaller; Hg, Pb, Ag, Cu, Fe, Cd, Zn.
Organizmaya sindirim dışı yol ile protein verildiğinde yabancı
bir madde olarak kabul edilirler ve antikorlar oluştururlar.
Her protein kendi türüne karşı oluşmuş spesifik antikor ile
çöker.
92
Proteinlerin Genel Nitelikleri
Ağır metal tuzları
• Metal zehirlenmelerde antidot proteinlerden yaralanılır.
Negatif iyonları
• Analiz amacı ile kan proteinlerinin çöktürülmesinde
yararlanılır.
Spesifik antikor proteinler
• Antijen elde etmekte kullanılır.
93
Proteinlerin Genel Nitelikleri
Proteinlerin hidrasyonu
•
•
Su bağlarlar. Peptid zincirindeki polar gruplar, amino,
karboksil, hidroksil, imino vb. gruplardır.
Polar gruplar su ile bağlanma yeteneğine sahiptirler.
Proteinlerin viskozitesi
•
•
Molekül şekli ile doğrudan ilgilidir.
Molekül uzun ise viskozite daha fazladır. Büyük moleküllü
proteinlerde de vizkozite fazladır.
94
Proteinlerin Genel Nitelikleri
Proteinlerin kristalleşmesi
•
Peptin, tripsin ve üreaz gibi enzim proteinleri kristal halde
elde edilmişlerdir.
•
Kristalleşme işinde NaCl, (NH4)2SO4 ilave edilerek izoelektrik
nokta pH’sının ayarlanması hızla
95
Proteinlerin Sınıflandırılması
İki tip sınıflandırma yapılabilir.
1.Yapılarına Göre Sınıflandırma
2.Biyolojik Rollerine Göre veya
Fonksiyonel Açıdan Sınıflandırma
96
Proteinlerin Yapılarına Göre Sınıflandırılması
Basit Proteinler
• Basit proteinler,yalnızca amino asitlerden oluşmuş; hidroliz olduklarında
sadece amino asitleri veren, polipeptit zincirleri yapısındaki
proteinlerdir. Basit proteinler, değişik niteliklerine göre alt gruplara
ayrılarak incelenirler; Globüler ve Fibriler Proteinler.
Konjuge Proteinler (Proteidler/Birleşik Proteinler))
• Hidrolize olunca, amino asitlerden başka kimyasal maddelerde veren
proteinlerdir.
• Amino asitlerden oluşmuş polipeptid zincirlerinin prostetik grup denen
yapılara bağlanması ile oluşurlar.
Türev Proteinler
• İlk iki grupta yer proteinlerin belirli etkilerle değişmeleri sonucunda
oluşan proteinlerdir.
97
Basit Proteinler
Basit proteinler,yalnızca amino asitlerden oluşmuşturlar.
Globüler ve Fibriler Proteinler olmak üzere iki alt
gruba ayrılırlar.
Globüler Proteinler
• Molekülünün üç boyutlu şekli rotasyon elipsoid biçiminde olan
proteinlerdir.
• Globüler proteinlerde albüminler, globülinler, globinler,
glutelinler, prolaminler, protaminler, histonlar gibi alt gruplara
ayrılırlar.
98
Basit Proteinler
• Albüminler
◦
◦
◦
◦
◦
Suda ve sulu çözeltilerde çözünürler.
Isı ile pıhtılaşırlar.
MW < 100.000.
Glisince fakirdirler.
Ör.: Ovalbümin, serum albümin, laktalbümin, legumelin, löykosin
• Globulinler
◦
◦
◦
◦
Suda erimezler. Nötr tuzlu su çözeltilerinde erirer.
Glisince zengindirler.
MW > 100.000.
Ör.: Ovoglobulin, laktoglobulin, α-, β-, γ-globulinler, legümin, faseolin
99
Basit Proteinler
• Globinler
◦ Genellikle bileşik halde, başlıca hemoglobin yapısında bulunurlar.
• Glutelinler
◦
◦
◦
◦
Bitkiseldir.
Suda erimez. Seyreltik asit ve alkalilerde çözünür.
Isı ile denatüre olurlar.
Ör.: Buğdayda glutenin, arpada hordenin, prinçde orizenin.
• Histonlar
◦ Suda erir.
◦ Kuvvetli bazik amino asitler yönünden zengindir. Arjininden zengindir.
Ör.: Timohiston (bez doku), skombron (uskumru)
100
Basit Proteinler
• Prolaminler
◦
◦
◦
◦
Bitkiseldir.
Suda erimez. % 70-80 etanolda çözünür.
Lizin ve sistin yönünden fakirdir. Prolin’ den zengindir.
Özellikle taneli bitkilerde çok bulunurlar. Ör.: Gliadin (buğday), zein
(mısır).
◦ Buğday unu hamuru akar su altında nişastasını kaybedince, geriye çok
elastik bir madde kalır. Gluten adını alan bu madde, gliadin ve
glutenin karışımıdır.
◦ Çölyak Hastalığı (Gluten Enteropatisi): Genetik olarak duyarlı
kişilerde başlıca buğdaydaki gluten ve arpa, çavdar, yulaf gibi
tahıllardaki gluten benzeri diğer tahıl proteinlerine karşı kalıcı
intolerans olarak gelişen proksimal ince barsak hastalığıdır.
101
Basit Proteinler
• Protaminler
◦ Balık spermalarından elde edilmiştir.
◦ Suda, seyreltik asit ve alkalilerde, seyreltik amonyum hidroksit
çözeltisinde çözünürler.
◦ Triptofan, tirozin ve kükürtlü amino asitleri kapsamazlar.
◦ Arjinin yönünden zengindirler.
◦ Kuvvetli bazik karakter gösterirler.
◦ Proteinlerin en kısa zincirli olanlarıdır (MW 1000-5000).
◦ Dokularda özellikle nükleik asitlerle birleşmiş halde bulunurlar.
◦ Ör.: Skombrin (uskumru), salmin (som balığı), lüpein (ringa balığı).
102
Basit Proteinler
Fibriler Proteinler
• Molekülünün üç boyutlu şekli çok gerilmiş elipsoid biçiminde
olan proteinlerdir.
• Sklereprotein (Albüminoidler)
◦ Hayvansal kaynaklıdır.
◦ Suda, nötral tuz çözeltilerinde, seyreltik asit ve alkalilerde ve saf
alkolde çözünmezler.
◦ Pepsin ve tripsin gibi enzimlere dirençlidirler.
◦ Keratin (boynuz, kıl) sindirilmez, kolajen (bağ doku, kemik, kırıkdak,
tendo) sindirilir. Elastin (ligament) de örnek verilebilir. Keratin
kükürtlü amino asitlerden çok zengindir.
103
Basit Proteinler
• Fibrinojen
◦
◦
◦
◦
◦
◦
Kan plazması içinde çözünmüş olarak bulunur.
Kanın pıhtılaşmasında (koagülasyon) görev alan akut faz reaktanıdır.
MW 340.000’ dir. İki subüniteden oluşur.
Hemostazda doku onarımı ve yara iyileşmesinde önemli işlevleri vardır.
Kanın pıhtılaşması sırasında trombin tarafından fibrine dönüştürülür.
Karaciğerde hepatositler tarafından sentezlenir.
• Miyozin
◦ Kas dokuda bulunur.
◦ Kasın kasılmasında görev alır.
104
Konjuge (Birleşik) Proteinler
Hidrolize olunca, amino asitlerden başka kimyasal
maddelerde veren proteinlerdir.
Amino asitlerden oluşmuş polipeptid zincirlerinin
prostetik grup denen yapılara bağlanması ile oluşurlar.
•
•
•
•
•
•
•
Fosfoproteinler
Glikoproteinler
Proteoglikanlar
Lipoproteinler
Metalloproteinler
Nükleoproteinler
Kromoproteinler
105
Konjuge (Birleşik) Proteinler
• Fosfoproteinler
◦ Prostetik grup olarak fosforik asit (fosfat) taşıyan proteinlerdir.
◦ Fosforik asit, protein molekülündeki serin, treonin ve tirozin’ in OH
gruplarına bağlanmıştır yani esterleşmiştir.
◦ Sütte kazein, yumurtada vitellin, livetin, fosvitin ve balık
yumurtasında ihtulin örnek olarak verilebilir.
• Glikoproteinler
◦ Prostetik grup olarak karbonhidrat taşıyan proteinlerdir
◦ % 1-80 arasında değişen oranda karbonhidrat içerirler.
◦ Karbonhidrat oranı < % 4 ise glikoprotein denir.
106
Konjuge (Birleşik) Proteinler
◦ Oran % 10 - 20 arasında ise mükoprotein, karbonhidrat oranı çok,
protein oranı daha az olursa mükoid adını alırlar.
◦ Kan plazması proteinlerinden bazı taşıyıcı proteinler (seruloplazmin,
transferrin) ve immunoglobulinler; kemikteki osseomukoprotein,
tendonlardaki tendomukoprotein, kıkırdak dokudaki
kartilagomukoprotein, tükürükteki müsin, prostetik grupları
karbonhidrat olan proteinlerdir; Glikoproteinlerdir.
• Proteoglikanlar
◦ % 80-95 gibi çok yüksek oranda karbonhidrat içeren konjuge
proteinlerdir.
◦ Bir veya daha fazla kovalent bağla eklenmiş glikozaminoglikan (GAG)
zincirli bir çekirdek (core) proteinden oluşur.
– Heparin, kondroitin sülfat örnek olarak verilebilir (bknz. Karbonhidratlar)
107
Konjuge (Birleşik) Proteinler
• Lipoproteinler (Proteolipidler)
◦ Prostetik grup olarak fosfolipid, trigliserit,
kolesterol gibi lipidleri taşıyan
proteinlerdir.
◦ Suda kolay çözünürler.
◦ Lipidler suda çözünemedikleri için kanda
proteinlere bağlanarak lipoprotein
şeklinde taşınırlar.
◦ Şilomikron, Lipovitellin, VLDL, IDL, LDL ve
HDL örnek olarak verilebilir.
– Bknz. Lipidler
© McGraw-Hill Companies Inc.
108
Konjuge (Birleşik) Proteinler
• Metalloproteinler
◦ Prostetik grup olarak metal taşıyan (Fe, Cu, Zn...) proteinlerdir.
◦ Fe taşıyanlar (Ferritin , Hemoglobin, sitokromlar), Cu taşıyanlar
(seruloplazmin, SOD), Zn taşıyanlar (SOD), Se taşıyanlar (GPx, IDs).
• Kromoproteinler
◦ Prostetik gruplardan metalik bir elementin varlığıyla oluşan renkli
protein. Metal-porfirin kompleks sistemleri ile oluşurlar.
◦ Hemoglobin, myoglobin, sitokromlar örnek olarak verilebilir.
109
Konjuge (Birleşik) Proteinler
• Nükleoproteinler
◦ Protaminler, histonlar ve diğer basit proteinlerin nükleik asitlerle
bağlanması sonucu oluşmuş konjuge proteinlerdir.
◦ Nükleoprotaminler, en basit nükleoproteinlerdir; nükleik asit ile
proteinler, arjinin-fosfat bağı ile bağlanmıştır; balık spermalarında
boldurlar.
◦ Nükleohistonlarda da nükleik asit ile proteinler, arjinin-fosfat bağı ile
bağlanmıştır; balık spermalarında ve kuş eritrositlerinde boldur.
◦ Yüksek nükleoproteinler, ribozomlar, kovalent bağlı RNA-protein, DNAprotein bileşiminde sitoplazma ve mitokondrilerde bulunurlar.
110
Türev Proteinler
İlk iki protein grubunda yer alan çeşitli proteinlerin
belirli etkilerle değişmeleri sonucu oluşan proteinlerdir.
Primer ve Sekunder Türev Proteinler olmak üzere iki alt
grupta incelenirler.
• Primer Türev Proteinler
◦ Peptid bağları yıkılmadan denatüre edici etkenlerle oluşurlar.
◦ Denatüre tip proteinler olarak da isimlendirilirler.
◦ Suda erimeyen bu proteinlerin seyreltik asitler ve enzim etkisiyle
oluşanlarına protean denir.
◦ Asit ve alkalilerin sürekli etkisi ile oluşanlarına metaprotein denir.
◦ Kaynatma, çalkalama, UV ışınları ve etanol etkisi ile oluşanlarına
pıhtılaşma veya koagüle proteinler denir.
111
Türev Proteinler
• Sekunder Türev Proteinler
◦ Peptid bağlarını kısmen yıkan asit veya enzimlerin etkisiyle oluşurlar.
◦ Protein molekülleri daha küçük parçalara bölünürler.
◦ Büyük parçalara proteoz (albüminoz) denir; küçük parçalara pepton
denir.
◦ Daha küçük zincirler de polipeptitler ve peptitlerdir.
◦ Bu türev proteinler kaynatmakla çökelmez veya ısı ile pıhtılaşmaz.
112
Proteinlerin Fonksiyonel Açıdan Sınıflandırılması
Katalitik Proteinler
Taşıyıcı Proteinler (transport proteinleri)
Besleyici ve Depo Proteinler
Kontraktil Proteinler
Yapısal Proteinler
Savunma Proteinleri
Fizyolojik Düzenleyici Proteinler
113
Katalitik Proteinler
Biyokimyasal reaksiyonları katalize eden enzimler,
yüksek derecede özelleşmiş proteinlerdir.
Enzimler, biyokimyasal tepkimelerin olağan koşullarda
hızla gerçekleşebilmelerine olanak veren ve canlı
dokunun temel karakteristiğini oluşturan biyokatalistik
maddeler olarak tanımlanır.
Amilaz, pepsin, lipaz önemli katalitik protein veya
enzim örnekleridirler
114
Taşıyıcı (Transport) Proteinler
Spesifik molekülleri veya iyonları bağlayıp bir organdan bir
başka organa veya hücre membranının bir tarafından diğer
tarafına transport eden proteinlerdir.
• Serum albümin, en iyi bilinen taşıyıcı proteindir; bilirubin,
kalsiyum, yağ asitleri ve birçok ilaç serum albümine bağlanarak
taşınır.
• Hemoglobin, oksijen taşıyan,
• Lipoproteinler, lipid taşıyan,
• Transferrin, demir taşıyan önemli taşıyıcı protein örnekleridirler.
Bütün organizmaların plazma membranlarında ve
intrasellüler membranlarında bulunan taşıyıcı proteinler,
glikoz, amino asitler ve diğer maddeleri bağlarlar; bunları
membranın bir tarafından diğer tarafına taşırlar.
115
Besleyici ve Depo Proteinler
Organizma tarafından kullanlan metal iyonları ve amino
asitler için biyolojik rezerv görevü üstlenen
proteinlerdir.
• Yumurta akının esas proteini ovalbümin, sütün esas proteini
kazein besleyici proteinlerdir; amino asit depolarıdır.
• Bir çok bitki tohumu da çimlenen tohumun büyümesi için
gerekli besleyici proteinleri depolamıştır. Buğdaydaki en iyi
bilinen depo proteini glutendir.
• Ferritin, demir depolayan proteindir.
116
Kontraktil Proteinler
Kasılabilen veya kendiliğinden hareket edebilen
proteinlerdir.
Miyozin ve aktin, iskelet kaslarının kontraktil sisteminde
ve aynı zamanda bir çok kas olmayan hücrede işlev
görür.
Tubulin, mikrotubilleri oluşturan proteindir.
• Hücrelerde bulunan mikrotubuller, hücreleri yürütmek için
kamçı ve kirpiklerdeki dynein proteini ile birlikte hareket eder.
117
Yapısal Proteinler
Tendonların ve kıkırdağın esas yapısını, çok yüksek
gerilme gücüne sahip kollajen oluşturmuştur.
• Kösele, hemen hemen saf kollajendir
• Ligamentler, iki boyutta gerilme yeteneğinde bir yapısal
protein olan elastin içerirler.
• Saç, tırnak ve tüyler, keratin içerirler.
• İpek liflerinin ve örümcek ağlarının esas komponenti
fibroindir. Bazı böceklerin kanat eksenleri, resilinden
yapılmıştır.
118
Savunma Proteinleri
Organizmaları diğer türler tarafından istilaya karşı
savunan, organizmayı hasardan koruyan proteinlerdir.
• İmmünoglobülinler, omurgalıların lenfositleri tarafından
yapılan, spesialize (özgülleşmiş) proteinlerdir.
• İmmunoglobulinler organizmayı istila eden;
◦ Bakterileri,
◦ Virüsleri veya,
◦ Başka türe ait yabancı proteinleri (antijenler)
tanıyabilirler ve presipite edebilirler (çöktürebilirler) veya
nötralize edebilirler
119
Savunma Proteinleri
• Fibrinojen ve trombin gibi kan pıhtılaşma proteinleri, vasküler
sistem yaralandığında yaralanan yerin kan pıhtısı ile
kapatılarak kan kaybının önlenmesini sağlarlar.
• Yılan zehirleri, bakteriyel toksinler ve risin gibi toksik bitki
proteinleri, aynı zamanda savunucu fonksiyonlara sahip gibi
görünmektedirler.
• Savunma proteinlerinin fibrinojen, trombin ve bazı zehirler
dahil bazıları, aynı zamanda enzimdirler.
120
Fizyolojik Düzenleyici Proteinler
Sellüler düzenleme veya fizyolojik aktiviteye yardım
eden proteinlerdir.
İnsülin, büyüme hormonu gibi bazı hormonlar,
düzenleyici proteinlerdir.
• İnsülin, şeker metabolizmasının düzenlenmesinde etkilidir
• Büyüme hormonu ise büyümenin düzenlenmesinde etkilidir
• Bir çok hormona sinyal için sellüler yanıta, sıklıkla Gproteinler denen, GTP- bağlayan proteinler sınıfı aracı olur.
• Bazı düzenleyici proteinler, DNA’yı sarar; enzimlerin ve RNA
moleküllerinin biyosentezini düzenlerler.
121
Nükleoproteinler
Birleşik proteinlerin çok önemli bir grubunu oluşturular.
Prostetik grubu nükleik asitler olan proteinlerdir.
NÜKLEİK ASİTLER
• Kalıtsal nitelikleri olan, genler, taşıyan ve protein
biyosentezinde anahtar özellik gösteren maddelerdir.
• İlk olarak hücre çekirdeğinden izole edildiklerinden nüklein
veya nüklein maddesi adı verilmiştir.
• Hücrenin parçalanması dahil her özel biyolojik olayın nükleik
asitlerle ilgisi vardır.
122
Nükleik asitler yapısında üç madde bulunur.
Azotlu baz + Pentoz + Fosfat
Nükleosid
Azotlu baz + Pentoz
Nükleotid
+
Fosfat
(Mononükleotid)n=Nükleik asit
123
Bir nükleotidin yapısında
pentoz ortada yer
almaktadır.
5
1
3
1. karbonu ile azotlu bazla,
5. karbonu ile fosfatla
bağlanırken,
3. karbon atomu ile de bir
sonraki nükleotid’in fosfatı
ile bağlanmaktadır.
124
Nükleoproteinler
Bir nükleotid’ deki fosfat ile pentoz’ un birleşmesi,
pentozun 5. karbon atomundaki birincil alkol (CH2OH)
grubunun fosfat ile aralarında bir mol H2O çıkması sonu
esterleşmeleri ile gerçekleşir.
Pentoz’ un, azotlu bazla bağlanması ise pentozun birinci
karbonu üzerinden sağlanır.
125
Nükleoproteinler
Mononükleotidlerin birleşmeleri, pentoz ve fosfat
aracılığı ile olur.
1. nükleotiddeki pentoz’un 3. karbonundaki OH grubu
ile, 2. nükleotiddeki fosfatın esterleşmesi ile gerçekleşir.
Bu bağlantı yerine göre «n» sayıdaki nükleotidin
birleşmesiyle devam eder ve nükleik asitler oluşur.
126
Nükleoproteinler
Bir nükleotid de bulunan azotlu bazlar pürin ve
pirimidin bazlardır.
• Bu bazlar dışında azda olsa rastlanan farklı bazlarda vardır. Bu
bazların metil-, dimetil- ve N-metil türevleridir.
Pürin bazları; adenin ve guanin’ dir.
Pirimidin bazları; sitozin, urasil ve timin’dir.
• Sitozin hem DNA hemde RNA’da bulunur. Urasil RNA’da,
timin ise sadece DNA’ da bulunur.
127
128
Nükleoproteinler
Hücreler pürin ve pirimidin bazları sentez edebilirler.
• Zaman zaman dışarıdan da alırlar.
Nükleik asitler, DNA ve RNA adlarını yapılarındaki
pentozdan alır.
Deoksiriboz bulunuyorsa DNA (deoksiribonükleik asit)
adını alır.
Riboz bulunuyorsa RNA (ribonükleik asit) adını alır.
129
130
Nükleoproteinler
Biyolojik yönden önemli serbest nükleotidler
• Nükleotidler, nükleik asitlerin yapılarında bulunmanın yanı sıra,
nükleotidlere yakın yapıda olan bir çok maddeler, dokularda
serbest halde bulunurlar.
• Bu maddelerin çoğunun katalitik görevleri vardır ve enzim
sistemleri ile birlikte görev yaparlar.
• Azotlu baz + pentoz = Nükleosid (Adenin + riboz = Adenozin)
• Adenozin + Fosfat = Adenozin monofosfat (AMP) adı verilen
nükleotid oluşur. İki fosfat ise Adenozin difosfat (ADP), üç
fosfat bağlanırsa adenozin trifosfat (ATP) oluşur.
• Diğer bazlarında fosfatla birleşmesi sonucu nükleotidler oluşur.
131
ATP
ADP
AMP
132
Biyolojik yönden önemli serbest nükleotidler
AMP (Adenozin monofosfat=Adenilik asit) : Adenin – Riboz – PO4
ADP (Adenozin difosfat) : Adenin – Riboz – PO4 – PO4
ATP (Adenozin trifosfat) : Adenin – Riboz – PO4 – PO4 – PO4
NAD (Nikotinamid Adenin Dinükleotid) : Adenin – Riboz – PO4 – PO4 – Riboz – Nikotinamid
NADP (Nikotinamid Adenin Dinükleotid fosfat) : Adenin – Riboz (– PO4) – PO4 – PO4 – Riboz – Nikotinamid
FMN (Flavin mononükleotid) : Flavin – Ribitol - PO4
FAD (Flavin adenin dinükleotid) : Flavin – Ribitol - PO4 - PO4 – Riboz - Adenin
UDP-G (Uridin difosfat-Glikoz) : Urasil – Riboz - PO4 - PO4 - Glikoz
Koenzim A : Adenin – Riboz (– PO4) – PO4 – PO4 – Pantotenat tiyoletilamin
133
Azotlu baz
Nükleosid
Nükleotid
Simgesi
Adenin
Adenozin
Adenilik asit
AMP
Guanin
Guanozin
Guanilik asit
GMP
Sitozin
Sitidin
Sitidilik asit
CMP
Urasil
Uridin
Uridilik asit
UMP
Timin
Timidin
Timidik asit
TMP
134
Nükleik Asitlerin Yapı ve Görevleri
Hayvan dokularında hem DNA hemde RNA yaygın bir
biçimde bulunur.
DNA nükleusta daha çok bulunmakla beraber çok sayıda
RNA’da bulunur.
Sitoplazmanın başlıca nükleik asit fraksiyonu, RNA’ dır.
Sitoplazmada RNA genellikle mitokondriler ve
ribozomlarda yer alır.
135
Dezoksiribonükleik Asit (DNA)
Yapı taşları; Fosfat, dezoksiriboz ve Adenin (A), Guanin
(G), Sitozin (C), Timin (T) gibi pürin ve pirimidin
bazlarıdır.
Bir DNA’da adenin ile timin veya guanin ile sitozin daima
ekimolar yani eşit oranda bulunduğu halde (A+T) / (G+C)
oranı değişebilir.
DNA molekülünde üç yapı bulunur.
• Birincil yapı
◦ Belli türlerden ve belli sayıdaki nükleotidlerin bir diziliş sırasında göre
polinükleotid zincirleri oluşturmasıdır.
136
Dezoksiribonükleik Asit (DNA)
• İkinci yapı
◦
◦
◦
◦
İki polinükleotid zincirinin karşılıklı yer almasından meydana gelir.
Bu iki zincir birbirine azotlu bazlar arasında H köprüleriyle birleşir.
Ancak bu bağlantıda karşılıklı bazlarında uygun olması gereklidir.
Daima adenin timine (A-T), guanin sitozine (G-C) karşı bulunur.
• Üçüncü yapıda
◦ İki polinükleotid sarmallaşmış başka bir deyişle çift spiral oluşmuştur.
◦ Aynı azotlu bazlar karşılıklı gelir ve iki zincir H köprüleriyle birleşir
137
DNA’ nın Molekül Yapıları
Birincil yapı
İkincil yapı
Üçüncül yapı
138
Dezoksiribonükleik Asit (DNA)
DNA’ nın organizmada iki temel görevi vardır.
1. Genetik haberi taşımak
2. Eşleşme (Replikasyon) yeteneğine sahip olmak.
Hücre bölünmesinde genetik unsular, tamamıyla ve
değiştirilmeksizin yavruya verilir.
Yeni bir DNA molekülünün meydana gelebilmesi (DNA
replikasyonu) için çift sarmalın yani üçüncü yapının
bozulup ikinci yapının meydana gelmesi lazımdır.
139
Dezoksiribonükleik Asit (DNA)
Ayrılan DNA şeritleri, yeni oluşacak DNA şeritleri için,
adeta bir kalıp meydana getirir.
Bu kalıp karşısında ancak ve sadece bu şeridin
kendisinden ayrıldığı eş şeridin yapısına benzer bir DNA
şeridi oluşabilir.
Çünkü kalıp olarak adlandırdığımız DNA şeridi içerisinde
yer alan azotlu bazlar ancak kendi sırasına uygun azotlu
bazlar ile eşleşebilir.
140
Dezoksiribonükleik Asit (DNA)
Burada meydana gelen şeritler, baz sıralaması yönünden
ebeveynin çift şeridine tümüyle benzediği ve çift
şeritlerinden herbiri bir ebeveyn şeridi içerdiği için
replikasyona semikonservatif eşleşme denir.
DNA molekülünde birbiri üzerinde yer alan 3 azotlu baz
bir amino asidi kodlar ve buna kodon denir.
141
142
Ribonükleik Asit (RNA)
RNA’ların oluşabilmesi için, primer (birincil) DNA’ lara
gereksinim duyulur.
RNA yapısının DNA yapısından farkı ?
• Deoksiriboz yerine riboz bulunur.
• Timin yerine Urasil bulunur.
• Çift sarmal değildir.
Başlıca üç tip RNA vardır. mRNA, rRNA, tRNA
143
144
145
Transkripsiyon
DNA Transcription
146
mRNA (Messenger/Haberci/Elçi RNA)
Proteinlerin amino asitlerinin diziliş sırasını DNA’ lar
belirler.
Bir DNA’ nın polinükleotid zincirinde bulunan her üç
azotlu baz, bir amino asidi kodlar (kodon).
• İşte nükleustaki DNA’ lardaki azotlu bazların diziliş sırası
genetik haberi oluşturur.
Protein biyosentezinde ilk koşul DNA’ lardaki genetik
haberin, ribozomlarda protein sentezinin meydana
geldiği yere taşınmasıdır. Bunu mRNA’ lar
gerçekleştirir.
147
mRNA (Messenger/Haberci/Elçi RNA)
Protein sentezi için gerekli genetik haberi ve DNA
kısmını temsil eden bir RNA kalıbı oluşur. Sitoplazmada
yerleşir. Orada ribozomlara bağlanarak mRNA adınır alır.
Amino asit kodu virüslar dahil hayatın şimdiye kadar
araştırılmış tüm şekilleri için geçerlidir.
DNA’ nın genetik haberi için, DNA’ nın baz sırasının RNA’
nın baz sırasını temsil etmesi sağlanır.
mRNA’ nın baz sırası meydana gelen proteinin amino
asit sırasını belirler.
148
149
rRNA (Ribozomal RNA)
İkinci RNA tipini, sitoplazmanın endoplazmik
retikulumunun ribozom denen organilende yer alan rRNA
oluşturur. Ribozomların büyük kısmını RNA meydana
getirmektedir.
150
tRNA (Taşıyıcı=Transfer RNA)
Özel amino asitlerle birleşme ve onları
ribozomlara nakletme yeteneğinde
olan RNA molekülleridir. 3 önemli
özelliği vardır.
• Özel bir amino asidi kovalent olarak
bağlayabilirler.
• Kendi yapıları içerisinde mRNA kodundaki
amino asidi tamamlayan ve bu nedenle
antikodon denen üçlü bir koda sahiptirler.
• mRNA’ nın kodu, ile tRNA’ nın antikodunu
temsil eden bazlardan ilk ikisinin birleşmesi
DNA’ daki prensibe göre olur.
151
Kodlayan zincir
(Kodonlar)
5' > > > - - - - - - T T C - - - - - - > > > 3'
Kalıp zincir
(Anti-kodonlar)
3' < < < - - - - - - A A G - - - - - - > > > 5'
mRNA
Aktarılan bilgi (mesaj)
(Kodonlar)
5' > > > - - - - - - U U C - - - - - - > > > 3'
tRNA
Taşıma
(Anti-kodonlar)
3' < < < A A G < < < 5'
Protein
Amino asid
Amino > > > Fenilalanin > > > Karboksi
DNA
152
Standard genetic code
2nd base
1st
base
T
TTT
TTC
T
C
A
TAT
TCC
TAC
TCA
TTG
CTT
CTC
CTA
CTG
ATT
ATC
ATA
(Leu/L) Leucine
(Ile/I) Isoleucine
(Met/M) Methioni
ne
A
TCT
TTA
ATG[A]
G
(Phe/F) Phenylal
anine
C
(Ser/S) Serine
TGA
TCG
TAG
Stop (Amber)
TGG
CCT
CCC
CCA
CCG
ACT
ACC
ACA
CAT
CAC
CAA
CAG
AAT
AAC
AAA
(Pro/P) Proline
(Thr/T) Threonine
GTT
GCT
GAT
GTC
GCC
GAC
GTG
TGC
Stop (Ochre)
AAG
(Val/V) Valine
TGT
TAA
ACG
GTA
(Tyr/Y) Tyrosine
G
GCA
GCG
(Ala/A) Alanine
GAA
GAG
(His/H) Histidine
(Gln/Q) Glutamine
(Asn/N) Asparagine
(Lys/K) Lysine
(Asp/D) Aspartic acid
(Glu/E) Glutamic acid
CGT
CGC
CGA
CGG
AGT
AGC
AGA
AGG
(Cys/C) Cysteine
Stop (Opal)
(Trp/W) Tryptophan
(Arg/R) Arginine
(Ser/S) Serine
(Arg/R) Arginine
3rd
base
T
C
A
G
T
C
A
G
T
C
A
G
GGT
T
GGC
C
GGA
GGG
(Gly/G) Glycine
A
G
153
154
Kromoproteinler
Prostetik grubu porfirinler gibi renki maddeler olan
konjuge proteinlerdir.
Hemoglobin ve solunum enzimleri prostetik grubu hem
olan kromoproteinlerdir.
Yine prostetik grubu riboflavin olan flavoproteidler,
prostetik grubu melanin olan saç ve yünde bulunan proteinli
maddelerde kromoproteinlerdir.
Katalaz enzimide prostetik grubu hem olan kromoproteindir.
Hem maddesini prostetik grup olarak taşıyan
kromoproteinlere hemoproteidler adı verilir.
• Hemoglobin, myoglobin, sitokromlar ve peroksidazlar birer
hemoproteiddirler.
155
Porfirinler
Pirol halkası porfirinlerin ilk ve en basit temek
maddesini oluşturur. Pirol halkasına propiyonik asit,
asetik asit veya metil, etil, hidroksi etil, vinil gibi yan
zincirler eklenirse porfobilinojen denen yapı meydana
gelir. Porfobilinojen’ e monopirol denir ve porfirinlerin
ön maddesi olarak kabul edilirler.
• Dört porfobilinojen halkası =CH— köprüleriyle birbirine
bağlanırsa porfirinler meydana gelir.
• Porfirinler; yan zincir taşımayan 4 pirol halkasından kurulu
kapalı bir yapı olan porfin ön maddesinin türevleri olarak da
tanımlanmaktadır.
156
Pirol Halkası
Porfobilinojen (PBG)
157
Porfirinler
Porfirin halkasında 4 asetik
asit, 4 propiyonik asit
bağlanırsa üroporfirinler
oluşur.
•
•
•
•
Üroporfirin I
Üroporfirin III
Korpoporfirin I
Korpoporfirin III
Porfin Halkası
158
Porfirinler
Hemoglobin
• Prostetik grup olarak HEM taşıyan kromoproteinlerdir.
• Dört hem grubunun birbirine paralel bir şekilde ve peptid
zincirine dik olarak globinle bağlanmalarıyla oluşur.
• Ana karnında hemoglobin başlıca karaciğerde sentezlenir.
Yetişkinlerde kemik iliğinde de sentez edilir.
• Hemoglobin histidin yönünden zengindir ve kanda fazla
bulunması nedeniyle iyi bir tampondur.
• En önemli görevi oksihemoglobin oluşturmak suretiyle
akciğerlerde atmosferik oksijen ile birleşerek oksijeni
dokulara taşımaktır.
159
Heme
Hemoglobin
160
Porfirinler
• Hemoglobindeki 4 hem grubundan her biri 1 molekül oksijen
bağlayabilir.
• Hemoglobin CO2 ile birleşirse karbamino-hemoglobin meydana
gelir.
• CO ile birleşirse karboksihemoglobin oluşur.
• Fe++ oksitleyici maddeler ile tepkimeye girerse methemoglobin
meydana gelir.
• Fe++ bazı anyonlar ile yer değiştirebilir. Siyanür ile birleşerek
siyan-methemglobin oluşturu.
• Oksihemoglobin H2S ile muamele edilirse sulfhemoglobin
meydana gelir.
161
Porfirinler
Myoglobin
• Hemoglobinin dokulara getirdiği
oksijeni tutar.
• Yapısında;
◦ 153 amino asit içeren tek bir
polipeptid zincir bulunur.
◦ Globüler yapıdadır.
◦ Prostetik grup olarak 1 molekül hem
maddesi taşır.
• Kas dokuda bulunur.
162
Safra Renkli Maddeleri
Eritrositler yaklaşık 125 gün ömürleri sonunda yıkılırlar ve
bunun sonucu olarak porfirin halkası açılır. 4 pirol halkası
içeren açık bir zincir meydana gelir ki bunlara safra renkli
maddeleri denir.
Safra renkli maddeler grubuna dahil maddelerin tamamının
teorik olarak bir ana (proto)Bilen maddesinden türemiş
oldukları kabul edilir.
Hemoglobinin parçalanmasında, ilk basamakta meydana
gelen safra renkli maddesi biliverdin’ dir.
Biliverdindeki porfobilinojen halkalarını bağlayan metin
gruplarından birisinin metilen grubuna indirgenmesiyle
(redüklenmesiyle) bilirubin meydana gelir.
163
Safra Renkli Maddeleri
Bilirubindeki vinil gruplarının etil gruplarına çevrilmesi ile
mezobilirubin oluşur. Bundaki porfobilinojen halkalarını
bağlayan diğer iki metin (CH) grubundan, metilen (CH2)
grubuna indirgenmesiyle mezobilirubinojen oluşur.
Bununda iki yan porfobilinojen halkalarına ikişer H atomu
girmesiyle sterkobilinojen oluşur.
Klinik Biyokimya’ da mezobilirubinojen ve sterkobilinojene
bilinojenler veya ürobilinojenler adı verilir. Her ikisinde
mevcut metilen grubunun H atomu kaybetmesiyle
(oksitlenerek), mezobilirubinojenden ürobilin,
sterkobilinojenden sterkobilin meydana gelir.
Ürobilin idrarda, sterkobilin dışkıda ilk kez izole edildi.
Aslında bir çok doku ve diğer vücut sıvılarında bulunurlar.
164
Safra Renkli Maddeleri
Özellikleri
• Mezobilinojen ve sterkobilinojen renksiz, ürobilin ve sterkobilin
sarı, mezobilirubin ve bilirubin portakal sarısı ve biliverdin de
mavimsi yeşil renktedir.
• Biliverdin ve bilirubin’in Na ve K tuzları suda çözündüğü halde, Ba
ve Ca tuzları çözünmez.
• Tüten nitrik asit ile safra renkli maddelerinin çözeltileri tabaka
yaptırılırsa, temas yüzetinde yeşil, mavi, menekşe, kırmızı renkler
meydana gelir. Buna Gmelin deneyi adı verilir. Bu deney ile idrarda
sarılığın teşhisi yapılabilir.
• Bilirubin taze hazırlanmış diazo ayıracı ile reaksiyona sokulursa
kırmızı renkte azo-bilirubin meydana gelir. Kanda bilirubin miktar
tayininde kullanılır. Tepkime adı Van den Bergh’ dir.
◦ Diazo ayıracı sülfanilik asit, HCl ve sodyum nitrit içeren bir karışımdır.
165
İkterus (Sarılık)
Safra renkli maddelerinden olan bilirubin’ in plazmada,
toplanmasına bilirubinemi, idrarla çıkarılmasına
bilirubinüri, deri ve mukazaya toplanarak bu dokuları
boyaması haline
adı verilir. İkterus oluş
nedenlerine göre üçe ayrılır.
Safra yollarının yangı, taş, parazit,
urlar gibi çeşitli nedenlerle, mekanik olarak tıkanması ve safranın
karaciğer hücrelerinde ve dokularda toplanması olayıdır.
Serumda, hem direkt hemde indirekt bilirubin yükselmiştir.
İdrarda, bilirubin (+), ürobilinojen normaldir.
Dışkı renksizdir.
166
İkterus (Sarılık)
Hepatit ve zehirlenmeler gibi nedenlerle,
karaciğer hücresinin bilirubini kandan alıp, safra kanallarına
salgılayamaması ile oluşur.
Serumda, indirekt bilirubin yükselmiştir.
İdrarda, ürobilinojen (+)’dir.
Dışkı açık renklidir.
Eritrosit parçalanmasının arttığı durumlarda
birdenbire oluşan fazla bilirubinin karaciğer tarafından safra
kanalına salgılamaya yetişememesi sonucu kanda birikmesiyle
oluşur.
Serumda, indirekt bilirubin yükselmiştir.
İdrarda, ürobilinojen çok fazladır.
Dışkı koyu renklidir.
167
Organizma Sıvılarının ve Dokularının Başlıca Proteinleri
Serum ve Plazma
• İçerisinde pıhtılaşmaya engel olacak uygun bir antikoagulan
madde bulunan tüpe kan alındıktan sonra, santrifüje edilecek
olursa, dibe çöken şekilli elemanlar ve üstte kalan sarı pembe
renkli sıvı kısımdan oluşan iki tabakaya ayrılır.
• Kanın bu şekilde ayrılan sıvı kısmına plazma denir. Plazma
içinde % 8 oranında plazma proteinleri, % 1 inorganik tuzlar,
geri kalan oranda da lipidler, karbonhidratlar, amino asitler
gibi maddeler bulunur. % 8 kısmını oluşturan plazma
proteinlerinin fibrinojen fraksiyonuda plazma içerisinde yer
alır.
168
Görsel Kaynak: WikiMedia
Organizma Sıvılarının ve Dokularının Başlıca Proteinleri
Plazma içerisinde bulunan ve fibrin haline geçerek kanın
pıhtılaşmasını sağlayan fibrinojen plazmadan ayrıldığı
takdirde geriye kalan açık sarı kısım serum adını alır.
Plazma
(Su, proteinler, lipidler,
karbonhidratlar, hormonlar vs.)
Lökosit ve trombositler
Eritrositler
Normal
Hematokrit
(HCT)
Anemi
(HCT )
Polisitemi
(HCT )
169
Organizma Sıvılarının ve Dokularının Başlıca Proteinleri
Kanın Pıhtılaşması
• Dolaşım kanında buluna, çözünür bir protein olan fibrinojenin
değişmesiyle ortaya çıkar. Gerektiğinde bu fibrinojen bir dizi
tepkime ile fibrine dönüşür. Bu olaya koagülasyon (kanın
pıhtılaşması) adı verilir.
• Fibrinojenin fibrine çevrilmesi, trombin adı verilen bir enzim
sayesinde olur. Bu enzim dolaşımda aktif değildir.
• Kanın pıhtılaşmasında başta Ca olmak üzere bir çok faktör rol
oynar.
• Kanın pıhtılaşması basit bir olay değil, kompleks ve kontrol
mekanizmalı bir süreçtir.
170
Organizma Sıvılarının ve Dokularının Başlıca Proteinleri
Trombositler, kanın şekilli elementleridir.
• Dolaşım kanından kan alındığında, bu
trombositler tüpün cidarına yada bir kanama
söz konusu ise yaranın kenarlarına yapaşırlar
ve parçalanırlar.
• Bu parçalanma sonu taşıdıkları tromboplastin
adı verilen bir madde açığa çıkar.
• Tromboplastinler, dolaşım kanında bulunan
ve trombinin inaktif şekli olan protrombin’i
trombin’e çevirir. Trombinde fibrinojenin
fibrin haline geçmesini sağlayarak kanın
pıhtılaşmasını sağlar.
Canine
Feline
Kaynak: eClinPath
171
Coagulation Cascade Animation
172
Organizma Sıvılarının ve Dokularının Başlıca Proteinleri
Plazma ve serum proteinleri
Fibrinojen
Glikoprotein yapıdadır. Elipsoid, çomak yapısındadır.
Çözeltilerde ileri derecede vizkozdur. Kanın pıhtılaşmasında
en önemli rolü oynar.
Serum
Albümin
Çoğunlukla lipoprotein yapıdadır. Elipsoid biçimdedir. Ozmotik
basıncın korunmasında önemlidir. Zor çözünür maddeleri
bağlayarak çözünür hale getirirler ve dolaşım kanında
transportlarını sağlarlar.
Serum
Globulin
α-globulinler: Glikoprotein yapısındadır. Seruloplazmin ve
protrombin örnek olabilir.
β-globulinler
γ-globulinler: Antikorlar yada immunglobulinlerde denir.
173
Organizma Sıvılarının ve Dokularının Başlıca Proteinleri
Kas Proteinleri
Sarkoplazma Proteinleri Miyojen, Miyoglobin, Miyoalbümin, Globin-X
Fibriller Proteinler
Miyozin, Aktin (Globuler aktin/G-aktin, Fibriller
aktin/F-aktin)
Süt ve Yumurta Proteinleri
Süt Proteinleri
Kazein, Laktalbümin, Laktoglobulin, İmmunoglobulinler
Yumurta
Proteinler
Akında: Ovalbümin, Konalbümin, Ovomükoid,
Ovoglobulinler, Müsin, Avidin
Sarısında: Vitellin, Livetin, Fosfvitin (tamamı
fosfoprotein yapıdadır).
Kaynaklar
Ası. T. 1999. Tablolarla Biyokimya, Cilt 1
Engelking LR. 2014. Textbook of Veterinary Physiological Chemistry. 3rd
edn. Academic Press.
Smith JG (2010). Organic Chemistry, 3rd Edition, McGraw-Hill.
Smith JG (2012). General, Organic, & Biological Chemistry 2nd Edition,
McGraw-Hill.
Sözbilir Bayşu N, Bayşu N. 2008. Biyokimya. Güneş Tıp Kitapevleri, Ankara
175
Sorular
Aşağıdakilerden hangisi bilinen en basit amino asittir ?
a) Alanin
b) Glisin
c) Treonin
d) Triptofan
e) Glumatik asit
Cevap: B
176
Sorular
Proteinlerin çeşitli maruziyetler nedeniyle yapısının
bozulmasına ............ denir.
a) Deamidasyon
b) Renatürasyon
c) Denatürasyon
d) Dekarboksilasyon
e) Deaminasyon
Cevap: C
177
Sorular
Porfirinlerin ilk ve en basit temel maddesini hangi
molekül oluşturur?
a) Pirol halkası
b) Porfobilinojen
c) Fibrinojen
d) Sterkobilin
e) Biliverdin
Cevap: A
Sorularınız ?
Bir sonraki konu;
ENZİMLER