ATOMLAR MOLEKÜLLER ve
İYONLAR
PERİYODİK TABLO
Dimitri Mendeleev
Periyodik Tablo: Benzer fiziksel ve kimyasal özellik
gösteren elementlerin birarada gösterildiği çizelgedir.
Yatay sıralar: PERİYOT
Düşey kolonlara: GRUP adı verilir.
1A grubu elementleri: Li, Na, K, Rb, Cs, Fr Alkali metaller
2A grubu elementleri: Be, Mg, Ca, Sr, Ba, Ra Toprak Alkali met.
7A grubu elementleri: F, Cl, Br, I, At halojenler
8A grubu elementleri: He, Ne, Ar, Xe, Rn soygazlar
MOLEKÜLLER
Kimyasal bağlar olarak da adlandırılan kuvvetlerle
birarada tutulan en az iki atomun biraraya gelmesiyle
oluşur.
Diatomik moleküller: H2 Cl2 I2
O2
Poliatomik moleküller: O3 H2O
NH3
CO
HCl
İYONLAR: Anyon, katyon
Kimyasal değişim sonucu elektron kazanan veya
kaybeden nötr bir atom yada molekülden oluşan yüklü
türlere iyon denir.
Monoatomik iyonlar : Na+ Cl- Mg2+ Fe3+
S2-
N2-
Poliatomik iyonlar : OH- CNKİMYASAL FORMÜLLER:Moleküllerin ve iyonik
bileşiklerin bileşimlerini oluşturan kimyasal sembollerdir.
Molekül formülü: Bir maddenin en küçük biriminde
bulunan her elementin atomlarının tam sayısını gösterir.
H2 O2
O3
H2O
Allotrop: Bir elementin iki veya daha fazla farklı şeklidir.
Örnek, elmas ve grafit karbonun allotropudur.
Deneysel (ampirik) formül: Bir bileşikte hangi atomların
bulunduğunu ve aralarındaki en basit oranı gösterir.
Molekül Formülü
N2H4 (hidrazin)
H2O
CO2
C6H12O6
Deneysel Formül
NH2
H 2O
CO2
CH2O
İyonik bileşiklerin formülleri daima ampirik formülleri ile aynıdır.
İyonik bileşikler, elektriksel olarak nötr olduğu için, her birim
formülde anyon ve katyonların üstlerindeki yüklerin toplamı sıfır
olmalıdır.
Örnek: NaCl , KCl , ZnCl2 , AlCl3
BİLEŞİKLERİN ADLANDIRILMASI
Bileşiklerin formülleriyle gösterilmesi dışında,
kendilerine atanan isimleri de vardır. Bu isimler,
belirgin bir sistematiğe göre kurulmasaydı,
milyonlarca bileşik için milyonlarca ismi
ezberlemek gerekirdi. Bu nedenle, bileşiklerin
adlandırılmasında bir kurallar sistematiğinin
geliştirilmesi gerekmiş ve bu kuralların
uygulanması ile bilinmeyen bir bileşiğin isminin
tahmin edilebilmesi mümkün olmuştur.
İyonik karakterli metal-ametal ikili bileşiklerinin
adlandırılmasında şu kural izlenir:
1) Metalin adı olduğu gibi söylenir,
2) Ametalin adının sonuna “ür” eki getirilir.
Not: Farklı değerliklere sahip metal iyonları
farklı formüllere sahip bileşikler oluşturacağı
için, bunların isimlendirilmesinde, metal
iyonunun yükseltgenme basamağı da belirtilir.
Dikkat edilmesi gereken nokta, bileşiklerin
oluşumunda elektriksel olarak nötralliğin
sağlanmış olduğudur.
NaCl: Sodyum klorür
MgI2: Magnezyum iyodür
Al2O3: Alüminyum oksit
İki element içeren iyonik bileşikler binary bileşikler olarak
adlandırılır.
Üç element içeren iyonik bileşikler ternary bileşikler olarak
adlandırılır.
FeCl3: Demir(III) klorür (Ferri klorür)
FeCl2: Demir (II) klorür (Ferro klorür)
Hg2(NO3)2: Civa (I) nitrat
Hg(NO3)2: Civa (II) nitrat
Bazı basit iyonlar
Değerlikleri sabit olan pozitif iyonlar
(katyonlar)
Li+: Lityum
Na+: Sodyum
K+: Potasyum
Rb+: Rubidyum
Cs+: Sezyum
Mg2+ : Magnezyum
Ca2+ : Kalsiyum
Sr2+ : Stronsiyum
Ba2+ : Baryum
Al3+ : Alüminyum
Zn2+ : Çinko
Ag+: Gümüş
Farklı değerliklere sahip olabilen katyonlar
Cr3+ : Krom (III)
Cr2+ : Krom (II)
Fe3+ : Demir (III)
Fe2+ : Demir (II)
Co3+ : Kobalt (III)
Co2+ : Kobalt (II)
Cu2+ : Bakır (II)
Cu+: Bakır (I)
Hg2+ : Civa (II)
Hg22+ : Civa (I)
Sn4+ : Kalay (IV)
Sn2+ : Kalay (II)
Pb4+ : Kurşun (IV)
Pb2+ : Kurşun (II)
Bazı Basit Anyonlar
H-: Hidrür
F-: Fluorür
Cl-: Klorür
Br-: Bromür
I-: İyodür
O2- : Oksit
S2- : Sülfür
N3- : Nitrür
Klasik adlandırma: “öz”-”ik” sistemi
Daha önceki adlandırma sisteminde, farklı
değerlik alabilen bir metal iyonunun düşük
değerliği ile oluşan bileşiği için “öz”, yüksek
değerliği ile oluşan bileşiği için “ik” son eki
kullanılmakta idi.
Örnek: Kupröz oksit, Cu2O (bakır (I) oksit)
Kuprik oksit, CuO (bakır (II) oksit)
İkiden fazla değerlik alabilen mangan
ve vanadyum gibi iyonların bileşiklerini
isimlendirmekte yaşanan zorluklar
nedeniyle, bu yöntem akademik
çevrelerde bir süre sonra terk
edilmiştir; bazı ticari firmalar tarafından
hâlâ kullanıldığı görülmektedir.
Adı verilen bir bileşiğin formülün
yazılması: Baryum oksit, kalsiyum
fluorür ve demir (III) sülfür
bileşiklerinin formüllerini yazınız.
Baryum oksit: Baryum iyonu Ba2+ , oksit
iyonu O2- şeklinde yazılır. 1:1 oranında
birleştiklerinde dışarıya karşı nötral
oldukları için, herhangi bir katsayı
kullanmaya gerek yoktur.
Cevap: BaO
Kalsiyum fluorür: Kalsiyum iyonu Ca2+ ,
fluorür iyonu ise F- şeklinde yazılır.
Elektrikçe nötral olmaları için, iki adet
fluorürün bir kalsiyum iyonuna bağlanması
gereklidir.
Cevap: CaF2
Metal-Ametal ikili bileşikleri:
Alıştırmalar
Demir (III) sülfür: Demir (III) iyonu Fe3+ , sülfür
iyonu ise S2- şeklinde yazılır. Ortak paydaları 6
olduğu için, demir (III) iyonundan iki, sülfür
iyonundan üç tane gereklidir.
Cevap: Fe2S3
Örnekleri çalıştıktan sonra, aşağıda ismi
verilen bileşiklerin formüllerini yazınız.
1) Lityum oksit
2) Kalay (II) klorür
3) Lityum nitrür
4) Alüminyum sülfür
5) Magnezyum nitrür
6) Vanadyum (III) oksit
Metal-Ametal ikili bileşikleri:
Alıştırmalar
Formülü verilen bir bileşiğin isminin
bulunması:
Na2S, AlF3 ve Cu2O bileşiklerini
uygun biçimde adlandırınız.
Na2S: Bileşikte Na iyonu 1+, S iyonu 2yüklüdür.
Na+ iyonu sodyum, S2- iyonu sülfür olduğu
için, bileşiğin isimlendirilmesi “sodyum
sülfür” şeklinde olmalıdır.
AlF3: Al3+ ve F- iyonlarından oluşmuş olan
bu bileşiğin isimlendirilmesi “Alüminyum
fluorür” şeklindedir. Alüminyum iyonunun
sadece (III) değerliği bulunduğu ve başka bir
değerliği olmadığı için, “alüminyum (III)”
şeklindeki bir isimlendirme gereksizdir.
Cu2O: Bileşikte Cu1+ ve O2- iyonları
mevcuttur.
Cu1+ iyonu bakır (I), O2- iyonu oksit olduğu
için, bileşiğin ismi “bakır (I) oksit”
şeklindedir. Eski isimlendirme sistemi, bu
bileşiği “kupröz oksit” şeklinde
adlandırmaktadır.
Metal-Ametal ikili bileşikleri:
Yapılacak Alıştırmalar
Aşağıda formülleri verilmiş bileşiklerin
isimlerini yazınız.
1) CsI
2) CaF2
3) FeO
4) CrCl3
5) CaH2
6) CuCl
7) Ag2S
8) Hg2Cl2
MOLEKÜLER BİLEŞİKLER
İki Ametalin İkili Bileşikleri
Bir bileşik iki ametal atomundan oluşuyor
ise, kovalent bağlı bir molekül yapısı
mevcut demektir. Bu tür bileşiklerin
adlandırılması, bir önceki metal-ametal
ikili bileşiklerin adlandırılmasına benzer.
Örnek 1: HCl: Hidrojen klorür
Bu örnekte, önce pozitif yüklü iyonun,
sonra da negatif yüklü iyonun
yazıldığı görülmektedir. Nötralleşme
nedeniyle yazılması gereken sayılar,
Lâtince karşılıkları söylenerek belirtilir.
Örnek 2: SO2: Kükürt dioksit
SO3: Kükürt trioksit
Bu örneklerde, birinci atom tek olduğu
için “mono” ön ekinin kullanılması
gerektiği düşünülebilir, ancak basitlik
amacı ile kullanılmaz. İkinci atom tek ise
“mono” ön eki mutlaka kullanılır.
Örnek 3: B2Br4: Dibor tetrabromür
Bu örnekte, birinci atomdan iki tane
olduğu için, karşılık gelen “di” ön eki,
ikinci atom dört tane olduğu için, karşılık
gelen “tetra” ön eki kullanılmıştır.
Hatırlatma
ÖNTAKI
MonoDiTriTetraPentaHekzaHeptaOktaNonaDeka-
ANLAMI
1
2
3
4
5
6
7
8
9
10
Kural dışı bazı bileşikler
Bazı bileşiklerin sistematik adları, geleneksel
adlarının çok yaygınlaşması nedeniyle hiç
kullanılmaz.
H2O: su (dihidrojen monoksit)*
NH3: amonyak (trihidrojen mononitrür)**
*Bu örnekte, mono ve oksit kelimeleri
birleştiğinde hece düşmesinin gerçekleştiğine
ve “monoksit” haline geldiğine dikkat ediniz.
**Bu örnekte, pozitif yüklü hidrojenler, yine
geleneksel nedenlerle sağ tarafta
gösterilmiştir.
Bazı hatırlatmalar
Lâtince ön ekler yalnızca ametal-ametal
bileşiklerinin isimlendirilmesinde kullanılır;
metal ametal bileşikleri için lâtince ön ek
kullanılması yanlıştır.
MgCl2: Magnezyum diklorür klorür
FeCl3: Demir triklorür (Demir (III) klorür)
Ametal-Ametal İkili Bileşiklerin
Adlandırılması - Örnekler
BCl3: Bor triklorür CCl4: Karbon tetraklorür
CO: Karbon monoksit CO2: Karbon dioksit
NO: Azot monoksit NO2: Azot dioksit
N2O: Diazot monoksit N2O3: Diazot trioksit
PCl3: Fosfor triklorür SF6:Kükürt heksafluorür
Not: Lâtince bir ön ek ve “iyodür” kelimeleri yan yana
geldiğinde hece düşmesi kuralı uygulanmaz, yani
“triyodür” değil, “triiyodür” yazılır.
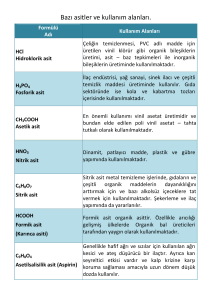
ASİTLER ve BAZLAR
Asit, suda çözündüğünde hidrojen iyonları (H+) veren madde
olarak tanımlanır.
Oksi asitler: Hidrojen ve oksijen içeren asitlerdir.
H2CO3
HClO3
HNO3
H3PO4
H2SO4
karbonik asit
klorik asit
nitrik asit
fosforik asit
sülfirik asit
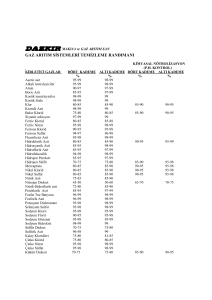
Tablo. Bazı Basit Asitler
ANYON
F- (florür)
Cl- (klorür)
Br - (bromür)
I- (iyodür)
CN- (siyanür)
S2- (sülfür)
İLGİLİ ASİT
HF (hidroflorik asit)
HCl (hidroklorik asit)
HBr (hidrobromik asit )
HI (hidroiyodik asit )
HCN (hidrosiyanik asit)
H2S (hidrosülfirik asit)
ASİTLER VEBAZLAR
En önemli nokta şudur: İkili asit
bileşikleri suda çözündüğünde başka
türlü, gaz halinde ise başka türlü
isimlendirilir.
Örnek: HF (suda)
HF(gaz) :
: Hidrofluorik asit
Hidrojen fluorür
Baz, suda çözündüğünde hidroksit iyonları (OH-) veren madde
olarak tanımlanır.
NaOH
sodyum hidroksit
KOH
potasyum hidroksit
Ba(OH)2 baryum hidroksit
Çok Atomlu İyonlar
İçinde oksijenin de bulunduğu üç farklı türden
atomdan oluşan anyonlara sıkça
rastlanmaktadır.
Bunların dışında, iki atomun birleşmesi ile
oluşan anyonlar da vardır. Katyonlar için
yaygın rastlanan tek örnek, amonyağın
protonlanması ile elde edilen “amonyum”
iyonudur.
Çok Atomlu İyonlar
Amonyum: NH4+, amonyum klorür: NH4Cl
Asetat: CH3COO-, sodyum asetat: NaCH3COO*
Karbonat: CO32- , sodyum karbonat: Na2CO3**
*: Bu yazım şeklinde sodyum iyonunun karbona bağlı imiş gibi
gözükme durumunu gidermek amacı ile, bileşiğin alternatif
yazımında katyon sağ tarafa alınarak CH3COONa veya anyon
ters çevrilerek NaOOCCH3 biçimleri de kullanılmaktadır.
**Karbonat iyonunun protonlanmış hali olan hidrojen karbonat,
“bikarbonat” olarak ta bilinmektedir, HCO3- formülü ile
gösterilir.
Çok Atomlu İyonlar
Kromat: CrO42- , amonyum kromat: (NH4)2CrO4
Dikromat: Cr2O72- , amonyum dikromat: (NH4)2Cr2O7
Siyanür: CN-, potasyum siyanür: KCN
Hidroksit: OH-, lityum hidroksit: LiOH
Nitrit: NO2-, sodyum nitrit: NaNO2
Nitrat: NO3-, sodyum nitrat: NaNO3
Çok Atomlu İyonlar
Oksalat: C2O42- ,
kalsiyum oksalat: CaC2O4
Permanganat: MnO4-, potasyum permanganat: KMnO4
Manganat: MnO42- , sodyum manganat: Na2MnO4
Fosfat: PO43- , sodyum fosfat: Na3PO4
Hidrojen fosfat: HPO42-, sodyum hidrojen fosfat: Na2HPO4
Dihidrojen fosfat: H2PO4-, sodyum dihidrojen fosfat: NaH2PO4
Çok Atomlu İyonlar
Sülfit: SO32- , sodyum sülfit: Na2SO3
Hidrojen sülfit (bisülfit): HSO3-, potasyum hidrojen sülfit: KHSO3
Sülfat: SO42- , sodyum sülfat: Na2SO4
Hidrojen sülfat (bisülfat): HSO4-, potasyum hidrojen sülfat: KHSO4
Tiyosülfat: S2O32- , sodyum tiyosülfat: Na2S2O3
Tiyosiyanat: SCN-, potasyum tiyosiyanat: KSCN*
* Bu iyonun bir başka adı da “rodanür”dür.
Halojenli oksianyonlar
Oksijen içeren ve farklı yükseltgenme basamaklarına
sahip anyonların isimlendirilmesinde bazı ön ve son
eklerden faydalanılır.
1) hipo (ön ek) … it (son ek): “en küçük pozitif” değerlik
2) ...it (son ek): “en küçük pozitif değerin bir üstü” değerlik
3) …at (son ek): “en büyük pozitif değerin bir altı” değerlik
4) per (ön ek) ...at (son ek): “en büyük pozitif” değerlik
Halojenli oksianyonlar
Klor atomunun oksijenle bileşik yapabilmesi için pozitif değerlikte
bulunması gerekir. Klor atomunun pozitif değerlikleri +1, +3, +5 ve
+7'dir. Bu dört farklı anyonun adlandırılması için
bir önceki sayfada belirtilen kuralları uygulayalım:
ClO-: hipoklorit,
HClO: hipokloröz asit
ClO2-: klorit,
HClO2: kloröz asit
ClO3-: klorat,
HClO3: klorik asit
ClO4-: perklorat,
HClO4: perklorik asit
*”hipo” anyonlarda oksijenin önce yazıldığına da rastlanmaktadır,
örneğin OCl- ile ClO- aynı anyondur.
Adlandırma Alıştırmaları
1) CuCl2
Bakır (II) klorür
2) ClO2
Klor dioksit
3) HIO4
Periyodik asit
4) Ca(H2PO4)2
Kalsiyum dihidrojen fosfat
HİDRATLAR
Bileşiğin formül biriminin belirli sayıda su molekülü
içerdiği “kristal sulu” bileşikler, karmaşık bileşiklere
en sık rastlanan örneklerdir. Bu bileşiklerin
adlandırılmasında, metal-ametal isimlendirme tekniği
kullanılır, ardından, yapıya bağlanmış su molekülü
sayısı Lâtince ön ek kullanılarak belirtilir.
HİDRATLAR
CoCl2.6H2O:
ZnSO4.7H2O:
Kobalt (II) klorür heksahidrat
Çinko sülfat heptahidrat
Na2CO3.12H2O: Sodyum karbonat dodekahidrat
CuSO4 . 5H2O (mavi)
CuSO4 (beyaz)