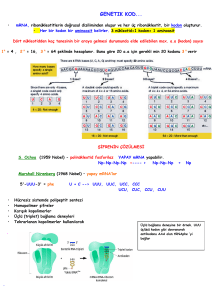
TRANSLASYON:
Prof. Dr Lülüfer Tamer Gümüş
Sağlık Slaytları
http://hastaneciyiz.blogspot.com
1
TRANSLASYON: m-RNA daki bilginin deşifre edilerek
ribozomlarda protein sentezinin gerçekleşmesi işlemidir.
Bir protein sentez aşamasının gerçek hali
2
Translasyon, transkripsiyonuda içeren işlemler dizisidir
3
Protein sentezinin üç komponenti mRNA, tRNA ve
ribozomlardır.
Protein Sentezi Ribozomlarda gerçekleşir
Sitoplazmada serbest veya endoplazmik retikulumun sitozolik
yüzüne tutunmuş olarak bulunurlar
Protein sentezinin fazla olduğu hücrelerde ribozomların sayıları
fazladır. Ribozomların yapısında RNA ve protein bulunur.
5
Protein Sentezi Ribozomlarda gerçekleşir
Hücreden izole edilmiş ribozomlar, hücre dışında mRNA, uygun
aminoasitler, gerekli enerji ve tRNA'lar bulunduğu zaman
protein sentezleyebilir.
6
Ribozomlarda
• Prokaryotik ribozom
50S subunit
70S ribozom
23S rRNA
5S rRNA
35 protein
30S subunit
16S rRNA
21 protein
• Ökaryotik ribosom
60S subunit
28S rRNA
5S rRNA
5.8S rRNA
49 protein
80S ribozom
40S subunit
18S rRNA
33 protein
7
Ribosom yapısı
P PP
P
P
P
P
P A
büyük subunit
P-kenarı
(peptidil tRNA kenarı)
A-kenarı
(aminoaçil tRNA kenarı)
5’
mRNA
Küçük subunit
tRNA’ları ve mRNA’yı bağlayan ribozom
8
Genetik kodu oluşturan nükleik asit dizeleri belli bir protein
sentezlenmesi için gerekli bilgiyi taşır.
Nükleotidlerin dizilişine göre (Genetik kod) proteinleri
oluşturan özgün aminoasitler birbiri ile birleşir. Böylece
protein sentezi gerçekleşir.
GH geni
Ör; GH
9
Genetik kod, bir nükleotid baz dizesinin karşılık geldiği aminoasit
dizesini belirtir.
Üç tane nükleotid bazı bir kodonu oluşturur.
Kodonlar mRNA da bulunan A, G, C ve U bazlarından oluşur.
Bir kodonda bu bazlardan üçü bulunur
10
*Ribozomlarda protein sentezini başlatan ve
*Protein sentezini sonlandıran kodonları vardır
AUG
UAA, UAG
UGA
11
*Translasyon mRNA boyunca 5’-3’ yönündedir
*Sentez N terminalden C-terminale doğrudur.
*Ribozomlarda protein sentezi AUG (Met) kodonu ile başlar
*Protein sentezi UAA, UAG, UGA kodonlarından
herhangi biri ile sonlanır
polipeptid
büyük ribozomal subunit
N
N
5’
UGA
UAA
AUG
UAG
polizom
küçük ribozomal subunit
Subunitler ayrışır
12
Protein sentezine m-RNA daki bilgiye göre doğru
aminoasidin girebilmesi için t-RNA nın bu şifrelerin
hepsini tanıması gerekir
Aminoasit(pCCA)
t-RNA
Sentetaz
bağlanır(TC) (DHU)
Ribozomlara
Antikodon
(a.a taşınacağı)
13
14
tRNA, her amino asit için en az bir tane olmak üzere bulunur.
Protein sentezi sırasında 3 ucuna bir aminoaçil kalıntısı bağlar ve
mRNA ile etkileşen bir adaptör olarak işlev görür
tRNA üzerinde antikodon denilen ve mRNA’daki kodonları
tamamlayıcı üçer bazlık nükleotid dizileri vardır
Wobble hipotezine göre, bir baz, birden fazla baz ile hidrojen
köprüsü yapabilir.
Bir tRNA, aynı amino aside ait üç değişik kodonu tanıyabilir.
Örneğin tRNAArg’deki (5′)ICG antikodonu, mRNA’da, arjinine
ait (5′)CGA, (5′)CGU, (5′)CGC kodonlarını tanıyabilir
t RNA antikodonu ve mRNA daki kodon komplementerdir ve
antiparalel bağlanır.
mRNA kodonu 5’-3’ yönünde okunur ve buna eşleşen antikodon ters
yönden 3’-5’ buraya oturur.
Örneğin, antikodon baz sırası 3'-AAG-5' ise, mRNA’daki kodon 5'UUC-3' biçimindedir.
Translasyon sürecinin genel hata oranı; her 10000 amino asitten bir
hatalı yerleşme
17
Translasyon için gerekli bileşenler
*Aminoasitler ( Diyetteki esansiyel aminoasitler)
*t RNA
*mRNA
*Aminoasil tRNA sentetazlar
*Fonksiyonel ribozomlar
A bölgesi: A bölgesinde kodona özgü a.a buraya oturur
P bölgesi: peptidil tRNA oturur.
*Başlama, uzama ve sonlanma faktörleri
* ATP ve GTP
18
PROTEİN SENTEZİNİN BASAMAKLARI
1- Aminoasitlerin aktivasyonu
ATP, t-RNA
Aminoasit
Aminoasit t-RNA sentetaz
2-Protein sentezinin başlaması
m-RNA (AUG kodonlu)
Ribozom, GTP
Başlatıcı t-RNA ( AUG antikodonlu)
Başlatıcı Faktörler (IF1, IF2, IF3)
3-Protein zincirinin uzaması
Uzatma faktörü (EF1, EF2)
GTP
4-Protein sentezinin sonlandırılması
m-RNA bitiş kodonu (UAA, UAG, UGA)
Releasing Faktör
19
1- Aminoasitlerin aktivasyonu
ATP, t-RNA
Aminoasit
Aminoasit t-RNA sentetaz
E
1-ATP+ AminoasitEnzim-AMP-aminoasit+Ppi
E
2-Enzim-AMP-aminoasit+t-RNA Aminoasil-t-RNA
AMP
Enzim
E: Aminoasil t-RNA sentetaz
20
amino asid
yüksüz tRNA
- =
RO
H2N-C-C-OH
3’
H
ATP
H
E: Aminoasil t-RNA sentetaz
1 amino asid için 1 aminoaçil tRNA
AMP
sentetaz
Ayrıca her bir aminoasit için farklı tRNA
Tüm tRNA’lar 1 aa için aynı sentetazı
kullanır.
Her bir aminoaçil tRNA sentetaz
amino asit
ATP
tRNA bağlar
E
RO
H2N-C-C-O
- =
PPi
Adenillenmiş (aktif)
R O amino asit (E-AMP-aa)
H2N-C-C-O-P-O-riboz-adenin
- =
E
H
aminoaçil
(yüklü)
tRNA
21
Protein sentezinin başlaması: mRNA bağlanması
m-RNA (AUG kodonlu), Ribozom, GTP, Başlatıcı t-RNA ( AUG
antikodonlu), Başlatıcı Faktörler (IF1, IF2, IF3)
M
Başlatıcı tRNA ( Met yüklü)
küçükribozomal subünite initiation
faktor-2 (IF2) ile bağlanır.
eIF2
40S subunit
küçük subunit 5’ cap’i bulur ve
mRNA’daki ilk AUG kodonunu bulmak için tarar
5’ cap
AUG
22
mRNA
60S subunit
• Başlangıç kodon bulunur
• IF2 kompleksden ayrışır
• Büyük ribosomal subunit bağlanır
eIF2
M
5’
AUG
mRNA
40S subunit
23
A
M
5’
AUG GCC
• İkinci bir aminoaçil tRNA
A-kenarına bağlanır
• ilk peptid bağ oluşur
5’
mRNA
P kenarı
M
A
A kenarı
AUG GCC
mRNA
24
P-kenarı
NH2
CH3-S-CH2-CH2-CH
O=C
C
O
tRNA
Peptide bağ oluşumu
• peptide bağ oluşumu peptidil transferaz
tarafından katalizlenir
• peptidil transferaz,prokaryotlarda büyük
ribozomal subunitde 23S rRNA’da
bulunur;
Ökaryotlarda da 28S rRNA bulunur.
• Enerji ATP’den sağlanır,
A-kenarı
N 2
NH
CH3-CH
O=C
O
tRNA
NH2
CH3-S-CH2-CH2-CH
O=C
NH
CH3-CH
O=C
O
25
tRNA
Protein Sentezinin Uzaması (Elongasyon)
P
P
P
P
P
UCA GCA GGG UAG
•ribosom diğer mRNA kodonuna kayar
peptidil tRNA’da A kenarından P
kenarına kayar; Bu translokasyon
elongasyon faktör 2 (EF2) gerektirir.
EF1
EF2
A
P
P
P
P
P
UCA GCA GGG UAG
• Diğer aminoaçil tRNA A-kenarına
bağlanır; bu tRNA bağlanması
elongasyon faktör1 (EF1) gerektirir
• Elengasyon için enerji 2 GTP hidrolizi
ile sağlanır:
• 1 GTP translokasyon için
•1 GTP aminoaçil tRNA bağlanması
26
için
27
Bazı antibiotikler Protein sentezini inhibe ederler
Inhibitor
Etkisi
kasugamisin
streptomisin
tetrasiklin
erythromisin
lincomisin
klindamisin
kloromfenikol
Etki yeri
initiator tRNA bağlar
30S subunit
initiasyon, elongasyon
30S subunit
aminoaçil tRNA bağlama
A-site
peptidil transferaz 50S subunit
“
“
peptidil transferaz
50S subunit
28
29
30
4. Terminasyon (sonlanma); m-RNA bitiş kodonu (UAA, UAG, UGA), RF
RF
P
P
P
P
P
• translasyon stop kodonuna ulaştığında,
release faktor (RF) A kenarına bağlanır ve
stop kodonunu tanır.
UCA GCA GGG UAG
PPPP
PP
P
P
• release faktör, peptidil tRNA’dan
tamamlanmış polipeptidi
hidrolizleyerek ayrıştırır ve tüm
kompleks ayrışır.
UCA GCA GGG UAG
(Leninger movie 1401)
31
Sitozolde serbest bulunan poliribozomal partiküller, intrasellüler fonksiyonlar
için gereken proteinlerin sentezinden sorumludurlar
Pürtüklü endoplazmik retikulumun poliribozomları tarafından sentez edilen
proteinler, hücre dışına salgılanırlar veya bazıları Golgi de zimojen
partiküller halinde paketlenirler
Protein olgunlaşması: modifikasyon, sekresyon, yönlenme
Çoğu lizozomal protein, membran proteini
ve hücreden salgılanan proteinler,
kendilerinin endoplazmik retikulum lümeni
içinde translokasyonu için işaret olan bir
amino-terminal sinyal dizisine sahiptirler.
SRP
5’
ER da, sinyal tanıyan kısım (SRP)
Sentezlenmiş proteindeki,
sinyal peptidini bağlar .
ER lumen c
SRP reseptor
sitosol
AUG
salınacak protein için polizom
Sitozolik mRNA da translasyon başlaması
33
Polipeptid ER lümenine
doğru hareket eder
ER lümeninde bulunan signal peptidaz,
sinyal peptidini ayrıştırır.
ER lumen
Sinyal Peptidaz
sitosol
5’
SRP serbest kalır
ve tekrar kullanılır
Ribosomlar ER membranına
yanaşır
34
Translasyon polipeptidin ER lümenine girsede devam edebilir
Translasyon sonlandığında, tamamlanan protein ER içine girer
ve sekresyon için ileri işlemlere tabi tutulur
ER lumen
sitoplazma
5’
UGA
Sentezi tamamlanan
protein işlenir
(Posttranyonel
değişimlere uğrar
•Proteolitik işlemler
•Glikolizasyon
•Hidroksilasyon
•Fosforilasyon
Golgiye geçer ve
salgılanır 35
İNHİBİTÖRLER
DNA nın replikasyonunu, transkripsiyonunu
ve translasyonunu geriye dönüşümsüz olarak
inhibe eden antibiotik ve antimetabolitler vardır.
Bazı antibiotikler Protein sentezini inhibe ederler
Inhibitor
Etkisi
kasugamisin
streptomisin
tetrasiklin
erythromisin
lincomisin
klindamisin
kloromfenikol
Etki yeri
initiator tRNA bağlar
30S subunit
initiasyon, elongasyon
30S subunit
aminoaçil tRNA bağlama
A-site
peptidil transferaz 50S subunit
“
“
peptidil transferaz
50S subunit
36
Aktinomisin D
Streptomyces suşundan elde edilen bir antibiotikdir.
Aktinomisin D, DNA ya bağlı RNA polimeraz enziminin
RNA sentezini inhibe eder.
DNA zincirinde G-C baz çifti arasına girer ve guanin ile
hidrojen bağı kurarak RNA polimeraz enziminin bağlanmasını
engeller.
37
Etidium Bromür; Aktinomisin D gibi iki DNA
zinciri arasına girer.
Bleomisin; DNA zincirinde kopmalar meydana getirir
Mitomisin; Bazları alkile eder ve çarpraz bağlar
kurulmasına neden olurlar
Nalidiksik Asit; DNA polimeraz enzimini inhibe eder,
Rifamisin; Direkt olarak RNA polimeraz enzimine
bağlanarak mRNA sentezini engeller.
38
Alfatoksin; Aspergillus flavustan üretilen bir toksin olup,
Replikasyon ve transkripsiyonu önler.
Alfa-Amanitin;Zehirli bir mantar olan Amanita phalloides’in
toksin maddesi olup, RNA polimerazı inhibe eder.
Puromisin; Protein sentezinde aynı aminoasit gibi peptid bağı
yapar. Fakat yeni gelecek aminoasit bu peptid bağına ilave
edilemez.
Kloromfenikol; Bu antibiotik, 50 s ribozomlara bağlanarak protein
sentezini inhibe eder.
39
Streptomisin
Bu antibiotik ise 30 s ribozomlara bağlanarak genetik kodun
yanlış okunmasına neden olarak protein sentezini bloke eder.
40
Posttransyonel Modifikasyonlar
Polipeptid zincirlerinin çoğunda Posttransyonel
Modifikasyonlar (değişim) meydana gelir.
Bu değişimler ya polipeptid zinciri ribozom üzerindeyken
veya sentez tamamlanıp ribozomdan ayrıldıktan sonra
meydana gelir.
Değişimler translasyon başladıktan sonra ortaya çıktığı için ,
bunlara posttransyonel modifikasyonlar denir.
Posttransyonel Modifikasyonlar
Proteolitik işlemler (Kısaltmalar)
Amino-terminal ve karboksil-terminal modifikasyonlar
Proteolitik işlem
Kovalen değişimler
Fosforilasyon
Glikozilasyon ve protein yönlendirilmesi
Hidroksilasyon
Diğer
Disülfid çapraz bağlarının oluşması ve zincir katlanması
İzoprenil grupların eklenmesi
Prostetik grupların eklenmesi
Amino-terminal ve karboksil-terminal modifikasyonlar:
Translasyon sonunda yeni sentezlenmiş olan bütün polipeptitler,
prokaryotlarda N-formilmetionin kalıntısı ile, ökaryotlarda ise metionin
kalıntısı ile başlar
Amino-terminal ve karboksil-terminal metionin kalıntılarına eklenmiş olan
formil grupları, enzimatik olarak çıkarılırlar
Ökaryotik proteinlerin %50’den fazlasında amino-terminal kalıntıların amino
grupları translasyondan sonra asetillenir. Karboksil-terminal kalıntılar da
bazen modifiye edilir
Proteolitik işlem:
Birçok protein, örneğin insülin, bazı viral proteinler, tripsin ve
kimotripsin gibi proteazlar, başlangıçta büyük ve inaktif prekürsör
proteinler olarak sentez edilirler. Bu prekürsörler, son aktif
formlarına dönüşmek için proteolitik olarak kısaltılırlar
Proteolitik işlemler
insulin (pankreatik b-hücreleri ER’da sentez edilir)
Sinyal peptid
N
N
Sinyal peptidinin
sinyal peptidaz
tarafından
C
ayrıştırılması
Preproinsulin
N
I
I
S
S
I
I
S
S
Disulfid bağ oluşumu
Proinsulin
B-chain
N
N
S
S
C
Insulin
S
S
C
karboxipeptidaz B-benzeri
enzim tekrar keserek herbir
yeni ucun bazı kısımlarını
C uzaklaştırır
S
S
I
I
S
S
A-chain
C
C-chain
tripsin-benzeri enzimler
C-peptidini ayrılmasını sağlar
C-chain
C-zincirini salgılama veziküllerinde paketler ve
aktif insülin olarak salgılar.
45
Preproopiomelanokortin
• çoğu fonksiyonel polipeptidler tek prekürsörden gelir
26aa
48aa
12aa
40aa
14aa
21aa
40aa
18aa 5aa 26aa
C
N
Signal
peptide
Proopiomelanocortin
g-MSH
Kortikotropin
(ACTH)
a-MSH
b-Lipotropin
31aa
b-MSH Endorfin
g-Lipotropin
Enkefalin (5aa)
46
Proteinlerin fosforilasyonu
•
Serin, threonin ve tirozin aa’lerinde fosforilasyon görülür.
•
Bu fosforilasyon reaksiyonları protein kinazlar tarafından
gerçekleştirilir.
•
Tirozin kinaz
•
Serin-Threonin kinaz
•
Fosforilasyon sonucu proteinlerin aktiviteleri artar veya azalır
•
Defosforilasyon protein fosfatazlar tarafından gerçekleştirilir.
47
Glikozillenme, serum proteinleri, immünoglobülinler, kollajen, membran
proteinlerinin oluşumunda sıklıkla gerçekleşen posttranslasyonal
modifikasyondur
Proteinlerin glikolizasyonu
Translasyon süresince ER içine girmeden
glikozillenir.
ER ve Golgi içinde çeşitli oligosakkarid
modifikasyonları gerçekleşir
-
Örnek: Glikoprotein ve proteoglikanlar
49
N-linked oligosakkaridlerin Biyosentezi
P
(ilk 7 basamak)
Dolikol fosfat (polyprenol lipid carrier)
(2) UDP-
ER lumen
(1) UMP, (1) UDP
(5) GDP(5) GDP
reorientation
Sitosol
Monosakkaridlerden nükleotid şekerler
spesifik glycosyltransferases aracılığı ile
eklenir
N-asetilglukozamin (GlcNAc) =
Mannose =
N-linked oligosakkaridlerin Biyosentezi
ER lumen
PP
P
(ikinci 7 basamak)
Dolicol fosfatlar ER lümenindeki şeker vericileridir;
lümende transloke olmadan sitozolde sentezlenirler
(4)
PP
Dolicol-P-mannoz =
P
(3)
Dolicol-P-glukoz =
PP
Sitosol
P
P
Oligosakkaritlerin proteinlere transferi
PP
ER lumen
Büyüyen polipeptide
oligosakkarit transferi
Asn
I
X
I
Ser (Thr)
Bağlantı asparajinin amid grubuna olur. Prolin olmamak
kaydıyla herhangi bir aa takip eder ve sonraki aa serin
veya threonin aminoasidi olmalıdır.
Sitosol
Sentezi takiben, protein Golgi kompleksine transfer olur ve
burada budanır ve yeni oligosakkarid kompleksleri eklenir.
Oligosakkarit kompleks oluşumu
Asn
I
X
I
Ser (Thr)
Glkozidazlar tarafından budanma;
glikoziltransferaz tarafından eklenme
= yaygın kor yapısı
Asn
I
Golgi lumen
X
I
Ser (Thr)
Oligosakkarit kompleksi
fruktoz =
galaktoz =
sialik asid =
Golgi membranını geçerken nükleotit şekerlei
transloke olur.
Sitosol
Karbonhidrat tipi proteinin membranamı, vezikülemi
yada direkt olarak sekrete edilip edilmeyeceğini
belirler
Proteinlerin lizozomlara yönlendirilmesi
• mannose-6-phosphate içeren
proteinler lizozomlara yönlendirilir.
Asn
UDPP
Fosfat grupları mannoza eklenir
(UDP N-asetil glukozaminden
alınan fosfat- Nasetil glukozamin
yapısı)
Asn
P
P
Nasetilglukozaminler uzaklaştırılır.
Asn
P
Proteinlerin Hidroksilasyonu
•
Kolllajenin a-zincirinde bulunan prolin ve lizin aa’lerinin
hidroksilasyona uğrayarak hidroksiprolin ve hidroksilizin
oluşturma reaksiyonudur.
•
Bu reaksiyon endoplazmik retikulumda gerçekleşir
55
•
56
İzoprenil grupların eklenmesi:
Ökaryotik proteinlerin bir grubu izoprenillenmiştir;
proteinin bir sistein kalıntısı ile izoprenil grubu arasında bir tiyoeter
bağı oluşturulmuştur.
İzoprenil grupları, farnesil pirofosfat gibi, kolesterol biyosentez
yolunun pirofosfat ara ürünlerinden türemiştir
Ras onkogen ve proto-onkogen ürünleri, G proteinleri, nükleer matrikste bulunan
laminler, bu yolla modifiye edilmiş proteinlerdir. İzoprenil grupları, bazı hallerde
bir membrandaki proteini yerinde tutmak için görev görür
Prostetik grupların eklenmesi:
Birçok prokaryotik ve ökaryotik protein, aktiviteleri için, prostetik
grupların kovalent olarak bağlanmasını gerektirir.
Prostetik gruplar, protein zincire zincir ribozomdan ayrıldıktan
sonra bağlanır.
Asetil-CoA karboksilazdaki biotin molekülü ve sitokrom c’deki
hem grubu, iki önemli prostetik grup örneğidir
Sitokrom c
Disülfid çapraz bağlarının oluşması polipeptit zincirin
katlanması:
Protein polipeptit zincirinin katlanması, sentez sırasında ve aminoterminal uçtan başlayarak olur.
Polipeptit zinciri sentezi bittiğinde spontan olarak gerçekleşen
katlanma da hemen hemen bitmiştir.
Proteinin sekonder, tersiyer yapılarının oluşması spontan
olmaktadır. Bu sırada sistein kalıntıları arasında zincir içi veya
zincirler arası disülfid çapraz bağları oluşur
Protein zincirinin katlanması, kotranslasyonal modifikasyon
olarak tanımlanır.
Proteinlerin katlanmasında iki farklı görüş vardır: 1) Proteinlerin
doğru katlanabilmesi için primer yapının doğru olması yeterlidir. 2)
Proteinlerin doğal yapılarına katlanmalarında primer yapılarının
yanı sıra moleküler şaperon olarak adlandırılan uygun bazı
yapılar da gerekmektedir
Şaperon, proteinlerin katlanarak üç boyutlu hâle gelmesi işleminde
yer alan refakatçı proteinlerdir. Endoplazmik retukulumda
bulunurlar.
Moleküler Şaperonlar
Ribozomda üretilen proteinlerin kıvrılmalarına engel olurlar
Proteinlerin hedeflerine ulaştığında katlanmalarını sağlarlar.
Yanlış katlanmış proteinleri tanıyıp, onları düzeltirler
Düzeltilmesi mümkün olmayan proteinleri tanırlar. Bunların
parçalanmasını ve ortamdan uzaklaşmasını sağlarlar.
Moleküler şaperonlar, proteinlerin sentezinde, taşınmasında,
polimerlerinin oluşmasında ve denatüre proteinlerin yeniden doğal
şekillerine dönüşmesinde (renatürasyonda) rol oynamaktadırlar
Sağlık Slaytları
http://hastaneciyiz.blogspot.com