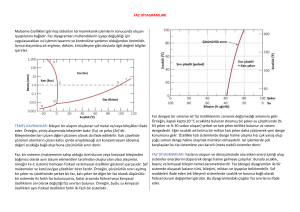
Faz ( denge) diyagramları
• İki elementin birbirleriyle karıştırılması sonucunda,
toplam iç enerji mimimum olacak şekilde yeni atom
düzenleri meydana gelir. Fazlar, İç enerjinin minimum
olmasını sağlayacak düzende oluşurlar.
• Kimyasal bileşim ve sıcaklığa bağlı olarak belirli
şartlarda hangi fazların stabil olduğu (basınç sabit ise,
yani atmosferik koşullarda) faz diyagramları ile
belirlenir.
• Faz diyagramları yardımıyla alaşımın hangi fazlardan
oluştuğu, fazların bileşimi ve fazların yüzde miktarları
tespit edilebilir.
Faz diyagramları
•
•
•
Alaşımların yapı ve özellikleri arasındaki ilişkileri en iyi biçimde inceleyebilmek için
faz diyagramlarına başvurulur.
Sıvı saf metal, denge halinde atmosfer basıncında yavaş yavaş soğutulursa, sabit bir
sıcaklıkta oluşur.
Faz: Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren
bölgelerdir.
Saf metalin soğuma eğrisi
Katı halde birbiri içinde her oranda çözünen
alaşımların denge diyagramı ve soğuma
eğrisi
Çözünebilirlik sınırı
Şekerin şeker-su karışım içindeki çözünürlüğü
Birçok alaşım sisteminde
belirli bir sıcaklıkta çözünen
atomların, çözen kafes içinde
ulaşabileceği ve çözünebilirlik
(çözünürlük) sınırı olarak
isimlendirilen bir üst
konsantrasyon sınır değeri
vardır.
20 oC’de şekerin sudaki en
fazla çözünebilirliği %65 dir.
Belirli bir sıcaklık için
çözünme sınırı o sıcaklığa ait
koordinatın grafikteki
çözünme eğrisini kestiği yerdir.
Şekerin çözünebilme sınır
suyun sıcaklığına bağlı olarak
değişir.
Fazlarda denge hali
• Faz dengesi bir sisteme ait faz özelliklerinin zamanla
değişmediğini ifade eder.
• Denge hali, serbest enerji (bir sistemin iç enerjisi ile atom
veya moleküllerinin düzensizliğinin (entropi) bir
fonksiyonu) adı verilen bir termodinamik büyüklük ile
tanımlanır.
• Örneğin, kapalı bir kapta ve 20 C ‘de birbirleriyle temas
halinde bulunan şeker-su şerbeti ile katı şeker örneği
verilebilir. Eğer sistem denge halinde ise şeker su karışımı
ağırlıkça %65 şeker-%35 su içerir ve bu kimyasal bileşim
ile bileşenlerin oranları zamanla değişmez.
Bir bileşenli faz diyagramları
Su (H2O) için basınçsıcaklık faz diyagramı
Tek bileşenli faz diyagramlarında kimyasal bileşim sabit tutulmakta(bu durumda faz
diyagramı sadece saf maddeler için geçerli olmakta) ve sıcaklık ile basınç faz
diyagramının değişkenlerini oluşturmaktadır. Söz konusu iki boyutlu diyagramlar aynı
zamanda basınç-sıcaklık (P-T) diyagramları olarak nitelendirilmektedir.
O noktasında sistem 273,16 K sıcaklığında ve 6.04x 10-3 atm basınç altında sadece bu
noktada sistemin 3 fazı ( katı,sıvı,buhar) birbirleriyle dengede bulunduğu noktadır ve
bu noktadan sıcaklık ve/veya basınçta olabilecek değişiklikle uzaklaşılması durumunda
en azından fazlardan biri yok olur.
İkili faz diyagramları
Cu-Ni faz diyagramı
Çoğu alaşım sistemi ikiden fazla
bileşen içermekle birlikte, faz
diyagramlarının prensiplerini
açıklamada ve yorumlamada ikili
alaşım sistemlerinden ve bunların
faz diyagramlarından faydalanılır.
Tek fazlı sistemler homojen olarak
adlandırılırken, birden fazla faz
içeren sistemler heterojen sistemler
olarak adlandırılırlar. Çoğu metal
alaşımları, seramik, polimer ve
kompozit sistemler heterojen özellik
gösterirler.
Likidüs eğrisi: katılaşmanın
başladığı sıcaklıkları gösterir ve bu
eğrinin üzerindeki sıcaklıklarda
alaşımlar tamamen sıvıdır.
Solidüs eğrisi: Katılaşmanın sona
erdiği sıcaklıkları gösterir ve bu
eğrinin altındaki sıcaklıklarda
alaşımlar tamamen katı durumdadır.
İkili faz diyagramları
S sıvısı, hem bakır hem de nikel
içeren homojen bir sıvı çözeltidir. Katı
faz ( α fazı); Cu ve Ni içeren bir yeralan
katı çözelti olup, YMK kristal yapısına
sahiptir.
Yaklaşık 1080 oC ‘nin altında Cu ve
Ni birbiri içerisinde tam olarak
çözünebilme yeteneğine sahiptir ve
Cu-Ni elementlerinin hem katı hem de
sıvı hallerde gösterdiği tam
çözünürlük özelliğinden dolayı, bu
sistem izomorfik olarak nitelendirilir.
Cu-Ni faz diyagramı
Faz diyagramlarının yorumlanması
Faz diyagramları sıcaklık ve bileşimin belirli olduğu denge halindeki
bir sistemde en az 3 çeşit bilgiye ulaşılabilmektedir :
Hangi sıcaklıkta bileşimde hangi fazlar var?
Bu fazların kimyasal bileşimleri?
Bu fazların hangi oranlarda sisteme yeralır?
1100 C’de ağırlıkça %60 Ni ve
%40 Cu içeren alaşım A noktası ile
gösterilmiş olup bu noktada sadece
α katı fazı bulunur.
1250 C ‘de ağırlıkça %35 Ni ve &65
Cu içeren alaşım aynı şekil üzerinde
B noktası ile gösterilmiş olup, bu
noktada α+S fazı dengede
bulunmaktadır.
Cu-Ni faz diyagramı
Katı halde birbiri içerisinde kısmen
çözünen alaşımların faz diyagramı
Şekilde Pb metalince
zengin ve özellikleri
Pb‘a yakın α ile Sn
metalince zengin ve
özellikleri Sn ‘a yakın
olan β katı eriyiklerine
ait olanlar arasında bu
iki katı eriyiğin
dengede bulunduğu iki
fazlı yapılar mevcuttur.
Ötektik reaksiyon
Cu-Ag faz diyagramı
Cu metalince zengin αfazında Ag çözünen fazdır.
Ag metalince zengin βfazında Cu çözünen fazdır.
α- ve β- katı fazlarının
birbirleri içerisindeki
çözünürlükleri sınırlıdır.
Örneğin,779 C’de α-katı
fazında Ag metalinin Cu
içerisinde max
çözünürlüğü ağırlıkça %8
‘dir. Çözünebilirlik sıcaklık
arttıkça azalarak A
noktasında, yani Cu in
ergime noktasında
kaybolur.
779C’nin altındaki
sıcaklıklar için α-fazı
bölgesini α+ β
bölgesinden ayıran çizgi
solvüs olarak tanımlanır.
Ötektik reaksiyon
Ötektik
Bileşim
Ötektik altı bileşim
(hypo)
X
Ötektik üstü bileşim
(hyper)
α-fazı Pb metalince zengin faz
β-fazı Sn metalince zengin faz
Ötektik alaşımlarda mikroyapı oluşumu
Kurşun-kalay sisteminde ötektik yapı
oluşumu. Kalay atomlarının yayınma
yönü mavi, kurşun atomlarının yayınma
yönü ise kırmızı oklarla gösterilmiştir.
Ötektik faz
Pb-Sn alaşımının ötektik
kompozisyonundaki mikroyapı
görüntüsü. Pb- zengin α-fazı (
koyu tabakalar), Sn- zengin faz
açık renkli katı eriyik fazlarını
gösterir ( büyütme 375x).
Kaynak: Metals handbook, 9th ed, vol.9, Metallography and Microstructure, ASTM, Materials Park, OH, 1985.)
(a) Ötektikaltı Pb-Sn alaşımı, (b) Ötektiküstü Pb-Sn alaşımı. Koyu
bölgeler Pb-zengin α fazı, açık renkli fazlar Sn-zengin β fazı, ince
tabaka şeklindeki yapılar ötektik fazı göstermektedir.
Kaynak: Metals handbook, 9th ed, vol.9, Metallography and Microstructure, ASTM, Materials Park, OH, 1985.)
Ötektik
Peritektik
Monotektik
Ötektoid
Peritektoid
Ara Fazlar
Gerçek sistemlerin çoğunda birden fazla reaksiyon bulunur. Şekilde görüldüğü gibi
A ve B ye komşu olmayan tek fazlı bölgeler ortaya çıkar.
Arafazın tek bir kimyasal bileşik olması durumunda metaller arası fazlar söz
konusudur. Metaller arası fazların özellikleri A ve B metallerinden farklı olup genellikle
çok sert ve kırılgan malzemelerdir.
AxBy metaller arası bileşiktir ve bunların kimyasal bileşiklerden farkı metalik
karaktere sahip olmalarıdır.
Arafazı gösteren diyagram
Metaller arası bileşiği gösteren
diyagram
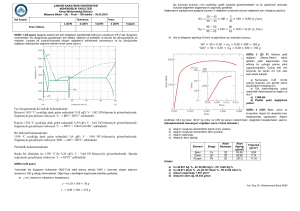
Demir Karbon Faz diyagramı
Fe3C: Sementit
: Ferrit
: Ostenit
δ: Ferrit
Fe-C faz diyagramındaki reaksiyonlar
Ötektoid reaksiyon-727 oC
Ötektik reaksiyon- 1147 oC
Peritektik reaksiyon- 1493 oC
L ( sıvı) + δ ↔ ɣ
Mikroyapılar
α-Ferrit ( X90)
ɣ-ostenit (X325)
Ötektoid bileşimde mikroyapılar
Ötektoid bileşimdeki (ağırlıkça %0.76 C
içeren) demir-karbon alaşımının ötektoid
sıcaklığın altındaki ve üstündeki
mikroyapılarının şematik olarak gösterilişi
Perlitik iç yapıya sahip ötektoid çeliğe ait
mikroyapı fotoğrafı. Açık renkli yapılar
ferrit, koyu renkli tabakalar sementit
(X470).
Ötektoidaltı alaşımlar
Co bileşimindeki (ağırlıkça %0.76’dan
daha az C içeren) ötektoidaltı bir FeC alaşımının ostenit bölgeden
ötektoid sıcaklığın altına kadar
soğutulması ile oluşan iç yapılarının
şematik olarak gösterilişi.
Ötektoid öncesi
ferrit
Perlit
Bileşiminde ağırlıkça %0.38 C içeren
çeliğin ötektoid öncesi ferrit ve perlitten
oluşan mikroyapısına ait fotoğraf (X635)
Ötektoidüstü çelikler
C1 bileşimindeki (ağırlıkça %0.76 C ile
2.14 arasında C içeren) otektoidüstü bir
demir-karbon alaşımının ostenit
bölgeden otektoid sıcaklığın altına kadar
soğutulması ile oluşan iç yapılarının
şematik gösterilişi
Bileşiminde ağ.% 1.4C içeren çeliğin
perlit ile bunların bir ağ yapısı halinde
çevreleyen ötektoid öncesi sementitten
oluşan mikroyapısına ait fotoğraf x1000)