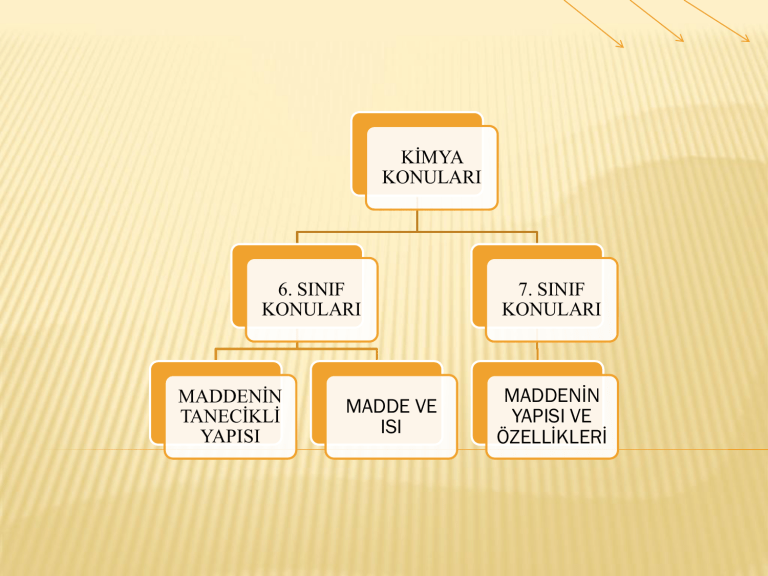
KİMYA
KONULARI
6. SINIF
KONULARI
MADDENİN
TANECİKLİ
YAPISI
MADDE VE
ISI
7. SINIF
KONULARI
MADDENĠN
YAPISI VE
ÖZELLĠKLERĠ
MADDENĠN HALLERĠ
ATOM
ELEMENTLER
BĠLEġĠKLER
FĠZĠKSEL VE KĠMYASAL DEGĠġĠMLER
KĠMYA
MADDENĠN HALLERĠ
KATI
SIVI
GAZ
KĠMYA
KATI HALİ
Katı maddelerin atom veya molekülleri arasındaki boşluk
çok azdır.
Maddenin en düzenli halidir.(Çünkü tanecikler
arasındaki boşluk yok denecek kadar azdır.)
Tanecikler arası çekim kuvvetinin en fazla olduğu
haldir.Bu nedenle belirli bir şekle sahip olan haldir.Öteleme
hareketi yapamazlar.
Tanecikler birbirine çok yakın olduğundan titreşim
hareketi yapar birbirlerinin arasına giremezler.
KĠMYA
SIVI HALİ
Belirli bir hacme sahiptirler ancak belirli Ģekilleri
yoktur.(su yağ süt pekmez mazot benzin vb)
Sıvı tanecikleri arasındaki boĢluklar katılarınkinden
fazladır.
Tanecikler arası boĢluk çok olmadığından sıvıları
sıkıĢtıramayız.
Katılardan daha düzensizdir.
Sıvı taneciklerinin birbirine uyguladığı çekim kuvveti
katılardan daha azdır.
Tanecikler birbirleri üzerinden kayarak öteleme hareketiKĠMYA
yaparlar.Ayni zamanda titreĢim hareketi de yaparlar.
GAZ HALİ
- Belli bir Ģekle ve belli bir hacme sahip olmayan haldir.Bu
nedenle içine kondukları kabın hem Ģeklini hem hacmini
alırlar.(hava, oksijen, helyum vb.)
- Tanecikleri arasındaki boĢluk çoktur.Bu yüzden tanecikler
birbirinden bağımsız olarak hareket ederler.Birbirlerinin
arasına girebilirler.
- Gazlar sıkıĢtırılabilir.(Tüplerde bulunan gazlar sıkıĢtırılmıĢ
haldedir.)
- Tanecikler arası boĢluk çok olduğundan aralarındaki çekim
kuvveti de azdır.
- Maddenin en düzensiz halidir.
- Gazlar sıvılar gibi akıĢkandır.
- Hem titreĢim hem de öteleme hareketi yapabilirler.
KĠMYA
- Enerjisi en fazla olan haldir
KĠMYA
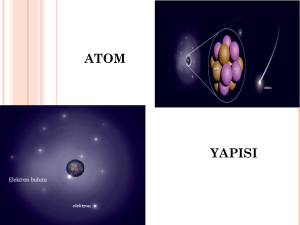
ATOM MODELLERĠ
Maddelerin, gözle görülemeyecek kadar küçük olan yapı
taşlarına “atom” denir. Atom kelimesi Yunanca “bölünemez”
anlamına gelen “atomos” kelimesinden gelir. Atomlar küre
şeklindedir.
Atomların yapısında atomdan daha da küçük tanecikler
bulunur. Bu tanecikler; „proton‟, „elektron‟ ve „nötron‟dur.
KĠMYA
Atomda bulunan yükler; negatif yükler ve pozitif yüklerdir.
Atomu oluĢturan parçacıklar:
Cisimden cisme elektrik yüklerini taĢıyan negatif yüklü
elektron,
Elektronların yükünü dengeleyen aynı sayıda ama pozitif
yüklü olan proton,
Elektrik yükü taĢımayan nötr parcacık nötron.
Atom iki kısımdan oluĢur :
1-Çekirdek (merkez) ve 2-Katmanlar (yörünge; enerji düzeyi)
Çekirdek, hacim olarak küçük olmasına karĢın, atomun tüm
kütlesini oluĢturur. Çekirdekte proton ve nötronlar bulunur.
Elektronlar ise çekirdek çevresindeki katmanlarda bulunur.
KĠMYA
Proton sayısı atomlar (elementler) için ayırt edici özelliktir. Yani
proton sayısının farklı olması elementin diğerinden farklı olduğu
anlamına gelir.
Elektronların bulunma olasılığının olduğu bölgelere elektron
bulutu denir.
Kimyasal olaylarda (reaksiyonlarda) yalnızca elektron sayısı
değişir. Proton ve nötron, çekirdekte bulunduğu için sayıları
değişmez.
Nötr bir atom için; elektron sayısı= proton sayısı
(A.N.) Atom numarası= proton sayısı
Çekirdek yükü= proton sayısı
İyon yükü= proton sayısı – elektron sayısı (E.S.)
(K.N.) Kütle numarası= proton + (N.S)nötron sayısı (Nükleon
KĠMYA
sayısı)(atom ağırlığı)
Atom Numarası = Proton Sayısı = Çekirdek Yükü = Elektron Sayısı
DEMOCRĠTUS :
Maddenin küçük ve bölünemez parçacıklardan oluĢtuğu
fikrini ortaya atan ilk kiĢi, Yunanlı filozof “Democritus”dur.
Democritus‟a göre bütün maddeler aynı tür (özdeĢ)
atomlardan oluĢuyordu. Maddelerin farklı görünmesinin
sebebi, atomların farklı Ģekilde dizilmesiydi.
JOHN DALTON :
Ġngiliz bilim adamı Dalton‟a göre; maddenin en küçük yapı
taĢı atomdur. Atomlar bölünemez. Bir maddenin bütün
atomları aynıdır. Farklı maddelerin atomları da farklıdır.
J.THOMSON :
Atomun yapısında atomdan daha da küçük parçacıkların
olduğunu keĢfetti. Yaptığı çalıĢmalar sonucunda atomu,
içinde erik parçacıkları bulunan bir pudinge benzetti.
ERNEST RUTHERFORD :
Thomson‟un bulduğu küçük parçacıkların atomun
KĠMYA
içinde değil atom merkezinin (çekirdek) etrafında
dolaĢtığını ileri sürdü.
.
Rutherford atom için geliĢtirdiği modeli, GüneĢ‟in etrafında
dönen gezegenlere benzetti.
NĠELS BOHR :
Danimarkalı bilim adamı Bohr, elektronların atomun
çevresinde belirli yörüngeler izlediğini belirtti.
Bugün kullanılan atom modeli “Bulut modeli”dir. Bu modele
göre; atomun merkezinde (çekirdeğinde) (+) yüklü protonlar
ve yüksüz nötronlar bulunur. Atom çekirdeğinin çevresinde
ise (-) yüklü elektronlar sürekli hareket halindedir
KĠMYA
1.Elementler ve Elementlerin Özellikleri :
a) Elementler :
Aynı cins atomlardan oluĢan, fiziksel ya da kimyasal yollarla
kendinden daha basit ve farklı maddelere ayrılamayan saf
maddelere element denir.
Elementler çok sayıda atomdan oluĢur ve elementleri
oluĢturan atomlar aynı cins atomlardır. Çok sayıda aynı cins
atom birleĢerek görünür boyuta geldiklerinde elementleri
oluĢtururlar.
KĠMYA
KĠMYA
Bir elementi oluĢturan bütün atomların
büyüklükleri yani Ģekilleri (ve atomları
arasındaki uzaklık) aynıdır. Fakat bir
elementin atomları ile baĢka bir elementin
atomlarının büyüklükleri yani Ģekilleri
farklıdır (ve atomları arasındaki uzaklık).
KĠMYA
BĠLEġĠKLER
En az iki farklı element atomunun belirli oranlarda bir araya
gelerek kendi özelliğini kaybedip yeni özellikler kazanması
ile oluĢan saf maddelere BĠLEġĠK denir.
Oksijen ve hidrojen birer element iken su,oksijen(yakıcı) ve
hidrojenin(Yanıcı) birleĢmesiyle oluĢur.Yakıcı ya da yanıcı
değildir.Söndürücüdür.
• Alkol,su,tuz,Ģeker gibi maddeler bileĢiktir.
• Yapılarında en az iki çeĢit atom bulunur.
• Fiziksel yolla daha basit maddelere bölünemezler.
• Kimyasal yolla daha küçük maddelere ayrıĢabilirler.
• BileĢiği oluĢturan atomlar arasındaki oran değiĢirse
oluĢan madde baĢka bir madde olur.
KĠMYA
BileĢikler, kendini oluĢturan elementlerin (atomları)
özelliklerini göstermezler.
BileĢiği oluĢturan elementler (atomlar) kendi özelliklerini
kaybederler. BileĢiği oluĢturan elementler belirli oranlarda
birleĢirler.
KĠMYA
BileĢikler oluĢurken enerji alıĢveriĢi olur.
BileĢikler, kimyasal tepkimelerle oluĢur ve kimyasal yollarla
ayrılırlar.
BileĢikler en az iki farklı elementten yani atomdan oluĢurlar.
BileĢiklerin belirli erime, kaynama, donma ve yoğunlaĢma
sıcaklıkları vardır.
BileĢikler saf ve homojen maddelerdir.
BileĢikler formüllerle gösterilirler.
BileĢiklerin en küçük yapı birimleri moleküllerdir.
KĠMYA
FİZİKSEL VE KİMYASAL DEĞİŞİMLER
FĠZĠKSEL DEĞĠġĠM: Bir maddenin
ezilme,kırılma,yırtılma,ufalanma,erime,donma gibi olaylarla
maddenin kimliğinde bir değiĢim olmadan yalnızca
görünümünde meydana gelen değiĢimlere FĠZĠKSEL
DEĞĠġĠM denir
Örnek:Cam kırılması,ġekerin erimesi,Kağıdın
yırtılması,Mumun erimesi,Odundan talaĢ elde edilmesi gibi.
KĠMYA
KĠMYASAL DEĞĠġĠM
Yanma,çürüme,kokuĢma,kömürleĢme,paslanma,küflenme
gibi olayların tümünde maddenin kimliği yani cinsi
değiĢir.Bu Ģekilde gerçekleĢen değiĢimlere KĠMYASAL
DEĞĠġĠM denir.
Örnek:Elmanın çürümesi,mumun yanması,Ģekerin
piĢirilmesi,kağıdın yanması,demirin paslanması gibi.
KĠMYA
MADDE VE ıSı
ISI bir ENERJĠDĠR. Bir maddenin bütün moleküllerinin toplam
kinetik(hareket) enerjisinin toplamına ISI denir.
SICAKLIK; bir maddenin moleküllerinin ortalama kinetik
enerjisidir.
KĠMYA
Bir kap içine koyduğumuz suyu ısıtmaya baĢlarsak
sıvının molekülleri de hareketlenir.Ancak biz bu hareketi
gözümüzle göremeyiz.Ama sıvının içine küçük tahta
parçacıkları atarsak su ısındıkça tahta parçacıklarının
hareket ettiğini görürüz.Suyun ısısı arttıkça tahta
parçacıkları daha da süratlenir.Bu da bize ısınan sıvı
moleküllerinin de hareket ettiğini gösterir.
Sıvı molekülleri birbiri üzerinde kayma bulundukları
yerde titreĢme ve dönme hareketi yapar.
Gazlarda moleküllerin arasındaki bağlar daha zayıf
olduğu için ısı verildiğinde gaz molekülleri daha kolay
hareket eder.
KĠMYA
KATILARDA ISININ YAYILMASI
Katılarda ısı iletim yoluyla yayılır.Katıların
molekülleri yer değiĢtiremediğinden
moleküller ısıyı dalga halinde her yöne iletir.
Her katı maddenin iletkenliği
farklıdır.Ġletkenlik maddenin cinsine
bağlıdır.Metaller ısıyı iyi iletirken cam plastik
tahta gibi katılar ısıyı iyi iletmez.Isıyı iyi
iletmeyen maddelere yalıtkan madde denir.
KĠMYA
SIVILARDA ISININ YAYILMASI:
Sıvılarda ısının yayılması moleküllerin hareketi ile olur.Bu
Ģekilde olan ısı yayılmasına taĢıma ya da konveksiyon
denir.Sıvılarda moleküller birbirine bağlı olmadığı için ısı
aldıkça hareket enerjileri artar.Isınan maddenin hacmi de
artar.Öz kütlesi azalır.Öz kütlesi azalınca yukarı doğru
yükselir.Yukarıda olan moleküller de aĢağı doğru iner.ĠĢte bu
hareketle ısı bir yerden bir yere taĢınmıĢ olur.Tenceredeki
suyun ısınması sobaların odayı ısıtması konveksiyon yolu ile
olur.
KĠMYA
GAZLARDA ISININ YAYILMASI:
Gazlarda ısının yayılması ya taĢıma(konveksiyon) ya da
ıĢıma (radyasyon) yolu ile olur.
IĢıma yolu ile olan yayılmada ısınan maddelerin sıcaklığı
artar.Sıcaklık artması maddenin rengine ve yüzeyinin
durumuna göre değiĢir.Mat ve koyu renkli olan cisimler ısıyı
emer parlak ve açık renkli olan cisimler ise ısıyı yansıtır.
.
KĠMYA