MADDENİN HALLERİ KONU ANLATIMI-4
1
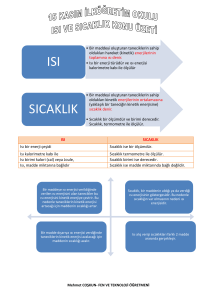
HAL DEĞİŞİMİ
Saf maddelerin ısı alarak veya vererek belirli sıcaklıkta bulunduğu fazdan başka
bir faza geçişine hal değişimi denir. Bir maddenin üç farklı halinin fiziksel
değişimi şu şekilde gösterilebilir
Katı → Sıvı → Gaz Dönüşümünde
Gaz → Sıvı → Katı Dönüşümünde
Hacim büyür (genelde).
Hacim küçülür (genelde).
Kütle değişmez.
Kütle değişmez.
Molekül yapısı değişmez.
Molekül yapısı değişmez.
Yoğunluk azalır (genelde).
Yoğunluk artar (genelde).
Moleküller arası boşluk artar
Moleküller arası boşluk azalır
(genelde)
(genelde).
Kimyasal özellikler değişmez.
Kimyasal özellikler değişmez
Fiziksel özellikler değişir.
Fiziksel özellikler değişir.
Potansiyel enerji artar. Kinetik enerji
Potansiyel enerji azalır. Kinetik
ve sıcaklığı değişmez
enerjisi ve sıcaklığı değişmez.
Madde ısı alır (endotermik).
Madde ısı verir (ekzotermik).
Düzensizlik artar.
Düzensizlik azalır.
ERİME - DONMA VE BUHARLAŞMA - YOĞUŞMA ISISI
Erime sıcaklığındaki 1 gram saf katı maddenin sıvı hale geçmesi için gereken ısı miktarına o maddenin erime ısısı denir. Her maddenin
erime ısısı farklıdır. Erime ısısı “Le" ile gösterilir, birimi J/g veya kal/g dir. 0°C taki 1 gram buzun eriyerek 0°C ta su olması için buza 334, 4
Joule enerji verilmesi gerekir. Erime sıcaklığındaki bir miktar katı maddenin sıvı hale geçmesi için maddeye verilmesi gereken ısı aşağıdaki
bağıntı ile hesaplanır
Q= m. Le
Maddenin erirken aldığı ısı= Kütle x Erime ısısı
Donma sıcaklığındaki 1 gram saf sıvı maddenin katı hale geçmesi için çevreye verdiği ısı miktarına donma ısısı adı verilir. Donma ısısı “ Ld ”
harfiyle gösterilir. Bir madde için erime ısısı, donma ısısına eşittir. Kaynama sıcaklığındaki 1 gram saf sıvıyı gaz haline geçirmek için gerekli
ısıya buharlaşma ısısı denir. Buharlaşma ısısı “ Lb “ şeklinde ifade edilir. Kaynama sıcaklığında kütlesi “ m “ olan bir sıvının buharlaşarak sıvı
hale geçmesi için maddeye verilmesi gereken ısı aşağıdaki bağıntı ile hesaplanır.
Q= m. Lb
Maddenin buharlaşırken aldığı ısı = Kütle x Buharlaşma ısısı
Yoğuşma sıcaklığındaki 1 gram gazın, sıvı hale geçmesi sırasında verilen ısıya yoğuşma ısısı denir. Yoğuşma ısısı "Ly" olarak ifade edilir. Bir
madde için buharlaşma ısısı, yoğuşma ısısına eşittir.
Hal Değişim Grafikleri
Saf bir katı maddenin, sabit basınç altında hal değiştirmesi ile ilgili sıcaklık-zaman ve sıcaklık-ısı grafikleri aşağıdaki gibidir.
t1, maddenin ilk sıcaklığıdır.
O, maddenin erime noktasıdır.
t2, maddenin kaynama noktasıdır.
A noktasında madde; t1°C'de
katıdır.
B noktasında madde; 0°C'de
katıdır.
C noktasında madde; 0°C'de
sıvıdır.
D noktasında madde; t2°C'de
sıvıdır.
E noktasında madde; t2°C'de
gazdır.
F noktasında madde; t3°C'de
gazdır.
Maddenin hareketinden dolayı sahip
olduğu enerjiye kinetik enerji denir. Sıcaklığı artan maddelerin kinetik
enerjileri de artar. Depolanan ve kullanılmaya hazır olan enerjiye potansiyel
enerji denir. Gaz halinde maddenin potansiyel enerjisi maksimum, katı halde
ise minimumdur.
I., III. ve V. bölgelerde
I. bölgede katı madde ısı alır.
III. bölgede sıvı madde ısı alır.
V. bölgede gaz madde ısı alır.
Üç bölgede de sıcaklık ve kinetik enerji artar.
Potansiyel enerji sabittir.
Üç bölgede de madde homojendir.
Alınan ya da verilen ısı Q= m.c.∆t bağıntısı ile
bulunur.
Q= ısı, m= kütle, c= öz ısı
∆t= sıcaklık değişimi (t2 – t1)
II. ve IV. bölgelerde
II. bölgede erime olmaktadır.
IV. bölgede kaynama olmaktadır.
Her iki bölgede de potansiyel enerji artar.
Her iki bölgede de madde heterojendir.
Her iki bölgede de sıcaklık ve kinetik enerji
değişmez.
Alınan ya da verilen ısı Q = m.L bağıntısı ile
bulunur. L= Hal değişim ısısı
KATILAR
Maddenin en düzenli halidir.
Tanecikler bulundukları yerde sadece titreşim hareketi yaparlar.
Akışkan özelliği yoktur.
Katının yapısı, atomları, iyonları ve molekülleri bir arada tutan kuvvetlerin cinsine
bağlıdır.
Katı maddeler, taneciklerini bir arada tutan kuvvetlere göre, kristalli katılar ve
amorf katılar olmak üzere iki ana gruba ayrılır.
Amorf katılar
Taneciklerin gelişigüzel düzensiz bir şekilde istiflendiği katı türüdür. Yani bu katılarda atom, iyon ya da moleküller rastgele yığılmıştır.
Belirli geometrik şekilleri yoktur. Amorf katılar serttir ve sıkıştırılamazlar. Cam, lastik, tereyağı ve plastik amorf katılara örnektir.
Amorf kelimesi Yunancadan gelir, şekilsiz anlamındadır. En önemli özellikleri, belirli bir erime sıcaklıklarının olmamasıdır.
Isıtıldıklarında önce yavaş yavaş yumuşayarak esneklik kazanırlar. Ancak akıcılıkları yoktur. Bir sıcaklık aralığında gitgide yumuşayarak
akıcılık kazanırlar. Yumuşamanın başladığı sıcaklığa camsı geçiş sıcaklığı denir. Ancak cam hamuruna şekil verilip, soğutulurken cam
molekülleri komşu moleküllerle kuvvetli bağlar oluşturur ve katılaşır. Sert olmaları dışındaki özellikleri yönüyle daha çok sıvılara
benzerler.
http:\\hasanfirat.com
MADDENİN HALLERİ KONU ANLATIMI-4
2
Kristal katılar
Atom, iyon veya moleküllerin belirli bir geometrik kalıba göre istiflenmesi ile oluşan katılara kristal katı denir. Kararlı bir yapıya
sahiptirler. Serttirler ve sıkıştırılamazlar. Ancak sert yapıda olan her katı kristal yapıda olmayabilir. Örneğin cam. Kristal katıların sayısı
amorf katıların sayısından daha fazladır. Buz, yemek tuzu, elmas, grafit, çay şekeri gibi katılar kristal katılara örnek olarak gösterilebilir.
Doğadaki katıların çoğu kristal haldedir. Kristali oluşturan taneciklerde iyonik bağlar, kovalent bağlar, Van der Waals kuvvetleri, hidrojen
bağları söz konusudur. Kristal katılar; iyonik, kovalent, moleküler ve metalik kristaller olarak sınıflandırılabilir.
1. İyonik Kristaller
Anyon ve katyonların elektrostatik çekim kuvveti ile oluşturdukları iyonik bağlı bileşiklerin katı halleri iyonik kristalleri oluşturur.
İyonik bir kristalin yapısı katyon ve anyonların yüklerine ve yarıçaplarına bağlıdır. NaCl, ZnS, CaF2, LiF, CaO bileşikleri iyonik kristalli
maddelerdir. İyonları bir arada tutan çok güçlü kuvvetlerden dolayı yüksek erime noktasına sahiptirler. Katı halleri elektrik akımını
iletmez. Bunun nedeni yapıdaki iyonların yer değiştirebilme özelliklerinin olmamasıdır. Ancak bu katılar eritildiklerinde veya suda
çözüldüklerinde iyonlar serbestçe hareket edebilecekleri için elektriği iletirler.
2. Kovalent kristaller
Atomların kovalent bağlarla üç boyutlu ağ yapısında bir araya gelmesiyle oluşan katılardır. Ağ yapılı katılar yapmış oldukları kovalent
bağlar sayesinde yüksek erime ve kaynama noktalarına sahiptir. Aynı zamanda sert ve dayanıklıdırlar. Elmas, grafit, kuartz (SiO2),
silisyum karbür (SiC) maddeleri kovalent kristallere örnek verilebilir.
3. Moleküler kristaller
Molekül içi bağları kovalent olan maddelerin katı halleri moleküler kristal olarak adlandırılır. Van der Waals kuvvetleri ya da hidrojen
bağları tarafından bir arada tutulan atom ya da moleküllerce oluşturulurlar. Yani kovalent kristallerdeki gibi sürekli kovalent bağlardan
oluşan bir ağ örgüsü yoktur. Moleküler kristallerdeki çekim kuvvetleri iyonik kristaller ve kovalent kristallere göre oldukça zayıftır.
Erime noktaları genellikle düşüktür. CO2 (kuru buz), I2, O2 gibi apolar moleküllerden oluşan kovalent kristallerde London kuvvetleri, SO2
ve H2S gibi polar molekül içeren kristallerde dipol–dipol etkileşimleri H2O, NH3, HF gibi moleküllerden oluşan katı kristallerinde ise
hidrojen bağları etkindir
4. Metalik kristaller
Metalik kristaller en basit kristal yapısına sahip en düzenli ve en kararlı katılardır. Metaldeki değerlik elektronları, metal atomları
tarafından kuvvetle tutulmadıkları için her yöne doğru akabilen bulut oluşturur. Bu nedenle metal kristalleri bir elektron bulutu içerisine
yerleşmiş artı yüklü iyonlardan oluşmuştur. Metal katyonlarının elektron denizi içerisinde düzenli bir şekilde yerleşmesiyle oluşan
katılardır. Temel özellikleri; kendilerine özgü parlaklıklarının olması, kolay tel ve levha haline getirilebilmeleri, ısı ve elektriği iyi
iletmeleridir. Metalik bağın oluşumunda yer alan değerlik elektron sayısı arttıkça metalin erime noktası da artar. Metalik kristallerdeki
bağlanma diğer kristallerdekinden farklı olup, bir metaldeki bağ elektronları tüm kristal boyunca dağılmıştır
Kristal Tipi
İyonik Kristaller
Moleküler Kristaller
Birim hücreleri bir
arada tutan kuvvetler
Elektrostatik çekim
Kovalent Kristaller
Hidrojen bağları, Van
der Waals çekimleri,
dipol-dipol etkileşimleri
Kovalent bağ
Metalik Kristaller
Metalik bağ
Genel özellikler
Sert ve kırılgandırlar. Yüksek erime ve
kaynama noktasına sahiptir. Suda
çözünürler, ısı ve elektriği iletirler.
Yumuşaktırlar. Erime noktaları iyonik
katılardan daha düşüktür
Serttirler. Yüksek erime noktasına
sahiptirler. Su içinde çözünmezler.
Isı ve elektriği iyi iletirler. Sert ve
dayanıklıdırlar.
Örnekler
CsCl, ZnS, NaCl, LiF, MgO, KNO3,
CaCO3, CaF2, K2S
CO2, O2, Ar, H2O, C6H12O6, HF,
NH3, CH3OH, HCl, H2S, TiCl4,
S8,P4
C(elmas), C(grafit), SiO2(kuartz)
Cu, Ca, Al, Pb, Zn, Fe, Na... gibi
tüm metaller
http:\\hasanfirat.com